ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в отношении 35 U.S.C. 119(e) предварительной заявки U.S. № 62/167,054, поданной 27 мая 2015 г., содержание которой включено в данный документ посредством ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение в целом относится к области композиций, наборов и способов модуляции иммунного ответа. В частности, изобретение относится к модифицированным углеводами частицам и порошкообразным композициям для модуляции иммунного ответа.
Методы модуляции иммунных ответов важны для многих методов лечения заболеваний, и частицы-носители были исследованы на эффективность в качестве средств доставки для белков, лекарств и других способов лечения. Однако данные носители в основном естественные и обычно функционируют только как носители для активных компонентов. Здесь авторы изобретения исследовали возможность функционализации носителей-наночастиц таким образом, чтобы активно модифицировать получаемый иммунный ответ. Используя изученный материал наночастиц, сополимер молочной и гликолевой кислот или PLGA, и собственный высокопроизводительный скрининг для иммуномодулирующих со-сигналов, авторы изобретения разработали улучшенные углеводами наночастицы (CENP), которые способны модулировать иммунные ответы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрыты композиции, наборы и способы модуляции иммунного ответа. Композиции и наборы включают в себя и способы применения модифицированных углеводами частиц, и порошкообразные композиции, содержащие модифицированные углеводами частицы.
Модифицированные углеводами частицы, раскрытые в данном документе, являются относительно небольшими и имеют эффективный средний диаметр в микромасштабе или наномасштабе. В частности, модифицированные углеводами частицы могут называться «наночастицами, усиленными углеводами» или «CENP». Частицы модифицируются путем присоединения одного или нескольких углеводных фрагментов на поверхности частиц. Предпочтительно, частицы модифицируют посредством ковалентного присоединения одного или нескольких углеводных фрагментов на поверхности частиц. Углеводные фрагменты могут быть прикреплены непосредственно к поверхности частиц или посредством одной или нескольких молекул линкера. Углеводные фрагменты, предпочтительно, функционируют как иммуномодуляторы, например, модуляторы, которые индуцируют иммунную толерантность.
Раскрытые частицы композиций и составов, предпочтительно, являются биодеградируемыми и образованы из полимерного основного материала. В некоторых вариантах осуществления частицы содержат полимерный основной материал, образованный из углеводных мономеров или форполимеров.
В дополнение к углеводному фрагменту раскрытые модифицированные углеводами частицы могут включать дополнительные компоненты для модуляции иммунного ответа. В частности, раскрытые модифицированные углеводами частицы могут включать в себя антиген, например, пептид, полипептид или белок, который используют в качестве антигена и вводят субъекту для десенсибилизации субъекта к антигену и/или индуцирования толерантности у субъекта. Подходящие для включения антигены в раскрытые модифицированные углеводами частицы могут включать аутоантигены, связанные с аутоиммунным заболеванием (например, пептиды, полипептиды или белки, которые связаны с аутоиммунным заболеванием). Подходящие антигены могут включать аутоантигены, связанные с диабетом 1 типа (T1D). Подходящие антигены также могут включать антигены, связанные с аллергическими реакциями (т.е., аллергены).
Раскрытые частицы могут быть получены способами, которые включают одну или несколько из следующих этапов: (а) скрининг библиотеки углеводных фрагментов для активности иммуномодулятора путем контактирования библиотеки с иммунной клеткой и измерение влияния библиотеки на стимуляцию иммунной клетки (например, путем измерения продукции цитокинов по сравнению с исходным уровнем и, в частности, продуцирования IL-10, TGFβ и/или продуцирования CCL4 на фоне продуцирования IL-6); (b) выбор углеводного фрагмента на основе его влияния на стимуляцию иммунной клетки; и (c) присоединение углеводного фрагмента, выбранного таким образом, к частицам, образованным из полимерного основного материала, предпочтительно путем ковалентного прикрепления углеводного фрагмента к поверхности частиц, образованных из биодеградируемого полимерного основного материала.
Раскрытые частицы могут быть сформированы в виде композиции для модуляции иммунного ответа. Таким образом, композиции могут вводиться субъекту, нуждающемуся в этом, для того, чтобы индуцировать иммунный ответ, который может включать, но не ограничивается, десенсибилизацию субъекта и/или индуцирование толерантности у субъекта. Композиции могут вводиться для лечения и/или профилактики заболеваний и расстройств, связанных с аутоиммунными ответами, или для лечения и/или предотвращения аллергических реакций. Композицию можно вводить для лечения и/или предотвращения отторжения трансплантата.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 показано, что in vitro стимуляция (LPS) макрофагов частицами PLGA (PP) не усиливает IL-10, тогда как EDC-клетки (EDC SP) усиливают IL-10.
На Фиг. 2 показана стратегия высокопроизводительного скрининга углеводных соединений для индукции продуцирования цитокинов макрофагами.
На Фиг. 3А и 3В показаны индукционные тепловые карты для усиления экспрессии или снижения экспрессии IL-10, как определено с использованием скрининга с высокой пропускной способностью, как показано на Фиг. 2.
На Фиг. 4 показаны химические реакции сочетания для добавления L-фукозы к PLGA-наночастицам.
На Фиг. 5 показано, что фукозилированные PLGA (F-CENP) способствуют более интенсивной индукции IL-10, чем только PLGA, EDC-клетки или свободная L-фукоза.
На Фиг. 6 показаны иммунологические механизмы сенсибилизации и толерантности.
На Фиг. 7 показаны потенциальные методы лечения аллергии путем десенсибилизации и повышения толерантности.
На Фиг. 8 показаны потенциальные природные толерогенные сигналы на клеточной поверхности апоптотической клетки.
Фиг. 9 иллюстрирует гипотезу о том, что эффективность системы доставки Ag-NP для терапии толерантности при T1D может быть значительно увеличена путем: (1) синхронизированного инжиниринга направленных лигандов (LNFPIII и GAS6) на NP для двойной сигнализации CD209 и Mer; и (2) доставки дезамидированной формы инсулина (INS (Q→E)) в качестве исходного патогенетического аутоантигена для индуцирования перенесенной толерантности.
На Фиг.10А, 10В и 1°C показано, что AG-SP индуцирует толерантность через экспансию клеток Treg, делецию AD и анергию клеток Teff. A. Клетки Treg CD4+Foxp3+ в селезенке, dLN и трансплантатах, обработанных Ag-SP, и контрольных реципиентах на 28-й день после трансплантации. B. Конгенно маркированные трансгенные Т-клетки TEa TCR, подсчитаны в селезенке, dLN и трансплантатах, обработанных Ag-SP, и контрольных реципиентах на день -4, день 0 и день 7. C. Конгенно маркированные и CFSE-меченые 4C TCR трансгенные T-клетки, исследованы на пролиферацию in vivo после первой и второй инъекций Ag-SP. Графическая накладка гистограмм также показывает непролифелирующие 4C Т-клетки у необработанных мышей. (Kheradmand et al, J Immunol 189:804-12, 2012).
Фиг. 11. Инъекции AG-SP индуцируют экспансию MDSCs и растворимых медиаторов, вовлеченных в индукцию и хоминг Treg. A. MDSCs Ly6CHI и Gr1HI размножаются в большом количестве после инъекций Ag-SP. B. Сокультуривание MDSC Ly6CHI и Gr1HI со стимулированными Т-клетками индуцирует продуцирование IL-10 и CCL4. C. Аллотрансплантаты от получавших Ag-SP реципиентов показывают прогрессирующее накопление Tregs Foxp3+. (Bryant et al, J Immunol 192(12): 6092, 2014).
На Фиг. 12А, 12В и 12С показано, что экспансия MDSC, опосредованная Ag-SP, зависит от рецепторной тирозинкиназы MER. A. Две популяции селезеночных макрофагов, экспрессирующие поверхностный лектин CD209 и CD169, регулируют экспрессию Mer в ответ на лечение Ag-SP. B. Ag-SP-индуцированная экспансия MDSCs Ly6CHI and Gr1HI теряется у мышей MerTK-/-. C. Ag-SP терапия толерантности неэффективна у мышей MerTK-/-. Это есть в модели трансплантации сердца BALB/c→B6, в которой Ag-SP у мышей MerTK+/+ (дикого типа) значительно продлевает выживаемость аллотрансплантата сердца, хотя и не является неопределенно долгой выживаемостью, в отличие от аллотрансплантатов островков (неопубликованные данные).
На Фиг.13А, 13В и 13С показано, что NPs могут быть адаптированы для доставки антигена и индукции толерантности. A. PLG NPs могут быть изготовлены с заданным размером (в данном случае ~500 нм) и дзета-потенциалом (в данном случае ~-75 мВ). B. Донорные антигены в виде лизата донорных спленоцитов могут быть связаны с NPG PLG и безопасно доставлены мышам-реципиентам. Тем не менее, существующая форма Ag-NP обеспечивает только маргинальную защиту трансплантированного аллотрансплантата островков, если дается отдельно. В сочетании с коротким курсом рапамицина, с низкая доза Ag-NP значительно улучшает его эффективность в защите аллотрансплантата островков. (Bryant et al, Biomaterials 35: 8887-94, 2014).
На Фиг. 14A, 14B и 14C показан гуморальный ответ на дезамидированный проинсулин у пациентов с T1D и у мышей NOD. A. Гуморальный иммунный ответ на дезамидированный проинсулин человека, обнаруженный с помощью вестерн-блоттинга, у четырех из группы 30 взрослых T1D-пациентов. B. Верхняя группа: репрезентативный гуморальный иммунный ответ на дезамидированный мышиный проинсулин 1 с помощью вестерн-блоттинга в группе самок мышей NOD, последовательно исследованных начиная с 3-нед возраста. Нижняя группа: развитие диабета в подгруппах самок мышей NOD с антителами к дезамидированному проинсулину или без них. C. 4×30 пептидный массив мышиного проинсулина 1 и 2, исследованный супернатантом из β-клеток положительных гибридов NOD.
ПОДРОБНОЕ ОПИСАНИЕ
Раскрытыми в данном документе являются композиции, наборы и способы индуцирования иммунного ответа против заболевания, которые могут быть описаны с использованием нескольких определений, как описано ниже.
Если не указано иное или не обозначено контекстом, термины «a», «an» и «the» означают «один или несколько». Кроме того, существительные в единственном числе, такие как «углевод» и «углеводный фрагмент», следует интерпретировать как означающие «один или несколько углеводов» и «один или несколько углеводных фрагментов», соответственно, если не указано иное или не обозначено контекстом. Существительные в единственном числе, такие как «частица», следует интерпретировать как «одну или несколько частиц», если не указано иное или не обозначено контекстом.
Используемые в данном документе слова «примерно», «приблизительно», «по существу» и «значительно» будут поняты специалистами обычной квалификации в данной области техники и будут варьироваться в некоторой степени в зависимости от контекста, в котором они используются. Если используются термины, которые не понятны специалистам в данной области техники, учитывая контекст, в котором они используются, «примерно» и «приблизительно» будет означать плюс или минус≤10% от конкретного значения, и «по существу» и «значительно» будут означать плюс или минус>10% от конкретного значения.
Используемые в данном документе термины «включать» и «включающий» имеют то же значение, что и термины «содержать» и «содержащий». Термины «содержать» и «содержащий» следует интерпретировать как «открытые» переходные термины, которые допускают включение дополнительных компонентов в дополнение к компонентам, указанным в формуле изобретения. Термины «состоять» и «состоящий из» должны интерпретироваться как «закрытые» переходные термины, которые не допускают включения дополнительных компонентов, отличных от компонентов, указанных в формуле изобретения. Термин «состоящий в основном из» следует интерпретировать частично закрытым и позволяющим включать только дополнительные компоненты, которые принципиально не изменяют заявленный предмет.
Термины «субъект», «пациент» или «хозяин» могут использоваться в данном документе взаимозаменяемо и могут относиться к человеку или не относящимся к человеку животным. Не относящиеся к человеку животные могут включать, но не ограничиваются ими, нечеловекообразных приматов, собак и кошек.
Термины «субъект», «пациент» или «индивидуум» могут использоваться для обозначения человека или не относящегося к человеку животного. Субъект может включать человека, имеющего или подверженного риску заражения заболеванием и/или расстройством, которое можно лечить и/или предотвращать иммунномодуляцией, которая может включать десенсибилизацию и/или индуцирование толерантности. Заболевания и/или расстройства, которые лечатся и/или предотвращаются иммунномодуляцией, могут включать, но не ограничиваются, аллергию, включая пищевые аллергии и другие виды аллергии. Заболевания и/или расстройства, которые лечатся и/или предотвращаются иммунномодуляцией, могут включать аутоиммунные заболевания и расстройства, такие как аутоиммунные заболевания сердца (например, миокардит и постинфарктный синдром), почки (например, нефрит, обусловленный антителами к базальной мембране капилляров клубочков), печени (например, аутоиммунный гепатит, первичный билиарный цирроз), кожи (например, круговая алопеция, псориаз, системная склеродермия и витилиго), надпочечной железы (например, болезнь Аддисона), поджелудочной железы (например, аутоиммунный панкреатит и сахарный диабет 1 типа (T1D)), щитовидной железы (например, базедова болезнь), слюнных желез (например, синдром Шегрена), пищеварительной системы (например, целиакия, болезнь Крона и язвенный колит), крови (например, тромбоцитопеническая пурпура, синдром Эванса, пернициозная анемия и тромбоцитопения), соединительной ткани (например, анкилозирующий спондилоартрит, ювенильный артрит, ревматоидный артрит, саркоидоз и системная красная волчанка), мышечной ткани (например, фибромиалгия, миастения гравис и дерматомиозит) и нервной системы (например, острый рассеянный энцефаломиелит, синдром Гийена-Барре, рассеянный склероз и идиопатическое воспалительное демиелинизирующее заболевание).
Субъект может включать субъекта, подвергающегося трансплантации, или субъекта, перенесшего трансплантацию. Субъект может включать субъекта, подвергающегося трансплантации, или субъекта, перенесшего трансплантацию, когда субъект отторгает трансплантат или подвергается риску отторжения трансплантата.
В данном документе раскрыты модифицированные углеводами частицы. Модифицированные углеводами частицы относительно малы и имеют эффективный средний диаметр в микромасштабе или наномасштабе. В некоторых вариантах осуществления модифицированные углеводами частицы могут иметь эффективный средний диаметр менее чем, примерно, 500 мкм, 200 мкм, 100 мкм, 50 мкм, 20 мкм, 10 мкм, 5 мкм, 2 мкм, 1 мкм, 0,5 мкм, 0,2 мкм, 0,1 мкм, 0,05 мкм, 0,02 мкм, 0,01 мкм, или модифицированные углеводами частицы могут иметь эффективный средний диаметр в диапазоне, ограниченном любым из этих значений в качестве конечных точек, таких как 0,02-1 мкм или 200-1000 нм. Модифицированные углеводами частицы могут упоминаться здесь как «микрочастицы» и/или «наночастицы». В частности, модифицированные углеводами частицы могут называться «наночастицами, усиленными углеводами» или «CENP».
Раскрытые частицы обычно имеют подходящий дзета-потенциал, например, для введения раскрытых частиц субъекту, нуждающемуся в этом. В некоторых вариантах раскрытые частицы имеют отрицательный дзета-потенциал, например, в диапазоне, ограниченном любым из следующих значений дзета-потенциала: -10 мВ, -20 мВ, -30 мВ, -40 мВ, -50 мВ, - 60 мВ, -70 мВ, -80 мВ, -90 мВ или -100 мВ, например, от -50 до -100 мВ или от -60 до -80 мВ.
Раскрытые частицы могут содержать биодеградируемый основной материал. Частицы являются «биодеградируемыми», как должно быть понятно в данной области техники. Термин «биодеградируемый» может использоваться для описания материала, который способен деградировать в физиологической среде на более малые основные компоненты. Предпочтительно, меньшие основные компоненты являются безвредными. Например, биодеградируемый полимер можно разлагать на основные компоненты, которые включают, но не ограничиваются ими, воду, углекислый газ, сахара, органические кислоты (например, трикарбоновые кислоты или аминокислоты) и спирты (например, глицерин или полиэтиленгликоль). Биодеградируемые материалы, которые могут быть использованы для получения частиц, рассматриваемых в настоящем документе, могут включать материалы, раскрытые в патентах U.S. № 7,470,283; 7,390,333; 7,128,755; 7,094,260; 6,830,747; 6,709,452; 6,699,272; 6,527,801; 5,980,551; 5,788,979; 5,766,710; 5,670,161; и 5,443,458; и опубликованных заявках U.S. № 20090319041; 20090299465; 20090232863; 20090192588; 20090182415; 20090182404; 20090171455; 20090149568; 20090117039; 20090110713; 20090105352; 20090082853; 20090081270; 20090004243; 20080249633; 20080243240; 20080233169; 20080233168; 20080220048; 20080154351; 20080152690; 20080119927; 20080103583; 20080091262; 20080071357; 20080069858; 20080051880; 20080008735; 20070298066; 20070288088; 20070287987; 20070281117; 20070275033; 20070264307; 20070237803; 20070224247; 20070224244; 20070224234; 20070219626; 20070203564; 20070196423; 20070141100; 20070129793; 20070129790; 20070123973; 20070106371; 20070050018; 20070043434; 20070043433; 20070014831; 20070005130; 20060287710; 20060286138; 20060264531; 20060198868; 20060193892; 20060147491; 20060051394; 20060018948; 20060009839; 20060002979; 20050283224; 20050278015; 20050267565; 20050232971; 20050177246; 20050169968; 20050019404; 20050010280; 20040260386; 20040230316; 20030153972; 20030153971; 20030144730; 20030118692; 20030109647; 20030105518; 20030105245; 20030097173; 20030045924; 20030027940; 20020183830; 20020143388; 20020082610; и 0020019661; содержание которых включено в настоящее описание посредством ссылки в полном объеме. Как правило раскрытые здесь частицы деградируют in vivo при скорости деградации, так что частицы теряют более, примерно, 50%, 60%, 70%, 80%, 90%, 95% или 99% от их начальной массы после, примерно, 4, 5, 6, 7 или 8 недель от введения субъекту с помощью одного или нескольких из: деградация биодеградируемых полимеров частиц до мономеров: разложение биодеградируемых полимеров частиц на воду, углекислый газ, сахара, органические кислоты (например, трикарбоновые или аминокислоты) и спирты (например, глицерин или полиэтиленгликоль); и деградация частиц для высвобождения углеводного фрагмента частиц или любого иммуномодулятора, присутствующего в частицах.
Подходящие полимеры для получения основного материала частиц могут включать, но не ограничиваются ими, сополимеры PLA и PGA (т.е. PLGA), монополимеры, такие как полилактиды (т.е. PLA), включая полимолочную кислоту, монополимеры, такие как полигликолиды (т.е. PGA), включая полигликолевую кислоту. Другие подходящие полимеры могут включать, но не ограничиваются ими, поликапролактон (PCL), поли(диоксанон) (PDO), коллаген, денатурированный коллаген, желатин, сшитый желатин и их сополимеры. Полимер частиц предназначен для деградации в результате гидролиза полимерных цепей в биологически приемлемые и все более меньшие компоненты, такие как полилактиды, полигликолиды и их сополимеры. Они, в конечном итоге, разрушаются до молочной и гликолевой кислоты, входят в цикл Кребса и разрушаются до углекислого газа и воды, и выводятся из организма.
В дополнение к углеводному фрагменту раскрытые модифицированные углеводами частицы могут включать дополнительные компоненты для модуляции иммунного ответа. В частности, раскрытые модифицированные углеводами частицы могут включать в себя антиген, например, антиген, используемый и вводимый субъекту для десенсибилизации субъекта к антигену и/или индуцирования толерантности у субъекта. Антиген может быть ковалентно или иным образом присоединен к поверхности модифицированных углеводами частиц. Подходящие антигены также могут включать антигены, связанные с аллергическими реакциями, например, антигены, связанные с пищевой аллергией. Подходящие антигены для включения в раскрытые модифицированные углеводами частицы могут включать аутоантигены, связанные с аутоиммунным заболеванием, такие как антигены, связанные с аутоиммунными заболеваниями, выбранными из аутоиммунных заболеваний сердца (например, миокардит и постинфарктный синдром), почки (например, нефрит, обусловленный антителами к базальной мембране капилляров клубочков), печени (например, аутоиммунный гепатит, первичный билиарный цирроз), кожи (например, круговая алопеция, псориаз, системная склеродермия и витилиго), надпочечной железы (например, болезнь Аддисона), поджелудочной железы (например, аутоиммунный панкреатит и сахарный диабет 1 типа (T1D)), щитовидной железы (например, базедова болезнь), слюнных желез (например, синдром Шегрена), пищеварительной системы (например, целиакия, болезнь Крона и язвенный колит), крови (например, тромбоцитопеническая пурпура, синдром Эванса, пернициозная анемия и тромбоцитопения), соединительной ткани (например, анкилозирующий спондилоартрит, ювенильный артрит, ревматоидный артрит, саркоидоз и системная красная волчанка), мышечной ткани (например, фибромиалгия, миастения гравис и дерматомиозит) и нервной системы (например, острый рассеянный энцефаломиелит, синдром Гийена-Барре, рассеянный склероз и идиопатическое воспалительное демиелинизирующее заболевание).
В некоторых вариантах осуществления раскрытых модифицированных углеводами частиц в дополнение к углеводному фрагменту раскрытые модифицированные углеводами частицы могут включать антиген или аллерген, например, где модифицированные углеводами частицы могут вводиться субъекту, проявляющему аллергическую реакцию к антигену или аллергену или к риску развития аллергической реакции на антиген или аллерген, для десенсибилизации субъекта к антигену или аллергену и/или индуцирования толерантности у субъекта к антигену или аллергену. В других вариантах осуществления раскрытых модифицированных углеводами частиц в дополнение к углеводному фрагменту раскрытые модифицированные углеводами частицы могут включать в себя антиген, полученный из инсулина, например, когда модифицированные углеводами частицы могут вводиться субъекту, имеющему сахарный диабет типа 1 или риск развития сахарного диабета типа 1, для десенсибилизации субъекта к инсулину и/или индуцирования толерантности у субъекта к инсулину. В дополнительных вариантах осуществления раскрытых модифицированных углеводами частиц в дополнение к углеводному фрагменту раскрытые модифицированные углеводами частицы могут включать в себя антиген, полученный из трансплантата, для десенсибилизации субъекта к антигену трансплантата и/или индуцирования толерантности у субъекта к антигену трансплантата и лечения и/или предотвращения отторжения трансплантата.
Подходящие антигены для включения в модифицированные углеводами частицы, могут включать пептиды, полипептиды или белки. Используемые в данном документе термины «пептид», «полипептид» и «белок», которые могут быть названы здесь взаимозаменяемыми, относятся к молекулам, которые содержат полимеры аминокислот. В тех случаях, когда «аминокислотная последовательность» указывается для обозначения последовательности белковой молекулы природного происхождения, «аминокислотная последовательность» и подобные термины не предназначены для ограничения аминокислотной последовательности до полностью нативной аминокислотной последовательности, связанной с указанной молекулой белка. Термин «аминокислота» может относиться аминокислотам к природного и/или неприродного происхождения.
Как предусмотрено в настоящем документе, пептиды, полипептиды и белки могут быть использованы в качестве антигенов, например, антигенов, которые ковалентно присоединены к поверхности частиц, раскрытых здесь. Например, SEQ ID NO:1-9 обеспечивают аминокислотные последовательности частей инсулина или его вариантов (например, варианты дезамидированного Q→E), которые могут быть использованы в качестве антигенов, как предусмотрено здесь. Приводимые в качестве примера пептиды, полипептиды и белки могут содержать аминокислотную последовательность любого из SEQ ID NO: 1-9 или могут содержать аминокислотную последовательность, имеющую, по меньшей мере, примерно 80%, 90%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по любому из SEQ ID NO:1-9. Приводимые в качестве примера пептиды, полипептиды и белки могут включать полипептиды, имеющие одну или несколько аминокислотных замен, делеций, добавок и/или аминокислотных вставок относительно эталонных пептидов, полипептидов и белков.
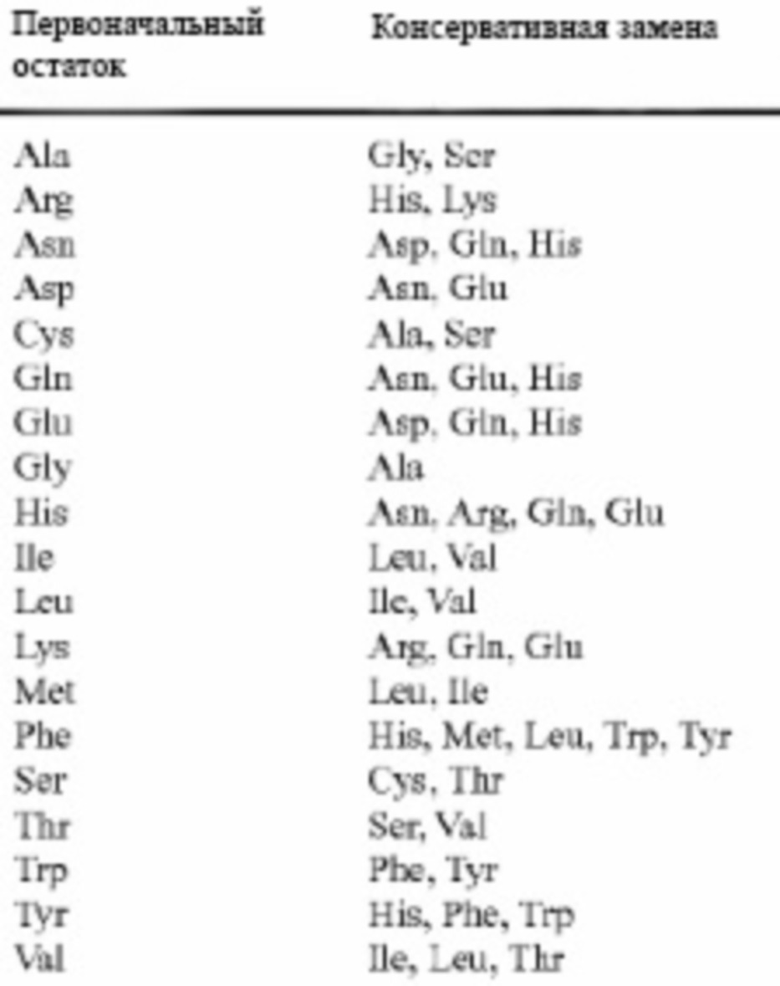
Предусмотренные в данном документе аминокислотные последовательности могут включать консервативные аминокислотные замены относительно эталонной аминокислотной последовательности. Например, вариант полипептида инсулина может включать консервативные аминокислотные замены относительно природного полипептида инсулина. «Консервативные аминокислотные замены» представляют собой замены, которые, как предполагается, меньше всего влияют на свойства эталонного полипептида. Другими словами, консервативные аминокислотные замены существенно сохраняют структуру и функцию эталонного белка. В следующей таблице приведен список примерных консервативных аминокислотных замен.
Консервативные аминокислотные замены обычно поддерживают (a) структуру полипептидного остова в области замены, например, в виде бета-листа или альфа-спиральной конформации, (b) заряд или гидрофобность молекулы в месте замены, и/или (c) основную часть боковой цепи.
«Делеция» относится к изменению аминокислотной или нуклеотидной последовательности, которая приводит к отсутствию одного или нескольких аминокислотных остатков или нуклеотидов относительно эталонной последовательности. Делеция удаляет, по меньшей мере, 1, 2, 3, 4, 5, 10, 20, 50, 100 или 200 аминокислотных остатков или нуклеотидов. Делеция может включать в себя интерстициальную делецию или терминальную делецию (например, N-концевое усечение или усечение C-концевой части эталонного полипептида или 5'-концевое или 3'-концевое усечение эталонного полинуклеотида).
«Фрагмент» представляет собой часть аминокислотной последовательности или полинуклеотида, которая идентична последовательности, но короче, чем эталонная последовательность. Фрагмент может содержать вплоть до всей длины эталонной последовательности, за вычетом, по меньшей мере, одного нуклеотидного/аминокислотного остатка. Например, фрагмент может содержать от 5 до 1000 смежных нуклеотидов или смежных аминокислотных остатков эталонного полинуклеотида или эталонного полипептида, соответственно. В некоторых вариантах осуществления фрагмент может содержать, по меньшей мере, 5, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 150, 250 или 500 смежных нуклеотидов или смежных аминокислотных остатков эталонного полинуклеотид или эталонного полипептида, соответственно. Фрагменты могут быть предпочтительно выбраны из определенных областей молекулы. Термин «по крайней мере один фрагмент» охватывает полноразмерный полинуклеотид или полноразмерный полипептид.
«Гомология» относится к сходству последовательностей или взаимозаменяемости, идентичности последовательностей между двумя или более полинуклеотидными последовательностями, или двумя или более полипептидными последовательностями. Гомология, сходство последовательностей и процент идентичности последовательностей могут быть определены с использованием способов в данной области техники и описанных здесь.
Фразы «процент идентичности» и «% идентичности» применительно к полипептидным последовательностям, относятся к проценту совпадений остатков между, по меньшей мере, двумя полипептидными последовательностями, выровненными с использованием стандартизованного алгоритма. Способы выравнивания полипептидной последовательности хорошо известны. Некоторые способы выравнивания учитывают консервативные аминокислотные замены. Такие консервативные замены, более подробно описанные выше, обычно сохраняют заряд и гидрофобность в месте замены, тем самым сохраняя структуру (и, следовательно, функцию) полипептида. Процент идентичности для аминокислотных последовательностей может быть определен, как известно в данной области техники. (См., например, патент U.S. № 7,396,664, который включен в настоящий документ в полном объеме посредством ссылки). Набор часто используемых и находящихся в свободном доступе алгоритмов сравнения последовательностей представлен Национальным центром биотехнологической информации (NCBI), Средство поиска основного локального выравнивания (BLAST) (Altschul, S. F. et al. (1990) J. Mol. Biol. 215:403 410), который доступен из нескольких источников, включая NCBI, Bethesda, Md., на веб-сайте. Набор программного обеспечения BLAST включает в себя различные программы анализа последовательности, включая «blastp», который используется для выравнивания известной аминокислотной последовательности с другими аминокислотными последовательностями из множества баз данных.
Процент идентичности можно измерять по длине всей определенной последовательности полипептида, например, как определено конкретным номером SEQ ID, или можно измерять на более короткой длине, например, по длине фрагмента, взятого из большей, определенной полипептидной последовательности, например, фрагмент, по меньшей мере 15, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 70 или, по меньшей мере 150, смежных остатков. Такие длины являются только примерными, и понятно, что любая длина фрагмента, поддерживаемая последовательностями, показанными здесь, в таблицах, фигурах или Списке последовательностей, может использоваться для описания длины, на которой может быть измерен процент идентичности.
«Вариант» конкретной полипептидной последовательности определяется как полипептидная последовательность, имеющая, по меньшей мере, 50% идентичность последовательности с конкретной полипептидной последовательностью на определенной длине одной из полипептидных последовательностей с использованием blastp с помощью инструмента «BLAST 2 Sequences», доступного на веб-сайте Национального центра биотехнологической информации. (См. Tatiana A. Tatusova, Thomas L. Madden (1999), ʺBlast 2 sequences - a new tool for comparing protein and nucleotide sequencesʺ, FEMS Microbiol Lett. 174:247-250). Такая пара полипептидов может показывать, например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или, по меньшей мере, 99% или более идентичность последовательности на известной определенной длине одного из полипептидов.
Раскрытые полипептиды могут быть модифицированы таким образом, чтобы содержать аминокислотную последовательность или модифицированные аминокислоты, так что описанные полипептиды нельзя назвать природными. В некоторых вариантах осуществления раскрытые полипептиды модифицированы, и модификация выбирается из группы, состоящей из ацилирования, ацетилирования, формилирования, ацилирования высшими жирными кислотами, ацилирования остатком миристиновой кислоты, пальмитоилирования, алкилирования, изопренилирования, пренилирования и амидирования. Аминокислота в раскрытых полипептидах может быть модифицирована таким образом, но, в частности, модификации могут присутствовать на N-конце и/или С-конце полипептидов (например, N-концевое ацилирование или ацетилирование и/или С-концевое амидирование). Модификации могут повысить стабильность полипептидов и/или сделать полипептиды устойчивыми к протеолизу.
Раскрытые частицы могут быть получены способами, известными в данной области техники, включая, но не ограничиваясь ими, способы, раскрытые в патентах U.S. № 8,546,371; 8,518,450; и 7,550,154, содержание которых включено в настоящее описание посредством ссылки в полном объеме. Способы формирования микрочастиц и/или наночастиц могут включать, но не ограничиваются, высушивание распылением, осаждение и/или измельчение основного материала (например, биодеградируемого полимерного основного материала).
Раскрытые частицы обычно модифицируются путем включения углеводного фрагмента, предпочтительно углеводного фрагмента, который является иммуномодулятором, присоединенным к поверхности частиц (например, посредством ковалентного присоединения). Подходящие углеводные фрагменты могут включать, но не ограничиваются, фрагменты из следующей группы или их фармацевтические соли: гепарина дисахарид I-A, гепарина дисахарид II-A, гепарина дисахарид III-A, гепарина дисахарид IV-A, гепарина дисахарид IV-S, ненасыщенный гепарина дисахарид I-H, ненасыщенный гепарина дисахарид II-H, ненасыщенный гепарина дисахарид III-H, ненасыщенный гепарина дисахарид I-P, хондроитина дисахарид Δdi-0S, хондроитина дисахарид Δdi-4S, хондроитина дисахарид Δdi-6S, хондроитина дисахарид ΔDi-diSB, хондроитина дисахарид ΔDi-diSE, хондроитина дисахарид ΔDi-triS, хондроитина дисахарид ΔDi-UA2S, неокаррадекаоз-41,3,5,7,9-пента-O-сульфат, неокаррагексадекаоз-41,3,5,7,9,11,13,15-окта-O-сульфат, GalNAcβ1-4Gal (рецептор для пили Pseudomonas aeruginosa), линейный трисахарид группы крови B группы 2, антиген P1, антиген Tn, сиалил-Льюис A, сиалил-Льюис X, сиалил-Льюис X β-метил гликозид, сульфо-Льюис A, сульфо-Льюис X, α1-2-маннобиоза, α1-3-маннобиоза, α1-6-маннобиоза, маннотетраоза, α1-3, α1-3, α1-6-маннопентоза, β1-2-N-ацетилглюкозамин-манноза, LS-тетрасахарид a (LSTa), LS-тетрасахарид c (LSTc), α-D-N-ацетилгалактозаминил-1-3-галактоза, α-D-N-ацетилгалактозаминил-1-3-галактоза-β1-4-глюкоза, D-галактоза-4-O-сульфат, глицил-лактоза (Lac-gly), глицил-лакто-N-тетраоза (LNT-gly), 2'-фукозиллактоза, лакто-N-неотетраоза (LNnT), лакто-N-тетраоза (LNT), лакто-N-дифукогексаоза I (LNDFH I), лакто-N-дифукогексаоза II (LNDFHII), лакто-N-неогексаоза (LNnH), 3'-сиалиллактоза (3'-SL), 6'-сиалиллактоза (6'-SL), 3'-сиалил-N-ацетиллактозамин, 6'-сиалил-N-ацетиллактозамин (6'-SLN), 3-фукозиллактоза (3FL), фукоидан, 4-β-галактобиоза, 1-3-галактодиозил-β-метил-гликозид, α1-3, β1-4, α1-3-галактотетраоза, β-галактозил-1-3-N-ацетил-галактозамин-метил-гликозид, β1-3-Gal-N-ацетил галактозаминил-β1-4 Gal-β1-4-Glc, β1-6 галактобиоза, глоботриоза, β-D-N-ацетилглактозаминил 1-3-галактоза (терминальный дисахарид глоботриозы), 1-дезоксинойириминцин (DNJ), D-фукоза, L-фукоза, D-талоза, калистегин A3, калистегин B3, N-метил цис-4-гидроксиметил-L-пролин, 2,5-дидезокси-2,5-имино-D-маннит, кастаноспермин, 6-эпи-кастаноспермин и их комбинаций. В некоторых вариантах осуществления частицы содержат сложные углеводные фрагменты и предназначены для лечения и/или предотвращения заболевания или расстройства посредством иммунномодуляции.
Углеводные фрагменты раскрытых частиц обычно представляют собой углеводы, состоящие из атомов углерода, водорода и кислорода, и могут иметь эмпирическую формулу Cm(H2O)n, где m и n являются целыми числами и могут быть одинаковыми или различными. Некоторые углеводы могут включать в себя атомы, отличные от углерода, водорода и кислорода, например, атомы азота, фосфора и/или серы. Однако углеводы, которые включают атомы, отличные от углерода, водорода и кислорода, например, атомы азота, фосфора и/или серы, обычно включают данные отличные атомы при низком молярном массовом содержании молекулы углевода (например, менее чем 10% или 5%).
Углеводные фрагменты могут быть прикреплены непосредственно к поверхности частиц (например, посредством ковалентного связывания). В ряде случаев углеводные фрагменты могут быть прикреплены опосредованно к поверхности частиц, например, ковалентно с помощью одной или нескольких молекул линкера (например, полиэтиленгликолевый линкер). Углеводные фрагменты могут быть прикреплены к поверхности частиц с помощью способов сшивания, которые могут включать, но не ограничиваются ими, сшивание карбодиимидом (EDC).
В ряде случаев раскрытые частицы могут содержать один или несколько дополнительных иммуномодулирующих агентов, отличных от углеводного фрагмента. Дополнительные агенты могут включать антигены, как отмечалось выше, и/или цитокины (например, интерлейкины и интерфероны) и/или иммуномодулирующие антитела.
Раскрытые частицы функционируют как «иммуноусилители» и/или «иммуноингибиторы». Таким образом, раскрытые частицы могут вводиться при ряде применений, включая, но не ограничиваясь ими: укрепление иммунитета для улучшения эффективности вакцины; укрепление иммунитета для улучшения противоопухолевого иммунитета и результатов лечения рака; укрепление иммунитета для улучшения результатов лечения во время инфекционных заболеваний; иммуноингибирование для лечения аллергических заболеваний, таких как астма, пищевая аллергия и экзема; иммуноингибирование для лечения аутоиммунных заболеваний, таких как ревматоидный артрит, рассеянный склероз и диабет; и/или иммуноингибирование для улучшения результатов лечения во время трансплантации.
Раскрытые частицы можно вводить для десенсибилизации субъекта и/или индуцирования толерантности у субъекта к антигену. Десенсибилизация и/или толерантность могут оцениваться с использованием способов в данной области техники и раскрытых здесь, которые могут включать, но не ограничиваются, предпочтительно, индуцированием секреции IL-10, TGFβ или CCL4 макрофагами по сравнению с исходным уровнем, включая секрецию IL-6 по сравнению с исходным уровнем. Таким образом, десенсибилизация и/или толерантность могут оцениваться с использованием отношения IL-10/IL-6, которое отражает относительное изменение секреции IL-10 по сравнению с исходным уровнем в сравнении с изменением секреции IL-6 по сравнению с исходным уровнем.
Раскрытые частицы можно вводить для модуляции иммунного ответа у субъекта. По существу, раскрытые частицы могут быть составлены в виде фармацевтической композиции. Такие композиции могут быть составлены и/или введены в дозах и с помощью методов, хорошо известных специалистам в области медицины, с учетом таких факторов, как возраст, пол, вес и состояние конкретного пациента, а также способ введения.
Композиции могут включать фармацевтические растворы, содержащие носители, разбавители, эксципиенты (например, порошкообразные эксципиенты, такие как лактоза, сахароза и маннит), и поверхностно-активные вещества (например, неионные поверхностно-активные вещества), как известно в данной области техники. Кроме того, композиции могут включать консерванты (например, антимикробные или антибактериальные агенты). Композиции также могут включать буферные агенты (например, для поддержания рН композиции между 6,5 и 7,5).
Фармацевтические композиции можно вводить профилактически или терапевтически. При профилактическом введении композицию можно вводить субъекту в количестве, достаточном для модуляции иммунного ответа для защиты от заболевания или расстройства (то есть «профилактически эффективная доза»)). При терапевтических применениях композиции вводят субъекту в количестве, достаточном для лечения заболевания или расстройства (то есть «терапевтически эффективная доза»)).
Композиции, раскрытые в данном документе, могут быть доставлены с помощью различных путей введения. Типичные пути доставки включают парентеральное введение (например, внутрикожная, внутримышечная, внутрибрюшинная или подкожная доставка). Другие способы включают интраназальные и внутрилегочные пути введения. Составы фармацевтических композиций могут включать жидкости (например, растворы и эмульсии), спреи и аэрозоли. В частности, композиции могут быть составлены в виде аэрозолей или спреев для интраназальной или внутрилегочной доставки. Подходящие устройства для введения аэрозолей или спреев для интраназальной или внутрилегочной доставки могут включать ингаляторы и распылители.
Раскрытые в данном документе композиции могут вводиться совместно или последовательно с другими иммунологическими, антигенными или вакцинными, или терапевтическими композициями, включая адъювант, или химический или биологический агент, вводимый в комбинации с антигеном для усиления иммуногенности антигена. Дополнительные терапевтические агенты могут включать, но не ограничиваются ими, цитокины, такие как интерлейкины и интерфероны.
Используемый здесь термин «режим вакцинации примирование-стимулирование» относится к режиму, в котором субъекту вводится первая композиция, а затем по истечении определенного периода времени (например, примерно через 2, 3, 4, 5 или 6 недель), субъекту вводят вторую композицию, которая может быть такой же или отличной от первой композиции. Первая композиция (и вторая композиция) может вводиться один или несколько раз. Раскрытые способы могут включать примирование субъекта первой композицией путем введения первой композиции по меньшей мере один раз, позволяя пройти определенному промежутку времени (например, по меньшей мере, примерно 2, 3, 4, 5 или 6 недель), и затем стимулируя путем введения той же композиции или второй, отличной композиции.
Чтобы оценить эффективность описанных здесь фармацевтических композиций, иммунный ответ можно оценить, измеряя индукцию клеточных иммунных ответов и/или образования антител. Т-клеточные ответы могут быть измерены, например, с использованием окрашивания тетрамерами первичных или культивируемых МКПК (РВМС), методом иммуноферментных пятен (ELISPOT) или с использованием функциональных анализов цитотоксичности, которые хорошо известны специалистам в данной области техники. Образования антител могут быть измерены с помощью анализов, известных в данной области техники, таких как ИФА (ELISA). Титр или нагрузка патогена могут быть измерены с использованием способов в данной области техники, включая способы, которые обнаруживают нуклеиновую кислоту патогена. (См., например, патент U.S. № 7,252,937, содержание которого включено путем ссылки в полном объеме).
ПРИМЕРЫ
Следующие примеры являются иллюстративными и не предназначены для ограничения раскрытого объекта изобретения.
Пример 1 - Улучшенные углеводами наночастицы для иммунномодуляции
Введение
Наночастицы PLGA использовались для различных применений, включая доставку лекарств, тканевую и клеточную визуализацию, а также для доставки собственных или чужеродных белков, чтобы способствовать индукции иммунной активации или толерантности. (См. Sah et al., ʺConcepts and practices used to develop functional PLGA-based nanoparticulate systems,ʺ International Journal of Medicine, 2013:8 747-765). В данном документе мы разработали технологию для создания функционализированных PLGA-частиц и установили их потенциал для модификации иммунного ответа.
Экспериментальные методы, результаты и обсуждение
Первоначально мы подошли к этой области из наших исследований по связанной с клетками толерантности к антигенам, в качестве терапевтического подхода к лечению аллергических заболеваний (см. Smarr et al., ʺAntigen-fixed leukocytes tolerize Th2 responses in mouse models of allergy,ʺ The Journal of Immunology, 11/2011; 187(1):5090-8), в результате чего белки, вызывающие аллергию, присоединяются к аутологичным клеткам с использованием химического сшивания карбодиимидом EDC, вводятся обратно в мышей, и формируется толерантность (то есть состояние иммунологической неотвечаемости). Поскольку применение этого подхода для пациентов осложняется использованием клеток, мы начали изучать потенциальное использование наночастиц PLGA в качестве замены; однако наши данные показали, что антиген, инкапсулированный в наночастицы PLGA, вызывал другой ответ (десенсибилизацию вместо толерантности, и поэтому реактивность со временем восстанавливалась). Поскольку макрофаги являются одной иммунной клеткой, которая считается важной в иммунных ответах, включая толерантность, посредством продуцирования ими ключевого иммунного медиатора под названием интерлейкин-10 (IL-10), мы разработали in vitro подход к скринингу эффектов EDC-клеток по сравнению с PLGA-наночастицами для их эффектов на продуцирование IL-10. Как показано на Фиг. 1, мы наблюдали, что EDC-клетки усиливали IL-10 после стимуляции (Липополисахарид (LPS)), в то время как частицы PLGA этого не делали.
Исходя из этого, мы пришли к выводу, что сигналы, присутствующие на клетках, не присутствуют на частицах PLGA, и поэтому был разработан скрининг, основанный на высокой пропускной способности (выполненный посредством Northwestern HTS core в Эванстоне). Мы исследовали провоспалительный ответ (IL-6) или противовоспалительный ответ (IL-10), как показано на Фиг. 2.
Мы рассмотрели группу из 70 уникальных углеводных соединений, которые найдены на клетках, но не присутствовали на наночастицах PLGA. Используя стратегию на Фиг. 2, мы рассчитали наибольшую кратность изменения для продуцирования цитокинов по терапевтически применимой кривой доз 0,1, 1, 10 и 100 мкМ. Как показано на Фиг. 3, мы идентифицировали много углеводных соединений, которые были способны модифицировать ответ макрофагов, с повышением уровня экспрессии, понижением или без изменений, в сравнении с EDC-клетками или самостоятельной стимуляцией, с предположением, что они имеют потенциал для функционализации PLGA, если связаны с частицами. Для дальнейшего продолжения мы выбрали одного кандидата (L-фукозу) и связали его с PLGA с использованием двухстадийного химического процесса. Процесс связывания показан на Фиг. 4.
Первоначально производное L-фукозы (4-аминофенил бета-L-фукопиранозид) присоединяли к полиэтиленгликолевому (PEG) линкеру с использованием реакции сшивания EDC. Затем присоединяли к карбоксилированным наночастицам PLGA с использованием второй реакции сшивания EDC. Характеристика конечного продукта показала потерю сферической структуры несвязанных частиц и неровные частицы неправильной формы. Чтобы проверить функциональные способности фукозилированных наночастиц PLGA (называемых F-CENP), мы исследовали их влияние на нашей in vitro модели для продуцирования IL-10. Как показано на Фиг. 5, F-CENP были значительно лучше по индукции IL-10, чем клетки, получающие только PLGA, только L-фукозу или даже EDC-клетки, что указывает на то, что функционализированная частица PLGA является улучшением даже по сравнению с EDC-клетками.
Пример 2 - Разработка улучшенных углеводами наночастиц с индукции иммунной толерантности при пищевых аллергиях
Пищевые аллергии могут быть определены как неблагоприятная иммунная реакция на пищевые продукты и могут включать в себя аллергическую сыпь и опасную для жизни анафилаксию. Тяжесть реакции может зависеть от ряда факторов, в том числе от количества пищи, формы пищи (например, сырой, приготовленной или обработанной) и факторов риска, таких как возраст, степень сенсибилизации и другие сопутствующие заболевания. Пищевые аллергии классически известны как опосредованные IgE, но могут быть гетерогенными в физиологических ответах и симптомах. (См. Sicherer and Sampson, J Allergy Clin. Immunol. (2010) Feb;125(2 Suppl 2)S116-25; Berin and Mayer, J. Allergy Clin. Immunol. (2013) Jan;131(1):14-22; и Boyce et al. (NIAID Guidelines), J. Allergy Clin. Immunol. (2010) Dec;126(6 Suppl):S1-58). Иммунологические механизмы, вовлеченные в пищевую аллергию, включают сенсибилизацию и толерантность (см. Johnston et al., J. Immunol. (2014) Mar 15;192(6):2529-34, и Фиг. 6), а потенциальная терапия для пищевой аллергии может включают в себя введение антигена для десенсибилизации (краткосрочная терапия) и/или для повышения толерантности (длительная терапия) (Berin and Mayer, J. Allergy Clin. Immunol. (2013) Jan;131(1):14-22, и Фиг. 7). Антигены, инкапсулированные в микрочастицу, были введены в модель пищевой аллергии, чтобы индуцировать десенсибилизацию, и показано, что антиген-фиксированные лейкоциты вызывают толерантность в мышиных моделях аллергии. (См. Smarr et al., J. Immunol. (2011) 187:5090-5098). Однако идеальное разработанное терапевтическое средство должно обеспечивать не только антиген для индуцирования десенсибилизации или толерантности, но также и одновременные толерогенные сигналы иммунной системе. В связи с этим желательны способы идентификации толерогенных сигналов, которые могут быть использованы для лечения аллергии, включая десенсибилизацию и толерантность. После идентификации, толерогенные сигналы могут быть составлены как часть микро- и/или наночастиц, которые необязательно включают антигены для индуцирования десенсибилизации и/или толерантности. Апоптотические клетки включают естественные толерогенные сигналы на поверхности клетки. (См. Taylor et al., Nat. Rev. Mol. Bio. (2008) Mar;9(3):231-41, и Фиг. 8). Соединения, присутствующие на поверхности клетки, включая белки, липиды, гликолипиды и углеводы, которые могут участвовать в развитии толерантности.
Аллергические реакции обычно включают воспалительный ответ, и LPS-стимулированные макрофаги (то есть «активированные макрофаги») использовались в качестве инструмента для изучения смещения воспалительного ответа. Например, LPS-стимулированные макрофаги выделяют провоспалительные цитокины, такие как IL-6, TNF-α и IL1β, и модуляция секреции данных воспалительных цитокинов может быть использована для идентификации соединений, которые ингибируют воспалительный ответ. Химические соединения, которые, как было обнаружено, ингибируют данный воспалительный ответ в макрофаге RAW 264,7, характеризующийся уменьшением секреции провоспалительных цитокинов и увеличением IL-10/TGFβ, включают: 6-дегидроджинджордион; пеимин; аденозин; и сайкосапонин A. (См. Huang et al., J. Agric. Food Chem. (2014) Seep 17;62(37):9171-9; Yi et al., Immunopharmacol. Immunotoxicol. (2013) Oct;35(5):567-72; Zhu et al., Exp. Ther. Med. (2013) May;5(5):1345-1350; и Koscso et al., J. Leukoc. Biol. (2013) Dec;94(6):1309-15). Соответственно, активированные макрофаги RAW могут использоваться в качестве модели для скрининга толерогенных сигналов.
Используя активированные макрофаги RAW, мы разработали метод скрининга с высокой пропускной способностью для определения толерогенных сигналов. (См. Фиг. 2). Мы тестировали семьдесят (70) соединений на основе способности соединения увеличивать секрецию IL-10 по сравнению с исходным уровнем и/или уменьшать секрецию IL-6 по сравнению с исходным уровнем в макрофагах, активированных LPS, и в макрофагах, активированных LPS, в присутствии спленоцитов (SP) которые были обработаны химическим сшивающим этилкарбодиимидом (ECDI-SP). Антигены, которые сшиты на поверхности ECDI-SP, можно вводить при индуцировании антиген-специфической толерантности (см. Jenkins et al., J. Exp. Med. 165:302-319 (1987)), и в связи с этим мы включили макрофаги, активированные LPS в присутствии ECDI-SP, чтобы определить, будет ли соединение проявлять подобные толерогенные сигналы в макрофагах, активированных LPS, и в макрофагах, активированных LPS в присутствии ECDI-SP. Мы идентифицировали ряд углеводных соединений, которые проявляют толерогенные сигналы. (См. Фиг. 3A и 3B). Фукоза была выбрана в качестве типичных углеводных соединений, обладающих толерогенным сигналом, и была связана с наночастицами, имеющими полимерное ядро PLGA, для получения улучшенных углеводами наночастиц PLGA (F-CENP). (См. Фиг. 4). Как показано на Фиг. 5, F-CENP был значительно лучше по индукции IL-10, чем клетки, получающие только PLGA, только L-фукозу или даже EDC-клетки, что указывает на то, что функционализированная частица PLGA является улучшением даже по сравнению с EDC-клетками.
Таким образом, макрофаги RAW могут быть использованы в качестве системы скрининга для выявления потенциальных соединений, которые могут индуцировать толерантность. Наш предварительный скрининг из 70 соединений показал несколько соединений, которые можно было бы использовать для стимуляции секреции IL-10, не изменяя или уменьшая секрецию IL-6. Наши результаты показывают, что сигналы, благоприятствующие толерантности, могут быть включены в композицию терапевтического средства для введения антигена и индуцирования толерантности с большей эффективностью.
Пример 3 - Сигнальные наночастицы LNFPIII и GAS6 для доставки толерантности при T1D
Уровень техники
Диабет 1 типа (T1D) является аутоиммунным расстройством, вызванным аутореактивным опосредованным Т-клетками разрушением β-клеток поджелудочной железы, приводящим к гипергликемии, требующей экзогенной терапии инсулином. Пациенты с высоким риском развития T1D теперь могут быть идентифицированы комбинацией генотипирования для лейкоцитарных антигенов человека и серологическим тестированием для группы аутоантител к островковым клеткам.1 В этой группе высокого риска, до или во время острого начала клинического диабета, все еще может присутствовать значительная масса β-клеток, так что, если непрерывная аутоиммунность, направленная на β-клетки, может быть эффективно и постоянно ингибирована, оставшиеся клетки могут восстановить нормогликемию.2,3 Регуляторные Т-клетки (Tregs) играют важную роль в поддержании периферической толерантности, и их недостаток были связан с неконтролируемой аутоиммунностью, включая T1D.4 По этой причине иммунотерапии, прямо или косвенно увеличивающие Tregs, рассматривались как перспективный терапевтический подход.5-7 Недавнее клиническое исследование 1 фазы продемонстрировало возможность экспансии ex vivo и безопасность адоптивного переноса поликлональных Tregs у T1D-пациентов7; однако эффективность такой адоптивной иммунотерапии с использованием ex vivo размноженных Tregs еще не определена. В то же время, антигенспецифические Tregs считаются более эффективными, чем поликлональные Tregs для супрессии аутоиммунности при T1D.8-10 Однако ex vivo экспансия антигенспецифических Tregs для лечения человека является очень трудоемкой и несет значительную нормативную и лицензионную нагрузку, не говоря уже о том, что вовлеченные β-клеточные аутоантигены являются движущейся мишенью, учитывая широко известный эпитоп, распространяющийся у таких индивидуумов.11 Следовательно, иммунотерапия, направленная на экспансию эндогенных Tregs in vivo, вероятно более осуществима и, более вероятно, для достижения желаемого антигенспецифического ингибирования, адаптированного к конкретному набору аутоантигенов, присутствующих в данном индивидууме. Наиболее перспективным кандидатом-антигеном для иммунотерапии при T1D является сам инсулин и его производные.12 В идеале, соответствующий аутоантиген, полученный из инсулина, может быть использован для индукции эффективной перенесенной толерантности13, которая распространяется на другие β-клеточные аутоантигены.
Мы и наши коллеги создали эффективную толерогенную вакцину для контроля аутоиммунитета и аллоиммунитета.14,15 Толерогенная вакцина производится как антигенсвязанные, фиксированные этиленкарбодиимидом (ECDI) спленоциты (Ag-SP), и назначается через внутривенный (i.v.) путь введения. Показано, что i.v. инъекция аутоантигенсвязанного Ag-SP индуцирует эффективную и длительную антиген-специфическую толерантность в мышиных моделях аутоиммунного диабета,16 EAE,17,18 аллергических заболеваний19; и в последнее время Luo Lab в аллогенных и ксеногенных моделях трансплантов как у мышей20,21, так и у нечеловекообразных приматов (неопубликованные данные). Более того, наши коллеги недавно опубликовали первое клиническое испытание для рассеянного склероза, основанное на данном принципе, с использованием аутологичных клеток, связанных с миелином22, в котором была установлена возможность клинической реализации, безопасность и эффективность данной новой стратегии толерантности. Примечательно, что характерной особенностью опосредованной Ag-SP толерантности является устойчивая экспансия эндогенных Tregs in vivo,15,19,23 - данные исследования, которое недавно было воспроизведено у нечеловеческих приматов.24 В связи с этим Ag-SP является весьма перспективной антиген-специфической толерантной терапией для пациентов с T1D.
Чтобы обойти необходимость производства большого количества клеток пациента для получения Ag-SP, в последнее время мы начали работу с использованием биоинженерных наночастиц (NP) в качестве носителей для доставки антигенных нагрузок и опубликовали нашу раннюю работу, демонстрирующую перспективную эффективность таких толегоренных вакцин Ag-NP.25-27 Однако в мышиных моделях как пищевой аллергии, так и аллогенной трансплантации островков мы наблюдаем, что такая Ag-NP обладает субоптимальной эффективностью толерантности по сравнению с Ag-SP. Из этих наблюдений мы рационализируем, что должны существовать дополнительные толерогенные сигналы, обеспечиваемые Ag-SP, которых нет на Ag-NP. В наших предварительных исследованиях мы выявили два таких недостающих толерогенных сигнала от Ag-NP, которые могут активировать (1) лектин CD209 и (2) эффероцитарную рецепторную тирозинкиназу Mer (Фиг. 12A, B и C) при взаимодействии с фагоцитами хозяина. Поэтому мы выдвигаем гипотезу о том, что сопряжение лигандов для CD209 и Mer к NP (например, через ковалентное присоединение прямо или косвенно через линкер) значительно повысит толерогенность вакцин Ag-NP.
В данном документе мы предлагаем разработать биоинженерные NP, несущие CD209 и Mer двойные сигнальные лиганды, и проверить их способность индуцировать β-клеточную специфическую толерантность для T1D. Наши убедительные предварительные результаты, всесторонний экспериментальный план и синергетический опыт исследовательской группы представляют уникальную возможность для разработки высокоэффективной биоинженерной вакцины Ag-NP для доставки толерантности при T1D.
Предлагаемые исследования
Центральная гипотеза: Как схематически показано на Фиг. 9, мы выдвигаем гипотезу о том, что эффективность системы доставки Ag-NP для терапии толерантности при T1D может быть значительно увеличена за счет: (1) синхронизированного инжиниринга направленных лигандов (LNFPIII и GAS6) на NP для двойной сигнализации CD209 и Mer; и (2) доставки дезамидированной формы инсулина (INS (Q→E)) в качестве исходного патогенетического аутоантигена для индуцирования перенесенной толерантности.
Определенные цели: Цель 1. Разработать NP, содержащие LNFPIII и GAS6, присутствующие на поверхности NP. В частности, мы определим, приводит ли конъюгация LNFPIII и GAS6 с NP к одновременному таргетингу и сигнализации в соответствующих мышиных фагоцитах, что приводит к эффективной индукции толерогенных признаков в этих фагоцитах. Мы предполагаем, что LNFPIII-GAS6-NP эффективно индуцирует толерогенные признаки в мышиных макрофагах (MF) через двойную сигнализацию CD209 и Mer. Цель 2. Проверить эффективность толерантности INS(Q→E)-LNFPIII-GAS6-NP на мышиной модели диабета, не страдающей ожирением (NOD). В частности, мы будем определять у мышей NOD, если доставка LNFPIII-GAS6-NP в сочетании с дезамидированным мышиным проинсулином приводит к устойчивой толерантности к аутоиммунитету, направленному на β-клетки, и, следовательно, предотвращает и/или завершает клинический диабет у мышей NOD. Мы выдвигаем гипотезу, что INS(Q→E)-LNFPIII-GAS6-NP эффективно подавляет аутоиммунитет, направленный на β-клетки, у мышей NOD.
Обоснование целесообразности
Антиген-специфическая терапия толерантности была в центре внимания Luo lab, особенно в контексте трансплантации островков для T1D.14 Наш основной подход заключался в том, чтобы доставить (донорные) антигены, представляющие интерес, путем связывания их с поверхностью спленоцитов (Ag-SP) посредством образования амидной связи в присутствии активирующего карбоксил агента 1-этил-3-(3-диметиламинопрофил)карбодиимида (ECDI).20 Этот подход изначально был экспериментально проведен нашими коллегами для индукции толерантности на животных моделях аутоиммунитета.28 Новаторская работа в Luo lab еще более расширила устойчивую эффективность данного подхода толерантности к аллогенной и ксеногенной трансплантации,21,23,29 в то время как Bryce lab успешно продемонстрировала эффективность данного подхода при астматическом и аллергическом заболевании.19 Чтобы обойти необходимость производства большого количества клеток пациента для получения Ag-SP, в последнее время мы опубликовали нашу новаторскую работу с использованием биоинженерных NP для доставки толегоренного антигена, демонстрирующую перспективную эффективность таких толегоренных вакцин Ag-NP.25-27 С четким представлением о клиническом переводе, в этом приложении мы планируем сосредоточить наши исследования на разработке высокоэффективной вакцины Ag-NP для доставки толерантности при T1D путем: (1) связывания двойных сигнальных лигандов CD209 и Mer с поверхностью NP; и (2) доставки дезамидированного проинсулина в качестве исходного аутоантигена для индуцирования перенесенной толерантности.
Обоснование целесообразности для опосредованной LNFPIII и GAS6 доставки толерантности: в мышиных моделях как пищевой аллергии, так и аллогенной трансплантации островков мы наблюдаем, что Ag-NP обладает субоптимальной эффективностью толерантности по сравнению с Ag-SP. В наших предварительных исследованиях мы идентифицировали два толерогенных сигнальных рецептора, которые были связаны с толерантностью Ag-SP, которые не связаны с Ag-NP: (1) эффероцитарная рецепторная тирозинкиназа Mer (Фиг. 12A, B и C); и (2) лектин CD209. Следовательно, мы предполагаем, что связывание лигандов Mer и CD209 с поверхностью NP значительно повысит толерогенность вакцин Ag-NP. Существует три члена семейства рецепторных тирозинкиназ (RTK), которые специализируются на гомеостатическом клиренсе апоптотических клеток: TYRO3, Axl и Mer, в совокупности именуемые TAM RTK, причем последние два являются основными TAM RTK в иммунной системе.30 Протеин S (Protein S) и GAS6 (Growth Arrest-Specific 6) являются двумя когнатными лигандами для TAM RTK. TAM RTK имеют две известные функции: (1) опосредовать «эффероцитоз», процесс гомеостатического фагоцитоза апоптотических клеток31,32; и (2) передавать регуляторные сигналы, которые модулируют врожденные иммунные ответы.33,34 Дефекты в сигнализации ТАМ, как известно, приводят к значительному аутоиммунитету.30,33 Экзогенный GAS6 может стимулировать тирозиновое аутофосфорилирование как Mer, так и Axl, тогда как Protein S способен сигнализировать только через Mer.35 Кроме того, GAS6 стимулирует более эффективный фагоцитоз, чем Protein S,35 особенно в условиях воспалительного процесса.36 CD209 представляет собой рецептор лектина C-типа, присутствующий на поверхности MF. Его сигнализация в MF была связана с IL-10-опосредованными подавляющими функциями MF.37 Lacto-N-фукопентаоза III (LNFPIII) представляет собой природный пентасахарид, содержащий трисахарид LewisX, который связывает и сигнализирует через CD209,38 и, как было показано, индуцирует иммуномодулирующие эффекты,39,40 пролонгирует выживаемость аллотрансплантата41 и способствует толерантности к трансплантату.37 В наших предварительных исследованиях (Фиг. 12А) мы отмечаем, что CD209 маркирует рельефные селезеночные MF, которые повышающе регулируют RTK Mer в результате Ag-SP, но не Ag-NP инъекции. Эти особенности делают GAS6 и LNFPIII двумя перспективными кандидатами для терапевтической биоинженерии Ag-NP для двойной сигнализации Mer и CD209, тем самым обеспечивая отсутствующие сигналы, которые усилят толерогенность Ag-NP.
Обоснование целесообразности дезамидированного инсулина в качестве исходного применимого при диабете аутоантигена для таргетинга: поскольку клетки островков сильно восприимчивы к окислительному и ЭР-стрессу в физиологических условиях, белки, присутствующие в этих клетках, имеют высокую вероятность прохождения различных посттрансляционных модификаций (PTM). Модифицированные β-клеточные белки могут генерировать нео-антигены, которые не были самостоятельно лишены иммуногенности с помощью механизмов центральной и/или периферической толерантности, поэтому более вероятно, будут вызывать иммунные ответы и последующую аутоиммунитет, направленный на подобные нео-антигены. В трех недавних исследованиях42-44 с использованием клеточного фракционирования и масс-спектрометрии было установлено, что инсулин является обильным источником полипептидных компонентов, продуцируемых секреторными гранулами β-клеток, в соответствии с существующей литературой, демонстрирующей первостепенную роль инсулина в опосредовании аутоиммунности против β-клеток.12,45 При детальном изучении базы данных the Global Proteome Machine мы обнаружили, что дезамидирование глутамина (Q) является частой PTM на инсулине. Дезаминирование боковой цепи Q может быть катализировано ферментами деамидазы или может самопроизвольно возникать, когда белок подвергается влиянию кислоты. In vivo, β-клетки, испытывающие окислительный стресс, который вызывает везикулярное окисление, предположительно обеспечивают среду, способствующую генерации большого количества дезамидированного белка/пептидов инсулина. Примечательно, что в наших предварительных исследованиях мы обнаружили более сильные гуморальные (Фиг. 14A, B и C) и клеточные (данные не показаны) ответы на дезамидированный (Q→E) проинсулин, чем на нативный инсулин, как у пациентов с T1D, так и у мышей NOD, подтверждая нашу гипотезу о том, что такой дезамидированный инсулин обладает высокой иммуногенностью. Важно отметить, что данный ответ на дезамидированный проинсулин с высокой степенью коррелирует с частотой развития диабета у мышей NOD (Фиг. 14B), в настоящее время явление также оценивается в педиатрических группах, подверженных риску Т1D. Учитывая более устойчивый иммунный ответ на дезамидированный проинсулин по сравнению с нативным проинсулином, мы выдвигаем гипотезу о том, что толерантность будет более эффективной, если дезамидированный проинсулин используется в качестве целевого антигена в нашем подходе доставки Ag-NP. Весьма любопытен тот факт, что клонирование от гибридом, собранных у мышей NOD с положительным гуморальным ответом на дезамидированный проинсулин и изучение пептидных массивов, позволило нам отобразить реактивность на единственный дезамидированный остаток глутамина в C-пептиде (Фиг. 14C). Эта высокоиммуногенная дезамидированная последовательность С-пептида будет нашим первоначальным кандидатом для таргетинга.
Предварительные данные
Доставка антигена с помощью клеток Ag-SP приводит к значительной экспансии клеток Treg и толерантности клеток Teff посредством делеции и анергии. В модели трансплантации аллогенных островков BALB/c→B6 инъекции спленоцитов (Ag-SP) фиксированного ECDI донора (BALB/c) на день -7 и день +1 (относительно трансплантации островков BALB/c на день 0) у реципиентов B6 приводят к неопределенно долгой выживаемости аллотрансплантата островков.20 Инъекции Ag-SP приводят к значительной экспансии Tregs CD4+Foxp3+ в селезенке, дренирующих лимфатических узлах (dLNs) и трансплантированном аллотрансплантате реципиентов (Фиг. 10A). Соответственно, толерантность, индуцированная Ag-SP, зависит от экспансии Tregs с помощью Ag-SP, поскольку истощение Tregs на момент инъекций Ag-SP полностью аннулирует его эффективность толерантности.20 Экспансия Treg с помощью Ag-SP недавно была подтверждена на модели аллотрансплантации островков нечеловекообразных приматов нашей собственной работой (неопубликованные данные) и опубликованным данным других ученых.24 Сопутствующие экспансии Treg, клетки Teff лишаются иммуногенности двумя различными механизмами: (1) удаление Т-клеток с косвенной специфичностью; и (2) анергия Т-клеток с прямой специфичностью.23 Как показано на Фиг. 10В, в селезенке и dLNs Т-клетки с непрямой донорной специфичностью (исследуемые путем адоптивного переноса трансгенных Т-клеток TEa TCR46) подвергаются устойчивой первичной пролиферации (день -4), за которым следует быстрое сокращение и истощение (день 0, день 7), так что немногие такие Т-клетки инфильтруются в аллотрансплантаты островков ко дню 7. Напротив, как показано на Фиг. 10С, Т-клетки с прямой донорной специфичностью (исследуемые путем адаптивного переноса трансгенных Т-клеток 4C TCR47) подвергаются значительно сниженной пролиферации до первой инъекции Ag-SP, по сравнению с их пролиферацией до инъекции необработанного SP BALB/c. Что еще более важно, остальные 4C Т-клетки больше не реагируют на стимуляцию донора, что проявляется в отсутствии ответа на вторую инъекцию ECDI-SP (правые точечные диаграммы), что указывает на то, что они эффективно анергизированы. В совокупности эти данные свидетельствуют о том, что Ag-SP устойчиво увеличивает Tregs при удалении и/или анергизации Teffs.
При Ag-SP-толерантности индукция Treg и миграция в место воспаления зависят от экспансии миелоидных супрессорных клеток (MDSCs). Инъекции Ag-SP приводят к значительным экспансиям двух миелоидных популяций в селезенке (Фиг. 11A) и месте прививки (данные не показаны): клетки CD11b+Ly6CHIGr1INT (называемые клетками Ly6CHI) и клетки CD11b+Ly6CLOGr1HI (называемые клетками Gr1HI). Эти две клеточные популяции обладают фенотипическим сходством с миелоидными супрессорными клетками (MDSCs) и подавляют пролиферацию Т-клеток in vitro.29,48 Важно отметить, что при совместном культивировании с Т-клетками при стимуляции anti-CD3/CD28, аллотрансплантаты клеток Ly6CHI и Gr1HI способны индуцировать значительное продуцирование IL-10 и CCL4, двух растворимых медиаторов, участвующих в индукции и хоуминге клеток Treg (Фиг. 11B). Обеспечивая данную возможность, аллотрансплантаты, пересаженные от доноров реципиентам, получавшим Ag-SP, показывают прогрессирующее увеличение клеток Foxp3+ по сравнению с теми, которые от контрольных реципиентов (Фиг. 11C). Следовательно, истощение MDSCs Ly6CHI и Gr1HI эффективно отменяет индукцию толерантности с помощью Ag-SP.29,48 В совокупности эти данные показывают, что экспансия MDSCs является критическим шагом, опосредующим индукцию Treg и миграцию, индуцированную Ag-SP.
Экспансия Ly6CHI и Gr1HI MDSCs с помощью Ag-SP зависит от рецепторной тирозинкиназы Mer. Когда мы отслеживали инъецируемые Ag-SP in vivo, мы обнаружили, что они сохраняются в селезеночной маргинальной зоне и поглощаются фагоцитами в данной области.23 Поскольку семейство рецепторов тирозинкиназы (RTK) TAM (Tyro 3, Axl, Mer) вовлечены в гомеостатический клиренс апоптотических клеток, сначала мы исследовали, участвуют ли они в толерантности, индуцированной Ag-SP. Как показано на Фиг. 12А, экспрессия Mer индуцируется инъекциями Ag-SP, прежде всего в двух селезеночных популяциях MF, экспрессирующих лектины клеточной поверхности: металлофильные MFs CD169+ переходной зоны и MFs CD209+ маргинальной зоны. Чтобы определить, играет ли роль индукция Mer в популяциях фагоцитов в толерантности, индуцированной Ag-SP, мы воспользовались мышами Mer-/-. Как показано на Фиг. 12В, экспрессия MDSCs Ly6CHI и Gr1HI, индуцированных Ag-SP, значительно снижается у мышей Mer-/-.
Экспансия MDSCs Ly6CHI и Gr1HI с помощью Ag-SP зависит от рецепторной тирозинкиназы Mer. Когда мы отслеживали инъецируемые Ag-SP in vivo, мы обнаружили, что они сохраняются в селезеночной маргинальной зоне и поглощаются фагоцитами в данной области.23 Поскольку семейство рецепторов тирозинкиназы (RTK) TAM (Tyro 3, Axl, Mer) вовлечены в гомеостатический клиренс апоптотических клеток, сначала мы исследовали, участвуют ли они в толерантности, индуцированной Ag-SP. Как показано на Фиг. 12А, экспрессия Mer индуцируется инъекциями Ag-SP, прежде всего в двух селезеночных популяциях MF, экспрессирующих лектины клеточной поверхности: металлофильные MFs CD169+ переходной зоны и MFs CD209+ маргинальной зоны. Чтобы определить, играет ли роль индукция Mer в популяциях фагоцитов в толерантности, индуцированной Ag-SP, мы воспользовались мышами Mer-/-. Как показано на Фиг. 12В, экспрессия MDSCs Ly6CHI и Gr1HI, индуцированных Ag-SP, значительно снижается при индукции ингибирующих моноцитов мышей Mer-/- и экспансии клеток Treg.34,35,37,41
Наночастицы (NPs) могут использоваться для доставки толерогенного антигена (Ag-NP). Надеясь таким образом упростить и стандартизировать доставку антигена, мы и другие ученые пытались использовать PLG NPs в качестве носителя антигена.25-27,49 Как показано на Фиг. 13A, мы изготовили PLG NPs с размерами и характеристиками заряда, и связанными донорными антигенами (Ag) в форме донорного (BALB/c) лизата спленоцитов с использованием вышеуказанного ECDI-связывающего химического вещества и вводили Ag-NP реципиентам B6 на день -7 и день +1, относительно трансплантации островков BALB/c на день 0. Как показано на Фиг. 13B, инъекции только Ag-NP (группа «PLG-dAg») приводили лишь к защите маргинального трансплантата. В связи с этим, хотя использование Ag-NP может значительно повысить возможность клинической реализации данного подхода к толерантности, эффективность толерантности с помощью Ag-NP менее устойчива по сравнению с использованием Ag-SP.25 Мы предполагаем, что это связано с отсутствием на Ag-NP критических клеточных поверхностных углеводных и белковых лигандов, что приводит к нарушенной толерогенной сигнализации во взаимодействующих фагоцитах.
Скрининг с высокой пропускной способностью демонстрирует, что углеводы могут модулировать репертуар продуцирования цитокинов макрофагов. В поддержку нашей ключевой концепции о том, что фиксированные ECDI NPs не имеют сигналов для индукции толерогенных сигналов, мы изучили способность модулировать цитокиновые ответы в линии клеток макрофагов (RAW264,7). Эта клеточная линия ранее использовалась для прогнозирования клеточных ответов на антиген для толерантности. Используя подход на основе 384-луночного анализа с высокой пропускной способностью (HTS), посредством которого клетки стимулируются для экспрессии как IL-6, так и IL-10 путем добавления LPS, фиксированные ECDI SP приводят к значительному увеличению продуцирования IL-10 (Фиг. 1) и пониженному IL-6 (не показано). В абсолютном контрасте, обработанные ECDI NPs были неэффективны и фактически понижали продуцирование IL-10 клетками RAW264,7 по сравнению с контролем (Фиг. 1). Используя данный подход HTS, мы исследовали широкий диапазон потенциальных сигналов, которые могут обеспечиваться клетками, но не NPs, и сфокусировались на группе как природных, так и синтетических углеводных структур из-за их способности модулировать репертуар продуцирования цитокинов MFs. Основываясь на одновременном усилении IL-10 и подавлении продуцирования IL-6, мы успешно идентифицировали несколько подобных перспективных углеводных кандидатов, включая антиген ЛьюисаХ (LewisX) (Фиг. 3A). Кроме того, в предварительных экспериментах прикрепления фукозы было достаточно для повышения поглощения NP клетками и содействия смещенному ответу IL-10 (Фиг. 5).
Дезамидирование проинсулина Q→E вызывает устойчивый иммунный ответ у людей и мышей. Сначала мы синтезировали рекомбинантный проинсулин человека или мышиный проинсулин 1 и белки проинсулина 2 со всеми их остатками глутамина (Q), мутированными в остатки глутамата (E), и использовали данные проинсулиновые белки Q→E для исследования сыворотки крови группы из 30 взрослых пациентов с известным T1D (Фиг. 14А) и 33 молодых самок мышей NOD, начиная с 3-недельного возраста (Фиг. 14B). Как показано на Фиг. 14А, у четырех из 30 взрослых пациентов с Т1D был гуморальный иммунный ответ на дезамидированный проинсулин, но не на нативный (WT) проинсулин. Аналогично, как показано в верхней группе Фиг. 14B, отдельные мыши NOD развивали гуморальный иммунный ответ на дезамидированный проинсулин, но не на проинсулин WT (показан пример гуморального иммунного ответа на дезамидированный мышиный проинсулин 1, но ответ на дезамидированный мышиный проинсулин 2 или на оба также наблюдался). Важно отметить, что у мышей NOD гуморальный ответ на дезамидированный проинсулин с высокой степенью коррелирует с частотой развития диабета (нижняя группа Фиг. 14B). Эта прогнозирующая корреляция в настоящее время также оценивается в педиатрических группах, подверженных риску развития Т1D. Весьма любопытен тот факт, что клонирование от гибридом, собранных у мышей NOD с положительным гуморальным ответом на дезамидированный проинсулин и изучение пептидных массивов, как показано на Фиг. 14C, позволило нам отобразить гуморальную реактивность на единственный дезамидированный остаток глутамина в C-пептиде: пятно Y19, 20, 22 коррелируется с последовательностью GGGPGAGDLET (SEQ ID NO:4).
Схема проведения и методы исследования
Цель 1. Разработать LNFPIII- и GAS6-декорированные NPs
Цель 1А. Разработка и изготовление LNFPIII-GAS6-NP. Сначала мы изготовим наночастицы сополимера лактида с гликолидом (1:1)) (PLG) диаметром примерно 500 нм с использованием одностадийного эмульсионного метода, описанного ранее Bryant et al.25 Поверхность наночастиц будет частично гидролизована 0,05 или 0,1 М NaOH для увеличения плотности карбоксильных групп, доступных для функционализации поверхности частиц и связывания антигенов. Модификация будет контролироваться путем измерения дзета-потенциала NP, а также количественного определения содержания карбоксила с использованием толуидинового синего.50 Карбоксильные группы на NPs будут активированы с использованием химического вещества карбодиимида (ECDI) и подвергаться взаимодействию с (гидразидом N-малеимидопропионовой кислоты (BMPH), чтобы обеспечить малеимидные группы на поверхности NPs, которые являются реакционноспособными по отношению к тиоловым группам, используемым в клик-химии.51 Лиганды LNFPIII и GAS6 будут дериватизированы цистеином для обеспечения тиоловой группы, которая обеспечит их ковалентную связь с функционализованными малеимидами NPs. LNFPIII-Cys будет синтезироваться посредством восстановительного аминирования между LNFPIII и Cys.52 GAS6 с терминальным Cys будет синтезироваться с использованием технологии рекомбинантной ДНК с использованием His6-метки в клетках HEK 293T и изолирован с помощью аффинной хроматографии с использованием сфер Ni-NTA с последующей очисткой на ионообменной колонне HiTrap Q FF (GE Healthcare), как описано выше.36
Как LNFPIII-Cys, так и GAS6-Cys будут присоединены к PLG-NPs с помощью клик-химии.51 Если ожидаемые результаты не будут получены с использованием клик-химии, как определено с помощью анализа MF RAW264,7 (подробно описанного ниже в Цели 1B), альтернативно PLG NPs будут функционализированы стрептавидином с помощью химического вещества карбодиимида. Затем стрептавидин-PLG NPs будут подвергаться взаимодействию с биотинилированными LNFPIII и GAS6. Эффективность связывания лигандов будет определяться путем количественного определения белка и углевода в супернатантах до и после реакции связывания. Кроме того, белок и углевод на поверхности NPs будут обнаружены с помощью меченых антител, которые являются специфическими для GAS6 и LNFPIII.
Если активация с использованием PLG-платформы является субоптимальной, как определено с помощью анализа MF RAW264,7 (подробно описанного в Цели 1B ниже), мы будем исследовать использование поли(полиэтиленгликольцитрат-со-N-изопропилакриламида) (PPCN) в виде платформы доставки. PPCN представляет собой термореактивную биодеградируемую макромолекулу, разработанную, как было показано, биосовместимой и способной медленно доставлять белки.53 Эта макромолекула имеет высокую плотность карбоксильных групп, которые могут функционализироваться и могут легко образовывать NPs с диаметром приблизительно 200-300 нм при очень мягких условиях. Лиганды могут быть конъюгированы с PPCN с использованием той же клик-химии, описанной выше для PLG NPs. Потенциальным преимуществом использования PPCN является проявление значительно более высокой плотности лигандов на поверхности NPs из-за прямой конъюгации макромолекулы с лигандами и образования NPs посредством самосборки лиганд-функционализированной PPCN.
Цель 1B. Скрининг LNFPIII-GAS6-NP с помощью цитокиновой модуляции в MFs RAW264,7. LNFPIII-GAS6-NP, разработанный как в Цели 1A, будет исследован с использованием системы со-культивирования с клеточной линией макрофагов RAW264,7, как показано на Фиг. 2. Мы прогнозируем, что LNFPIII-GAS6-NP с различными параметрами (способы конъюгации (клик-химия против биотин-стрептавидина), полимерные материалы (PLG против PPCN)) будут последовательно изготавливаться и, следовательно, будут проверяться на чередующейся основе. Каждый тип LNFPIII-GAS6-NP будет со-культивироваться с MF RAW264,7 в присутствии LPS-стимуляции (MFs+LNFPIII-GAS6-NP+LPS) в течение 72 ч. Полученные супернатанты будут измеряться на IL-10 и IL-6 с помощью ELISA. Контрольные со-культуры будут включать: (1) только MFs; (2) MFs+LPS; (3) MFs+немодифицированная NP; (4) MFs+немодифицированная NP+LPS; и (5) MFs+LNFPIII-GAS6-NP. Отношение IL-10/IL-6 контрольного состояния № 2 будет считаться исходным уровнем. Отношение IL-10/IL-6 выше исходного уровня будет считаться скринированным «положительно»; тогда как отношение ниже исходного уровня будет считаться скринированным «отрицательно». Для обеспечения поддержки результатов, полученных от клеточной линии MF RAW264,7, скринированные «положительные» типы LNFPIII-GAS6-NP также будут подтверждены с использованием первичных MFs, полученных из мышиного костного мозга, в подобной системе со-культивирования.
Цель 1C. Загрузка антигена для скрининга «положительной» LNFPIII-GAS6-NP. Мы загрузим три возможных β-клеточных антигена для экспериментов, предложенных в Цели 2: дезамидированный проинсулиновый пептид «GGGPGAGDLETLALE (SEQ ID NO:2)» (Фиг. 14C), дезамидированный цельный проинсулин или цельный лизат клеток MIN6 (β-клеточная линия). Мы проверим два метода загрузки антигена для скрининга «положительных» типов LNFPIII-GAS6-NP. Первый метод будет связывать пептидные/белковые антигены с поверхностью наночастиц с использованием химического вещества ECDI, как мы описывали ранее.25 Количество пептидов/белков, связанных с частицами, будет определяться путем количественного определения антигенов в супернатантах до и после реакции связывания. Если либо эффективность связывания, либо их взаимодействие с MFs RAW264,7 являются субоптимальными, мы также проверим, будет ли более эффективна инкапсуляция антигенов внутри частиц. Частицы PLG, сформированные с инкапсулированными пептидами, эффективны в моделях аутоиммунного энцефалита.54 Антигены будут инкапсулированы в частицы PLG или PPCN посредством двустадийного эмульсионного метода, который направлен на создание частиц с таким же диаметром и зарядом, что и одностадийный эмульсионный метод (500 нм, ζ потенциал =-60 мВ). Полимерные композиции и средние молекулярные массы (как охарактеризовано характеристической вязкостью) будут опробованы для инкапсуляции, так как эти свойства будут влиять на стабильность NPs, поэтому влияют как на интернализацию клеток, так и на высвобождение инкапсулированных антигенов.55 Распределение размеров частиц и дзета-потенциал будут измеряться с помощью анализатора «Zetasizer». Количество пептидов/белков, инкапсулированных внутри частиц, будет количественно определяться путем растворения нагруженных антигеном NPs в DMSO для последующего анализа с помощью метода CBQCA.56
Ожидаемый результат, возможные недостатки и альтернативные подходы. Мы ожидаем, что конъюгирование LNFPIII и GAS6 с NPs значительно повысит их толерогенное взаимодействие с MFs и приведет к желательному соотношению продуцирования IL-10/IL-6. Мы ожидаем, что при различных способах конъюгации (клик-химия против биотин-стрептавидина), полимерных материалах (PLG против PPCN), методов загрузки антигена (сшивание против инкапсуляции), выборе β-клеточных антигенов (проинсулиновый пептид против цельного лизата β-клеток), мы будем генерировать библиотеку типов Ag-LNFPIII-GAS6-NP со спектром соотношения продуцирования MF IL-10/IL-6. Лучшие типы будут выбраны для экспериментов, предложенных в Цели 2. Если субоптимальное соотношение продуцирования IL-10/IL-6 наблюдается без всяких исключений со всеми вариациями, еще одна разработка заключается в усилении сигнализации GAS6 путем связывания фосфатидилсерина (PS) с GLA-доменом GAS6.32 Это может быть достигнуто путем введения PS в частицы PLG или PPCN с помощью эмульсионного метода с добавлением PS при массовом соотношении 1:10 (PS:полимер).57 PS имеет основную группу карбоновой кислоты и алкильные «хвосты», поэтому обладают функциональными группами как для включения в полимерные частицы, так и для загрузки антигена через ECDI-связывание или инкапсуляцию.
Цель 2. Проверить эффективность толерантности INS (Q→E)-LNFPIII-GAS6-NP в мышиной модели NOD
Цель 2A: Профилактика и лечение диабета в NOD с помощью толерогенных вакцин INS (Q→E) -LNFPIII-GAS6-NP. Мышиные модели. Мы будем использовать две модели NOD. В первой модели (модель «профилактика») мы будем рассматривать две возрастные группы: самки NOD-мышей 5-нед и 9-нед. В обеих возрастных группах уже начались воспалительные реакции в поджелудочной железе, что подтверждается наличием провоспалительной инфильтрации иммунных клеток, но уровень глюкозы в крови все еще находится в пределах нормы. Таким образом, они являются пред-диабетическими. Мы применим наилучшую идентифицированную формулу лечения INS(Q→E)-LNFPIII-GAS6-NP (по Цели 1), чтобы определить, можем ли мы предотвратить данных пред-диабетических мышей NOD от диабета. У мышей будут контролировать уровни глюкозы в крови после лечения INS (Q→E)-LNFPIII-GAS6-NP до 30-нед возраста. Во второй модели (модель «лечение») мы будем использовать диабетических (12-30-нед) мышей NOD с острыми осложнениями, которые только что стали гипергликемией, выявляемой дважды в неделю скринингом, начиная с возраста 12 нед. Мы будем применять лечение INS(Q→E)-LNFPIII-GAS6-NP в течение 3-5 д после острого начала гипергликемии. На данном этапе значительная масса β-клеток по-прежнему остается у данных мышей NOD такой, что эффективный контроль аутоиммунности с иммунотерапией может привести к восстановлению функции оставшихся β-клеток и, следовательно, к завершению диабета.58 Мы применим лечение INS(Q→E)-LNFPIII-GAS6-NP для диабетических мышей NOD с острыми осложнениями и определим, можем ли мы завершить диабет у данных мышей. У мышей будут контролировать уровни глюкозы в крови в течение 60 д после лечения INS(Q→E)-LNFPIII-GAS6-NP для определения завершения диабета.
Лечение INS(Q→E)-LNFPIII-GAS6-NP. Типы NP с устойчивым соотношением продуцирования IL-10/IL-6 при со-культивировании с MFs RAW264,7 будут изготовлены в терапевтических количествах для загрузки направленного антигена для in vivo обработки мышей NOD. Вначале мы будем тестировать 15-aa проинсулиновый пептид «GGGPGAGDLETLALE» (SEQ ID NO:2), содержащий критический сайт дезамидирования, идентифицированный как на Фиг. 14C, в качестве нашего направленного антигена. 15-aa INS(Q→E) пептид будет либо прикреплен к поверхности LNFPIII-GAS6-NP (через ECDI-опосредованное сшивание54), либо инкапсулирован в LNFPIII-GAS6-NP. Выбор между сшиванием и инкапсулированием будет определяться на основе эффективности загрузки антигена, как определено в Цели 1C. 3 мг INS(Q→E)-LNFPIII-GAS6-NP будет введено i.v. самкам мышей NOD трех возрастных групп (5-нед, 9-нед или диабетические с острыми осложнениями). Контрольными мышами будут самки мышей NOD в соответствующей возрастной группе, инъецированные LNFPIII-GAS6-NP, загруженными нативным проинсулиновым пептидом («GGGPGAGDLQTLALE» (SEQ ID NO:3)), без загрузки LNFPIII-GAS6-NP или без NPs. Эти контрольные группы позволят нам определить, будет ли: (1) не усиленная LNFPIII-GAS6-NP иметь какой-либо эффект модификации болезни, как это было описано в моделях инфекции ЦНС и сердечной ишемии27; и (2) нацеленный дезамидированный проинсулиновый пептид являться более эффективным, чем нацеленный нативный проинсулиновый пептид. Если экспериментальные группы (обработанные INS(Q→E)-LNFPIII-GAS6-NP) демонстрируют лучший контроль диабета, мы также протестируем, будут ли многократные инъекции эффективной вакцины INS(Q→E)-LNFPIII-GAS6-NP каждые 4 нед иметь дополнительное преимущество для устойчивого контроля за болезнью. Чтобы завершить наши предлагаемые эксперименты в рамках сроков этого гранта (2 года), мы ожидаем, что нам нужно будет провести проверку на основе чередующихся многократных перспективный видов NP по мере их разработки и проверки для представления полученных данных IL-10/IL-6, как указано выше.
Дополнительные аутоантигены должны быть протестированы как толерогенные вакцины LNFPIII-GAS6-NP для T1D. В дополнение к проинсулиновому пептиду «GGGPGAGDLETLALE» (SEQ ID NO:2), возможно, потребуется включить пул из множества аутоантигенов, чтобы достичь эффективной толерантности,22,59 особенно на поздних стадиях заболевания, когда аутоантигенность может распространиться на другие эпитопы. По этой причине, если INS(Q→E)-LNFPIII-GAS6-NP показывает «перелом» болезни, особенно у старых мышей, мы доставим дополнительные возможные аутоантигены с использованием того же носителя LNFPIII-GAS6-NP. Дополнительные возможные аутоантигены, подлежащие тестированию с помощью толерогенной доставки LNFPIII-GAS6-NP, следующие: (a) Дезамидированный цельный инсулин: поскольку было показано, что цельный инсулин в его нативной форме продемонстрировал эффективность в терапии толерантности у мышей NOD16,59, и наш предварительный результат (Фиг. 14B) продемонстрировал усиленный иммунный ответ на дезамидированный цельный проинсулин, мы также проверим дезамидированный цельный инсулин (белки рекомбинантного мышиного проинсулина 1 и проинсулина 2 со всеми их остатками глутамина (Q), мутированными в остатки глутамата (E)) в качестве аутоантигенов, поставляемых LNFPIII-GAS6-NP, чтобы определить, обладает ли такой дезамидированный проинсулин с расширенным объемом эпитопов лучшей эффективностью толерантности по сравнению с таковой только у GGGPGAGDLETLALE (SEQ ID NO:2). (b) цельный лизат β-клеток: Мы будем изготавливать цельный лизат β-клеток из линии инсулиномы MIN6, полученной из трансгенных мышей, экспрессирующих Т-антиген большой SV40 в β-клетках.60 Цельный лизат β-клеток будет либо присоединен к поверхности с помощью сшивания ECDI (как мы ранее делали с лизатом донорных клеток для трансплантационных антигенов25) или инкапсулировали в LNFPIII-GAS6-NP. Выбор между сшиванием и инкапсулированием будет также определен на основе эффективности загрузки антигена, как описано в Цели 1C. β-клеточный лизат-LNFPIII-GAS6-NP будет инъецирован к пред-диабетических и диабетических с острыми осложнениями самок мышей NOD, и мыши будут контролироваться для профилактики диабета и завершения диабета, соответственно.
Экспериментальные выводы. Для группы профилактики диабета (пред-диабетических мышей NOD) уровень глюкозы в крови будет проверяться дважды в неделю после обработки INS(Q→E)-LNFPIII-GAS6-NP до тех пор, пока мыши не достигнут 30-нед возраста. Процент развития диабета мышей будет сравниваться с процентом контрольных групп. Для группы лечения диабета (диабетических мышей NOD) уровни глюкозы в крови будут проверяться дважды в неделю после обработки INS(Q→E)-LNFPIII-GAS6-NP в течение 60 д. Процент мышей, восстанавливающих нормогликемию, будет сравниваться с процентом контрольных групп. По окончании эксперимента мыши NOD будут умерщвлены для обследования размера островков поджелудочной железы, их количества и строения, и инфильтрации воспалительных клеток.
Цель 2B: Определить механизмы защиты толерогенными вакцинами INS (Q→E)-LNFPIII-GAS6-NP. Экспансия MDSCs. Мы рассмотрим влияние вакцин INS(Q→E)-LNFPIII-GAS6-NP на in vivo экспансию MDSCs и Tregs, и ингибирование Teffs. Обработанные и контрольные мыши NOD будут исследованы на экспансию клеток CD11b+Ly6CHIGr1INT (LyCHI)и клеток CD11b+Ly6CLOGr1HI (Gr1HI) в селезенке и поджелудочной железе. Клетки Ly6CHI или Gr1HI, выделенные из селезенки и поджелудочной железы обработанных и контрольных мышей NOD, будут со-культивированы с наивными Т-клетками NOD, стимулированными анти-CD3/CD28 в течение 72 ч. Подавление пролиферации Т-клеток будет определяться дилюцией CFSE. Получение IL-10 и CCL4 в супернатанте культуры будет измеряться с помощью ELISA, как показано на Фиг. 11B, и экспансия Tregs будет определяться путем подсчета клеток Foxp3+ после со-культивирования с Ly6CHI или Gr1HI.
Экспансия аутоантиген-специфических Tregs CD4+Foxp3+. Обработанные и контрольные мыши NOD будут исследоваться для индукции или экспансии антиген-специфических CD4+Foxp3+ Tregs со специфичностью к модифицированному проинсулиновому пептиду «GGGPGAGDLETLALE» (SEQ ID NO:2): (a) DLN поджелудочной железы и селезенка будут исследоваться (с помощью FACS) на общее количество Tregs CD4+Foxp3+ в последовательных временных контрольных точках после лечения INS(Q→E)-LNFPIII-GAS6-NP; (b) очищенные тотальные Т-клетки CD4+ (Tregs и non-Tregs) из DLN поджелудочной железы или селезенки будут стимулироваться пептидом GGGPGAGDLETLALE (SEQ ID NO:2) или нерелевантным OVA-пептидом, или анти-CD3 антителом (стимуляция pan-TCR). Пост-стимуляция, Tregs CD4+Foxp3+ будут подсчитаны, чтобы определить, произошла ли экспансия Tregs антиген-специфическим образом. (c) обогащенные T-клетки CD4+CD25- (non-Tregs) из DLN поджелудочной железы или селезенки будут стимулироваться с помощью того же пептида GGGPGAGDLETLALE (SEQ ID NO:2) или нерелевантного OVA-пептида, или анти-CD3 антитела (стимуляция pan-TCR). После стимуляции T-клетки CD4+Foxp3+ будут подсчитаны, чтобы определить, произошла ли индукция Tregs антиген-специфическим образом.
Ингибирование аутоантиген-специфических эффекторных Т-клеток (Teff). Обработанные и контрольные мыши NOD будут исследоваться на функциональность аутоантиген-специфических клеток Teff следующим образом: (a) DLN поджелудочной железы и селезенка будут исследованы и подсчитаны (с помощью FACS) на CD4 или CD8, IFN-γ, или IL-17 продуцирующие клетки в последовательных временных контрольных точках после лечения INS(Q→E)-LNFPIII-GAS6-NP; (b) обогащенные тотальные Т-клетки CD4+ (Tregs и non-Tregs) из DLN поджелудочной железы или селезенки будут стимулироваться пептидом «GGGPGAGDLETLALE» (SEQ ID NO:2) или нерелевантным OVA-пептидом, или анти-CD3-антителом (стимуляция pan-TCR). Пост-стимуляция, пролиферация Т-клеток будут определяться дилюцией CFSE, и провоспалительные цитокины, полученные из Т-клеток, включая IFN-γ, IL-17 и IL-4, будут определяться с помощью анализа ELISA супернатанта культуры; (c) очищенные T-клетки CD4+CD25- (non-Tregs) из DLN поджелудочной железы или селезенки будут стимулироваться пептидом GGGPGAGDLETLALE (SEQ ID NO:2) или нерелевантным OVA-пептидом, или анти-CD3-антителом (стимуляция pan-TCR). Пост-стимуляция, пролиферации Т-клеток и цитокинов, полученных из Т-клеток, в отсутствие Tregs будет измеряться, чтобы определить, увеличивается ли пролиферация и/или продуцирование воспалительных цитокинов до уровня Т-клеток у необработанных мышей.
Ожидаемый результат, возможные недостатки и альтернативные подходы. Мы ожидаем, что диабет будет предотвращен у пред-диабетических мышей с NOD и будет завершен у диабетических мышей NOD с острыми осложнениями, обработанных вакциной INS(Q→E)-LNFPIII-GAS6-NP. Кроме того, мы ожидаем, что дезамидированный проинсулин или проинсулиновый пептид будет более эффективен при индуцировании толерантности, чем их немодифицированный аналог. Наконец, на поздних стадиях диабета толерантность с использованием более широкого пула антигенов, такого как цельный β-клеточный лизат, может быть более эффективной, чем только одинарная белковая/пептидная вакцина. Защищенные мыши NOD будут демонстрировать сохраненное строение островков и уменьшенный инсулит. Мы также ожидаем, что большее количество Tregs, демонстрирующих специфичность аутоантигена, будет наблюдаться у мышей NOD, обработанных толерогенной вакциной INS(Q→E)-LNFPIII-GAS6-NP. И наоборот, стимулированные аутоантигеном, но не неспецифически анти-CD3-стимулированные, пролиферация эффекторных Т-клеток и продуцирование провоспалительных цитокинов будут ингибироваться у обработанных мышей, и это ингибирование является Treg-зависимым. Мы прогнозируем, что толерогенная вакцина INS(Q→E)-LNFPIII-GAS6-NP перепрограммирует иммунную систему путем дуального индуцирования аутоантиген-специфических Tregs и ингибирования аутоантиген-специфических Teffs. Ожидается, что результаты и знания, полученные в результате вышеупомянутых экспериментальных исследований, предоставят относящиеся к механизмам реакций и практические принципы для перевода нашего подхода в клинические условия для пациентов с T1D. Если вакцины INS(Q→E)-LNFPIII-GAS6-NP демонстрируют перспективную эффективность в контролировании аутоиммунности во время пред-диабетических и диабетических стадий с острыми осложнениями, будущие исследования двухгодичного предлагаемого периода финансирования будут разработаны для дальнейшего изучения: (1) поздних диабетических стадий с использованием модели изогенной трансплантации островков NOD, как мы опубликовали ранее58; (2) индукции перенесенной толерантности путем изучения толерантности Т-клеток с другими антигенными специфичностями (такими как NOD 8,361 (специфичные к IGRP) или NOD BDC2,545 (специфичные для ChgA) Т-клетки) с помощью инсулин-специфического INS(Q→E)-LNFPIII-GAS6-NP. Если вакцины INS(Q→E)-LNFPIII-GAS6-NP демонстрируют только частичную эффективность у мышей NOD, мы рассмотрим комбинаторную терапию, такую как дополнительная низкая доза IL-2 или рапамицин, которые могут еще больше склонить баланс Treg/Teff к регуляции.
Преимущества перед альтернативными подходами, которые будут направлены на достижение наших целей. Текущие антиген-специфические иммунотерапии для T1D содержат в основном только антигены, поэтому обладают ограниченной активностью. Наш подход к доставке β-клеточных нео-аутоантигенов с помощью LNFPIII-GAS6-NP обеспечит направленные толерогенные сигналы фагоцитам хозяина, увеличит популяции эндогенных супрессорных клеток, таких как MDSCs и антиген-специфических Tregs, и в конечном итоге, повысит эффективность толерантности и, тем не менее, сохранит простоту производства вакцины Ag-NP. Кроме того, подход предлагает платформенную технологию, которая имеет потенциал для широкого применения при других аутоиммунных и аллергических состояниях.
Если будет финансироваться наша заявка на грант JDRF, очень вероятно, что представленное исследование приведет к созданию промышленного сотрудничества с фокусом на разработке и лицензировании T1D-терапевтического продукта. В течение первого года предлагаемого периода финансирования мы, вполне вероятно, получим достаточные предварительные данные о производственной и терапевтической эффективности толерогенной вакцины INS(Q→E)-LNFPIII-GAS6-NP для привлечения промышленного партнера.
Перечень ссылочных документов
1. Brorsson CA, Onengut S, Chen WM, et al. Novel Association Between Immune-Mediated Susceptibility Loci and Persistent Autoantibody Positivity in Type 1 Diabetes. Diabetes 2015;64:3017-27.
2. Voltarelli JC, Couri CE, Stracieri AB, et al. Autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus. JAMA: the journal of the American Medical Association 2007;297:1568-76.
3. Moole H, Moole V, Mamidipalli A, et al. Spontaneous complete remission of type 1 diabetes mellitus in an adult - review and case report. J Community Hosp Intern Med Perspect 2015;5:28709.
4. Sakaguchi S. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells in immunological tolerance to self and non-self. Nature immunology 2005;6:345-52.
5. Tan T, Xiang Y, Chang C, Zhou Z. Alteration of regulatory T cells in type 1 diabetes mellitus: a comprehensive review. Clin Rev Allergy Immunol 2014;47:234-43.
6. Pham MN, von Herrath MG, Vela JL. Antigen-Specific Regulatory T Cells and Low Dose of IL-2 in Treatment of Type 1 Diabetes. Frontiers in immunology 2015;6:651.
7. Bluestone JA, Buckner JH, Fitch M, et al. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Science translational medicine 2015;7:315ra189.
8. Tang Q, Henriksen KJ, Bi M, et al. In vitro-expanded antigen-specific regulatory T cells suppress autoimmune diabetes. The Journal of experimental medicine 2004;199:1455-65.
9. Tarbell KV, Yamazaki S, Olson K, Toy P, Steinman RM. CD25+ CD4+ T cells, expanded with dendritic cells presenting a single autoantigenic peptide, suppress autoimmune diabetes. The Journal of experimental medicine 2004;199:1467-77.
10. Bluestone JA, Tang Q. Therapeutic vaccination using CD4+CD25+ antigen-specific regulatory T cells. Proceedings of the National Academy of Sciences of the United States of America 2004;101 Suppl 2:14622-6.
11. Luo X, Herold KC, Miller SD. Immunotherapy of type 1 diabetes: where are we and where should we be going? Immunity 2010;32:488-99.
12. Nakayama M, Abiru N, Moriyama H, et al. Prime role for an insulin epitope in the development of type 1 diabetes in NOD mice. Nature 2005;435:220-3.
13. Kendal AR, Waldmann H. Infectious tolerance: therapeutic potential. Current opinion in immunology 2010;22:560-5.
14. McCarthy DP, Bryant J, Galvin JP, Miller SD, Luo X. Tempering allorecognition to induce transplant tolerance with chemically modified apoptotic donor cells. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2015;15:1475-83.
15. Miller SD, Turley DM, Podojil JR. Antigen-specific tolerance strategies for the prevention and treatment of autoimmune disease. Nature reviews Immunology 2007;7:665-77.
16. Fife BT, Guleria I, Gubbels Bupp M, et al. Insulin-induced remission in new-onset NOD mice is maintained by the PD-1-PD-L1 pathway. The Journal of experimental medicine 2006;203:2737-47.
17. Turley DM, Miller SD. Peripheral tolerance induction using ethylenecarbodiimide-fixed APCs uses both direct and indirect mechanisms of antigen presentation for prevention of experimental autoimmune encephalomyelitis. J Immunol 2007;178:2212-20.
18. Chen G, Sun H, Yang H, et al. The role of anti-non-Gal antibodies in the development of acute humoral xenograft rejection of hDAF transgenic porcine kidneys in baboons receiving anti-Gal antibody neutralization therapy. Transplantation 2006;81:273-83.
19. Smarr CB, Hsu CL, Byrne AJ, Miller SD, Bryce PJ. Antigen-fixed leukocytes tolerize Th2 responses in mouse models of allergy. J Immunol 2011;187:5090-8.
20. Luo X, Pothoven KL, McCarthy D, et al. ECDI-fixed allogeneic splenocytes induce donor-specific tolerance for long-term survival of islet transplants via two distinct mechanisms. Proceedings of the National Academy of Sciences of the United States of America 2008;105:14527-32.
21. Wang S, Tasch J, Kheradmand T, et al. Transient B-cell depletion combined with apoptotic donor splenocytes induces xeno-specific T- and B-cell tolerance to islet xenografts. Diabetes 2013;62:3143-50.
22. Lutterotti A, Yousef S, Sputtek A, et al. Antigen-specific tolerance by autologous myelin Peptide-coupled cells: a phase 1 trial in multiple sclerosis. Science translational medicine 2013;5:188ra75.
23. Kheradmand T, Wang S, Bryant J, et al. Ethylenecarbodiimide-fixed donor splenocyte infusions differentially target direct and indirect pathways of allorecognition for induction of transplant tolerance. J Immunol 2012;189:804-12.
24. Lei J, Kim JI, Shi S, et al. Pilot Study Evaluating Regulatory T Cell-Promoting Immunosuppression and Nonimmunogenic Donor Antigen Delivery in a Nonhuman Primate Islet Allotransplantation Model. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2015;15:2739-49.
25. Bryant J, Hlavaty KA, Zhang X, et al. Nanoparticle delivery of donor antigens for transplant tolerance in allogeneic islet transplantation. Biomaterials 2014;35:8887-94.
26. Getts DR, Martin AJ, McCarthy DP, et al. Microparticles bearing encephalitogenic peptides induce T-cell tolerance and ameliorate experimental autoimmune encephalomyelitis. Nature biotechnology 2013;31:565.
27. Getts DR, Terry RL, Getts MT, et al. Therapeutic inflammatory monocyte modulation using immune-modifying microparticles. Science translational medicine 2014;6:219ra7.
28. Getts DR, McCarthy DP, Miller SD. Exploiting apoptosis for therapeutic tolerance induction. J Immunol 2013;191:5341-6.
29. Chen G, Kheradmand T, Bryant J, et al. Intragraft CD11b(+) IDO(+) cells mediate cardiac allograft tolerance by ECDI-fixed donor splenocyte infusions. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2012;12:2920- 9.
30. Lemke G, Rothlin CV. Immunobiology of the TAM receptors. Nature reviews Immunology 2008;8:327-36.
31. Scott RS, McMahon EJ, Pop SM, et al. Phagocytosis and clearance of apoptotic cells is mediated by MER. Nature 2001;411:207-11.
32. Lemke G, Burstyn-Cohen T. TAM receptors and the clearance of apoptotic cells. Annals of the New York Academy of Sciences 2010;1209:23-9.
33. Lu Q, Lemke G. Homeostatic regulation of the immune system by receptor tyrosine kinases of the Tyro 3 family. Science 2001;293:306-11.
34. Rothlin CV, Ghosh S, Zuniga EI, Oldstone MB, Lemke G. TAM receptors are pleiotropic inhibitors of the innate immune response. Cell 2007;131:1124-36.
35. Zagorska A, Traves PG, Lew ED, Dransfield I, Lemke G. Diversification of TAM receptor tyrosine kinase function. Nature immunology 2014;15:920-8.
36. Bhattacharyya S, Zagorska A, Lew ED, et al. Enveloped viruses disable innate immune responses in dendritic cells by direct activation of TAM receptors. Cell host & microbe 2013;14:136-47.
37. Conde P, Rodriguez M, van der Touw W, et al. DC-SIGN(+) Macrophages Control the Induction of Transplantation Tolerance. Immunity 2015;42:1143-58.
38. Meyer S, van Liempt E, Imberty A, et al. DC-SIGN mediates binding of dendritic cells to authentic pseudo- LewisY glycolipids of Schistosoma mansoni cercariae, the first parasite-specific ligand of DC-SIGN. The Journal of biological chemistry 2005;280:37349-59.
39. Srivastava L, Tundup S, Choi BS, Norberg T, Harn D. Immunomodulatory glycan lacto-N-fucopentaose III requires clathrin-mediated endocytosis to induce alternative activation of antigen-presenting cells. Infection and immunity 2014;82:1891-903.
40. Tundup S, Srivastava L, Norberg T, Watford W, Harn D. A Neoglycoconjugate Containing the Human Milk Sugar LNFPIII Drives Anti-Inflammatory Activation of Antigen Presenting Cells in a CD14 Dependent Pathway. PloS one 2015;10:e0137495.
41. Dutta P, Hullett DA, Roenneburg DA, et al. Lacto-N-fucopentaose III, a pentasaccharide, prolongs heart transplant survival. Transplantation 2010;90:1071-8.
42. Schvartz D, Brunner Y, Coute Y, Foti M, Wollheim CB, Sanchez JC. Improved characterization of the insulin secretory granule proteomes. Journal of proteomics 2012;75:4620-31.
43. Brunner Y, Coute Y, Iezzi M, et al. Proteomics analysis of insulin secretory granules. Molecular & cellular proteomics: MCP 2007;6:1007-17.
44. Hickey AJ, Bradley JW, Skea GL, et al. Proteins associated with immunopurified granules from a model pancreatic islet beta-cell system: proteomic snapshot of an endocrine secretory granule. Journal of proteome research 2009;8:178-86.
45. Stadinski BD, Delong T, Reisdorph N, et al. Chromogranin A is an autoantigen in type 1 diabetes. Nature immunology 2010;11:225-31.
46. Grubin CE, Kovats S, deRoos P, Rudensky AY. Deficient positive selection of CD4 T cells in mice displaying altered repertoires of MHC class II-bound self-peptides. Immunity 1997;7:197-208.
47. Brennan TV, Hoang V, Garrod KR, et al. A new T-cell receptor transgenic model of the CD4+ direct pathway: level of priming determines acute versus chronic rejection. Transplantation 2008;85:247-55.
48. Bryant J, Lerret NM, Wang JJ, et al. Preemptive Donor Apoptotic Cell Infusions Induce IFN-gamma-Producing Myeloid-Derived Suppressor Cells for Cardiac Allograft Protection. J Immunol 2014;192:6092- 101.
49. Hlavaty KA, McCarthy DP, Saito E, Yap WT, Miller SD, Shea LD. Tolerance induction using nanoparticles bearing HY peptides in bone marrow transplantation. Biomaterials 2015;76:1-10.
50. Hoshi RA, Van Lith R, Jen MC, Allen JB, Lapidos KA, Ameer G. The blood and vascular cell compatibility of heparin-modified ePTFE vascular grafts. Biomaterials 2013;34:30-41.
51. Best MD. Click chemistry and bioorthogonal reactions: unprecedented selectivity in the labeling of biological molecules. Biochemistry 2009;48:6571-84.
52. Shang J, Piskarev VE, Xia M, et al. Identifying human milk glycans that inhibit norovirus binding using surface plasmon resonance. Glycobiology 2013;23:1491-8.
53. Yang J, van Lith R, Baler K, Hoshi RA, Ameer GA. A thermoresponsive biodegradable polymer with intrinsic antioxidant properties. Biomacromolecules 2014;15:3942-52.
54. Hunter Z, McCarthy DP, Yap WT, et al. A biodegradable nanoparticle platform for the induction of antigen- specific immune tolerance for treatment of autoimmune disease. ACS nano 2014;8:2148-60.
55. Whittlesey KJ, Shea LD. Delivery systems for small molecule drugs, proteins, and DNA: the neuroscience/biomaterial interface. Experimental neurology 2004;190:1-16.
56. Yap WT, Song WK, Chauhan N, et al. Quantification of particle-conjugated or particleencapsulated peptides on interfering reagent backgrounds. BioTechniques in press.
57. Shin S, Tuinstra HM, Salvay DM, Shea LD. Phosphatidylserine immobilization of lentivirus for localized gene transfer. Biomaterials 2010;31:4353-9.
58. Luo X, Yang H, Kim IS, et al. Systemic transforming growth factor-beta1 gene therapy induces Foxp3+ regulatory cells, restores self-tolerance, and facilitates regeneration of beta cell function in overtly diabetic nonobese diabetic mice. Transplantation 2005;79:1091-6.
59. Prasad S, Kohm AP, McMahon JS, Luo X, Miller SD. Pathogenesis of NOD diabetes is initiated by reactivity to the insulin B chain 9-23 epitope and involves functional epitope spreading. Journal of autoimmunity 2012;39:347-53.
60. Ishihara H, Asano T, Tsukuda K, et al. Pancreatic beta cell line MIN6 exhibits characteristics of glucose metabolism and glucose-stimulated insulin secretion similar to those of normal islets. Diabetologia 1993;36:1139-45.
61. Krishnamurthy B, Mariana L, Gellert SA, et al. Autoimmunity to both proinsulin and IGRP is required for diabetes in nonobese diabetic 8.3 TCR transgenic mice. J Immunol 2008;180:4458-64.
Специалисту в данной области техники будет очевидно, что различные изменения и модификации могут быть внесены в раскрытое в данном документе изобретение без отклонения от объема и сущности изобретения. Изобретение, иллюстративно описанное в данном документе, подходящим образом может быть осуществлено на практике в отсутствие любого элемента или элементов, ограничений или ограничений, которые не описаны здесь конкретно. Используемые термины и выражения применяются как термины описания, но не ограничения, и не существует намерения использовать такие термины и выражения для исключения любых эквивалентов показанных и описанных признаков или их частей, но признается, что в рамках объема изобретения возможны различные модификации. Таким образом, следует понимать, что, хотя настоящее изобретение было проиллюстрировано конкретными вариантами осуществления и необязательными функциями, модификация и/или изменение раскрытых в данном документе концепций могут быть применены специалистами в данной области, и что такие модификации и вариации рассматриваются чтобы быть в рамках объема данного изобретения.
В настоящем документе приводятся цитирования ряда патентных и непатентных ссылок. Цитируемые ссылочные документы включены здесь путем ссылки в полном объеме. В случае несогласованности между определением термина в описании изобретения по сравнению с определением термина в цитируемом ссылочном документе этот термин следует интерпретировать на основе определения в описании изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УСТОЙЧИВОЙ ИММУНОТЕРАПИИ | 2014 |
|
RU2696876C2 |
| ТОЛЕРОГЕННАЯ ДНК-ВАКЦИНА | 2017 |
|
RU2752608C2 |
| НОВЫЕ КОМБИНАЦИИ ДЛЯ АНТИГЕННОЙ ТЕРАПИИ | 2015 |
|
RU2702632C2 |
| НОВЫЕ КОМБИНАЦИИ ДЛЯ АНТИГЕННОЙ ТЕРАПИИ | 2015 |
|
RU2824503C2 |
| ЧАСТИЦЫ, КОНЪЮГИРОВАННЫЕ С ПЕПТИДОМ | 2014 |
|
RU2685186C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ БАКТЕРИИ, СТАБИЛЬНО ЭКСПРЕССИРУЮЩИЕ ИЛ-10 И ИНСУЛИН | 2017 |
|
RU2768027C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОЛОГИЧЕСКИХ МОЛЕКУЛ ДЛЯ ИНДУЦИРОВАНИЯ ТОЛЕРАНТНОСТИ | 2017 |
|
RU2770492C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА 1 ТИПА | 2017 |
|
RU2760997C2 |
| СПОСОБ ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ БИОСОВМЕСТИМЫХ БИОАБСОРБИРУЕМЫХ НАНОСФЕР | 2011 |
|
RU2635537C2 |
| КОМПОЗИЦИИ НАНОЧАСТИЦ ДЛЯ ДЛИТЕЛЬНОЙ ТЕРАПИИ | 2016 |
|
RU2773380C2 |
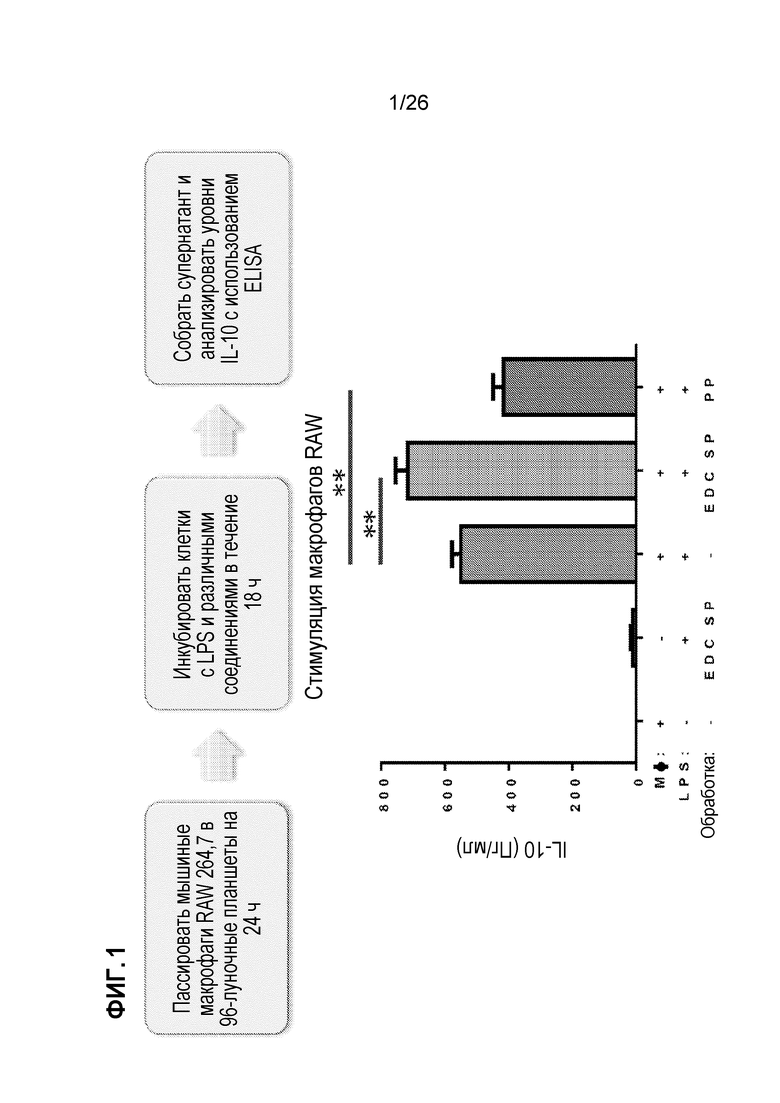
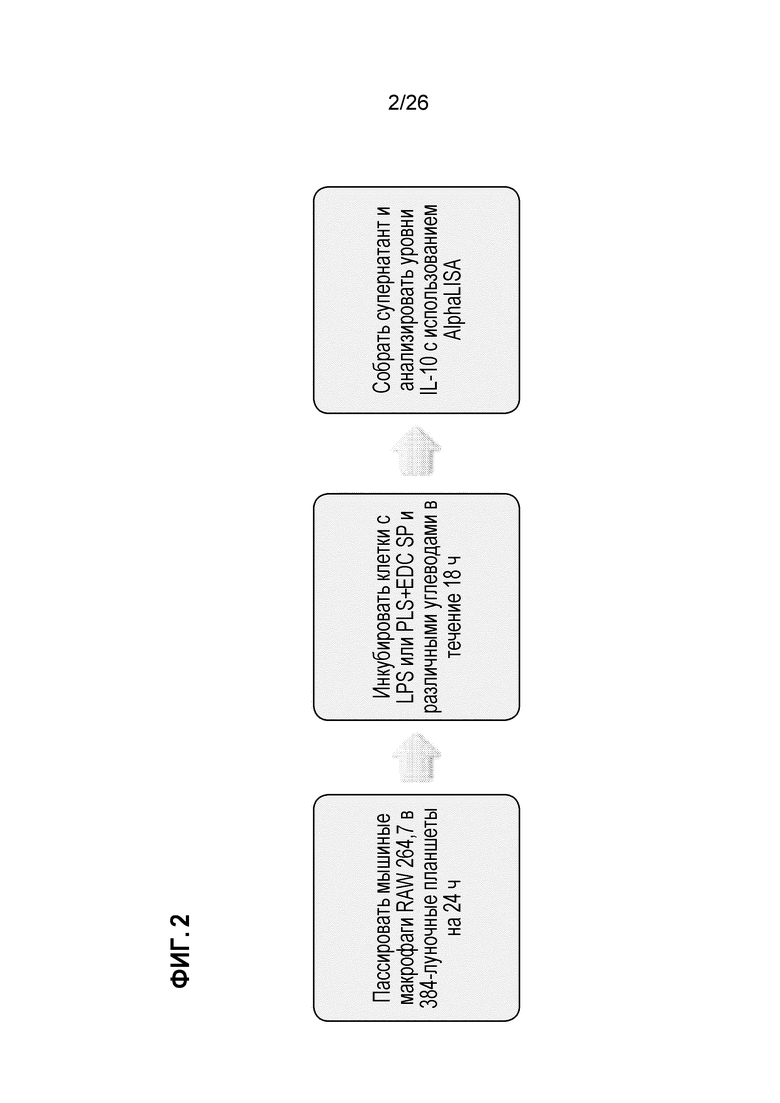


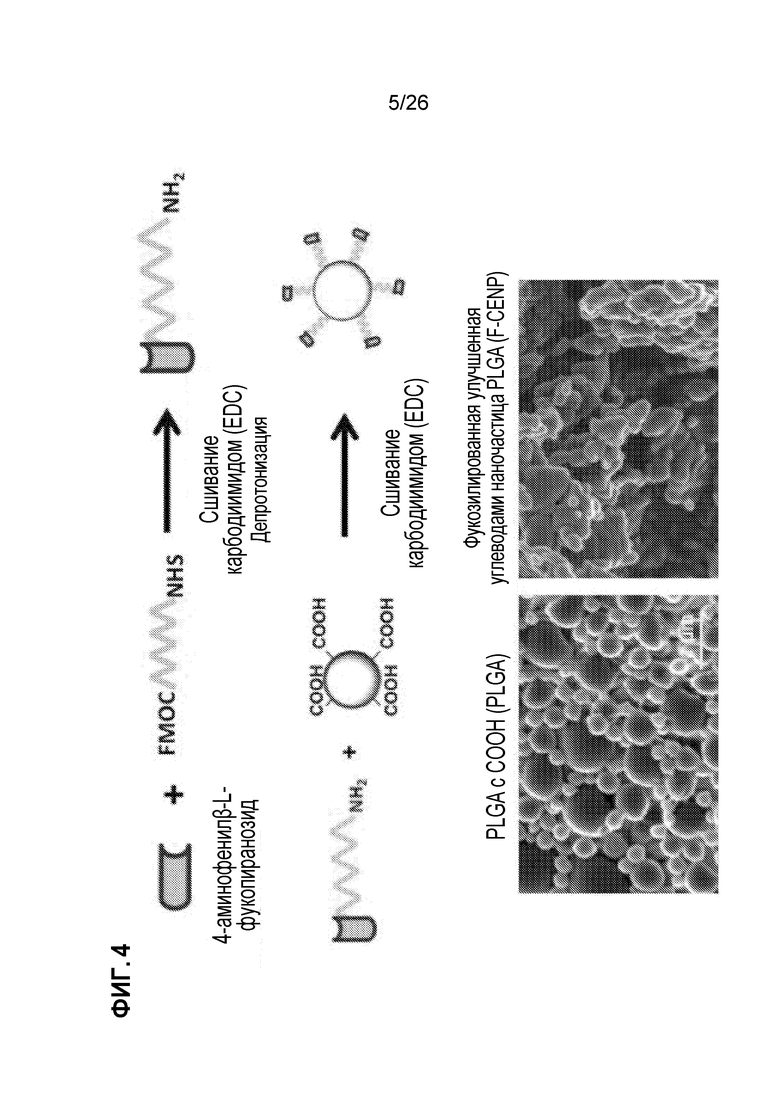
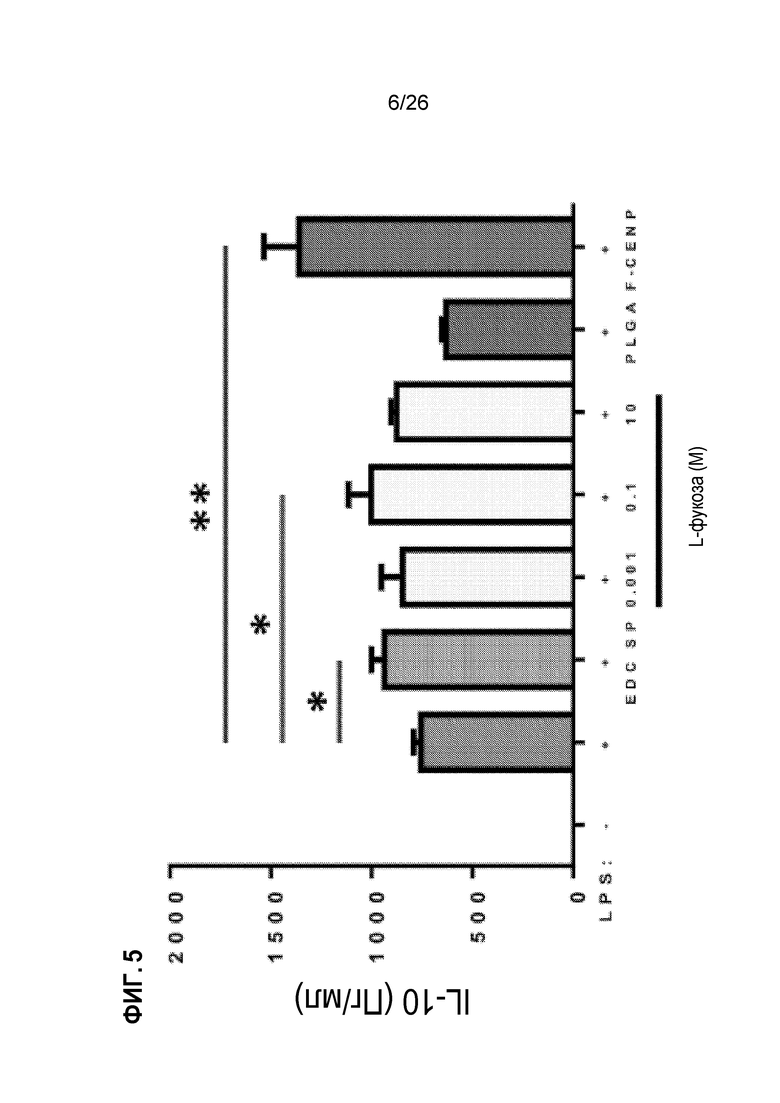
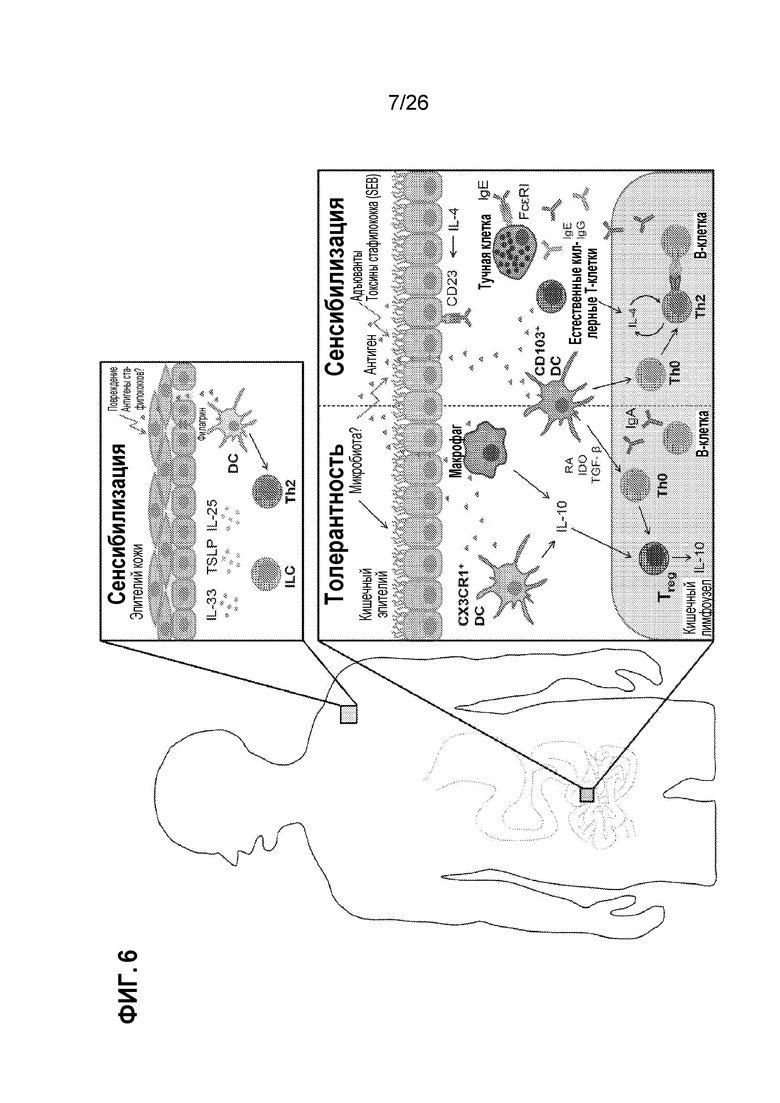
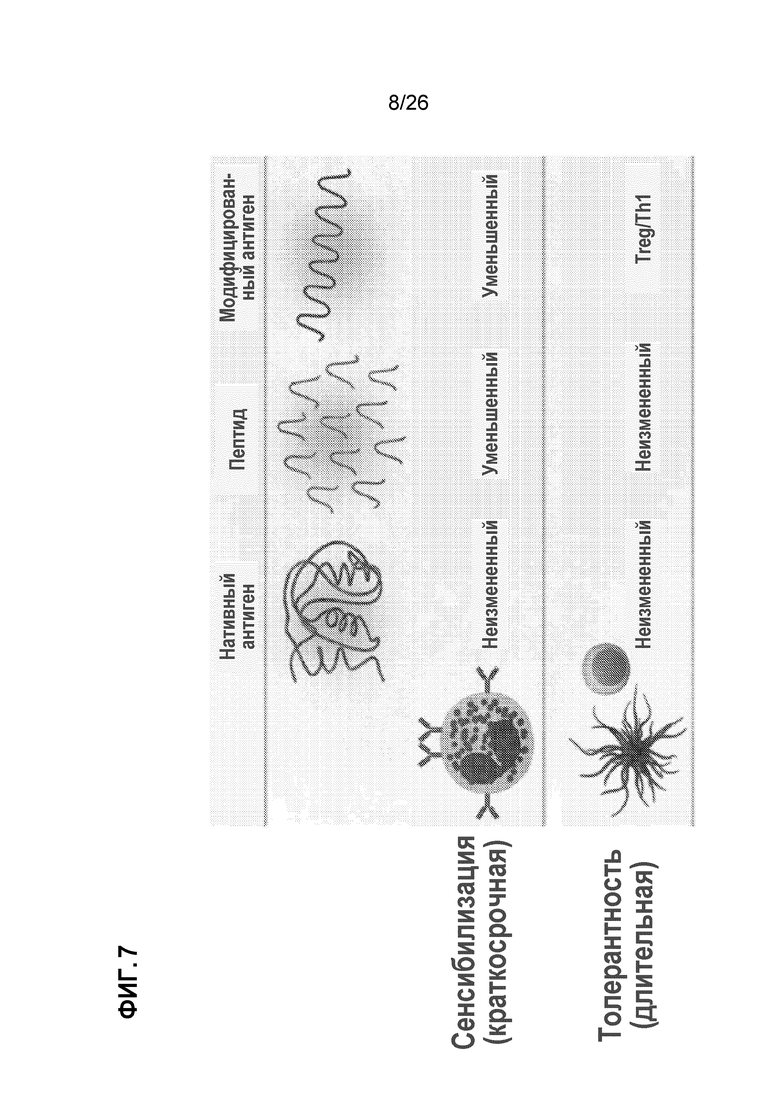
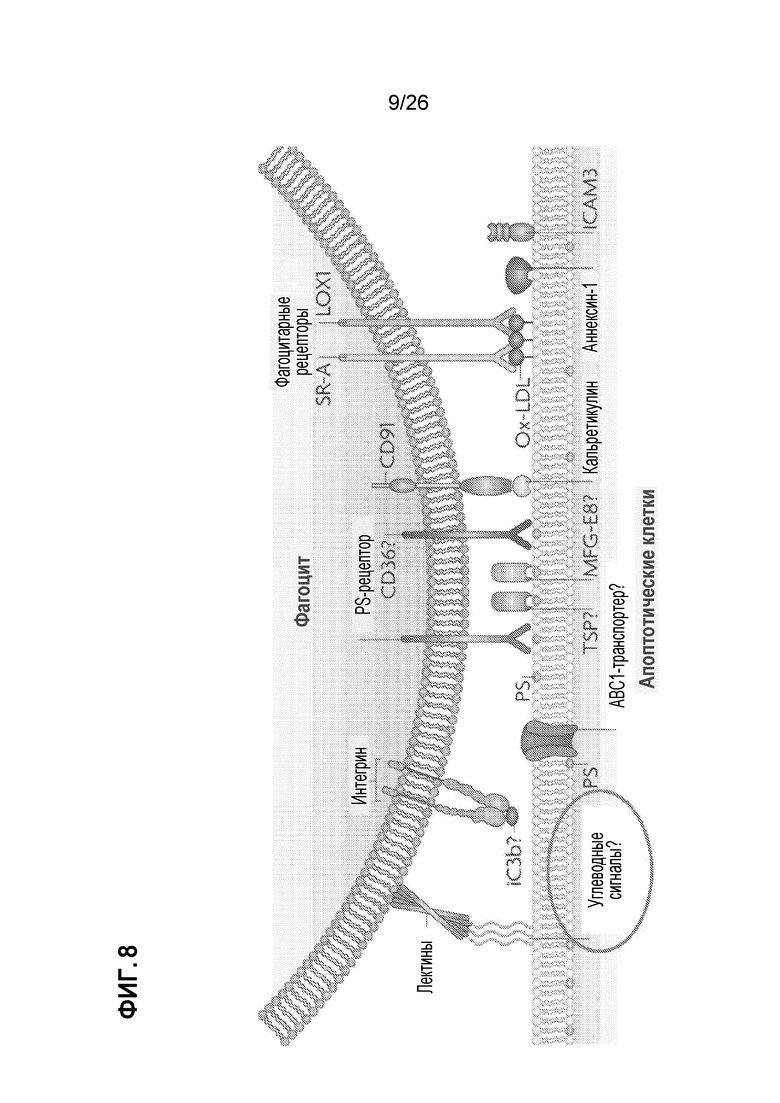
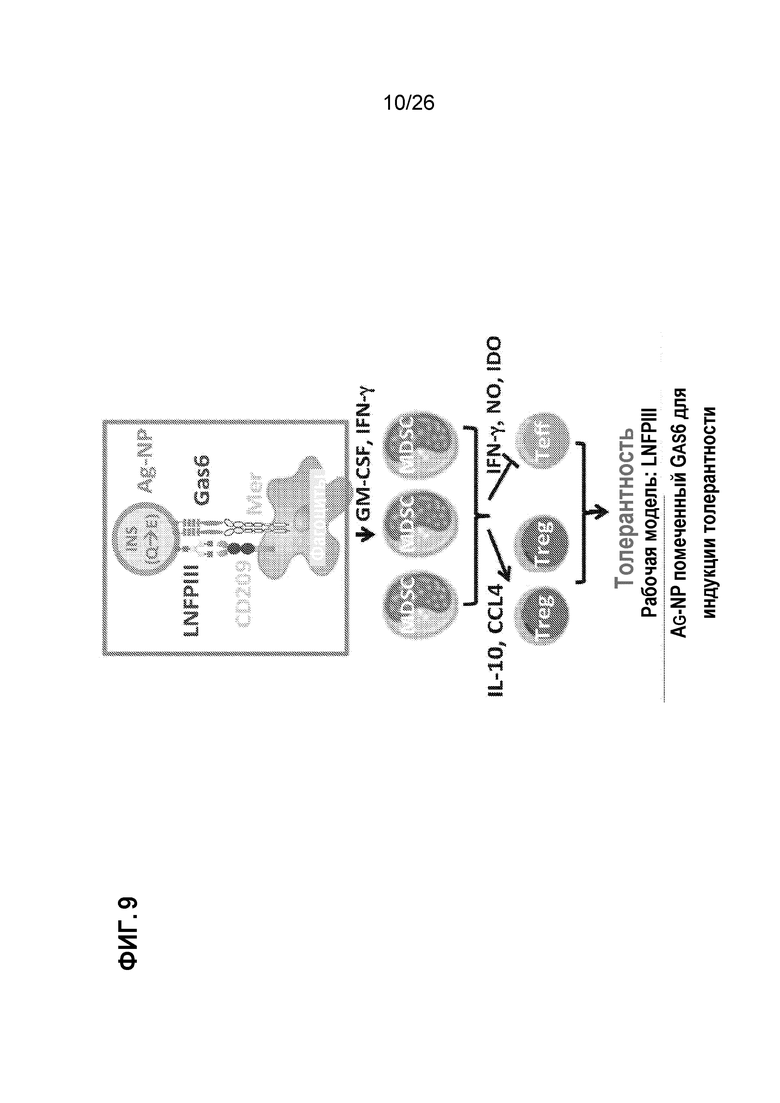
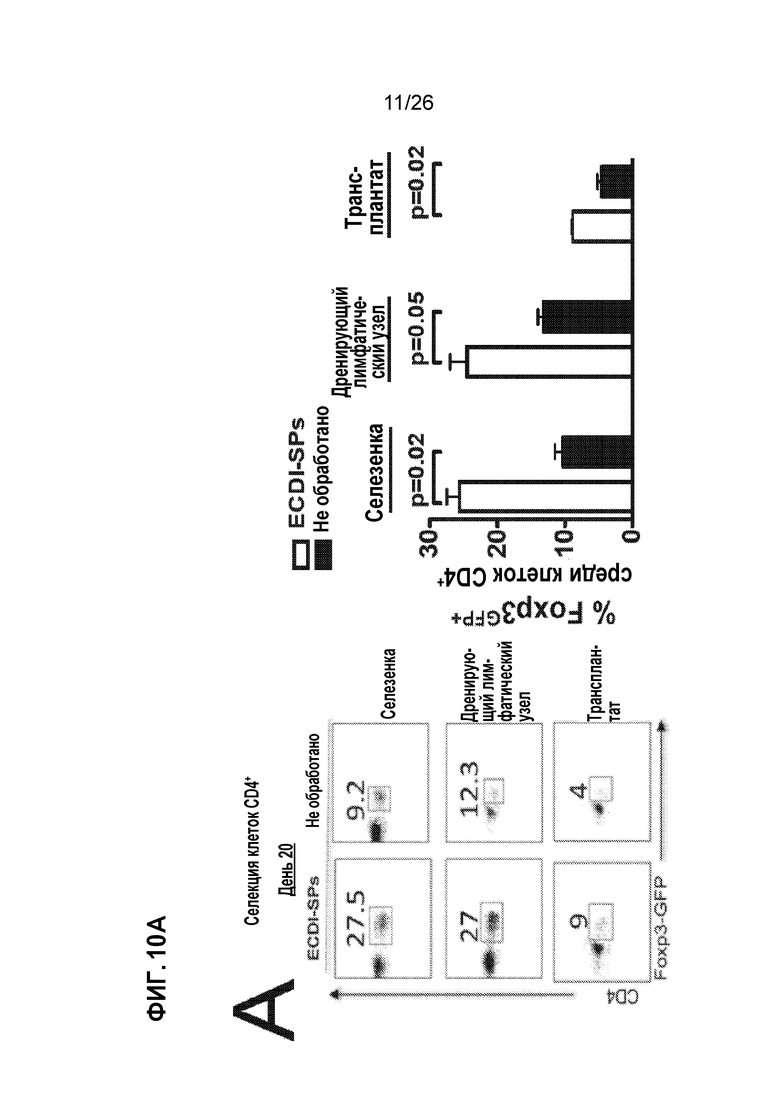
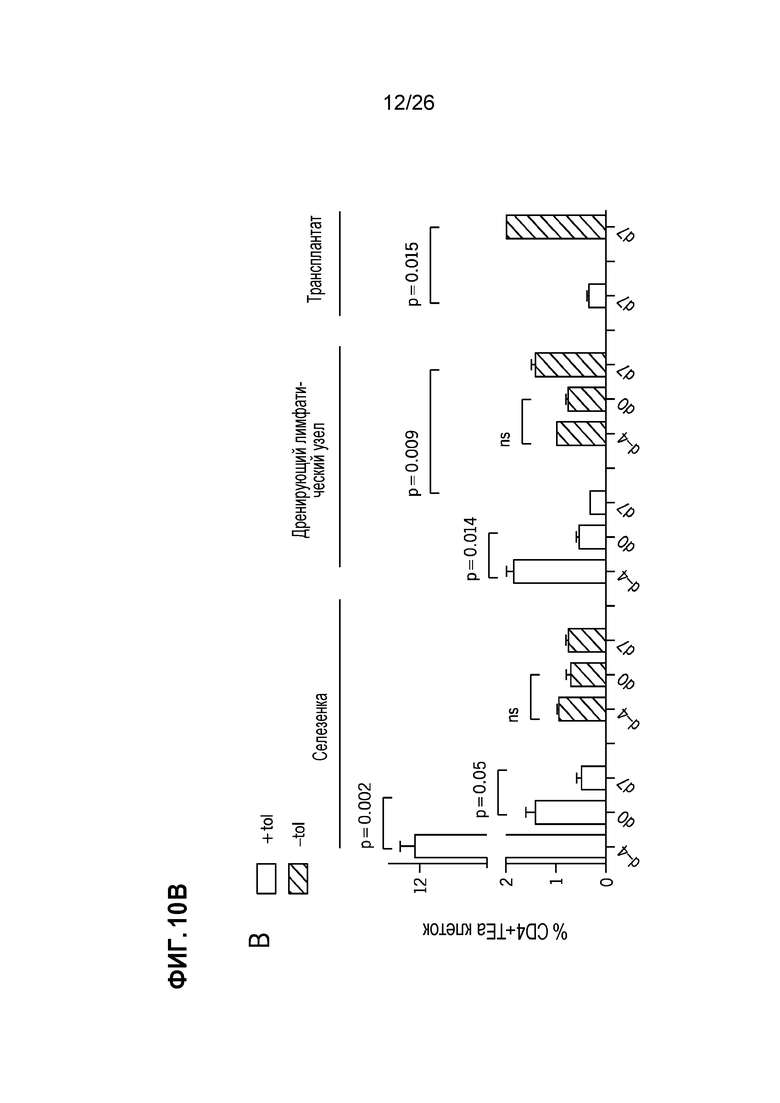
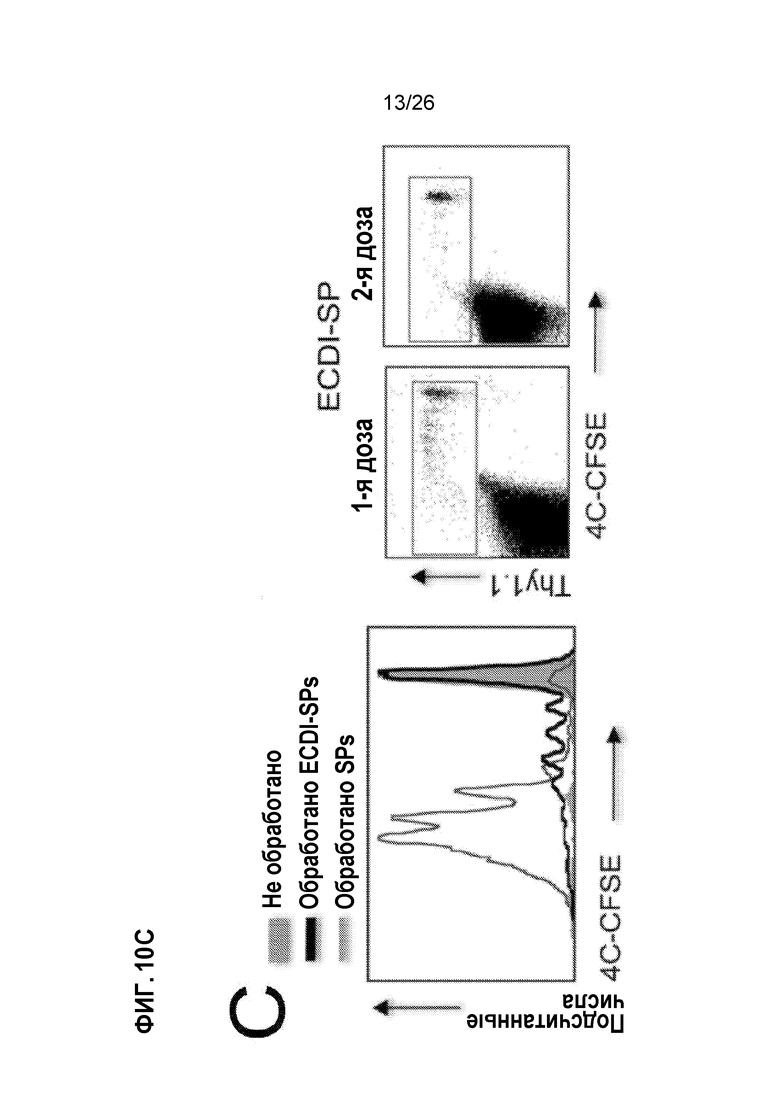
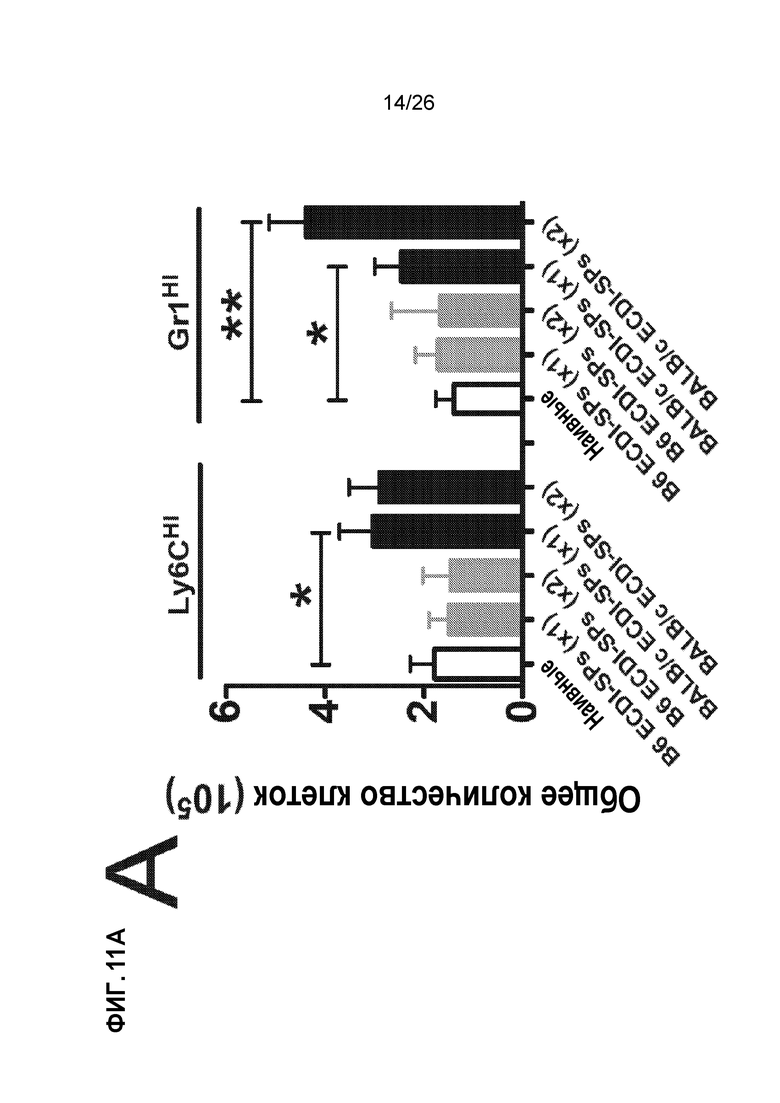
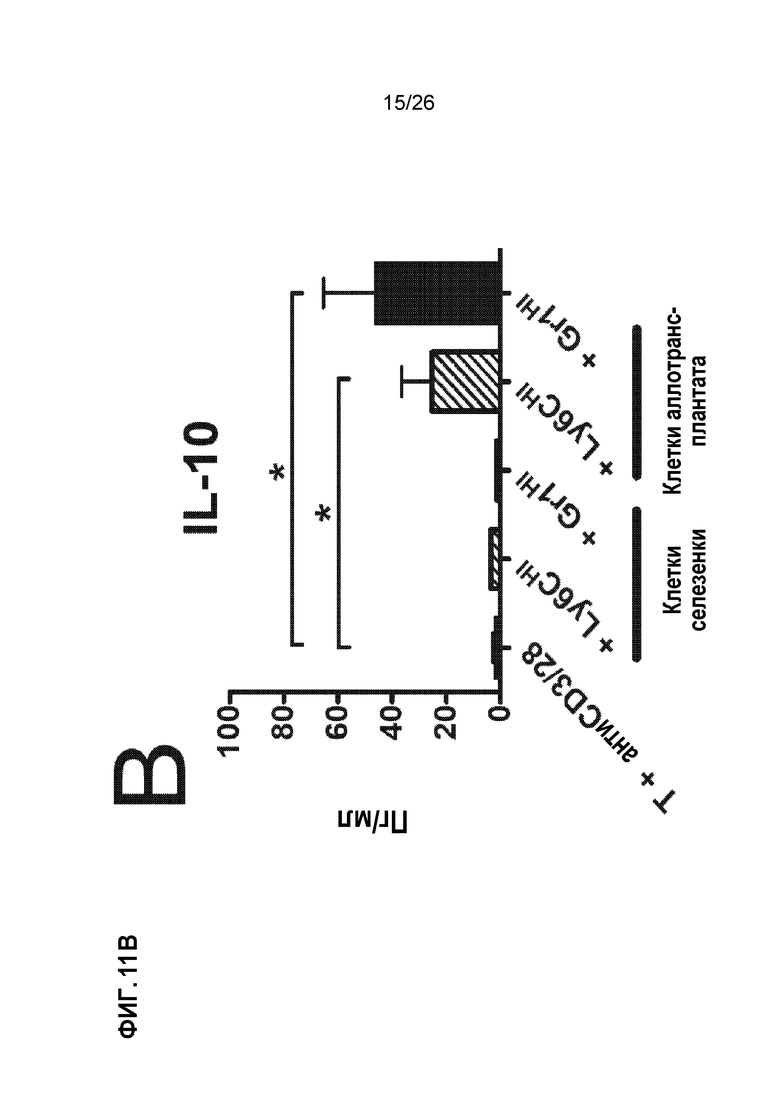
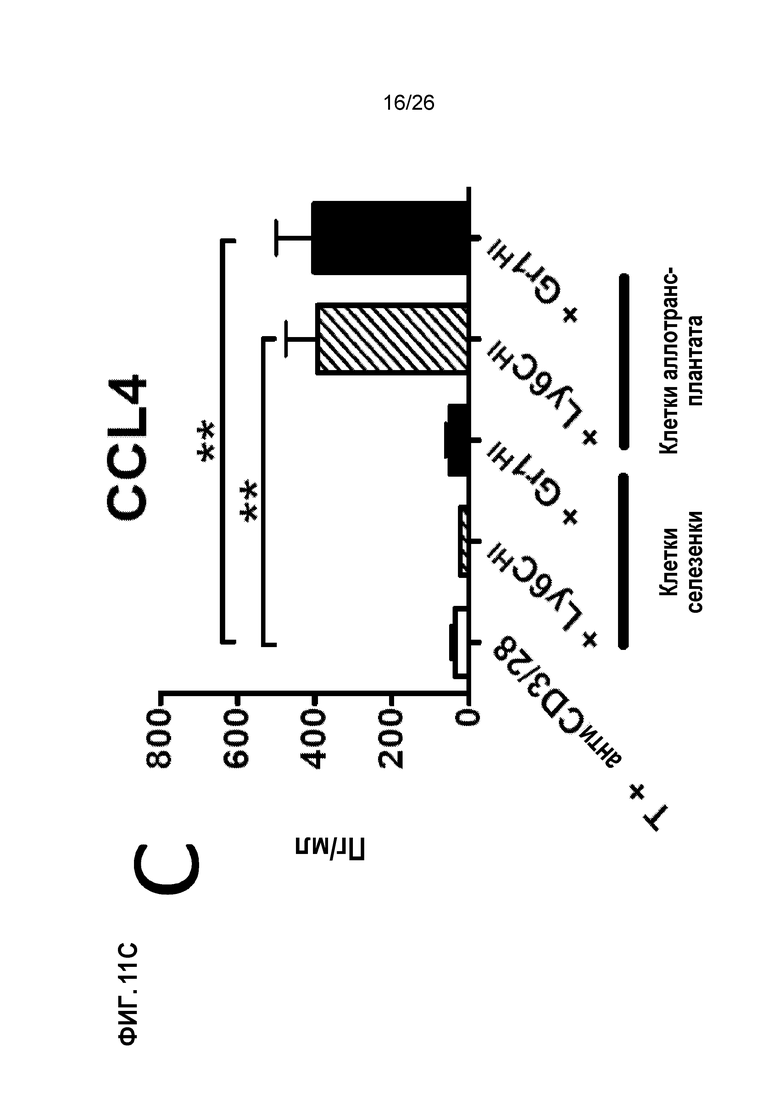
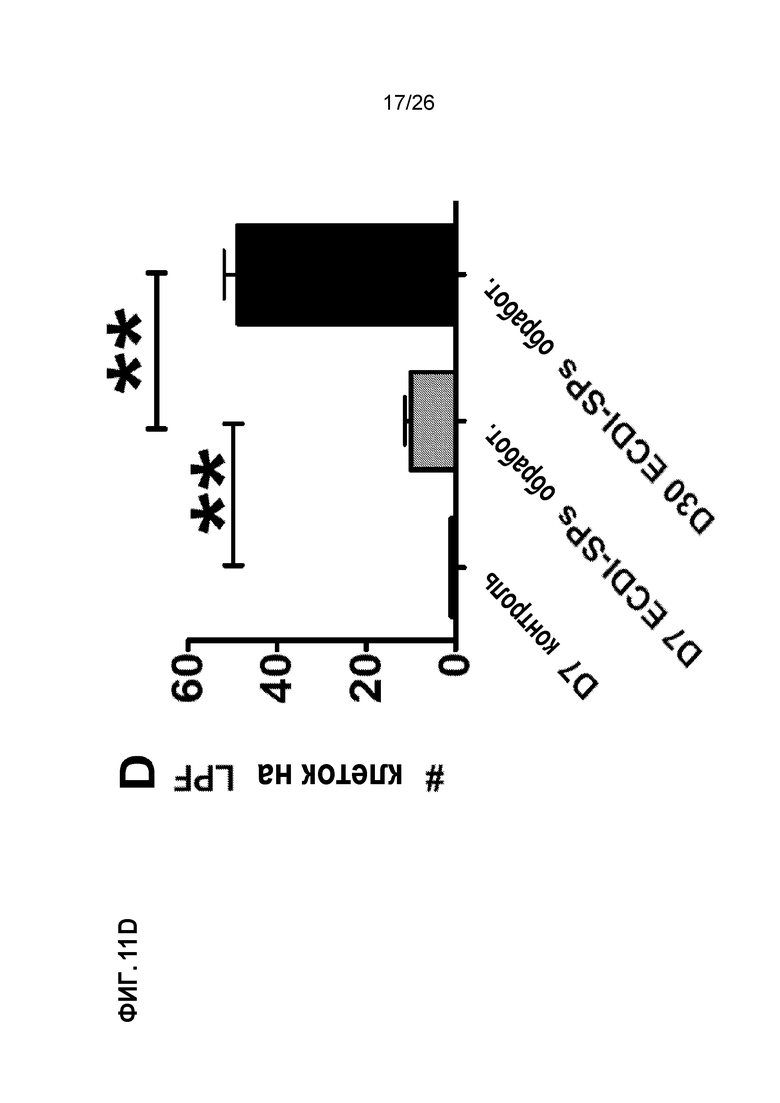
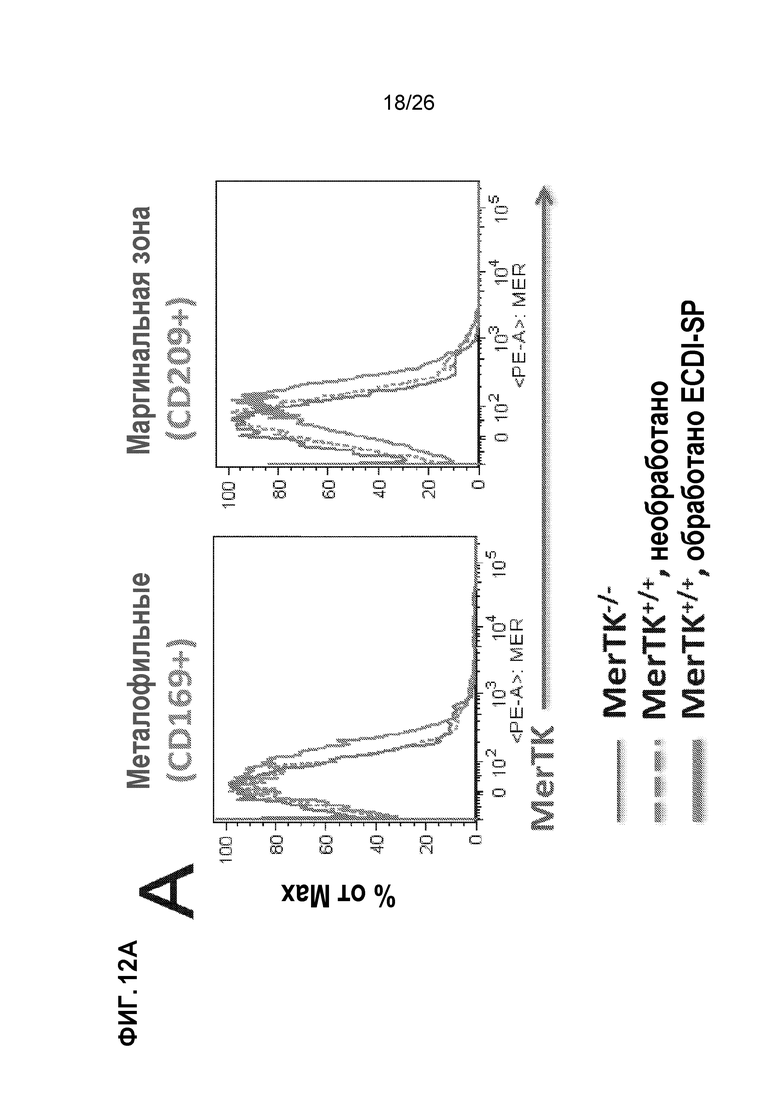
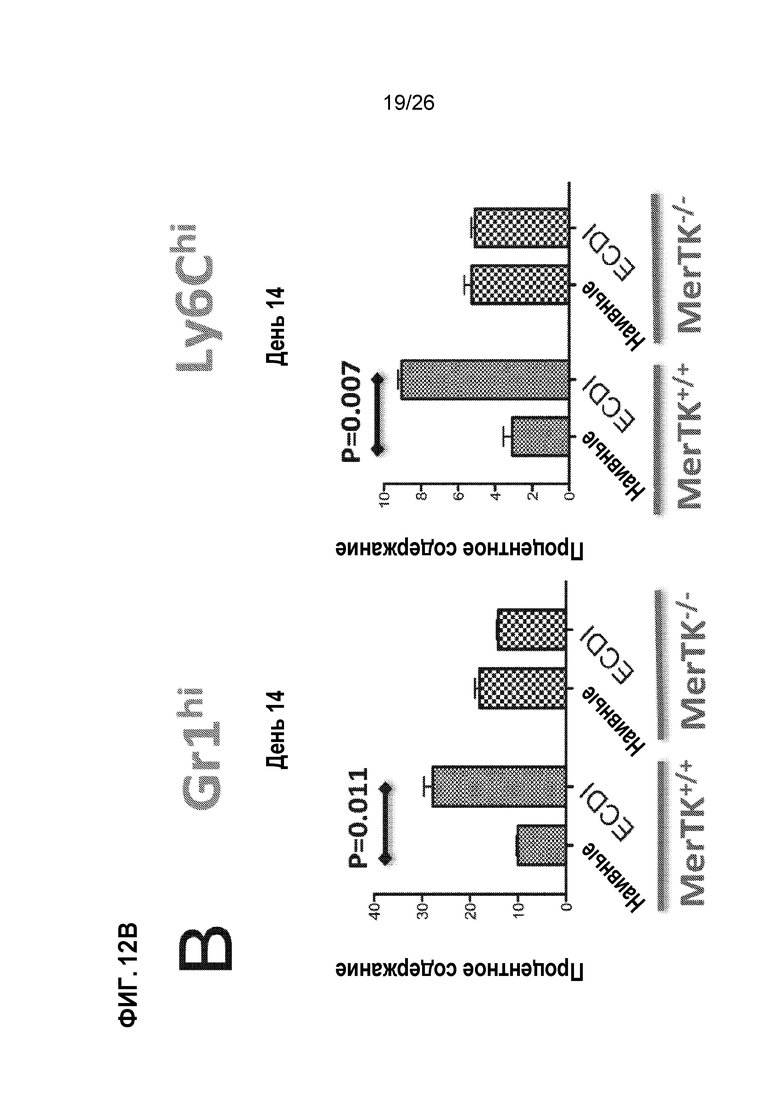
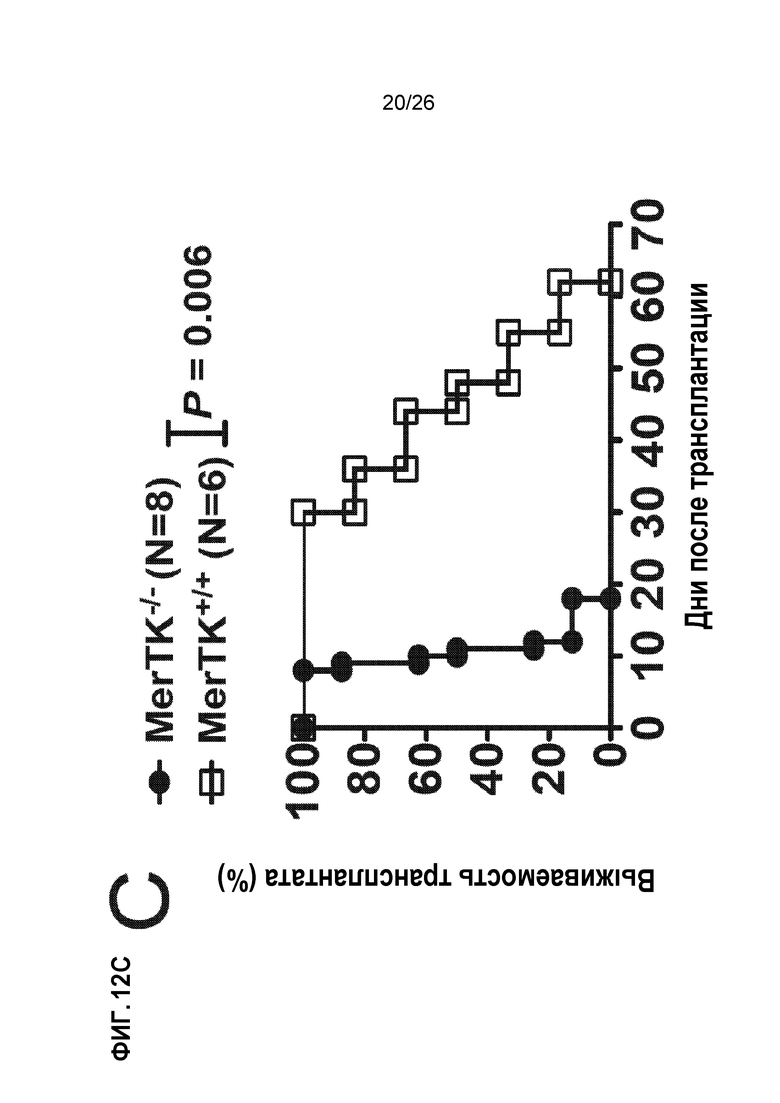
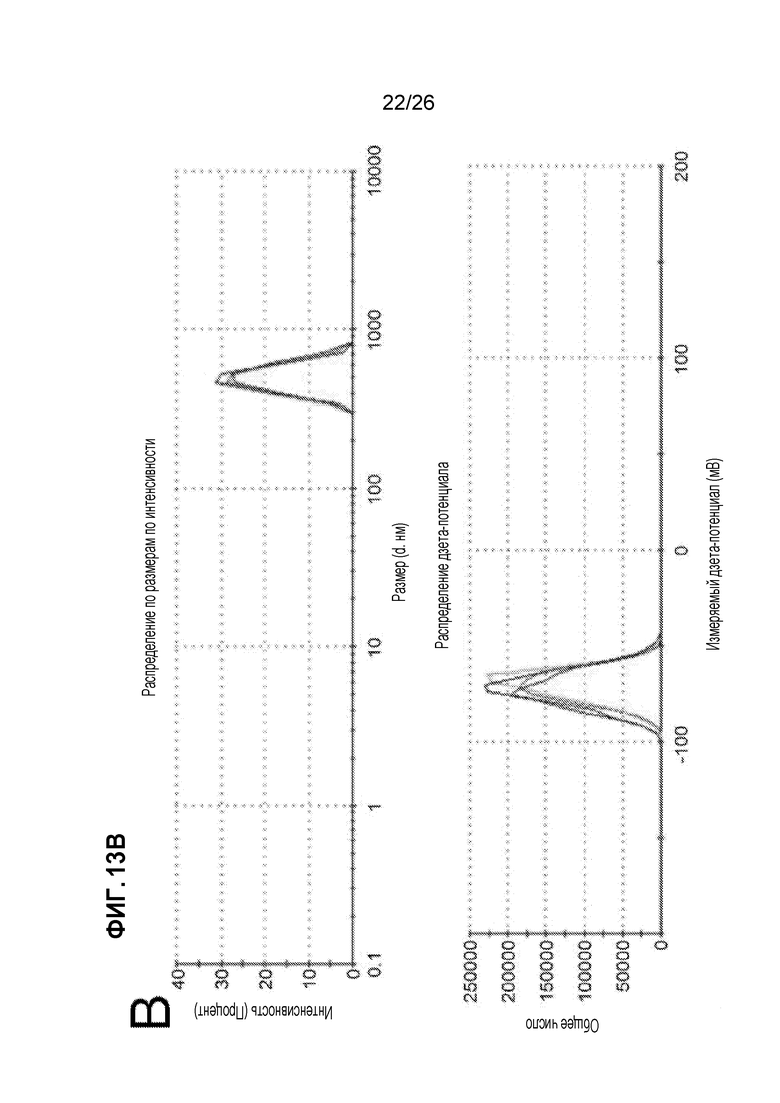
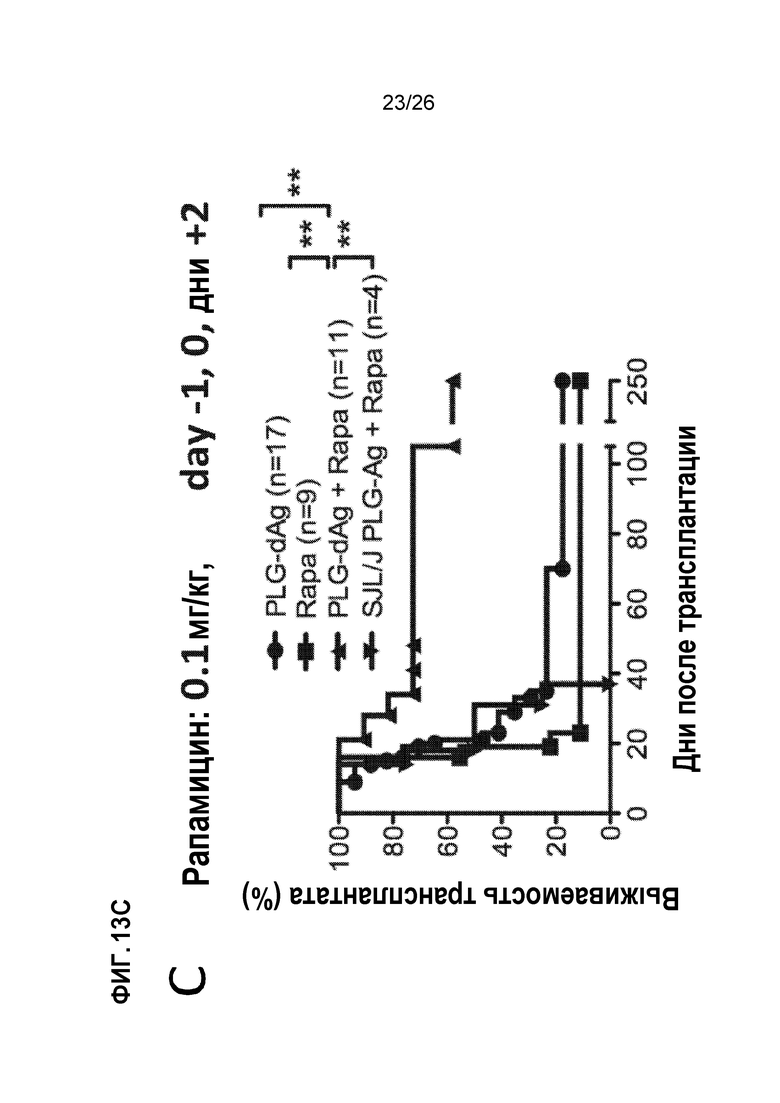
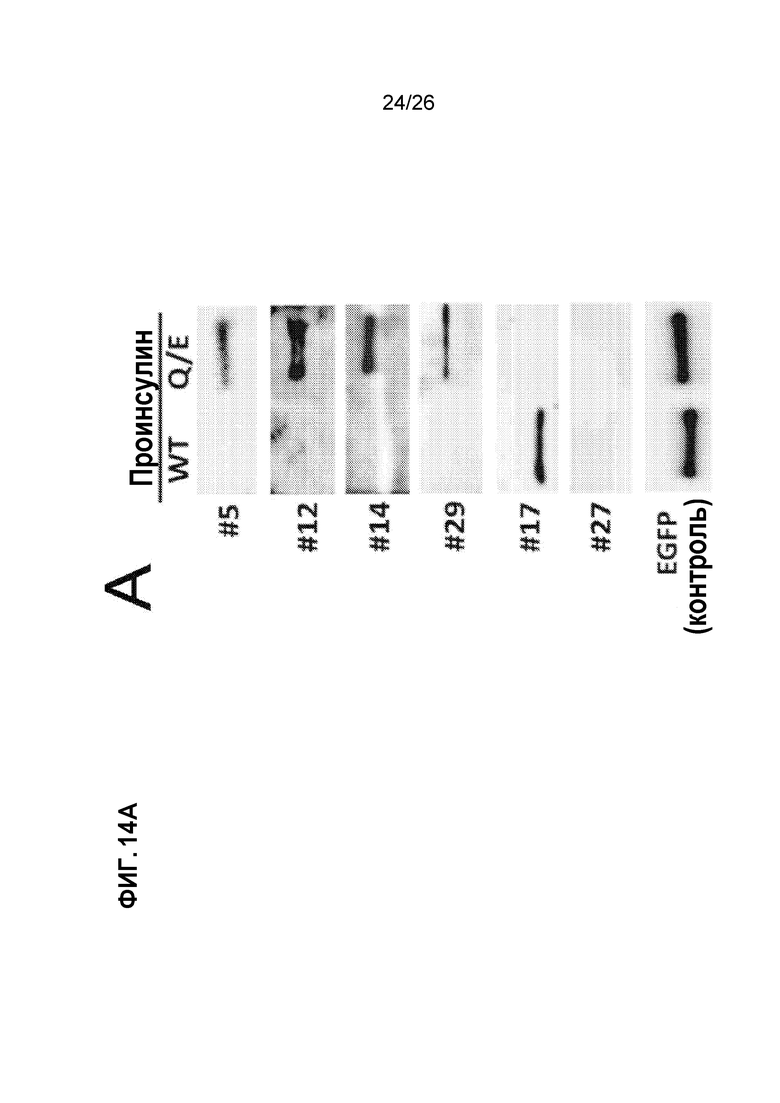
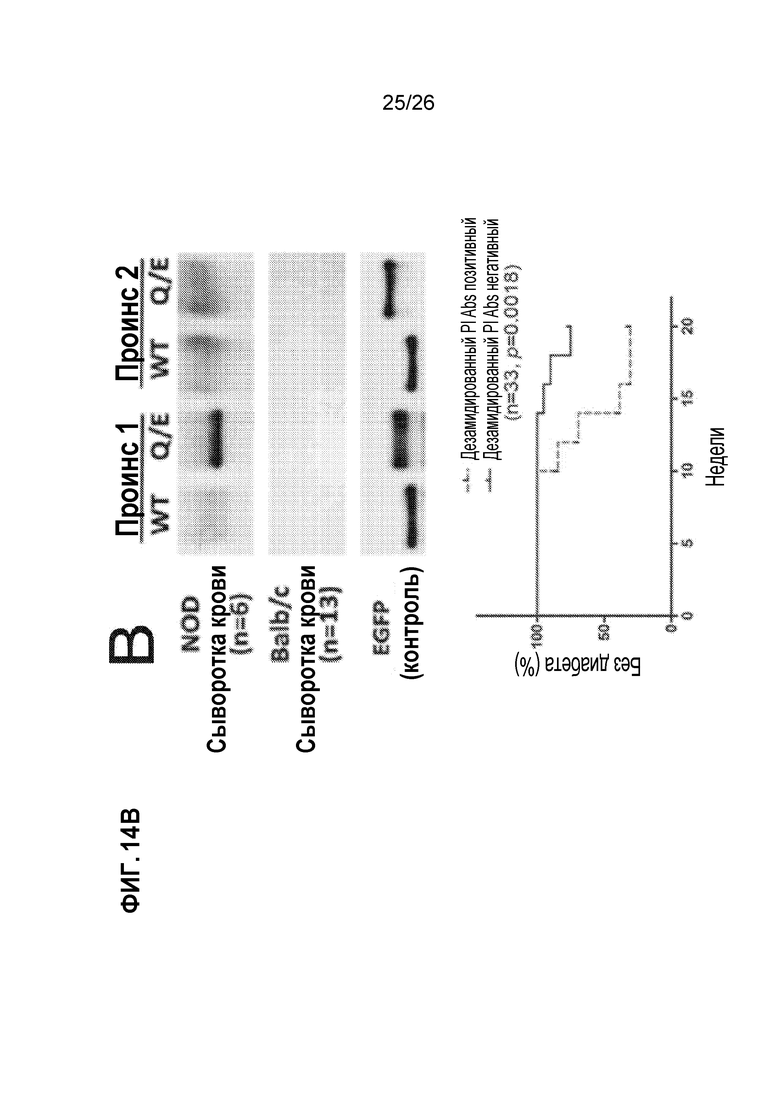
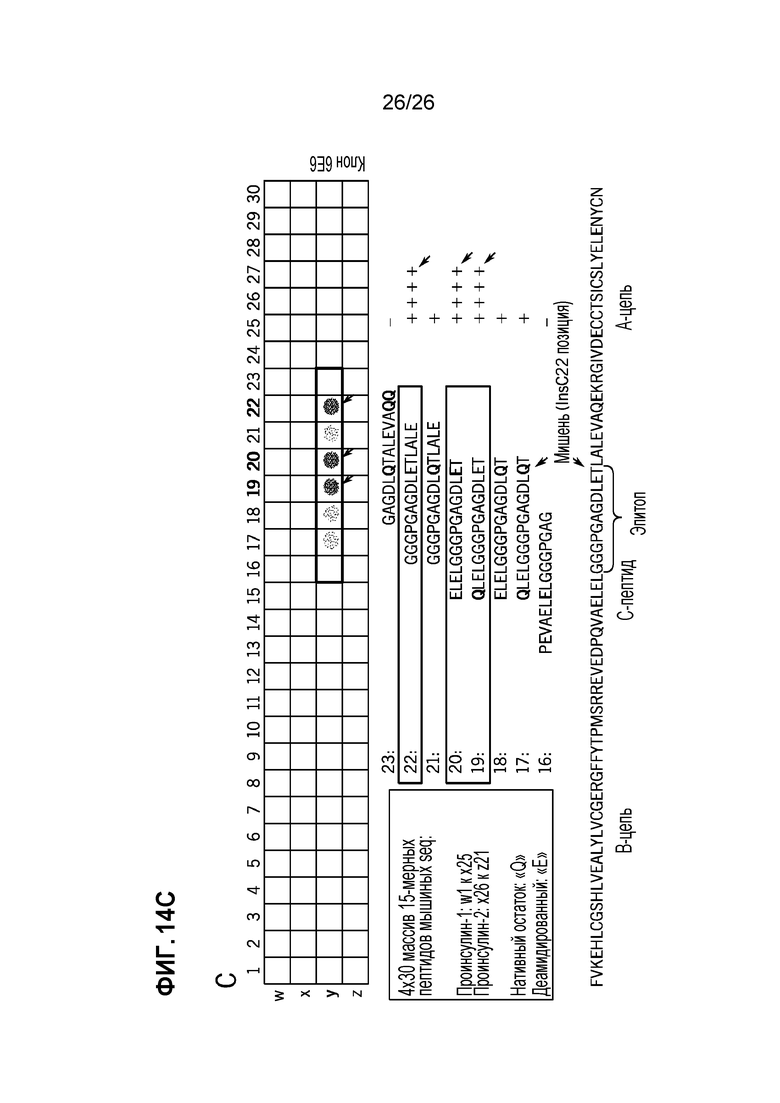
Группа изобретений относится к модуляции иммунного ответа. Модифицированные углеводами частицы инкапсулирующие антиген содержат биодеградируемый полимерный материал, имеющий эффективный средний диаметр 0,01-500 мкм и углеводный фрагмент, который является иммуномодулятором, ковалентно присоединенным к поверхности частиц, где полимерный материал содержит полимолочную кислоту, полигликолевую кислоту или сополимер полимолочной кислоты и полигликолевой кислоты, где частицы вызывают толерантность к антигену, и, углеводный фрагмент выбран из группы, состоящей из гепарина дисахарида II-A, хондроитина дисахарида ΔDi-triS, антигена P1, сиалил-Льюиса A, α1-3-маннобиозы, α-D-N-ацетилгалактозаминил-1-3-галактоза-β1-4-глюкозы и других фрагментов и их комбинаций. Также раскрыты фармацевтическая композиция для применения при индуцировании толерантности к антигену, способ лечения иммунного заболевания или расстройства у субъекта, способ получения частиц и модифицированные углеводами частицы инкапсулирующие антиген. Группа изобретений обеспечивает улучшенные углеводами наночастицы, которые способны модулировать иммунные ответы. 5 н. и 14 з.п. ф-лы, 23 ил., 1 табл., 3 пр.
1. Модифицированные углеводами частицы инкапсулирующие антиген, где частицы содержат биодеградируемый полимерный материал, имеющий эффективный средний диаметр 0,01-500 мкм и углеводный фрагмент, который является иммуномодулятором, ковалентно присоединенным к поверхности частиц, где полимерный материал содержит полимолочную кислоту (PLA), полигликолевую кислоту (PGA) или сополимер полимолочной кислоты (PLA) и полигликолевой кислоты (PGA) (т.е., PLGA), где частицы вызывают толерантность к антигену, и,
углеводный фрагмент выбран из группы, состоящей из гепарина дисахарида II-A, гепарина дисахарида III-A, гепарина дисахарида IV-A, ненасыщенного гепарина дисахарида I-H, хондроитина дисахарида ΔDi-triS, линейного трисахарида группы крови B группы 2, антигена P1, сиалил-Льюиса A, сиалил-Льюис X β-метил гликозида, сульфо-Льюиса A, сульфо-Льюиса X, α1-3-маннобиозы, α1-6-маннобиозы, маннотетраозы, α1-3, α1-3, α1-6-маннопентозы, β1-2-N-ацетилглюкозамин-маннозы, α-D-N-ацетилгалактозаминил-1-3-галактоза-β1-4-глюкозы, лакто-N-тетраозы (LNT), 4-β-галактобиозы, 1-3-галактодиозил-β-метил-гликозида, α1-3, β1-4, α1-3-галактотетраозы, β-галактозил-1-3-N-ацетил-галактозамин-метил-гликозиды, β1-3-Gal-N-ацетил галактозаминила-β1-4 Gal-β1-4-Glc, 1-дезоксинойириминцина (DNJ), D-фукозы, L-фукозы, калистегина A3, калистегина B3, N-метил цис-4-гидроксиметил-L-пролина и их комбинаций.
2. Частицы по п. 1, где углеводный фрагмент ковалентно присоединен к поверхности частиц через линкер.
3. Частицы по п. 2, где линкер содержит: (1) электрофил, который реагирует со свободной гидроксильной группой углеводного фрагмента; и (2) нуклеофил, который реагирует со свободной карбоксильной группой полимерного материала.
4. Частицы по п. 3, где углеводный фрагмент ковалентно присоединен к поверхности частиц посредством сшивания карбодиимидом.
5. Частицы по п. 1, дополнительно содержащие дополнительный иммуномодулятор, отличный от углеводного фрагмента.
6. Частицы по п. 1, где иммуномодулятор индуцирует десенсибилизацию или толерантность, и/или иммуномодулятор индуцирует противовоспалительный ответ.
7. Частицы по п. 5, где дополнительный иммуномодулятор представляет собой антиген, ассоциированный с аутоиммунным заболеванием или расстройством.
8. Частицы по п. 7, где антиген представляет собой антиген, полученный из инсулина.
9. Фармацевтическая композиция для применения при индуцировании толерантности к антигену, содержащая частицы по п. 1 вместе с подходящим носителем, эксципиентом или разбавителем.
10. Способ лечения заболевания или расстройства у субъекта, нуждающегося в этом, способ включает введение композиции по п. 9 субъекту, где заболевание является иммунным заболеванием.
11. Способ по п. 10, где субъект имеет или находится в риске развития иммунного заболевания или расстройства.
12. Способ по п. 11, где иммунное заболевание или расстройство представляет собой аллергическую реакцию, и способ индуцирует толерантность у субъекта.
13. Способ по п. 11, где иммунное заболевание или расстройство представляет собой аутоиммунное заболевание или расстройство.
14. Способ по п. 13, где иммунным заболеванием или расстройством является сахарный диабет 1 типа.
15. Способ получения частиц по п. 1, способ, включающий следующие стадии:
(а) скрининг библиотеки углеводных фрагментов для активности иммуномодулятора путем контактирования библиотеки с иммунной клеткой и измерение влияния библиотеки на стимуляцию иммунной клетки;
(b) выбор углеводного фрагмента на основе его влияния на стимуляцию иммунной клетки; а также
(c) присоединение углеводного фрагмента к частицам, образованным из полимерного материала.
16. Способ по п. 15, где измерение влияния библиотеки на стимуляцию иммунной клетки включает измерение продуцирования цитокинов.
17. Способ по п. 16, где измерение продуцирования цитокинов включает в себя измерение продуцирования IL-10 по сравнению с исходным уровнем и измерение продуцирования IL-6 по сравнению с исходным уровнем, и выбор углеводного фрагмента на основе его влияния на стимулирование иммунной клетки включает в себя выбор углеводного фрагмента, который увеличивает секрецию IL-10 по сравнению с исходным уровнем, не изменяя секрецию IL-6 или уменьшая секрецию IL-6.
18. Способ по п. 15, где присоединяющийся углеводный фрагмент связывается ковалентно с частицами, образованными из полимерного материала.
19. Модифицированные углеводами частицы инкапсулирующие антиген, где частицы содержат биодеградируемый полимерный материал, имеющий эффективный средний диаметр 0,01-500 мкм и углеводный фрагмент, который является иммуномодулятором, ковалентно присоединенным к поверхности частиц, где полимерный материал содержит полимолочную кислоту (PLA), полигликолевую кислоту (PGA) или сополимер полимолочной кислоты (PLA) и полигликолевой кислоты (PGA) (т.е., PLGA), где частицы вызывают противовоспалительный ответ на антиген, и,
углеводный фрагмент выбран из группы, состоящей из, гепарина дисахарида II-A, гепарина дисахарида III-A, гепарина дисахарида IV-A, ненасыщенного гепарина дисахарида I-H, хондроитина дисахарида ΔDi-triS, линейного трисахарида группы крови B группы 2, антигена P1, сиалил-Льюиса A, сиалил-Льюис X β-метил гликозиды, сульфо-Льюиса A, сульфо-Льюиса X, α1-3-маннобиоза, α1-6-маннобиозы, маннотетраозы, α1-3, α1-3, α1-6-маннопентозы, β1-2-N-ацетилглюкозамин-маннозы, α-D-N-ацетилгалактозаминил-1-3-галактоза-β1-4-глюкозы, лакто-N-тетраозы (LNT), 4-β-галактобиозы, 1-3-галактодиозил-β-метил-гликозида, α1-3, β1-4, α1-3-галактотетраозы, β-галактозил-1-3-N-ацетил-галактозамин-метил-гликозиды, β1-3-Gal-N-ацетил галактозаминила-β1-4 Gal-β1-4-Glc, 1-дезоксинойириминцина (DNJ), D-фукозы, L-фукозы, калистегина A3, калистегина B3, N-метил цис-4-гидроксиметил-L-пролина и их комбинаций.
| НАЦЕЛИВАНИЕ НА АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ ИММУНОНАНОТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2009 |
|
RU2497542C2 |
| WO 2013144811 A2, 03.10.2013 | |||
| WO 2015066535 A1, 07.05.2015 | |||
| Устройство для дистанционного управления форсунками котла | 1960 |
|
SU136001A1 |
| RU 2011125366 A, 10.01.2013 | |||
| КОНЪЮГАТЫ γ-ИНТЕРФЕРОНА | 2000 |
|
RU2268749C2 |
Авторы
Даты
2021-07-29—Публикация
2016-05-27—Подача