Изобретение относится к новым биологически активным соединениям, а именно к пептиду - фрагменту нуклеофозмина. Иммунизация данным пептидом стимулирует образование антител, позволяющих методом иммуноблоттинга селективно выявлять мономерную форму нуклеофозмина в гомогенатах опухолевых клеток, содержащих как олигомерные, так и мономерные формы белка. Полученные с помощью заявляемого пептида антитела могут быть использованы для диагностики опухолевых заболеваний.
Ядрышковый белок нуклеофозмин участвует в регуляции таких важных клеточных процессов, как биогенез рибосом, пролиферация клеток, стабилизация генома и канцерогенез [Lim M.J., Wang X.W. // Nucleophosmin and human cancer. Cancer Detect. Prev. 2006. V.30. P.481-490]. В опухолевых клетках наблюдается сверхэкспрессия нуклеофозмина и образование специфических структурных форм белка, часть из которых представляет собой мономеры, а часть - олигомеры, причем олигомер-мономерное состояние, а также распределение мономерных и олигомерных форм между ядрышками и нуклеоплазмой меняется в процессе канцерогенеза [Grummit C.G. et al. // Structural consequences of nucleophosmin mutations in acute myeloid leukemia. J. Biol. Chem. 2008. V.283. N.34. P.23326-23332]. Таким образом, анализ мономер-олигомерного состояния нуклеофозмина является важной составляющей диагностики опухолей и мониторинга эффективности противоопухолевой терапии. Данное изобретение позволяет селективно выявлять мономерные формы нуклеофозмина в опухолевых клетках, где присутствуют одновременно мономеры и олигомеры, и является необходимым инструментом для определения локализации мономерных форм в раковых клетках.
В настоящее время широко известны и применяются в научной практике антитела, полученные к выделенному из культуры клеток нуклеофозмину [Pui К. Chan, Fung Y. Chan. Nucleophosmin/B23 (NPM) oligomer is a major and stable entity in HeLa cells. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1995. V.1262. P.37-42; R.Ochs, M.Lischwe, P.O'Leary, H.Busch. Localization of Nucleolar Phosphoproteins B23 and C23 during Mitosis Experimental. Cell Research. 1983. V.146. P.139-149]. Антитела выявляют мономерные и олигомерные формы нуклеофозмина.
На сегодняшний день в мире не существует антител, селективно выявляющих мономерную форму нуклеофозмина в препаратах, где присутствуют одновременно мономерная и олигомерная формы.
Известен наиболее близкий к заявленному препарат, представляющий собой лизат клеток лимфобластомы человека, к которому были получены моноклональные антитела 3С9, выявляющие мономерную и олигомерную формы нуклеофозмина в иммуноблоте [Патент РФ №2296159, МКИ C12N 5/18, опубл. 1997]. Антитела, полученные с помощью этого препарата, однако, не способны селективно выявлять только мономерную форму белка в препаратах, в которых одновременно присутствуют обе формы - мономерная и олигомерная. Это создает препятствия для детальной диагностики и мониторинга раковых заболеваний.
Изобретение решает задачу расширения ассортимента препаратов для селективной детекции мономерных форм нуклеофозмина в опухолевых клетках.
Поставленная задача решается за счет пептида, индуцирующего при иммунизации высокоспецифические антитела к мономерной форме нуклеофозмина, формулы:
Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp.
Сущностью изобретения является новый пептидный фрагмент нуклеофозмина формулы Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp (SEQ ID NO 1) получаемый с помощью стандартных методик пептидного синтеза. При иммунизации заявляемым синтетическим пептидом вырабатываются антитела, способные связываться только с мономерной формой нуклеофозмина. Техническим результатом изобретения является селективное выявление с помощью полученных противопептидных антител методом иммуноблоттинга мономеров нуклеофозмина в гомогенатах культур опухолевых клеток HeLa и RAMOS, содержащих мономерные и олигомерные формы белка.
Заявляемый в изобретении пептид (SEQ ID NO 1), соответствующий аминокислотной последовательности (19-36) нуклеофозмина, локализован в общей для разных форм нуклеофозмина области полипептидной цепи, антитела к фрагментам которой наиболее перспективны для определения мономера нуклеофозмина в опухолевых клетках различного типа. Пептид (SEQ ID NO 1) по сравнению с известным препаратом является химически индивидуальным веществом и способен стимулировать образование антител, строго направленных к единственному участку (19-36), универсальному для всех мономерных форм нуклеофозмина. Синтез этого пептида не требует большой трудоемкости и материальных затрат. Антитела, полученные против пептида (SEQ ID NO 1), селективно выявляют на иммуноблотах только мономерные формы белка в препаратах опухолевых клеток различного типа, содержащих как мономерные, так и олигомерные формы нуклеофозмина.
Синтез целевого продукта осуществляют твердофазным методом, ступенчато, на 4-(гидроксиметил)феноксиметил полистирольном полимере (смоле Ванга) с использованием 9-флуоренилметоксикарбонил (Fmoc) производных аминокислот. Конденсации осуществляют при помощи тетрафторбората бензтриазол-1-ил-N-окси-бис(диметиламино)урония (TBTU). Для отделения пептида от полимерного носителя и конечного деблокирования используют трифторуксусную кислоту с добавкой этандитиола, триизопропилсилана и воды.
Структуру и гомогенность целевого продукта подтверждают данными аминокислотного анализа, масс-спектра и высокоэффективной жидкостной хроматографии.
Изобретение иллюстрируют графические материалы.
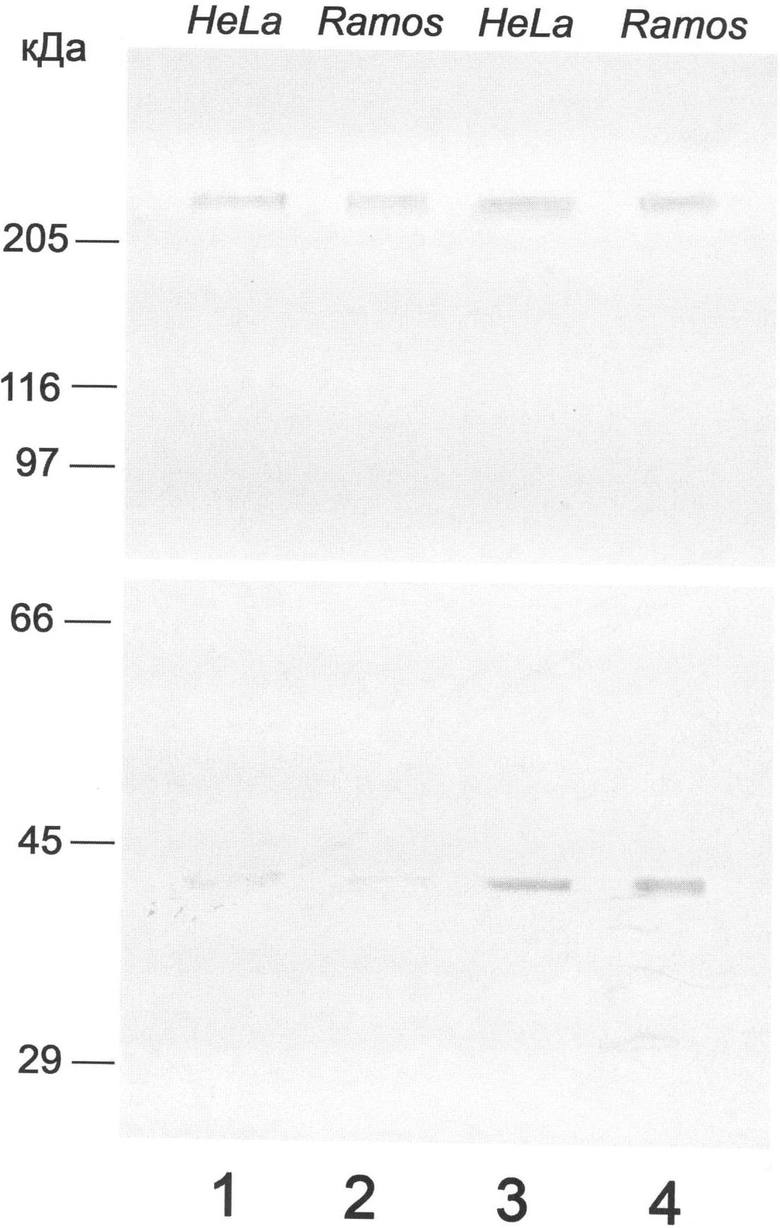
Чертеж Иммуноблот. Иммунохимический анализ нуклеофозмина в лизатах клеток HeLa и Ramos с помощью антител к заявляемому пептиду (19-36) (дор.1 и 2) и контрольных моноклональных антител 3 С9 (дор.3 и 4). Из чертежа видно, что антитела к заявляемому пептиду выявляют только мономерную форму белка (38-40 кДа), тогда как контрольные антитела выявляют мономерную и олигомерную (210-230 кДа) формы.
Пример 1. Синтез пептида Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp (SEQ ID NO 1).
Операция 1. 0,3 г смолы Ванга с содержанием ОН-групп 0,5 ммоль/г полимера помещают в проточный реактор, промывают диметилформамидом (2×10 мл), снова добавляют 10 мл диметилформамида и оставляют набухать в течение 10 мин, затем диметилформамид удаляют. Синтез пептида ведут в проточном реакторе при комнатной температуре.
Операция 2. Получение Fmoc-Asp(OBut)-полимера (I).
В 4 мл диметилформамида растворяют 0,618 г (1,5 ммоль) Fmoc-Asp(OBut)-OH, добавляют 116 мкл (0,75 ммоль) N,N'-диизопропилкарбодиимида и 1,8 мг (0,015 ммоль) 4-диметиламинопиридина. Раствор перемешивают при температуре 0°С. Через 10 мин раствор добавляют к алкоксибензильному полимеру, находящемуся в проточном реакторе. Полученную смесь выдерживают при периодическом перемешивании при комнатной температуре 12 часов. Полученный Fmoc-Asp(OBut)-полимер промывают диметилформамидом (2×10 мл), этанолом (2×10 мл) и снова диметилформамидом (2×10 мл). Непрореагировавшие аминогруппы ацилируют смесью 2 мл уксусного ангидрида, 2 мл пиридина и 6 мл диметилформамида в течение 2 ч. Промывки повторяют. Содержание Fmoc-Asp(OBut) в продукте составляет 1,05 ммоль на 0,3 г полимера.
Операция 3. Получение Fmoc-Asn-Asp(OBut)-полимера (II).
а) Fmoc-Asp(OBut)-полимер (I) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,160 г (0,45 ммоль) Fmoc-Asn-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 4. Получение Fmoc-Asp(OBut)-Asn-Asp(OBut)-полимера (III).
а) Fmoc-Asn-Asp(OBut)-полимер (II) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,185 г (0,45 ммоль) Fmoc-Asp(OBut)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 5. Получение Fmoc-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (IV).
a) Fmoc-Asp(OBut)-Asn-Asp(OBut)-полимер (III) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,154 г (0,45 ммоль) Fmoc-Val-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 6. Получение Fmoc-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (V).
а) Fmoc-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (IV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,211 г (0,45 ммоль) Fmoc-Lys(Boc)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 7. Получение Fmoc-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (VI).
а) Fmoc-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (V) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,175 г (0,45 ммоль) Fmoc-Phe-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 8. Получение Fmoc-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (VII).
а) Fmoc-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (VI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,279 г (0,45 ммоль) Fmoc-His(Trt)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 9. Получение Fmoc-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (VIII).
а) Fmoc-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (VII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,207 г (0,45 ммоль) Fmoc-Tyr(But)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 10. Получение Fmoc-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (IX).
а) Fmoc-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (VIII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,185 г (0,45 ммоль) Fmoc-Asp(OBut)-ОН и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 11. Получение Fmoc-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера(Х).
а) Fmoc-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (X) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,211 г (0,45 ммоль) Fmoc-Lys(Boc)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 12. Получение Fmoc-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XI).
а) Fmoc-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (X) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,185 г (0,45 ммоль) Fmoc-Asp(OBut)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 13. Получение Fmoc-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Вос)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XII).
а) Fmoc-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,141 г (0,45 ммоль) Fmoc-Ala-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 14. Получение Fmoc-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XIII).
a) Fmoc-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,211 г (0,45 ммоль) Fmoc-Lys(Boc)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 15. Получение Fmoc-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XIV).
а) Fmoc-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XIII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,159 г (0,45 ммоль) Fmoc-Leu-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 16. Получение Fmoc-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XV).
a) Fmoc-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lyc(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XIV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,191 г (0,45 ммоль) Fmoc-Glu(OBut)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 17. Получение Fmoc-Cys(Trt)-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XVI).
а) Fmoc-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,264 г (0,45 ммоль) Fmoc-Cys(Trt)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 18. Получение Fmoc-Gly-Cys(Trt)-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XVII).
a) Fmoc-Cys(Trt)-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XVI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,134 г (0,45 ммоль) Fmoc-Gly-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 19. Получение Fmoc-Phe-Gly-Cys(Trt)-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимера (XVIII).
а) Fmoc-Gly-Cys(Trt)-Glu(OBut)-Leu-Lys(Boc)-Ala-Asp(OBut)-Lys(Boc)-Asp(OBut)-Tyr(But)-His(Trt)-Phe-Lys(Boc)-Val-Asp(OBut)-Asn-Asp(OBut)-полимер (XVII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,175 г (0,45 ммоль) Fmoc-Phe-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч при комнатной температуре. Полимер промывают диметилформамидом (2×10 мл).
Операция 20. Получение целевого пептида Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp (SEQ ID NO 1). 0,3 г пептидил-полимера (XVIII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл), этанолом (2×10 мл) и высушивают в токе воздуха. Сухой полимер обрабатывают 4 мл смеси трифторуксусная кислота-вода-этандитиол-триизопропилсилан в объемном соотношении 94:2,5:2,5:1 в течение 2 ч. Полимер отфильровывают, раствор упаривают, сухой остаток промывают сухим диэтиловым эфиром (2×50 мл). Растворяют в 10%-ной уксусной кислоте и очищают на препаративной ВЭЖХ при следующих условиях: колонка Phenomenex (США) Jupiter 10µ С18 300А (250×10 мм), растворитель А: 0,1%-ная трифторуксусная кислота в воде, растворитель Б: 0,1%-ная трифторуксусная кислота в ацетонитриле, градиент растворителя А в Б - от 10 до 70% за 1 ч, скорость потока элюента - 3 мл/мин, выход пептида регистрируют при оптической длине волны 226 нм. Собранную после ВЭЖХ фракцию, содержащую целевой продукт, лиофилизуют.
Данные аминокислотного анализа
Asp 4,7 (5), Glu 1,0 (1), Gly 0,8 (1), Ala 0,7 (1), Val 0,7 (1), Leu 0,8 (1), Tyr 1,0 (1), Phe 1,6 (2), Lys 2,5 (3), His 0,6 (1)
По данным масс-спектрометрии МН+2143. По данным аналитической ВЭЖХ время удерживания составляет 18,5 мин, условия: колонка Phenomenex (США) Jupiter 5µ С18 300А (250×4,6 мм), растворитель А: 0,1%-ная трифторуксусная кислота в воде, растворитель Б: 0,1%-ная трифторуксусная кислота в ацетонитриле, градиент растворителя А в Б - от 10 до 70% за 1 ч, скорость потока элюента - 1 мл/мин, выход пептида регистрируют при оптической длине волны 226 нм.
Проведение биологических испытаний.
Пример 2. Получение противопептидных сывороток
а) Получение конъюгатов пептидов с гемоцианином улитки.
2,4 мг пептида (SEQ ID NO 1) и 12 мг гемоцианина улитки (Sigma, США) растворяют в 2 мл буфера состава: 2,7 мМ KCl, 140 мМ NaCl, 8,1 мМ Na2HPO4, 1,5 мМ KH2PO4, рН 7,4 (PBS) и при перемешивании в течение часа добавляют 480 мкл 0,5%-ного водного глутарового диальдегида. Полученный раствор перемешивают 15 часов, после чего диализуют против буфера PBS в течение ночи.
а) Раствор конъюгата, содержащего 2,4 мг пептида (SEQ ID NO 1), смешивают с равным объемом полного (для первой иммунизации), или неполного (для второй иммунизации) адъюванта Фрейнда и эмульгируют. Содержание пептида в каждой иммунизирующей дозе составляет 1 мг.
б) Кроликов породы шиншилла весом 3 кг иммунизируют дважды с интервалом в 42 дня. Перед первой иммунизацией из ушной вены отбирают кровь, полученные преиммунные сыворотки объединяют и используют как контрольные. Через 14 дней после второй иммунизации проводят забор крови из ушной вены. Полученные сыворотки объединяют.
Пример 3. Определение содержания противопептидных антител в сыворотках методом твердофазного иммуноферментного анализа.
а) В лунки плашки вносят по 0,1 мл раствора пептида (SEQ ID NO 1) в 0,05 М Na-карбонат-бикарбонатном буфере (рН 9,6) в концентрации 20 мкг/мл и инкубируют 16 часов при 4°С. Затем раствор пептида удаляют и плашку четырежды промывают буфером PBS, содержащим 0,05% Tween-20.
б) В лунки вносят по 0,1 мл образцов объединенной преиммунной и объединенной иммунной сывороток в двойных разведениях, начиная с разведения 1:100, и инкубируют в течение 1 часа при 37°С. Затем плашку четырежды промывают PBS, содержащим 0,05% Tween-20.
в) Проводят инкубацию (1 час, 37°С) с конъюгированными с пероксидазой хрена козьими антителами против IgG кроликов (0,1 мл на лунку, 1 мг/мл в PBS). Затем плашку четырежды отмывают PBS, содержащим 0,05% Tween-20.
г) Проводят инкубацию с раствором субстрата (по 0,1 мл на лунку) - 0,05% перекисью водорода и 0,05% о-фенилендиамином в 0,15 М Na-цитратном буфере, рН 5,0. После появления окрашивания в лунках, содержащих контрольную преиммунную сыворотку, реакцию останавливают добавлением 100 мкл 10% серной кислоты.
д) Оптическую плотность раствора в лунках измеряют при длине волны 492 нм на приборе Multiscan Plus MKII (Flow Laboratories, Великобритания). За титр противопептидных антител принимают значение разведения сыворотки, дающее окрашивание более 0,1 ОЕ и превышающее окрашивание в лунках с контрольной преиммунной сывороткой в два раза. Полученное значение титра противопептидных антител составляет 5,9, выраженного в -lg разведения сыворотки.
Пример 4. Получение аффинного носителя.
1 г CNBr-активированной сефарозы 4В (GE Healthcare bio-science AB, Швеция) суспендируют в 6 мл 1 мМ HCl в течение 15 мин до образования прозрачного геля и промывают 1 мМ HCl (5×10 мл). 2,8 мг пептида (SEQ ID NO 1) растворяют в 4 мл конденсирующего буфера (0.1 М NaHCO3, 0,1 М NaCl, рН 8,0), добавляют к сефарозе и при периодическом перемешивании оставляют на 1 ч при 20°С. После промывки конденсирующим буфером (5×3 мл) к сефарозе добавляют блокирующий буфер (0,2 М Gly, 0,1 М NaCl, рН 8,0) и выдерживают в течение 2 ч. Затем сефарозу промывают поочередно ацетатным (0,1 М NaOCOCH3, 0,1 М NaCl, рН 4,0) и боратным буфером (0,1 М Na2B4O7·10H2O, 0,1 М NaCl, рН 8,1) (5×10 мл).
Пример 5. Аффинная очистка антител.
2 мл сыворотки наносят на колонку с 3,5 мл аффинного носителя, промытую буфером состава: 0,15 М NaCl, 0.01 М Na2HPO4, рН 7,4 (PBS2) и инкубируют при комнатной температуре в течение 60 мин. Затем колонку промывают 35 мл буфера PBS2 и 35 мл элюирующего буфера (0,2 М раствора глицина в 0,1 М NaCl, рН 2,5). В отобранных фракциях элюата значения рН доводят до 8,0 с помощью 1М TRIS, рН 10. Содержание белка во фракциях определяют спектрофотометрически, измеряя оптическое поглощение при длине волны 208 нм. Титр аффинноочищенных противопептидных антител (5,4) определяют с помощью твердофазного иммуноферментного анализа по описанной в операции 2 методике.
Пример 6. Приготовление лизатов клеток
В работе используют культуры клеток человека: HeLa (клетки карциномы шейки матки) и Ramos (лимфома Буркитта). Культуры клеток выращивают в среде DMEM, содержащей 10% эмбриональной бычьей сыворотки и антибиотики (10 мкг/мл пенициллина и 10 мкг/мл стрептомицина) при 37°С в присутствии 5% СО2. Клетки для экспериментов выращивают в культуральных флаконах.
Клетки HeLa, растущие в монослойной культуре, отмывают от среды буфером PBS. Клетки снимают с поверхности культурального флакона раствором Версена (Панэко, Россия) в течение 5 мин при 37°С и осаждают центрифугированием в течение 10 мин при 500g и 4°С на центрифуге 5804R («Eppendorf», Германия).
Суспензионную культуру клеток Ramos сливают вместе с культуральной средой и осаждают центрифугированием в течение 10 мин при 500g и 4°С на центрифуге 5804R («Eppendor», Германия).
Полученные осадки после декантации ресуспендируют в PBS и повторно центрифугируют при 500g и 4°С в течение 10 мин. После суспендирования осадков в PBS добавляют глицерин так, чтобы концентрация последнего составляла 30% и затем измеряют концентрацию белка и проводят электрофоретический и иммунохимический анализ. На всех стадиях в растворы добавляют непосредственно перед использованием ингибиторы протеаз (1 мМ PMSF, 1 мкг/мл лейпептина и 1 мкг/мл апротинина).
Пример 7. Измерение концентрации белка
Измерение концентрации белка осуществляют по модифицированному методу Лоури с использованием в качестве стандарта бычий сывороточный альбумин [Lowry, О.Н., Rothenbrough, N.Y., Farr, A.H., and Randall, R.G. Protein measurement with the Folin phenol reagent. // J. Biol. Chem. 1951. V.193. P.265-275].
Пример 8. Обработка образцов для электрофореза
Перед добавлением лизирующих растворов к суспензии клеток добавляют буфер PBS и глицерин так, чтобы концентрация белка в пробе составляла ~1-1,5 мг/мл, а концентрация глицерина - 30%. К суспензии белка добавляют ингибиторы протеаз (фенилметилсульфенилфторид до концентрации 1 мМ, 1 мкг/мл лейпептина и 1 мкг/мл апротинина).
К суспензии клеток добавляют буфер, содержащий додецилсульфат натрия, 2-меркаптоэтанол и ЭДТА до концентрации 5%, 2,5% и 1 мМ соответственно. Смесь термостатируют при 100°С в течение 1 мин (для предотвращения распада олигомерных форм белка В23).
Пример 9. Электрофорез и электроблоттинг
а) Электрофорез проводят на пластинках толщиной 1,5 мм с концентрацией полиакриламида 7,5%. Электрофорез выполняют в денатурирующих условиях по методу Лэммли [Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage. // Nature. 1970. V.227, P.680-685]. Концентрирование белков осуществляют при силе тока 10 мА на пластину, а их разделение - при силе тока 20 мА на пластину при 12°С. Для проявления белковых полос на геле используют окрашивание раствором Кумасси G-250 в 10% уксусной кислоте, содержащей 25% изопропилового спирта.
б) Электроблоттинг осуществляют на мембраны иммобилона NC (Millipore, США) диаметром пор 0,45 мкм. Для электропереноса используют условия: 0,025М натрий-бикарбонатный буфер (рН 9,0), 20% СН3ОН и 0,1% додецилсульфата натрия. Электроперенос проводят при 12°С и постоянной силе тока ~400 мА. После проведения электроблоттинга в течение 3 ч часть геля, содержащую белки с молекулярными массами <60 кДа, и соответствующую часть мембраны отрезают, а верхнюю часть геля, содержащую более высокомолекулярные белки, подвергают дополнительному электропереносу еще в течение 12 ч. Контроль полноты электропереноса на мембраны осуществляют с помощью окрашивания гелей (после электроблоттирования) раствором Кумасси G-250 и по окрашиванию маркерных смесей белков на мембранах раствором амидочерного 10Б.
Пример 10. Иммуноокрашивание.
После электропереноса мембраны иммобилона шестикратно отмывают буфером А (50 мМ Tris-HCl, 200 мМ NaCl, 0,1% Тритон Х-100, рН 7,5) по 5 мин на качалке. После этого мембраны помещают в буфер А, содержащий 5% молока, инкубирование проводят в течение 1,5 ч. Затем мембраны инкубируют с антителами к пептиду (SEQ ID NO 1) или с контрольными моноклональными антителами 3С9 [Булычева Т.И., Дергунова Н.Н., Артеменко Е.Г., Дудник О.А., Шпакова А.П., Малашенко О.С., Зацепина О.В. Анализ пролиферативной активности клеток с использованием новых моноклональных антител к ядрышковому белку В23/нуклеофозмину. Цитология. 2000. Т.42. С.944-954] в буфере А, содержащем 5% молока, при 4°С в течение ночи. Далее мембраны шестикратно отмывают буфером А по 5 мин. Проводят повторную забивку мембран 5% молоком, приготовленным на буфере А, в течение 50 мин. Затем проводят инкубацию с конъюгированными с пероксидазой хрена козьими антителами против IgG+IgM мыши (для проявления связывания контрольных антител 3С9) или против IgG кролика (для проявления связывания антител к пептиду (SEQ ID NO 1) в буфере А, содержащем 5% молока в течение 1,5 ч. Мембраны промывают буфером А 6 раз по 5 мин и дистиллированной водой 3 раза по 3 мин. Для окрашивания полос к мембранам добавляют 25 мл раствора 50 мМ Tris (pH 7,6), содержащего 12,5 мг диаминобензидина. Раствор пероксида водорода (10 мкл 50% раствора) вносят непосредственно перед окрашиванием. Проявление осуществляют в течение 5-20 мин в темноте. Антитела к заявляемому пептиду выявляют только мономерную форму белка (38-40 кДа).
Таким образом, получен новый пептид формулы Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp, способный индуцировать образование антител, выявляющих в иммуноблоттинге мономерную форму нуклеофозмина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, ОБЛАДАЮЩИЙ ЗАЩИТНЫМ ДЕЙСТВИЕМ ПРОТИВ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2008 |
|
RU2372355C1 |
| ПЕПТИД, СТИМУЛИРУЮЩИЙ ОБРАЗОВАНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ, ВЫЯВЛЯЮЩИХ СУРВИВИН В ОПУХОЛЕВЫХ ТКАНЯХ | 2009 |
|
RU2396277C1 |
| ПЕПТИД, СТИМУЛИРУЮЩИЙ ОБРАЗОВАНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ ОЛИГОМЕРНОЙ ФОРМЫ НУКЛЕОФОЗМИНА В ОПУХОЛЕВЫХ КЛЕТКАХ | 2009 |
|
RU2401275C1 |
| ПЕПТИД GLP-1 С ПРИСОЕДИНЕННОЙ ОЛИГОСАХАРИДНОЙ ЦЕПЬЮ | 2008 |
|
RU2539829C2 |
| ГЛИКОЗИЛИРОВАННЫЙ ПЕПТИД GLP-1 | 2009 |
|
RU2543157C2 |
| ПЕПТИД, ОБЛАДАЮЩИЙ ЛЕЧЕБНЫМ ДЕЙСТВИЕМ ПРОТИВ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2014 |
|
RU2558242C1 |
| ПРОИЗВОДНЫЕ МЕТАСТИНА И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2430107C2 |
| Пептид, обладающий лечебным действием против болезни Альцгеймера | 2018 |
|
RU2677296C2 |
| ПРОИЗВОДНЫЕ МЕТАСТИНА И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2454425C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛИКОПРОТЕИНА И СПОСОБ СКРИНИНГА | 2009 |
|
RU2520240C2 |
Изобретение относится к биотехнологии и представляет собой новое биологически активное соединение, такое как пептид, позволяющий получать антитела, селективно выявляющие мономерную форму белка нуклеофозмина в препаратах, содержащих мономерные и олигомерные формы белка. Изобретение может быть эффективно использовано для создания иммунодиагностического препарата для исследования и мониторинга раковых опухолей. 1 ил.
Пептид, индуцирующий при иммунизации высокоспецифические антитела к мономерной форме нуклеофозмина, формулы
Phe-Gly-Cys-Glu-Leu-Lys-Ala-Asp-Lys-Asp-Tyr-His-Phe-Lys-Val-Asp-Asn-Asp.
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИНОЙ ГИБРИДОМЫ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ЯДРЫШКОВОМУ АНТИГЕНУ, АССОЦИИРОВАННОМУ С КЛЕТОЧНОЙ ПРОЛИФЕРАЦИЕЙ | 1998 |
|
RU2145634C1 |
| CHAN P.K | |||
| ET AL | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Пишущая машина с ножной педалью для передвижения каретки и бумажного валика | 1923 |
|
SU1262A1 |
| OCHS R | |||
| ET AL | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Experimental Cell Res | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Приспособление, увеличивающее число оборотов движущихся колес паровоза | 1919 |
|
SU146A1 |
Авторы
Даты
2010-10-10—Публикация
2009-04-06—Подача