ПРИОРИТЕТНОЕ ТРЕБОВАНИЕ
Данная заявка испрашивает приоритет предварительной заявки США № 61/120228, поданной 5 декабря 2008 г., полное содержание которой включено в данное описание посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Секретируемый белок, кислый, обогащенный цистеинами (SPARC), также известный как остеонектин, представляет собой гликопротеин из 303 аминокислот, который экспрессируется в организме человека. Экспрессия SPARC регулируется онтогенетически с преимущественной экспрессией SPARC в тканях, подвергающихся ремоделированию в процессе нормального развития или в ответ на повреждение. Смотри, например, Lane et al., FASEB J., 8, 163-173 (1994). Например, высокие уровни белка SPARC экспрессируются в развивающихся костях и зубах, прежде всего в остеобластах, одонтобластах, околохрящевых фибробластах и дифференцирующихся хондроцитах мыши, крупного рогатого скота и эмбрионов человека. SPARC также играет важные роли в клетка-матриксных взаимодействиях в процессе ремоделирования ткани, заживления ран, морфогенеза, клеточной дифференцировки, клеточной миграции и ангиогенеза, включая те процессы, которые ассоциированы с болезненными состояниями. Например, SPARC экспрессируется в почечном интерстициальном фиброзе и играет роль в ответе хозяина на легочные инсульты, такие как индуцированный блеомицином легочный фиброз.
SPARC дифференциально экспрессируется в опухолях и окружающей их строме при различных злокачественных опухолях по сравнению с нормальной тканью с паттерном, зависящим от типа рака. Таким образом, отсутствует унифицированная модель, которая объясняет все аспекты его функции и содействие развитию и прогрессии рака. В одном примере было сообщено об увеличенной экспрессии SPARC в раке молочной железы (Bellahcene and Castronovo, 1995; Jones et al., 2004; Lien et al., 2007; Porter et al., 1995), меланоме (Ledda et al., 1997a) и глиобластомах (Rempel et al., 1998). Увеличенная экспрессия SPARC играет роль в опухолевой промоции или прогрессии этих злокачественных опухолей.
В связи с этим сверхэкспрессия SPARC в воспалении и в некоторых злокачественных опухолях делает SPARC потенциальной мишенью диагностики и терапии.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом («SBP») и фармацевтически приемлемым носителем («изобретательские композиции») включительно, где SBP включает один или несколько SEQ ID NOs:1-117.
Особенно предпочтительные варианты осуществления по изобретению включают, например, изобретательские композиции для доставки терапевтического агента в область заболевания млекопитающего, включающие один или несколько SBP, где терапевтический агент представляет собой антительный фрагмент, включающий функциональный антительный Fc домен включительно, например, где функциональный антительный Fc домен включает SEQ ID NO:118.
Дополнительные предпочтительные варианты осуществления по изобретению включают изобретательские композиции для доставки терапевтического или диагностического агента в область заболевания в композиции для млекопитающего, например, где SBP включает: по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117. Предпочтительно SBP может включать по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117. Другие варианты осуществления по изобретению включают композиции, например, где имеются два или несколько отдельных SBP, где каждый индивидуальный SBP включает по меньшей мере 10 последовательных аминокислот из любого одного SEQ ID NOs:1-112 и 117, предпочтительно любого одного или нескольких SEQ ID NOs:1-5. Варианты осуществления по изобретению включают композиции, например, где имеются два или несколько отдельных SBP, где индивидуальные SBP включают один или несколько SEQ ID NOs:1-117.
Изобретение также предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный с SBP, фармацевтически приемлемый носитель и фармацевтически приемлемый носитель, далее включающий альбумин-связывающий пептид («ABP»), где ABP включает SEQ ID NO:119 или SEQ ID NO:120 или оба SEQ ID NOs:119 и 120. Такие композиции включают [состав], где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах.
Изобретение далее предоставляет способы доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом и фармацевтически приемлемым носителем («изобретательские способы»), где SBP включает один или несколько SEQ ID NOs:1-117. Предпочтительные варианты осуществления по изобретению включают изобретательские способы, где композиции, например, где SBP, включает: по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112 и 117, более предпочтительно из любого одного или нескольких SEQ ID NOs:1-5 и 117.
Другие предпочтительные варианты осуществления по изобретению включают изобретательские способы, например, где имеются два или несколько отдельных SBP, где индивидуальные SBP включают один или несколько SEQ ID NOs:1-117. Изобретение также предоставляет изобретательские способы, где имеются два или несколько отдельных полипептидов, каждый включающий по меньшей мере один SBP, и где SBP включают по меньшей мере 10 последовательных аминокислот из любого одного SEQ ID NOs:1-112.
Особенно предпочтительные изобретательские способы включают композиции, например, в которых терапевтический агент представляет собой антительный фрагмент, включающий функциональный антительный Fc домен, такие, где антительный фрагмент включает SEQ ID NO:118. Такие способы в соответствии с изобретением включают, например, способы, в которых терапевтический агент представляет собой антительный фрагмент, который опосредует одну или несколько активаций комплемента, опосредованную клеткой цитотоксичность, индуцированный апоптоз, индуцированную клеточную гибель и опсонизацию.
Изобретательские способы, предоставляемые изобретением, также включают связывающие сывороточный альбумин пептиды («ABP»), включающие SEQ ID NOs:119 или 120 или оба SEQ ID NOs:119 и 120. Способы в соответствии с изобретением далее включают, например, способы, где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах. Однако SBP может также включать по меньшей мере 10 последовательных аминокислот из любого одного или нескольких SEQ ID NOs:1-112.
Изобретательские композиции и предоставляемые изобретательские способы могут быть использованы там, где область заболевания представляет собой опухоль и где млекопитающим является человек-пациент.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ЧЕРТЕЖЕЙ
Фиг.1 показывает общий принцип слияния связывающего пептида с терапевтическим или диагностическим агентом. В примере, показанном в этом чертеже, терапевтический агент представляет собой антительный Fc домен.
Фиг.2 показывает общую стратегию итеративного скрининга библиотеки фагового дисплея.
Фиг.3 показывает последовательности, идентифицированные после скрининга пептидной библиотеки фагового дисплея на связывание со SPARC определенное число раз, последовательность изолируется.
Фиг.4 показывает последовательности, идентифицированные после скрининга пептидной библиотеки фагового дисплея на связывание со SPARC посредством авидности связывания со SPARC (как указано посредством OD).
Фиг.5 показывает клонирование пептида пептидов PD15 или PD21 в вектор pFUSE-hIgG1-Fc с получением PD15 или PD21 Fc слитого белка.
Фиг.6 демонстрирует последовательность ДНК, полученную в результате клонирования последовательностей, кодирующих пептид 15 и пептид 21 в вектор pFUSE-hIgG1-Fc, кодирующий слитые белки пептид-Fc.
Фиг.7 показывает экспрессированные и очищенные слитые белки PD15-Fc и PD21-Fc при электрофорезе в полиакриламидном геле.
Фиг.8 показывает Проточип, используемый для определения отдаленных мишеней связывания PD15 и PD21.
Фиг.9 представляет собой график анализов связывания ELISA [фермент-связанный иммуносорбентный анализ], сравнивающий авидность связывания SPARC при посредстве PD15 и PD21 с авидностью связывания анти-SPARC антитела.
Фиг.10 представляет микрофотографии иммуногистологических исследований, выполненных на срезах опухоли человека, демонстрирующих опухолевую экспрессию SPARC с использованием анти-SPARC антитела (R&D Анти SPARC). Отрицательный контроль анти-Герцептиновое антитело (только Fc фрагмент) и слитый белок Стаблин-связывающий пептид-Fc (stab-Fc) не окрашивают опухоль.
Фиг.11 показывает гистологическое окрашивание экспрессирующей SPARC опухоли, демонстрируя связывание PD15 и PD21 с экспрессирующими SPARC клетками опухоли.
Фиг.12 показывает потенциальный сайт связывания SPARC на эластине.
Фиг.13 показывает противоопухолевую активность PD15 и PD21 в раковой опухоли предстательной железы человека/модельной системе голой мыши.
Фиг.14 показывает противоопухолевую активность PD15 и PD21 в раковой опухоли молочной железы человека/модельной системе голой мыши.
Фиг.15 показывает два полипептида svFc, ScFv 3-1 и ScFv 3-2 со SPARC-связывающей активностью.
Фиг.16 показывает два полипептида svFc, ScFv 2-1 и ScFv 2-2 со SPARC-связывающей активностью.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
SBP и ABP представляют собой «пептидные лигандные домены». Термин «пептидный лигандный домен» означает аминокислотную последовательность, которая может существовать сама по себе и/или в большей полипептидной последовательности и которая связывает другую биомолекулу со специфичностью. Например, основная транспортная система крови для жирных кислот, билирубина, триптофана, кальция, стероидных гормонов и других физиологически важных соединений вовлекает связывание этих биомолекул с сывороточным альбумином. Связывание этих биомолекул происходит в дискретных сайтах в аминокислотных последовательностях альбумина, т.е. в пептидных лигандных доменах в сывороточном альбумине.
Изобретение предоставляет композиции для доставки терапевтического или диагностического агента в область заболевания млекопитающего, включающие терапевтически или диагностически эффективное количество фармацевтической композиции, включающей терапевтический или диагностический агент, соединенный со SPARC-связывающим пептидом («SBP») и фармацевтически приемлемым носителем («изобретательские композиции» и «изобретательские способы»). Настоящее изобретение включает композиции и способы, где SBP включает пептид с последовательностью любого одного или нескольких SEQ ID NOs:1-117, более желательно любого одного или нескольких SEQ ID NOs:1-5 или одного или нескольких гомологов любого одного из SEQ ID NOs:1-117.
Термин «гомолог» означает полипептид, имеющий существенно сходную аминокислотную последовательность с первоначальной последовательностью и проявляющий релевантные свойства, которые существенно сходны со свойствами, проявляемыми первоначальной последовательностью. Иллюстрацией одного из таких свойств является способность модулировать тканевое распределение активного агента, где гомолог SEQ ID NOs:1-117 был бы способен обеспечить существенно сходный уровень модуляции с уровнем, предоставляемым SEQ ID NOs:1-117. В этом контексте, например, и при желании гомолог SEQ ID NOs:1-117, проявляющий такую существенно сходную модуляцию, обеспечивал бы уровень в крови активного агента по меньшей мере примерно 80%, предпочтительно по меньшей мере примерно 85%, более предпочтительно по меньшей мере примерно 90% и наиболее предпочтительно по меньшей мере примерно 95% относительно уровня, предоставляемого SEQ ID NOs:1-117. Альтернативно, термин «гомолог» также относится к, например, пептидной последовательности из по меньшей мере 6 последовательных аминокислот, предпочтительно по меньшей мере 7 последовательных аминокислот, более предпочтительно по меньшей мере 8 последовательных аминокислот, даже более предпочтительно по меньшей мере 9 последовательных аминокислот, наиболее предпочтительно по меньшей мере 10 последовательных аминокислот любой одной из SEQ ID NOs:1-112 и наиболее желательно любой одной или нескольких SEQ ID NOs:1-5.
Композиции и способы, предоставляемые по изобретению, также включают ABP, включающие SEQ ID NOs:119 или 120, или оба SEQ ID NOs:119 и 120, и их гомологи. Способы в соответствии с изобретением далее включают, например, оба [белка], где SBP и ABP находятся в одном и том же полипептиде и где SBP и ABP находятся в различных полипептидах.
В контексте изменений относительно первоначальной последовательности будет желательно, если гомолог первоначальной последовательности по меньшей мере примерно на 80% идентичен первоначальной последовательности, предпочтительно по меньшей мере примерно на 90% идентичен первоначальной последовательности, даже более предпочтительно по меньшей мере примерно на 95% идентичен первоначальной последовательности и наиболее предпочтительно по меньшей мере примерно на 99% идентичен первоначальной последовательности.
Как использовано в данном описании, «процент идентичности последовательностей» означает значение, определенное путем сравнения двух оптимально выровненных последовательностей в пределах окна сравнения. Дополнительно часть полипептидной последовательности в окне сравнения может включать добавления или делеции (т.е. бреши) по сравнению с эталонной последовательностью (которая не включает добавления или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определения числа положений, в которых идентичные аминокислотные остатки встречаются в обеих последовательностях, с получением определенного числа положений спаривания, деления числа положений спаривания на общее число положений в окне сравнения и умножения полученного результата на 100 с получением процента идентичности последовательностей. Предпочтительно оптимальное выравнивание проводится с использованием алгоритма гомологичного выравнивания Needleman и Wunsch (1970) J. Mol Biol. 48:443 453.
Также желательно, чтобы в случае, когда гомологи не содержат идентичных аминокислот, мутации приводят только к консервативным аминокислотным изменениям. В связи с этим положения остатков, которые не являются идентичными, отличаются, так что аминокислотные остатки замещаются на другие аминокислотные остатки со сходными химическими свойствами (например, заряд или гидрофобность) и поэтому не изменяют функциональные свойства молекулы. В случае если последовательности отличаются по консервативным заменам, процент идентичности последовательностей может быть отрегулирован в сторону увеличения коррекцией консервативной природы замены. Говорят, что последовательности, которые отличаются по таким консервативным заменам, проявляют «сходство последовательностей» или «сходство». Средства для проведения этой регулировки хорошо известны специалистам в данной области.
Затем далее приводится пример для понимания «консервативной» аминокислотной замены или изменения в контексте настоящего изобретения. Группы A-F перечислены ниже. Замещение одного члена следующих групп другим членом этой же группы считается «консервативной» заменой.
Группа A включает лейцин, изолейцин, валин, метионин, фенилаланин, серин, цистеин, треонин и модифицированные аминокислоты, имеющие следующие боковые цепи: этил, изобутил, -CH2CH2OH, -CH2CH2CH2OH, -CH2CHOHCH3 и CH2SCH3.
Группа B включает глицин, аланин, валин, серин, цистеин, треонин и модифицированную аминокислоту, имеющую этил боковой цепи.
Группа C включает фенилаланин, фенилглицин, тирозин, триптофан, циклогексилметил и модифицированные аминоостатки, имеющие замещенные бензил или фенил боковых цепей.
Группа D включает глутаминовую кислоту, аспарагиновую кислоту, замещенный или незамещенный алифатический, ароматический или бензиловый сложный эфир глутаминовой или аспарагиновой кислоты (например, метил, этил, н-пропил, изо-пропил, циклогексил, бензил или замещенный бензил), глутамин, аспарагин, CO-NH-алкилированный глутамин или аспарагин (например, метил, этил, н-пропил и изо-пропил), и модифицированные аминокислоты, имеющие боковую цепь -(CH2)3COOH, ее сложный эфир (замещенный или незамещенный алифатический, ароматический или бензиловый сложный эфир), ее амид и ее замещенный или незамещенный N-алкилированный амид.
Группа E включает гистидин, лизин, аргинин, N-нитроаргинин, п-циклоаргинин, г-гидроксиаргинин, N-амидиноцитрулин, 2-амино гуанидиномасляную кислоту, гомологи лизина, гомологи аргинина и орнитин.
Группа F включает серин, треонин, цистеин и модифицированные аминокислоты, имеющие C1-C5 прямые или разветвленные алкильные боковые цепи, замещенные с использованием -OH или -SH.
Изобретение далее предоставляет композиции, включающие конъюгированную молекулу; конъюгированная молекула включает пептидный лигандный домен, конъюгированный с активным агентом, где пептидный лигандный домен включает вплоть до дополнительно примерно 50 аминокислот, предпочтительно вплоть до дополнительно примерно 25 аминокислот, более предпочтительно вплоть до дополнительно примерно 15 аминокислот и наиболее предпочтительно вплоть до дополнительно примерно 10 аминокислот, добавленных к N- или C-концу или к обоим концам. Полученные в результате полипептиды, которые находятся в соответствии с изобретением, включают полипептиды, которые имеют менее чем 50, менее чем 40, менее чем 30, менее чем 25 или менее чем 20 аминокислот общей длины.
Изобретение далее предоставляет композиции, включающие конъюгированную молекулу; конъюгированная молекула включает SBP, конъюгированный с активным агентом, где имеются один или множество SBP, включающих любой один из SEQ ID NOs:1-137, 141-143 и наиболее желательно любой один или несколько из SEQ ID NOs:1-2 и 135-137, 141-143.
Изобретение далее предоставляет изолированные полинуклеотиды, которые кодируют полипептиды, имеющие аминокислотную последовательность пептидного лиганд-связывающего домена, включая полипептиды с указанной дополнительной аминокислотой, добавленной к N- или C-концу.
II. Способы получения пептидов в соответствии с изобретением
Содержащие пептидный лигандный домен полипептиды, предоставляемые настоящим изобретением, могут быть синтезированы, определены, количественно проанализированы и очищены с использованием известных методик. Например, клетки, экспрессирующие экзогенные, содержащие пептидный лигандный домен полипептиды, могут быть генерированы путем помещения кДНК под контроль сильного промотора/сайта инициации трансляции и вектора, трансфицирующего или трансформирующего приемлемые прокариотические или эукариотические клетки для запуска экспрессии содержащих пептидный лигандный домен полипептидов посредством методов, хорошо известных специалистам в данной области. Альтернативно, содержащие пептидный лигандный домен полипептиды могут быть получены химически посредством методов, хорошо известных специалистам в данной области.
Содержащие пептидный лигандный домен полипептиды могут быть получены путем стандартного твердофазного синтеза. Как общеизвестно, пептиды необходимой длины могут быть получены с использованием коммерчески приемлемого оборудования и реагентов, следуя инструкциям по получению для блокирования мешающих групп, защиты аминокислоты для вступления в реакцию, соединения, снятия защитных групп и кепирования непрореагировавших остатков. Приемлемое оборудование может быть получено, например, от Applied BioSystems, Фостер Сити, Калифорния или от BioSearch Corporation в Сан-Рафаэль, Калифорния.
Например, пептиды синтезируются с использованием протоколов стандартного автоматизированного твердофазного синтеза с применением т-бутоксикарбонил-альфа-аминокислот с соответствующей защитой боковой цепи. Полные пептиды удаляются с твердофазной подложки с одновременным снятием защиты боковой цепи с использованием стандартного метода на основе водород фторида. Неочищенные пептиды далее очищают посредством полупрепаративной обращенно-фазовой ВЭЖХ (Vydac C18) с использованием градиентов ацетонитрила в 0,1% трифторуксусной кислоте (TFA). Пептиды сушат в вакууме с удалением ацетонитрила и лиофилизируют из раствора 0,1% TFA в воде. Чистоту проверяют посредством аналитической обращенно-фазовой ВЭЖХ. Пептиды могут быть лиофилизированы и затем солюбилизированы в воде или в 0,01 М уксусной кислоте в концентрациях 1-2 мг/мл по массе.
Использование вышеупомянутых синтетических методов требуется, если в пептидах встречаются некодируемые аминокислоты или D-формы аминокислот. Однако пептиды, которые кодируются генами, могут быть также получены посредством рекомбинантных методик с использованием легкосинтезируемых последовательностей ДНК в коммерчески пригодных экспрессионных системах.
Изобретение в связи с этим предоставляет рекомбинантный вектор, включающий элементы, контролирующие экспрессию полинуклеотидной последовательности, кодирующей содержащий пептидный лигандный домен полипептид. Дополнительно изобретение предоставляет клетку, включающую нуклеиновую кислоту, кодирующую содержащий пептидный лигандный домен полипептид, где клетка представляет собой прокариотическую клетку или эукариотическую клетку. Методы микробного или тканевого культивирования хорошо известны специалистам в данной области (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 16.1-16.54). Изобретение, таким образом, предоставляет способ получения содержащих пептидный лигандный домен полипептидов, включающий: а) трансформацию клеток нуклеиновой кислотой, кодирующей полипептид по пункту 1; б) индукцию экспрессии полипептида трансформированной клеткой; и в) очистку полипептида.
Белковая экспрессия зависит от уровня транскрипции РНК, которая в свою очередь регулируется сигналами ДНК. Аналогично для трансляции мРНК требуется как минимум инициирующий кодон AUG, который обычно локализован в пределах 10-100 нуклеотидов 5'-конца матричной РНК. Было показано, что последовательности, фланкирующие инициирующий кодон AUG, влияют на его распознавание. Например, для распознавания эукариотическими рибосомами инициирующие кодоны AUG встроены в последовательности, соответствующие полной «консенсусной последовательности Козака», обеспечивающей оптимальную трансляцию (смотри Kozak, J. Molec. Biol. 196:947-950 (1987)). Также для успешной экспрессии экзогенной нуклеиновой кислоты в клетке может потребоваться посттрансляционная модификация полученного белка.
Молекулы нуклеиновой кислоты, описанные в данном описании, предпочтительно включают кодирующую область, функционально сцепленную с приемлемым промотором, например, промотором, функциональным в эукариотических клетках. Вирусные промоторы, такие как без ограничения промотор RSV [вирус саркомы Рауса] и главный поздний промотор аденовируса могут быть использованы в изобретении. Приемлемые невирусные промоторы включают, но не ограничиваясь ими, промотор [гена] фосфоглицеролкиназы (PGK) и промотор [гена] фактора элонгации 1α. Невирусные промоторы представляют собой желательно промоторы человека. Дополнительные приемлемые генетические элементы, многие из которых известны в данной области, также могут быть прикреплены или встроены в изобретательскую нуклеиновую кислоту и конструкции с обеспечением дополнительных функций, уровня экспрессии или паттерна экспрессии.
Дополнительно молекулы нуклеиновой кислоты, описанные в данном описании, могут быть функционально сцеплены с энхансерами для облегчения транскрипции. Энхансеры представляют собой цис-действующие элементы ДНК, которые стимулируют транскрипцию соседних генов. Примеры энхансеров, которые обеспечивают высокий уровень транскрипции на сцепленных генах в ряде различных клеточных типов многих видов, включают без ограничения энхансеры из SV40 [вирус обезьян 40] и LTR [длинный концевой повтор] RSV. Такие энхансеры могут быть скомбинированы с другими энхансерами, которые проявляют специфичные для клеточного типа эффекты, или любой энхансер может быть использован индивидуально.
Для оптимизации выработки белка в эукариотических клетках молекула изобретательской нуклеиновой кислоты может далее включать сайт полиаденилирования после кодирующей области молекулы нуклеиновой кислоты. Также предпочтительно, если все соответствующие транскрипционные сигналы (и трансляционные сигналы в необходимых случаях) будут точно согласованы, так что экзогенная нуклеиновая кислота будет правильно экспрессироваться в клетках, в которые она введена. При желании экзогенная нуклеиновая кислота также может вводиться в сайты сплайсинга (т.е. акцепторные и донорные сайты сплайсинга) для облегчения выработки мРНК-полноразмерного транскрипта помимо поддержания в рамке. Кроме того, молекулы изобретательской нуклеиновой кислоты могут далее включать соответствующие последовательности для процессинга, секреции, внутриклеточной локализации и подобное.
Молекулы нуклеиновой кислоты могут быть встроены в любой приемлемый вектор. Приемлемые векторы включают без ограничения вирусные векторы. Приемлемые вирусные векторы включают без ограничения ретровирусные векторы, альфавирусные, векторы [на основе] вируса осповакцины, аденовирусные, аденоассоциированные вирусные, герпесвирусные и векторы [на основе] вируса оспы птиц. Векторы предпочтительно обладают природной или созданной с помощью генетической инженерии способностью к трансформации эукариотических клеток, например, клеток CHO-K1. Дополнительно векторы, полезные в контексте изобретения, могут представлять собой «голые» [депротеинизированные] векторы на основе нуклеиновой кислоты (т.е. векторы, содержащие небольшое количество [белка] или не содержащие белки, сахара и/или липиды, инкапсулированные в них), такие как плазмиды или эписомы, или векторы могут быть связаны с другими молекулами. Другие молекулы, которые могут быть приемлемо скомбинированы с изобретательскими нуклеиновыми кислотами, включают без ограничения вирусные оболочки, катионные липиды, липосомы, полиамины, частицы золота и мишенные части, такие как лиганды, рецепторы или антитела, которые нацеливаются на клеточные молекулы.
Молекулы нуклеиновых кислот, описанные в данном описании, могут трансформировать любую приемлемую клетку, обычно эукариотическую клетку, такую как CHO, HEK293 или BHK, что желательно приводит к экспрессии содержащего пептидный лигандный домен полипептида, такого как, например, полипептид, включающий SEQ ID NOs:1-120 или его гомологи, как описано в данном описании. Клетка может быть культивирована с обеспечением экспрессии молекулы нуклеиновой кислоты и поэтому вырабатывает содержащий пептидный лигандный домен полипептид, такой как, например, полипептид, включающий аминокислотную последовательность SEQ ID NOs:1-120 или ее гомолог, как описано в данном описании.
Таким образом, изобретение предоставляет клетку, трансформированную или трансфицированную молекулой изобретательской нуклеиновой кислоты, описанной в данном описании. Средства трансформации или трансфекции клетки экзогенными молекулами ДНК хорошо известны в данной области. Например, без ограничения молекула ДНК вводится в клетку с использованием стандартных методик трансформации или трансфекции, хорошо известных в данной области, таких как опосредованная кальций-фосфатом или DEAE-декстраном трансфекция, слияние протопластов, электропорация, липосомы и прямая микроинъекция (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 1.1-1.162, 15.1-15.53, 16.1-16.54).
Другой пример метода трансформации представляет собой метод слияния протопластов; протопласты, полученные из бактерий, несущих большое число копий плазмиды, представляющей интерес, смешивают непосредственно с культивированными клетками млекопитающего. После слияния клеточных мембран (обычно с использованием полиэтиленгликоля) содержимое бактерий доставляется в цитоплазму клеток млекопитающего, и плазмидная ДНК переносится в ядро.
Электропорация, применение коротких электрических импульсов высокого напряжения, в различных клетках млекопитающих и растений ведет к образованию пор нанометрового размера в плазматической мембране. ДНК проникает непосредственно в клеточную цитоплазму через эти поры или в результате перераспределения мембранных компонентов, которые сопровождают закрытие пор. Электропорация может быть крайне эффективной и может быть использована для преходящей экспрессии клонов генов и для поддержания клеточных линий, которые несут интегрированные копии гена, представляющего интерес.
Такие методики могут быть использованы для стабильной и преходящей трансформации эукариотических клеток. Для изоляции стабильно трансформированных клеток требуется введение селектируемого маркера вместе с трансформацией гена, представляющего интерес. Такие селектируемые маркеры включают гены, которые обеспечивают резистентность к неомицину, а также ген HPRT в отрицательных по HPRT клетках. Для селекции может потребоваться длительное культивирование в селективной среде, по меньшей мере в течение примерно 2-7 дней, предпочтительно в течение по меньшей мере примерно 1-5 недель (смотри, например, Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (2001), pp. 16.1-16.54).
Содержащий пептидный лигандный домен полипептид может быть экспрессирован и очищен из рекомбинантной клетки-хозяина. Рекомбинантные клетки-хозяева могут быть прокариотическими или эукариотическими, включая, но не ограничиваясь ими, бактерии, такие как E. coli, грибные клетки, такие как дрожжи, клетки насекомых, включая, но не ограничиваясь ими, полученные из дрозофилы и тутового шелкопряда клеточные линии, и клетки и клеточные линии млекопитающих. При экспрессии содержащего пептидный лигандный домен полипептида в клетке, например, в клетке человека, или in vitro, или in vivo, кодоны, выбранные для такого полинуклеотида, кодирующего пептид, могут быть оптимизированы для данного типа клетки (т.е. видов). Много методов оптимизации кодонов известны в данной области (смотри, например, Jayaraj et al., Nucleic Acids Res. 33(9):3011-6 (2005); Fuglsang et al., Protein Expr. Purif. 31(2):247-9 (2003); Wu et al., «The Synthetic Gene Designer: a Flexible Web Platform to Explore Sequence Space of Synthetic Genes for Heterologous Expression» csbw, 2005 IEEE Computational Systems Bioinformatics Conference - Workshops (CSBW'05), pp. 258-259 (2005)).
Проблемы, которые должны быть рассмотрены для оптимальной полипептидной экспрессии в прокариотах, включают использование экспрессионных систем, селекцию штамма-хозяина, стабильность мРНК, смещение кодонов, образование телец включения и предотвращение [их образования], слитый белок и сайт-специфический протеолиз, компартмент-направленную секрецию (смотри Sorensen et al., Journal of Biotechnology 115 (2005) 113-128, которая включена в данное описание посредством ссылки).
Экспрессия обычно индуцируется плазмидой, содержащейся системой, совместимой с генетическим окружением. Генетические элементы экспрессионной плазмиды включают область инициации репликации (ori), маркер резистентности к антибиотику, транскрипционные промоторы, области инициации трансляции (TIR), а также транскрипционные и трансляционные терминаторы.
Может быть использована любая приемлемая экспрессионная система, например, Escherichia coli облегчает экспрессию белка посредством своей относительной простоты, высокой плотности культивирования, хорошо изученной генетикой и большим количеством совместимых средств, включая ряд пригодных плазмид, рекомбинантные слитые партнеры и мутантные штаммы, которые пригодны для полипептидной экспрессии. Штамм E. coli или генетическое окружение для рекомбинантной экспрессии являются в высшей степени важными. Экспрессионные штаммы должны быть дефектными по большинству вредных природных протеаз, поддерживать стабильность экспрессионной плазмиды и обеспечивать генетические элементы, релевантные к экспрессионной системе (например, DE3).
Число плазмидных копий контролируется областью инициации репликации, которая предпочтительно реплицируется в ослабленной форме (Baneyx, 1999). Репликон ColE1 присутствует в умеренных экспрессионных плазмидах, полученных из семейства плазмид pBR322 (число копий 15-20) или pUC (число копий 500-700), тогда как репликон p15A получен из pACYC184 (число копий 10-12). Большинство обычных маркеров лекарственной резистентности в рекомбинантных экспрессионных плазмидах обеспечивают резистентность к ампициллину, канамицину, хлорамфениколу или тетрациклину.
Экспрессионные системы [на основе] E. coli включают основанную на [фаге] T7 экспрессионную систему pET (запущенная в серийное производство Novagen), промотор лямбда PL/репрессор cI (например, Invitrogen pLEX), промотор Trc (например, Amersham Biosciences pTrc), промотор Tac (например, Amersham Biosciences pGEX) и гибрид lac/T5 (например, Qiagen pQE), промотор BAD (например, Invitrogen pBAD).
Для инициации трансляции с области инициации трансляции (TIR) транскрибированной матричной РНК требуется рибосомный сайт связывания (RBS), включающий последовательность Шайна-Дальгарно (SD) и кодон инициации трансляции. Последовательность Шайна-Дальгарно локализована в 7±2 нуклеотидах, вышележащих от инициирующего кодона, который представляет собой канонический AUG в эффективных рекомбинантных экспрессионных системах. Оптимальная инициация трансляции получается с мРНК с использованием SD-последовательности UAAGGAGG.
Использование кодонов в E. coli отражается уровнем сходных аминоацилированных тРНК, имеющихся в цитоплазме. Главные кодоны встречаются в высокой степени экспрессируемых генах, тогда как минорные или редкие кодоны проявляют тенденцию находиться в генах, экспрессируемых на низких уровнях. Кодоны, редкие в E. coli, часто имеются в избытке в гетерологичных генах из источников, таких как эукариоты, архебактерии и другие отдаленно родственные организмы с различной частотой предпочтения кодонов (Kane, 1995). Экспрессия генов, содержащих редкие кодоны, может привести к трансляционным ошибкам в результате рибосомной блокировки в положениях, требующих встраивания аминокислот, соединенных с минорным кодоном тРНК (McNulty et al., 2003). Проблемы смещения кодонов становятся крайне распространенными в рекомбинантных экспрессионных системах, когда транскрипты, содержащие редкие кодоны в кластерах, таких как дубликаты и триплеты, накапливаются в большом количестве.
Белковая активность требует сворачивания в точные трехмерные структуры. Стрессовые ситуации, такие как тепловой шок, нарушают сворачивание in vivo, и сворачивающиеся интермедиаты проявляют тенденцию к соединению в аморфные белковые гранулы, названные тельцами включения.
Тельца включения представляют собой набор структурно сложных агрегатов, часто воспринимаемых как стрессовый ответ, когда рекомбинантный белок экспрессируется с высокими скоростями. Макромолекулярное группирование белков в концентрациях 200-300 мг/мл в цитоплазме E. coli означает крайне неблагоприятные условия сворачивания белка, особенно в течение рекомбинантной экспрессии на высоком уровне (van den Berg et al., 1999). Неизвестно, формируются ли тельца включения посредством пассивного события, происходящего путем гидрофобного взаимодействия между экспозированными участками на несвернутых цепях, или путем специфических механизмов кластерирования (Villaverde and Carrio, 2003). Очищенные агрегаты могут быть солюбилизированы с использованием детергентов, подобных мочевине и гуанидия гидрохлорида. Природный белок может быть получен путем in vitro пересворачивания из солюбилизированных телец включения путем разведения, диализа или методами пересворачивания на колонке (Middelberg, 2002; Sorensen et al., 2003a).
Стратегии пересворачивания могут быть улучшены путем включения молекулярных шаперонов (Mogk et al., 2002). Оптимизация процедуры пересворачивания данного белка, однако, требует отнимающих много времени усилий и не всегда способствует высокому выходу продукта. Возможной стратегией предотвращения образования телец включения является совместная сверхэкспрессия молекулярных шаперонов.
Был разработан широкий диапазон белковых партнеров слияния, для того чтобы упростить процедуру очистки и экспрессии рекомбинантных белков (Stevens, 2000). Слитые белки или химерные белки обычно включают партнер или «метку», связанную с пассажиром или мишенным белком, посредством сайта распознавания для специфической протеазы. Большинство партнеров слияния используется для специфических стратегий аффинной очистки. Партнеры слияния также имеют преимущество in vivo, где они могут защищать пассажиров от внутриклеточного протеолиза (Jacquet et al., 1999; Martinez et al., 1995), увеличивать растворимость (Davis et al., 1999; Kapust and Waugh, 1999; Sorensen et al., 2003b) или использоваться как специфические экспрессионные репортеры (Waldo et al., 1999). Высокие уровни экспрессии часто могут переноситься с N-конца партнера слияния на слабо экспрессируемого пассажира, скорее всего как результат стабилизации мРНК (Arechaga et al., 2003). Обычные аффинные метки представляют собой полигистидиновую метку (His-метка), которая совместима с иммобилизованной металлом аффинной хроматографией (IMAC), и метку глутатион-S-трансферазы (GST) для очистки на основанных на глутатионе смолах. Имеются некоторые другие аффинные метки и [они] были подробно рассмотрены (Terpe, 2003).
Рекомбинантно экспрессируемые белки могут быть в принципе направлены в три различных участка, а именно, цитоплазму, периплазму или среду для культивирования. Различные преимущества и недостатки связаны с направлением рекомбинантного белка в специфический клеточный компартмент. Экспрессия в цитоплазме обычно предпочтительна, так как выход продукции является высоким. Образование дисульфидной связи сегрегировано в E. coli и активно катализируется в периплазме посредством системы Dsb (Rietsch and Beckwith, 1998). Снижение [уровня] цистеинов в цитоплазме достигается за счет тиоредоксина и глутаредоксина. Тиоредоксин сохраняется пониженным за счет тиоредоксинредуктазы и глутаредоксин - за счет глутатиона. Молекула глутатиона с низкой молекулярной массой восстанавливается глутатионредуктазой. Разрушение генов trxB и gor, кодирующих две редуктазы, обеспечивает образование дисульфидных связей в цитоплазме E. coli.
Основанные на клетках экспрессионные системы имеют недостатки по показателю качества и количества вырабатываемых белков и не всегда приспособлены для высокопроизводительной продукции. Многих из этих недостатков можно избежать путем использования бесклеточных трансляционных систем.
Бесклеточные системы in vitro экспрессии генов и синтеза белков были описаны для многих различных прокариотических и эукариотических систем (смотри Endo & Sawasaki Current Opinion in Biotechnology 2006, 17:373-380). Эукариотические бесклеточные системы, такие как лизат ретикулоцитов кролика и экстракт зародышей пшеницы, получены из неочищенного экстракта, содержащего все компоненты, необходимые для трансляции in vitro транскрибированных РНК-матриц. Эукариотические бесклеточные системы используют изолированную РНК, синтезированную in vivo или in vitro как матрицу для реакции трансляции (например, Системы Лизата Ретикулоцитов Кролика или Системы Экстракта Зародышей Пшеницы). Сопряженные эукариотические бесклеточные системы комбинируют прокариотическую фаговую РНК-полимеразу с эукариотическими экстрактами и используют экзогенную ДНК или генерированные с помощью ПЦР матрицы с фаговым промотором для in vitro белкового синтеза (например, TNT® сопряженная [система] лизата ретикулоцитов).
Белки, транслированные с использованием TNT® Сопряженных Систем, могут быть использованы для многих типов функциональных исследований. TNT® Сопряженные реакции Транскрипции/Трансляции в силу традиции были использованы для подтверждения открытых рамок считывания, изучения белковых мутаций и получения белков in vitro для исследований ДНК-белкового связывания, анализов белковой активности или исследований белок-белкового взаимодействия. Недавно белки, экспрессированные с использованием TNT® Сопряженных Систем, также были использованы в анализах для подтверждения взаимодействий в дрожжевой двугибридной [системе] при выполнении in vitro экспрессионного клонирования (IVEC) и получении белковых субстратов для анализов ферментативной активности или белковой модификации. Для составления списка последних ссылок по использованию TNT® сопряженных систем для различного применения, пожалуйста, посетите: www.promega.com/citations/.
Транскрипция и трансляция обычно сопряжены в прокариотических системах; а именно, они содержат эндогенную или фаговую РНК-полимеразу, которая транскрибирует мРНК с экзогенной ДНК-матрицы. Эта РНК затем используется как матрица для трансляции. ДНК матрица может быть геном, клонированным в плазмидный вектор (кДНК), или генерированной посредством ПЦР(a) матрицей. Рибосома-связывающий сайт (RBS) необходим для матриц, транслированных в прокариотических системах. В процессе транскрипции 5'-конец мРНК становится доступным для рибосомного связывания и инициации трансляции, допуская транскрипцию и трансляцию, которые происходят одновременно. Пригодными являются прокариотические системы, которые используют ДНК-матрицы, содержащие прокариотические промоторы (такие как lac или tac; Экстракционная Система [на основе] E. coli S30 для Кольцевой или Линейной ДНК или фаговый промотор РНК-полимеразы; Экстракционная система [на основе] E. coli T7 S30 Кольцевой ДНК для Растворимости очищенного, содержащего пептидный лигандный домен полипептида, может быть улучшена с помощью методов, известных в данной области. Например, для увеличения растворимости экспрессированного белка (например, E. coli) она может снижать скорость белкового синтеза путем снижения роста температуры с использованием более слабого промотора, с использованием низкокопийной плазмиды, снижения концентрации индуктора, изменения ростовой среды, как описано у Georgiou & Valax (Current Opinion Biotechnol. 7:190-197(1996)). Это снижает скорость белкового синтеза и обычно приводит к получению более растворимого белка. Также могут быть добавлены простетические группы или кофакторы, которые являются важными для правильного сворачивания или белковой стабильности, или добавлен буфер для контроля флуктуаций pH в среде в процессе роста, или добавлена 1% глюкоза для подавления индукции промотора lac посредством лактозы, которая присутствует в более обогащенной среде (такой как LB, 2xYT). Полиолы (например, сорбит) и сахароза могут быть также добавлены в среду, поскольку увеличение осмотического давления, вызванное этими добавками, ведет к накоплению осмопротектантов в клетке, которые стабилизируют природную белковую структуру. Могут быть добавлены этанол, низкомолекулярные тиолы и дисульфиды и NaCl. Дополнительно шапероны и/или фолдазы могут быть совместно экспрессированы с желательным полипептидом. Молекулярные шапероны стимулируют правильную изомеризацию и клеточное нацеливание путем преходящего взаимодействия со свернутыми интермедиатами. Шаперонные системы E. coli включают, но не ограничиваясь ими, GroES-GroEL, DnaK-DnaJ-GrpE, CIpB.
Фолдазы ускоряют скорость-лимитирующие стадии вдоль пути сворачивания. Три типа фолдаз играют важную роль: пептидил пролил цис/транс изомеразы (PPI), дисульфид оксидоредуктаза (DsbA) и дисульфид изомераза (DsbC), протеин дисульфид изомераза (PDI), которая представляет собой эукариотический белок, который катализирует окисление белкового цистеина и изомеризацию дисульфидной связи. Совместная экспрессия одного или нескольких этих белков с мишенным белком может привести [к получению] более высоких уровней растворимого мишенного белка.
Содержащий пептидный лигандный домен полипептид может быть получен в виде слитого белка для улучшения его растворимости и продукции. Слитый белок включает содержащий пептидный лигандный домен полипептид и второй полипептид, слитый вместе в рамке. Второй полипептид может представлять собой слитый партнер, известный в данной области, для улучшения растворимости полипептида, с которым он сливается, например, NusA, бактериоферритин (BFR), GrpE, тиоредоксин (TRX) и глутатион-S-трансфераза (GST). Novagen Inc. (Мэдисон, Висконсин) предоставляет векторные серии pET 43.1, которые обеспечивают образование слияния NusA-мишень. Также были показаны положительные эффекты DsbA и DsbC на уровни экспрессии при их использовании в качестве партнера слияния, поэтому [они] могут быть использованы для слияния с пептидным лигандным доменом для достижения более высокой растворимости.
В аспекте таких слитых белков экспрессированный, содержащий пептидный лигандный домен полипептид включает линкерный полипептид, включающий сайт расщепления протеазы, включающий пептидную связь, которая гидролизуется протеазой. В результате пептидный лигандный домен в полипептиде может быть выделен из оставшегося полипептида после экспрессии посредством протеолиза. Линкер может включать одну или несколько дополнительных аминокислот на любой стороне связи, с которыми каталитический сайт протеазы также связывается (смотри, например, Schecter & Berger, Biochem. Biophys. Res. Commun. 27,157-62 (1967)). Альтернативно, сайт расщепления линкера может быть выделен из сайта распознавания протеазы и два сайта расщепления и сайт распознавания могут быть разделены одной или несколькими (например, от двух до четырех) аминокислотами. В одном аспекте линкер включает по меньшей мере примерно 2, 3, 4, 5, 6, 7, 8, 9, примерно 10, примерно 20, примерно 30, примерно 40, примерно 50 или более аминокислот. Более предпочтительно линкер содержит от примерно 5 до примерно 25 аминокислот в длину, и наиболее предпочтительно линкер содержит от примерно 8 до примерно 15 аминокислот в длину.
Некоторые протеазы, полезные в соответствии с изобретением, обсуждаются в следующих ссылках: Hooper et al., Biochem. J. 321:265-279 (1997); Werb, Cell 91:439-442 (1997); Wolfsberg et al., J. Cell Biol. 131:275-278 (1995); Murakami & Etlinger, Biochem. Biophys. Res. Comm. 146:1249-1259 (1987); Berg et al., Biochem J. 307:313-326 (1995); Smyth and Trapani, Immunology Today 16:202-206 (1995); Talanian et al., J. Biol. Chem. 272:9677-9682 (1997); и Thornberry et al., J. Biol. Chem. 272:17907-17911 (1997). Клеточноповерхностные протеазы также могут быть использованы с расщепляемыми линкерами в соответствии с изобретением и включают, но не ограничиваясь ими: Аминопептидазу N; Пиромицин-чувствительную аминопептидазу; Ангиотензин-превращающий фермент; Пироглутамил пептидазу II; Дипептидил пептидазу IV; N-аргинин двухосновную конвертазу; Эндопептидазу 24.15; Эндопептидазу 24.16; Секретазы альфа, бета и гамма амилоидного белка-предшественника; Секретазу ангиотензин-превращающего фермента; Секретазу TGF альфа [трансформирующий фактор роста альфа]; Секретазу TNF альфа [фактор некроза опухоли альфа]; Секретазу FAS-лиганда; Секретазы рецептора-I и -II TNF; Секретазу CD30; Секретазы KL1 и KL2; Секретазу рецептора IL6; Секретазу CD43, CD44; Секретазы CD16-I и CD16-II; Секретазу L-селектина; Секретазу рецептора фолата; MMP 1,2, 3,7, 8,9, 10,11, 12,13, 14 и 15; Активатор плазминогена урокиназного [типа]; Активатор плазминогена тканевого [типа]; Плазмин; Тромбин; BMP-1 (C-пептидаза проколлагена); ADAM 1,2, 3,4, 5,6, 7,8, 9,10 и 11; и Гранзимы A, B, C, D, E, F, G и H.
Альтернативно к основанным на ассоциации с клетками протеазам они используются как саморасщепляемые линкеры. Например, протеаза 2A вируса ящера (FMDV) может быть использована как линкер. Она представляет собой короткий полипептид из 17 аминокислот, который расщепляет полипротеин FMDV по соединению 2A/2B. Последовательность пропептида 2A FMDV представляет собой NFDLLKLAGDVESNPGP. Расщепление происходит по C-концу пептида в концевой глицин-пролиновой аминокислотной паре и не зависит от присутствия других последовательностей FMDV, и расщепление происходит даже в присутствии гетерологичных последовательностей.
Аффинная хроматография может быть использована индивидуально или вместе с ионообменными, определяющими размер молекул или ВЭЖХ хроматографическими методиками очистки содержащих пептидный лигандный домен полипептидов. Такой хроматографический подход может быть выполнен с использованием колонок или в серийных форматах. Такие хроматографические методы очистки хорошо известны в данной области.
Дополнительно изобретение предоставляет изолированные нуклеиновые кислоты, кодирующие содержащие пептидный лигандный домен полипептиды с одной или несколькими аминокислотными заменами и инсерциями или делециями от 1 до примерно 5 аминокислот, предпочтительно от 1 до примерно 3 аминокислот, более предпочтительно 1 аминокислоту в последовательностях SEQ ID NOs:1-117, где релевантные свойства являются существенно сходными со свойствами, проявляемыми первоначальной последовательностью.
Мутагенез может быть проведен с помощью любого из нескольких методов, известных в данной области. Обычно мутагенез может выполняться путем клонирования последовательности нуклеиновой кислоты в плазмиду или какой-нибудь другой вектор для облегчения манипуляции с последовательностью. Затем уникальный сайт рестрикции, в который дополнительные нуклеиновые кислоты могут быть добавлены в последовательность нуклеиновой кислоты, идентифицируют или включают в последовательность нуклеиновой кислоты. Двунитевой синтетический олигонуклеотид обычно создается из перекрывающихся синтетических однонитевых смысловых и антисмысловых олигонуклеотидов, так что двунитевой олигонуклеотид включается в рестрикционные сайты, фланкирующие мишенную последовательность, и, например, может быть использован для включения замещающей ДНК. Плазмида или другой вектор расщепляется рестрикционным ферментом, и олигонуклеотидная последовательность, имеющая совместимые липкие концы, легируется в плазмидный или другой вектор для замещения первоначальной ДНК.
Другие средства in vitro сайт-направленного мутагенеза известны специалистам в данной области и могут быть выполнены (в частности, с использованием полимеразной цепной реакции (ПЦР) с перекрыванием-достройкой, смотри, например, Parikh & Guengerich, Biotechniques 24:428-431 (1998)). Комплементарные праймеры, перекрывающие сайт изменения, могут быть использованы для ПЦР-амплификации целой плазмиды в смеси, содержащей 500 мМ дНТФ, 2 единицы полимеразы Pfu, 250 нг каждого смыслового и антисмыслового праймеров и 200 нг плазмидной ДНК, включающей последовательность, кодирующую содержащий пептидный лигандный домен полипептид. ПЦР желательно включает 18 циклов с временем достройки 2,5 минуты для каждой т.п.н. ДНК. ПЦР-продукты могут быть обработаны DpnI (которая переваривает только метилированную по аденину плазмидную ДНК) и трансформированы в клетки Escherichia coli DH5α. Трансформанты могут быть скринированы посредством переваривания рестрикционным ферментом для включения изменений, которые затем могут быть подтверждены анализом последовательности ДНК.
Приемлемые методы определения белка и количественного анализа содержащих пептидный лигандный домен полипептидов включают вестерн-блот, фермент-связанный иммуносорбентный анализ (ELISA), окрашивание серебром, BCA анализ (смотри, например, Smith et al., Anal. Biochem., 150,76-85 (1985)), анализ белка по Лоури (описан в Lowry et al., J. Biol. Chem., 193,265-275 (1951)), который представляет собой колориметрический анализ, основанный на комплексах белок-медь, и анализ белка по Брэдфорду (описан в Bradford et al., Anal. Biochem., 72,248 (1976)), который зависит от изменения абсорбции Кумасси голубого G-250 при белковом связывании. После экспрессии содержащие пептидный лигандный домен полипептиды могут быть очищены посредством традиционных методов очистки, таких как ионообменная, ситовая или C18 хроматография.
III. Методы соединения пептидных лигандных доменов
Методы «соединения» (или «конъюгации» или «сшивки») приемлемых активных агентов, таких как, например, терапевтические средства, химиотерапевтические средства, радионуклиды, полипептиды и подобное, с содержащим пептидный лигандный домен полипептидом основательно описаны в данной области. Для получения конъюгатов, предоставленных в данном описании, активный агент связывается непосредственно или опосредовано с пептидным лигандным доменом с помощью метода, известного в настоящее время в данной области, для скрепления двух частей, пока скрепление конъюгированной или соединенной части с пептидным лигандным доменом не существенно затрудняет функцию пептидного лигандного домена или не существенно затрудняет функцию активного агента. Соединение может происходить при помощи любых приемлемых средств, включая, но не ограничиваясь ими, ионные и ковалентные связи и любую другую достаточно стабильную ассоциацию, посредством чего распределение мишенных агентов будет модулироваться.
Многочисленные гетеробифункциональные сшивающие реагенты, которые используются для образования ковалентных связей между аминогруппами и тиоловыми группами и для введения тиоловых групп в белки известны специалистам в этой области (смотри, например, Cumber et al., (1992) Bioconjugate Chem. 3':397 401; Thorpe et al., (1987) Cancer Res. 47:5924 5931; Gordon et al. (1987) Proc. Natl. Acad. Sci. 84:308 312; Walden et al. (1986) J. Mol. Cell Immunol. 2:191 197; Carlsson et al. (1978) Biochem. J. 173:723 737; Mahan et al. (1987) Anal. Biochem. 162:163 170; Wawryznaczak et al. (1992) Br. J. Cancer 66:361 366; Fattom et al. (1992) Infection & Immun. 60:584 589). Эти реагенты могут быть использованы для образования ковалентных связей между пептидным лигандным доменом или содержащим пептидный лигандный домен полипептидом и любым из активных агентов, раскрытых в данном описании. Эти реагенты включают, но не ограничиваясь ими: N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP; дисульфидный линкер); сульфосукцинимидил 6-[3-(2-пиридилдитио)пропионамидо]гексаноат (сульфо-LC-SPDP); сукцинимидилоксикарбонил-α-метил бензил тиосульфат (SMBT, защищенный дисульфатный линкер); сукцинимидил 6-[3-(2-пиридилдитио)пропионамидо]гексаноат (LC-SPDP); сульфосукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC); сукцинимидил 3-(2-пиридилдитио)бутират (SPDB; защищенный линкер дисульфидной связи); сульфосукцинимидил 2-(7-азидо-4-метилкумарин-3-ацетамид)этил-1,3-дитиопропионат (SAED); сульфо-сукцинимидил 7-азидо-4-метилкумарин-3-ацетат (SAMCA); сульфосукцинимидил 6-[альфа-метил-альфа-(2-пиридилдитио)толуамидо]гексаноат (сульфо-LC-SMPT); 1,4-ди-[3'-(2'-пиридилдитио)пропионамидо]бутан (DPDPB); 4-сукцинимидилоксикарбонил-α-метил-α.-(2-пиридилдитио)-толуол (SMPT, защищенный дисульфидный линкер); сульфосукцинимидил6[α.-метил-α.-(2-пиридилдитио)тлуамидо]гексаноат (сульфо-LC-SMPT); сложный эфир м-малеимидобензоил-N-гидроксисукциниимида (MBS); сложный эфир м-малеимидобензоил-N-гидроксисульфосукциниимида (сульфо-MBS); N-сукцинимидил(4-йодацетил)аминобензоат (SIAB; тиоэфирный линкер); сульфосукцинимидил(4-йодацетил)аминобензоат (сульфо-SIAB); сукцинимидил4(п-малеимидофенил)бутират (SMPB); сукцинимидил-4-(п-малеимидофенил)бутират) (сульфо-SMPB); азидобензоил гидразид (ABH).
Другие гетеробифункциональные расщепляемые сшивающие агенты включают N-сукцинимидил (4-йодацетил)-аминобензоат; сульфосукцинимидил (4-йодацетил)-аминобензоат; 4-сукцинимидил-оксикарбонил-a-(2-пиридилдитио)-толуол; сульфосукцинимидил-6-[a-метил-a-(пиридилдитио)-толуамидо]гексаноат; N-сукцинимидил-3-(-2-пиридилдитио)пропионат; сукцинимидил 6[3(-(-2-пиридилдитио)-пропионамидо]гексаноат; сульфосукцинимидил 6[3(-(-2-пиридилдитио)-пропионамидо]гексаноат; 3-(2-пиридилдитио)-пропионил гидразид, реактив Элмана, дихлортриазиновую кислоту, S-(2-тиопиридил)-L-цистеин. Дальнейшие примеры бифункциональных связывающих соединений раскрыты в патентах США № 5349066, 5618528, 4569789, 4952394 и 5137877.
Альтернативно, например, полипептидные сульфгидрильные группы могут быть использованы для конъюгации. Дополнительно сахарные части связываются с гликопротеинами, например, антитела могут быть окислены с получением альдегидных групп, полезных для ряда методик соединения, известных в данной области. Конъюгаты, образованные в соответствии с изобретением, могут быть стабильными in vivo или лабильными, как, например, ферментативно расщепляемые тетрапептидные связи или кислотолабильные цис-аконитиловые или гидразоновые связи.
Содержащий пептидный лигандный домен полипетид при необходимости связывается с активным агентом через один или несколько линкеров. Линкерная часть выбирается в зависимости от желательных свойств. Например, длина линкерной части может быть выбрана для оптимизации кинетики и специфичности лигандного связывания, включая любые конформационные изменения, индуцированные посредством связывания лиганда с мишенным рецептором. Линкерная часть должна быть достаточно длинной и достаточно гибкой для предоставления возможности полипептидной лигандной части и мишенного клеточного рецептора к свободному взаимодействию. Если линкер слишком короткий или слишком жесткий, может происходить стерическое затруднение между полипептидной лигандной частью и клеточным токсином. Если линкерная часть слишком длинная, активный агент может быть деградирован в процессе продукции или не сможет обеспечить свой желательный эффект в мишенной клетке эффективно.
Любой приемлемый линкер, известный специалистам в данной области, может быть использован в данном описании. Обычно отличающийся набор линкеров будет использоваться в конъюгатах, которые представляют собой слитые белки из линкеров в химически полученных конъюгатах. Линкеры и связи, которые приемлемы для химически связанных конъюгатов, включают, но не ограничиваясь ими, дисульфидные связи, тиоэфирные связи, защищенные дисульфидные связи и ковалентные связи между свободными реакционными группами, такими как аминные и тиоловые группы. Эти связи образуются при использовании гетеробифункциональных реагентов с получением реактивных тиоловых групп на одном или обоих полипептидах и затем реакции тиоловых групп на одном полипептиде с реактивными тиоловыми группами или аминными группами, при которой реактивные малеимидо группы или тиоловые группы могут быть прикреплены на другом. Другие линкеры включают кислоторасщепляемые линкеры, такие как бисмалеимидотокси пропан, кислотолабильные трансферриновые конъюгаты и адипиновой кислоты диигидразид, который расщеплялся бы в более кислых внутриклеточных компартментах; сшитые линкеры, которые расщепляются при экспозиции УФ или видимым светом и линкеры. В некоторых вариантах осуществления по изобретению некоторые линкеры могут быть включены для того, чтобы воспользоваться преимуществом в виде желательных свойств каждого линкера. Химические линкеры и пептидные линкеры могут быть введены путем ковалентного соединения линкера с содержащим пептидный лигандный домен полипептидом и мишенным агентом. Гетеробифункциональные агенты, описанные ниже, могут быть использованы для влияния на такое ковалентное соединение. Пептидные линкеры могут быть также связаны посредством экспрессирующейся ДНК, кодирующей линкер и пептидный лигандный домен, линкер и активный агент или пептидный лигандный домен, ликер и активный агент как слитый белок. Гибкие линкеры и линкеры, которые увеличивают растворимость конъюгатов, рассматриваемые для использования индивидуально или с другими линкерами, также рассматриваются в данном описании.
Таким образом, линкеры могут включать, но не ограничиваясь ими, пептидные связи, аминокислотные и пептидные связи, обычно содержащие между одной и примерно 30 аминокислотами, более предпочтительно между примерно 10 и 30 аминокислотами. Альтернативно, химические линкеры, такие как гетеробифункциональные расщепляемые сшитые линкеры, включают, но не ограничиваясь ими, N-сукцинимидил(4-йодацетил)-аминобензоат, сульфосукцинимидил(4-йодацетил)-аминобензоат, 4-сукцинимидил-оксикарбонил-а-(2-пиридилдитио)толуол, сульфосукцинимидил-6-а-метил-а-(пиридилдитио)толуамидо)гексаноат, N-сукцинимидил-3-(-2-пиридилдитио)-пропионат, сукцинимидил 6(3(-(-2-пиридилдитио)-пропионамидо)гексаноат, сульфосукцинимидил 6(3(-(-2-пиридилдитио)-пропионамидо)гексаноат, 3-(2-пиридилдитио)-пропионил гидразид, реактив Элмана, дихлортриазиновую кислоту и S-(2-тиопиридил)-L-цистеин.
Другие линкеры включают тритиловые линкеры, конкретнее дериватизированные тритиловые группы с генерацией рода конъюгатов, которые обеспечивают высвобождение терапевтических агентов при различной степени кислотности или щелочности. Гибкость при этом дает возможность заранее выбирать диапазон pH, при котором терапевтический агент будет высвобождаться, допуская селекцию линкера, основанную на известных физиологических различиях между тканями, в которые требуется доставка терапевтического агента (смотри, например, патент США № 5612474). Например, кислотность опухолевых тканей является более низкой, чем нормальных тканей.
Кислоторасщепляемые линкеры, фоторасщепляемые линкеры и чувствительные к нагреванию линкеры могут быть также использованы, конкретнее там, где они могут быть необходимы для расщепления мишенного агента для обеспечения его более легкой доступности в реакции. Кислоторасщепляемые линкеры включают, но не ограничиваясь ими, бисмалеимидотокси пропан; и адипиновой кислоты дигидразидные линкеры (смотри, например, Fattom et. al. (1992) Infection & Immun. 60:584 589) и кислотолабильные трансферриновые конъюгаты, которые содержат достаточную часть трансферрина для обеспечения вхождения во внутриклеточный путь кругооборота трансферрина (смотри, например, Welhoner et al. (1991) J. Biol. Chem. 266:4309 4314).
Фоторасщепляемые линкеры представляют собой линкеры, которые расщепляются при экспозиции светом (смотри, например, Goldmacher et al. (1992) Bioconj. Chem. 3:104 107, где линкеры включены в данное описание посредством ссылки), посредством чего высвобождается мишенный агент при экспозиции светом. Фоторасщепляемые линкеры, которые расщепляются при эспозиции светом, известны (смотри, например, Hazum et al. (1981) in Pept., Proc. Eur. Pept. Symp., 16th, Brunfeldt, K (Ed), pp. 105-110, которые описывают использование нитробензильной группы как фоторасщепляемой защитной группы для цистеина; Yen et al. (1989) Macromol. Chem 190:69 82, которые описывают водорастворимые фоторасщепляемые сополимеры, включая сополимер гидроксипропилметакриламида, глициновый сополимер, флуоресцеиновый сополимер и метилродаминовый сополимер; Goldmacher et al. (1992) Bioconj. Chem. 3:104 107, которые описывают сшитый линкер и реагент, которые подвергаются фотолитической деградации при экспозиции ближним УФ-светом (350 нм); и Senter et al. (1985) Photochem. Photobiol 42:231 237, которые описывают нитробензилоксикарбонил хлоридные перекрестно сшитые реагенты, которые продуцируют фоторасщепляемые связи), тем самым высвобождая мишенный агент при экспозиции светом. Такие линкеры будут иметь практическое использование для лечения дерматологических или офтальмологических патологических состояний, которые могут быть подвергнуты действию света с использованием оптоволокна. После введения конъюгата глаз, или кожа, или другая часть тела могут быть подвергнуты действию света, что приводит к высвобождению мишенной части из конъюгата. Такие фоторасщепляемые линкеры полезны в связи с диагностическими протоколами, в которых желательно удалять мишенный агент для обеспечения быстрого клиренса из тела животного.
IV. Изобретение предоставляет множество активных агентов
Различные аспекты настоящего изобретения рассматривают, что содержащий пептидный лигандный домен полипептид соединяется с активным агентом, т.е. терапевтическим или диагностическим агентом.
Как использовано в данном описании, термин «терапевтический агент» относится к химическому соединению, биологической макромолекуле или экстракту, полученному из биологических материалов, таких как бактерии, растения, грибы или животные (особенно млекопитающее) клетки или ткани, которые, как предполагается, имеют терапевтические свойства, например химиотерапевтический агент или радиотерапевтический агент. Термин «терапевтический», как использовано в данном описании, относится к улучшению эффектов, выздоровлению или предупреждению (иллюстрировано посредством предупреждения или уменьшения вероятности [развития] мишенного заболевания, например рака или другого пролиферативного заболевания) заболевания или родственного патологического состояния, поражающего субъекта-млекопитающего. Целебная терапия относится к облегчению полностью или частично существующего заболевания или патологического состояния у млекопитающего.
Агент может быть очищен, существенно очищен или частично очищен. Далее такой терапевтический агент может находиться в или может быть ассоциирован с липосомой или иммунолипосомой, и конъюгация может осуществляться непосредственно в агенте или в липосоме/иммунолипосоме. «Липосома» представляет собой маленький пузырек, составленный из различных типов липидов, фосфолипидов и/или сурфактанта, который используется для доставки лекарственного средства (например, лекарственные средства, антитела, токсины). Компоненты липосомы обычно расположены в определенном порядке в бислойном образовании, сходном с липидным расположением в биологических мембранах.
Иллюстрация терапевтических агентов, которые могут быть соединены с содержащим пептидный лигандный домен полипетидом в манере, рассматриваемой настоящим изобретением, включает без органичения химиотерапевтические агенты (например, доцетаксел, паклитаксел, таксаны и соединения платины), антифолаты, антиметаболиты, антимитотики, ДНК-повреждающие агенты, проапоптотики, индуцирующие дифференцировку агенты, противоангиогенные агенты, антибиотики, гормоны, пептиды, антитела, тирозинкиназные ингибиторы, биологически активные агенты, биологические молекулы, радионуклиды, адриамицин, ансамициновые антибиотики, аспарагиназу, блеомицин, бисульфан, цисплатин, карбоплатин, кармустин, капецитабин, хлорамбуцил, цитарабин, циклофосфамид, камптотецин, дакарбазин, дактиномицин, даунорубицин, дексразоксан, доцетаксел, доксорубицин, этопозид, эпотилоны, флоксуридин, флударабин, фторурацил, гемцитабин, гидроксимочевину, идарубицин, ифосфамид, иринотекан, ломустин, мехлоретамин, меркаптопурин, меплхалан, метотрексат, рапамицин (сиролимус), митомицин, митотан, митоксантрон, нитрозомочевину, паклитаксел, памидронат, пентостатин, пликамицин, прокарбазин, ритуксимаб, стрептозоцин, тенипозид, тиогуанин, тиотепа, таксаны, винбластин, винкристин, винорелбин, таксол, комбретастатины, дискодермолиды, трансплатин, тирозинкиназные ингибиторы (генистеин) и другие химиотерапевтические агенты.
Как использовано в данном описании термин «химиотерапевтический агент» относится к агенту с активностью против рака, неопластических и/или пролиферативных заболеваний. Предпочтительные химиотерапевтические агенты включают доцетаксел и паклитаксел как частицы, включающие альбумин, у которых более чем 50% химиотерапевтического агента находится в форме наночастиц. Более предпочтительно химиотерапевтический агент включает частицы альбумин-связанного паклитаксела, например Абраксан®.
Приемлемые терапевтические агенты также включают, например, биологически активные агенты (TNF, tTF), радионуклиды (131I, 90Y, 111In, 211At, 32P и другие известные терапевтические радионуклиды), противоангиогенные агенты (ингибиторы ангиогенеза, например, IFN-альфа, фумагиллин, ангиостатин, эндостатин, талидомид и подобное) другие биологически активные полипептиды, терапевтические сенсибилизаторы, антитела, лектины и токсины.
Приемлемые заболевания для применения по изобретению включают злокачественные и презлокачественные патологические состояния, а также пролиферативное заболевание, включая, но не ограничиваясь ими, где пролиферативные заболевания представляют собой, например, доброкачественную гиперплазию предстательной железы, эндометриоз, гиперплазию эндометрия, атеросклероз, псориаз, иммунологическую пролиферацию или пролиферативную почечную гломерулопатию.
Термин «терапевтически эффективное количество» означает количество, которое возвращает к норме частично или полностью физиологические или биохимические параметры, ассоциированные с или вызывающие заболевание или патологическое состояние. Клинические специалисты в данной области должны быть способны определять количество фармацевтической композиции, которая будет терапевтически эффективной относительно конкретного заболевания или патологического состояния. В качестве примера и в соответствии с предпочтительным вариантом осуществления по изобретению, где терапевтическим агентом является паклитаксел, веденная доза паклитаксела может находиться в диапазоне от примерно 30 мг/м2 до примерно 1000 мг/м2 с использованием циклического введения дозы примерно 3 недели (т.е. введение дозы паклитаксела один раз каждые примерно три недели), желательно от примерно 50 мг/м2 до примерно 800 мг/м2, предпочтительно от примерно 80 мг/м2 до примерно 700 мг/м2 и наиболее предпочтительно от примерно 250 мг/м2 до примерно 300 мг/м2 с использованием циклического введения дозы примерно 3 недели, предпочтительно цикла из примерно 2 недель, более предпочтительно еженедельных циклов.
Настоящее изобретение также содержит диагностические аспекты. Например, диагностический агент может представлять собой индикатор или метку, включая без ограничения радиоактивные агенты, контрастные агенты для ЯМР [ядерный магнитный резонанс] [исследования], контрастные агенты для рентгенологического [исследования], контрастные агенты для ультразвукового [исследования] и контрастные агенты для PET [позитронно-эмиссионная томография] [исследования]. Соединение этих агентов, описанное в связи с терапевтическими агентами, также рассматривается этим аспектом по изобретению. Далее термин «диагностически эффективное количество» представляет собой количество фармацевтической композиции, которая в релевантных клинических условиях обеспечивает достаточно точное определение присутствия и/или обнаруживает аномальную пролиферативную, гиперпластическую, ремоделирующую, воспалительную активность в тканях и органах. Например, патологическое состояние, «диагностированное» в соответствии с изобретением, может быть доброкачественной или злокачественной опухолью.
Диагностические агенты, изучаемые в данном описании, включают полипептиды, такие как антитела, которые могут быть мечены путем соединения ковалентно или нековалентно с веществом, которое обеспечивает регистрируемый сигнал. Известно большое разнообразие меток и методик конъюгации и [о них] всесторонне сообщается в научной и патентной литературе. Приемлемые метки включают радионуклиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцентые группы, хемилюминесцентные группы, магнитные частицы и подобное. Патенты с идеей использования таких меток включают патенты США № 3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241. Также могут быть получены рекомбинантные иммуноглобулины, смотри Cabilly, патент США № 4816567; Moore, et al., патент США № 4642334; и Queen et al. (1989) Proc. Nat'l Acad. Sci. USA 86:10029-10033.
Доставка терапевтических или диагностических агентов в опухоль или другой участок заболевания посредством изобретательских композиций и способов может быть мониторирована и измерена посредством любого приемлемого метода, включая, например, добавление радиоактивной метки или непроницаемой для радиоактивности метки в композицию и получение изображения, который является подходящим и хорошо известен обычным специалистам в данной области. Секвестрация композиций в плазматическом компартменте может быть мониторирована посредством любого приемлемого метода, включая, например, венопункцию.
Далее и в родственном аспекте изобретение предоставляет способ предсказания или определения опухолевого ответа на химиотерапевтический агент, а также способ предсказания или определения ответа пролиферативного заболевания на химиотерапевтический агент, или лечение пролиферативного заболевания, включая, но не ограничиваясь ими, где пролиферативные заболевания представляют собой, например, доброкачественную гиперплазию предстательной железы, эндометриоз, гиперплазию эндометрия, атеросклероз, псориаз, иммунологическую пролиферацию или пролиферативную почечную гломерулопатию.
V. Изобретение предоставляет слитые белки, которые присоединены пептидными лигандными доменами к полипептидным активным агентам
Настоящее изобретение далее рассматривает присоединение пептидных лигандных доменов к полипептидным активным агентам в слитых белках. Например, и без ограничения последовательности пептидных лигандных доменов могут быть слиты выше или ниже расположенных диагностически полезных белковых доменов (такой как гаптен, GFP), терапевтических сенсибилизаторов, активных белковых доменов (например, без ограничения tTF, TNF, полученный из Smar1 пептид p44, интерферон, TRAIL, Smac, VHL, прокаспаза, каспаза и IL-2) или токсина (например, без ограничения рицин, PAP, дифтерийный токсин, эндотоксин Pseudomonas).
«Слитый белок» и «слитый полипептид» относятся к полипептиду, содержащему по меньшей мере две части, ковалентно связанные вместе, где каждая из частей представляет собой полипептид, имеющий отличительное свойство. Свойство может быть биологическим свойством, таким как активность in vitro или in vivo. Свойство может быть также простым химическим или физическим свойством, таким как связывание с мишенной молекулой, катализ реакции и подобное. Свойства могут быть связаны прямо посредством одной пептидной связи или через пептидный линкер, содержащий один или несколько аминокислотных остатков. Обычно части и линкер должны находиться в рамке считывания друг с другом.
VI. Антитело или антительный фрагмент активных агентов
В конкретном аспекте по настоящему изобретению терапевтический агент может представлять собой антитело или антительный фрагмент, которые опосредуют одну или несколько активаций комплемента, опосредованную клеткой цитотоксичность, апоптоз, некротическую клеточную гибель и опсонизацию.
Термин «антитело» в данном описании включает без ограничения моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифичные антитела (например, биспецифичные антитела). Антитела могут быть мышиными, человеческими, гуманизированными, химерными или полученными из других видов. Антитело представляет собой белок, генерированный иммунной системой, который способен распознавать и связываться со специфическим антигеном. Мишенный антиген обычно имеет множество сайтов связывания, также называемых эпитопами, распознаваемыми CDR на множественных антителах. Каждое антитело, которое специфически связывается с отличающимся эпитопом, имеет отличающуюся структуру. Таким образом, один антиген может иметь более чем одно соответствующее антитело. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, т.е. молекулу, которая содержит антиген-связывающий сайт, который иммуноспецифически связывает антиген мишени, представляющей интерес, или ее часть; такие мишени включают, но не ограничиваясь ими, раковые клетки или клетки, которые вырабатывают аутоиммунные антитела, ассоциированные с аутоиммунным заболеванием. Иммуноглобулин, раскрытый в данном описании, может относиться к любому классу (например, IgG, IgE, IgM, IgD и IgA) или подклассу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) молекулы иммуноглобулина. Иммуноглобулины могут быть получены из любых видов.
«Антительные фрагменты» включают часть полноразмерного антитела, которая поддерживает желательную биологическую активность. «Антительные фрагменты» часто представляют собой его антиген-связывающую или вариабельную область. Примеры антительных фрагментов включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела; линейные антитела; фрагменты, полученные посредством экспрессионной библиотеки Fab, анти-идиотипические (анти-Id) антитела, CDR (комплементарно определяемая область) и эпитоп-связывающие фрагменты любого из вышеупомянутых, которые иммуноспецифически связываются с антигенами раковых клеток, вирусными антигенами или микробными антигенами, одноцепочечные антительные молекулы; и мультиспецифичные антитела, образованные из антительных фрагментов. Однако другие не антиген-связывающие части антител могут представлять собой «антительные фрагменты», что подразумевает данное описание, например, без ограничения антительный фрагмент может представлять собой полный или частичный Fc домен.
Моноклональные антитела данного описания специфически включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих конкретному антительному классу или подклассу, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других видов или принадлежащих другому антительному классу или подклассу, а также фрагменты таких антител, поскольку они проявляют желательную биологическую активность (патент США № 4816567). Химерные антитела, представляющие интерес в данном описании, включают «приматизированные» антитела, включающие вариабельный домен антиген-связывающих последовательностей, полученных из нечеловекообразного примата (например, обезьяна Старого Света или примат) и последовательностей константной области человека.
«Антитело-зависимая клеточно-опосредованная цитотоксичность» и «ADCC» относятся к клеточно-опосредованной реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют Fc рецепторы (FcR) (например, Естественные Киллерные (NK) клетки, нейтрофилы и макрофаги), распознают связанное антитело на мишенной клетке и впоследствии вызывают лизис мишенной клетки. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только Fc.гамма.RIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Для оценки ADCC-активности молекулы, представляющей интерес, может быть выполнен in vitro анализ ADCC (патент США № 55003621; патент США № 5821337). Полезные эффекторные клетки для таких анализов включают моноядерные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно или дополнительно ADCC-активность молекулы, представляющей интерес, может быть оценена in vivo, например, на животной модели, такой как модель, предоставленная Clynes et al. PNAS (USA), 95:652-656 (1998).
Антитело, которое «индуцирует клеточную гибель», представляет собой антитело, которое заставляет жизнеспособную клетку становиться нежизнеспособной. Клеточная гибель in vitro может быть определена в отсутствие комплемента и иммунных эффекторных клеток для различения клеточной гибели, индуцированной антитело-зависимой клеточно-опосредованной цитотоксичностью (ADCC) или комплемент-зависимой цитотоксичностью (CDC). Таким образом, анализ клеточной гибели может быть осуществлен с использованием инактивированной нагреванием сыворотки (т.е. в отсутствие комплемента) и в отсутствие иммунных эффекторных клеток. Для определения того, способно ли антитело индуцировать клеточную гибель, утрата целостности мембраны, что определено путем поглощения пропидиум йодида (PI), трипанового синего или 7AAD, может быть оценена относительно необработанных клеток. Индуцирующие клеточную гибель антитела представляют собой антитела, которые индуцируют поглощение PI в анализе поглощения PI в клетках BT474.
Антитело, которое «индуцирует апоптоз», представляет собой антитело, которое индуцирует программированную клеточную гибель, что установлено посредством связывания аннексина V, фрагментацией ДНК, клеточным сжатием, расширением эндоплазматического ретикулума, клеточной фрагментацией и/или образованием мембранных пузырьков (названных апоптозными тельцами).
VII. Способ модулирования распределения активных агентов
В другом аспекте по настоящему изобретению используются свойства содержащих пептидный лигандный домен конъюгатов, раскрытых в данном описании, с получением способов модуляции распределения активного агента в ткани животного, включающих введение животному композиции, включающей конъюгированную молекулу, которая включает пептидный лигандный домен, конъюгированный с активным агентом, где пептидный лигандный домен включает пептид SEQ ID NOs:1-137, 139, или 140, или 141-143, или их гомологи и где введение композиции животному приводит к распределению в ткани активного агента, которое отличается от распределения в ткани, полученного при введении одного активного агента.
Композиции и способы по настоящему изобретению по желанию представляют модулированное распределение в ткани активного агента в области заболевания. Это пожелание проявляется само в предоставлении концентрации активного агента в области заболевания и/или увеличенного или пролонгированного (период полувыведения) уровня в крови активного агента, который больше чем уровень, который будет представляться, если активный агент (в неконъюгированной форме) вводился животному. Эта модуляция может также проявляться сама путем увеличения скорости поглощения тканью конъюгированной пептидной молекулы, увеличения [времени] задержки молекулы в ее мишенной области, т.е. в опухоли, увеличения скорости диффузии конъюгированной пептидной молекулы в ткани и/или усиления распределения конъюгированной пептидной молекулы через ткань и соответствие скорости поглощения тканью конъюгированной пептидной молекулы скорости интернализации одного или нескольких тканевых рецепторов. Такие усиления могут быть измерены посредством любого приемлемого метода, известного в данной области, включая без ограничения определение, локализацию и относительную дискретизацию приемлемого меченого активного агента, например, с использованием радиографической, микроскопической, химической, иммунологической или ЯМР-методик.
Посредством «увеличения скорости» означает скорость, которая является скоростью по меньшей мере примерно на 33% больше, предпочтительно по меньшей мере примерно на 25% больше, более предпочтительно по меньшей мере примерно на 15% больше, наиболее предпочтительно по меньшей мере примерно на 10% больше. Посредством «более высокой концентрации в области заболевания» означает концентрацию активного агента в конъюгате в области заболевания, которая является по меньшей мере примерно на 33% больше, предпочтительно по меньшей мере примерно на 25% больше, более предпочтительно по меньшей мере примерно на 15% больше, наиболее предпочтительно по меньшей мере примерно на 10% больше, чем концентрация неконъюгированного активного агента в сопоставимой области заболевания.
Приемлемые области заболевания включают без ограничения области аномальных патологических состояний пролиферации, ремоделирования ткани, гиперплазии, гипертрофированного заживления раны в любой ткани организма, включая мягкую ткань, соединительную ткань, кость, солидные органы, кровеносный сосуд и подобное. Более специфические примеры таких заболеваний включают рак, диабетическую или другую ретинопатию, воспаление, фиброз, артрит, рестеноз кровеносных сосудов или искусственных трансплантатов кровеносных сосудов, или внутрисосудистых устройств и подобное, катаракту и дегенерацию сетчатки, остеопороз и другие заболевания кости, атеросклероз и другие заболевания, где часто наблюдается кальцификация.
В предпочтительном аспекте изобретение предоставляет способы диагностики и/или лечения опухоли, где опухоль выбрана из группы, состоящей из опухолей полости рта, глоточных опухолей, опухолей пищеварительной системы, опухолей дыхательной системы, костных опухолей, хрящевых опухолей, костных метастазов, сарком, кожных опухолей, меланомы, опухолей молочной железы, опухолей генитальной системы, опухолей мочевого тракта, глазничных опухолей, опухолей головного мозга и центральной нервной системы, глиом, опухолей эндокринной системы, опухолей щитовидной железы, опухолей пищевода, опухолей желудка, опухолей тонкой кишки, опухолей толстой кишки, опухолей прямой кишки, опухолей заднего прохода, опухолей печени, опухолей желчного пузыря, опухолей поджелудочной железы, опухолей гортани, опухолей легкого, бронхиальных опухолей, немелкоклеточной карциномы легкого, мелкоклеточной карциномы легкого, опухолей шейки матки, опухолей тела матки, опухолей яичника, опухолей вульвы, вагинальных опухолей, опухолей предстательной железы, карциномы предстательной железы, тестикулярных опухолей, опухолей полового члена, опухолей мочевого пузыря, опухолей почки, опухолей почечной лоханки, опухолей мочеточника, опухолей головы и шеи, рака паращитовидной железы, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, лейкоза, острого лимфоцитарного лейкоза, хронического лимфоцитарного лейкоза, острого миелоидного лейкоза, хронического миелоидного лейкоза. В дополнение изобретение предоставляет способ предсказания или определения опухолевого ответа на химиотерапевтический агент, способы лечения опухоли и наборы для предсказания ответа опухоли млекопитающего на химиотерапевтический агент, где опухоль представляет собой саркому, аденокарциному, плоскоклеточную карциному, крупноклеточную карциному, мелкоклеточную карциному, базальноклеточную карциному, светлоклеточную карциному, онцитому или их комбинации.
В другом аспекте изобретение предоставляет композиции и способы использования указанных композиций, где введение композиции животному приводит к уровню в крови активного агента, который больше чем уровень в крови, полученный при введении одного активного агента. Может быть использовано любое приемлемое измерение уровня в крови активного агента, включая без ограничения Cmax, Cmin и AUC. Посредством «больший чем уровень в крови, полученный при введении одного активного агента» означает уровень в крови, который является по меньшей мере примерно на 33% больше, предпочтительно по меньшей мере примерно на 25% больше, более предпочтительно по меньшей мере примерно на 15% больше, наиболее предпочтительно по меньшей мере примерно на 10% больше.
В еще другом аспекте изобретение предоставляет композиции и способы использования указанных композиций, где введение композиции животному приводит к [получению] уровня в крови периода полувыведения активного агента, который больше уровня в крови периода полувыведения, полученного при введении одного активного агента. Посредством «больший чем период полувыведения в крови, полученный при введении одного активного агента» означает период полувыведения, который по меньшей мере примерно на 33% больше, предпочтительно по меньшей мере примерно на 25% больше, более предпочтительно по меньшей мере примерно на 15% больше, наиболее предпочтительно по меньшей мере примерно на 10% больше.
VIII. Составы и введение
Для использования in vivo активный агент, соединенный с пептидным лигандным доменом, таким как SEQ ID NOs:1-117 и его гомологами, по желанию подбирается в фармацевтическую композицию, включающую физиологически приемлемый носитель. Любой приемлемый физиологически пригодный носитель может быть использован в контексте изобретения в зависимости от пути введения. Специалисты в данной области оценят те носители, которые могут быть использованы для получения фармацевтической композиции, приемлемой для желательного способа введения.
Введение фармацевтических композиций по настоящему изобретению может быть выполнено при посредстве любого приемлемого пути введения, включая, но не ограничиваясь ими, внутривенное, подкожное, внутримышечное, внутрибрюшинное, внутриопухолевое, оральное, ректальное, вагинальное, внутрипузырное и ингаляционное введение с использованием внутривенного и внутриопухолевого введения как наиболее предпочтительного. Композиция может далее включать любые другие приемлемые компоненты, особенно для усиления стабильности композиции и/или ее конечного использования. Соответственно существует широкий ряд приемлемых составов композиции по изобретению. Следующие составы и способы являются примерными и ни в коей мере не ограничивающими.
Фармацевтические композиции могут также включать по желанию дополнительные терапевтические или биологически активные агенты. Например, могут присутствовать терапевтические факторы, полезные для лечения конкретного показания. Факторы, которые контролируют воспаление, такие как ибупрофен или стероиды, могут являться частью композиции для снижения припухлости и воспаления, ассоциированных с in vivo введением фармацевтической композиции и физиологическим дистрессом.
Носитель обычно бывает жидким, но также может быть твердым или комбинацией жидких и твердых компонентов. Носитель по желанию представляет собой физиологически приемлемый (например, фармацевтически или фармакологически приемлемый) носитель (например, эксципиент или разбавитель). Физиологически приемлемые носители хорошо известны и легкодоступны. Выбор носителя будет определяться по меньшей мере частично путем определения местоположения мишенной ткани и/или клеток и конкретного способа, используемого для введения композиции.
Обычно такие композиции могут быть получены как инъецируемые или как жидкие растворы или суспензии; твердые формы, приемлемые для использования при получении растворов или суспензий до добавления жидкости перед инъекцией, могут быть также получены; и препараты могут быть также эмульгированы. Фармацевтические составы, приемлемые для инъекционного использования, включают стерильные водные растворы или коллоидные растворы; составы, содержащие известные белковые стабилизаторы и лиопротектанты, составы, включающие кунжутное масло, арахисовое масло или водный пропиленгликоль, и стерильные порошки для экстемпорального приготовления стерильных инъецируемых растворов или коллоидных растворов. Во всех случаях состав должен быть стерильным и должен быть жидким до степени, которая обеспечивает возможность легкого введения через шприц. Он должен быть стабильным в условиях получения и хранения и должен быть предохранен от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Растворы активных соединений как свободная основа или фармакологически приемлемые соли могут быть получены в воде, приемлемо смешанной с сурфактантом, таким как гидроксицеллюлоза. Коллоидные растворы могут быть также получены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и использования эти препараты содержат консерванты для предотвращения роста микроорганизмов.
Содержащий пептидный лигандный домен конъюгат может быть представлен в композиции в нейтральной [форме] или в форме соли. Фармацевтически приемлемые соли включают кислые дополнительные соли (образованные с использованием свободных аминогрупп белка) и соли, которые образованы с использованием неорганических кислот, таких как, например, соляная или фосфорная кислоты, или таких как органические кислоты, как уксусная, щавелевая, винная, миндальная и подобное. Соли, образованные с использованием свободных карбоксильных групп, также могут быть получены из неорганических оснований, таких как, например, натрий, калий, аммоний, кальций или гидраты окиси железа, и таких органических оснований как изопропиламин, триметиламин, гистидин, прокаин и подобное.
Составы, приемлемые для парентерального введения, включают водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики, и растворы, которые делают состав изотоническим с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, ожижающие агенты, загущающие агенты, стабилизаторы и консерванты. Составы могут быть представлены в герметичных упаковках для однократных доз или многократных доз, таких как ампулы и флаконы, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого эксципиента, например воды для инъекций непосредственно перед использованием. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток описанного ранее вида. В предпочтительном варианте осуществления по изобретению содержащий пептидный лигандный домен конъюгат получен для инъекции (например, парентеральное введение). В этом отношении состав по желанию приемлем для внутриопухолевого введения, но также может быть получен для внутривенной инъекции, внутрибрюшинной инъекции, подкожной инъекции и подобное.
Изобретение также предоставляет по желанию варианты осуществления, в которых содержащий пептидный лигандный домен конъюгат (т.е. содержащий пептидный лигандный домен полипептид, конъюгированный поровну с активным агентом) далее конъюгируется с полиэтиленгликолем (PEG). PEG-конъюгация может увеличить циркуляцию периода полувыведения этих полипептидов, снизить полипептидную иммуногенность и антигенность и улучшить их биоактивность. При использовании любой приемлемый способ PEG-конъюгации может быть использован, включая, но не ограничиваясь ими, реакцию метокси-PEG с пептидной пригодной аминогруппой (группами) или другими реакционноспособными участками, такими как, например, гистидины или цистеины. Дополнительно подходы [на основе] рекомбинантной ДНК могут быть использованы для добавления аминокислот с PEG-реакционноспособными группами в содержащий пептидный лигандный домен конъюгат. Далее могут быть использованы стратегии PEGилирования с возможностью последующего удаления и гибридного PEGилирования в соответствии с аспектами по настоящему изобретению, такие как PEGилирование полипептида, где молекулы PEG, добавляемые в определенные участки содержащей пептидный лигандный домен конъюгированной молекулы, высвобождаются in vivo. Примеры способов PEG конъюгации известны в данной области. Смотри, например, Greenwald et al., Adv. Drug Delivery Rev. 55:217-250 (2003).
Составы, приемлемые для введения при посредстве ингаляции, включают аэрозольные составы. Аэрозольные составы могут быть помещены в находящиеся под давлением пригодные пропелленты, такие как дихлордифторметан, пропан, азот и подобное. Они также могут быть получены как не находящиеся под давлением препараты для доставки из ингалятора или пульверизатора.
Составы, приемлемые для анального введения, могут быть получены в виде суппозиториев посредством смешивания активного ингредиента с рядом основ, таких как эмульгирующие основы или водорастворимые основы. Составы, приемлемые для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреевых составов, содержащих дополнительно к активному ингредиенту такие носители, которые, как известно в данной области, являются подходящими.
Кроме того, композиция по изобретению может включать дополнительные терапевтические или биологически активные агенты. Например, могут быть представлены терапевтические факторы, полезные для лечения конкретного показания. Факторы, которые контролируют воспаление, такие как ибупрофен или стероиды, могут являться частью композиции для снижения припухлости и воспаления, ассоциированных с in vivo введением фармацевтической композиции и физиологическим дистрессом.
В случае ингаляционной терапии фармацевтическая композиция по настоящему изобретению находится желательно в форме аэрозоля. Генераторы аэрозоля и спрея для введения агента, если он находится в твердой форме, являются пригодными. Эти генераторы дают частицы, которые являются пригодными для вдыхания или ингаляции и генерируют объем аэрозоля, содержащий предварительно установленную отмеренную дозу лекарственного средства со скоростью, приемлемой для введения человеку. Примеры таких генераторов аэрозоля и спрея включают ингаляторы с отмеренными дозами и порошковдуватели, известные в данной области. В случае жидкой формы фармацевтические композиции по изобретению могут быть аэрозолированы с помощью любого приемлемого устройства.
При использовании в связи с внутривенным, внутрибрюшинным или внутриопухолевым введением фармацевтическая композиция по изобретению может включать стерильные водные и неводные инъекционные растворы, суспензии или эмульсии активного соединения, препараты которых являются предпочтительно изотоническими с кровью предполагаемого реципиента. Эти препараты могут содержать один или несколько антиоксидантов, буферов, сурфактантов, сорастворителей, бактериостатиков, растворенных веществ, которые делают композиции изотоническими с кровью предполагаемого реципиента, и другие компоненты состава, известные в данной области. Водные и неводные стерильные суспензии могут включать суспендирующие агенты и загущающие агенты. Композиции могут быть представлены в упаковках для однократных доз или многократных доз, например, герметичных ампулах и флаконах.
Способы по настоящему изобретению могут также являться частью комбинированной терапии. Фраза «комбинированная терапия» относится к введению терапевтического агента в соответствии с изобретением совместно с другой терапевтической композицией последовательным или одновременным образом, так что благоприятные эффекты этой комбинации достигаются у млекопитающего, подвергающегося терапии.
IX. Изобретение применимо для многих патологических состояний
Композиции и способы по изобретению приемлемы для использования в диагностике и лечении различных заболеваний, включая, но не ограничиваясь ими, заболевания, в которых область заболевания представляет собой аномальные состояния пролиферации, ремоделирования ткани, гиперплазии, гипертрофированного заживления раны в любой ткани организма, включая мягкую ткань, соединительную ткань, кость, солидные органы, кровеносный сосуд и подобное. Более специфические примеры таких заболеваний включают рак, диабетическую или другую ретинопатию, воспаление, фиброз, артрит, рестеноз кровеносных сосудов или искусственных трансплантатов кровеносных сосудов, или внутрисосудистых устройств и подобное, катаракту и дегенерацию сетчатки, остеопороз и другие заболевания кости, атеросклероз и другие заболевания, где часто наблюдается кальцификация.
В предпочтительном аспекте изобретение предоставляет способы диагностики и/или лечения опухоли, где опухоль выбрана из группы, состоящей из опухолей полости рта, глоточных опухолей, опухолей пищеварительной системы, опухолей дыхательной системы, костных опухолей, хрящевых опухолей, костных метастазов, сарком, кожных опухолей, меланомы, опухолей молочной железы, опухолей генитальной системы, опухолей мочевого тракта, глазничных опухолей, опухолей головного мозга и центральной нервной системы, глиом, опухолей эндокринной системы, опухолей щитовидной железы, опухолей пищевода, опухолей желудка, опухолей тонкой кишки, опухолей толстой кишки, опухолей прямой кишки, опухолей заднего прохода, опухолей печени, опухолей желчного пузыря, опухолей поджелудочной железы, опухолей гортани, опухолей легкого, бронхиальных опухолей, немелкоклеточной карциномы легкого, мелкоклеточной карциномы легкого, опухолей шейки матки, опухолей тела матки, опухолей яичника, опухолей вульвы, вагинальных опухолей, опухолей предстательной железы, карциномы предстательной железы, тестикулярных опухолей, опухолей полового члена, опухолей мочевого пузыря, опухолей почки, опухолей почечной лоханки, опухолей мочеточника, опухолей головы и шеи, рака паращитовидной железы, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, лейкоза, острого лимфоцитарного лейкоза, хронического лимфоцитарного лейкоза, острого миелоидного лейкоза, хронического миелоидного лейкоза. В дополнение изобретение предоставляет способ предсказания или определения опухолевого ответа на химиотерапевтический агент, способы лечения опухоли и наборы для предсказания ответа опухоли млекопитающего на химиотерапевтический агент, где опухоль представляет собой саркому, аденокарциному, плоскоклеточную карциному, крупноклеточную карциному, мелкоклеточную карциному, базальноклеточную карциному, светлоклеточную карциному, онцитому или их комбинации.
Изобретение предоставляет варианты осуществления, в которых заболевание имеется у млекопитающего, включая, но не ограничиваясь ими, человека.
X. Наборы
Изобретение предоставляет наборы для лечения опухолей, включающие фармацевтический состав и инструкции по использованию состава для лечения опухолей, где фармацевтический состав включает конъюгированную молекулу, которая включает пептидный лигандный домен, конъюгированный с активным агентом, и где пептидный лигандный домен включает пептид SEQ ID NOs:1-137, 139, или 140, или 141-143, или его гомолог, где пептидный лигандный домен проявляет аффинность в отношении сывороточного альбумина человека, характеризующуюся равновесной константой диссоциации (Kd) примерно 700 мкМ или менее, и по желанию где конъюгированная молекула далее включает второй пептидный лигандный домен и инструкции по использованию указанных наборов (например, утвержденные FDA [Управление по надзору за качеством пищевых продуктов и лекарственных средств] инструкции по применению препарата).
Следующие примеры далее иллюстрируют изобретение, но конечно не должны толковаться как каким-либо образом ограничивающие его объем.
ПРИМЕР 1
Этот пример демонстрирует идентификацию SPARC-связывающих пептидов с использованием методики фагового дисплея и включение таких SPARC-связывающих пептидов в молекулы для опухолевой терапии.
В частности, главной целью являлось генерирование молекулы со SPARC-связывающим пептидом, конъюгированным с терапевтическим или диагностическим агентом. Конкретнее целью являлось генерирование слитого белка SPARC-связывающий пептид-Fc (фиг.1), где антительный Fc-домен действует как терапевтический агент путем стимуляции иммунных функций, таких как, например, антитело-зависимая цитотоксичность (ADC) или клеточно-зависимая цитотоксичность (CDC).
Общим принципом методологии дисплея является связь лиганда (пептид, белок) с геном, кодирующим этот лиганд (смотри фиг.2). В методике фагового дисплея это получают путем слияния лигандного гена с геном, кодирующим оболочечный белок нитчатого фага. Рекомбинантный фаговый геном затем вводится в Escherichia coli, где гибридный белок будет экспрессироваться совместно со всеми другими фаговыми белками. Слитый белок будет затем включаться в фаговую оболочку, содержащую фаговый геном (содержащий лигандный ген). Секретированная фаговая частица, выявляющая лиганд, может быть отобрана на иммобилизованной мишени, в то время как все несвязанные фаги смываются. После стадии элюирования извлеченный фаг используется для инфицирования E. coli с обеспечением амплификации этого фага для нового раунда селекции и в конечном счете для анализа связывания.
В связи с этим коммерческую пептидную библиотеку фагового дисплея (12 мер пептиды в M13) скринировали на пептиды, которые связываются со SPARC. Мишень SPARC представляет собой кислый гликопротеин с PI 4,6. Путем иммобилизации на 96-луночных планшетах с pH 9,6, покрытых буфером, пептидную библиотеку Ph.D.-12 скринировали четыре раунда с отбором пептидных связывающих агентов с использованием методики фагового дисплея. В частности, связанные фаги элюировали кислым элюирующим раствором в 1-м раунде скрининга. Затем жесткие условия скрининга постепенно усиливали путем снижения концентрации мишенного белка и увеличения процентного содержания Твин-20 в промывном буфере. В то же время применяли конкурентное элюирование с избытком мишени для улучшения специфичности скрининга. Наконец после четырех раундов скрининга одДНК (однонитевая ДНК) отобранных клонов подвергали ДНК-секвенированию. В то же время валидизировали связывание положительных фагов с мишенным белком с использованием фагового ELISA.
Результаты этого скрининга пептидной библиотеки фагового дисплея на SPARC-связывающие пептиды показаны на фиг.3 и 4. SPARC-связывание может быть количественно определено с помощью ряда изолированных фаговых клонов, которые кодируют пептиды со сходными последовательностями (фиг.3) или по авидности SPARC-связывания, измеренной путем связывания экспрессирующего пептид фага с покрытыми SPARC лунками планшета для микротитрования (фиг.4). Далее охарактеризовали два из пептидов, идентифицированных с помощью фагового дисплея, PD 15 (SEQ ID NO:1) и PD 21 (SEQ ID NO:2).
PD 15 и PD 21 затем клонировали в экспрессионный вектор pFUSE-hIg1-Fc2 (фиг.5) с получением плазмид, которые кодируют слитые белки PD 15-Fc и PD 21-Fc (фиг.6). Эти слитые белки экспрессировали и успешно очистили, как показано с помощью электрофореза в полиакриламидном геле (фиг.7).
Анализ с использованием белкового микрочипа (смотри фиг.8) PD 15 и PD 21 показал только минимальную перекрестную реактивность с не-SPARC белками среди 5000 белков на проанализированном чипе (Invitrogen, Проточип v.3).
ELISA анализы зависимого от концентрации связывания, демонстрировавшие связывание PD 15 и PD 21 со SPARC, показали, что оно являлось лишь немного слабее, чем связывание с анти-SPARC антителом (фиг.9). Kd SPARC-связывания PD 15 имеет 4,1±0,6×10-8 М и Kd SPARC-связывания PD 21 имеет 1,0±0,7×10-7 М. (Тестированное анти-SPARC антитело имеет Kd SPARC-связывания 6,2±3,4×10-9 М, т.е. антитело связывает SPARC лишь немного более авидно.)
Фиг.10 и 11 показывают совместную локализацию SPARC (на что указывало иммуногистохимическое (IHC) окрашивание с использованием анти-SPARC антитела) и связывание PD 15 и PD 21 в срезах опухоли головного мозга человека (которая содержала эпитоп, меченый для IHC-окрашивания). Как показано на фиг.10, литературное сообщение о связывании стабилина 1 со SPARC не подтвердилось, так как stab-Fc не связывается с опухолевой тканью, тогда как PD 15 и PD 21 связываются (фиг.11).
Анализ гомологии последовательностей SPARC-связывающих пептидов, изолированных посредством фагового дисплея, продемонстрировавший, что ряд изолированных SPARC-связывающих пептидных последовательностей содержал последовательности, тождественные области Эластина, показан на фиг.12.
Таким образом, этот пример демонстрирует, что SPARC-связывающие пептиды могут быть идентифицированы посредством фагового дисплея и до какой степени далее охарактеризованы идентифицированные пептиды. Из двух обработанных клонов, PD 15 и PD 21, PD 15 показал более высокую аффинность в отношении SPARC, чем PD 21 в экспериментах ELISA и IHC.
ПРИМЕР 2
Слитые с Fc белки PD 15 и PD 21 анализировали на противоопухолевую активность на модели ксенотрансплантата PC3 карциномы предстательной железы мыши-человека. Слитые с Fc белки PD 15 и PD 21 демонстрировали статистически значимое ингибирование опухолевого роста (фиг.13). PD 15 показал лучшую противоопухолевую активность, чем PD 21 против ксенотрансплантата PC3. На модели ксенотрансплантата HT29 толстой кишки мыши-человека PD 21 показал лучшую противоопухолевую активность, чем PD 15, с активностью, почти эквивалентной Абраксану (фиг.14).
ПРИМЕР 3
Этот пример демонстрирует потенциальную иммуногенность SPARC-связывающих пептидов.
ProPred представляет собой графический web-инструмент для предсказания областей связывания ГКГС [главный комплекс гистосовместимости] класса II в антигенных белковых последовательностях (смотри Singh et al.: ProPred: prediction of HLA-DR binding sites. Bioinformatics 2001, 17(12):1236-7). Основанный на сервере управления матриксом прогнозирующий алгоритм применяет таблицу коэффициентов аминокислота/положение, выведенную из литературы. Предсказанные связывающие агенты могут быть визуализированы как пики в графическом интерфейсе или как окрашенные остатки в HTML интерфейсе. Этот сервер может быть полезным инструментом для определения положения разнородных связывающих областей, которые могут связываться с некоторыми аллелями HLA-DR.
Результаты ProPred анализа SPARC-связывающих пептидов, идентифицированных с использованием фагового дисплея, включая PD 21 и PD 15, указывают, что только несколько молекул HLA-DR будут представлены этими пептидами, и означают то, что пептиды не будут в значительной степени иммуногенными.
Любой пептид, раскрытый в данном описании, включая, например, SEQ ID:1-112 или 117, показывающий высокую аффинность, может быть сходным образом проанализирован на низкую [иммуногенность] или отсутствие иммуногенности.
ПРИМЕР 4
Антительные фрагменты также могут быть проявлены на фагах с использованием различных форматов. Одноцепочечный вариабельный фрагмент (scFv) представляет собой слияние вариабельных областей тяжелой и легкой цепей иммуноглобулинов, связанных вместе коротким (обычно серин, глицин) линкером. Эта химерная молекула сохраняет специфичность природного иммуноглобулина, несмотря на удаление константных областей и введение линкерного пептида. Наиболее распространенные форматы антительного фагового дисплея включают использование библиотек scFv. Большие коллекции антительных вариантов могут быть таким образом скринированы на присутствие антиген-связывающего клона.
Общая стратегия представляла прежде всего скрининг антительных библиотек фагового дисплея человека посредством ELISA с использованием SPARC в качестве антигена.
Сначала HuScL-3® скринировали четыре раунда (три раунда с элюированием в кислой среде и один раунд с конкурентным элюированием) и 17 положительных клонов отобрали посредством фагового ELISA. ДНК-секвенирование этих клонов выявило две уникальных антительных последовательности, между которыми в 1-й последовательности распределялись 15 положительных клонов и во 2-й последовательности распределялись остальные два положительных клона. После этого специфичность связывания двух уникальных антител валидизировали посредством растворимого scFv ELISA.
Затем HuScL-2® скринировали в течение трех раундов (два раунда с элюированием посредством переваривания трипсином и один раунд с конкурентным элюированием). В конечном счете отобрали 30 положительных клонов посредством фагового ELISA. В соответствии с результатами секвенирования 29 клонов распределялись в одной антительной последовательности и оставшийся один клон кодировал другое уникальное антитело. После этого специфичность связывания этих двух антител также валидизировали посредством растворимого scFv ELISA.
Идентифицировали четыре уникальных ScFv против SPARC, ScFv 3-1, ScFv 3-2, ScFv 2-1 и ScFv 2-2 (SEQ ID NOs:1-113-116).
Все ссылки, включая публикации, патентные заявки и патенты, цитированные в данном описании, настоящим включены посредством ссылки в том же объеме, как если бы каждая ссылка была индивидуально и специфически включена посредством ссылки, и изложены во всей своей полноте в данном описании.
Использование терминов «a», «an» и «the» и сходных объектов в контексте описания изобретения (особенно в контексте последующих пунктов изобретения) интерпретируется как относящееся к единственному или множественному числу, если не указано иное в данном описании или четко противоречащее контексту. Термины «включающий», «имеющий», «включающий» и «содержащий» интерпретируются как допускающие изменения термины (т.е. означающий «включая, но не ограничиваясь ими»), если не указано иное. Перечисление диапазонов значений в данном описании только предназначается для использования как способ краткого обозначения, относящийся индивидуально к каждому отдельному значению, попадающему в диапазон, если не указано иное в данном описании, и каждое отдельное значение включено в описание, как если бы оно индивидуально цитировалось в данном описании. Все способы, описанные в данном описании, могут быть выполнены в любом приемлемом порядке, если не указано иное в данном описании или четко противоречащее контексту. Использование любого и всех примеров или примерного языка (например, «такой как»), предоставляемого в данном описании, предназначается только для лучшего освещения изобретения и не представляет ограничения объема изобретения, если не заявлено иное. Отсутствие языка [заявки] в описании должно быть интерпретировано как указывающее на каждый не заявленный элемент как существенный для практического осуществления изобретения.
Предпочтительные варианты осуществления по этому изобретению описаны в данном описании, включая лучшие методы, известные изобретателям для выполнения изобретения. Вариации этих предпочтительных вариантов осуществления по изобретению становятся очевидными специалистам в данной области при чтении вышеизложенного описания. Изобретатели предполагают, что специалисты в данной области используют такие вариации как подходящие, и изобретатели предназначают для практического осуществления изобретения [способы], другие, чем те, которые специфически описаны в данном описании. Таким образом, изобретение включает все модификации и эквиваленты предмета изобретения, перечисленного в пунктах формулы изобретения, присоединенные к этому документу как разрешенные действующим законодательством. Кроме того, любая комбинация вышеописанных элементов во всех их возможных вариациях охватывается изобретением, если не указано иное в данном описании или четко противоречащее контексту.
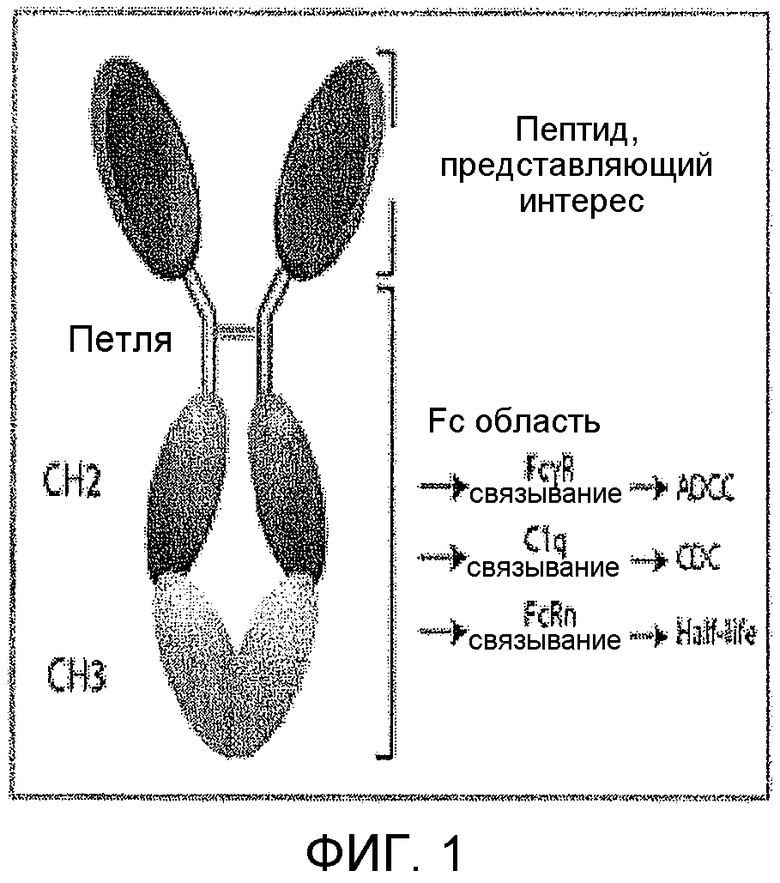
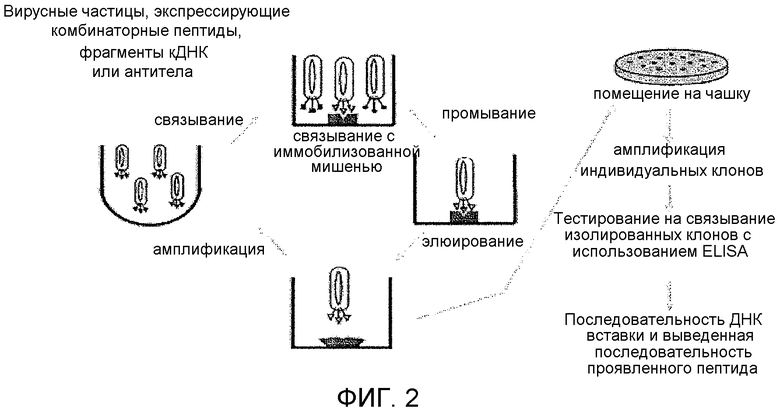
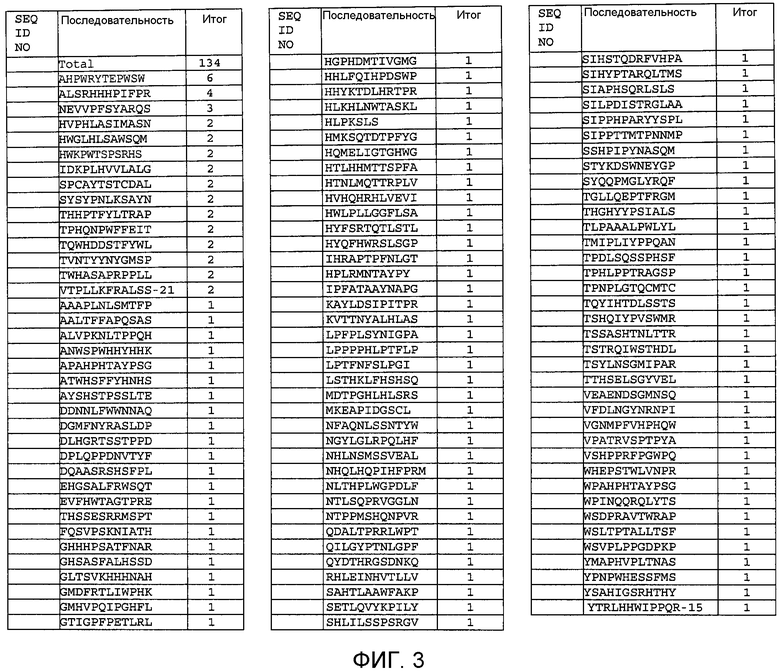
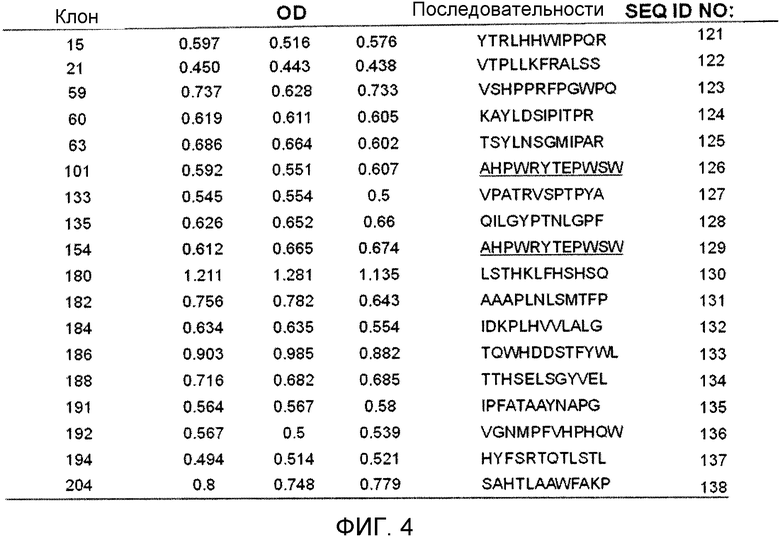
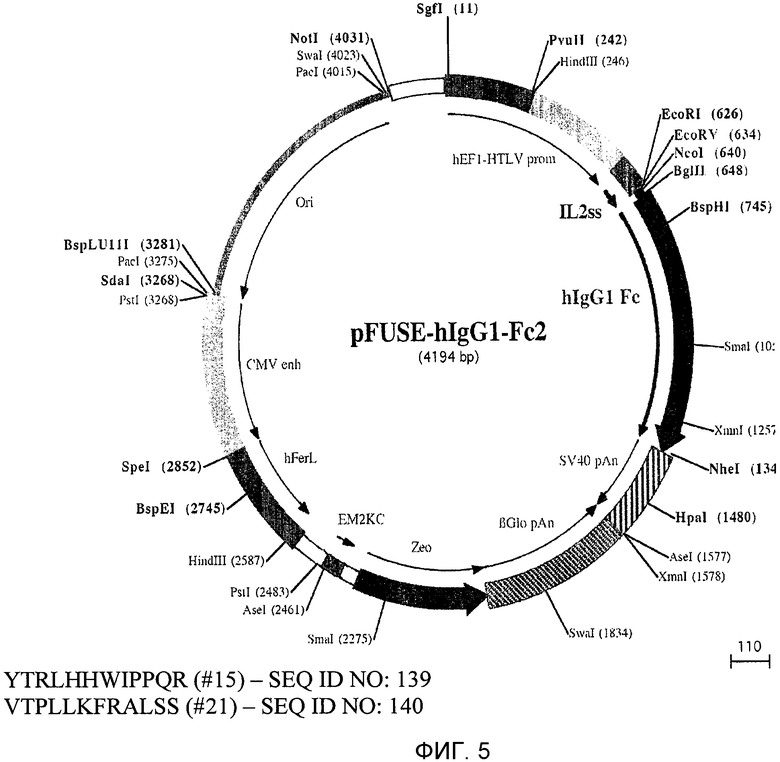
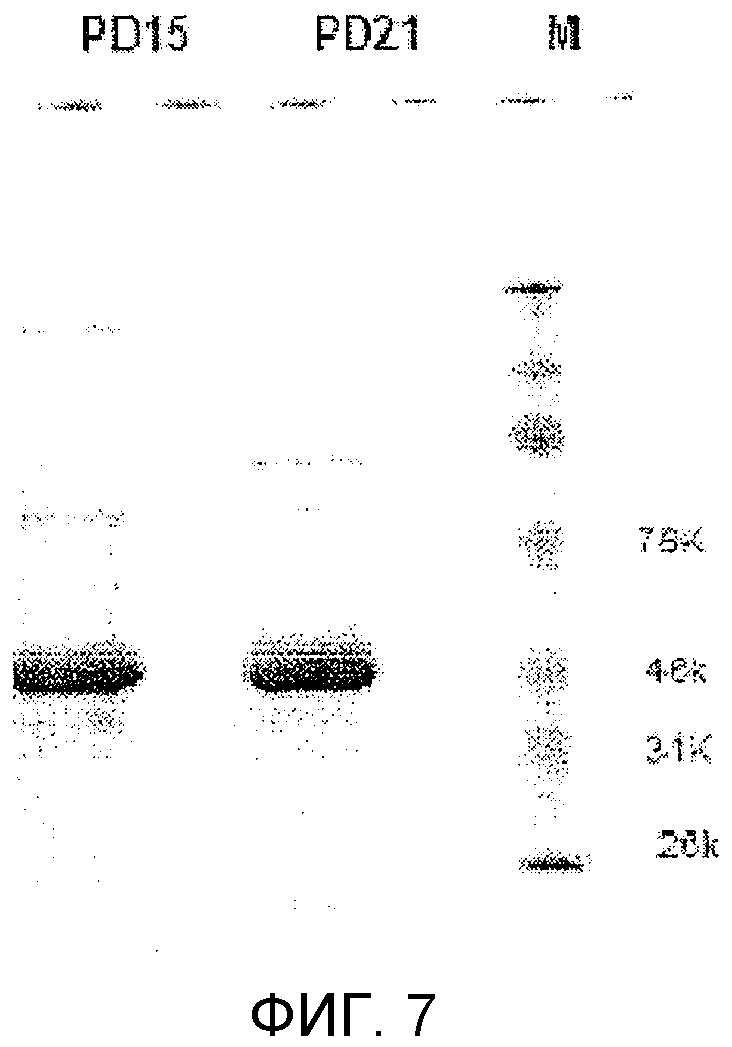
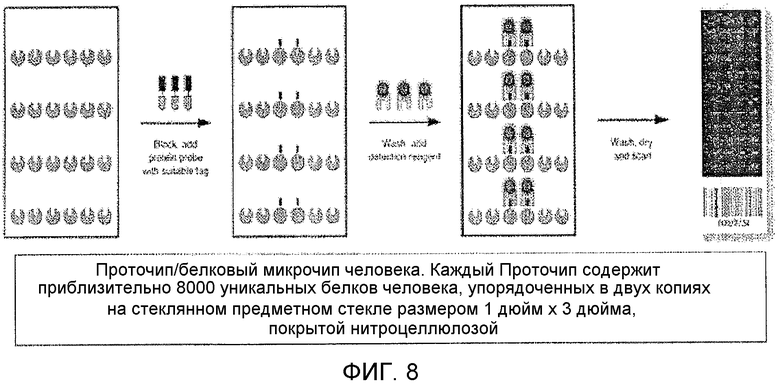
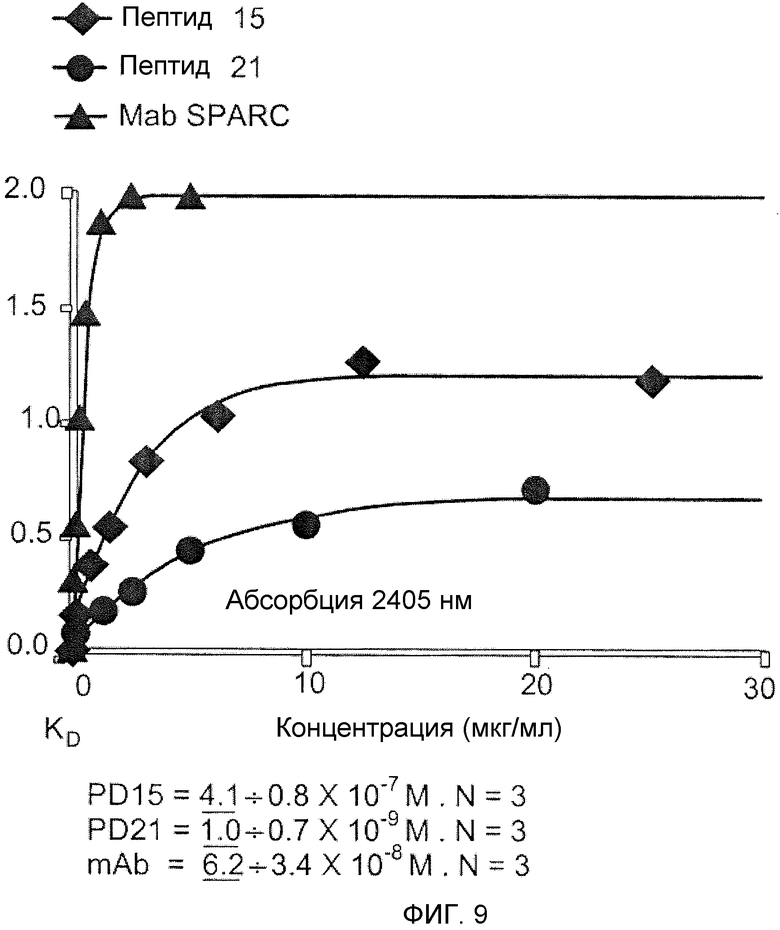
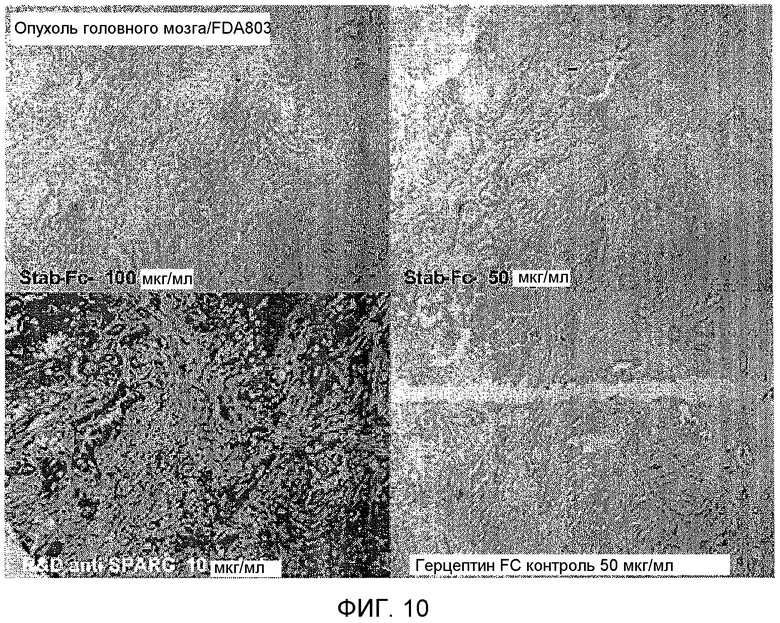


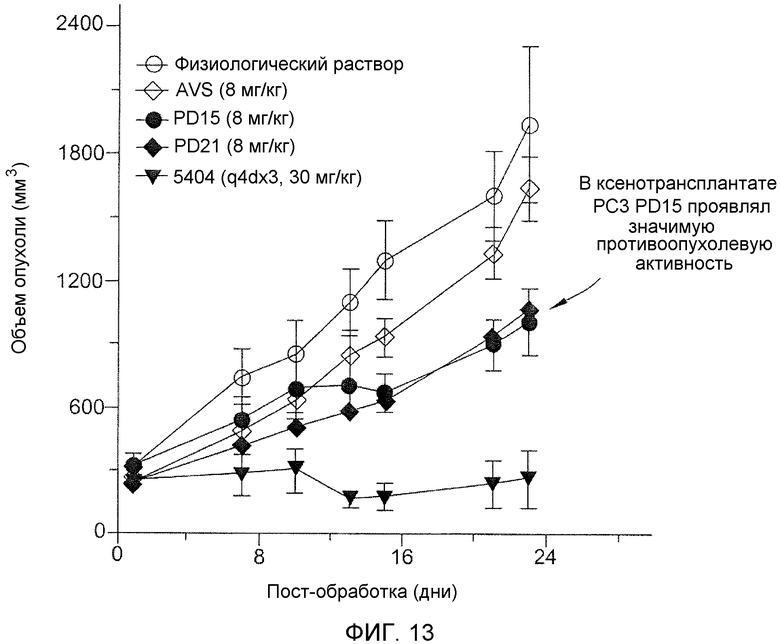
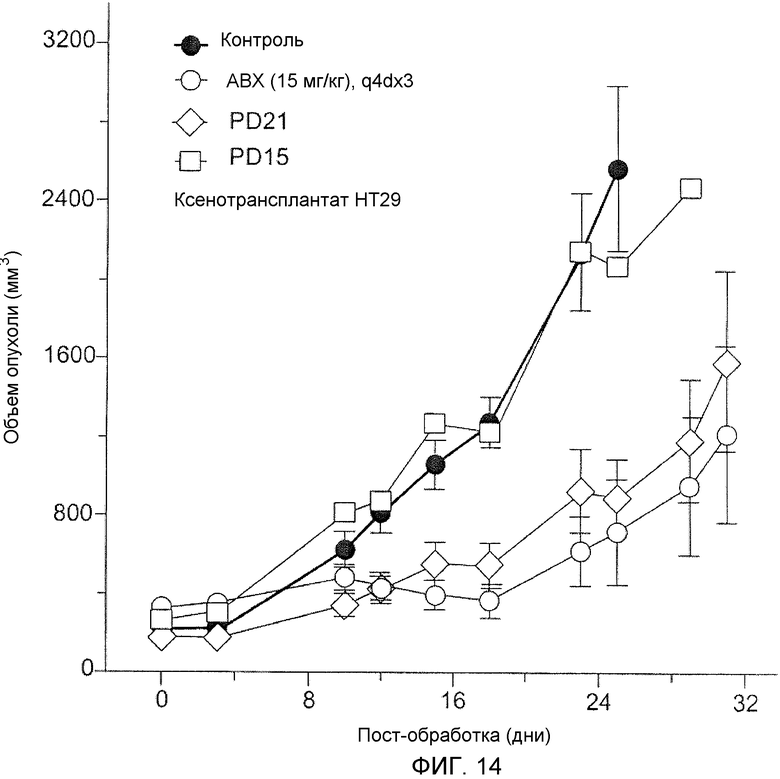
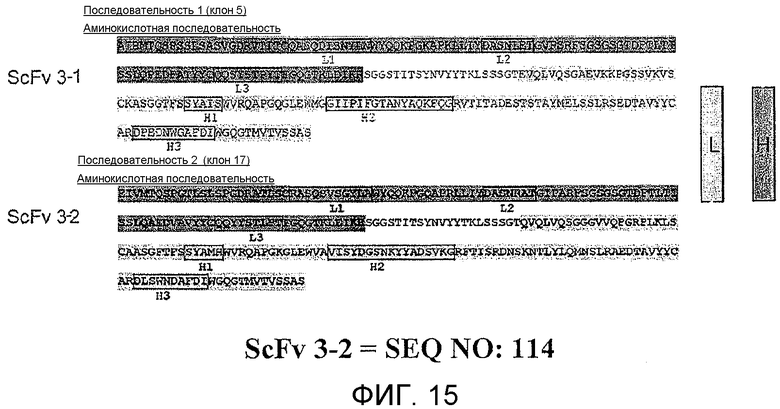
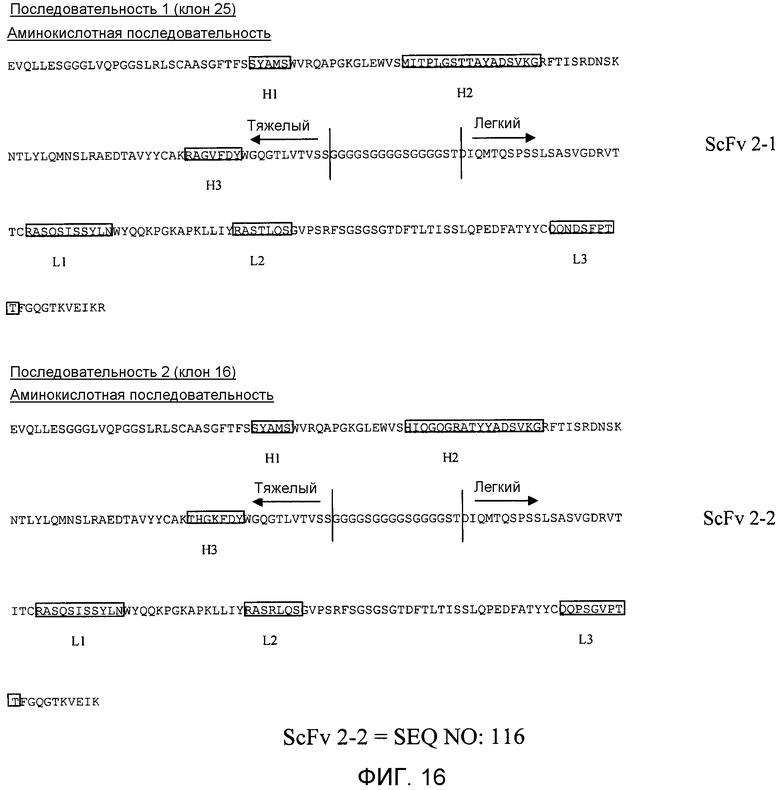
Изобретение относится к области биотехнологии, конкретно к генно-инженерным композициям для доставки терапевтического агента в область опухоли пациента, и может быть использовано в медицине. Композиция включает терапевтически эффективное количество фармацевтической композиции из функционального фрагмента Fc домена антитела, соединенного с одним или более SPARC-связывающим полипептидом (SBP), и фармацевтически приемлемого носителя. Композицию используют в способе доставки терапевтического агента, включающего функциональный фрагмент Fc домена антитела. Изобретение обеспечивает эффективную доставку терапевтического агента к области опухоли, экспрессирующей SPARC, у млекопитающего. 2 н. и 10 з.п. ф-лы, 16 ил., 4 пр.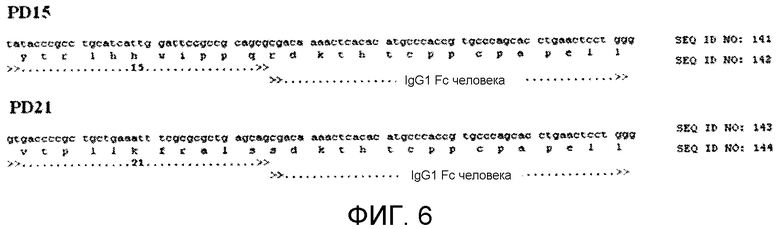
1. Композиция для доставки терапевтического агента, включающего функциональный фрагмент Fc домена антитела, к области опухоли, экспрессирующей SPARC у млекопитающего, включающая терапевтически эффективное количество фармацевтической композиции, включающей функциональный фрагмент Fc домена антитела, соединенного с одним или более SPARC-связующим полипептидом (SBP), и фармацевтически приемлемый носитель, где SBP состоит из одной или более аминокислотной последовательности с по крайней мере 10 последовательными аминокислотами из SEQ ID NO:1 или SEQ ID NO:2 или комбинации указанных 10 последовательных аминокислот.
2. Композиция по п.1, где SBP состоят из отдельного полипептида, содержащего одну SEQ ID NO:1; две или более SEQ ID NO:1; одну SEQ ID NO:2; две или более SEQ ID NO:2 или комбинацию одной или более SEQ ID NO:1 и одной или более SEQ ID NO:2.
3. Композиция по п.1, где SBP представляют собой два или более отдельных полипептидов, где SBP в указанных отдельных полипептидах состоят из одной SEQ ID NO:1; двух и более SEQ ID NO:1, одной SEQ ID NO:2, двух или более SEQ ID NO:2, или комбинации одной или более SEQ ID NO:1 и одной или более SEQ ID NO:2.
4. Композиция по п.1, 2 или 3, где функциональный фрагмент Fc домена антитела включает SEQ ID NO:118.
5. Композиция по любому из пп.1-3, где млекопитающим является человек-пациент.
6. Способ доставки терапевтического агента, включающего функциональный фрагмент Fc домена антитела, к области опухоли, экспрессирующей SPARC у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества фармацевтической композиции, включающей функциональный фрагмент Fc домена антитела, соединенного с одним или более SPARC-связующим полипептидом (SBP), и фармацевтически приемлемый носитель, где SBP состоит из одной или более аминокислотной последовательности с по крайней мере 10 последовательными аминокислотами из SEQ ID NO:1 или SEQ ID NO:2 или комбинации указанных 10 последовательных аминокислот.
7. Способ по п.6, где SBP состоит из полипептида, содержащего SEQ ID NO:1; две или более SEQ ID NO:1; одну SEQ ID NO:2; две или более SEQ ID NO:2 или комбинацию одной или более SEQ ID NO:1 и одной или более SEQ ID NO:2.
8. Способ по п.6, где имеются два отдельных SBP, где отдельные SBP состоят из одной SEQ ID NO:1; двух и более SEQ ID NO:1, одной SEQ ID NO:2, двух или более SEQ ID NO:2 или комбинации одной или более SEQ ID NO:1 и одной или более SEQ ID NO:2.
9. Способ по пп.6, 7 или 8 где функциональный фрагмент Fc домена антитела включает SEQ ID NO:118.
10. Способ по любому из пп.6-8, где млекопитающим является человек-пациент.
11. Композиция по любому из пп.1, 2 или 3, где общая длина SBP составляет менее 50 аминокислот.
12. Способ по любому из пп.6, 7 или 8, где общая длина SBP составляет менее 50 аминокислот.
| US 2007117133 A1, 24.05.2007 | |||
| DB EMBL/GenBank/DDBJ, N Q6ZUN2, 05.07.2004, cDNA FLJ43523 fis, clone PLACE5000282, weakly similar to Homo sapiens elastin (supravalvular aortic stenosis, Williams-Beuren syndrome) (ELN) | |||
| US 2008255035 A1, 16.10.2008 | |||
| СПОСОБ УКЛАДКИ НЕПАТРОНИРОВАННЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 0 |
|
SU181581A1 |
| WO 2007145318 A1, 21.12.2007 | |||
| ВЕКТОРЫ И УСИЛИТЕЛИ ТРАНСЦИТОЗА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ | 1996 |
|
RU2169010C2 |
Авторы
Даты
2013-08-27—Публикация
2009-12-07—Подача