Введение
Изобретение относится к химической промышленности, а именно к получению нового производного 2,3-дикарбоксиантрахинона как исходного соединения для синтеза металлокомплексов тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина, которые могут быть использованы в качестве красителей, катализаторов и в других отраслях науки и техники.
Уровень техники
Известен 2,3-дикарбоксиантрахинон [K.Sakamoto, E.Ohno Synthesis of Cobalt Phthalocyanine Derivatives and their Cyclic Voltammograms // Dyes and Pigments. 1997. Vol.35. N 4. P. 380].
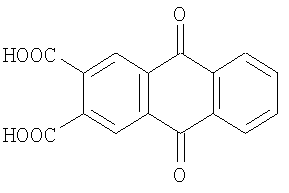
Однако при использовании этого соединения в качестве исходного можно получить лишь тетраантрахинонопорфиразины, которые не обладают растворимостью в органических средах. Поэтому они не могут быть использованы при крашении в растворителях.
Сущность изобретения
Изобретательская задача состояла в поиске нового соединения, являющегося производным 2,3-дикарбоксиантрахинона, которое при использовании его в качестве исходного продукта дало бы возможность синтезировать металлокомплексы тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина, обладающие свойствами красителей и катализаторов.
Поставленная задача решена 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахиноном формулы

Структура этого соединения доказана данными элементного анализа и ИК-спектроскопии.
Так, в ИК-спектре заявляемого соединения (фиг.1) можно выделить ряд общих полос поглощения с антрахиноном [C.Pecile, B.Lunelli Polarized Infrared Spectra of Single Crystals of 9, 10 - Anthraquinone and 9, 10 - Anthraquinone-ds // J. Chem. Phys. 1967. Vol.46. N6. P.2109-2118].
Изобретение позволяет получить следующие преимущества: использование 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона дает возможность синтезировать металлокомплексы тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина, обладающие свойствами красителей и катализаторов.
Сведения, подтверждающие возможность осуществления изобретения
Для реализации способа используют следующие вещества:
м-анизидин - 5344-90-1 Aldrich (Merck Index 122831);
уксусный ангидрид - ГОСТ 21039-75;
диангидрид пиромеллитовой кислоты - ТУ 6-14-786-72;
безводный хлористый алюминий - ОСТ 6-01-300-74;
концентрированная серная кислота - ГОСТ 4204-77.
Способ реализуют в три стадии.
Стадия 1. Ацилирование м-анизидина уксусным ангидридом по схеме:

В колбе, снабженной мешалкой, термометром и обратным холодильником, растворяют 6.1 г (0.05 моль) м-анизидина в 10 мл толуола. Затем к находящемуся в колбе раствору осторожно в течение 15 мин приливают 5.1 мл (0.5 моль) уксусного ангидрида, при этом происходит разогрев реакционной массы. После добавления всего количества уксусного ангидрида смеси дают охладиться. Выпавшие кристаллы игольчатой формы отфильтровывают на воронке Бюхнера. Промывают толуолом небольшим порциями до исчезновения запаха уксусной кислоты, промывают водой до нейтральной среды и сушат при температуре 75-80°С.
Получен 1-ацетиламино-3-метоксибензол.
Стадия 2. Ацилирование 1-ацетиламино-3-метоксибензола диангидридом пиромеллитовой кислоты в присутствии безводного хлористого алюминия, по схеме:

В трехгорлую колбу емкостью 100 мл, снабженную мешалкой, обратным холодильником и термометром, помещают 10.0 г (0.046 моль) диангидрида пиромеллитовой кислоты, 8.42 г (0.051 моль) 1-ацетиламино-3-метоксибензола и 20 мл гептана. Массу нагревают до 50°С и при перемешивании прибавляют 16.12 г (0.119 моль) безводного хлористого алюминия. Выдерживают 3 часа при кипении реакционной массы (≈100°С), а после отгонки гептана еще 6 часов при 120-130°С. После охлаждения к реакционной массе добавляют 50 мл воды и после выдержки в течение 30 минут добавляют горячий раствор соды и отделяют выпавший в осадок гидроксид алюминия. К водному слою фильтрата добавляют соляную кислоту до pH 3-4. Выпадает осадок 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты. Его отфильтровывают, промывают водой до нейтральной среды и сушат при температуре 75-80°С.
Получена 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовая кислота.
Стадия 3. Внутримолекулярная циклизация путем обработки 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты концентрированной серной кислотой (моногидратом), по схеме:
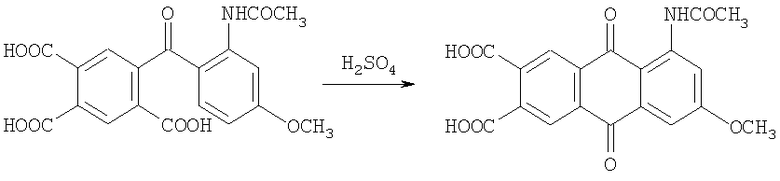
В колбу объемом 200 мл, снабженную мешалкой и термометром, помещают 10 мл моногидрата и нагревают до 130°С. Затем в течение 15 минут при интенсивном перемешивании вносят 5 г полученной 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты, температуру поднимают до 150°С и выдерживают в течение 5 часов. Массу после охлаждения при перемешивании выливают в 200 мл воды, фильтруют, промывают большим количеством ледяной воды, растворяют в содовом растворе и подкисляют соляной кислотой. Осадок отфильтровывают и промывают водой до исчезновения хлорид-ионов. Такую обработку повторяют дважды. Сушат при 100°С.
Найдено, %: С 59.50; Н 3.2. C19H13NO8.
Вычислено, %: С 59.54; Н 3.3.
Выход 4.1 г (87%).
Полученный целевой продукт - 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинон - твердое вещество белого цвета, обладает растворимостью в водно-щелочных растворах, горячей воде, бензоле, ДМФА.
Пример 1. Использование 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона в качестве исходного соединения для синтеза медного и кобальтового комплексов (5-ацетиламино-7-гептилокси)антрахинонопорфиразина.
Стадия 1. Синтез (5-ацетиламино-7-гидрокси)антрахинонопорфиразинов меди и кобальта.
В кварцевую ампулу помещают растертую смесь 0.23 г (0.60 ммоль) 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона, 0.24 г (4.00 ммоль) мочевины, 0.036 г (0.18 ммоль) ацетата меди или 0.037 г (0.18 ммоль) ацетата кобальта, 0.02 г (0.40 ммоль) хлорида аммония и 0.002 г (0.01 ммоль) молибдата аммония. Массу медленно нагревают до 180°С в течение часа и выдерживают 3 часа. После охлаждения реакционную массу измельчают, переносят в колбу емкостью 25 мл с 10 мл 1%-ного раствора гидроксида натрия и нагревают на водяной бане при 80°С в течение 40-50 минут. Полученную суспензию отфильтровывают, переосаждают из серной кислоты и промывают в аппарате Сокслета ацетоном в течение 10 часов. Сушат при 100°С.
Выход тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди 0.13 г.
Выход тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина кобальта 0.12 г.
Стадия 2. Синтез тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина меди и кобальта.
В одногорлую колбу на 50 мл, снабженную обратным холодильником, загружают 15 мл ДМФА, 0.12 г поташа (К2СO3), 0.05 г тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди или кобальта, 4 мл бромистого гептила (C7H15Br). Реакционную массу кипятят в течение 24 часов, далее выливают в холодную воду, фильтруют и промывают гексаном до исчезновения запаха бромистого гептана, далее водой, ацетоном и подвергают осадок колоночной хроматографии, сорбент - окись алюминия II степени активности, элюент - хлороформ.
Выход тетра-(5-ацетамино-7-гептилокси)антрахинонопорфиразина меди 0.04 г (85%).
Выход тетра-(5-ацетамино-7-гептилокси)антрахинонопорфиразина кобальта 0.04 г (84%).
Темно-зеленые вещества, обладают растворимостью в ДМФА, хлороформе, о-ксилоле, концентрированной серной кислоте.
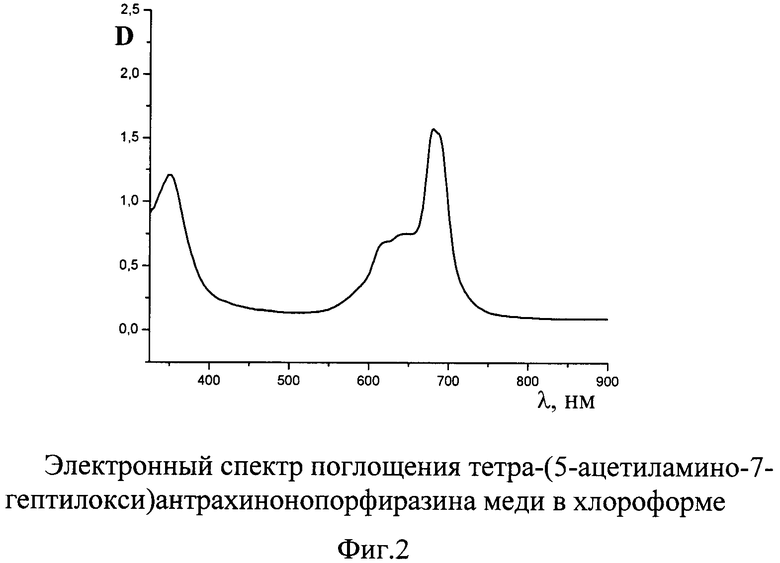
ЭСП медного комплекса в хлороформе, λmах, нм: 358, 641, 683 (фиг.2).
ЭСП кобальтового комплекса в хлороформе, λmах, нм: 358, 641, 684 (фиг.3).
С 67.56; Н 5.15; N 9.50. C100N12H92O16Co.
С 67.43; Н 5.21; N 9.44. C100N12H92O16Co.
Пример 2. Использование тетра-(5-ацетиламино-7-гептилокси)-антрахинонопорфиразина меди в качестве красителя для крашения полиэтилена и полистирола.
Крашение полиэтилена. 2 г полиэтилена помещают в фарфоровую чашку и нагревают до расплавления, затем вливают раствор 5 мл хлороформа, в котором растворено 0.003 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина меди. Выдерживают при нагревании до полного удаления хлороформа и выливают полученную массу в форму.
Образец прилагается (см. на фиг.5).
Крашение полистирола. 0.1 г полистирола растворяют при нагревании в 1 мл бензола и добавляют 1 мл бензола, в котором растворено 0.002 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина меди. Раствор кипятят в течение 3 минут и полученную массу выливают в форму.
Образец прилагается (см. на фиг.5).
Пример 3. Использование тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина кобальта в качестве красителя для крашения полиэтилена и полистирола.
Крашение полиэтилена. 2 г полиэтилена помещают в фарфоровую чашку и нагревают до расплавления, затем вливают раствор 5 мл хлороформа, в котором растворено 0.003 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина кобальта. Выдерживают при нагревании до полного удаления хлороформа и выливают полученную массу в форму.
Образец прилагается (см. на фиг.5).
Крашение полистирола. 0.1 г полистирола растворяют при нагревании в 1 мл бензола и добавляют 1 мл бензола, в котором растворено 0.002 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина кобальта. Раствор кипятят в течение 3 минут и полученную массу выливают в форму.
Образец прилагается (см. на фиг.5).
Пример 4. Использование тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина кобальта в качестве катализатора процессов окисления меркаптанов.
Исследование каталитической активности кобальтового комплекса тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина проводили на 0.02 М растворе диэтилдитиокарбамата натрия (ДЭДТК) на установке, изображенной на фиг.4:
1 - термометр, 2 - барботер, 3 - стеклянный стакан, 4 - образцы гетерогенного катализатора, 5 - насос, 6 - пробоотборник, 7 - обратный холодильник.
Для приготовления гетерогенного катализатора раствор кобальтового комплекса тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина в ДМФА с концентрацией 0.01 моль/л в 50 мл погружают и полностью пропитывают образец нетканого полипропилена массой 2 г. Затем полипропилен извлекают и погружают в воду для удаления органического растворителя. При этом происходит быстрая кристаллизация и осаждение кобальтового комплекса на поверхности полипропиленовых волокон. Концентрация комплекса на поверхности нетканого материала при такой обработке составляет 1.5·10-5 моль на 1 г полипропилена. Полученный таким образом гетерогенный катализатор помещают в стакан с ДЭДТК, снабженный насосом CIRCULATOR 650 производительностью 600 л/ч для подачи воздуха, необходимого для окисления, с постоянной скоростью 2 л/мин. После того, как в реакционной смеси в стакане установится постоянная температура, отбирают пробу 2 мл для определения начальной концентрации ДЭДТК и пропускают воздух. Момент подачи воздуха принимают за начало реакции. В ходе реакции через определенные промежутки времени отбирают пробы по 2 мл для спектрофотометрического определения текущей концентрации ДЭДТК.
Эффективная константа скорости окисления ДЭДТК составляет 2.6±0.4 сек-1.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕТРА-(5-АЦЕТИЛАМИНО-7-ГИДРОКСИ)-АНТРАХИНОНОПОРФИРАЗИНЫ МЕДИ И КОБАЛЬТА | 2009 |
|
RU2404186C1 |
| ТЕТРА-(5-АЦЕТИЛАМИНО-7-ГЕПТИЛОКСИ)АНТРАХИНОНОПОРФИРАЗИНЫ МЕДИ И КОБАЛЬТА | 2009 |
|
RU2404986C1 |
| ТЕТРА-(5-ОКТАДЕЦИЛСУЛЬФАМОИЛ)АНТРАХИНОНОПОРФИРАЗИНЫ МЕДИ И КОБАЛЬТА | 2008 |
|
RU2382788C1 |
| 2,3-ДИКАРБОКСИ-6-БРОМ-7-МЕТОКСИАНТРАХИНОН | 2005 |
|
RU2282617C1 |
| 2,3-ДИКАРБОКСИ-5,8-ДИМЕТОКСИАНТРАХИНОН | 2005 |
|
RU2277084C1 |
| 2,3-ДИКАРБОКСИ-6,7-ДИМЕТИЛАНТРАХИНОН | 2004 |
|
RU2264380C1 |
| 2,3-ДИКАРБОКСИ-6-(ПАРА-СУЛЬФОФЕНИЛЕН) АНТРАХИНОН | 2003 |
|
RU2258065C2 |
| 2,3-ДИКАРБОКСИ-5,8-ДИМЕТОКСИ-6-СУЛЬФОАНТРАХИНОН | 2005 |
|
RU2280027C1 |
| 2,3-ДИКАРБОКСИ-5,6,8-ТРИМЕТИЛАНТРАХИНОН | 2004 |
|
RU2264381C1 |
| 1-АЦЕТИЛ-5,10-ДИОКСИ-5,10-ДИГИДРО-2Н-АНТРА[2,3-D][1,2,3]ТРИАЗОЛ-7,8-ДИКАРБОНОВАЯ КИСЛОТА | 2009 |
|
RU2421450C1 |




Изобретение относится к получению 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона как исходного соединения для синтеза металлокомплексов тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина, которые могут быть использованы в качестве красителей и катализаторов. 5 ил.

2,3-Дикарбокси-5-ацетиламино-7-метоксиантрахинон формулы:

| CN 101139282 А, 12.03.2008 | |||
| GB 928700 А, 12.06.1963 | |||
| Докунихин Н.С., Мостославская Э.И | |||
| «Производные антрахинона | |||
| VIII | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Sakamoto К., Eiko Ohno "Synthesis of cobalt phthalocyanine derivarives and their cyclic voltammograms", DYES AND PIGMENTS 1997, Vol.35, No.4, p.375-386. | |||
Авторы
Даты
2010-11-27—Публикация
2009-06-15—Подача