Изобретение относится к биохимии и физиологии растений, в частности к иммунохимии растительных белков, а именно к получению антител к белковым макромолекулам, связанным с важнейшими процессами роста и развития растений. Данные антитела применяются для выявления и количественного определения растительных антигенов с использованием различных иммуноаналитических методов как в процессе их выделения из растительного материала, так и при создании иммунодиагностикумов, используемых в агробиотехнологии и создающих основу для совершенствования селекционного процесса с использованием современных клеточных технологий.
Известен способ выявления растительных антигенов с использованием моноспецифических антисывороток к этим антигенам (Володарский А.Д. Иммунохимический анализ антигенной структуры тканей растений. // В кн. Биофизические методы в физиологии растений. М.: Наука 1971, с.14-33). Согласно данному способу, на первом этапе получают полиспецифическую противотканевую антисыворотку на сумму антигенов исследуемой растительной ткани, в частности меристемы. Затем из этой антисыворотки удаляют антитела, перекрестно реагирующие с антигенами гетерологичной ткани. В случае меристематической ткани из противотканевой антисыворотки удаляются антитела, дающие реакции с антигенами дифференцированных клеток листа, стебля и корня. В результате получают антисыворотку узкой специфичности к исследуемому антигену и другим белкам меристематической ткани. Для дополнительного повышения специфичности антител следующего животного иммунизируют преципитатом, образованным исследуемым антигеном и антителами узкой специфичности к нему, и получают антисыворотку на этот преципитат.
Такую процедуру получения моноспецифических антисывороток следует признать неэкономичной в связи с тем, что для получения моноспецифических антисывороток требуется не один, а несколько этапов иммунизации лабораторных животных. Кроме того, этот метод отличает длительность около трех месяцев.
Наиболее близким к заявляемому техническому решению является способ получения моноспецифических антисывороток (Патент РФ на изобретение №4472621), заключающийся в электрофоретическом выделении антигена из общей массы белков в виде полоски полиакриламидного геля, измельчении, добавлении адъюванта Фрейнда и иммунизации животных полученной смесью посредством ее многократного введения с последующим забором крови у иммунизированных животных. При этом перед смешением измельченного геля с адьювантом полоски геля обрабатывают вначале водным раствором этанола, затем 0,01 М трис-НСl буферным раствором, рН 9,0, содержащим 2% додецилсульфат натрия, 5% 2-меркаптоэтанол, инкубируют вначале в течение 3 минут при 100°С и затем в течение 48 часов при комнатной температуре. Суспензию разделяют на элюат и осадок размельченного геля, каждую часть диализуют против физиологического раствора, а иммунизацию животных осуществляют комбинированно путем двукратного введения им подкожно в область лопаток элюата в смеси с адъювантом Фрейнда и однократного введения осадка без адъюванта.
Однако использование полученных данным способом моноспецифических антисывороток к растительным антигенам может быть затруднительно, т.к. различные белки сыворотки могут давать с растительными белками реакции, имеющие природу, отличную от взаимодействия антиген-антитело, что может существенно снижать специфичность и чувствительность иммунодот/блот анализа.
Задачей изобретения является разработка способа получения моноспецифических антител к белкам растительных клеток.
Техническим результатом является повышение специфичности получаемых антител к белкам растительных клеток за счет введения дополнительных операций по фракционированию антисывороток и получению очищенных поликлональных моноспецифических антител к растительному антигену - молекулярному маркеру меристематических клеток пшеницы.
Поставленная задача решается тем, что в способе получения моноспецифических антител, включающем получение очищенных белковых антигенов, иммунизацию лабораторных животных с последующим забором крови и получением специфических антисывороток, содержащих антитела к исследуемым антигенам, согласно изобретению проводят очистку антител, при которой антисыворотку фракционируют каприловой кислотой с последующим обессоливанием и катионообменной хроматографией, при этом в качестве антигена используют белок растительных клеток, в частности маркерный белок меристематических клеток пшеницы. Очищенный белковый антиген получают методом нативного электрофореза по известной молекулярной массе антигена. Иммунизацию лабораторных животных проводят трехкратно, при этом при первой иммунизации введение антигена проводят в подколенные лимфоузлы, а при второй и третьей - подкожно в активные точки по брюшине. Перед иммунизацией очищенные белковые антигены инкубируют в трис-НСl буферном растворе, содержащем додецилсульфат натрия, 2-меркаптоэтанол, в течение 12-20 часов при температуре 2-10°С. Каприловую кислоту вносят в антисыворотку до конечной объемной концентрацией ее 3%. Обессоливание осуществляют на колонке с сорбентом Sephadex G25 М, а катионообменную хроматографию проводят с использованием сорбента широкопористого гидрофильного сильного катионита, содержащего сульфогруппы, SP-Toyopearl HW 650M, в 0,05 М трис-НСl буфере с рН 4,5 в градиенте NaCl от 0 до 0,5М.
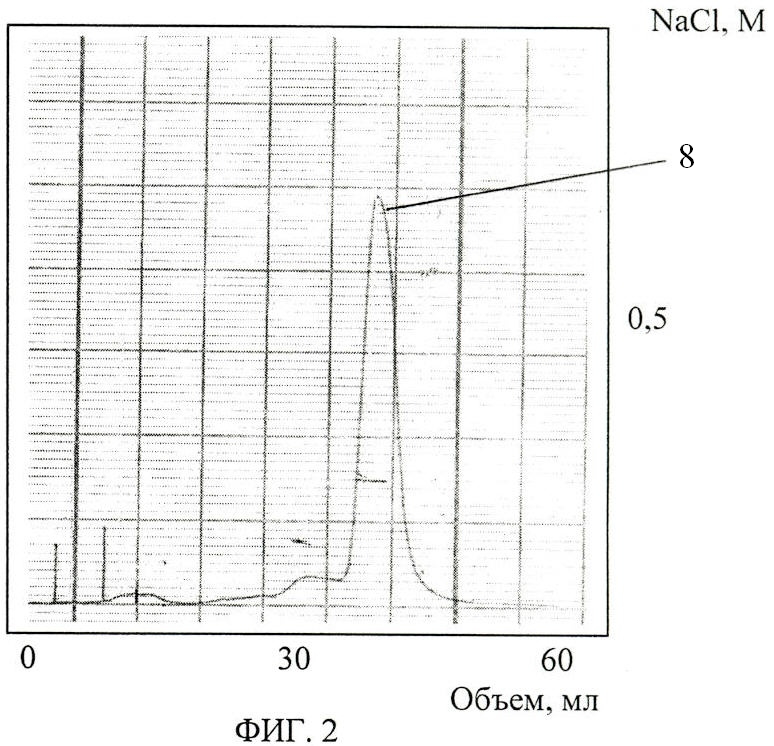
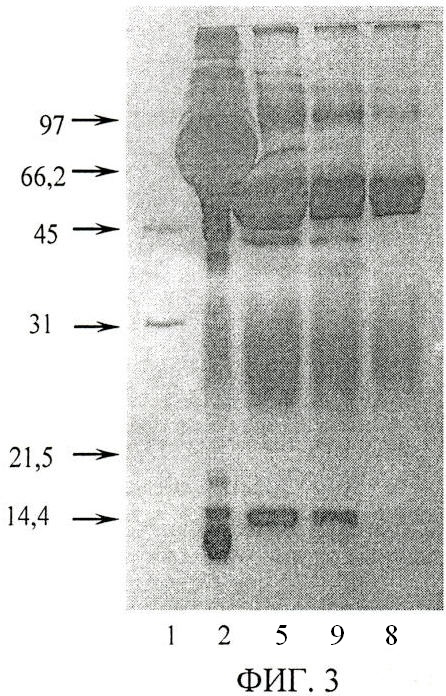
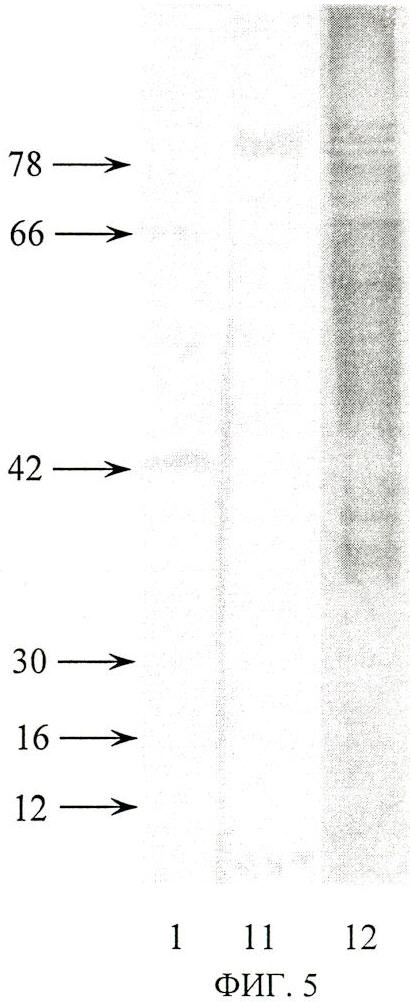
Изобретение поясняется чертежами. На фиг.1 представлены результаты электрофоретического разделения белков сыворотки крови кролика в полиакриламидном геле с додецилсульфатом натрия. Позициями на фиг.1 обозначены: 1 - белки-маркеры (указана их молекулярная масса, кДа); 2 - исходная сыворотка; 3, 4, 5, 6, 7 - супернатант сыворотки после осаждения каприловой кислотой при ее концентрации 2, 2.5, 3, 3.5 и 4% соответственно. На фиг.2 - результат хроматографического разделения белков сыворотки крови кролика на катионообменном сорбенте SP-Toyopearl HW 650M: 8 - фракция иммуноглобулинов после катионообменной хроматографии на SP-Toyopearl HW 650M. На фиг.3 - результаты электрофоретического разделения в полиакриламидном геле с додецилсульфатом натрия белков сыворотки крови кролика на различных стадиях очистки: 1 - белки-маркеры, указана их молекулярная масса, кДа; 2 - исходная сыворотка; 5 - супернатант сыворотки после осаждения 3%-ной каприловой кислотой; 9 - фракция белков сыворотки после гель-фильтрации на PD-10; 8 - фракция иммуноглобулинов после катионообменной хроматографии на SP-Toyopearl HW 650M. На фиг.4 - иммунодот-анализ: 8 - в качестве первичных антител использовалась фракция иммуноглобулинов к меристематическому антигену, очищенная каприловой кислотой в комбинации с катионообменной хроматографией; 10 - контроль с неспецифической сывороткой, очищенной таким же способом; а, 6, в, г, д - последовательные двукратные разведения суммарной фракции меристематических белков пшеницы. На фиг.5 - иммуноблот-анализ: 1 - белки-маркеры, указана их молекулярная масса, кДа, 11 - суммарная фракция белков меристемы, проявленная моноспецифическими антителами к меристематическому антигену; 12 - общий спектр белков меристемы пшеницы в электрофорезе в полиакриламидном геле с додецилсульфатом натрия.
Способ заключается в предварительной очистке белкового антигена с использованием методов хроматографии или электрофореза, или их сочетанием с достижением выделения антигена из общей массы белков в виде полоски полиакриламидного геля, измельчении в экстрагирующем буфере, добавлении адъюванта Фрейнда и иммунизации животных полученной смесью посредством ее многократного введения с последующим забором крови у иммунизированных животных. Полученную специфическую антисыворотку, содержащую антитела к исследуемому антигену, подвергают фракционированию каприловой кислотой с последующим обессоливанием и катионообменной хроматографией.
Заявляемым способом получают моноспецифические антитела к белкам растительных клеток.
Способ был опробован на растительном антигене - молекулярном маркере меристематических клеток пшеницы. Заявляемым способом была повышена специфичность антисыворотки путем исключения неиммунных реакций и получены антитела, которые из всей массы белков меристематических клеток пшеницы выявляют только исследуемый антиген.
Способ заключался в экстракции и предварительной очистке исследуемого белка - антигена меристематических клеток пшеницы, который включал несколько этапов: разрушение растительной ткани в жидком азоте и экстракцию в 0,05М трис-НСl-буфере, рН 7,8; центрифугирование экстракта при 20000g, 30 минут; гель-фильтрацию на Sephadex G 50; анионообменную хроматографию на колонке Mono-Q, HR 5/5, системы FPLC, Pharmacia в 0,025 М трис-HCl буфере с градиентом NaCl (5-20%), скорость протока 1 мл/мин, отделение белка от минорных примесей в нативном электрофорезе в полиакриламидном геле с градиентом концентрации акриламида (5-15%); выделение исследуемого антигена в составе полоски полиакриламидного геля; измельчение геля; инкубацию суспензии в буфере следующего состава: 0.05М трис-HCl, рН 8.0, 5% 2-меркаптоэтанол, 2% додецилсульфат натрия, в течение 24 часов при температуре 2-10°С в холодильнике. Полученную смесь подвергали диализу против физиологического раствора. Иммунизацию животных проводили трехкратно с двухнедельными перерывами: первоначально в подколенные лимфоузлы порцией измельченного геля, содержащего антиген с полным адъювантом Фрейнда, а вторую и третью иммунизации - в активные точки по брюшине порцией размельченного геля с неполным адъювантом Фрейнда, с последующим забором крови у иммунизированных животных и получением моноспецифической антисыворотки. Полученную антисыворотку подвергали фракционированию каприловой кислотой. Для этого сыворотку титровали до рН 6 ацетатным буфером 0.1 М, рН 4.5. Каприловую кислоту добавляли медленно по каплям до оптимальной концентрации. Данные электрофореза в денатурирующих условиях показали, что наибольшая степень очистки антител без потери их активности достигается при конечной объемной концентрации каприловой кислоты в сыворотке 3% (фиг.1). Для быстрого освобождения от каприловой кислоты и других низкомолекулярных примесей сыворотку подвергали обессоливанию на колонке с сорбентом Sephadex G-25 М, промытой 0,05 М трис-НСl буфером с рН 4,5. На следующем этапе очистки антител использовали хроматографию на колонке с катионным сорбентом SP-Toyopearl HW 650М в 0,05 М трис-НСl буфером с рН 4,5 с градиентом NaCl от 0 до 0,5 М (фиг.2). Элюируемые фракции анализировали методом электрофореза в денатурирующих условиях в присутствии додецилсульфата натрия (фиг.3) и определяли их активность и специфичность методом иммунодот-анализа. Очищенные таким образом антитела не дают неспецифического окрашивания исследуемых образцов в иммунодот-анализе (фиг.4). В иммуноблот-анализе полученные антитела в общем спектре белков апикальных стеблевых меристем пшеницы выявляли 2 полосы 83-84 кДа, соответствующие субъединицам исследуемого белка в электрофорезе в денатурирующих условиях (фиг.5).
Заявляемый способ получения моноспецифических антител к антигену - маркеру меристематических клеток пшеницы, может быть использован также для получения антител к другим белковым антигенам из различных тканей растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения моноспецифических антисывороток | 1988 |
|
SU1587724A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИКЛОНАЛЬНОЙ МОНОСПЕЦИФИЧЕСКОЙ СЫВОРОТКИ ПРОТИВ СЕКРЕТОРНОГО ИММУНОГЛОБУЛИНА А ЧЕЛОВЕКА - SIgA | 2012 |
|
RU2499605C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОСПЕЦИФИЧЕСКИХ ПОЛИКЛОНАЛЬНЫХ АНТИСЫВОРОТОК К АНТИГЕННО РОДСТВЕННЫМ БЕЛКАМ | 2001 |
|
RU2215294C2 |
| Способ получения моноспецифических антител к лактоферрицину человека | 2022 |
|
RU2795322C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОЙ СЫВОРОТКИ ДЛЯ ВЫЯВЛЕНИЯ ВИРУСА АЛЕУТСКОЙ БОЛЕЗНИ НОРОК | 2015 |
|
RU2592232C1 |
| СПОСОБ ВЫДЕЛЕНИЯ БЕЛКОВ ТОКСИН-КОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ И OmpU ХОЛЕРНОГО ВИБРИОНА КЛАССИЧЕСКОГО БИОВАРА | 2006 |
|
RU2324740C2 |
| ОЧИЩЕННАЯ И ИЗОЛИРОВАННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, РЕКОМБИНАНТНАЯ ПЛАЗМИДА, РЕКОМБИНАНТНЫЙ ВЕКТОР, ОЧИЩЕННЫЙ И ИЗОЛИРОВАННЫЙ БЕЛОК, ОЧИЩЕННЫЙ И ИЗОЛИРОВАННЫЙ БЕЛОК D 15 НАРУЖНОЙ МЕМБРАНЫ ИЛИ ЕГО ЧАСТЬ, СИНТЕТИЧЕСКИЙ ПЕПТИД, ХИМЕРНАЯ МОЛЕКУЛА, ИММУНОГЕННАЯ КОМПОЗИЦИЯ И АНТИСЫВОРОТКА ИЛИ АНТИТЕЛО | 1993 |
|
RU2141528C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ВЫСОКОМОЛЕКУЛЯРНОГО СОМАТИЧЕСКОГО СИБИРЕЯЗВЕННОГО АНТИГЕНА | 2002 |
|
RU2230570C1 |
| СИНТЕТИЧЕСКИЙ ПЕПТИД ДЛЯ ПОЛУЧЕНИЯ МОНОСПЕЦИФИЧНЫХ АНТИТЕЛ ПРОТИВ ИЗОФОРМЫ 2 ЭУКАРИОТИЧЕСКОГО ФАКТОРА ЭЛОНГАЦИИ ТРАНСЛЯЦИИ 1А | 2013 |
|
RU2562880C2 |
| СПОСОБ УСИЛЕНИЯ ИММУННОГО ОТВЕТА | 2010 |
|
RU2442604C1 |

Изобретение относится к биотехнологии и предназначено для получения моноспецифических антител к белкам растительных клеток. Получение очищенных белковых антигенов проводят с использованием методов хроматографии и электрофореза в полиакриламидном геле, при этом в качестве антигена используют маркерный белок меристематических клеток пшеницы. Полученные белковые антигены перед иммунизацией инкубируют в трис-HCl буферном растворе, содержащем додецилсульфат натрия и 2-меркаптоэтанол, в течение 12-24 часов при 2-10°С. Иммунизацию лабораторных животных проводят трехкратно с двухнедельными перерывами, при этом первую иммунизацию проводят в подколенные лимфоузлы порцией измельченного геля, содержащего антиген с полным адъювантом Фрейнда, а вторую и третью иммунизацию - в активные точки по брюшине порцией измельченного геля с неполным адъювантом Фрейнда. Получают из крови иммунизированных животных моноспецифическую сыворотку, содержащую антитела к исследуемым антигенам. Очистку антител проводят фракционированием антисыворотки каприловой кислотой с последующим обессоливанием и катионообменной хроматографией. Изобретение позволяет повысить специфичность и титр получаемых антител за счет введения дополнительных операций по их очистке. 5 з.п. ф-лы, 5 ил.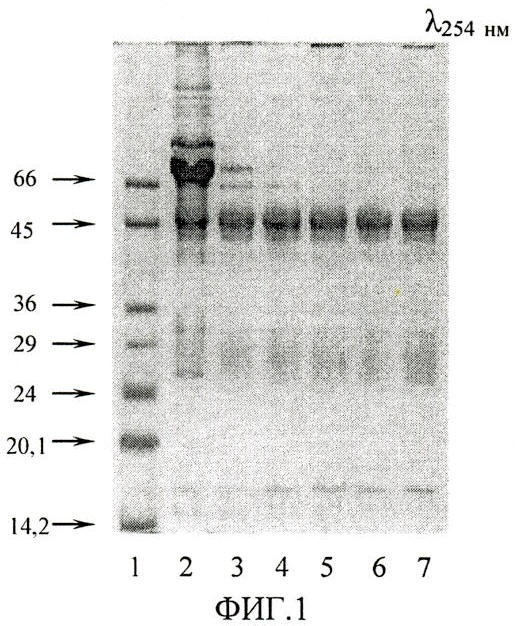
1. Способ получения моноспецифических антител, включающий получение очищенных белковых антигенов методом хроматографии и/или электрофореза в полиакриламидном геле, иммунизацию лабораторных животных полученным антигеном с последующим забором крови и получением специфических антисывороток, содержащих антитела к исследуемым антигенам, очистку антител, при которой антисыворотку фракционируют каприловой кислотой с последующим обессоливанием и катионообменной хроматографией, при этом в качестве антигена используют белок растительных клеток, отличающийся тем, что перед иммунизацией очищенные белковые антигены инкубируют в трис-НСl буферном растворе, содержащем додецилсульфат натрия, 2-меркаптоэтанол, в течение 12-24 ч при температуре 2-10°С, а иммунизацию лабораторных животных проводят трехкратно с двухнедельными перерывами, при этом первую иммунизацию проводят в подколенные лимфоузлы порцией измельченного геля, содержащего антиген с полным адъювантом Фрейнда, а вторую и третью иммунизацию - в активные точки по брюшине порцией измельченного геля с неполным адъювантом Фрейнда.
2. Способ по п.1, отличающийся тем, что хроматографическая очистка антигена включает гель-фильтрацию на Sephadex G 50 с последующей анионообменной хроматографией на колонке Mono-Q HR 5/5 системы FPLC в 0,025 М трис-HCl буфере с градиентом NaCl 5-20%.
3. Способ по п.1, отличающийся тем, что для получения очищенных белковых антигенов полиакриламидный гель используют с градиентом концентрации акриламида 5-15%.
4. Способ по п.1, отличающийся тем, что в буферном растворе для инкубирования трис используют в концентрации 0,05М с рН=8,0, 2-меркаптоэтанол в концентрации 5%, и додецилсульфат натрия в концентрации 2%, полученную смесь после инкубации подвергают диализу против физиологического раствора.
5. Способ по п.1, отличающийся тем, что перед фракционированием каприловой кислотой сыворотку титруют до рН 6,0 ацетатным буфером 0,1 М, рН 4,5, а каприловую кислоту добавляют в антисыворотку медленно по каплям до конечной объемной концентрации ее 3%.
6. Способ по п.1, отличающийся тем, что обессоливание осуществляют на колонке с сорбентом Sephadex G25 М, а катионообменную хроматографию проводят с использованием сорбента - широкопористого гидрофильного сильного катионита, содержащего сульфогруппы, SP-Toyopearl HW 650M, в 0,05 М трис буфере с рН 4,5 в градиенте NaCl до 0,5М.
| ФАДЕЕВА И.Ю | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - Саратов, 25.04.2007 | |||
| Способ получения моноспецифических антисывороток | 1988 |
|
SU1587724A1 |
| ШТАММ ВИРУСА ЗАПАДНОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ (WESTERN ENCEPHALOMYELITIS VIRUS-WEE 163-A) ГКВ № 964 ДЛЯ ПРИГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ ПРЕПАРАТОВ | 2003 |
|
RU2242512C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОСПЕЦИФИЧЕСКОЙ АНТИСЫВОРОТКИ | 1992 |
|
RU2019190C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2011-01-27—Публикация
2008-05-04—Подача