Область техники, к которой относится изобретение
Настоящее изобретение относится к способу и набору для детектирования микроорганизма, содержащегося в пищевом продукте, биологической пробе и пробе окружающей среды, такой как промышленная вода и водопроводная вода. Более точно, настоящее изобретение относится к способу и набору для детектирования микроорганизма, которые позволяют селективно детектировать живые клетки микроорганизма, содержащиеся в пищевом продукте, биологической пробе и пробе окружающей среды, такой как промышленная вода и водопроводная вода.
Уровень техники
Способ культуры на чашках обычно использовали для измерения общих количеств живых бактерий в пищевых продуктах, биологических пробах или пробах окружающей среды. Однако способ культуры на чашках требует времени около двух дней для получения результата.
Благодаря усовершенствованию способов стерилизации и способов обработки пищевых продуктов потребность в отличении живых состояний микроорганизмов от мертвых состояний микроорганизмов, существующих в тест-пробах, является увеличивающейся даже для случаев, в которых эти клетки существуют в чрезвычайно малом количестве. В частности, в областях санитарного надзора и клинического испытания в качестве быстрого способа детектирования бактерий делаются попытки определения присутствия или отсутствия бактерий или определения количества бактерий амплификацией генов, специфических для этих бактерий, при помощи ПЦР до такого количества, что эти гены могут наблюдаться визуально. Однако, если мишенью является бактериальная ДНК, фон мертвых бактерий, первоначально содержащихся в тест-пробе, также детектируется, и, следовательно, положительный результат, полученный при помощи ПЦР, необязательно предполагает присутствие живых бактерий. Таким образом, существующая ситуация в областях санитарного надзора и клинического испытания такова, что ПЦР не используется широко, хотя она является высокочувствительным и быстрым способом.
В настоящее время предпринимается попытка детектирования и количественного определения только живых клеток микроорганизма в тест-пробе получением кДНК с использованием обратной транскриптазы для мРНК в качестве мишени и выполнением ПЦР с праймерами, специфическими в отношении различных бактерий. Однако в этом способе сама обратная транскрипция мРНК мертвых клеток не ингибируется, и, когда в тест-пробе содержатся 104 КОЕ/мл или 104 КОЕ/г или более мертвых клеток, детектируется фон этих мертвых клеток. Таким образом, этот способ не может быть назван достаточным в качестве способа определения живых и мертвых состояний.
Конкретно, в качестве способа различения живого состояния и мертвых состояний микроорганизмов, таких как бактерии, с использованием способа ПЦР, были описаны способы, описанные в патентных документах 1 и 2. Однако с использованием этого способа ПЦР остаются следующие проблемы в этих способах различения живого и мертвого состояний микроорганизмов.
Что касается способа, описанного в патентном документе 1, упоминаются примеры различения мертвых клеток, содержащихся в прокипяченных пищевых продуктах, подвергнутых продолжительной стерилизации при высокой температуре при 100°С в течение 10-30 минут, и микроорганизмов, содержащихся в пищевых продуктах, подвергнутых стерилизации этанолом или стерилизации формальдегидом. Однако, особенно в случае обработки последнего типа, нет пищевых продуктов, действительно подвергаемых таким обработкам пастеризации. Кроме того, не предполагается детектирование только живых микроорганизмов, подвергнутых существующему основному способу стерилизации в пищевой промышленности, низкотемпературной длительной пастеризации (LTLT-пастеризации), высокотемпературной кратковременной пастеризации (HTST-пастеризации) или ультравысокотемпературной пастеризации (UHT-пастеризации), и детектирование только живых специфических патогенных бактерий в клинических образцах пациентов с инфекционным заболеванием, которым вводят антибиотики. Кроме того, в случае тест-пробы пищевого продукта или клинического образца, содержащих фон мертвых клеток при концентрации 104 КОЕ/мл или выше, количества конечных продуктов ПЦР-амплификации, полученных из мертвых клеток, превышают предел детектирования способа патентного документа 1, и, следовательно, невозможно определить, происходит ли положительная реакция тест-пробы, полученная при помощи ПЦР, из живых клеток или мертвых клеток.
Далее, в качестве патентного документа 2 описан способ различения живых клеток и мертвых клеток с использованием относительного уменьшения молярного отношения РНК/ДНК мертвых клеток в сравнении с молярным отношением РНК/ДНК живых клеток. В этом способе экстрагируют тотальную РНК, получают комплементарную кДНК с использованием реакции обратной транскрипции, затем выполняют ПЦР для расчета ее величины Ct и молярную концентрацию РНК получают с использованием отдельно полученной калибровочной кривой. Отдельно район хромосомной ДНК, соответствующий этой РНК, амплифицируют при помощи ПЦР для получения ее величины Ct и молярную концентрацию этой хромосомной ДНК рассчитывают на основе этой калибровочной кривой для получения молярного отношении РНК/ДНК. То есть описанная выше процедура требует трудоемкой экстракции общей РНК и выполнения двухстадийной обратной реакции транскрипции и ПЦР. Таким образом, этот способ является худшим относительно обычной ПЦР, нацеленной на ДНК, в определении количества и быстроте выполнения. Далее, РНК непрерывно продуцируется в живых клетках, тогда как РНК, полученная из мертвых клеток, разрушается на ранней стадии. Таким образом, этот способ лишен стабильности. Кроме того, в пищевом продукте или клиническом образце, содержащем мертвые клетки в высокой концентрации, только живые клетки 1/10 этой концентрации могут быть детектированы этим способом. Таким образом, этот способ трудно применять в областях санитарного контроля пищевых продуктов и в клиническом испытании, которые требуют быстроты, высокой чувствительности и точности.
Патентный документ 1: отечественная выложенная публикация японского перевода заявки РСТ (KOHYO) № 2003-530118.
Патентный документ 2: международная патентная публикация WO 2002/052034.
Описание изобретения
Проблемы, подлежащие решению этим изобретением
Задачей настоящего изобретения является обеспечение способа селективного детектирования живых клеток (жизнеспособных и культивируемых клеток) микроорганизма, содержащегося в пищевом продукте или биологической пробе, в противоположность мертвым клеткам или поврежденным клеткам (поврежденным клеткам или жизнеспособным, но не культивируемым клеткам (VNC-клеткам)) микроорганизма, то есть способа быстрого детектирования, альтернативного способу культивирования, но достигающего существующих характеристик способа культивирования, и набора для выполнения этого способа.
Средства решения этих проблем
Авторы настоящего изобретения провели экстенсивные исследования в отношении способа различения между жизнью и смертью микроорганизмов, который применим к различным способам стерилизации и пригоден для санитарного контроля пищи с высокой чувствительностью детектирования, и в отношении способа детектирования конкретного патогена в пациенте с инфекцией в больнице или в клинической практике. В результате авторы настоящего изобретения обнаружили, что эта оценка может выполняться быстро при помощи способа различения живых клеток микроорганизма и поврежденных клеток микроорганизма в тест-пробе, который предусматривает: обработку тест-пробы сшивающим агентом, способным сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; облучение этой пробы светом, имеющим длину волны 350 нм-700 нм; удаление сшивающего агента; добавление среды, пригодной для культуры для микроорганизма, содержащегося в этой тест-пробе, и инкубирование этой тест-пробы в течение определенного периода времени; обработку этой пробы опять сшивающим агентом; облучение этой пробы светом, имеющим длину волны 350 нм-700 нм, и селективную амплификацию хромосомной ДНК этого микроорганизма реакцией амплификации нуклеиновых кислот. Таким образом, было завершено настоящее изобретение.
То есть настоящее изобретение обеспечивает способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий стадии:
а) добавления сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к этой тест-пробе;
b) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
с) удаления сшивающего агента, содержащегося в тест-пробе, облученной светом;
d) добавления среды к тест-пробе, из которой удален сшивающий агент, и инкубирования этой тест-пробы;
е) добавления опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубированной тест-пробе;
f) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
g) экстракции ДНК из этой тест-пробы и амплификации района-мишени экстрагированной ДНК при помощи способа амплификации нуклеиновых кислот; и
h) анализа амплифицированного продукта.
В этом способе предпочтительно анализировать амплифицированный продукт на основе калибровочной кривой, которая получена с использованием стандартной пробы этого микроорганизма и показывает зависимость между количеством этого микроорганизма и амплифицированного продукта.
Далее, в этом способе предпочтительно использовать способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК в качестве способа амплификации нуклеиновых кислот.
В предпочтительном варианте осуществления вышеуказанного способа ПЦР выполняют с использованием ПЦР реального времени и выполняют одновременно ПЦР и анализ амплифицированного продукта.
Далее, в этом способе тест-пробой является предпочтительно пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
Кроме того, в этом способе предпочтительно выбирать сшивающий агент из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоралена.
Далее, в этом способе район-мишень предпочтительно имеет длину 50-5000 оснований.
Далее, в этом способе микроорганизм является предпочтительно патогенной бактерией. В этом аспекте предпочтительно районом-мишенью является патогенный ген.
Кроме того, настоящее изобретение обеспечивает набор для детектирования живой клетки микроорганизма в тест-пробе способом амплификации нуклеиновых кислот, содержащий следующие компоненты:
сшивающий агент, способный сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм;
среду; и
праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, который является мишенью детектирования, способом амплификации нуклеиновых кислот.
В этом наборе предпочтительно способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК представляет собой способ амплификации нуклеиновых кислот.
В этом наборе предпочтительно выбирать сшивающий агент из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоларена.
Краткое описание фигур
[Фиг.1] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов hlyA-ПЦР Listeria (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Listeria.
Поврежденные: поврежденные клетки Listeria.
[Фиг.2] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов ompA-ПЦР Enterobacter sakazakii (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Enterobacter sakazakii.
Поврежденные: поврежденные клетки Enterobacter sakazakii.
[Фиг.3] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов MMS-ПЦР Enterobacter sakazakii (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Enterobacter sakazakii.
Поврежденные: поврежденные клетки Enterobacter sakazakii.
[Фиг.4] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов invA-ПЦР Salmonella (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Salmonella.
Поврежденные: поврежденные клетки Salmonella.
[Фиг.5] Изображение электрофореза, иллюстрирующее интенсивности полос конечных амплифицированных продуктов энтеротоксин-ПЦР Salmonella (живых клеток и поврежденных клеток), обработанных одностадийной обработкой и многостадийной обработкой сшивающим агентом (ЕМА).
Живые: живые клетки Salmonella.
Поврежденные: поврежденные клетки Salmonella.
Описание предпочтительных вариантов осуществления
Далее подробно описываются предпочтительные варианты осуществления настоящего изобретения. Однако настоящее изобретение не ограничивается следующими предпочтительными вариантами осуществления и может быть модифицировано в объеме настоящего изобретения. Процент в настоящем описании выражен в виде масс. процента, если нет другого указания.
Мишень, подлежащая детектированию способом настоящего изобретения, включает в себя все типы нуклеиновых кислот, в частности одноцепочечную ДНК, двухцепочечную ДНК, одноцепочечную РНК и двухцепочечную РНК, пока эта мишень может в конечном счете амплифицироваться. Из этих мишеней мишенью, подлежащей детектированию, предпочтительно является ДНК, еще более предпочтительно двухцепочечная ДНК.
<1> Способ настоящего изобретения
Способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий стадии:
а) добавления сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к этой тест-пробе;
b) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
с) удаления сшивающего агента, содержащегося в тест-пробе, облученной светом;
d) добавления среды к тест-пробе, из которой удален сшивающий агент, и инкубирования этой тест-пробы;
е) добавления опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубированной тест-пробе;
f) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350 нм-700 нм;
g) экстракции ДНК из этой тест-пробы и амплификации района-мишени экстрагированной ДНК при помощи способа амплификации нуклеиновых кислот; и
h) анализа амплифицированного продукта.
В описании настоящего изобретения термин «тест-проба» относится к объекту, содержащему живые клетки микроорганизма, подлежащие детектированию. Тест-проба не ограничивается конкретно, пока присутствие микроорганизма может быть детектировано амплификацией специфического района хромосомной ДНК способом амплификации нуклеиновых кислот. Предпочтительные примеры тест-пробы включают в себя пищевые продукты, пробы крови, пробы мочи, пробы спинальной жидкости, пробы синовиальной жидкости, пробы плеврального выпота, промышленную воду, водопроводную воду, грунтовую воду, речную воду и дождевую воду. В частности, предпочтительные примеры пищевых продуктов включают в себя: напитки, такие как безалкогольные напитки, газированные безалкогольные напитки, обогащенные напитки, содержащие фруктовые соки напитки и содержащие Lactobacillus напитки (включая концентраты и порошки этих напитков); замороженные кондитерские продукты, такие как мороженое, фруктовое мороженое и ледяная стружка; молочные продукты, такие как подвергшееся технологической обработке молоко, молочные напитки, кисломолочные продукты и масло; энтеральные пищевые продукты, жидкие пищевые рационы, молоко для новорожденных, напитки для спортсменов; и функциональные пищевые продукты, такие как пищевые продукты диетического питания и диетические добавки. В настоящем изобретении тест-пробой может быть любой из таких продуктов или самих биологических проб или может быть любой из их разбавленных или концентрированных продуктов, полученных другой предобработкой, отличающейся от способа настоящего изобретения. Примеры такой предобработки включают в себя обработку нагреванием, фильтрацию и центрифугирование.
Кроме того, чужеродные вещества, такие как клетки, другие, чем микроорганизмы, коллоидные белковые частицы и липиды, в тест-пробе могут быть удалены или уменьшены обработкой ферментами или т.п. В случае когда эта тест-проба является любой из молока, молочных продуктов и пищевых продуктов, полученных из молока или молочных продуктов, примеры клеток, других, чем микроорганизмы, в этой тест-пробе включают в себя бычьи лейкоциты и эпителиоциты молочной железы. Между тем, в случае когда эта тест-проба является любой из биологических проб, таких как пробы крови, пробы мочи, пробы спинальной жидкости, пробы синовиальной жидкости, пробы плеврального выпота, примеры этих клеток включают в себя эритроциты, лейкоциты (такие как гранулоциты, нейтрофилы, базофилы, моноциты и лимфоциты) и тромбоциты.
Этот фермент не ограничивается конкретно, пока он может деградировать эти чужеродные вещества и не повреждает живые клетки подлежащего детектированию микроорганизма, и примеры его включают в себя липид-деградирующие ферменты и белок-деградирующие ферменты. Из них могут быть использованы один фермент или два или более ферментов, но предпочтительно используют липид-деградирующий фермент и белок-деградирующий фермент.
Примеры липид-деградирующих ферментов включают в себя липазу и фосфатазу, и примеры белок-деградирующих ферментов включают в себя протеиназу К и проназу.
«Микроорганизм» является объектом, подлежащим детектированию способом настоящего изобретения, и не ограничивается конкретно, пока он может быть детектирован способами амплификации нуклеиновых кислот, и сшивающий агент действует на живые клетки этого микроорганизма иным образом, чем на мертвые клетки и поврежденные клетки этого микроорганизма. Предпочтительные примеры включают в себя бактерии, грибы, дрожжи и т.п. Бактерии включают в себя как грамположительные бактерии, так и грамотрицательные бактерии. Примеры грамположительных бактерий включают в себя бактерии Staphylococcus, такие как Staphylococcus epidermifis, бактерии Streptococcus, бактерии Listeria, такие как Listeria monocytogenes, бактерии Bacillus, такие как Bacillus cereus, бактерии Mycobacterium, бактерии Clostridium, такие как Clostridium botulinum и Clostridium perfringens и т.д. Примеры грамотрицательных бактерий включают в себя бактерии Escherichia, такие как Escherichia coli, бактерии Enterobacter, такие как Enterobacter sakazakii, бактерии Citrobacter, такие как Citrobacter kozeri, и бактерии Klebsiella, такие как Klebsiella oxytoca, бактерии Salmonella, бактерии Vibrio, бактерии Pseudomonas, и т.д.
В настоящем изобретении термин «живая клетка» относится к клетке в таком состоянии, что эта клетка пролиферирует и проявляет метаболические активности этого микроорганизма (жизнеспособном и культивируемом состоянии), когда ее культивируют обычно при предпочтительных условиях культивирования, и является клеткой, по существу не имеющей повреждения клеточной стенки. Что касается вышеупомянутых метаболических активностей, примерами могут быть АТФ-активность, эстеразная активность и т.д.
«Мертвая клетка» является клеткой в таком состоянии, что она не может пролиферировать и не проявляет метаболические активности (мертвом состоянии), даже если ее культивируют при оптимальных условиях культивирования. Кроме того, она находится в таком состоянии, что, хотя структура клеточной стенки сохраняется, сама эта клеточная стенка является сильно поврежденной и ядерный агент-краситель, проявляющий слабую проникаемость, такой как иодид пропидия, может проникать или увеличивать проницаемость этой клеточной стенки.
«Поврежденная клетка» (поврежденная клетка или жизнеспособная, но не культивируемая клетка) является клеткой в таком состоянии, что даже при культивировании при обычно предпочтительных условиях культивирования она едва ли пролиферирует, так как она повреждена вследствие искусственного стресса или связанного с окружающей средой стресса, и она обнаруживает метаболические активности на более низком уровне в сравнении с живой клеткой, но на значимом уровне в сравнении с мертвой клеткой.
Детектирование бактерий, проявляющих состояние поврежденной клетки вследствие обработки слабым нагреванием или введением антибиотиков, привлекает внимание, в частности, в области санитарного контроля пищевых продуктов и клинического исследования, и настоящее изобретение обеспечивает способ детектирования микроорганизма, который позволяет не только детектирование живых клеток, но также различение живых клеток и мертвых клеток или поврежденных клеток.
Единицей количества клеток является обычно количество клеток/мл для всех живых клеток, поврежденных клеток и мертвых клеток. Количество живых клеток может быть аппроксимировано количеством образованных колоний (КОЕ/мл (колониеобразующих единиц/мл)), получаемых культивированием этих клеток при оптимальных условиях на подходящей среде для чашек. Стандартная проба поврежденных клеток микроорганизма может быть приготовлена, например, подверганием суспензии живых клеток обработке нагреванием, например обработке нагреванием в кипящей воде. Количество поврежденных клеток в такой пробе может быть аппроксимировано КОЕ/мл в суспензии живых клеток перед обработкой нагреванием. Хотя время обработки нагреванием в кипящей воде для получения поврежденных клеток варьируется в зависимости от типа микроорганизма, поврежденные клетки бактерий, описанных в примерах, например, могут быть получены обработкой нагреванием приблизительно 50 секунд. Кроме того, стандартная проба поврежденных клеток микроорганизма может быть также приготовлена обработкой антибиотиком. В таком случае количество поврежденных клеток может быть аппроксимировано на основе количества образованных колоний (КОЕ/мл), наблюдаемых при культивировании этих клеток при оптимальных условиях на подходящей среде для чашек, т.е. суспензию живых клеток обрабатывают антибиотиком, затем антибиотик удаляют, измеряют коэффициент пропускания видимого света (длина волны: 600 нм) через эту суспензию, т.е. мутность этой суспензии, и измеренная мутность может сравниваться с мутностью суспензии живых клеток с известной плотностью живых клеток для расчета количества поврежденных клеток, обработанных антибиотиком.
Способ настоящего изобретения предназначен для детектирования живых клеток микроорганизма, и клетками этого микроорганизма, отличаемыми от живых клеток, могут быть поврежденные клетки или мертвые клетки.
В настоящем изобретении «детектирование живых клеток» включает в себя как определение присутствия или отсутствия живых клеток в тест-пробе, так и определение количества живых клеток в тест-пробе. Это количество живых клеток не ограничивается абсолютным количеством и может быть относительным количеством относительно количества живых клеток в контрольной пробе.
Далее способ настоящего изобретения будет объяснен для каждой стадии.
(1) Стадия а)
Тест-пробу обрабатывали сшивающим агентом, способным сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм.
Сшивающим агентом, который должен быть использован в настоящем изобретении, является сшивающий агент, который может интеркалироваться в хромосомную ДНК и связываться ковалентно с хромосомной ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, для сшивания посредством этого молекул ДНК.
Этот сшивающий агент предпочтительно имеет различные действия на живые клетки микроорганизма в сравнении с поврежденными или мертвыми клетками микроорганизма и соматическими клетками, такими как бычьи лейкоциты, лейкоциты или тромбоциты. Более конкретно, этим сшивающим агентом является предпочтительно сшивающий агент, который более легко проходит через клеточные мембраны соматических клеток, таких как бычьи лейкоциты, лейкоциты или тромбоциты, в сравнении с клеточными стенками живых клеток микроорганизма.
Примеры этого сшивающего агента включают в себя моноазид этидия, диазид этидия, псоларен, 4,5',8-триметилпсоларен (PMA) и 8-метоксипсоларен. Один тип этих сшивающих агентов может использоваться отдельно, или могут быть использованы два или более их типа в комбинации.
Условия обработки сшивающим агентом могут быть установлены подходящим образом. Например, условия для легкого различения живых клеток микроорганизма и мертвых или поврежденных клеток микроорганизма могут быть определены: добавлением различных концентраций сшивающего агента к суспензиям живых клеток подлежащего детектированию микроорганизма и мертвых и поврежденных клеток микроорганизма; оставлением этих суспензий стоять в течение различных периодов времени; разделением этих клеток центрифугированием и анализом этих клеток при помощи способа амплификации нуклеиновых кислот. Кроме того, условия легкого различения живых клеток микроорганизма и разнообразных клеток могут быть определены: добавлением различных концентраций сшивающего агента к суспензиям живых клеток подлежащего детектированию микроорганизма и соматических клеток, таких как бычьи лейкоциты или тромбоциты; оставлением этих суспензий стоять в течение различных периодов времени; разделением этих клеток и разнообразных клеток центрифугированием и анализом этих клеток при помощи способа амплификации нуклеиновых кислот. Конкретно: примерами условий являются условия обработки моноазидом этидия при конечной концентрации 1-100 мкг/мл в течение 5 минут-48 часов при 4-10°С; условия обработки диазидом этидия при конечной концентрации 1-100 мкг/мл в течение 5 минут-48 часов при 4-10°С; условия обработки псолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С; условия обработки 4,5',8-триметилпсолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С; и условия обработки 8-метоксипсолареном при конечной концентрации 1×10-5-10 мкг/мл в течение 5 минут-48 часов при 25-37°С.
(2) Стадия b)
Затем каждую тест-пробу, содержащую сшивающий агент, облучают светом, имеющим длину волны 350 нм-700 нм.
Этот сшивающий агент может легко проходить через клеточные стенки мертвых клеток и поврежденных клеток в сравнении с клеточными стенками живых клеток микроорганизма. Таким образом, предполагается, что этот сшивающий агент по существу не проходит через клеточные стенки живых клеток микроорганизма, но проходит через клеточные стенки поврежденных или мертвых клеток микроорганизма или мертвых соматических клеток, при условии, что эту обработку выполняют в пределах вышеупомянутых периодов времени. Между тем, живые соматические клетки имеют только клеточные мембраны и не имеют клеточных стенок, и, следовательно, предполагается, что этот сшивающий агент проходит через соматические клетки. В результате сшивающий агент перемещается в мертвые соматические клетки, мертвые и поврежденные клетки микроорганизма и случайным образом связывается ковалентным присоединением с хромосомной ДНК или интеркалируется в хромосомную ДНК. Затем этот сшивающий агент облучается светом, имеющим длину волны 350 нм-700 нм, для сшивания молекул ДНК и вызывает большую деформацию в хромосомной ДНК, приводя к разрыванию (фрагментации/расщеплению) хромосомной ДНК.
Свет, имеющий длину волны 350 нм-700 нм, может включать в себя по меньшей мере свет, имеющий длину волны 350 нм-700 нм, и этот свет может быть светом единственной длины волны или светом множественных длин волн. Кроме того, все компоненты света могут находиться в диапазоне 350 нм-700 нм или этот свет может включать в себя коротковолновый свет, имеющий длину волны, более короткую чем 350 нм, и/или длинноволновый свет, имеющий длину волны, более длинную чем 700 нм. Пик в распределении интенсивности находится предпочтительно в диапазоне 350 нм-700 нм. Предпочтительно этот свет не включает в себя компонент с короткой длиной волны в такой степени, что хромосомная ДНК микроорганизма расщепляется только облучением светом.
Когда хромосомная ДНК поврежденных или мертвых клеток разрывается, что более предпочтительно, чем хромосомная ДНК живых клеток микроорганизма, район-мишень хромосомной ДНК живых клеток амплифицируют способом амплификации нуклеиновых кислот, в то время как район-мишень поврежденных или мертвых клеток разрывается (расщепляется), приводя к ингибированию реакций амплификации нуклеиновой кислоты. В результате живые клетки микроорганизма могут быть детектированы более селективно, чем поврежденные или мертвые клетки.
В предпочтительном варианте осуществления настоящего изобретения сшивающим агентом является моноазид этидия, и этот способ включает в себя стадию облучения тест-пробы, к которой добавлен моноазид этидия, светом, имеющим длину волны 350 нм-700 нм. Моноазид этидия (ЕМА) может легко проходить через клеточные стенки поврежденных или мертвых клеток в сравнении с клеточными стенками живых клеток микроорганизма. Таким образом, предполагается, что ЕМА по существу не проходит через клеточные стенки живых клеток микроорганизма, но проходит через клеточные стенки поврежденных или мертвых клеток микроорганизма или клеточные мембраны мертвых соматических клеток. Следует обратить внимание на то, что, в случае когда живыми клетками являются лейкоциты и тромбоциты в крови, ЕМА может легко проходить через клеточные стенки этих клеток в стерилизованной воде или гипотоническом солевом растворе. ЕМА перемещается в мертвые соматические клетки и поврежденные и мертвые клетки и интеркалируется случайным образом в ядерную ДНК, и только ЕМА, интеркалируемый при облучении светом, имеющим длину волны 350 нм-700 нм, превращается в нитрен и связывается ковалентно с ядерной ДНК со сшиванием ДНК-молекул. Затем предполагается, что ЕМА, который связывается ковалентно с основаниями и дезоксирибозами в хромосомной ДНК во многих точках, вызывает большую деформацию в хромосомной ДНК, приводя к разрыванию (фрагментированию) этой хромосомной ДНК.
Даже если сшивающий агент является другим, чем моноазид этидия, сшивающий агент может быть использован в настоящем изобретении, пока этот сшивающий агент может более легко проходить через клеточные стенки поврежденных или мертвых клеток в сравнении с клеточными стенками живых клеток микроорганизма и может сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм (длинноволновым ультрафиолетовым светом или видимым светом), для разрывания посредством этого хромосомной ДНК.
Условия для обработки ЕМА могут быть определены подходящим образом. Например, условия, которые позволяют легкое различение между живыми клетками микроорганизма и мертвыми клетками и поврежденными клетками, могут быть определены добавлением ЕМА при различных концентрациях к суспензиям живых клеток и поврежденных клеток или мертвых клеток микроорганизма, являющегося объектом детектирования, оставлением их в течение различных периодов времени, затем облучением их видимым светом, удалением этих клеток центрифугированием или т.п., при необходимости, и выполнением анализа при помощи способов амплификации нуклеиновых кислот. Предпочтительные условия для облучения видимым светом могут быть подходящим образом определены выполнением такого эксперимента, какой упомянут выше, с использованием различных периодов времени облучения. Конкретные примеры условий для облучения видимым светом включают в себя облучение видимым светом 100-750 ватт в течение 5 минут-2 часов с расстояния 10-50 см от тест-пробы. Облучение видимым светом предпочтительно выполняют при низкой температуре, например с охлаждением этой пробы на льду.
(3) Стадия с)
Непрореагировавший сшивающий агент, содержащийся в тест-пробе, обработанной облучением светом, удаляют из тест-пробы.
Эту стадию предпочтительно выполняют сразу же после стадии b). Примеры способа удаления сшивающего агента включают в себя способ, предусматривающий: центрифугирование тест-пробы для отделения осадков, содержащих микроорганизмы, от супернатанта, содержащего сшивающий агент; и удаление этого супернатанта. Этот способ может дополнительно включать в себя, после удаления сшивающего агента, стадию промывания микроорганизмов агентом очистки.
(4) Стадия d)
Затем к тест-пробе, из которой удален сшивающий агент, добавляют среду и полученную смесь инкубируют.
Эта среда является предпочтительно средой, подходящей для культивирования микроорганизма, содержащегося в этой тест-пробе, и особенно предпочтительно используют жидкую среду. Ее конкретные примеры включают в себя бульонную среду, пептонную среду, инфузионный мясопептонный бульон с сердечно-мозговым экстрактом (BHI). Инкубирование предпочтительно выполняют при температуре, подходящей для пролиферации детектируемого микроорганизма, например при оптимальной температуре культивирования микроорганизма или при температуре, сходной с оптимальной температурой культивирования. Оптимальная температура культивирования микроорганизма может быть определена: культивированием микроорганизма при различных температурах и выбором температуры, при которой этот микроорганизм может наиболее активно пролиферировать. Например, в случаях вышеупомянутых бактерий, температура обычно равна 20°С-43°С, предпочтительно 25°С-37°С, более предпочтительно 30°С-37°С. Время инкубирования конкретно не ограничивается, пока микроорганизм в пробе может пролиферировать. Конкретно, это время равно, например, 0,5-48 часам, предпочтительно 1-24 часам, более предпочтительно 2-3 часам. При инкубировании тест-пробы, содержащей микроорганизм, в среде живые клетки микроорганизма, не имеющего сшивающего агента и не имеющего разорванной хромосомной ДНК, могут пролиферировать при культивировании в этой среде, что может улучшать чувствительность детектирования в различении между присутствием и отсутствием живых клеток микроорганизма в тест-пробе и в определении количества живых клеток микроорганизма.
(5) Стадии е) и f)
Стадии е) и f) выполняют таким же образом, что и стадии а) и b) соответственно.
Ожидается, что живые клетки микроорганизма в тест-пробе пролиферируют выполнением стадии d), так что может увеличиваться различие между чувствительностью детектирования живых клеток и чувствительностью детектирования других клеток посредством выполнения стадий е) и f) после стадии d). Это может разительно улучшать чувствительность детектирования в различении между присутствием и отсутствием живых, поврежденных или мертвых клеток в тест-пробе и в определении количества живых клеток микроорганизма. Сшивающий агент, добавляемый в стадии е), и сшивающий агент в стадии а) могут быть одинаковыми или отличающимися друг от друга.
Особенно предпочтительным аспектом настоящего изобретения является последовательное выполнение: добавления сшивающего агента к тест-пробе и обработки облучения светом; удаления сшивающего агента центрифугированием; добавления и инкубирования среды; дополнительного добавления сшивающего агента и обработки облучением светом. После вышеупомянутых последовательных обработок следующий процесс может быть повторен несколько раз для дополнительного улучшения чувствительности детектирования: удаление сшивающего агента; добавление и инкубирование среды; и дополнительное добавление сшивающего агента и обработка облучением светом. Конкретно, стадии с), d) и f) могут повторяться два или более раз после стадий а) и b).
В примерах и сравнительных примерах ниже процесс, который включает в себя только стадии а) и b) и не включает в себя стадии е) и f), называют иногда «одностадийной обработкой», в то время как процесс, который включает в себя не только стадии а) и b), но также и стадии е) и f), называют иногда «многостадийной обработкой».
(6) Стадия g)
ДНК экстрагируют из каждой из тест-проб, обработанных в стадиях а)-f), и район-мишень экстрагированной ДНК амплифицируют способом амплификации нуклеиновых кислот. Примеры способа амплификации нуклеиновых кислот включают в себя способ ПЦР (White, T.J. et al., Trends Genet., 5, 185 (1989)), способ LAMP (Loop-Mediated Isothermal Amplification: principal and application of novel gene amplification method (LAMP method), Tsugunori Notomi, Tori Nagatani, BIO INDUSTRY, Vol. 18, No. 2, 15-23, 2001), способ SDA (Strand Displacement Amplification: Edward L. Chan, Ken Brandt, Karen Olienus, Nick Antonishyn, Greg B. Horsman., Performance characteristics of the Becton Dickinson ProbeTec System for direct detection of Chlamydia trachomatis and Neisseria gonorrhoeae in male and female urine specimens in comparison with the Roche Cobas system. Arch. Pathol. Lab. Med., 124: 1649-1652, 2000), способ LCR (Ligase Chain Reaction: Barany, F., Proc. Natl. Acad. Sci. USA, Vol. 88, p. 189-193, 1991), способ микроматриц ДНК (Validation of Virulence and Epidemiology DNA Microarray for Identification and Characterization of Staphylococcus aureus Isolates: Richards P. Spence, et al., J. Clin. Microbiol., Vol. 46, No. 5, p. 1620-1627, 2008). В настоящем изобретении способ ПЦР используют особенно предпочтительно, но способ амплификации нуклеиновых кислот не ограничивается этими способами.
Способ экстракции ДНК из тест-пробы не ограничивается конкретно, пока экстрагированная ДНК может функционировать в качестве матрицы в ПЦР, и экстракция может выполняться в соответствии с обычно используемым способом экстракции ДНК микроорганизма.
Способ экстракции ДНК описан, например, Maniatis T. and Fritsch, E.F., Sambrook, J., Molecular Cloning: A Laboratory Manual, 3rd edn., Cold Spring Harbor, NY: Cold Spring Harbor Press, 2001.
В настоящем изобретении «район-мишень» особо не ограничивается, пока выбирается район хромосомной ДНК, который может быть амплифицирован при помощи ПЦР с использованием праймеров, используемых для настоящего изобретения, и позволяет детектировать подлежащий детектированию микроорганизм, и этот район может быть подходящим образом выбран в зависимости от этой цели. Например, когда в тест-пробе содержатся клетки типа, отличающегося от клеток детектируемого микроорганизма, этот район-мишень предпочтительно содержит последовательность, специфическую в отношении этого микроорганизма как объекта детектирования. Кроме того, в зависимости от этой цели, район-мишень может быть районом, содержащим последовательность, общую для нескольких типов микроорганизма. Кроме того, этот район-мишень может состоять из единственного района или из двух или более районов. Если используется набор праймеров, подходящих для района-мишени, специфического для микроорганизма в качестве объекта детектирования, и набор праймеров, подходящих для хромосомных ДНК многочисленных разновидностей микроорганизмов, могут быть измерены одновременно количество живых клеток этого микроорганизма в качестве объекта детектирования и количество живых клеток многочисленных разновидностей микроорганизмов. Длина районов-мишеней равна, например, обычно 50-5000 нуклеотидов, предпочтительно 50-2000 нуклеотидов, особенно предпочтительно 50-500 нуклеотидов.
Праймеры для применения в амплификации нуклеиновой кислоты могут быть выбраны на основе принципов различных способов амплификации нуклеиновых кислот и не ограничиваются особо, пока эти праймеры могут специфически амплифицировать вышеуказанный район-мишень.
В случае когда микроорганизм мишени детектирования является патогенной бактерией, район-мишень может быть патогенным геном. Примеры патогенного гена включают в себя: ген листериолизина О (hlyA) бактерии Listeria; ген энтеротоксина и ген инвазии (invA) бактерии Salmonella; ген веротоксина патогенной Escherichia coli О-157; ген белка А наружной мембраны (ompA) (Enterobacter sakazakii) и оперон макромолекулярного синтеза (MMS) (Enterobacter sakazakii) бактерии Enterobacter; ген энтеротоксина Staphylococcus aureus; ген цереулида и ген энтеротоксина Bacillus cereus и гены различных токсинов Clostridium botulinum. Примеры праймеров для патогенного гена включают в себя: набор праймеров, представленных SEQ ID NO: 1 и 2 для гена hlyA Listeria; набор праймеров, представленных SEQ ID NO: 3 и 4 для гена ompA Enterobacter sakazakii; и набор праймеров, представленных SEQ ID NO: 5 и 6 для оперона MMS Enterobacter sakazakii.
Если используют праймеры, подходящие для двух или более типов микроорганизмов, могут быть детектированы живые клетки двух или более типов этих микроорганизмов в тест-пробе. Кроме того, если используют праймер (праймеры), специфический для конкретной бактерии, может быть детектирована живая клетка конкретной бактерии в тест-пробе.
Условия реакций амплификации нуклеиновых кислот особо не ограничиваются, пока нуклеиновая кислота может специфически амплифицироваться на основе принципов различных способов амплификации нуклеиновых кислот (таких как PCR (ПЦР), LAMP, SDA и LCR), и эти условия могут быть подходящим образом установлены.
(7) Стадия h)
Затем амплифицированные продукты, полученные способом амплификации нуклеиновых кислот, анализировали.
Способ анализа не ограничивается конкретно, пока этот способ может детектировать или определять количественно амплифицированные продукты нуклеиновых кислот, и их примеры включают в себя электрофорез. Следует обратить внимание на то, что, в случае использования ПЦР-способа в качестве способа амплификации нуклеиновых кислот, может быть использован ПЦР-способ реального времени (Nogva et al., Application of 5'-nuclease PCR for quantitative detection of Listeria monocytogenes in pure cultures, water, skim milk, and unpasteurized whole milk. Appl. Environ. Microbiol., vol. 66, 2000, pp. 4266-4271, Nogva et al., Application of 5'-nuclease PCR assay in evolution and development of methods for quantitative detection of campylobacter jejuni. Appl. Environ. Microbiol., vol. 66, 2000, pp. 4029-4036).
Для оценки количеств и размеров амплифицированных продуктов нуклеиновых кислот используют электрофорез. Кроме того, для быстрого количественного определения ПЦР-амплифицированных продуктов используют ПЦР реального времени.
В случае когда используют ПЦР реального времени, изменения интенсивностей флуоресценции являются обычно уровнями шума и находятся около нуля, если число циклов амплификации находится в диапазоне 1-10. Таким образом, эти интенсивности считают слепыми опытами проб, не содержащих продуктов амплификации. Рассчитывают стандартное отклонение (SD) этих изменений и величину, полученную умножением величины SD на 10, определяют как пороговую величину. Количество ПЦР-циклов, при котором достигается впервые величина, большая, чем эта пороговая величина, называют «пороговой величиной циклов» (величиной Ct). Таким образом, чем больше начальное количество ДНК-матрицы в растворе для ПЦР-реакции, тем меньше величина Ct. Даже если количества ДНК-матрицы являются одинаковыми, чем выше доля матрицы, в которой район-мишень ПЦР был расщеплен, тем больше величина Ct в ПЦР-реакциях в отношении этого района.
Далее, присутствие или отсутствие продукта амплификации может быть также определено анализом распределения температуры плавления (ТМ) продукта амплификации.
Все вышеупомянутые способы могут быть также использованы для оптимизации различных условий для способа настоящего изобретения.
При детектировании живых клеток микроорганизма способом настоящего изобретения точность определения присутствия или отсутствия живых клеток микроорганизма и количественного определения их в анализе продукта ПЦР-амплификации может быть увеличена с использованием калибровочной кривой, представляющей зависимость между количеством микроорганизма и продуктом амплификации, которую получают с использованием стандартных проб этого микроорганизма, в которых этот микроорганизм идентифицирован. Хотя может быть использована предварительно полученная калибровочная кривая, предпочтительно использовать калибровочную кривую, полученную выполнением стадий способа настоящего изобретения для стандартных проб одновременно с тест-пробой. Кроме того, если зависимость между количеством микроорганизма и количеством ДНК определяют предварительно, в качестве стандартной пробы может быть использована ДНК, выделенная из этого микроорганизма.
В случае когда детектирование живых клеток микроорганизма настоящим изобретением включает в себя определение количества живых клеток микроорганизма для определения количества живых клеток микроорганизма в тест-пробе, необходимо учитывать степень пролиферации этих живых клеток микроорганизма, так как живые клетки микроорганизма пролиферируют в стадии d). Это может достигаться созданием калибровочной кривой, показывающей зависимость между количеством микроорганизма и амплифицированных продуктов, с использованием стандартной пробы этого микроорганизма, как описано выше.
<2> Набор настоящего изобретения
Набор настоящего изобретения является набором для детектирования живых клеток микроорганизма в тест-пробе способом амплификации нуклеиновых кислот и содержит сшивающий агент, среду и праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, подлежащего детектированию, способом амплификации нуклеиновых кислот.
Реакцией амплификации нуклеиновых кислот является предпочтительно PCR (ПЦР), LAMP, SDA или LCR. Сшивающий агент и среда являются теми же самыми, что и описанные в способе настоящего изобретения.
В наборе в соответствии с предпочтительным аспектом настоящего изобретения сшивающий агент выбран из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоларена. Особенно предпочтительно используют моноазид этидия.
Набор настоящего изобретения может дополнительно содержать раствор для разведения, реакционный раствор для реакции сшивающего агента и инструкцию, описывающую способ настоящего изобретения.
Примеры
Далее настоящее изобретение описывается более конкретно со ссылкой на следующие примеры. Однако настоящее изобретение не ограничивается этими примерами.
[Пример 1]
1. Приготовление пробы - Приготовление суспензий Listeria monocytogenes (живых клеток и поврежденных клеток)
Грамположительную бактерию, Listeria monocytogenes (Listeria monocytogenes JCM 2873; далее в некоторых случаях сокращаемую как “Listeria”), культивировали в мясопептонном инфузионном бульоне с экстрактом головного мозга-сердца (BHI) при 30°С и 40 мл культуральной среды в фазе логарифмического роста центрифугировали при 8000g в течение 15 минут при 4°С с последующим удалением супернатанта. 40 мл физиологического солевого раствора добавляли к этим бактериальным клеткам и эту смесь энергично перемешивали и центрифугировали, как описано выше. Супернатант удаляли и 10 мл физиологического солевого раствора добавляли к бактериальным клеткам для получения посредством этого суспензии живых клеток. Количество живых клеток в суспензии живых клеток определяли в стандартной среде для чашек с агаром, и было обнаружено, что оно было равно 1,3×108 КОЕ/мл.
Суспензию живых клеток (1 мл) помещали в 1,5-миллилитровую микропробирку и эту микропробирку погружали в кипящую воду на 50 секунд и немедленно охлаждали водой со льдом с получением посредством этого суспензии поврежденных клеток. Клетки в этой суспензии, возможно, включают в себя небольшие количества живых клеток и мертвых клеток, но в основном они включают в себя поврежденные клетки. Таким образом, эти клетки называют просто «поврежденными клетками». Способ настоящего изобретения первоначально предназначен для детектирования живых клеток микроорганизма, и клетками микроорганизма, отличаемыми от живых клеток, могут быть поврежденные клетки или мертвые клетки.
2. Тест-способ
2-1) Многостадийная обработка (Способ настоящего изобретения)
Моноазид этидия (ЕМА) добавляли к суспензии живых клеток и суспензии поврежденных клеток Listeria, приготовленных, как описано выше, в конечной концентрации 0 или 100 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 5 минут. Эти суспензии помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий. Затем суспензии центрифугировали при 15000g в течение 10 минут при 4°С и супернатанты удаляли. К осадкам добавляли равный объем физиологического раствора и суспензии перемешивали и центрифугировали при охлаждении при 15000g в течение 10 минут при 4°С с последующим удалением супернатантов. К осадкам добавляли равный объем мясопептонного инфузионного бульона с экстрактом головного мозга-сердца (BHI) и эти суспензии инкубировали при 30°С в течение 2 часов.
В первой обработке ЕМА, ЕМА не добавляли опять к суспензиям живых клеток и поврежденных клеток, имеющим концентрацию ЕМА 0, в то время как ЕМА добавляли опять при конечной концентрации ЕМА 10 мкг/мл или 25 мкг/мл к суспензиям живых клеток и поврежденных клеток, имеющих концентрацию ЕМА 100 мкг/мл. Этим суспензиям давали стоять при затенении при 4°С в течение 5 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт на расстоянии 20 см от этих суспензий.
2-2) Единственная обработка (Сравнительный пример 1)
Моноазид этидия (ЕМА) добавляли к суспензии живых клеток и суспензии поврежденных клеток Listeria, приготовленным в разделе «1», в конечной концентрации 0, 10 или 25 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 5 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий.
2-3) Приготовление суспензии бактерий для применения в ПЦР-тесте
Микропробирки, включающие в себя одну из суспензий живых клеток или поврежденных клеток Listeria, обработанных, как описано в разделах 2-1) и 2-2) выше, центрифугировали при 15000g в течение 10 минут при 4°С. Супернатанты удаляли и к осадкам добавляли 1 мл физиологического солевого раствора. Полученные суспензии энергично перемешивали и центрифугировали, как описано выше (промывочная обработка). Еще одну промывочную обработку выполняли таким же образом, что и первую обработку, и к осадкам добавляли 10 мкл ТЭ-буфера (10 мМ Трис-HCl-буфер, 1 нМ ЭДТА.2Na) с последующим сильным перемешиванием.
3. ПЦР, нацеленная на патогенный ген (короткую ДНК) Listeria
3-1) Амплификация патогенного гена, гена листериолизина О (hlyA) Listeria
Master Mix ПЦР (общий объем: 50,5 мкл) готовили с использованием смеси Direct Buffer Mix (G&g SCIENCE CO., LTD., Yokohama, Kanagava), способной последовательно и автоматически выполнять элюцию хромосомной ДНК из бактерии и ПЦР-реакций. Buffer Mix содержит: компонент (поверхностно-активное вещество) для ингибирования адсорбции белка, происходящего из бактерии, на ДНК-матрице, происходящей из бактерии, которая должна быть использована в ПЦР-реакциях; и компонент (поверхностно-активное вещество) для ингибирования адсорбции полисахарида, происходящего из бактерии, на ДНК-полимеразе; и дополнительно ингредиент, необходимый для ПЦР-реакций реального времени. Подробности Master Mix ПЦР являются следующими:
- Direct buffer MIX, производимая G&g SCIENCE CO., LTD: 42 мкл;
- (5 Е/мкл) Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,5 мкл;
- (10 пмоль/мкл) SEQ ID NO: 1 (hlyA-F) ДНК: 4 мкл;
- (10 пмоль/мкл) SEQ ID NO: 2 (hlyA-R) ДНК: 4 мкл.
Следует обратить внимание на то, что общее количество вышеуказанных реагентов равно 50,5 мкл и в Direct buffer MIX, производимой G&g SCIENCE CO., LTD, требуемые компоненты для Master Mix для ПЦР были приготовлены заранее в общем количестве 50,5 мкл, чтобы они имели следующие конечные концентрации:
- буфер Ex-Taq (TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 1×;
- смесь dNTP Ex-Taq (TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,2 мМ каждый;
- SYBA Green (производимый ВМА, номер по каталогу 50513): 0,4×.
3-2) Профиль термических циклов ПЦР для амплификации гена hlyA
3-3) ПЦР-реакция
Тест-суспензии, приготовленные, как описано в разделе 2-3) выше (5 мкл каждой), добавляли к Master Mix ПЦР (50,5 мкл), приготовленной, как описано в разделе 3-1) выше. В качестве отрицательного контроля использовали ТЭ-буфер (5 мкл).
Согласно профилю термических циклов ПЦР, показанному в разделе 3-2), ПЦР-реакции выполняли с использованием устройства для ПЦР реального времени (iCycler, производимого Bio-Rad Laboratories, Inc., Model: iQ).
4. Электрофорез на агарозном геле для ПЦР-амплифицированного продукта
ПЦР-амплифицированные продукты, полученные в разделе 3-3) выше, подвергали электрофорезу на 3% агарозном геле. После завершения электрофореза агарозный гель погружали в водный раствор 1 мкг/мл бромида этидия на 20 минут и промывали дважды ионообменной водой и использовали УФ-транс-облучатель (длина волны: 254 нм) для наблюдения степени амплификации амплифицированных продуктов гена hlyA.
5. Результаты анализа
Фиг.1 показывает результаты, полученные выполнением: многостадийной обработки для живых клеток и поврежденных клеток Listeria; ПЦР для гена hlyA; и электрофореза на агарозном геле (дорожки многостадийной обработки), тогда как таблица 2 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Между тем, фиг.1 показывает результаты, полученные выполнением: одностадийной обработки для живых клеток и поврежденных клеток Listeria; ПЦР для гена hlyA; и электрофореза на агарозном геле (дорожки одностадийной обработки), и таблица 3 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Интенсивности полос в этих таблицах являются величинами, измеренными сканированием интенсивности цвета каждой полосы в направлении электрофореза с использованием денситометра Imaging Densitometer GS-700, производимого Bio-RadLaboratories, Inc. (денситометр: измеренная длина волны 600 нм).
+
Инкубация (30°C, 2 ч)
+
EMA 0 мкг/мл
+
Инкубация (30°C, 2 ч)
+
EMA 10 мкг/мл
+
Инкубация (30°C, 2 ч)
+
EMA 25 мкг/мл
В случае когда ЕМА не добавляли в многостадийной обработке, полосы, которые были приближенно оценены как амплифицированные продукты гена hlyA, детектировали как в живых клетках, так и в поврежденных клетках Listeria, и было невозможно детектировать только живые клетки. Однако в случае когда ЕМА добавляли в многостадийной обработке (ЕМА 100 мкг/мл - инкубация - ЕМА 25 или 10 мкг/мл), полосы явно детектировались в живых клетках, в то время как мало полос или отсутствие полос детектировали в поврежденных клетках. Эти результаты предполагают, что многостадийная обработка делает возможным селективное детектирование только живых клеток в ПЦР. Как видно из данных, полученных количественным определением интенсивностей полос (показанным в таблице 2), эта многостадийная обработка делала возможным ясное различение между живыми клетками и поврежденными клетками в ПЦР-нацеливании на этот короткий ген (113 п.н.).
С другой стороны, в случае когда ЕМА не добавляли в одностадийной обработке, полосы, приближенно оцененные как амплифицированные продукты гена hlyA, детектировали при помощи ПЦР как в живых клетках, так и в поврежденных клетках Listeria, и было невозможно селективно детектировать только живые клетки. Между тем, в случае когда ЕМА добавляли в концентрации 10 мкг/мл в одностадийной обработке, полосы, приближенно оцененные как амплифицированные продукты гена hlyA, детектировали как в живых клетках, так и в поврежденных клетках, и было невозможно специфически детектировать только живые клетки. В случае когда ЕМА добавляли в концентрации 25 мкг/мл в одностадийной обработке, полосы, приближенно оцененные как амплифицированные продукты гена hlyA, почти исчезали как в живых клетках, так и в поврежденных клетках, и было невозможно специфически детектировать только живые клетки. Как показано в таблице 3, одностадийная обработка не могла достигать ясного различения между живыми клетками и поврежденными клетками в ПЦР-нацеливании на короткий ген, такой как hlyA (113 п.н.).
6. Обсуждение
В случае когда живые клетки быстро отличаются (распознаются) от поврежденных клеток (включающих в себя и мертвые клетки) при фокусировании внимания на конкретной патогенной бактерии, район короткого гена с размером 80-200 оснований может быть мишенью для детектирования специфически только этой патогенной бактерии и для количественного определения количества бактериальных клеток в тест-пробе с использованием количественной ПЦР реального времени. В случае когда пробу обрабатывают ЕМА в концентрации, превышающей 10 мкг/мл, с использованием одностадийной обработки, как показано в сравнительном примере 1, ЕМА проходит не только через клеточные стенки поврежденных клеток, но также через клеточные стенки живых клеток для прямого расщепления двойных тяжей хромосомной ДНК в живых клетках и поврежденных клетках во многих точках независимо от ферментов в этой бактерии. Таким образом, невозможно специфически детектировать только живые клетки. Между тем, в случае когда пробу обрабатывают ЕМА в концентрации, равной или меньшей 10 мкг/мл, с использованием одностадийной обработки, ЕМА трудно проходить через клеточные стенки поврежденных клеток, и хромосомная ДНК имеет малую вероятность частого расщепления. Таким образом, в случае когда район-мишень ПЦР является коротким, районы-мишени хромосомных ДНК всех поврежденных клеток расщепляются не всегда, и, следовательно, ПЦР не ингибируется полностью.
С другой стороны, после добавления ЕМА один раз в многостадийной обработке, даже если часть ЕМА проходит через живые клетки, уменьшая количество живых клеток, можно извлечь количество живых клеток до начальной величины, для восстановления диффузионного насоса этих живых клеток или для удаления непрореагировавшего ЕМА к наружной стороне клеток микроорганизма инкубацией в среде, подходящей для культивирования. Таким образом, концентрация ЕМА, подлежащего добавлению в первой обработке, может быть высокой (например, 100 мкг/мл), и хромосомная ДНК поврежденных клеток расщепляется высокой концентрацией ЕМА во многих точках. Даже если поврежденные клетки инкубируют в этой среде, невозможно увеличить количество этих клеток в отличие от живых клеток. При таких обстоятельствах, если ЕМА добавляют опять при определенной концентрации (например, 10 мкг/мл), когда малое количество ЕМА проходит через клеточные стенки живых клеток за короткое время (например, 5 минут), ЕМА проходит только через клеточные стенки поврежденных клеток, усиливая дополнительное расщепление хромосомной ДНК, и полосы конечных ПЦР-амплифицированных продуктов не могут быть детектированы только в случае поврежденных клеток.
[Пример 2]
1. Приготовление пробы - Приготовление суспензий Enterobacter sakazakii (живых клеток и поврежденных клеток)
Грамположительную бактерию, Enterobacter sakazakii (Enterobacter sakazakii АТСС 6538Р; далее в некоторых случаях сокращаемую как “sakazakii”), культивировали в мясопептонном инфузионном бульоне с экстрактом головного мозга-сердца (BHI) при 37°С и 5 мл культуральной среды в фазе логарифмического роста центрифугировали при 8000g в течение 15 минут при 4°С с последующим удалением супернатанта. 5 мл физиологического солевого раствора добавляли к этим бактериальным клеткам и эту смесь энергично перемешивали и разбавляли в 10 раз. Таким образом получали суспензию клеток. Количество живых клеток в суспензии живых клеток определяли в стандартной среде для чашек с агаром, и было обнаружено, что оно было равно 8,38±0,25 log10 КОЕ/мл.
Суспензию живых клеток (1 мл) помещали в 1,5-миллилитровую микропробирку и эту микропробирку погружали в кипящую воду на 2 минуты и немедленно охлаждали водой со льдом с получением посредством этого суспензии поврежденных клеток. Клетки в этой суспензии, возможно, включают в себя небольшие количества живых клеток и мертвых клеток, но в основном они включают в себя поврежденные клетки. Таким образом, эти клетки называют просто «поврежденными клетками». Следует обратить внимание на то, что способ настоящего изобретения первоначально предназначен для детектирования живых клеток микроорганизма, и клетками микроорганизма, отличаемыми от живых клеток, могут быть поврежденные клетки или мертвые клетки.
2. Тест-способ
2-1) Многостадийная обработка (Способ настоящего изобретения)
Моноазид этидия (ЕМА) добавляли к суспензии живых клеток и суспензии поврежденных клеток sakazakii, приготовленным, как описано выше, в конечной концентрации 0, 10, 25 или 100 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 10 минут. Эти суспензии помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий. Затем суспензии центрифугировали при 15000g в течение 10 минут при 4°С и супернатанты удаляли. К осадкам добавляли равный объем физиологического раствора и суспензии перемешивали и центрифугировали при охлаждении при 15000g в течение 10 минут при 4°С с последующим удалением супернатантов. К осадкам добавляли равный объем мясопептонного инфузионного бульона с экстрактом головного мозга-сердца (BHI) и эти суспензии инкубировали при 37°С в течение 2 часов.
В первой обработке ЕМА, ЕМА не добавляли опять к суспензиям живых клеток и поврежденных клеток, имеющим концентрацию ЕМА 0, в то время как ЕМА добавляли опять при конечной концентрации ЕМА 10 мкг/мл к суспензиям живых клеток и поврежденных клеток, имеющим концентрацию ЕМА 10, 25 или 100 мкг/мл. Этим суспензиям давали стоять при затенении при 4°С в течение 10 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт на расстоянии 20 см от этих суспензий.
2-2) Единственная обработка (Сравнительный пример 1)
Моноазид этидия (ЕМА) добавляли к суспензии живых клеток и суспензии поврежденных клеток sakazakii, приготовленным в разделе «1», в конечной концентрации 0, 10, 25 или 100 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 10 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий.
2-3) Приготовление суспензии бактерий для применения в ПЦР-тесте
Микропробирки, включающие в себя одну из суспензий живых клеток или поврежденных клеток sakazakii, обработанных, как описано в разделах 2-1) и 2-2) выше, центрифугировали при 15000g в течение 10 минут при 4°С. Супернатанты удаляли и к осадкам добавляли 1 мл физиологического солевого раствора. Полученные суспензии энергично перемешивали и центрифугировали, как описано выше (промывочная обработка). Еще одну промывочную обработку выполняли таким же образом, что и первую обработку, и к осадкам добавляли то же самое количество стерильной воды, что и первоначальное количество, с последующим энергичным перемешиванием.
3. ПЦР, нацеленная на ген белка А наружной мембраны (ompA) и оперон макромолекулярного синтеза (MMS) (короткую ДНК) sakazakii
3-1) Амплификация гена ompA и гена MSS
Master Mix ПЦР (общий объем: 25,25 мкл) готовили с использованием смеси Direct Buffer Mix (G&g SCIENCE CO., LTD., Yokohama, Kanagava), способной последовательно и автоматически выполнять элюцию хромосомной ДНК из бактерии и ПЦР-реакций. Buffer Mix содержит: компонент (поверхностно-активное вещество) для ингибирования адсорбции белка, происходящего из бактерии, на ДНК-матрице, происходящей из бактерии, которая должна быть использована в ПЦР-реакциях; и компонент (поверхностно-активное вещество) для ингибирования адсорбции полисахарида, происходящего из бактерии, на ДНК-полимеразе; и дополнительно ингредиент, необходимый для ПЦР-реакций реального времени. Подробности Master Mix ПЦР являются следующими.
Каждый компонент Master Mix ПЦР для детектирования гена ompA является следующим:
- Direct buffer MIX, производимая G&g SCIENCE CO., LTD: 21 мкл;
- (5 Е/мкл) Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,25 мкл;
- (10 пмоль/мкл) SEQ ID NO: 3 (ompA-F) ДНК: 2 мкл;
- (10 пмоль/мкл) SEQ ID NO: 4 (ompA-R) ДНК: 2 мкл.
Каждый компонент Master Mix ПЦР для детектирования гена MMS является следующим:
- Direct buffer MIX, производимая G&g SCIENCE CO., LTD: 21 мкл;
- (5 Е/мкл) Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,25 мкл;
- (10 пмоль/мкл) SEQ ID NO: 5 (MMS-F) ДНК: 2 мкл;
- (10 пмоль/мкл) SEQ ID NO: 6 (MMS-R) ДНК: 2 мкл.
Следует обратить внимание на то, что общее количество вышеуказанных реагентов равно 25,25 мкл и в Direct buffer MIX, производимой G&g SCIENCE CO., LTD, требуемые компоненты в Master Mix для ПЦР были приготовлены заранее в общем количестве 25,25 мкл, чтобы они имели следующие конечные концентрации:
- буфер Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 1×;
- смесь dNTP (производимая TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,2 мМ каждый;
- SYBA Green (производимый ВМА, номер по каталогу 50513): 0,4×.
3-2) Профиль термических циклов ПЦР для амплификации гена ompA и гена MMS
3-3) ПЦР-реакция
Тест-суспензии, приготовленные, как описано в разделе 2-3) выше (2 мкл каждой), добавляли к Master Mix ПЦР (25,25 мкл), приготовленной, как описано в разделе 3-1) выше. В качестве отрицательного контроля использовали стерильную воду (2,5 мкл).
Согласно профилю термических циклов ПЦР, показанному в разделе 3-2), ПЦР-реакции выполняли с использованием устройства для ПЦР реального времени (iCycler, производимого Bio-Rad Laboratories, Inc., Model: iQ).
4. Электрофорез на агарозном геле для ПЦР-амплифицированного продукта
ПЦР-амплифицированные продукты, полученные в разделе 3-3) выше, подвергали электрофорезу на 2% агарозном геле. После завершения электрофореза, агарозный гель погружали в водный раствор 1 мкг/мл бромида этидия на 20 минут и промывали дважды ионообменной водой и использовали УФ-транс-облучатель (длина волны: 254 нм) для наблюдения степени амплификации амплифицированных продуктов гена ompA и гена MMS.
5. Результаты анализа
Фиг.2 показывает результаты, полученные выполнением: многостадийной обработки для живых клеток и поврежденных клеток sakazakii; ПЦР для гена ompA; и электрофореза на агарозном геле (дорожки многостадийной обработки), тогда как таблица 5 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Между тем, фиг.2 показывает результаты, полученные выполнением: одностадийной обработки для живых клеток и поврежденных клеток sakazakii; ПЦР для гена ompA; и электрофореза на агарозном геле (дорожки одностадийной обработки), и таблица 6 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Интенсивности полос в этих таблицах являются величинами, измеренными сканированием интенсивности цвета каждой полосы в направлении электрофореза с использованием денситометра Imaging Densitometer GS-700, производимого Bio-RadLaboratories, Inc. (денситометр: измеренная длина волны 600 нм). Кроме того, таблица 7 показывает количество циклов при начальном повышении в каждой кривой ПЦР реального времени в многостадийной обработке или одностадийной обработке (величину Ct).
На фиг.3 показаны результаты электрофореза для конечных ПЦР-амплифицированных продуктов гена MMS после многостадийной обработки (дорожки многостадийной обработки), и в таблице 8 показаны данные, полученные количественным определением полос ПЦР. Между тем, на фиг.3 показаны результаты электрофореза после одностадийной обработки (дорожки одностадийной обработки), и в таблице 9 показаны данные, полученные количественным определением ПЦР. Между тем, в таблице 10 показано количество циклов при начальном повышении в каждой кривой ПЦР реального времени в многостадийной обработке или одностадийной обработке (величину Ct).
+
инкубация (37°C, 2 ч)
+
EMA 0 мкг/мл
+
инкубация (37°C, 2 ч)
+
EMA 10 мкг/мл
b) “(i/2)” обозначает количество раз положительной реакции в двух ПЦР-анализах.
с) “ND” обозначает, что конечный ПЦР-амплифицированный продукт является отрицательным.
d) “36,3, ND” обозначает, что первая величина Ct равна 36,3, а вторая величина Ct является ND.
е) “EMA i/j мкг/мл” является результатами двухстадийной обработки ЕМА и означает, что первую обработку ЕМА выполняют при концентрации i мкг/мл, а вторую обработку ЕМА выполняют при концентрации j мкг/мл.
+
инкубация (37°C, 2 ч)
+
EMA 0 мкг/мл
+
инкубация (37°C, 2 ч)
+
EMA 10 мкг/мл
b) “(i/2)” обозначает количество раз положительной реакции в двух ПЦР-анализах.
с) “EMA i/j мкг/мл” является результатами двухстадийной обработки ЕМА и означает, что первую обработку ЕМА выполняют при концентрации i мкг/мл, а вторую обработку ЕМА выполняют при концентрации j мкг/мл.
d) “ND” обозначает, что конечный ПЦР-амплифицированный продукт является отрицательным.
е) “27,3, ND” обозначает, что первая величина Ct равна 27,3, а вторая величина Ct является ND.
В случае когда ЕМА не добавляли в многостадийной обработке, полосы, которые были приближенно оценены как амплифицированные продукты гена ompA и амплифицированные продукты гена MMS, детектировали как в живых клетках, так и в поврежденных клетках sakazakii, и было невозможно детектировать только живые клетки. Однако в случае когда ЕМА добавляли в многостадийной обработке (ЕМА 10 мкг/мл - инкубация - ЕМА 10 мкг/мл), полосы явно детектировались в живых клетках, в то время как полосу не детектировали в поврежденных клетках. (В случае поврежденных клеток, появляется полоса, более короткая, чем ген-мишень, и она является димером праймера.) Эти результаты предполагают, что многостадийная обработка делает возможным селективное детектирование только живых клеток в ПЦР. Как видно из данных, полученных количественным определением интенсивностей полос (показанных в таблицах 5 и 8), эта многостадийная обработка делала возможным ясное различение между живыми клетками и поврежденными клетками в ПЦР-нацеливании на этот относительно короткий и чрезвычайно короткий ген (469 п.н. и 78 п.н.).
Согласно величинам Ct в таблице 7, в одностадийной обработке 25 мкг/мл ЕМА, живые клетки микроорганизма отличаются (распознаются) от поврежденных клеток микроорганизма. Однако величина Ct в живых клетках микроорганизма равна 20,9±0,6, что превышает на приблизительно 5,0 величину Ct 15,9±0,4 в живых клетках, обработанных многостадийной обработкой (ЕМА 10/10 мкг/мл). То есть, даже хотя определение, являются ли эти клетки мертвыми или живыми, может быть оценено одностадийной обработкой, невозможно детектировать низкую концентрацию sakazakii, так как порог детектирования живых клеток является более низким на приблизительно 2 log10 клеток/мл, чем порог детектирования в многостадийной обработке.
6. Обсуждение
В случае ПЦР-нацеливания на очень короткий ген, ген MMS (78 п.н.), как показано в сравнительном примере 2, когда пробу обрабатывают 10 мкг/мл ЕМА с использованием одностадийной обработки, ЕМА проходит селективно только через поврежденные клетки микроорганизма для прямого расщепления двойных тяжей хромосомной ДНК в поврежденных клетках во многих точках независимо от ферментов в этой бактерии. Однако, если количество поврежденных клеток является таким высоким, как приблизительно 108 КОЕ/мл, районы гена MMS-мишени хромосомных ДНК всех поврежденных клеток микроорганизма не всегда расщепляются. В результате, даже если концентрация ЕМА является высокой в одностадийной обработке, конечный ПЦР-амплифицированный продукт поврежденных клеток не становится отрицательным. Между тем, в случае когда пробу обрабатывают ЕМА в концентрации, равной или меньшей 10 мкг/мл, с использованием одностадийной обработки, ЕМА трудно проходить через клеточные стенки поврежденных клеток, и хромосомная ДНК имеет малую вероятность частого расщепления. Таким образом, в случае когда район-мишень ПЦР является коротким, районы-мишени хромосомных ДНК всех поврежденных клеток микроорганизма расщепляются не всегда, и, следовательно, ПЦР не ингибируется полностью.
С другой стороны, после добавления ЕМА один раз в многостадийной обработке, даже если часть ЕМА проходит через живые клетки, уменьшая количество живых клеток, можно извлечь количество живых клеток микроорганизма до начальной величины, для восстановления диффузионного насоса этих живых клеток микроорганизма или для удаления непрореагировавшего ЕМА к наружной стороне клеток микроорганизма инкубацией в среде, подходящей для культивирования. С другой стороны, хотя хромосомная ДНК поврежденных клеток микроорганизма расщепляется EMA во многих точках, в случае когда ген, подлежащий амплификации при помощи ПЦР, является коротким, районы хромосомных ДНК всех поврежденных клеток микроорганизма не всегда расщепляются. Даже если поврежденные клетки инкубируют в этой среде, невозможно увеличить количество этих клеток в отличие от живых клеток. При таких обстоятельствах, если ЕМА добавляют опять при определенной концентрации (например, 10 мкг/мл), ЕМА проходит только через клеточные стенки поврежденных клеток, усиливая дополнительное расщепление хромосомной ДНК, и полосы конечных ПЦР-амплифицированных продуктов не могут быть детектированы только в случае поврежденных клеток.
[Пример 3]
1. Приготовление пробы - Приготовление суспензий Salmonella enteritidis (живых клеток и поврежденных клеток)
Грамположительную бактерию, Salmonella enteritidis (Salmonella enteritidis IIP 604; далее в некоторых случаях сокращаемую как “Salmonella”), культивировали в мясопептонном инфузионном бульоне с экстрактом головного мозга-сердца (BHI) при 37°С и 5 мл культуральной среды в фазе логарифмического роста центрифугировали при 8000g в течение 15 минут при 4°С с последующим удалением супернатанта. 5 мл физиологического солевого раствора добавляли к этим бактериальным клеткам и эту смесь энергично перемешивали и центрифугировали при охлаждении, как описано выше. Супернатант удаляли и к этим бактериальным клеткам добавляли 5 мл физиологического солевого раствора и разбавляли в 10 раз с получением таким образом суспензии живых клеток. Количество живых клеток в суспензии живых клеток определяли в стандартной среде для чашек с агаром, и было обнаружено, что оно было равно 8,06±0,02 log10 КОЕ/мл.
Суспензию живых клеток (1 мл) помещали в 1,5-миллилитровую микропробирку и эту микропробирку погружали в кипящую воду на 2 минуты и немедленно охлаждали водой со льдом с получением посредством этого суспензии поврежденных клеток. Клетки в этой суспензии, возможно, включают в себя небольшие количества живых клеток и мертвых клеток, но в основном они включают в себя поврежденные клетки. Таким образом, эти клетки называют просто «поврежденными клетками». Способ настоящего изобретения первоначально предназначен для детектирования живых клеток, и клетками микроорганизма, отличаемыми от живых клеток, могут быть поврежденные клетки или мертвые клетки.
2. Тест-способ
2-1) Многостадийная обработка (Способ настоящего изобретения)
Моноазид этидия (ЕМА) добавляли к суспензии живых клеток и суспензии поврежденных клеток Salmonella, приготовленным, как описано выше, в конечной концентрации 0, 10, 25 или 100 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 10 минут. Эти суспензии помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий. Затем суспензии центрифугировали при 15000g в течение 15 минут при 4°С и супернатанты удаляли. К осадкам добавляли равный объем физиологического раствора и суспензии перемешивали и центрифугировали при охлаждении при 15000g в течение 10 минут при 4°С с последующим удалением супернатантов. К осадкам добавляли равный объем мясопептонного инфузионного бульона с экстрактом головного мозга-сердца (BHI) и эти суспензии инкубировали при 37°С в течение 2 часов.
В первой обработке ЕМА, ЕМА не добавляли опять к суспензиям живых клеток и поврежденных клеток, имеющим концентрацию ЕМА 0, в то время как ЕМА добавляли опять при конечной концентрации ЕМА 10 мкг/мл к суспензиям живых клеток и поврежденных клеток, имеющим концентрацию ЕМА 10, 25 или 100 мкг/мл в первой обработке ЕМА. Этим суспензиям давали стоять при затенении при 4°С в течение 10 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт на расстоянии 20 см от этих суспензий.
2-2) Единственная обработка (Сравнительный пример 3)
Моноазид этидия (ЕМА) добавляли к суспензиям живых клеток и поврежденных клеток Salmonella, приготовленным в разделе «1», в конечной концентрации 0, 10, 25 или 100 мкг/мл и этим суспензиям давали стоять при затенении при 4°С в течение 10 минут, помещали на лед и облучали в течение 5 минут видимым светом 500 Вт (FLOOD PRF: 100 В, 500 Вт, IWASAKI ELECTRIC CO., LTD., длина волны: 500-700 нм) на расстоянии 20 см от этих суспензий.
2-3) Приготовление суспензии бактерий для применения в ПЦР-тесте
Микропробирки, включающие в себя одну из суспензий живых клеток или поврежденных клеток Salmonella, обработанных, как описано в разделах 2-1) и 2-2) выше, центрифугировали при 15000g в течение 10 минут при 4°С. Супернатанты удаляли и к осадкам добавляли 1 мл физиологического солевого раствора. Полученные суспензии энергично перемешивали и центрифугировали при охлаждении таким же образом, как описано выше (промывочная обработка). Еще одну промывочную обработку выполняли таким же образом, что и первую обработку, и к осадкам добавляли то же самое количество стерильной воды, что и первоначальное количество, с последующим энергичным перемешиванием.
3. ПЦР, нацеленная на ген инвазии (invA) и ген энтеротоксина Salmonella (оба гена являются короткими ДНК)
3-1) Амплификация гена invA и гена энтеротоксина
Master Mix ПЦР (общий объем: 25,25 мкл) готовили с использованием смеси Direct Buffer Mix (G&g SCIENCE CO., LTD., Yokohama, Kanagava), способной последовательно и автоматически выполнять элюцию хромосомной ДНК из бактерии и ПЦР-реакций. Buffer Mix содержит: компонент (поверхностно-активное вещество) для ингибирования адсорбции белка, происходящего из бактерии, на ДНК-матрице, происходящей из бактерии, которая должна быть использована в ПЦР-реакциях; и компонент (поверхностно-активное вещество) для ингибирования адсорбции полисахарида, происходящего из бактерии, на ДНК-полимеразе; и дополнительно ингредиент, необходимый для ПЦР-реакций реального времени. Подробности Master Mix ПЦР являются следующими.
Каждый компонент Master Mix ПЦР для детектирования гена invA является следующим:
- Direct buffer MIX, производимая G&g SCIENCE CO., LTD: 21 мкл;
- (5 Е/мкл) Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,25 мкл;
- (10 пмоль/мкл) ДНК invA-F: 2 мкл;
- (10 пмоль/мкл) ДНК invA-R: 2 мкл;
- invA-F: набор праймеров SIN-1 для детектирования гена invA Salmonella (код продукта: S018; TakaraBio);
- invA-R: набор праймеров SIN-2 для детектирования гена invA Salmonella (код продукта: S018; TakaraBio).
Каждый компонент Master Mix ПЦР для детектирования гена энтеротоксина является следующим:
- Direct buffer MIX, производимая G&g SCIENCE CO., LTD: 21 мкл;
- (5 Е/мкл) Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,25 мкл;
- (10 пмоль/мкл) ДНК энтеротоксин-F: 2 мкл;
- (10 пмоль/мкл) ДНК энтеротоксин-R ДНК: 2 мкл;
- энтеротоксин-F: набор праймеров STN-1 для детектирования гена энтеротоксина Salmonella (код продукта: S019; TakaraBio);
- энтеротоксин-R: набор праймеров STN-2 для детектирования гена энтеротоксина Salmonella (код продукта: S019; TakaraBio).
Следует обратить внимание на то, что общее количество вышеуказанных реагентов равно 25,25 мкл и в Direct buffer MIX, производимой G&g SCIENCE CO., LTD, требуемые компоненты в Master Mix для ПЦР были приготовлены заранее в общем количестве 25,25 мкл, чтобы они имели следующие конечные концентрации:
- буфер Ex-Taq (производимый TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 1×;
- смесь dNTP (производимая TAKARA SHUZO CO., LTD, номер по каталогу RR001B): 0,2 мМ каждый;
- SYBA Green (производимый ВМА, номер по каталогу 50513): 0,4×.
3-2) Профиль термических циклов ПЦР для амплификации гена invA и гена энтеротоксина
3-3) ПЦР-реакция
Тест-суспензии, приготовленные как описано в разделе 2-3) выше (2 мкл каждой), добавляли к Master Mix ПЦР (25,25 мкл), приготовленной как описано в разделе 3-1) выше. В качестве отрицательного контроля использовали ТЭ-буфер (2,5 мкл).
Согласно профилю термических циклов ПЦР, показанному в разделе 3-2), ПЦР-реакции выполняли с использованием устройства для ПЦР реального времени (iCycler, производимого Bio-Rad Laboratories, Inc., Model: iQ).
4. Электрофорез на агарозном геле для ПЦР-амплифицированного продукта
ПЦР-амплифицированные продукты, полученные в разделе 3-3) выше, подвергали электрофорезу на 2% агарозном геле. После завершения электрофореза агарозный гель погружали в водный раствор 1 мкг/мл бромида этидия на 20 минут и промывали дважды ионообменной водой и использовали УФ-транс-облучатель (длина волны: 254 нм) для наблюдения степени амплификации амплифицированных продуктов гена invA и гена энтеротоксина.
5. Результаты анализа
Фиг.4 показывает результаты, полученные выполнением: многостадийной обработки для живых клеток и поврежденных клеток Salmonella; ПЦР для гена invA; и электрофореза на агарозном геле (дорожки многостадийной обработки), тогда как таблица 12 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Между тем, фиг.4 показывает результаты, полученные выполнением: одностадийной обработки для живых клеток и поврежденных клеток Salmonella; ПЦР для гена invA; и электрофореза на агарозном геле (дорожки одностадийной обработки), и таблица 13 показывает данные, полученные количественным определением интенсивностей полос конечных ПЦР-амплифицированных продуктов. Интенсивности полос в этих таблицах являются величинами, измеренными сканированием интенсивности цвета каждой полосы в направлении электрофореза с использованием денситометра Imaging Densitometer GS-700, производимого Bio-Rad Laboratories, Inc. (денситометр: измеренная длина волны 600 нм). Кроме того, таблица 14 показывает количество циклов при начальном повышении в каждой кривой ПЦР реального времени в многостадийной обработке или одностадийной обработке (величину Ct).
Фиг.5 показывает результаты электрофореза для конечных ПЦР-амплифицированных продуктов гена энтеротоксина после многостадийной обработки (дорожки многостадийной обработки), и таблица 15 показывает данные, полученные количественным определением полос ПЦР. Между тем, фиг.5 показывает результаты электрофореза после одностадийной обработки (дорожки одностадийной обработки), и таблица 16 показывает данные, полученные количественным определением полос ПЦР. Между тем, таблица 17 показывает количество циклов при начальном повышении в каждой кривой ПЦР реального времени в многостадийной обработке и одностадийной обработке (величину Ct).
+
инкубация (37°C, 2 ч)
+
EMA 0 мкг/мл
+
инкубация (37°C, 2 ч)
+
EMA 10 мкг/мл
b) “(i/2)” обозначает количество раз положительной реакции в двух ПЦР-анализах.
с) “ND” обозначает, что конечный ПЦР-амплифицированный продукт является отрицательным.
d) “ND, ND” обозначает, что конечный ПЦР-амплифицированный продукт является отрицательным как в первом, так и во втором ПЦР-анализе.
е) “EMA i/j мкг/мл” является результатами двухстадийной обработки ЕМА и означает, что первую обработку ЕМА выполняют при концентрации i мкг/мл, а вторую обработку ЕМА выполняют при концентрации j мкг/мл.
+
инкубация (37°C, 2 ч)
+
EMA 0 мкг/мл
+
инкубация (37°C, 2 ч)
+
EMA 10 мкг/мл
b) “(i/2)” обозначает количество раз положительной реакции в двух ПЦР-анализах.
c) “ND” обозначает, что конечный ПЦР-амплифицированный продукт является отрицательным.
d) “ND, 35,1” обозначает, что первая величина Ct является ND, а вторая величина Ct равна 35,1.
е) “EMA i/j мкг/мл” представляет результаты двухстадийной обработки ЕМА и означает, что первую обработку ЕМА выполняют при концентрации i мкг/мл, а вторую обработку ЕМА выполняют при концентрации j мкг/мл.
В случае когда ЕМА не добавляли в многостадийной обработке, полосы, которые были приближенно оценены как амплифицированные продукты гена invA и амплифицированные продукты гена энтеротоксина, детектировали как в живых клетках, так и в поврежденных клетках Salmonella, и было невозможно специфически детектировать только живые клетки. Однако в случае когда ЕМА добавляли в многостадийной обработке (ЕМА 10 мкг/мл - инкубация - ЕМА 10 мкг/мл), полосы явно детектировались в живых клетках, в то время как полосу не детектировали в поврежденных клетках. Эти результаты предполагают, что многостадийная обработка делает возможным селективное детектирование только живых клеток в ПЦР. Как видно из данных, полученных количественным определением интенсивностей полос (показанных в таблицах 12 и 15), эта многостадийная обработка делает возможным ясное различение между живыми клетками и поврежденными клетками в ПЦР-нацеливании на этот относительно короткий ген (378 п.н. и 264 п.н.).
Согласно величинам Ct в таблице 14, в одностадийных обработках 25 мкг/мл и 100 мкг/мл ЕМА, живые клетки могут быть отличены (распознаны) от поврежденных клеток. Однако величина Ct в живых клетках равна 18,23±0,3 и 27,7±3,8 соответственно, что превышает на приблизительно 2,2 и 1,7 соответственно величину Ct 16,9±3,5 в живых клетках, обработанных многостадийной обработкой (ЕМА 10/10 мкг/мл). То есть, даже хотя определение, являются ли эти клетки мертвыми или живыми, может быть оценено одностадийной обработкой, невозможно детектировать низкую концентрацию Sakazakii, так как порог детектирования живых клеток является более низким на приблизительно 1 log10 клеток/мл или 4 log10 клеток/мл, чем порог детектирования в многостадийной обработке.
6. Обсуждение
В случае ПЦР-нацеливания на короткий ген, ген invA и ген энтеротоксина (378 п.н. и 284 п.н.), как показано в сравнительном примере 3, когда пробу обрабатывают 10 мкг/мл ЕМА с использованием одностадийной обработки, ЕМА непосредственно расщепляет двойные тяжи хромосомной ДНК в поврежденных клетках во многих точках независимо от ферментов в этой бактерии. Однако более высокая концентрация ЕМА вызывает увеличение величины Ct в живых клетках, приводя к снижению порога детектирования живых клеток.
С другой стороны, после добавления ЕМА один раз в многостадийной обработке, даже если часть ЕМА проходит через живые клетки, уменьшая количество живых клеток, можно извлечь количество живых клеток до начальной величины, для восстановления диффузионного насоса этих живых клеток или для удаления непрореагировавшего ЕМА к наружной стороне клеток микроорганизма инкубацией в среде, подходящей для культивирования. С другой стороны, хотя хромосомная ДНК поврежденных клеток микроорганизма расщепляется ЕМА во многих точках, в случае когда ген, подлежащий амплификации при помощи ПЦР, является коротким, районы хромосомных ДНК всех поврежденных клеток микроорганизма не всегда расщепляются. Даже если поврежденные клетки инкубируют в этой среде, невозможно увеличить количество этих клеток в отличие от живых клеток. При таких обстоятельствах, если ЕМА добавляют опять при определенной концентрации 10 мкг/мл, ЕМА проходит только через клеточные стенки поврежденных клеток, усиливая дополнительное расщепление хромосомной ДНК, и полосы конечных ПЦР-амплифицированных продуктов не детектируются только в случае поврежденных клеток. Кроме того, как видно из величин Ct, показанных в таблицах 14 и 17, многостадийная обработка может улучшать порог детектирования живых клеток, так как эта обработка включает в себя стадию инкубации в среде, приводящую к тому, что становится возможным детектирование только низкой концентрации живых клеток.
Как описано выше, во всех случаях, когда ПЦР выполняют для пяти коротких генов в целом с размерами приблизительно 80-500 оснований грамотрицательных бактерий (Enterobacter sakazakii и Salmonella) и грамположительной бактерии (Listeria) способом настоящего изобретения (многостадийной обработкой), конечные ПЦР-амплифицированные продукты 108 поврежденных клеток (в том числе мертвых клеток) не детектировались, в то время как конечные ПЦР-амплифицированные продукты живых клеток детектировались. Эти результаты выявляют, что этот способ может детектировать специфически живые клетки в молоке, содержащем максимально 105-107 клеток/мл поврежденных клеток и мертвых клеток различных патогенных бактерий. Кроме того, как показано в примере 2, даже если используется ген MMS, который присутствует специфически в sakazakii, но не всегда непосредственно участвует в патогенности, многостадийная обработка делает возможным различение между живыми клетками и поврежденными клетками ПЦР-нацеливанием на короткий ген. Это предполагает, что настоящее изобретение применимо не только к патогенным бактериям, но также к обычным бактериям, таким как вызывающие гниение бактерии. Таким образом, настоящее изобретение может быть широко применимо к санитарным инспекциям в отношении грамотрицательных и грамположительных бактерий, таких как О-157, Salmonella, Listeria, Enterobacter sakazakii, Campylobacter jejuni, Staphylococcus aureus, Bacillus cereus, Clostridium botulinum и Clostridium welchii.
Кровь пациента с дисфункцией печени вследствие бактериемии может содержать живые патогенные бактериальные клетки и поврежденные антибиотиком бактериальные клетки при высокой концентрации (104 клеток/мл или более), и в таком случае ожидается, что способ настоящего изобретения детектирует только живые патогенные бактериальные клетки. Между тем, в случае когда настоящее изобретение применяют к мониторингу лечения туберкулезного пациента противотуберкулезным лекарственным средством, в качестве материала для испытания используют мокроту. Почти все пробы мокроты туберкулезных пациентов перед лечением содержат живые клетки бацилл туберкулезных бугорков в концентрациях 108-109 клеток/г, и эти пробы пациентов в последнем курсе этого лечения содержат поврежденные клетки бацилл туберкулезных бугорков в концентрациях 107-108 клеток/г. При таких обстоятельствах ожидается, что определение количества живых клеток бацилл туберкулезных бугорков, которые могут быть культивированы, является альтернативным быстрым способом культивирования, и в соответствии с настоящим изобретением становится возможным применение ПЦР для диагностики в терапевтическом процессе туберкулезного пациента.
[Ссылочный пример 1] Приготовление тест-пробы из пищевого продукта
При предположении, что какой-то микроорганизм загрязняет молоко (которое является пищевым продуктом, используемым в качестве тест-пробы настоящего изобретения), ниже описан способ приготовления этой тест-пробы.
Раствор ЭДТА и Твин 80 добавляли к молоку при конечной концентрации 1-5 мМ, в частности 2 мМ, и при конечной концентрации 0,1%-0,5%, в частности 0,1% соответственно, и смесь центрифугировали при 10000g в течение 10 минут при 4°С. Этот способ получения предпочтительно включает в себя: добавление липазы (Sigma, Е.С.3.1.1.3) при конечной концентрации 10-20 Е/мл; обработку этой смеси при 30-37°С в течение 30 минут-1 часа; добавление протеиназы К (Sigma, Е.С.3.4.21.64) при конечной концентрации 20 Е/мл и оставление этой смеси стоять в течение 30 минут-1 часа. Жировой слой на поверхности жидкости и водный слой в среднем слое удаляли, и остаток собирали. Этот остаток содержит бактерии, эпителиальные клетки молочной железы и соматические клетки, такие как бычьи лейкоциты. Если центрифугирование выполняют при 10000g или более, этот остаток дополнительно содержит продукт, полученный неполной деградацией мицеллярного белка протеиназой К (не полностью деградированный продукт мицелл казеина). Этот не полностью деградированный продукт мицелл казеина считают субмицеллой α,β-казеина с высокой гидрофобностью.
Этот остаток суспендировали в равном объеме физиологического солевого раствора до начального объема и эту суспензию центрифугировали при 100g в течение 5 минут при 4°С, с последующим удалением супернатанта, содержащего микроорганизмы и т.п.
[Ссылочный пример 2] Приготовление тест-пробы из крови (1)
Равный объем физиологического солевого раствора добавляли к гепаринизированной крови и смесь центрифугировали при 10000g в течение 5 минут при 4°С. Супернатант удаляли для сбора остатка. Этот остаток содержит бактериальные клетки, тромбоциты, мононуклеарные клетки, такие как моноциты и лимфоциты, гранулоциты и эритроциты.
[Ссылочный пример 3] Приготовление тест-пробы из крови (2)
Равный объем физиологического солевого раствора добавляли к гепаринизированной крови и смесь центрифугировали при охлаждении при 100g в течение 5 минут при 4°С для разделения крови на плазму и клетки крови (мононуклеарные клетки, такие как моноциты и лимфоциты и гранулоциты и эритроциты) с последующим сбором плазмы, содержащей клетки микроорганизма.
[Ссылочный пример 4] Приготовление тест-пробы из крови (3)
Равный объем физиологического солевого раствора добавляли к гепаринизированной крови. Стерилизованную тест-пробирку наполняли равным объемом Ficoll-Paque [Amersham Biosciences K. K.; Ficoll 400: 5,7 г/100 мл, диатризоат натрия: 9 г/100 мл, удельная масса: 1,077 г/мл] и разбавленную в 2 раза гепаринизированную кровь медленно наслаивали при наклонном положении тест-пробирки. Затем пробирку центрифугировали при 100g в течение 5 минут при 4°С и супернатант, содержащий микроорганизмы, собирали. Перед наслаиванием разведенной в 2 раза гепаринизированной крови на Ficoll-Paque, этот способ приготовления предпочтительно включает в себя: добавление раствора липазы (Sigma, Е.С.3.1.1.3) при конечной концентрации 10-20 Е/мл; добавление раствора дезоксирибонуклеазы I (Sigma, EC.3.1.21.1) в конечной концентрации 10-50 Е/мл; обработку этой смеси при 30-37°С в течение 30 минут-1 часа; добавление протеиназы К (Sigma, Е.С.3.4.21.64) при конечной концентрации 10-20 Е/мл и обработку этой смеси при 30-37°С в течение 30 минут-1 часа.
[Ссылочный пример 5] Приготовление тест-пробы из крови (4)
Monopoly™ [Amersham Biosciences K. K.; смесь Фиколла и метризоата, удельная масса: 1,115 г/мл] добавляли в стерилизованную тест-пробирку в половинный объем гепаринизированной крови и эту гепаринизированную кровь медленно наслаивали при наклонном положении тест-пробирки. Затем пробирку центрифугировали при 100g в течение 5 минут при 4°С и супернатант, содержащий бактерии, собирали.
Промышленная применимость
Согласно настоящему изобретению живые клетки могут быть легко и быстро отличены (распознаны) от поврежденных и мертвых клеток в пищевых продуктах, биологических пробах и окружающей среде, такой как промышленная вода или водопроводная вода, при помощи способа амплификации нуклеиновых кислот. Этот способ и набор настоящего изобретения применимы для произвольных инспекций и являются превосходными с экономической точки зрения.


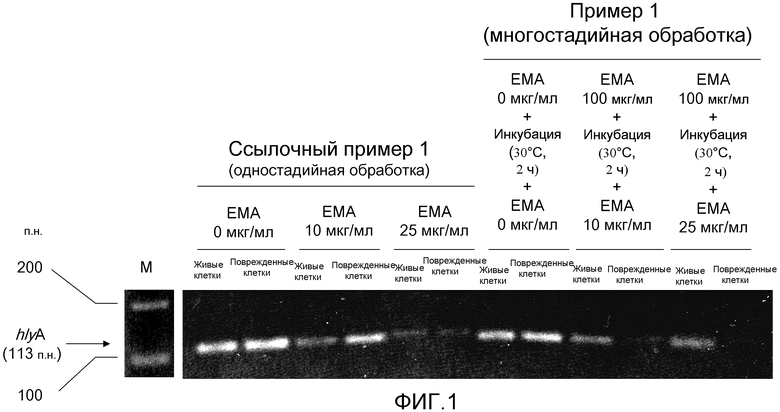
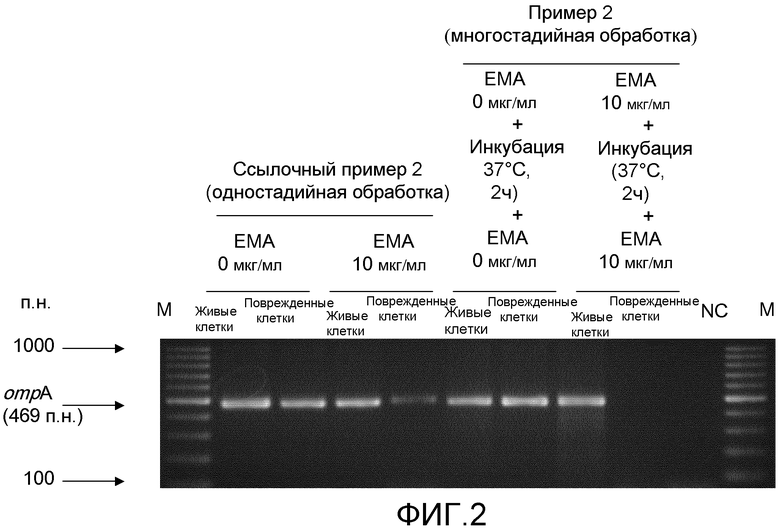
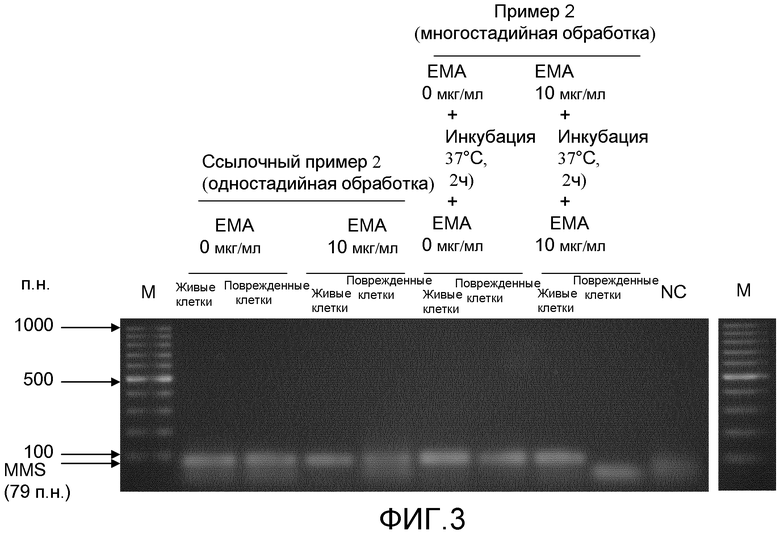
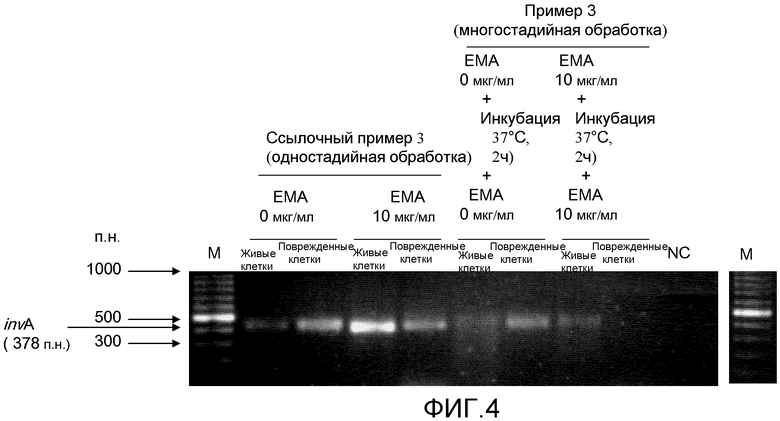
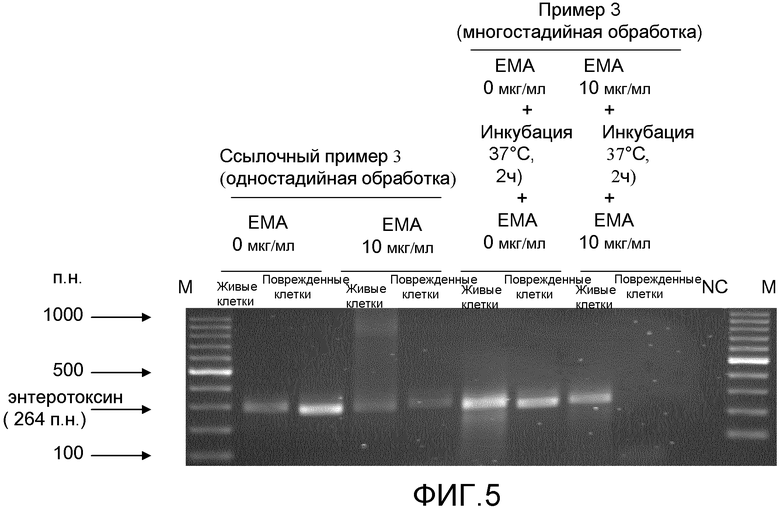
Изобретение относится к микробиологии. Описан способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий добавление к этой тест-пробе сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; облучение светом, имеющим длину волны 350 нм-700 нм; удаление сшивающего агента; добавление среды и дальнейшее инкубирование; добавление опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм, к инкубируемой тест-пробе; повторное облучение светом, имеющим длину волны 350 нм-700 нм; экстракцию ДНК из этой тест-пробы и амплификацию района-мишени экстрагированной ДНК; и анализ амплифицированного продукта. Предложен способ детекции живой клетки микроорганизма в тест-пробе, который включает использование набора, содержащего следующие компоненты: сшивающий агент, способный сшивать ДНК при облучении светом, имеющим длину волны 350 нм-700 нм; среду и праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, который является мишенью детектирования, способом амплификации нуклеиновых кислот. Изобретение позволяет детектировать живые клетки микроорганизмов в тест-пробе. 2 н. и 24 з.п. ф-лы, 5 ил., 17 табл.
1. Способ детектирования живой клетки микроорганизма в тест-пробе, предусматривающий стадии:
a) добавления сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350-700 нм, к этой тест-пробе;
b) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350-700 нм;
c) удаления сшивающего агента, содержащегося в тест-пробе, облученной светом;
d) добавления среды к тест-пробе, из которой удален сшивающий агент, и инкубирования этой тест-пробы;
e) добавления опять сшивающего агента, способного сшивать ДНК при облучении светом, имеющим длину волны 350-700 нм, к инкубируемой тест-пробе;
f) облучения тест-пробы, к которой добавлен сшивающий агент, светом, имеющим длину волны 350-700 нм;
g) экстракции ДНК из этой тест-пробы и амплификации района-мишени экстрагированной ДНК при помощи способа амплификации нуклеиновых кислот; и
h) анализа амплифицированного продукта.
2. Способ по п.1, в котором этот амплифицированный продукт анализируют на основе калибровочной кривой, которая создана с использованием стандартной пробы микроорганизма и показывает зависимость между количеством этого микроорганизма и амплифицированного продукта.
3. Способ по п.1, в котором способом амплификации нуклеиновых кислот является способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК.
4. Способ по п.2, в котором способом амплификации нуклеиновых кислот является способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК.
5. Способ по п.3, в котором способ ПЦР выполняют с использованием ПЦР реального времени и выполняют одновременно ПЦР и анализ амплифицированного продукта.
6. Способ по п.4, в котором способ ПЦР выполняют с использованием ПЦР реального времени и выполняют одновременно ПЦР и анализ амплифицированного продукта.
7. Способ по п.1, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
8. Способ по п.2, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
9. Способ по п.3, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
10. Способ по п.4, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
11. Способ по п.5, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
12. Способ по п.6, в котором тест-пробой является пищевой продукт, проба крови, проба мочи, проба спинальной жидкости, проба синовиальной жидкости, проба плеврального выпота, промышленная вода, водопроводная вода, грунтовая вода, речная вода или дождевая вода.
13. Способ по любому из пп.1-12, в котором сшивающий агент выбран из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоралена.
14. Способ по любому из пп.1-12, в котором длина района-мишени равна 50-5000 оснований.
15. Способ по п.13, в котором длина района-мишени равна 50-5000 оснований.
16. Способ по любому из пп.1-12, в котором этот микроорганизм является патогенной бактерией.
17. Способ по п.13, в котором этот микроорганизм является патогенной бактерией.
18. Способ по п.14, в котором этот микроорганизм является патогенной бактерией.
19. Способ по п.15, в котором этот микроорганизм является патогенной бактерией.
20. Способ по п.16, в котором районом-мишенью является патогенный ген.
21. Способ по п.17, в котором районом-мишенью является патогенный ген.
22. Способ по п.18, в котором районом-мишенью является патогенный ген.
23. Способ по п.19, в котором районом-мишенью является патогенный ген.
24. Способ детекции живой клетки микроорганизма в тест-пробе в соответствии с п.1, который включает использование набора, содержащего следующие компоненты:
сшивающий агент, способный сшивать ДНК при облучении светом, имеющим длину волны 350-700 нм;
среду и праймер (праймеры) для амплификации района-мишени ДНК микроорганизма, который является мишенью детектирования, способом амплификации нуклеиновых кислот.
25. Способ по п.24, где способом амплификации нуклеиновых кислот является способ ПЦР, LAMP, SDA, LCR или способ микроматрицы ДНК.
26. Способ по п.24 или 25, в котором сшивающий агент выбран из группы, состоящей из моноазида этидия, диазида этидия, псоларена, 4,5',8-триметилпсоларена и 8-метоксипсоларена.
| RUDI К | |||
| et al: "Detection of viable and dead Listeria monocytogenes on gouda-like cheeses by real-time PCR", Letters in Applied Microbiology 2005, 40, 301-306 | |||
| СПОСОБ ДЕТЕКЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ ИЗОТЕРМИЧЕСКОЙ РЕАКЦИИ АМПЛИФИКАЦИИ-RAMIL (РЕВЕРТАЗНОЕ АМПЛИФИКАЦИОННОЕ ЗАКЛЮЧЕНИЕ (REVERTASE AMPLIFICATION ILLATION) ИЛИ РНК-аза H ЗАВИСИМОЕ АМПЛИФИКАЦИОННОЕ ЗАКЛЮЧЕНИЕ (RNAase Н-DEPENDENT AMPLIFICATION ILLATION) | 2003 |
|
RU2258740C2 |
Авторы
Даты
2011-01-27—Публикация
2008-08-01—Подача