Изобретение относится к области биохимии, в частности к молекулярно-генетическим методам детекции микроорганизмов.
Одним из молекулярно-генетических методов детекции микроорганизмов является SDA (Strand Displacement Amplification) [1].
Амплификация с вытеснением цепи (SDA) использует свойство ДНК-полимеразы, лишенной экзонуклеазной активности синтезировать новую цепь ДНК, вытесняя рестрицированную цепь. Предварительно в ходе инициирования реакции с использованием специальных затравок создается сайт рестрикции для эндонуклеаз, например Hinc II. Поскольку в качестве предшественников в синтезе используются модифицированные дезоксинуклеозидтрифосфаты, такие как тиопроизводные аденозина (в случае использования эндонуклеазы рестрикции Hinc II) гидролиз рестриктазой Hinc II приводит к образованию насечки (гидролизуется одна цепь), в то время как вторая цепь остается нативной. SDA относится к классу изотермических реакций. Изотермические методы в отличие от ПЦР и ЛЦР позволяют отказаться от сложной и дорогостоящей аппаратуры и использовать в качестве инкубаторов лабораторные термостаты. Этот метод амплификации позволяет получить до 106-107 копий на одну используемую матрицу.
Цель изобретения - разработка нового молекулярно-генетического метода детекции микроорганизмов.
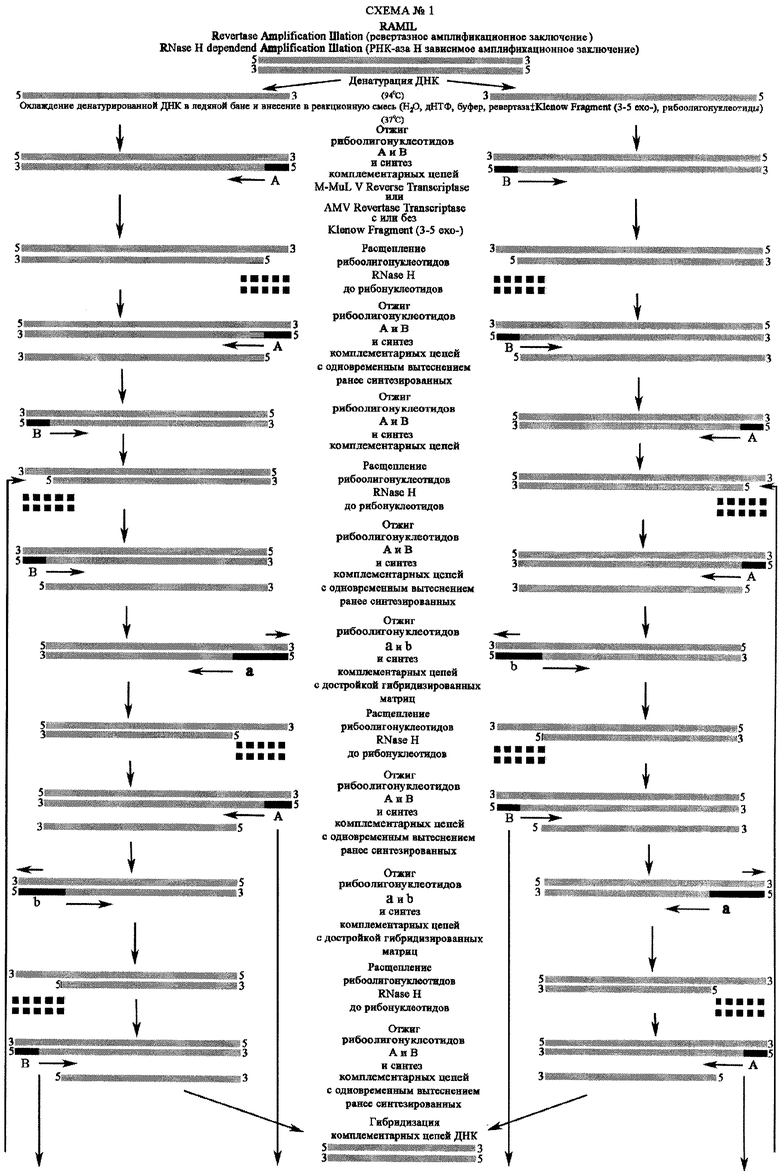
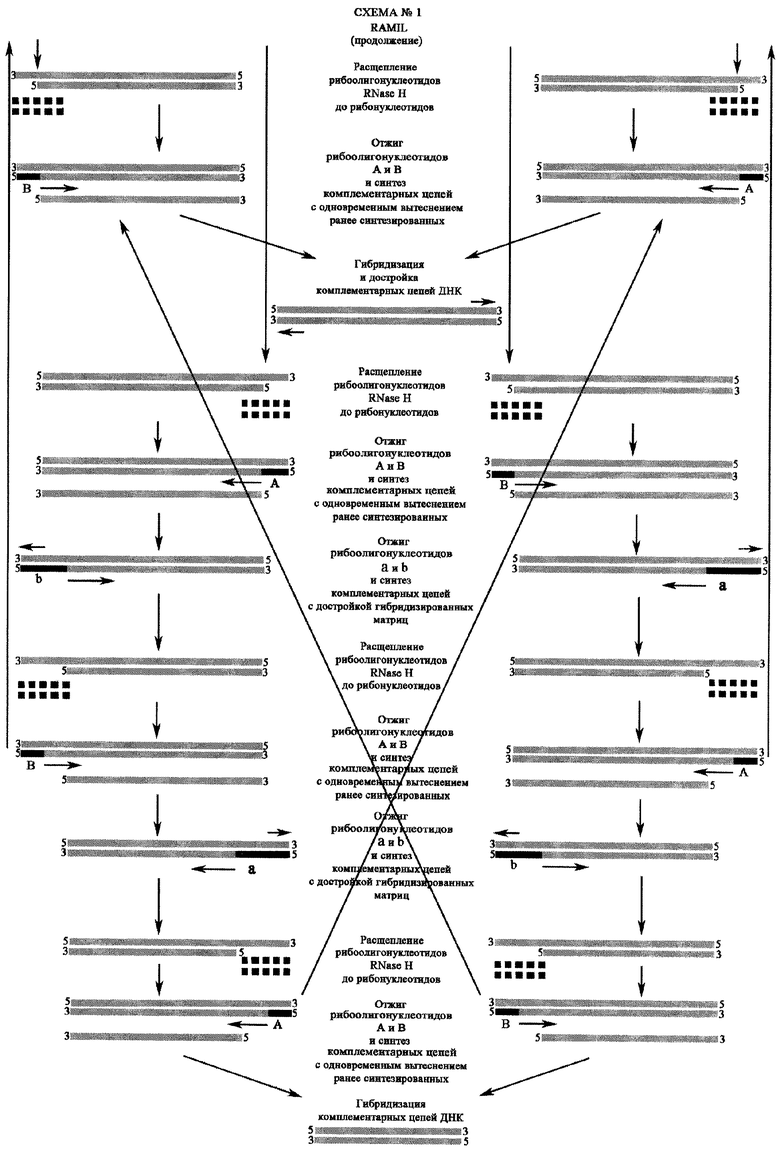
Предлагаемый метод детекции микроорганизмов отличается от метода SDA тем, что в качестве затравки используются 4 рибоолигонуклеотидных праймера, комплементарных к соответствующим последовательностям на противоположных цепях нуклеиновой кислоты: первые два ("А", "В") - комплементарные к участкам однонитевых фрагментов нуклеиновой кислоты, остальные два ("a", "b") - идентичные "А" или "В", но имеющие дополнительные нуклеотиды в направлении 3' (так называемые "3' концевые участки") также комплементарные к участкам однонитевых фрагментов нуклеиновой кислоты.
Рибоолигонуклеотиды "А" и "В" после отжига на ДНК матрицах (схема №1) и инициации синтеза новых цепей ДНК обратной транскриптазой M-MuLV или AMV с или без полимеразы фрагмент Кленова (3'-5' ехо-) удаляются от матриц в результате их расщепления РНК-азой Н, присутствующей в вышеперечисленных РНК зависимых ДНК полимеразах.
Рибоолигонуклеотиды "А" и "В" после отжига на РНК матрицах (схема 2) инициируют синтез новых цепей ДНК обратной транскриптазой M-MuLV или AMV. После элонгации ДНК матричные РНК разрушаются в результате их расщепления РНК-азой Н. Образующиеся в результате разрушения РНК-ДНК дуплексов однонитевые участки ДНК служат местом отжига для праймеров "В" и "А". Обратная транскриптаза M-MuLV или AMV синтезирует новую цепь ДНК на матрице ДНК с одновременным вытеснением недорушенной матричной РНК в РНК-РНК дуплексе (праймер - РНК матрица) и окончательной достройкой ДНК на комплементарном рибоолигонуклеотидам "А" и "В" участке. Затем только вышеперечисленные праймеры будут субстратами для РНК-азы Н.
Образующиеся в результате разрушения РНК-ДНК дуплексов однонитевые участки ДНК служат местом отжига для копий ранее расщепленных праймеров, которые являются затравками для последующего синтеза ДНК с одновременным вытеснением ранее синтезированных благодаря отсутствию экзонуклеазных активностей на ДНК у вышеперечисленных полимераз.
После синтеза новых цепей вышеперечисленными полимеразами освобождаются ранее синтезированные цепи ДНК, которые служат матрицами для праймеров "В" и "А".
Синтез новых цепей и последующее их вытеснение позволяет праймерам "а" и "b" гибридизироваться с ними так называемыми "З' концевыми участками" и инициировать синтез ДНК, а также достроить обратной транскриптазе M-MuLV или AMV участок гибридизированной матрицы, комплементарный праймеру "А" в случае отжига праймера "а", и комплементарного праймеру "В" после отжига праймера "b".
Рибоолигонуклеотиды "а" и "b" после отжига и инициации синтеза новых цепей ДНК обратной транскриптазой M-MuLV или AMV с или без полимеразы фрагмент Кленова (3'-5' ехо-) также удаляются от матриц в результате их расщепления РНК-азой Н, присутствующей в вышеперечисленных РНК зависимых ДНК полимеразах.
Образующиеся в результате разрушения РНК-ДНК дуплексов однонитевые участки ДНК служат местом отжига для праймеров "А" и "В", а также, но в гораздо меньшей степени, копий ранее расщепленных праймеров "а" и "b" (реакция проходит в изотермических условиях при температуре 37°С, более благоприятных для отжига праймеров "А" и "В"), которые являются затравками для последующего синтеза ДНК с одновременным вытеснением ранее синтезированных благодаря отсутствию экзонуклеазных активностей на ДНК у вышеперечисленных полимераз.
Такая стратегия позволяет проводить амплификацию ДНК в прогрессии, достаточной для последующей визуализации (из одной исследуемой мишени молекулы ДНК или РНК может амплифицироваться до 1011 копий двухцепочечной ДНК с тупыми концами за 4-6 часов), причем образующиеся ампликоны идентифицируются в электрофореграммах как следующие фрагменты:
")(" - амплифицированные двухцепочечные фрагменты ДНК с тупыми концами, ограниченные по 5' концам последовательностями дезоксирибонуклеотидов, идентичными последовательностям рибонуклеотидов в так называемых "3' концевых участках" рибоолигонуклеотидов "а" и "b"
"][" - не менее чем в 8 раз слабее сигнал (часто не видимый в электрофореграмме) по сравнению с ")(", что связано с механизмом амплификации и короче ")(" на число ограниченных по 5' концам последовательностям дезоксирибонуклеотидов, идентичных последовательностям рибонуклеотидов в так называемых "3' концевых участках" рибоолигонуклеотидов "а" и "b".
В процессе амплификации двухцепочечных фрагментов с тупыми концами ")(" и "][" нарабатываются так называемые "фоновые" фрагменты ДНК, обладающие разным размером ампликонов (недосинтезированные и не вытесненные цепи ДНК, недорушенные затравки на матрицах в момент непосредственного анализа).
Поэтому для детекции в RAMIL следует ориентироваться на самый яркий сигнал с заданной длиной ампликонов.
Условия проведения реакции.
Ревертазное амплификационное заключение (Revertase Amplificaton Illation) на примере детекции Chlamydia psittaci:
RAMIL выполняется в 25 мкл реакционной смеси, содержащей 2 мкл охлажденной в ледяной бане, но предварительно денатурированной кипячением исследуемой пробы ДНК, подготовленной любым методом выделения нуклеиновых кислот для молекулярно-генетических исследований; 75 мкМ КС1, 50 мМ Tris-HCl (pH 8,3 при 25°С), 3 мМ MgCl2, 10 мМ DTT, 200 мкМ dNTP, no 1 мкМ каждого из четырех рибоолигонуклеотидных праймеров ("А", "В", "а", "b"), 5 единиц обратной транскриптазы M-MuLV или AMV.
Реакцию проводят при температуре 37°С в условиях термостата в течение 4-6 часов с последующей визуализацией амплифицированной ДНК методом гель электрофореза. Для этого продукты амплификации смешивают с буфером для нанесения проб (0,25% бромфенолового синего, 40% (вес-объем) сахарозы в Н2О) в соотношении 6:1. Полученную смесь вносят в лунки 2% агарозного геля, приготовленного на ТАЕ буфере (0,04 М трис-ацетат, 0,002 М ЭДТА, pH 8,0) с содержанием бромистого этидия 0,5 мкг/мл и подвергают горизонтальному электрофорезу в ТАЕ буфере при напряжении 5 В/см в течение 1-1,5 часов с последующим просматриванием в УФ-трансиллюминаторе (290-330 нм).
РНК-аза В зависимое амплификационное заключение (RNase Н-dependent Amplificaton Illation) на примере детекции Chlamydia psittaci:
RAMIL выполняется в 25 мкл реакционной смеси, содержащей 2 мкл охлажденной в ледяной бане, но предварительно денатурированной кипячением исследуемой пробы ДНК, подготовленной любым методом выделения нуклеиновых кислот для молекулярно-генетических исследований; 50 мкМ КС1, 20 мМ Tris-HCl (pH 7,8 при 25°С), 5 мМ MgCl2, 7,5 мМ DTT, 200 мкМ dNTP, по 1 мкМ каждого из четырех рибоолигонуклеотидных праймеров ("А", "В", "а", "b"), 2 единицы обратной транскриптазы M-MuLV или AMV, 5 единиц полимеразы фрагмент Кленова (3'-5' exo-).
Реакцию проводят при температуре 37°С в условиях термостата в течение 4-6 часов с последующей визуализацией амплифицированной ДНК методом гель электрофореза. Для этого продукты амплификации смешивают с буфером для нанесения проб (0,25% бромфенолового синего, 40% (вес-объем) сахарозы в Н2О) в соотношении 6:1. Полученную смесь вносят в лунки 2% агарозного геля, приготовленного на ТАЕ буфере (0,04 М трис-ацетат, 0,002 М ЭДТА, pH 8,0) с содержанием бромистого этидия 0,5 мкг/мл и подвергают горизонтальному электрофорезу в ТАЕ буфере при напряжении 5 В/см в течение 1-1,5 часов с последующим просматриванием в УФ-трансиллюминаторе (290-330 нм).
Рибоолигонуклеотидные праймеры выбраны на основе анализа консервативного участка генома Chlamydia psittaci (СР. SEQ):
5'[(gcaagacactc)ctcaaagccat]taattgcctacaggatatcttgtctggctttaacttgg acgtggtgccgccagaagagcaaattagaatagcgagcacaaaaagaaaagatactaagc ataatctttagaggtgagtatgaaaaaactcttgaaatcggcattattgtttgccgctac gggttccgctctctccttacaagccttgcctgtagggaacccagctgaaccaagtttattaat[cgatggcact(atgtgggaagg)]3'
CP. SEQ представляет собой последовательность длиной 264 пары нуклеотидов (п.н.), включившую в себя 139 п.н. из 5'-не транслируемого региона и 125 п.н. из транслируемого региона, кодирующего синтез первых 41-42 аминокислот большого белка наружной мембраны возбудителя.
Рибоолигонуклеотидный праймер "A" 5'(gcaagacacuc)3' идентичен основаниям - 139-129 5'не транслируемого региона;
рибоолигонуклеотидный праймер "a" 5'[(gcaagacacuc)cucaaagccau]3' идентичен основаниям - 139-118 5' не транслируемого региона;
рибоолигонуклеотидный праймер "В" 5' (ccuucccacau)3' комплементарен к основаниям 115-125 транслируемого региона;
рибоолигонуклеотидный праймер "b" 5' [(ccuucccacau)agugccaucg]3' комплементарен к основаниям 105-125 транслируемого региона.
Результатом предлагаемого метода RAMIL со специфичными для Chlamydia psittaci рибоолигонуклеотидными праймерами "А", "В", "а", "b" проб ДНК штаммов Chl. psittaci "КС-93", "ПП-87", "250" является амплификация специфичного фрагмента ДНК хламидий длиной 242 пар нуклеотидов (см. чертеж).
Источник информации
1. STRAND DISPLACEMENT AMPLIFICATION /Inventor - Walker/ United States Patent №5,455,166 / Date of Patent *Oct.3, 1995.


Изобретение относится к области биохимии и может быть использовано в молекулярно-генетической диагностике. Предложенный способ изотермической реакции амплификации предусматривает инкубирование в присутствии буферной системы одноцепочечной пробы исследуемой нуклеиновой кислоты с обратной транскриптазой M-MuLV или AMV с фрагментом Кленова (3'-5'ехо-) или без него, дезоксинуклеозидтрифосфатами и двумя парами специфических рибоолигонуклеотидных праймеров, где последовательность первой пары праймеров идентична 5'-концевой последовательности смысловой цепи исследуемой нуклеиновой кислоты, а последовательность второй пары праймеров комплементарна 3'-концевой последовательности смысловой цепи. Праймеры каждой пары различаются между собой наличием на 3'-конце одного из них дополнительных нуклеотидов. Применение изобретения позволяет удешевить детекцию микроорганизмов. 1 з.п. ф-лы, 1 ил.
"А" - 5'gcaagacacuc3';
"а" - 5'gcaagacacuccucaaagccau3';
"В" - 5'ссuuсссасаu3';
"b" - 5'ccuucccacauagugccaucg3'.
| US 5824517, 20.10.1998 | |||
| GUATELLI JC, WHITFIELD KM, KWOH DY, BARRINGER KJ, RICHMAN DD, GINGERAS TR., Proc Nati Acad Sci, USA, 1990, Oct;87(19) | |||
| SHIBATA H, TAHIRA Т, HAYASHI К., Genome Res | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КОНСЕРВИРОВАННОГО ПРОДУКТА "САЛАТ СТОЛИЧНЫЙ" | 2006 |
|
RU2309625C1 |
Авторы
Даты
2005-08-20—Публикация
2003-08-21—Подача