ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент Австралии №2017905138, поданной 21 декабря 2017 г., содержание которой полностью включено в данную заявку посредством перекрестной ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к области молекулярной биологии. В частности, в соответствии с настоящим изобретением предложены способы нормировки количественных данных и/или определения уровней транскрипции в клетках, организмах, вирусах и тому подобных объектах. Указанные способы можно использовать во множестве применений, включая, но не ограничиваясь перечисленными: определение повышающей регуляции и понижающей регуляции транскрипции, выявление нарушения транскрипции, определение жизнеспособности/гибели и оценку ответов на лечение агентами (например, устойчивости или чувствительности к лекарственным средствам).
УРОВЕНЬ ТЕХНИКИ
Прогресс в области молекулярной биологии значительно улучшил способность определять характеристики клетки и тщательно исследовать их геномы и транскриптомы на наличие признаков изменений, связанных с заболеванием и/или внешними стимулами. Например, обнаружены специфические изменения в последовательности, связанные с приобретенными или наследственными заболеваниями, такими как рак или муковисцидоз. Изменения в экспрессии гена связаны как с болезненными состояниями, так и с ответом на стимулы. Кроме того, присутствие чужеродной последовательности может свидетельствовать о присутствии инфекционных агентов, таких как бактерии или вирусы. Тестирование с помощью технологии амплификации нуклеиновых кислот (ТАНК) находит широкое применение во всех данных областях для фундаментальных исследований, клинических исследований и клинической диагностики.
Широко распространено применение способов амплификации нуклеиновых кислот in vitro при тестировании ТАНК. Такие способы включают полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепи (SDA), геликаза-зависимую амплификацию (HDA), рекомбиназную полимеразную амплификацию (RPA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), опосредованную транскрипцией амплификацию (ТМА), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA). Были описаны различные типы ПЦР, включая количественную ПЦР в реальном времени, полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР) и цифровую ПЦР. В каждой из данных стратегий амплификации мишени требуется применение олигонуклеотидных праймеров. Процесс амплификации приводит к экспоненциальной амплификации целевых последовательностей, к 5'-концам которых присоединены олигонуклеотидные праймеры и которые содержат вновь синтезированные копии указанных последовательностей, расположенные между указанными праймерами. Методики амплификации сигнала, такие как EzyAmp, реакция с разветвленными цепями или DoC, также можно применять для тестирования ТАНК.
Нормировка экспрессии генов (уровней РНК) является дискуссионным вопросом, и для каждой из доступных стратегий существуют различные аргументы за и против. Указанные стратегии включают нормировку по величине образца, по общей РНК или рибосомной РНК, по мРНК генов домашнего хозяйства и по геномной ДНК. Нормировка по мРНК генов домашнего хозяйства требует продуманного выбора мишеней, так как на их стабильность и уровни экспрессии могут влиять условия эксперимента или окружающей среды. Кроме того, в бактериях уровни экспрессии могут изменяться в ходе цикла развития бактерий. Уровни экспрессии рибосомной РНК (рРНК), хотя она присутствует в большом количестве и обладает более длительным временем полужизни, также могут изменяться в ответ на условия эксперимента или окружающей среды; и, аналогично, ее уровни в бактериях могут изменяться в ходе цикла развития. Более того, так как рРНК составляет до 80% от общей фракции РНК, существует значительный дисбаланс между рРНК и мРНК: последняя составляет лишь 2-5%. Геномную ДНК считают хорошим кандидатом для нормировки экспрессии генов, так как она всегда присутствует, стабильна и, как правило, инвариантна. Было показано, что использование геномной ДНК обеспечивало получение более точных и воспроизводимых результатов.
Тем не менее, существует несколько ограничений для использования геномной ДНК в качестве средства нормировки уровней РНК. В большинстве протоколов РНК и ДНК не выделяют одновременно из образца, а, следовательно, их выделяют отдельно, проводят количественный анализ, а затем амплифицируют отдельно в параллельных реакциях, в которых обычно присутствует или отсутствует обратная транскриптаза, соответственно. По этой причине, существует большая вероятность возникновения ошибки при сравнении данных, полученных в результате двух очень различных протоколов и использовании результатов из (i) первого протокола (выделения ДНК и амплификации, например, с помощью ПЦР) для нормировки результатов из (ii) второго протокола (выделения РНК и амплификации, например, с помощью ОТ-ПЦР). Кроме того, такие параллельные протоколы дорогостоящи, трудоемки и требуют больших затрат времени.
Технологии ТАНК представляют собой золотой стандарт для анализа бактериальных инфекций благодаря их высокой чувствительности и специфичности, быстрым срокам выполнения работы, возможности проводить анализ на различных типах образцов и возможности их нацеливания на любые виды бактерий. Тем не менее, у современных способов есть недостатки в отношении некоторых конкретных применений. В частности, они не подходят для различения жизнеспособных и мертвых патогенов. Например, бактериальная ДНК не является хорошим маркером жизнеспособности клетки, так как такая ДНК может сохраняться в течение недель после того, как произошла гибель клетки. Данный факт делает понятными ограничения доступных тестов: неинформативное применение способов количественного анализа и неэффективный контроль инфекционного статуса или эффективности лечения. Также может происходить завышение положительности образца.
Существует первоочередная потребность в более информативных и точных способах детектирования, особенно в отношении инфекций, передающихся половым путем (ИППП). Остро необходимы новые средства, особенно в случаях, когда патогены присутствуют, но у пациентов отсутствуют симптомы, и/или когда у патогенов наблюдаются высокие уровни устойчивости к противомикробным препаратам (УПП). Для таких инфекций необходим контроль излеченности (ТОС), чтобы подтвердить успешный клиренс. Такое подтверждение излеченности уменьшит вероятность дальнейших осложнений, связанных с исходной инфекцией, и ограничит частоту встречаемости и распространение патогенов и устойчивых к лекарственным средствам штаммов. Способы ТОС на сегодняшний день ограничены анализом ТАНК, который проводят в одной временной точке после лечения, и оптимальное время может изменяться в зависимости от вида, вызывающего ИППП. Положительный результат может означать неэффективность лечения, но также может отражать обнаружение фрагментов ДНК и/или РНК нежизнеспособных организмов.
Существует несколько подходов к решению данной проблемы. Способы определения жизнеспособности включают метаболический контроль посредством новых способов культивирования, вызванную испарением стимуляцию осморегуляции бактерий, тестирование чувствительности к антибиотикам (AST), например, технологию Smarticles, детектирование, основанное на бактериофагах, и радиометрический анализ (основанный на измерении отношений) пре-рРНК. Хотя данные подходы продемонстрировали некоторый успех в отношении различения жизнеспособных и мертвых бактерий, во всех из описанных выше способов для достижения результата используют процедуры культивирования. В альтернативных методиках определения жизнеспособности избегают методов культивирования. Например, в некоторых из них используют интеркалирующие красители, которые добавляют перед процессом выделения ДНК, например, моноазид этидия (ЕМА) и моноазид пропидия (РМА). Данные красители связываются с двухцепочечной ДНК, присутствующей снаружи клетки, или краситель связывается с ней после проникновения через разрушенные стенки клеток. В результате этого ДНК мертвых бактерий не может впоследствии амплифицироваться путем ПЦР. Данный подход широко применялся при детектировании патогенов в клинических образцах, окружающей среде и пище, тем не менее, ограничения также очевидны и были описаны в литературе. Указанные красители не подходят для всех типов образцов или бактерий, при этом варьируются как условия инкубации, так и необходимые концентрации. Неоднократно было показано, что краситель, проникающий в живые клетки, может приводить к ингибированию сигнала, и может происходить ложноположительное детектирование вследствие присутствия большого количества нежизнеспособных бактерий.
Детектирование РНК представляет собой другой способ с потенциальной возможностью оценки жизнеспособности клеток, поскольку РНК менее стабильна, чем ДНК, и, следовательно, более точно отражает жизнеспособность. Тем не менее, необходимо дополнительное улучшение данных способов, поскольку также было показано, что РНК-транскрипты сохраняются в течение длительных периодов времени после обработки или гибели клетки. Вследствие этого, крайне необходимо продумывать выбор подходящих транскриптов и параметров ампликона, а также иметь возможность полностью устранить контаминирующую ДНК из препаратов РНК. Таким образом, существует потребность в проведении дополнительных исследований для выявления точных стратегий на основе РНК для определения количества жизнеспособных бактерий.
Дополнительно существует потребность в способах, которые обеспечивают возможность скрининга устойчивости или чувствительности к лекарственным средствам. В частности, остро требуются быстрые тесты чувствительности к противомикробным средствам для определения терапии отдельного пациента, чтобы предотвратить распространение устойчивых патогенов. Кроме того, такой способ можно применять в качестве метода скрининга для программ поиска новых лекарственных средств. Настоящее изобретение, раскрытое в данной заявке, позволяет получать более информативные результаты, отличать наличие инфекционных агентов от их отсутствия и, в свою очередь, неустраненную инфекцию от устраненной. В нем предложен альтернативный подход, заключающийся в одновременном анализе как РНК, так и ДНК, присутствующих в одном образце общих нуклеиновых кислот (ОНК).
Настоящее изобретение, раскрытое в данном документе, можно применять в указанных и других областях. В нем предложен способ нормировки уровня активной транскрипции в рамках одной реакции. У предыдущих исследований, в которых были предприняты попытки нормировать уровни РНК на ДНК, есть недостатки. В таких исследованиях исследователи экстрагировали (выделяли) РНК и ДНК из образца, амплифицировали их в отдельных, параллельных реакциях ОТ-ПЦР и ПЦР, а затем нормировали уровни экспрессии гена (РНК) по уровням, полученным по ДНК. С данным подходом связано множество проблем. Во-первых, хотя РНК и ДНК могут происходить из одного и того же образца, их обрабатывают различными способами, чтобы экстрагировать два различных вида нуклеиновой кислоты (ДНК и РНК), и, следовательно, маловероятно, что эффективность экстракции будет одинаковой. Аналогично, может присутствовать ошибка отбора проб данных двух экстрагируемых образцов, когда аликвоты помещают в отдельные пробирки для анализа. Кроме того, поскольку их амплифицируют в различных реакционных смесях ПЦР, которые отличаются по составу (например, по меньшей мере присутствием или отсутствием обратной транскриптазы) и часто по профилям температурных циклов, трудно провести значимые сравнения. Раскрытое далее изобретение позволяет преодолеть данные ограничения.
В данной области хорошо известно, что возможна одновременная экстракция как ДНК, так и РНК, которые вместе называют «общей нуклеиновой кислотой» (ОНК). Тем не менее, один аспект ОТ-ПЦР, который, как правило, не обсуждают в литературе, состоит в том, что протоколы, по которым амплифицируют конкретный транскрипт РНК (РНК-Х) в образце ОНК, также приводят к совместной амплификации ДНК (ДНК-Х) гена, с которого транскрибировали данную конкретную целевую РНК-Х. Также верно обратное, что при реакции с обратной транскриптазой невозможно амплифицировать только конкретную последовательность ДНК (ДНК-Х), если данная ДНК представляет собой ген или последовательность, которая активно транскрибируется, так как транскрибированная РНК (РНК-Х) также будет совместно амплифицироваться. Другими словами, продукты амплификации ОТ-ПЦР с образца ОНК всегда представляют собой сумму ампликонов, полученных как с РНК-Х, так и с ДНК-Х (РНК-Х плюс ДНК-Х), если ДНК-Х транскрибируется с образованием РНК-Х. По этой причине, невозможно нормировать конкретную неродственную PHK-Y на последовательность геномной ДНК-Х, если данная последовательность транскрибируется.
Настоящее изобретение направлено на преодоление одной или более трудностей, существующих в известном уровне техники, путем подготовки образцов нуклеиновых кислот, содержащих как ДНК, так и РНК (например, ОНК), и совместной амплификации (i) одного гена (ДНК-Х) и соответствующих ему продуктов транскрипции РНК (РНК-Х), наряду с неродственным участком ДНК (ДНК-N), который не транскрибируется. ДНК-N затем можно применять для нормировки уровней ДНК-Х плюс РНК-Х. Кроме того, возможно применение множества наборов праймеров, нацеленных на множество транскрибированных генов или участков и соответствующие им транскрипты, например, ДНК-Х плюс РНК-Х и ДНК-Y плюс PHK-Y можно нормировать на нетранскрибируемую ДНК-N. Необязательно, для удобства, отношение, полученное путем деления результатов анализа множества транскрибированных мишеней ДНК/РНК на результат для одной нетранскрибируемой ДНК-N, можно снова разделить на количество наборов праймеров, нацеленных на наборы молекул транскрибированной ДНК/РНК. Настоящее изобретение будет дополнительно пояснено с помощью следующих примеров.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение может включать совместную амплификацию трех видов нуклеиновых кислот (например, одновременно) в образце, содержащем как ДНК, так и РНК (например, в образце общей нуклеиновой кислоты (ОНК)). Данные виды представляют собой (i) ген(ы), (ii) транскрипты, экспрессированные с данного(-ых) гена(-ов), и (iii) неэкспрессируемые (т.е. нетранскрибируемые) последовательности ДНК. В совокупности, объединенное измеренное количество гена и соответствующих транскриптов часто называют в данной заявке ГИТ (Ген И Транскрипт) и измеренное количество нетранскрибируемой ДНК часто называют в данной заявке НЭД (НеЭкспрессируемая ДНК). Способы согласно настоящему изобретению включают совместную амплификацию данных видов в совокупности или отдельно и использование отношения оцененных ГИТ и НЭД в качестве показателя транскрипционной способности, которую, в свою очередь, можно использовать для оценки таких свойств как жизнеспособность клетки, гибель клетки, функциональное нарушение в клетках, возникшее в результате внешнего стимула или болезненного состояния, и тому подобных свойств.
В настоящем изобретении предложены, по меньшей мере частично, варианты реализации 1-48, перечисленные ниже:
Вариант реализации 1. Способ нормировки количественных данных, полученных по амплификации нуклеиновых кислот из клетки, организма или вируса, указанный способ включает:
(i) получение количественных данных
- по амплификации геномной ДНК с первого гена и РНК, транскрибированной с первого гена, и
- по амплификации последовательности нетранскрибируемой ДНК в клетке, организме или вирусе; и
(ii) применение указанных количественных данных для получения нормированного значения (nV), представляющего собой отношение количеств:
- указанных геномной ДНК и транскриптов РНК первого гена, к таковым для
- указанной геномной ДНК, которая не транскрибируется,
присутствующих в образце нуклеиновых кислот перед проведением указанной амплификации.
Вариант реализации 2. Способ согласно варианту реализации 1, отличающийся тем, что количественные данные представляют собой число копий ампликона, и указанный способ включает:
- получение значения A (vA), представляющего собой общее количество ампликонов, полученных в результате амплификации указанных геномной ДНК и транскриптов РНК первого гена, и значения В (vB), представляющего собой общее количество ампликонов, полученных из последовательности нетранскрибируемой ДНК;
- вычисление нормированного значения (nV) с применением уравнения:
vA/vB=nV
или эквивалентной его формы.
Вариант реализации 3. Способ согласно варианту реализации 1, отличающийся тем, что количественные данные представляют собой число копий ампликона, и указанный способ включает:
- получение значения X (vX), представляющего собой общее количество ампликонов, полученных в результате: амплификации геномной ДНК и транскриптов РНК с первого гена, и амплификации геномной ДНК и транскриптов РНК с по меньшей мере одного дополнительного гена;
- получение значения В (vB), представляющего собой общее количество ампликонов, полученных из последовательности нетранскрибируемой ДНК,
- вычисление нормированного значения (nV) с применением уравнения:
vX/(vB x(X+1))=nV
или эквивалентной его формы,
где X представляет собой количество указанного(-ых) дополнительного(-ых) гена(-ов).
Вариант реализации 4. Способ согласно варианту реализации 2 или варианту реализации 3, отличающийся тем, что амплификация представляет собой цифровую полимеразную цепную реакцию (цПЦР).
Вариант реализации 5. Способ согласно варианту реализации 1, отличающийся тем, что количественные данные представляют собой пороговое значение (Ct), и указанный способ включает:
- получение порогового значения цикла CtA для амплификации указанных геномной ДНК и транскриптов РНК первого гена,
- получение порогового значения цикла CtB для амплификации последовательности нетранскрибируемой ДНК; и
- вычисление нормированного значения (nV) с применением уравнения:

или эквивалентной его формы.
Вариант реализации 6. Способ согласно варианту реализации 1, отличающийся тем, что количественные данные представляют собой пороговое значение (Ct), и указанный способ включает:
- получение порогового значения цикла CtX для: амплификации указанных геномной ДНК и транскриптов РНК первого гена и амплификации геномной ДНК и транскриптов РНК с по меньшей мере одного дополнительного гена;
- получение порогового значения цикла CtB для амплификации последовательности нетранскрибируемой ДНК; и
- вычисление нормированного значения (nV) с применением уравнения:

или эквивалентной его формы,
где X представляет собой количество указанного(-ых) дополнительного(-ых) гена(-ов).
Вариант реализации 7. Способ согласно варианту реализации 5 или варианту реализации 6, отличающийся тем, что амплификация представляет собой количественную полимеразную цепную реакцию (кПЦР).
Вариант реализации 8. Способ согласно любому из вариантов реализации 1-7, отличающийся тем, что последовательность нетранскрибируемой ДНК представляет собой геномную ДНК.
Вариант реализации 9. Способ согласно любому из вариантов реализации 1-8, дополнительно включающий проведение указанной амплификации нуклеиновых кислот из клетки, организма или вируса.
Вариант реализации 10. Способ согласно любому из вариантов реализации 1-9, отличающийся тем, что указанные нуклеиновые кислоты из клетки, организма или вируса представляют собой экстракт общих нуклеиновых кислот.
Вариант реализации 11. Способ согласно любому из вариантов реализации 1-10, отличающийся тем, что любую указанную амплификацию проводят, применяя: полимеразную цепную реакцию (ПЦР), полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), амплификацию с замещением цепи (SDA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), рекомбиназную полимеразную амплификацию (RPA), геликаза-зависимую амплификацию (HDA), амплификацию на основе встраивания в цепь (SIBA), опосредованную транскрипцией амплификацию (ТМА), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), или любую комбинацию перечисленных способов амплификации.
Вариант реализации 12. Способ согласно любому из вариантов реализации 1-11, дополнительно включающий применение нормированного значения (nV) для оценки уровня транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 13. Способ согласно любому из вариантов реализации 1-12, дополнительно включающий:
- получение нормированного значения для отсутствия транскрипции (nV-), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности; и
- сравнение нормированного значения (nV), полученного по указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для отсутствия транскрипции (nV-), чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 14. Способ согласно варианту реализации 13, отличающийся тем, что нормированное значение для отсутствия транскрипции (nV-) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
Вариант реализации 15. Способ согласно варианту реализации 13 или варианту реализации 14, отличающийся тем, что:
- нормированное значение для отсутствия транскрипции (nV-) используют в качестве исходного значения для оценки наличия или отсутствия транскрипционной активности в клетке, организме или вирусе; и
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или ниже нормированного значения для отсутствия транскрипции (nV-), то это свидетельствует об отсутствии транскрипционной активности; или
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, выше нормированного значения для отсутствия транскрипции (nV-), то это свидетельствует о наличии транскрипционной активности.
Вариант реализации 16. Способ согласно любому из вариантов реализации 13-15, отличающийся тем, что указанное нормированное значение для отсутствия транскрипции (nV-):
- включает статистическую изменчивость в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности; и/или
- предложено с доверительным интервалом, в котором указанное нормированное значение для отсутствия транскрипции (nV-) позволяет спрогнозировать (предсказать) наличие или отсутствие транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 17. Способ согласно варианту реализации 16, отличающийся тем, что указанный доверительный интервал больше, чем 90%, или больше, чем 95%.
Вариант реализации 18. Способ согласно любому из вариантов реализации 13-17, дополнительно включающий:
- получение нормированного значения для наличия транскрипции (nV+), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и
- сравнение нормированного значения (nV), полученного по указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для наличия транскрипции (nV+), чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 19. Способ согласно варианту реализации 18, отличающийся тем, что нормированное значение для наличия транскрипции (nV+) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
Вариант реализации 20. Способ согласно варианту реализации 18 или вариант реализации 19, отличающийся тем, что:
- нормированное значение для наличия транскрипции (nV+) используют в качестве исходного значения транскрипционной активности в клетке, организме или вирусе; и
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, ниже нормированного значения для наличия транскрипции (nV+), то это свидетельствует о недостатке или отсутствии транскрипционной активности; или
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или выше нормированного значения для наличия транскрипции (nV+), то это свидетельствует о наличии транскрипционной активности.
Вариант реализации 21. Способ согласно любому из вариантов реализации 18-20, отличающийся тем, что указанное нормированное значение для наличия транскрипции (nV+):
- включает статистическую изменчивость в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и/или
- предложено с доверительным интервалом, в котором указанное нормированное значение для наличия транскрипции (nV+) позволяет спрогнозировать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 22. Способ согласно варианту реализации 21, отличающийся тем, что указанный доверительный интервал больше, чем 90%, или больше, чем 95%.
Вариант реализации 23. Способ согласно варианту реализации 13, дополнительно включающий:
- получение нормированного значения для отсутствия транскрипции (nV-), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности;
- получение нормированного значения для наличия транскрипции (nV+), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и
- сравнение нормированного значения (nV), полученного по указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с:
(i) нормированным значением для отсутствия транскрипции (nV-) и нормированным значением для наличия транскрипции (nV+), или
(ii) совокупным нормированным значением для транскрипции  , промежуточным между нормированным значением для отсутствия транскрипции (nV-) и нормированным значением для наличия транскрипции (nV+),
, промежуточным между нормированным значением для отсутствия транскрипции (nV-) и нормированным значением для наличия транскрипции (nV+),
чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 24. Способ согласно варианту реализации 23, отличающийся тем, что совокупное нормированное значение для транскрипции (nV-) рассчитывают с применением уравнения:
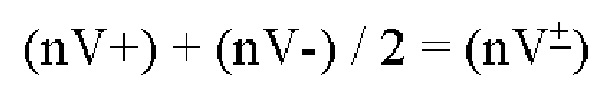
или эквивалентной его формы.
Вариант реализации 25. Способ согласно варианту реализации 24, отличающийся тем, что указанное совокупное нормированное значение для транскрипции  :
:
- включает статистическую изменчивость в указанной серии нормированных значений для отсутствия транскрипции (nV-) и/или нормированных значений для наличия транскрипции (nV+); и/или
- предложено с доверительным интервалом, в котором указанное совокупное нормированное значение для транскрипции  позволяет спрогнозировать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе.
позволяет спрогнозировать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе.
Вариант реализации 26. Способ согласно варианту реализации 25, отличающийся тем, что указанный доверительный интервал больше, чем 90%, или больше, чем 95%.
Вариант реализации 27. Способ согласно любому из вариантов реализации с 12 по 26, отличающийся тем, что уровень транскрипционной активности в клетке, организме или вирусе оценивают с целью определения любого одного или нескольких из следующих признаков:
- жизнеспособности исследуемой клетки или исследуемого организма;
- являются ли исследуемые клетка, организм или вирус живыми или мертвыми;
- нарушения транскрипции в исследуемых клетке, организме или вирусе.
Вариант реализации 28. Способ согласно любому из вариантов реализации 1-11, дополнительно включающий применение нормированного значения (nV) для оценки уровня устойчивости к лекарственному средству или чувствительности к лекарственному средству в клетке, организме или вирусе, отличающийся тем, что:
- указанную клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, и
- указанное нормированное значение (nV) сравнивают с контрольным нормированным значением (cnV), полученным с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которых известно, что они:
(i) устойчивы к указанному лекарственному средству; или
(ii) чувствительны к указанному лекарственному средству,
чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса.
Вариант реализации 29. Способ согласно любому из вариантов реализации 1-11 или 28, дополнительно включающий:
- получение нормированного значения для чувствительности к лекарственному средству (dsV), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которых известно, что они, чувствительны к указанному лекарственному средству; и
- сравнение нормированного значения (nV), полученного по указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для чувствительности к лекарственному средству (dsV), чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству в клетке, организме или вирусе, при этом указанные клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот.
Вариант реализации 30. Способ согласно варианту реализации 29, отличающийся тем, что нормированное значение для чувствительности к лекарственному средству (dsV) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
Вариант реализации 31. Способ согласно варианту реализации 29 или варианту реализации 30, отличающийся тем, что:
- нормированное значение для чувствительности к лекарственному средству (dsV) используют в качестве исходного значения для оценки наличия или отсутствия устойчивости или чувствительности к лекарственному средству у клетки, организма или вируса; и
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, выше нормированного значения для чувствительности к лекарственному средству (dsV), то это свидетельствует об устойчивости к лекарственному средству; или
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или ниже нормированного значения для чувствительности к лекарственному средству (dsV), то это свидетельствует о чувствительности к лекарственному средству.
Вариант реализации 32. Способ согласно любому из вариантов реализации 29-31, отличающийся тем, что указанное нормированное значение для чувствительности к лекарственному средству (dsV):
- включает статистическую изменчивость в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они чувствительны к указанному лекарственному средству; и/или
- предложено с доверительным интервалом, в котором указанное нормированное значение для чувствительности к лекарственному средству (dsV) позволяет спрогнозировать наличие или отсутствие:
(i) устойчивости к лекарственному средству у клетки, организма или вируса; или
(ii) чувствительности к лекарственному средству у клетки, организма или вируса.
Вариант реализации 33. Способ согласно варианту реализации 32, отличающийся тем, что указанный доверительный интервал больше, чем 90%, или больше, чем 95%.
Вариант реализации 34. Способ согласно любому из вариантов реализации 1-11 или 28, дополнительно включающий:
- получение нормированного значения для устойчивости к лекарственному средству (drV), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяций клеток, организмов или вирусов, про которых известно, что они устойчивы к указанному лекарственному средству; и
- сравнение нормированного значения (nV), полученного по указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для устойчивости к лекарственному средству (drV), чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству в клетке, организме или вирусе, при этом указанные клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот.
Вариант реализации 35. Способ согласно варианту реализации 34, отличающийся тем, что нормированное значение для устойчивости к лекарственному средству (drV) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
Вариант реализации 36. Способ согласно варианту реализации 34 или варианту реализации 35, отличающийся тем, что:
- нормированное значение для устойчивости к лекарственному средству (drV) используют в качестве исходного значения для оценки наличия или отсутствия устойчивости или чувствительности к лекарственному средству у клетки, организма или вируса; и
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или выше нормированного значения для устойчивости к лекарственному средству (drV), то это свидетельствует об устойчивости к лекарственному средству; или
- если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, ниже нормированного значения для устойчивости к лекарственному средству (drV), то это свидетельствует о чувствительности к лекарственному средству.
Вариант реализации 37. Способ согласно любому из вариантов реализации с 34 по 36, отличающийся тем, что указанное нормированное значение для устойчивости к лекарственному средству (drV):
- включает статистическую изменчивость в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они устойчивы к указанному лекарственному средству; и/или
- предложено с доверительным интервалом, в котором указанное нормированное значение для устойчивости к лекарственному средству (drV) позволяет спрогнозировать наличие или отсутствие:
(i) устойчивости к лекарственному средству у клетки, организма или вируса; или
(ii) чувствительности к лекарственному средству у клетки, организма или вируса.
Вариант реализации 38. Способ согласно варианту реализации 37, отличающийся тем, что указанный доверительный интервал больше, чем 90%, или больше, чем 95%.
Вариант реализации 39. Способ согласно одному из вариантов реализации 1-11, дополнительно включающий применение нормированного значения (nV) для оценки уровня устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса, отличающийся тем, что:
- первую популяцию указанных клеток, организмов или вирусов, которых подвергали воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, используют для получения первого указанного нормированного значения (nV),
- вторую популяцию указанных клеток, организмов или вирусов, которых не подвергали воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, используют для получения второго указанного нормированного значения (nV),
- указанное первое нормированное значение (nV) и указанное второе нормированное значение (nV) сравнивают, чтобы оценить уровень транскрипционной активности в клетке, организме или вирусе под воздействием или без воздействия лекарственного средства и посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса.
Вариант реализации 40. Способ согласно варианту реализации 39, отличающийся тем, что если указанное первое нормированное значение (nV) ниже, чем указанное второе нормированное значение (nV), то это свидетельствует о чувствительности к указанному лекарственному средству.
Вариант реализации 41. Способ согласно любому из вариантов реализации 27-40, отличающийся тем, что лекарственное средство представляет собой противомикробное средство.
Вариант реализации 42. Способ согласно любому из вариантов реализации 27-41, отличающийся тем, что лекарственное средство представляет собой противомикробное средство класса, выбранного из: аминогликозидов, ансамицинов, карбацефема, карбапенемов, цефалоспоринов, гликопептидов, макролидов, пенициллинов, монобактамов, полипептидов, хинолонов, сульфонамидов, тетрациклинов.
Вариант реализации 43. Способ согласно любому из вариантов реализации 27-42, отличающийся тем, что лекарственное средство представляет собой ципрофлоксацин, азитромицин, рифампицин или доксициклин.
Вариант реализации 44. Способ согласно любому из вариантов реализации 27-43, отличающийся тем, что первый ген представляет собой ген из вида Chlamydia (например, Chlamydia trachomatis), из вида Gonorrhea или из вида Mycoplasma (например, Mycoplasma genitralium).
Вариант реализации 45. Способ согласно любому из вариантов реализации 1-44, отличающийся тем, что указанную геномную ДНК из первого гена и РНК, транскрибированную с первого гена, а также указанную последовательность нетранскрибируемой ДНК совместно амплифицируют в одной реакции.
Вариант реализации 46. Способ согласно варианту реализации 45, отличающийся тем, что указанная реакция включает применение обратной транскриптазы.
Вариант реализации 47. Способ согласно любому из вариантов реализации 1-46, отличающийся тем, что клетка представляет собой клетку млекопитающего, клетку человека, клетку животного, клетку растения, бактериальную клетку, клетку-хозяина, инфицированную вирусами, или клетку-хозяина, инфицированную бактериями.
Вариант реализации 48. Способ согласно любому из вариантов реализации 1-47, отличающийся тем, что организм представляет собой млекопитающее, человека, растение, бактерию, вирус, гриб, водоросль, архею или простейшее.
В настоящем изобретении также предложены, по меньшей мере частично, варианты реализации 1-23, перечисленные ниже:
Вариант реализации 1. Способ оценки транскрипционной активности клетки или организма, указанный способ включает:
- проведение реакции амплификации нуклеиновых кислот с применением общей нуклеиновой кислоты из клетки или организма, при этом амплификация нуклеиновых кислот включает:
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК из первого гена и РНК, транскрибированную с первого гена,
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать участок некодирующей геномной ДНК, которая не транскрибируется в клетке или организме;
- анализ кинетики реакции амплификации нуклеиновых кислот для получения отношения:
(i) указанных геномной ДНК и транскриптов РНК первого гена, к
(ii) указанному участку некодирующей ДНК,
при этом указанное отношение отражает относительное количество (i) и (ii), присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот; и
- анализ указанного отношения для оценки транскрипционной активности клетки или организма, при этом:
отношение, равное 1, указывает на отсутствие транскрипционной активности в клетке или организме, и
отношение, большее чем 1, указывает на то, что транскрипционная активность присутствует или может присутствовать в клетке или организме.
Вариант реализации 2. Способ согласно варианту реализации 1, отличающийся тем, что отношение, большее чем 1,5, 1,7, 1,9, 2, 2,2, 2,4, 2,5, 2,7, 2,9 или 3, указывает на транскрипционную активность в клетке или организме.
Вариант реализации 3. Способ согласно варианту реализации 1, отличающийся тем, что отношение, меньшее чем 1,5, 1,4, 1,3, 1,2 или 1,1, указывает на отсутствие транскрипционной активности в клетке или организме.
Вариант реализации 4. Способ оценки жизнеспособности клетки или организма, указанный способ включает:
- проведение реакции амплификации нуклеиновых кислот с применением общей нуклеиновой кислоты из клетки или организма, при этом амплификация нуклеиновых кислот включает:
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК из первого гена и РНК, транскрибированную с первого гена,
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать участок некодирующей геномной ДНК, которая не транскрибируется в клетке или организме;
- анализ кинетики реакции амплификации нуклеиновых кислот для получения отношения:
(i) указанных геномной ДНК и транскриптов РНК первого гена, к
(ii) указанному участку некодирующей ДНК,
при этом указанное отношение отражает относительное количество (i) и (ii), присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот; и
- анализ указанного отношения для оценки транскрипционной активности клетки или организма, при этом:
отношение, равное 1, свидетельствует о том, что клетка или организм не жизнеспособны, и
отношение, большее чем 1, свидетельствует о том, что клетка или организм являются или могут быть жизнеспособными.
Вариант реализации 5. Способ согласно варианту реализации 4, отличающийся тем, что отношение, большее чем 1,5, 1,7, 1,9, 2, 2,2, 2,4, 2,5, 2,7, 2,9 или 3, свидетельствует о том, что клетка или организм жизнеспособны.
Вариант реализации б. Способ согласно варианту реализации 4, отличающийся тем, что отношение, меньшее чем 1,5, 1,4, 1,3, 1,2 или 1,1 свидетельствует о том, что клетка или организм не жизнеспособны.
Вариант реализации 7. Способ определения того, являются ли клетка или организм мертвыми, указанный способ включает:
- проведение реакции амплификации нуклеиновых кислот с применением общей нуклеиновой кислоты из клетки или организма, при этом амплификация нуклеиновых кислот включает:
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК из первого гена и РНК, транскрибированную с первого гена,
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать участок некодирующей геномной ДНК, которая не транскрибируется в клетке или организме;
- анализ кинетики реакции амплификации нуклеиновых кислот для получения отношения:
(i) указанных геномной ДНК и транскриптов РНК первого гена, к
(ii) указанному участку некодирующей ДНК,
при этом указанное отношение отражает относительное количество (i) и (ii), присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот; и
- анализ указанного отношения для оценки транскрипционной активности клетки или организма, при этом:
отношение, равное 1, свидетельствует о том, что клетка или организм мертвы, и
отношение, большее чем 1, свидетельствует о том, что клетка или организм являются живыми или могут быть живыми.
Вариант реализации 8. Способ согласно варианту реализации 7, отличающийся тем, что отношение, большее чем 1,5, 1,7, 1,9, 2, 2,2, 2,4, 2,5, 2,7, 2,9 или 3, свидетельствует о том, что клетка или организм живые.
Вариант реализации 9. Способ согласно варианту реализации 7, отличающийся тем, что отношение, меньшее чем 1,5, 1,4, 1,3, 1,2 или 1,1 свидетельствует о том, что клетка или организм не живые.
Вариант реализации 10. Способ обнаружения нарушения транскрипции внутри клетки, указанный способ включает:
- проведение реакции амплификации нуклеиновых кислот с применением общей нуклеиновой кислоты из клетки или организма, при этом амплификация нуклеиновых кислот включает:
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК из первого гена и РНК, транскрибированную с первого гена,
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать участок некодирующей геномной ДНК, которая не транскрибируется в клетке или организме;
- анализ кинетики реакции амплификации нуклеиновых кислот для получения отношения:
(i) указанных геномной ДНК и транскриптов РНК первого гена, к
(ii) указанному участку некодирующей ДНК,
при этом указанное отношение отражает относительное количество (i) и (ii), присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот; и
- анализ указанного отношения для оценки транскрипционной активности клетки или организма, при этом:
отношение, равное 1, указывает на полное нарушение транскрипции в клетке или организме, и
отношение, большее чем 1, указывает на отсутствие нарушения транскрипции в клетке или организме.
Вариант реализации 11. Способ согласно варианту реализации 10, отличающийся тем, что отношение, большее чем 1,5, 1,7, 1,9, 2, 2,2, 2,4, 2,5, 2,7, 2,9 или 3, указывает на отсутствие нарушения транскрипции в клетке или организме.
Вариант реализации 12. Способ согласно варианту реализации 10, отличающийся тем, что отношение, меньшее чем 1,5, 1,4, 1,3, 1,2 или 1,1, указывает на частичное или полное нарушение транскрипции в клетке или организме.
Вариант реализации 13. Способ согласно любому из вариантов реализации 1-12, включающий получение порогового значения цикла (Ct) для:
(i) указанного участка некодирующей ДНК, и
(ii) указанных геномной ДНК и транскриптов РНК первого гена;
в ходе указанной реакции амплификации нуклеиновых кислот и получение отношения путем сравнения указанных значений.
Вариант реализации 14. Способ согласно любому из вариантов реализации 1-13, отличающийся тем, что указанный способ включает:
- получение порогового значения цикла ctA для указанных геномной ДНК и транскриптов РНК первого гена и получение порогового значения цикла CtB для указанного участка некодирующей ДНК после начала реакции амплификации нуклеиновых кислот;
- вычисление кратности изменения между значениями CtB и ctA с применением уравнения:
 ; и
; и
- получение отношения с применением уравнения:
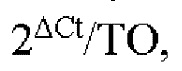
где ТО представляет собой отношение копий геномной ДНК первого гена к копиям участка некодирующей геномной ДНК в образце общих нуклеиновых кислот из клетки.
Вариант реализации 15. Способ согласно любому из вариантов реализации 1-14, отличающийся тем, что:
- проведение реакции амплификации нуклеиновых кислот дополнительно включает приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК со второго гена и РНК, транскрибированную со второго гена, и
- анализируют кинетику реакции амплификации нуклеиновых кислот, чтобы получить отношение, отражающее количество:
(i) указанного участка некодирующей ДНК, относительно
(ii) указанной геномной ДНК и транскриптов РНК с первого и второго генов, присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот.
Вариант реализации 16. Способ согласно варианту реализации 15, отличающийся тем, что указанный способ включает:
- получение порогового значения цикла ctA для указанных геномной ДНК и транскриптов РНК с первого и второго генов и получение порогового значения цикла CtB для указанного участка некодирующей ДНК после начала реакции амплификации нуклеиновых кислот;
- вычисление кратности изменения между значениями CtB и ctA с применением уравнения:
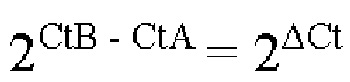
- получение отношения с применением уравнения

где ТО представляет собой отношение копий геномной ДНК с первого и второго генов к копиям участка некодирующей геномной ДНК в образце общих нуклеиновых кислот из клетки.
Вариант реализации 17. Способ согласно любому из вариантов реализации 1-16, отличающийся тем, что указанный анализ отношения включает сравнение отношения с пороговым отношением, полученным при осуществлении указанного способа на серии отрицательных или положительных контрольных клеток или организмов и получение среднего значения порогового отношения, указывающего на фенотип.
Вариант реализации 18. Способ детектирования устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки или организма, указанный способ включает:
- проведение первой реакции амплификации нуклеиновых кислот на общих нуклеиновых кислотах, полученных из первого образца клетки или организма, которые не подвергали воздействию лекарственного средства; и
- проведение второй реакции амплификации нуклеиновых кислот на общих нуклеиновых кислотах, полученных из второго образца клетки или организма, которые подвергали воздействию лекарственного средства;
при этом каждую указанную реакцию амплификации нуклеиновых кислот вели отдельно, и она включала:
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать геномную ДНК из первого гена и РНК, транскрибированную с первого гена,
приведение в контакт образца общих нуклеиновых кислот с одним или множеством праймеров, способных амплифицировать участок некодирующей геномной ДНК, которая не транскрибируется в клетке или организме;
- анализ кинетики каждой из указанных реакций амплификации нуклеиновых кислот с получением первого и второго отношений:
(i) указанных геномной ДНК и транскриптов РНК первого гена, к
(ii) указанному участку некодирующей ДНК,
при этом указанное отношение отражает относительное количество (i) и (ii), присутствующих в образце общих нуклеиновых кислот перед проведением реакции амплификации нуклеиновых кислот; и
- сравнение отношений для оценки того, устойчивы ли клетка или организм к лекарственному средству, при этом:
если первое и второе отношения равны, это свидетельствует о полной устойчивости клетки или организма к лекарственному средству, и
если второе отношение меньше, чем первое отношение, это свидетельствует о чувствительности клетки или организма к лекарственному средству.
Вариант реализации 19. Способ согласно варианту реализации 18, отличающийся тем, что клетку или организм считают устойчивыми к лекарственному средству, если значение второго отношения не более чем на 1%, 2%, 5%, 7,5%, 10%, 12%, 15% или 20% меньше, чем значение первого отношения.
Вариант реализации 20. Способ согласно варианту реализации 18, отличающийся тем, что клетку или организм считают чувствительными к лекарственному средству, если значение второго отношения составляет по меньшей мере 10%, 20%, 30%, 40% или 50% от значения первого отношения.
Вариант реализации 21. Способ согласно любому из вариантов реализации 1-20, отличающийся тем, что способ амплификации выбирают из группы, состоящей из: полимеразной цепной реакции (ПЦР), амплификации с замещением цепи (SDA), геликаза-зависимой амплификации (HDA), рекомбиназной полимеразной амплификации (RPA), изотермической амплификации с формированием петель (LAMP), амплификации по типу катящегося кольца (RCA), опосредованной транскрипцией амплификации (ТМА), самоподдерживающейся репликации последовательностей (3SR), амплификации, основанной на последовательности нуклеиновых кислот (NASBA), полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) и любой комбинации перечисленных способов.
Вариант реализации 22. Способ согласно любому из вариантов реализации 1-21, отличающийся тем, что клетка представляет собой клетку млекопитающего, клетку человека, клетку растения, бактериальную клетку, клетку-хозяина, инфицированную вирусами, или клетку-хозяина, инфицированную бактериями.
Вариант реализации 23. Способ согласно любому из вариантов реализации 1-21, отличающийся тем, что организм представляет собой бактерию, вирус, грибы, водоросли, архею или простейшее.
Настоящее изобретение, как правило, совместимо с современными процедурами, применяемыми в исследовательских или диагностических лабораториях, и в нем можно использовать такие же типы образцов, способы экстракции и способы амплификации. Нуклеиновые кислоты (например, ОНК), которые нужно проанализировать, можно получить из любого подходящего источника, такого как, например, прокариотические или эукариотические клетки, или из вируса. Настоящее изобретение позволяет определить наличие или отсутствие активной транскрипции, повышения или снижения уровней экспрессии РНК или незмененные уровни экспрессии РНК.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Варианты реализации настоящего изобретения теперь будут описаны, в качестве лишь некоторых из примеров, с ссылкой на сопроводительные фигуры 1-12, приведенные ниже.
Фигура 1. Схема, на которой показаны этапы АЖИТ (VITA)-ПЦР. ПЦР с обратной транскрипцией (ОТ-ПЦР) ведут, используя общую нуклеиновую кислоту в качестве матрицы. В данном анализе АЖИТ-ПЦР используют по меньшей мере один набор праймеров, которые способны совместно амплифицировать ДНК конкретного гена (ДНК-X) и РНК, транскрибированную с данного гена (РНК-Х). В нем также используют набор праймеров, нацеленных на участок ДНК, который не транскрибируется в РНК (ДНК-N). В ходе этапа с обратной транскриптазой РНК-Х копируется в кДНК-Х, а затем, во время температурных циклов ПЦР, все ДНК-Х, кДНК-Х и ДНК-N амплифицируются. Сигнал от ГИТ (Ген и Транскрипт), который является мерой суммы ампликонов, происходящих из ДНК-Х плюс РНК-Х, можно считать в одном канале флуорофора А, тогда как сигнал от НЭД ЩеЭкспрессируемая ДНК), который является мерой ампликонов с ДНК-N, можно считать во втором канале флуорофора В. Различие в пороговых значениях цикла (Ct) между ГИТ и НЭД в образце позволяет оценить кратность изменения (КИ) в образце, наблюдаемую для данных мишеней, при этом 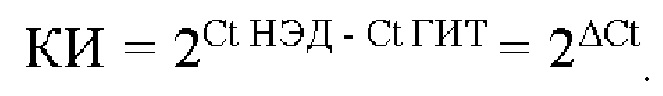 Показатель АЖИТ можно рассчитать путем деления кратности изменения, наблюдаемой в образце, на теоретическое отношение (ТО), ожидаемое в отсутствие активной транскрипции, допуская, что ген и локус НЭД присутствуют в равном числе копий. Если один транскрипт и ген используют для измерения ГИТ и одну последовательность ДНК используют для измерения НЭД, то ТО=(1 × ДНК-Х) разделить на (1 × ДНК-Y)=1. Если два транскрипта и гена (X и Z) используют для измерения ГИТ и одну последовательность ДНК (X) используют для измерения НЭД, то ТО=(1 × ДНК-Х+1 × ДНК-Z) разделить на (1 × ДНК-Y)=2. Возможность измерения ГИТ с использованием более чем одного гена и его транскриптов позволяет создать тесты, которые собирают данные с диапазона транскриптов, которые могут экспрессироваться в различные моменты времени в процессе клеточного цикла. Показатель АЖИТ представляет собой нормированную меру транскрипционной активности, которую можно сравнить между образцами независимо от количества проанализированного образца. Будут ожидать, что у клеток, которые мертвы и не содержат детектируемой остаточной РНК, показатель АЖИТ будет близок к 1; и с повышением уровня активной транскрипции будет соответственно повышаться показатель АЖИТ.
Показатель АЖИТ можно рассчитать путем деления кратности изменения, наблюдаемой в образце, на теоретическое отношение (ТО), ожидаемое в отсутствие активной транскрипции, допуская, что ген и локус НЭД присутствуют в равном числе копий. Если один транскрипт и ген используют для измерения ГИТ и одну последовательность ДНК используют для измерения НЭД, то ТО=(1 × ДНК-Х) разделить на (1 × ДНК-Y)=1. Если два транскрипта и гена (X и Z) используют для измерения ГИТ и одну последовательность ДНК (X) используют для измерения НЭД, то ТО=(1 × ДНК-Х+1 × ДНК-Z) разделить на (1 × ДНК-Y)=2. Возможность измерения ГИТ с использованием более чем одного гена и его транскриптов позволяет создать тесты, которые собирают данные с диапазона транскриптов, которые могут экспрессироваться в различные моменты времени в процессе клеточного цикла. Показатель АЖИТ представляет собой нормированную меру транскрипционной активности, которую можно сравнить между образцами независимо от количества проанализированного образца. Будут ожидать, что у клеток, которые мертвы и не содержат детектируемой остаточной РНК, показатель АЖИТ будет близок к 1; и с повышением уровня активной транскрипции будет соответственно повышаться показатель АЖИТ.
Фигура 2. Схематичное изображение тестов согласно вариантам реализации настоящего изобретения. Фигура 2А. Способы, описанные в данной заявке, можно применять для определения того, являются ли клетки или патогены мертвыми или живыми. Данные о присутствии мертвых или живых патогенов, в свою очередь, можно использовать в способе контроля излеченности (ТОС). Протокол включает проведение АЖИТ-ПЦР, амплифицирующей ГИТ и НЭД с ОНК, а затем использование полученных значений Ct для вычисления коэффициента АЖИТ образца. Представлены гипотетические графики амплификации. Будут ожидать, что у образца без активной транскрипции (мертвые клетки) будет показатель АЖИТ, равный или близкий к 1. Пороговое значение можно установить, используя эмпирические данные определенных анализов АЖИТ-ПЦР, амплифицирующих определенные комбинации ГИТ и НЭД, присутствующих в определенных типах клеток и/или определенных патогенах. У клеток, которые являются живыми и в которых идет активная транскрипция, показатель АЖИТ будет выше порогового значения. Фигура 2В. Способы, описанные в данной заявке, можно применять для определения чувствительности к лекарственному средству или устойчивости к лекарственному средству. Образец можно разделить и инкубировать в присутствии или отсутствие одного или более лекарственных средств. ОНК, экстрагированные после инкубации, можно проанализировать с помощью АЖИТ-ПЦР с получением показателей АЖИТ для обработанного и необработанного образца, и отношение между показателями АЖИТ указывает на чувствительность или устойчивость к лекарственному средству. Представлены гипотетические графики амплификации. Если образец чувствителен к указанному лекарственному средству, то будут ожидать, что показатели АЖИТ образца в присутствии лекарственного средства будут ниже, чем в отсутствие лекарственного средства. Наоборот, если образец устойчив к указанному лекарственному средству, то не будут ожидать, что показатель АЖИТ образца в присутствии лекарственного средства будет ниже, чем в отсутствие лекарственного средства, и может он быть сходным.
Фигура 3. Иммунофлуоресцентное окрашивание клеток и анализ с помощью ПЦР. Образцы Chlamydia trachomatis (серовар D), которые растили в клетках НЕр-2, обрабатывали различными концентрациями азитромицина, как описано в примере 1, протокол обработки А (1.2.1). В частности, клетки обрабатывали: i) без антибиотика, или с антибиотиком ii) ниже минимальной ингибирующей концентрации (МИК) (<МИК, 0,008 мкг/мл), iii) при МИК (0,064 мкг/мл) или iv) выше МИК (>МИК 0,512 мкг/мл). На панели i показаны примеры изображений для определения жизнеспособности необработанных клеток и клеток, обработанных каждой дозой антибиотика. Данные изображения получали посредством иммунофлуоресцентного окрашивания инфицированных клеток НЕр-2 и анализировали при 100Х увеличении с помощью флуоресцентного микроскопа IN Cell Analyser 2200 (GE Healthcare Life Sciences). На панели ii показана вычисленная жизнеспособность после инфекции (ПИ), измеренная в виде образующих включение единиц на мл (ОВЕ/мл), для обработки каждой дозой антибиотика, при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК), и для необработанных клеток (без антибиотика), рассчитанная по изображениям, представленным на панели i. Результаты нормировали на значение, полученное для образца, обработанного концентрацией антибиотика выше МИК. На панели iii показан анализ ОНК из данных клеток, которые были инфицированы хламидиями, и которые амплифицировали с помощью одного набора праймеров, способных амплифицировать как ДНК основного порина наружной мембраны (omp1), так и РНК omp1. ОНК амплифицировали с помощью ОТ-ПЦР (чтобы амплифицировать ДНК и РНК omp1) и с помощью ПЦР (чтобы амплифицировать только ДНК omp1). На панели iii представлена кратность изменения, представляющая собой разницу (ΔCt) между Ct ДНК omp1 в ПЦР и Ct РНК omp1 плюс ДНК omp1 в ОТ-ПЦР, рассчитанную как 2ΔCt, для обработки каждой дозой антибиотика, при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК), и необработанных клеток (без антибиотика).
Фигура 4. Анализ тестов согласно вариантам реализации настоящего изобретения. Анализ кандидатных мишеней ТИТ и НЭД путем амплификации образцов РНК или ОНК и сравнение результатов ПЦР (для амплификации только ДНК) и ОТ-ПЦР (для амплификации ДНК и РНК). На панелях i и ii показаны графики амплификации, полученные с применением потенциальных праймеров ГИТ (omp1), когда в качестве матрицы использовали только РНК (панель i) или ОНК (панель ii). Указана разница (ΔCt) между Ct для детектирования только ДНК omp1 с помощью ПЦР (пунктирные линии) и для детектирования ДНК omp1 плюс РНК omp1 с помощью ОТ-ПЦР (сплошные линии). На панелях iii и iv показаны графики амплификации с применением потенциальных праймеров для НЭД (InfAIGR), когда в качестве матрицы использовали только РНК (панель iii) или ОНК (панель iv). Указаны разницы (ΔCt) между Ct для детектирования только ДНК, применяя InfAIGR, с помощью ПЦР (пунктирные линии) и для детектирования ДНК, применяя InfAIGR, плюс РНК (если она присутствовала), применяя InfAIGR 1, с помощью ОТ-ПЦР (сплошные линии).
Фигура 5. Анализ тестов согласно вариантам реализации настоящего изобретения. Анализ хламидий с помощью АЖИТ-ПЦР. На панели i представлены показатели АЖИТ для необработанных клеток (без антибиотика) и для обработки каждой дозой антибиотика, как описано в примере 1 и представлено на панелях i и ii фигуры 3. В данной АЖИТ-ПЦР амплифицировали ОНК и использовали один ген и его транскрипты для измерения ГИТ и один нетранскрибируемый участок ДНК для измерения НЭД в одной реакции ОТ-ПЦР. На панели i показаны результаты ОТ-ПЦР для образцов, визуализированных, подвергнутых количественному анализу и изображенных на панелях i и ii фигуры 3, соответственно. На панели ii показан анализ хламидий с помощью АЖИТ-ПЦР. Представлены показатели АЖИТ для необработанных клеток (без антибиотика) и для обработки каждой дозой антибиотика. В данной АЖИТ-ПЦР амплифицировали два ампликона гена и его транскриптов (2 ГИТ) и одну нетранскрибируемую НЭД в одной реакции ОТ-ПЦР и, следовательно, получали ТО, равное 2 (2 ГИТ разделили на 1 НЭД).
Фигура 6. Тесты и анализ согласно варианту реализации настоящего изобретения. Анализ хламидий с помощью АЖИТ-ПЦР в образце мочи пациента. На панели i схематически изображен процесс получения образца. На панели ii показан анализ экспрессии хламидий из образца мочи пациента по сравнению с положительным (жизнеспособным) и отрицательным (нежизнеспособным) эталонными образцами хламидий, полученными посредством способов культивирования.
Фигура 7. Тесты и анализы согласно вариантам реализации настоящего изобретения. Анализ экспрессии в хламидиях с помощью АЖИТ-ПЦР в ответ на краткосрочную инкубацию с антибиотиками. На панели i схематически представлен процесс обработки образца, в котором тестируемый образец либо не обрабатывают (без лекарственного средства), либо обрабатывают различными антибиотиками (плюс лекарственное средство), а затем инкубируют в течение различных промежутков времени либо при комнатной температуре, либо при 37°С с 5% СО2. Затем экстрагируют ОНК из всех образцов и во все моменты времени и амплифицируют с помощью АЖИТ-ПЦР. На панели ii представлены показатели АЖИТ, полученные путем анализа ОНК для каждой группы лечения либо с азитромицином (темно-серый), либо без него (светло-серый). Отношения показателей АЖИТ (ДАЖИТ) плюс и минус азитромицин указаны над столбиками. Показатели АЖИТ были значительно ниже после инкубации с лекарственным средством при 37°С в течение либо 1 часа, либо 6 часов, указывая на то, что образцы были чувствительны к азитромицину, и это привело к снижению уровней транскрипции. Величина отношения ДАЖИТ может соответствовать степени уничтожения после инкубации в течение конкретных промежутков времени и при определенных условиях. На панели iii представлены показатели АЖИТ, полученные путем анализа ОНК для каждой группы лечения, при этом отношение показателей АЖИТ (ДАЖИТ) указано над столбиками. Уменьшение показателя АЖИТ после обработки 0,128 мкг/мл азитромицина при 37°С в течение 30 минут и 1 часа свидетельствовало о том, что данные образцы были чувствительны к данному антибиотику, и это выражалось в виде сниженных уровней транскрипции. На панели iv представлены показатели АЖИТ, полученные путем анализа ОНК для каждой группы лечения чувствительного и устойчивого штамма при обработке 0,256 мкг/мл рифампицина. Уменьшение показателя АЖИТ после обработки антибиотиком для чувствительного штамма после 5 минут инкубации при 37°С свидетельствовало о том, что данные образцы были чувствительны к антибиотику. Наряду с этим, показатель АЖИТ для устойчивого штамма при таких же условиях значительно не изменялся в присутствии рифампицина в любой момент времени, свидетельствуя о том, что данные образцы были действительно устойчивы к антибиотику. На панели v представлены показатели АЖИТ, полученные путем анализа ОНК для каждой группы лечения для штаммов, про которые известно, что они чувствительны и устойчивы к обработке 0,256 мкг/мл рифампицина в течение 15 минут при комнатной температуре. Выявили значимое уменьшение показателя АЖИТ чувствительного штамма в присутствии лекарственного средства, что согласуется с чувствительностью к рифампицину; тогда как выявили значимое учеличение показателя АЖИТ для устойчивого штамма при таких же условиях, что свидетельствует об устойчивости к рифампицину.
Фигура 8. Тесты и анализ согласно вариантам реализации настоящего изобретения. Анализ хламидий с помощью АЖИТ-ПЦР в ответ на возрастающие дозы антибиотика. На панели i схематически представлен процесс получения образца, обработки без и с различными концентрациями одного и того же антибиотика (азитромицин), инкубации в течение 1 часа при 37°С при подаче 5% СО2, экстракции ОНК из необработанных образцов и образцов, обработанных различными концентрациями антибиотика. На панели ii представлены показатели АЖИТ, полученные путем анализа ОНК для каждой дозы антибиотика, экстрагированных с применением фенола:хлороформа:изоамила. Статистические различия между обработанным и необработанным образцами представлены над сравниваемыми группами. Уменьшение показателя АЖИТ после обработки антибиотиком свидетельствует о том, что образцы были чувствительны к используемому антибиотику. Наблюдали уменьшение показателей АЖИТ при возрастающих концентрациях азитромицина (0,128 мкг/мл, 0,192 мкг/мл и 0,256 мкг/мл, соответственно), при этом для данной корреляции получают R2=0,98. На панели ш представлены показатели АЖИТ, полученные путем анализа ОНК для каждой дозы антибиотика, экстрагированных с применением набора для экстракции с использованием колонок. Статистические различия между обработанным и необработанным образцами представлены над группами лечения. Уменьшение показателя АЖИТ после обработки антибиотиком демонстрировало, что образцы были чувствительны к азитромицину, и показатели АЖИТ коррелировали с применяемыми дозами антибиотика 0,128 мкг/мл, 0,192 мкг/мл, 0,256 мкг/мл и 0,512 мкг/мл, соответственно, при этом получали R2=0,83.
Фигура 9. Анализ тестов согласно вариантам реализации настоящего изобретения. Анализ хламидий с помощью АЖИТ-ПЦР в ответ на краткосрочную инкубацию с различными антибиотиками с применением ОНК, экстрагированных из ряда штаммов, которые ранее охарактеризовали как чувствительные и устойчивые к конкретным антибиотикам. На панели i представлены показатели АЖИТ, полученные для каждого исследованного штамма (штаммов 1-3 и 5) после анализа ОНК с помощью АЖИТ-ПЦР для каждой группы лечения. Уменьшение показателя АЖИТ после обработки азитромицином (0,256 мкг/мл) свидетельствовало о том, что все штаммы были чувствительны к антибиотику, и транскрипция была нарушена. Статистические различия между обработанным и необработанным образцами показаны над сравниваемыми образцами. На панели ii представлены показатели АЖИТ, полученные для каждого исследованного штамма (штаммов 1-3 и 5) после анализа ОНК для каждой группы лечения. Уменьшение показателя АЖИТ после обработки доксициклином (0,256 мкг/мл) свидетельствовало о том, что все штаммы были чувствительны к антибиотику, и транскрипционная активность была нарушена. Статистические различия между обработанным и необработанным образцами показаны над сравниваемыми образцами. На панели iii представлены показатели АЖИТ, полученные для каждого исследованного штамма (штаммов 1-5) после анализа ОНК для каждой группы лечения с применением антибиотика рифампицина (0,256 мкг/мл). Уменьшение показателя АЖИТ после обработки свидетельствовало о том, что штаммы 1-4 были чувствительны антибиотику, и транскрипционная активность была нарушена. Статистические различия между обработанным и необработанным образцами показаны над сравниваемыми группами. Показатели АЖИТ, полученные для штамма 5 как в обработанном, так и в необработанном образцах, незначимо различались и свидетельствовали об устойчивости данного конкретного штамма к рифампицину. На панели iv представлено отношение ДАЖИТ, рассчитанное для каждого повторного исследования каждого штамма, который обрабатывали рифампицином, представленного на панели iii. Клетки группировали в соответствии с их профилем чувствительности, при этом для чувствительных клеток получали большее отношение ААЖИТ по сравнению с устойчивыми клетками.
Фигура 10. Схематическое представление тестов согласно вариантам реализации настоящего изобретения. Гипотетический пример, демонстрирующий процесс тестирования чувствительности к антибиотикам непосредственно в клиническом образце с инкубацией либо без лекарственного средства, либо в присутствии азитромицина, цефтриаксона и доксициклина, и дополнительного тестирования на присутствие Chlamydia trachomatis (СТ), Neisseria gonorrhoeae (GC) и Mycoplasma genitalium (MG). GC-двойная относится к двойной антибиотикотерапии.
Фигура 11. Анализ тестов согласно вариантам реализации настоящего изобретения. Анализ АЖИТ-ПЦР образцов ОНК хламидий, содержащих различные нагрузки жизнеспособными организмами. На панели i представлен показатель АЖИТ, полученный для каждого образца, содержащего определенный процент жизнеспособных хламидий на фоне нежизнеспособных хламидий. Представлены статистические различия между нежизнеспособным образцом и жизнеспособными образцами. На панели ii представлено среднее значение Ct для ГИТ1/2 и НЭД в каждом из исследованных образцов.
Фигура 12. Анализ тестов согласно вариантам реализации настоящего изобретения. Анализ хламидий в образцах ОНК с помощью альтернативной системы АЖИТ-ПЦР, которая нацелена на более длинные участки ГИТ1 и ГИТ2. На фигуре представлены показатели АЖИТ для необработанных клеток (без лечения) и для обработки каждой дозой антибиотика, как показано в примере 1 и на панелях i и ii фигуры 3. В данной АЖИТ-ПЦР амплифицировали два длинных ампликона гена и его транскриптов (2 ГИТ) и одну нетранскрибируемую НЭД в одной и той же реакции, и, следовательно, ТО равно 2.
Определения.
В данном описании форма единственного числа включает ссылку на множественное число, если в контексте явно не указано иное. Например, термин «полинуклеотид» также включает множество полинуклеотидов.
В данной заявке термин «включающий» означает «содержащий». Варианты термина «включающий», такие как «включать» и «включает», имеют соответствующим образом отличающиеся значения. Таким образом, например, полинуклеотид, «включающий» последовательность нуклеотидов, может состоять исключительно из данной последовательности нуклеотидов или может содержать один или более дополнительных нуклеотидов.
В данной заявке термины «порог цикла», «пороговое значение цикла», «пороговый цикл», «значение порогового цикла», «Ct» и «значение Ct» используют взаимозаменяемо, и они имеют одно и то же значение, представляющее собой количество циклов амплификации, необходимых для образования детектируемого количества ампликона в процессе реакции амплификации нуклеиновых кислот.
В данной заявке будет понятно, что в объем термина «амплификация», когда его используют в контексте нуклеиновых кислот, входит любая реакция, способная создавать копии одной или более матричных последовательностей нуклеиновой кислоты, если явно не указано иное. Лишь некоторые из примеров подходящих реакций включают полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепи (SDA), геликаза-зависимую амплификацию (HDA), рекомбиназную полимеразную амплификацию (RPA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), опосредованную транскрипцией амплификацию (ТМА), самоподдерживающуюся репликацию последовательностей (3SR) и амплификацию, основанную на последовательности нуклеиновых кислот (NASBA).
В данной заявке предполагается, что в объем термина «количественное значение» входит любое измерение количества данного фактора, включая, например, количественные измерения продуктов реакции амплификации (например, по значению Ct, по числу копий ампликона и тому подобные измерения).
В данной заявке термин «множество» означает более чем один. В некоторых конкретных аспектах или вариантах реализации множество может означать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 или более, и любое целое число, которое можно получить из них, и любой диапазон, который можно получить из них.
В данной заявке термин «субъект» включает любой животное экономического, социального или исследовательского значения, включая виды бычьих, лошадиных, овечьих, приматов, птичьих и грызунов. Следовательно, «субъект» может представлять собой млекопитающее, такое как, например, человек или не относящееся к человеку млекопитающее. Также в объем данного термина входят субъекты-микроорганизмы, включая, но не ограничиваясь перечисленными: бактерии, вирусы, грибы/дрожжи, простейшие и нематоды. «Субъект» в соответствии с настоящим изобретением также включает инфекционные агенты, такие как прионы.
В данной заявке термины «полинуклеотид» и «нуклеиновая кислота» можно использовать взаимозаменяемо, и они относятся к одно- или двухцепочечному полимеру из дезоксирибонуклеотидных или рибонуклеотидных оснований или их аналогов, производных, вариантов, фрагментов или комбинаций, включая, но не ограничиваясь перечисленными: ДНК, метилированную ДНК, алкилированную ДНК, РНК, метилированную РНК, микроРНК, миРНК, кшРНК, мРНК, тРНК, малые ядрышковые РНК (мякРНК), малые временные РНК (мвРНК), малые модулирующие РНК (ммРНК), пре- и при-микроРНК, другие некодирующие молекулы РНК, рибосомную РНК, ее производные, ампликоны или любую комбинацию перечисленных молекул. В качестве лишь одного из примеров, источник нуклеиновой кислоты можно выбрать из группы, включающей синтетический источник, млекопитающее, человека, животное, растение, гриб, бактерию, вирус, археи или любую комбинацию перечисленных источников. Термины «полинуклеотид», «нуклеиновая кислота» и «олигонуклеотид» включают ссылку на любую конкретную последовательность, а также на последовательность, комплементарную ей, если не указано иное.
В данной заявке термин «общая нуклеиновая кислота» относится к образцам, содержащим как РНК, так и ДНК.
В данной заявке термин «ГИТ» представляет собой акроним для «Ген И Транскрипт» и относится к совокупному измерению ДНК из одного гена и РНК, транскрибированной с данного гена, или ДНК из группы генов и РНК, транскрибированных с данных генов. В данной заявке термин «НЭД» представялет собой акроним для «НеЭкспрессируемая ДНК» и относится к измерению ДНК, происходящей из участка, который не транскрибируется в РНК.
В данной заявке термин «олигонуклеотид» относится к фрагменту ДНК или ДНК-содержащей молекулы нуклеиновой кислоты, или РНК или РНК-содержащей молекулы, или к их комбинации. Примеры олигонуклеотидов включают мишени; субстраты, например, такие, которые можно модифицировать с помощью многокомпонентных ферментов на основе нуклеиновых кислот (нуклеозимов, МНКзимов (MNAzyme)); праймеры, такие как применяемые для амплификации мишени in vitro с помощью способов, таких как ПЦР; и компоненты МНКзимов на основе нуклеиновых кислот. Термин «олигонуклеотид» включает ссылку на любую конкретную последовательность, а также на комплементарную ей последовательность, если не указано иное. Олигонуклеотиды могут содержать по меньшей мере одну вставку или замену, включая, но не ограничиваясь группой, включающей: 4-ацетил цитидин, 5-(карбоксигидроксилметил)уридин, 2'-O-метилцитидин, 5-карбоксиметиламинометилтиоуридин, дигидроуридин, 2'-O-метилпсевдоуридин, бета-D-галактозилквеуозин, 2'-O-метилгуанозин, инозин, N6-изопентениладенозин, 1-метиладенозин, 1-метилпсевдоуридин, 1-метил гуанозин, 1-метилинозин, 2,2-диметилгуанозин, 2-метиладенозин, 2-метилгуанозин, 3-метилцитидин, 5-метилцитидин, N6-метиладенозин, 7-метилгуанозин, 5-метиламинометилуридин, 5-метоксиаминометил-2-тиоуридин, бета-О-маннозилметилуридин, 5-метоксикарбонилметилуридин, 5-метоксиуридин, 2-метилтио-N6-изопентениладенозин, N-((9-бета-рибофуранозил-2-метилтиопурин-6-ил)карбамоил)треонин, N-((9-бета-рибофуранозилпурин-6-ил)N-метил-карбамоил)треонин, метиловый эфир уридин-5-оксиуксусной кислоты, уридин-5-оксиуксусную кислоту (v), вибутоксозин, псевдоуридин, квеуозин, 2-тиоцитидин, 5-метил-2-тиоуридин, 2-тиоуридин, 4-тиоуридин, 5-метилуридин, N-((9-бета-D-рибофуранозилпурин-6-ил)карбамоил)треонин, 2'-O-метил-5-метилуридин, 2'-O-метилуридин, вибутозин, 3-(3-амино-3-карбоксипропил)уридин, бета-D-арабинозил уридин, бета-D-арабинозилтимидин.
В данной заявке термины «комплементарный» и «комплементарность» относятся к способности нуклеотидов (например, дезоксирибонуклеотидов, рибонуклеотидов или их комбинаций) гибрид изо в аться друг с другом либо посредством спаривания оснований по Уотсону-Крику, либо посредством неоднозначного спаривания оснований. Связи могут образовываться посредством спаривания оснований по Уотсону-Крику между основаниями аденина (А) и основаниями урацила (U), между основаниями аденина (А) и основаниями тимина (Т), между основаниями цитозина (С) и основаниями гуанина (G). Неоднозначное спаривание оснований представляет собой спаривание оснований не по Уотсону-Крику между двумя нуклеотидами в полинуклеотидном дуплексе (например, гуанин-урацил, инозин-урацил, инозин-аденин и инозин-цитозин). Нуклеотиды, которые называют «комплементарными» или которые представляют собой «комплемент» друг друга, представляют собой нуклеотиды, которые обладают способностью гибрид изо в аться друг с другом либо посредством спаривания оснований по Уотсону-Крику, либо посредством неоднозначного спаривания между соответствующими основаниями.
В данной заявке термин «фермент» относится к любой молекуле, которая может катализировать химическую реакцию (например, амплификацию полинуклеотида, расщепление полинуклеотида и т.д.)
В данной заявке «амплификация мишени» относится к любому способу, который позволяет амплифицировать целевую нуклеиновую кислоту, включая, но не ограничиваясь перечисленными: полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепи (SDA), геликаза-зависимую амплификацию (HDA), рекомбиназную полимеразную амплификацию (RPA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), опосредованную транскрипцией амплификацию (ТМА), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), или полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР).
В данной заявке термин «ампликон» относится к нуклеиновой кислоте (например, ДНК или РНК, или их комбинации), которая представляет собой продукт естественной или искусственной амплификации нуклеиновых кислот или событий репликации, включая, но не ограничиваясь перечисленными: ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR или NASBA.
В данной заявке термины «фермент на основе нуклеиновой кислоты», «каталитическая нуклеиновая кислота», «нуклеиновая кислота с каталитической активностью» и «каталитический фермент на основе нуклеиновой кислоты» используют взаимозаменяемо, и они будут означать ДНК или ДНК-содержащую молекулу или комплекс, или РНК или РНК-содержащую молекулу или комплекс, или их комбинацию (т.е. гибридную молекулу или комплекс ДНК-РНК), которые могут распознавать по меньшей мере один субстрат и катализировать модификацию (такую как лигирование или расщепление) по меньшей мере одного субстрата. Нуклеотидные остатки в каталитических нуклеиновых кислотах могут включать основания А, С, G, Т и U, а также их производные и аналоги. Приведенные выше термины включают мономолекулярные ферменты на основе нуклеиновых кислот, которые могут включать отдельную ДНК или ДНК-содержащую молекулу (также известную в данной области как «ДНК-фермент», «дезоксирибозим» или «ДНКзим») или РНК или РНК-содержащую молекулу (также известную в данной области как «рибозим»), или их комбинацию, представляющую собой гибридную молекулу ДНК-РНК, которая может распознавать по меньшей мере один субстрат и катализировать модификацию (такую как лигирование или расщепление) по меньшей мере одного субстрата. Приведенные выше термины включают ферменты на основе нуклеиновых кислот, которые содержат ДНК или ДНК-содержащий комплекс, или РНК или РНК-содержащий комплекс, или их комбинацию, представляющую собой гибридный комплекс ДНК-РНК, который может распознавать по меньшей мере один субстрат и катализировать модификацию (такую как лигирование или расщепление) по меньшей мере одного субстрата. В объем терминов «фермент на основе нуклеиновой кислоты», «каталитическая нуклеиновая кислота», «нуклеиновая кислота с каталитической активностью» и «каталитический фермент на основе нуклеиновой кислоты» входят МНКзимы.
В данной заявке термины «МНКзим» и «многокомпонентный фермент на основе нуклеиновой кислоты» имеют одинаковые значения и относятся к двум или более последовательностям олигонуклеотидов (например, партзимам (partzymes)), которые, только в присутствии облегчающего сборку МНКзима фактора (например, мишени), образуют активный фермент на основе нуклеиновой кислоты, который способен каталитически модифицировать субстрат.МНКзимы могут катализировать ряд реакций, включая расщепление субстрата, лигирование субстратов и другие ферментативные модификации субстрата или субстратов. МНКзимы также известны в данной области как «PlexZyme». МНКзим образуется только когда сенсорные плечи партзимов А и В гибридизуются рядом друг с другом на облегчающем сборку факторе. Субстратные плечи МНКзима связывают субстрат, модификация (например, расщепление) которого катализируется каталитическим центром МНКзима, образованного в результате взаимодействия каталитических доменов партзимов А и В. Расщепление ДНК/РНК-химерного репортерного субстрата. МНКзим может расщеплять субстрат между парой красителей флуорофора и гасителя, в результате чего образуется сигнал. Термины «многокомпонентный фермент на основе нуклеиновой кислоты» и «МНКзим» включают двухкомпонентные структуры, состоящие из двух молекул, или трехкомпонентные структуры, состоящие из трех молекул нуклеиновых кислот, или другие многокомпонентные структуры, например, образованные четырьмя или более молекулами нуклеиновых кислот.
Очевидно, что в данной заявке в объем терминов «МНКзим» и «многокомпонентный фермент на основе нуклеиновой кислоты» входят все известные МНКзимы и модифицированные МНКзимы, включая описанные в любой одной или нескольких публикациях патентов РСТ №WO/2007/041774, WO/2008/040095, WO2008/122084, и публикациях родственных патентов США №2007-0231810, 2010-0136536 и 2011-0143338 (содержание каждого из данных документов полностью включено в данную заявку посредством ссылки). Лишь некоторые из примеров МНКзимов и модифицированных МНКзимов, входящих в объем терминов «МНКзим» и «многокомпонентный фермент на основе нуклеиновой кислоты», включают МНКзимы с расщепляющей каталитической активностью (примеры которых приведены в данной заявке), разобранные или частично собранные МНКзимы, содержащие один или более ингибиторов сборки, МНКзимы, содержащие один или более аптамеров («апта-МНКзимы»), МНКзимы, содержащие одно или более укороченных сенсорных плеч и необязательно один или более стабилизирующих олигонуклеотидов, МНКзимы, содержащие один или более ингибиторов активности, неактивные проферменты на основе многокомпонентных нуклеиновых кислот (MNAi) и МНКзимы с лигазной каталитической активностью («МНКзим-лигазы»), каждый из которых подробно описан в одном или нескольких из патентов WO/2007/041774, WO/2008/040095, WO2008/122084, US 2007-0231810, US 2010-0136536 и/или US 2011-0143338.
В данной заявке термины «партзим», «компонент-партзим» и «компонент партзима» относятся к ДНК-содержащему, или РНК-содержащему, или ДНК-РНК-содержащему олигонуклеотиду, два или несколько из которых, только в присутствии облегчающего сборку МНКзима фактора, согласно определению в данной заявке, могут вместе образовывать «МНКзим». В некоторых предпочтительных вариантах реализации один или несколько компонентов-партзимов, и предпочтительно по меньшей мере два, могут содержать три участка или домена: «каталитический» домен, который образует часть каталитического центра, который катализирует модификацию; домен «сенсорного плеча», который может ассоциироваться и/или связываться с облегчающим сборку фактором; и домен «субстратного плеча», который может ассоциироваться и/или связываться с субстратом. Партзимы могут содержать по меньшей мере один дополнительный компонент, включая, но не ограничиваясь аптамером, и их в данной заявке называют «апта-партзимами». Партзим может содержать множество компонентов, включая, но не ограничиваясь перечисленными: компонент партзима с укороченным сенсорным плечом и компонент стабилизирующего плеча, который стабилизирует структуру МНКзима путем взаимодействия либо с облегчающим сборку фактором, либо с субстратом.
Термины «облегчающий сборку фактор» и «облегчающий сборку МНКзима фактор» в данной заявке относятся к молекулам, которые могут способствовать самосборке компонентов-партзимов с образованием каталитически активного МНКзима путем взаимодействия с сенсорными плечами МНКзима. В данной заявке облегчающие сборку факторы могут способствовать сборке МНКзимов, которые обладают расщепляющей, лигазной или другой ферментативной активностью. В предпочтительных вариантах реализации облегчающий сборку фактор необходим для самосборки МНКзима. Облегчающий сборку фактор может состоять из одной молекулы или может состоять из двух или более «компонентов облегчающего сборку фактора», которые могут образовывать пару или связываться с сенсорными плечами одного или более олигонуклеотидных «партзимов». Облегчающий сборку фактор может содержать один или более нуклеотидных компонентов, которые не комплементарны по последовательности сенсорному(-ым) плечу(-ам) МНКзима. Облегчающий сборку фактор может представлять собой мишень. Мишень может представлять собой нуклеиновую кислоту, выбранную из группы, состоящей из ДНК, метилированной ДНК, алкилированной ДНК, РНК, метилированной РНК, микроРНК, миРНК, кшРНК, тРНК, мРНК, мякРНК, мвРНК, ммРНК, пре- и при-микроРНК, других некодирующих молекул РНК, рибосомных РНК, их производных, ампликонов или любой комбинации перечисленных молекул. Нуклеиновая кислота может представлять собой «ампликон», и амплификация может включать одну или более из: ПЦР, ОТ-ПЦР, SDA, HDA, RPA, LAMP, RCA, ТМА, 3SR, NASBA или лигазной цепной реакции.
Термин «детектируемый эффект» в данной заявке представляет собой эффект, который можно детектировать или осуществить его количественный анализ, как свидетельство того, что произошла модификация субстрата(-ов). Величина эффекта может указывать на исходное количество, например, облегчающего сборку фактора (например, мишени). Детектируемый эффект можно обнаружить с помощью различных способов, включая флуоресцентную спектроскопию, поверхностный плазмонный резонанс, масс-спектроскопию, ЯМР, электронный спиновый резонанс, поляризационную флуоресцентную спектроскопию, круговой дихроизм, иммуноанализ, хроматографию, радиометрию, фотометрию, сцинтиграфию, электронные способы, электрохимические способы, спектроскопию в УФ-, видимом или инфракрасном диапазоне, ферментативные способы или любую комбинацию перечисленных способов.
В объем термин «субстрат» в данной заявке входит любой одно- или двухцепочечный полимер из дезоксирибонуклеотидных или рибо нуклеотидных оснований или их аналогов, производных, вариантов, фрагментов или комбинаций, включая, но не ограничиваясь перечисленными: ДНК, метилированную ДНК, алкилированную ДНК, РНК, метилированную РНК, микроРНК, миРНК, кшРНК, мРНК, тРНК, мякРНК, мвРНК, ммРНК, пре- и при-микроРНК, другие некодирующие молекулы РНК, рибосомную РНК, их производные, ампликоны, или любую комбинацию перечисленных (включая смешанные полимеры дезоксирибонуклеотидных и рибонуклеотидных оснований), которые способен узнавать, на которые способен воздействовать или которые способен модифицировать фермент, включая каталитический фермент на основе нуклеиновой кислоты. «Субстрат» может быть модифицирован различными ферментативными активностями, включая, но не ограничиваясь расщеплением или лигированием. Модификация «полинуклеотидного субстрата» или «субстрата» может создать «детектируемый эффект» для контроля каталитической активности фермента.
«Репортерный субстрат» в данной заявке представляет собой субстрат, который специально приспособлен для упрощения измерения либо исчезновения субстрата, либо возникновения продукта, связанного с катализируемой реакцией. Репортерные субстраты могут свободно присутствовать в растворе или могут быть связаны (или «присоединены»), например, с поверхностью или с другой молекулой. Репортерный субстрат можно пометить с помощью любых из большого разнообразия средств, включая, например, флуорофоры (с одним или несколькими дополнительными компонентами, такими как гасители, или без них), радиоактивные метки, биотин (например, биотинилирование) или хемилюминестцентные метки.
Термин «зонд» в данной заявке относится к олигонуклеотиду, который применяют для детектирования целевой нуклеиновой кислоты. Лишь некоторые из примеров зондов включают зонды TaqMan; детектируемые зонды молекулярные маяки; и субстраты ферментов на основе нуклеиновых кислот, которые может каталитически модифицировать фермент на основе нуклеиновой кислоты.
В данной заявке термин «основание» будут понимать как имеющий такое же значение, что и термин «нуклеотид».
Любое описание документов известного уровня техники в данной заявке или сведений, указанных в данной заявке, полученных из данных документов или основанных на них, не является допущением, что указанные документы или полученные сведения являются частью общедоступных сведений в соответствующей области техники.
Для целей описания, все документы, на которые ссылаются в данной заявке, настоящим полностью включены посредством ссылки, если не указано иное.
Сокращения
Следующие сокращения используют в данной заявке и во всем тексте описания:
ГИТ: Ген и Транскрипт
НЭД: НеЭкспрессируемая ДНК
КИ: кратность изменения
ТО: теоретическое отношение
Ct: пороговый цикл/порог цикла
DMEM: модифицированная по способу Дульбекко среда Игла
ЖЖЭ: жидкость-жидкостная экстракция
MOI: множественность заражения
ПИ: после инфекции
ПО: после обработки
ОНК: общая нуклеиновая кислота
ИФ: иммунофлуоресценция
ОВЕ: образующая включение единица
МИК: минимальная ингибиторная концентрация
ТОС: контроль излеченности
ТАНК: технология амплификации нуклеиновых кислот
ИППП: инфекции, передающиеся половым путем
УПП: устойчивость к противомикробным препаратам
ЕМА: моноазид этидия
РМА: моноазид пропидия
МНКзим: многокомпонентный фермент на основе нуклеиновой кислоты, или многочастичный фермент на основе нуклеиновой кислоты;
Партзим: частичный фермент, содержащий олигонуклеотид;
ср.: средний
ПЦР: полимеразная цепная реакция;
г ДНК: геномная ДНК
дцДНК: двухцепочечная ДНК
ок: обратный комплемент
КБМ: контроль без матрицы
кПЦР: количественная ПЦР в реальном времени
R2: коэффициент корреляции
нМ: наномолярный
мМ: миллимолярный
мкл: микролитр
дНТФ: дезоксирибонуклеотидтрифосфат
БН-H2O: вода без нуклеазной активности;
Ф: флуорофор;
Г: гаситель;
N=А, С, Т, G, или любой их аналог;
N'=любой нуклеотид, комплементарный N или способный образовывать пару оснований cN;
W: А или Т;
R: A, G или АА;
rN: любое рибонуклеотидное основание;
rR: А или G;
rY: Силии;
М: А или С;
Н: А, С или Т;
D: G, А или Т;
JOE или 6-JOE: 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин;
FAM или 6-FAM: 6-карбоксифлуоресцеин.
BHQ1: гаситель Black Hole 1
BHQ2: гаситель Black Hole 2
ОТ-ПЦР: полимеразная цепная реакция с обратной транскрипцией
SDA: амплификация с замещением цепи
HDA: геликаза-зависимая амплификация
RPA: рекомбиназная полимеразная амплификация
LAMP: изотермическая амплификация с формированием петель
RCA: амплификация по типу катящегося кольца
ТМА: опосредованная транскрипцией амплификация
3SR: самоподдерживающаяся репликация последовательностей
NASBA: амплификация, основанная на последовательности нуклеиновых кислот
IB: гаситель Iowa Black® FQ
IBR: гаситель Iowa Black® RQ
мРНК: информационная РНК
тРНК: транспортная РНК
рРНК: рибосомная РНК
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В следующем подробном описании представлены типичные варианты реализации настоящего изобретения достаточно подробно, чтобы позволить средним специалистам в данной области осуществить настоящее изобретение. Особенности или ограничения различных описанных вариантов реализации не обязательно ограничивают другие варианты реализации настоящего изобретения или настоящее изобретение в целом. Следовательно, следующее подробное описание не ограничивает объем настоящего изобретения, который определяется только формулой изобретения.
В соответствии с настоящим изобретением предложены способы, позволяющие обнаружить присутствие, отсутствие и/или нарушение транскрипции в клетках, организмах, вирусах и тому подобных субъектах. Указанные способы можно применять, например, для детектирования наличия или отсутствия активной транскрипции; для детектирования нарушения или изменения уровней транскрипции в ответ на агенты или при болезненных состояниях; для детектирования отсутствия активной транскрипции в образцах, содержащих мертвые клетки и связанные с ними обломки клеток; и/или для того, чтобы различить живые и мертвые клетки. В качестве лишь одного из примеров, если субъект инфицирован бактериями, антибиотики можно вводить с целью устранения инфекции. Для таких инфекций желательно проводить контроль излеченности (ТОС) для подтверждения успешного клиренса бактерий. Ранее опубликованные способы измерения жизнеспособности бактерий включают протоколы измерения бактериальной РНК или бактериальной ДНК. Проблема с данными подходами состоит в том, что остаточная РНК и/или ДНК, связанная с мертвыми клетками или обломками клеток, может сохраняться в течение значительного времени после гибели клетки и лечения. Кроме того, способы, в которых пытаются нормировать уровни РНК, используя ДНК, например, AST, требуют точного количественного анализа экстрагированных нуклеиновых кислот.
В соответствии с настоящим изобретением предложены, среди прочего, улучшенные способы различения образцов, содержащих жизнеспособные клетки или патогены, в которых идет активная транскрипция, и образцов, содержащих мертвые клетки или обломки нуклеиновых кислот. Кроме того, в соответствии с настоящим изобретением предложены улучшенные способы нормировки результатов, относящихся к измерению экспрессируемой РНК, которые позволяют сравнение между образцами без необходимости определять концентрацию общих ОНК, присутствующих в каждом образце. Поскольку указанный способ позволяет сравнение между образцами и определение, является ли регуляция повышающей или понижающей, то результаты, полученные с применением настоящего изобретения, можно представить в формате тепловых карт.
Показатель АЖИТ.
Данная стратегия включает амплификацию определенных генов и их РНК-транскриптов, которые затем нормируют на определенную последовательность ДНК, про которую известно, что она не транскрибируется. В ходе ОТ-ПЦР праймеры, которые нацелены на определенный транскрипт, также будут амплифицировать ген, с которого он транскрибировался. Меру гена и соответствующих его транскриптов в данной заявке называют ГИТ (Ген и Транскрипт). Кроме того, в ходе ОТ-ПЦР, если присутствуют праймеры для участка ДНК, который не транскрибируется в РНК, то также можно амплифицировать только эту ДНК. Ее обозначают НЭД (НеЭкспрессируемая ДНК). Протоколы амплификации мишени для одновременной оценки ГИТ и НЭД называют тестами АЖИТ (Анализом Жизнеспособных Транскриптов), и, следовательно, когда амплификацию ведут с помощью ПЦР, указанный способ называют АЖИТ-ПЦР.
Анализ АЖИТ-ПЦР позволяет измерить уровни активной транскрипции, которые можно рассчитать различными способами. В качестве примера, полученные результаты можно применять для получения показателя АЖИТ, который равен Кратности Изменения (КИ) для образца, рассчитанной как 2ΔCt, деленные на теоретическое отношение (ТО), ожидаемое в отсутствие активной транскрипции (только остаточная ДНК). Например, различие значений Ct между ГИТ и НЭД в образце позволяет оценить КИ, наблюдаемую для ГИТ (ДНК плюс РНК), по сравнению с одной ДНК (НЭД), где КИ=2ΔCt=2(CtРЭД-Ct ГИТ). То ожидаемое в отсутствие активной транскрипции с ГИТ, равно количеству генов, амплифицированных при вычислении ГИТ, деленному на количество последовательностей, амплифицированных для вычисления НЭД. Допустим, что НЭД измеряют для одной последовательности ДНК, тогда если ГИТ измеряет амплификацию отдельного гена, то ТО = количеству наборов праймеров для ГИТ, деленному на количество наборов праймеров для НЭД=1/1=1; если ГИТ измеряет амплификацию двух генов (или участков), то ТО=2/1=2, и если ГИТ измеряет амплификацию трех генов, то ТО будет 3/1=3, и так далее. Например, показатель АЖИТ для образца с Ct (ГИТ), равным 10, и с Ct (НЭД), равным 13, будет иметь значение КИ=2ΔCt=23=8, что даст показатель АЖИТ, равный 8 (если ТО=1) или показатель АЖИТ, равный 4 (если ТО=2).
Показатель АЖИТ представляет собой меру транскрипционной активности в популяции клеток, которая достоверна независимо от того, являются ли клетки (i) жизнеспособными, (ii) мертвыми (с полным клиренсом или без остаточных, но детектируемых, низких уровней нуклеиновых кислот) или (iii) находятся на некотором уровне метаболического стресса вследствие присутствия внешних стимулов, например, присутствия соединения или лекарственного средства.
Данный подход позволяет преодолеть проблемы, с которыми столкнулись предыдущие исследователи, которые пытались использовать либо РНК, либо ДНК в качестве маркера присутствия живых клеток. В данных исследованиях показали, что, в некоторых случаях, РНК и/или ДНК может сохраняться в течение недель после гибели клетки. Показатель АЖИТ представляет собой меру уровней активной транскрипции на копию гена как способ установления присутствия живых организмов. В качестве примера, данный протокол можно применять для оценки контроля излеченности (ТОС) у пациентов, которым дают антибиотики для лечения бактериальной инфекции.
Кроме того, указанный способ позволяет измерить более слабовыраженные нарушения транскрипционной активности. Например, если клетки инкубируют в присутствии соединения, которое оказывает вредное воздействие на жизнеспособность и/или живучесть клетки, то можно провести количественный анализ влияния данного соединения с применением показателя АЖИТ. Примером применения, для которого данная мера будет полезна, является инкубация образцов, содержащих инфекционные бактерии, в присутствии антибиотиков и анализ с применением АЖИТ-ПЦР. Если бактерии чувствительны к антибиотику, то показатель АЖИТ будет снижаться. И наоборот, если бактерии устойчивы к антибиотику, то коэффициент не будет значительно изменяться.
Реакции амплификации.
Способы согласно настоящему изобретению можно применять для количественного измерения продуктов, образующихся в результате реакций амплификации нуклеиновых кислот.Можно применять любую реакцию амплификации нуклеиновых кислот, способную образовывать ампликоны с последовательностей целевой ДНК и/или целевой РНК (например, мРНК). Например, можно проводить амплификацию с помощью полимеразной цепной реакции (ПЦР), такой как ПЦР с обратной транскрипцией (ОТ-ПЦР), количественная ПЦР (кПЦР) и/или цифровая ПЦР (цПЦР). Другие лишь некоторые из примеров подходящих реакций амплификации включают амплификацию с замещением цепи (SDA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), рекомбиназную полимеразную амплификацию (RPA), геликаза-зависимую амплификацию (HDA), амплификацию на основе встраивания в цепь (SIBA), опосредованную транскрипцией амплификацию (ТМА), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), и комбинации перечисленных реакций.
Количественные измерения продуктов, образующихся в результате реакций амплификации, можно осуществить, применяя любые подходящие способы, известные в данной области. Указанные способы могут быть основаны, например, на числе копий ампликона, пороговых значениях цикла (Ct) и тому подобном, и включают, например, измерение флуоресценции.
Исследуемые субъекты.
Способы согласно настоящему изобретению можно применять в отношении любого подходящего субъекта, у которого степень транскрипции представляет интерес (например, как мера любого одного или более из уровня транскрипции, нарушения транскрипции, жизнеспособности, смерти, ответа на агенты, такие как лекарственные средства и другие соединения, и так далее).
В некоторых вариантах реализации субъект представляет собой клетку или популяцию клеток. Указанные клетки могут представлять собой одноклеточные организмы (например, бактерии, археи, простейшие, одноклеточные водоросли, одноклеточные грибы, одноклеточные амебы). В других вариантах реализации субъект представляет собой вирус.
Клетки и вирусы, анализируемые в соответствии со способами согласно настоящему изобретению, могут представлять собой компоненты биологического образца. Лишь некоторые из примеров биологических образцов включают цельную кровь или ее компонент (например, клетки крови, плазму, сыворотку), мочу, слюну, лимфу, желчь, мокроту, слезы, спинномозговую жидкость, жидкость бронхоальвеолярного лаважа, синовиальную жидкость, сперму, жидкость асцитной опухоли, молоко из молочной железы и гной.
Примеры вариантов реализации.
В некоторых вариантах реализации в соответствии с настоящим изобретением предложены способы определения совокупного нормированного значения для транскрипции (nV±), которое позволяет спрогнозировать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе (и тому подобных субъектах). Аналогичные способы можно применять для определения различий в транскрипционной активности между двумя популяциями образцов, такими как популяция клеток, организмов или вирусов, про которых известно, что они (i) устойчивы к указанному лекарственному средству и (ii) чувствительны к указанному лекарственному средству.
Исключительно в качестве лишь одного из примеров:
nV± можно рассчитать как среднюю точку между критической точкой в ограниченном снизу критерии nV+ и критической точкой в ограниченном сверху критерии nV-, оба с уровнем достоверности 95%.
nV±=((nV+-1,645 * δ+)+(nV-+1,645 * δ-))/2
где:
nV+ представляет собой среднее значение nV, полученное для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность.
nV- представляет собой среднее значение nV, полученное для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности.
δ+ представляет собой стандартное отклонение значений nV, полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность и критическая точка.
δ- представляет собой стандартное отклонение значений nV, полученных для индивидов из популяций клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности.
Примеры.
Настоящее изобретение далее будет описано на основании следующих конкретных примеров, которые не должны истолковываться как ограничивающие настоящее изобретение каким-либо образом.
Пример 1. Получение in vitro образцов хламидий в присутствии или отсутствие антибиотиков, анализ жизнеспособности с применением иммунофлуоресценции и способов экстракции ОНК из образцов.
1.1 Культура.
Образцы Chlamydia trachomatis (серовар D, лабораторный штамм UW-3/Сх) растили в клетках НЕр-2 и либо не обрабатывали (не инкубировали с антибиотиком азитромицином), чтобы получить положительный контроль «живые бактерии», либо инкубировали с различными концентрациями азитромицина, чтобы получить образцы, которые являются моделью мертвых бактерий (азитромицин является терапией первой линии хламидийных генитальных инфекций). Используемые условия описаны далее.
Линию эпителиальных клеток человека (НЕр-2) (АТСС® CCL-23™) растили в модифицированной по способу Дульбекко среде Игла (DMEM) (Sigma-Aldrich), дополненной 10% инактивированной нагреванием фетальной бычьей сывороткой (ФБС) (Sigma-Aldrich), 100 мг/мл стрептомицина (hivitrogen Corporation), 50 мг/мл гентамицина (Life Technologies) и 20 мМ глутамином (Sigma Aldrich), инкубировали при 37°С с 5% СО2. Бактериями Chlamydia trachomatis (серовар D) инокулировали монослой НЕр-2, находящийся на 6-луночном планшете с плоским дном (Thermo Fisher), при множественности заражения (MOI), равной 1. Инфицирование завершали путем инокуляции с помощью центрифугирования при 500 g в течение 30 минут при температуре 28°С, а затем инкубировали при указанных выше условиях.
1.1.1 Протокол обработки А
Через 4 часа после инфекции (ПИ) DMEM заменяли с добавлением различных доз антибиотика азитромицина (Sigma Aldrich) и снова инкубировали при 37°С с 5% СО2 до момента сбора. Используемые различные концентрации антибиотика перечислены далее: i) без антибиотика (0 мкг/мл), ii) < МИК (0,008 мкг/мл), iii) МИК (0,064 мкг/мл) и iv) > МИК (0,512 мкг/мл). «Доза МИК», выбранная для данных экспериментов, немного выше, чем наблюдаемая при лабораторных применениях данного современного штамма; тем не менее, ее специально выбрали, чтобы гарантировать воспроизводимое уничтожение бактерий. Применяемая доза также соответствует описанному в литературе анализу МИК. Через 44 часа ПИ клетки собирали, применяя сахароза-фосфат-глутаматный (SPG) буфер (250 мМ сахароза, 10 нМ фосфат натрия и 5 мМ L-глутамат). Половину объема хранили для количественного анализа жизнеспособности посредством иммунофлуоресцентного окрашивания (см. 1.2 Жизнеспособность/иммунофлуоресцентное окрашивание); другую половину оставляли для экстракции ОНК и/или РНК. Образцы хранили при -80°С до дальнейшей обработки. Каждое условие культивирования тестировали в трех повторах.
1.1.2 Протокол обработки В
Через 4 часа ПИ DMEM заменяли с добавлением циклогексамида и продолжали инкубацию. После достижения клетками экспоненциальной фазы роста, через 24 часа ПИ, проводили обработку. Это осуществляли путем замены DMEM для каждой инфекции либо i) без антибиотика, либо с добавлением ii) антибиотика при более высокой концентрации, чем МИК для азитромицина (0,128 мкг/мл). Образцы затем собирали через либо 30 минут, либо 1 час, либо 6 часов после обработки (ПО), применяя буфер SPG, и хранили при -80°С до дальнейшей обработки.
1.1.3 Протокол обработки С
После инфицирования не проводили замену среды в момент времени 4 часа, по существу создавая несинхронизованную популяцию, которая будет больше похожа на условия in vivo. После достижения экспоненциальной фазы роста, через 20 часов ПИ, проводили обработку. Это осуществляли путем замены DMEM в каждой лунке либо i) без антибиотика, либо с добавлением ii) антибиотика (0,256 мкг/мл рифампицина). Образцы затем либо инкубировали при 37°С с 5% СО2, и собирали через 5 минут ПО; либо инкубировали при комнатной температуре и собирали через 15 минут ПО. Для сбора использовали буфер SPG, и незамедлительно после этого экстрагировали ОНК. Штаммы, применяемые для данного протокола обработки, представляли собой: 1) лабораторный штамм серовара D (UW-3/Сх), чувствительный к рифампицину, и 5) созданный в лаборатории мутантный штамм серовара L2, устойчивый к рифампицину.
1.1.4 Протокол обработки D
После инфицирования не проводили замену среды в момент времени 4 ч. После достижения клетками экспоненциальной фазы роста, либо через 20, либо через 24 часа ПИ, клетки обрабатывали различными дозами азитромицина, что осуществляли путем замены DMEM в каждой лунке с добавлением нужного количества антибиотика. Дозы обработки антибиотиком, которые добавляли к инфицированным клеткам, были следующими: i) без антибиотика, ii) 0,128 мкг/мл, iii) 0,192 мкг/мл, iv) 0,256 мкг/мл и v) 0,512 мкг/мл. Образцы затем инкубировали при 37°С с 5% СО2, собирали через 1 час ПО, применяя буфер SPG, хранили при -80°С до дальнейшей обработки или экстрагировали ОНК незамедлительно после сбора.
1.1.5 Протокол обработки Е
После инфицирования не проводили замену среды в момент времени 4 ч. После достижения клетками экспоненциальной фазы роста, через 20 часов ПИ, клетки обрабатывали одной дозой различных антибиотиков. Применяли следующие антибиотики: i) азитромицин, ii) доксициклин и iii) рифампицин, каждый при дозе, равной 0,256 мкг/мл. Штаммы, применяемые для данного протокола обработки, представляли собой 1) лабораторный штамм серовара D (UW-3/Сх), 2) лабораторный штамм серовара L2 дикого типа (434/Bu), 3) созданный в лаборатории мутантный штамм серовара L2, устойчивый к триметоприму, 4) созданный в лаборатории мутантный штамм серовара L2, устойчивый к спектиномицину, и 5) созданный в лаборатории мутантный штамм серовара L2, устойчивый к рифампицину. МИК для всех сероваров и каждого антибиотика определяли заранее, используя стандартные процедуры, задокументированные в литературе, и они перечислены в таблице ниже. Согласно анализу МИК (таблица 1), все используемые штаммы были чувствительны к антибиотикам азитромицину и доксициклину. Штаммы 1, 2, 3 и 4 также были чувствительны к рифампицину, тогда как штамм 5 был устойчив к данному антибиотику. Образцы затем инкубировали при 37°С с 5% СО2 и собирали через 1 час ПО, применяя буфер SPG, и незамедлительно экстрагировали. Каждое условие осуществляли в двух биологических повторах.

1.1.6 Протокол обработки F
Через 4 часа ПИ DMEM заменяли с добавлением циклогексамида (1 мкг/мл), чтобы синхронизировать инфекцию и остановить продукцию белков клеткой-хозяином. В данный момент времени также осуществляли добавление антибиотика, при этом половину лунок оставляли необработанными, а другую половину обрабатывали высокой дозой антибиотика азитромицина. Клетки снова инкубировали при 37°С с 5% СО2 до момента сбора. Различные используемые условия описаны далее: i) без антибиотика обозначили «Живые СТ» или ii) плюс антибиотик (0,512 мкг/мл) обозначили «Мертвые СТ». Через 44 часа ПИ клетки собирали, применяя буфер SPG, и смешивали в различных соотношениях, чтобы получить образцы с различными процентами жизнеспособных и нежизнеспособных клеток, как указано в таблице ниже. Половину объема хранили для количественного анализа жизнеспособности посредством иммунофлуоресцентного окрашивания (см. 1.2 Жизнеспособность/иммунофлуоресцентное окрашивание; данные не представлены); другую половину оставляли для экстракции ОНК. Затем их хранили при -80°С до дальнейшей обработки.

1.2 Жизнеспособность/иммунофлуоресцентное окрашивание.
Готовили серийные разведения образцов, собранных для подсчета жизнеспособных бактерий, и культивировали их на свежем монослое НЕр-2, находящемся на 96-луночном планшете с плоским дном (Nunc™, Thermo Fisher). Инфицирование завершали путем инокуляции с помощью центрифугирования при 500 g в течение 30 минут при температуре 28°С, а затем инкубировали при 37°С с 5% СО2. Каждый образец культивировали в трех повторах. Через 38 часов ПИ культуры фиксировали с помощью метанола и окрашивали для микроскопии.
Прямое иммунофлуоресцентное (ИФ) окрашивание проводили, применяя антитела против CtHtrA, МОМР (Biodesign) и вторичные антитела, конъюгированные с красителями Alexa fluor (mvitrogen). Также добавляли DAPI (4', 6-диамидино-2-фенилиндол, дилактат) (Invitrogen) для окрашивания клетки-хозяина. Образцы изучали при 100х увеличении с помощью флуоресцентного микроскопа IN Cell Analyser 2200 (GE Healthcare Life Sciences). Клетки HEp-2 были представлены синим цветом, тогда как включения хламидий были представлены зеленым цветом. Образующие включение единицы (ОВЕ, мл-1) определяли путем подсчета включений на 10 типичных полях зрения для каждой лунки и каждого серийного разведения. Проводили экстраполяцию размера поля зрения на размер лунок для вычисления общего количества включений в данной лунке. Также учитывали разведения и добавленные объемы.
Иммунофлуоресцентная визуализация клеток, обработанных, как описано в протоколе обработки А (1.1.1), представлена на панели i фигуры 3, и результаты, полученные путем подсчета ОВЕ/мл по данным изображениям, представлены на панели ii фигуры 3; при этом результаты нормировали на значение, полученное для клеток, обработанных концентрацией выше МИК (>МИК). Каждая из клеток, которые не обрабатывали и обрабатывали различными дозами антибиотика, содержала различные количества инфицирующих единиц хламидий.
1.3 Экстракция общих нуклеиновых кислот.
1.3.1 Протокол экстракции А.
Образцы, собранные для экстракции ОНК, размораживали на льду и обломки клеток осаждали при 800 g в течение 10 минут при 4°С, а затем центрифугировали супернатант при 14000 об/мин в течение 20 минут при 4°С. Осадок ресуспендировали в смеси для гидролиза с протеиназой К (10 мг/мл протеиназы К (Ambion), 1 мМ Трис рН7,5, 0,5 М ЭДТА, 5 М NaCl, 10% ДСН и вода без нуклеазной активности (Ambion)) и инкубировали при 56°С в течение 60 минут.После гидролиза в смесь добавляли фенол:хлороформ:изоамил (25:24:1, рН 6,5-6,9, Sigma Aldrich), интенсивно встряхивали на вортексе и центрифугировали в течение 5 минут при максимальной скорости. Верхнюю фазу сохраняли и добавляли ацетат натрия (3 М, рН 5,2, Sigma Aldrich) и 100% этанол (Sigma Aldrich). Ее снова встряхивали на вортексе и инкубировали в течение 20 минут (10 минут при комнатной температуре и 10 минут при -20°С). ОНК затем осаждали при высокой скорости (14000 об/мин) в течение 10 минут с последующими двумя этапами промывки с применением 70% этанола. Осадок затем сушили на воздухе в течение 15 минут перед элюированием 50 мкл воды. Проводили количественный анализ элюата и хранили его при -80°С.
1.3.2 Протокол экстракции В.
Собранные образцы размораживали на льду, а затем осаждали клетки при 14000 об/мин в течение 20 мин при 4°С. После данного этапа следовали инструкциям производителя для одновременной экстракции ДНК и РНК, применяя набор PuriSpin FireMonkey (RevoluGen).
1.3.3 Протокол экстракции С.
Собранные образцы размораживали на льду, а затем осаждали клетки при 14000 об/мин в течение 20 мин при 4°С. После данного этапа следовали инструкциям производителя из набора для очистки общей РНК из клеток животных с дополнительным расщеплением ДНКазой на колонке. Экстракцию проводили, применяя набор RNeasy Mini (Qiagen).
Пример 2. Анализ гена и его транскриптов в необработанных и обработанных клетках в двухлуночном анализе.
В следующем примере оценивали уровни ДНК и ГИТ в образцах ОНК, экстрагированных из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК экстрагировали из клеток, которые не инкубировали с антибиотиком (необработанные, жизнеспособные клетки), и из клеток, которые инкубировали с антибиотиком при концентрации в восемь раз ниже МИК (<МИК), равной МИК (МИК) или в 8 раз выше МИК (>МИК), как описано в примере 1 (1.1.1 Протокол обработки А). ДНК и РНК хламидий амплифицировали, применяя праймеры, нацеленные на ген ompl и его транскрипты. Уровни ГИТ оценивали с помощью ОТ-ПЦР, в которой амплифицировали как ген ompl, так и его транскрипты (ДНК плюс РНК). Уровни гена ompl отдельно (ДНК отдельно) измеряли в отдельной реакции ПЦР, в которой отсутствовала обратная транскриптаза.
2.1 Олигонуклеотиды партзимов.
Партзимы были разработаны таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации гена ompl или транскриптов ompl. После сборки МНКзим может расщеплять репортерный субстрат Sub2-FB. Последовательности партзима А и партзима В представлены ниже от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.
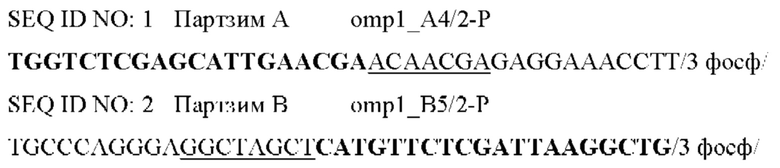
2.2 Репортерный субстрат.
В данном примере субстрат метили по концам молекулой 6-FAM на 5'-конце (обозначена «F» в названии субстрата ниже) и молекулой гасителя IABkFQ на 3'-конце (обозначена «IB» в названии субстрата ниже). Расщепление субстрата отслеживали на 516 нм (длина волны испускания FAM) с возбуждением на 492 нм (длина волны возбуждения FAM). Репортерный субстрат для данного примера показан ниже с последовательностью от 5' к 3'. Основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.
2.3 Праймеры ПЦР для амплификации гена ompl и транскриптов.
Амплификацию in vitro матрицы ОНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Указанные прямой и обратный праймеры использовали для амплификации ДНК внутри гена ompl с помощью ПЦР и обеих ДНК и РНК внутри гена ompl и транскриптов с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.

2.4 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2 согласно примеру 1 (1.1 Культура и 1.1.1 Протокол обработки А). Экстракцию проводили согласно методике жидкость-жидкостной экстракции (ЖЖЭ) с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот (ОНК), 1.3.1 Протокол экстракции А).
2.5 Смеси для ПЦР и ОТ-ПЦР.
Обе смеси для ПЦР и ОТ-ПЦР содержали 40 нМ 5'-праймера, 200 нМ З'-праймера, 200 нМ партзима А, 200 нМ партзима В, 200 нМ Sub2-FB, lx SensiFAST Probe No-ROX Mix (Bioline), 8 мМ MgCl2 (Bioline), и воду без нуклеазной активности (Ambion) в общем объеме 20 мкл. Дополнительно смеси для ОТ-ПЦР содержали 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline) и 0,2 мкл обратной транскриптазы (Bioline). Реакции вели в трех повторах на термоциклере CFX96 BioRad®, применяя одинаковые параметры циклов: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (минус 0,5°С на цикл), и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Смеси ОТ-ПЦР и ПЦР либо содержали 5 мкл матрицы ОНК (разведение 1/100), либо не содержали матрицу (dH2O).
2.6 Результаты.
ДНК и РНК (ГИТ) хламидий, или ДНК отдельно, амплифицировали с помощью ОТ-ПЦР и ПЦР, соответственно, используя ОНК, экстрагированные из жизнеспособных необработанных клеток и из клеток, инкубированных с антибиотиком при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК). В таблице 2 показаны значения порогового цикла (Ct), измеренные для каждого типа реакции и образца. ΔCt рассчитывали как различия между значениями Ct для ПЦР (ДНК отдельно) и ОТ-ПЦР (ГИТ), полученные по графикам амплификации. В свою очередь, кратность изменения (отношение числа копий РНК плюс ДНК (ГИТ) к ДНК отдельно), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и нанесли на график на панели iii фигуры 3. Полученные результаты затем сравнивали с жизнеспособностью каждой популяции клеток (панель ii фигуры 3).


Теоретически, если клетки более не инфицированы хламидиями, то транскрипты или их фрагменты не будут детектироваться или будут детектироваться только на очень низких остаточных уровнях. Аналогично, будут детектироваться только низкие остаточные уровни геномной ДНК, или ее фрагментов, тем не менее, можно ожидать, что количество обнаруженной ДНК будет больше, чем количество РНК, поскольку ДНК по своей природе более стабильна, чем РНК.
Анализ результатов показал, что когда амплифицировали образцы ОНК, экстрагированные из необработанных образцов или из образцов, обработанных при концентрации ниже МИК, то наблюдаемое значение Ct для ОТ-ПЦР было ниже, чем наблюдаемое для ПЦР (таблица 2), что соответствует активной транскрипции в данных образцах. Для реакций, в которых используют ОНК из культуры, которую обрабатывали при уровне, равном или выше МИК, значения ΔCt были ниже (таблица 2), что соответствует низкому уровню или отсутствию транскрипции.
В предыдущих исследованиях показали, что детектирование либо ДНК, либо РНК самих по себе не является надежным критерием клиренса Chlamydia trachomatis. Результаты из данного примера демонстрируют, что отношения кратности изменений между ДНК (измеренной с помощью ПЦР) и ГИТ (ДНК плюс РНК, измеренными с помощью ОТ-ПЦР) имеют сходную тенденцию с мерой жизнеспособности (ПИ) необработанных и обработанных клеток, о чем свидетельствует сравнение диаграмм на панелях ii и iii фигуры 3. Хотя в данном примере продемонстрирована польза исследования соотношений РНК и ДНК, данный эксперимент не служит примером настоящего изобретения, так как мишень ДНК отдельно по-прежнему экспрессируется в обеих реакциях. По этой причине для определения ДНК/РНК вместо ДНК отдельно необходимо провести две параллельные реакции с обратной транскриптазой и без нее. Это делает прямое сравнение результатов более затруднительным. По этой причине в более предпочтительном подходе будут применять способ согласно настоящему изобретению, в котором можно совместно амплифицировать различные субпопуляции нуклеиновых кислот (ДНК отдельно по сравнению с ДНК плюс РНК) в одной реакции АЖИТ ОТ-ПЦР.
Пример 3. Скрининг мишеней ГИТ и НЭД.
В следующем примере продемонстрированы способы скрининга подходящих мишеней для анализа ГИТ и НЭД. Нуклеиновые кислоты экстрагировали из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК и РНК экстрагировали из жизнеспособных клеток, собранных через 24 ч ПИ. Нуклеиновые кислоты затем амплифицировали, применяя пары праймеров, нацеленные на выбранный ген и его транскрипты (ГИТ), или только на нетранскрибированный ген (НЭД). Пригодность каждой мишени определяли путем сравнения (i) детектирования РНК с помощью ОТ-ПЦР в общей РНК, при этом будут детектироваться как ген, так и его транскрипты, и (ii) детектирования ДНК с помощью ПЦР, при этом будет детектироваться только ДНК гена. В данном эксперименте будет спрогнозировано, что Ct для ГИТ будут различными между обеими реакциями, тогда как Ct для НЭД не должны быть различными.
3.1 Олигонуклеотиды партзимов.
Партзимы были разработаны таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации либо гена ompl, либо транскриптов ompl. После сборки МНКзим может расщеплять репортерный субстрат Sub102(20)-FB. Вторая пара партзимов были разработаны таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка ДНК, обозначенного infA IGR, тем самым позволяя получить меру НЭД. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub72-A1B. Последовательности партзима А и партзима В для каждого МНКзима перечислены ниже, от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.
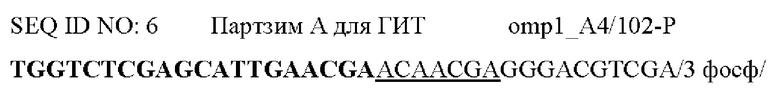

3.2 Репортерный субстрат.
В данном примере использовали два различных репортерных субстрата, каждый из которых был помечен различными флуорофорами. Sub102(20)-FB был помечен по 5'-концу 6-FAM и по 3'-концу IABkFQ, и его расщепление отслеживали на 516 нм с возбуждением при 492 нм. Sub72-A1B был помечен АТТО™ Rho101 по 5'-концу и IAbRQSp по 3'-концу, и его расщепление отслеживали на 609 нм с возбуждением при 592 нм. Репортерные субстраты для данного примера показаны ниже с последовательностью от 5' к 3'. Основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.

3.3 Праймеры ПЦР для амплификации ГИТ и НЭД.
Амплификацию in vitro матрицы ОНК и РНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Прямой и обратный праймеры применяли для амплификации участка гена и транскриптов ompl (ГИТ) и ДНК infAIGR (НЭД) с помощью ПЦР и ОТ-ПЦР. Все последовательности записаны от 5' к 3'.


3.4 Получение ОНК и РНК.
Нуклеиновые кислоты экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1(1.1 Культура). Через 4 часа ПИ DMEM сменяли на циклогексамид, чтобы синхронизировать инфекцию и остановить синтез белка хозяином. Клетки снова инкубировали при 37°С с 5% СО2 до момента сбора через 24 ч после инфицирования, в экспоненциальной фазе роста бактерий.
Экстракцию ОНК проводили с помощью методики ЖЖЭ, с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А), со следующей модификацией: этап осаждения обломков клеток не проводили в процессе экстракции образцов в данном примере.
Экстракцию РНК проводили, применяя набор RNeasy Mini(Qiagen), как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.3 Протокол экстракции С), и следуя инструкциям производителя для очистки общей РНК из клеток животного с дополнительным расщеплением ДНКазой на колонке.
3.5 Смеси для ПЦР и ОТ-ПЦР.
Обе смеси для ПЦР и ОТ-ПЦР содержали 40 нМ 5'-праймера, 200 нМ 3'-праймера, 200 нМ партзима А, 200 нМ партзима В, 200 нМ Sub2-FB для ГИТ и 200 нМ Sub72-A1B для НЭД, 1х смесь Probe No-ROX SensiFAST (Bioline), 8 мМ MgCl2 (Bioline) и воду без нуклеазной активности (Ambion) в общем объеме 20 мкл. Дополнительно смеси для ОТ-ПЦР содержали 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline) и 0,2 мкл обратной транскриптазы (Bioline). Реакции вели на термоциклере CFX96 BioRad®, используя одинаковые параметры циклов: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (минус 0,5°С на цикл), и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Смеси ОТ-ПЦР и ПЦР содержали либо 5 мкл матрицы ОНК или РНК (разведение 1/100), либо не содержали матрицу (dH2O).
3.6 Результаты.
ДНК и РНК хламидий, или ДНК отдельно, амплифицировали с помощью ОТ-ПЦР и ПЦР, соответственно, в образцах РНК и ОНК, собранных из жизнеспособных необработанных клеток через 24 часа ПИ. В таблице 3А указаны типы ампликонов и их происхождение из проведенных реакций. В таблице 3В показаны значения порогового цикла (Ct), измеренные для каждого типа реакции и образца. ΔCt рассчитывали как различия между значениями Ct для ПЦР (ДНК отдельно) и ОТ-ПЦР (ДНК и РНК), полученными по графикам амплификации (фигура 4).



Полученные результаты с применением кандидатных праймеров для ГИТ и ОНК (таблица 3В) позволяют предположить, что праймеры для omp1 способны амплифицировать как ДНК omp1, так и РНК omp1 (панель i и ii фигуры 4) и, следовательно, удовлетворяют критериям пригодности в качестве праймеров для ГИТ. Кроме того, поскольку Ct для ОТ-ПЦР на 4,92 цикла раньше, чем Ct для ПЦР, это позволяет предположить, что в образце ОНК присутствует множество копий РНК на копию ДНК гена omp1. Это также подтверждается полученными результатами при применении праймеров для omp1 с РНК (панель i фигуры 4), где наблюдали большое различие в Ct, равное 11,51, между результатами ОТ-ПЦР и ПЦР, что отражает сильную амплификацию РНК omp1 в очищеных образцах РНК, и лишь очень поздний Ct, обнаруженный для ПЦР, который наиболее вероятно отражает присутствие малых количеств контаминирующей ДНК в препарате РНК.
Полученные результаты с применением кандидатных праймеров для НЭД и ОНК (таблица 3В) позволяют предположить, что праймеры для InfAIGR способны амплифицировать межгенную последовательность ДНК infA (панель iv фигуры 4). Кроме того, поскольку Ct для ОТ-ПЦР и ПЦР очень сходны (ΔCt -0,05), это демонстрирует, что данные праймеры для НЭД не амплифицируют дополнительную последовательность РНК в ОНК, что согласуется с отсутствием транскрипции РНК, связанной с данной последовательностью. По этой причине, данные праймеры удовлетворяют критериям пригодности в качестве праймеров для НЭД. Это также подтверждается полученными результатами при применении праймеров для InfAIGR с РНК (панель iii фигуры 4), где получали только поздние значения Ct, которые были сходны для ПЦР и ОТ-ПЦР, и, как и ранее, вероятно, представляют лищь ампликоны, полученные из контаминирующей ДНК в препарате РНК.
В данном примере предложен способ, который подходит для скрининга кандидатных последовательностей для применения в качестве праймеров для ГИТ или для применения в качестве праймеров для НЭД. Кроме того, в данном примере приведены доказательства присутствия контаминирующей ДНК в препарате очищенной РНК, несмотря на проведение дополнительной процедуры расщепления ДНКазой в процессе экстракции. Данное наблюдение подчеркивает потребность в улучшенных способах, таких как АЖИТ-ПЦР, так как наиболее вероятно, что именно контаминирующая ДНК является источником по меньшей мере части ложно положительных результатов, наблюдаемых, когда амплификацию РНК используют в качестве меры жизнеспособности клеток в образцах, включая клинические образцы. В предыдущих исследованиях показали, что детектирование либо РНК, либо ДНК самих по себе не является надежной мерой клиренса Chlamydia trachomatis.
Пример 4. Анализ ГИТ и НЭД в необработанных и обработанных клетках с помощью АЖИТ-ПЦР.
В следующем примере оценивали уровни НЭД и ГИТ в образцах ОНК, экстрагированных из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК экстрагировали из клеток, которые не инкубировали с антибиотиком (необработанные, жизнеспособные клетки), и из клеток, которые инкубировали с антибиотиком при концентрации в восемь раз ниже МИК (<МИК), равной МИК (МИК) или в 8 раз выше МИК (>МИК), как описано в примере 1, протокол обработки А (1.1.1). ДНК и РНК (ГИТ) хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на ген omp1 и его транскрипты. ДНК хламидий отдельно (НЭД) совместно амплифицировали в одной и той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, обозначенный infAIGR, который не транскрибируется. Определяли значения Ct для ГИТ и НЭД.
4.1 Олигонуклеотиды партзимов.
Партзимы были разработаны таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации как гена omp1, так и транскриптов omp1. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub2-FB. Вторая пара партзимов были разработаны таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка, обозначенного infA_IGR. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub72-A1B. Последовательности партзима А и партзима В представлены ниже от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.



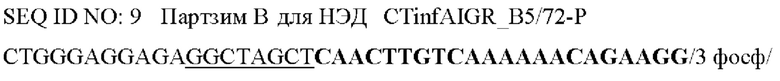
4.2 Репортерные субстраты.
В данном примере использовали два различных репортерных субстрата, каждый из которых был помечен различными флуорофорами. Sub2-FB был помечен по 5'-концу 6-FAM и по 3'-концу IABkFQ, и его расщепление отслеживали на 516 нм с возбуждением при 492 нм. Sub72-A1B был помечен АТТО™ Rho101 по 5'-концу и IAbRQSp по 3'-концу, и его расщепление А1В отслеживали на 609 нм с возбуждением при 592 нм. Репортерный субстрат для данного примера показан ниже с последовательностью от 5' к 3'. Основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.

4.3 Прайм еры ПЦР для амплификации гена и транскриптов omp1.
Амплификацию in vitro матрицы ОНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Указанные прямой и обратный праймеры использовали для амплификации РНК и ДНК (ГИТ) omp1 и ДНК inf_AGR (НЭД) с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.

4.4 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2 согласно примеру 1 (1.1 Культура, 1.1.1 Протокол обработки А). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А).
4.5 Компоненты реакции.
Все реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 200 нМ каждого субстрата, 1х смесь Probe No-ROX SensiFAST (Bioline), 2 мМ MgCl3 (Bioline), 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline), 0,2 мкл фермента обратной транскриптазы (Bioline) и воду без нуклеазной активности (Ambion) в общем объеме 20 мкл. Все реакции вели в трех повторах на термоциклере CFX96 BioRad®. Параметры циклов были следующими: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (со снижением температуры на 0,5°С на цикл) и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/100), либо не содержали мишень (dH2O).
4.6 Результаты.
ДНК и РНК (ГИТ) хламидий, или только ДНК (НЭД), совместно амплифицировали в одной реакции ОТ-ПЦР с ОНК, экстрагированными из жизнеспособных необработанных клеток и из клеток, инкубированных с антибиотиком при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК) (панель i фигуры 5). В таблице 4 показаны значения порогового цикла (Ct), измеренные для ГИТ или НЭД в каждом образце. ΔCt рассчитывали как разницу между значениями Ct сигналов НЭД и ГИТ. В свою очередь, кратность изменения (отношение ГИТ к НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt (таблица 4), и показатели АЖИТ представили на графике на панели i фигуры 5. Полученные результаты затем сравнивали с жизнеспособностью каждой популяции клеток (панели i и ii фигуры 3).


Теоретически, если клетки более не инфицированы хламидиями, то будут детектироваться только очень низкие остаточные уровни транскриптов или их фрагментов. Аналогично, будут детектироваться только низкие остаточные уровни геномной ДНК или ее фрагментов. Можно ожидать, что обнаруженное количество ДНК будет больше, чем количество РНК, поскольку ДНК по своей природе более стабильна, чем РНК. Анализ результатов показал, что когда амплифицировали образцы ОНК, экстрагированные из образцов, которые не были обработаны или были обработаны коцентрацией ниже МИК, значение Ct для ГИТ было ниже, чем для НЭД (таблица 4), что согласуется с активной транскрипцией. Для ГИТ и НЭД с ОНК, обработанных коцентрацией на уровне МИК или выше, различия в значении Ct были малы (таблица 4), что свидетельствует о низком уровне транскрипции или ее отсутствии. Кратность изменения и показатели АЖИТ рассчитывали для указанных четырех типов образцов. Поскольку только один ген и его транскрипты использовали для вычисления ГИТ и только один нетранскрибируемый участок использовали для вычисления НЭД, то кратность изменения и показатели АЖИТ равны (таблица 4).
В предыдущих исследованиях показали, что детектирование либо ДНК, либо РНК самих по себе не является надежной мерой клиренса Chlamydia trachomatis. Результаты из данного примера демонстрируют, что показатели АЖИТ коррелируют с мерой жизнеспособности (ПИ) для необработанных и обработанных клеток, о чем свидетельствует сравнение графиков на панели i фигуры 5 и панелях i и ii фигуры 3. В данном примере продемонстрировали, что ГИТ и НЭД можно измерять в одной реакции, и полученные результаты можно использовать для вычисления показателей АЖИТ, которые коррелируют с наблюдаемой жизнеспособностью клеток и ответом на присутствие антибиотиков. В данном примере предложен быстрый способ, пригодный для обнаружения жизнеспособности, в данном случае, жизнеспособности хламидий. Дополнительно он может предложить основу для контроля излеченности (ТОС) в образцах из пациентов путем определения того, был или не был достигнут клиренс инфекции.
Пример 5. Использование двух участков внутри гена и соответствующих транскриптов для измерения ГИТ с помощью АЖИТ-ПЦР, применяя ОНК из необработанных и обработанных клеток.
В следующем примере оценивали уровни НЭД и ГИТ в образцах ОНК, экстрагированных из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК экстрагировали из клеток, которые не инкубировали с антибиотиком (необработанные, жизнеспособные клетки), и из клеток, которые инкубировали с антибиотиком при концентрации в восемь раз ниже МИК (<МИК), равной МИК (МИК) или в 8 раз выше МИК (>МИК), как описано в примере 1, протокол обработки А (1.2.1). ДНК и РНК (ГИТ) хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах (ГИТ1/2). ДНК хламидий отдельно (НЭД) совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, обозначенный infAIGR (межгенный участок infA), который не транскрибируется. Получали значения Ct для ГИТ 1/2 и НЭД.
5.1 Олигонуклеотиды партзимов.
Партзимы были разработаны таким образом, чтобы они собирались в два активных МНКзима, когда они связаны с ампликонами, полученными путем амплификации либо гена omp1, либо транскриптов omp1. Данные два МНКзима были способны связываться с двумя различными ампликонами, полученными путем амплификации двух отдельных участков omp1 (участок ГИТ1 и ГИТ2). После сборки оба МНКзима могут расщеплять один и тот же репортерный субстрат Sub2-FB. Третья пара партзимов была разработана таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка ДНК, обозначенного infA_IGR, тем самым позволяя получить меру НЭД. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub72-A1B. Последовательности партзима А и партзима В для каждого МНКзима перечислены ниже, от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.
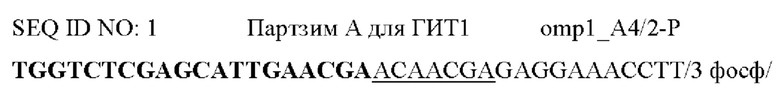
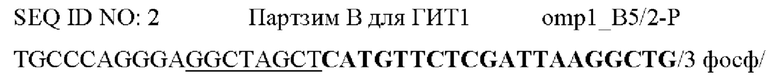

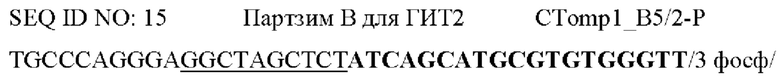


5.2 Репортерные субстраты.
В данном примере использовали два различных репортерных субстрата, каждый из которых был помечен различными флуорофорами, согласно примеру 4 (4.2 Репортерные субстраты).
5.3 Праймеры ПЦР для амплификации ГИТ1, ГИТ2 и НЭД.
Амплификацию in vitro матрицы ОНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Прямой и обратный праймеры применяли для амплификации двух участков гена omp1 и транскриптов (ГИТ1 и ГИТ2) и ДНК infA_IGR (НЭД) с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.






5.4 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), который был получен с помощью способов in vitro, культивированного в клетках в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.1 Протокол обработки А). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А).
5.5 Компоненты реакции.
Все реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 400 нМ каждого субстрата SEQ ID NO 3 и 200 нМ субстрата SEQ ID NO 11, 1х смесь Probe No-ROX SensiFAST (Bioline), 2 мМ MgCl3 (Bioline), 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline), 0,2 мкл фермента обратной транскриптазы (Bioline) и воду без нуклеазной активности (Ambion) в общем объеме 20 мкл. Все реакции вели в трех повторах на термоциклере CFX96 BioRad®. Параметры циклов были следующими: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (со снижением температуры на 0,5°С на цикл), и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/100), либо не содержали мишень (dH2O).
5.6 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена и транскриптов omp1 (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали в одной реакции ОТ-ПЦР с ОНК, экстрагированными из жизнеспособных необработанных клеток и из клеток, инкубированных с антибиотиком при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК) (панель ii фигуры 5). В таблице 5 показаны значения порогового цикла (Ct), измеренные для НЭД и для объединенных сигналов от ГИТ1 и ГИТ2 (ГИТ 1/2) в каждом образце. ΔCt рассчитывали как разницу между значениями Ct для НЭД и ГИТ 1/2. В свою очередь, кратность изменения (отношение ГИТ к НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 5. Показатели АЖИТ рассчитывали путем деления КИ на ТО, в данном случае 2. Полученные результаты затем сравнивали с жизнеспособностью каждой популяции клеток.

Анализ результатов показал, что когда амплифицировали образцы ОНК, экстрагированные из необработанных или обработанных образцов при концентрации ниже МИК, значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 5), что согласуется с активной транскрипцией. Для ГИТ1/2 и НЭД с ОНК, обработанных концентрацией на уровне МИК или выше, различия в значении Ct были малы (таблица 5), что свидетельствует о низком уровне транскрипции или ее отсутствии. Кратность изменения и показатели АЖИТ рассчитывали для указанных четырех типов образцов. Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения делили на ТО, чтобы вычислить показатели АЖИТ (таблица 5).
Возможность включить множество наборов праймеров, способных амплифицировать как ДНК, так и связанные с ней транскрипты РНК, в действительности весьма желательна, так как определенные гены могут экспрессироваться только во время некоторых стадий цикла развития, например, бактерий. Анализ, включающий множество экспрессируемых генов, предпочтительно на высоких уровнях при различных условиях, может гарантировать, что экспрессия будет устойчиво детектироваться в безнадежном состоянии.
Пример 6. Применение АЖИТ-ПЦР для клинических образцов.
В следующем примере оценивали уровни ГИТ по сравнению с НЭД в клиническом образце. Образец мочи получали из проявляющего симптомы пациента с очередной безрезультативной терапией первой линии антибиотиком азитромицином. Экстрагировали ОНК из образца и исследовали параллельно эталонному материалу, экстрагированному из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D), в подтвержденном живом/жизнеспособном (положительный эталон) или мертвом (отрицательный эталон) состоянии. ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах, для измерения ГИТ. Другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется, для измерения НЭД. Уровни ГИТ и НЭД определяли и использовали для вычисления показателей АЖИТ.
6.1 Анализ ГИТ1, ГИТ2 и НЭД с помощью АЖИТ-ПЦР.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими же, как в примере 5 (5.1, 5.2 и 5.3, соответственно).
6.2 Получение ОНК.
Клинический образец:
РНК и ДНК (ОНК) совместно экстрагировали из клинического образца мочи, который был получен из пациента с очередной безрезультативной терапией первой линии антибиотиком. Всего 8 мл мочи осаждали, а затем экстрагировали из нее нуклеиновые кислоты с применением набора для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В), следуя инструкции производителя для одновременной экстракции обеих ДНК и РНК.
Эталонный материал:
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), который был получен с помощью способов in vitro, культивирован в клетках НЕр-2, обработан высокой дозой антибиотика азитромицина (0,512 мкл/мл), и для которого подтвердили, что он «мертвый», или не обработан антибиотиком, и для которого подтвердили, что он «живой», как описано в примере 1. Статус жизнеспособности данных эталонных образцов подтверждали посредством иммунофлуоресцентного окрашивания. Экстракцию проводили согласно методике жидкость-жидкостной экстракции (ЖЖЭ) с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А)
6.3 Компоненты реакции.
Используемые условия ОТ-ПЦР были такие, как описано в примере 5 (5.5), со следующими модификациями: 0,1 мкл фермента обратной транскриптазы (Bioline) добавляли в общий объем 10 мкл реакционной смеси, которая содержала либо 2,5 мкл ОНК, экстрагированных из клинического образца (чистых), либо 2,5 мкл каждого эталонного образца ОНК (разведение 1/100), либо не содержала мишень (dH2O).
6.4 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена и транскриптов omp1 (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из клинического образца мочи (панель i фигуры 6). Амплификацию клинического образца сравнивали с эталонными образцами, полученными из культур хламидий, либо «живыми СТ» (образцы не обрабатывали), либо «мертвыми СТ» (обрабатывали высокими дозами азитромицина) (панель ii фигуры 6). ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 6.
Будет спрогнозировано, что клинический образец, полученный из проявляющего симптомы пациента, будет содержать жизнеспособные бактерии. В свою очередь это ожидаемо приведет к сходному показателю АЖИТ для клинического образца и эталонного живого СТ (положительный контроль), поскольку оба будут содержать высокие уровни присутствующего транскрипта.
Анализ результатов показал, что когда клинический образец, экстрагированный из мочи, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 6). Оно соответствовало активной транскрипции и было сходно с таковым, наблюдаемым для контрольного образца, живые СТ (положительный контроль) (таблица 6). Для всех трех эталонных образцов мертвого СТ (отрицательные контроли 1-3) значения Ct для ГИТ1/2 и НЭД были более сходными (таблица 6). ΔCt, кратность изменения и показатель АЖИТ рассчитывали для всех образцов (таблица 6). Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения вдвое превышала показатели АЖИТ (таблица 6). Сравнение показателей АЖИТ клинического образца и живого СТ показало отсутствие различий, что коррелировало с детектированием жизнеспособной популяции (панель ii фигуры 6). И наоборот, сравнение показателей АЖИТ клинического образца и образцов мертвого СТ показало различие в показателях АЖИТ. Они были выше для клинического образца, чем для образцов мертвого СТ (панель ii фигуры 6), что согласуется с пониженной транскрипционной активностью или ее отсутствием в образцах мертвого СТ, которые обработали высокой дозой азитромицина и подтвердили, что он нежизнеспособен.
Результаты из данного примера продемонстрировали, что ГИТ1/2 и НЭД можно измерить в одной реакции и полученные результаты использовать для вычисления показателей АЖИТ. Сравнение между показателями АЖИТ для клинического образца и таковыми для эталонного материала продемонстрировали точный сигнал жизнеспособности клеток в клиническом образце. Это свидетельствует о точной работе указанной технологии на клинических образцах и ее применимости в клинических условиях. Способность различать мертвые и живые клетки можно применять для определения того, смог пациент или нет успешно избавиться от инфекции после лечения антибиотиками. Данные тесты могут позволить установить первичный диагноз или «контроль излеченности».


Пример 7. Тестирование чувствительности к антибиотикам с применением АЖИТ-ПЦР.
В следующем примере оценивали изменение уровней ГИТ в образцах ОНК, экстрагированных из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК экстрагировали из клеток, которые находились в экспоненциальной фазе роста, через 24 часа после инфекции, и их либо обрабатывали антибиотиком при концентрации, равной МИК, либо не обрабатывали (контроль), как описано в примере 1, Обработка В (1.1.2). ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах, для измерения ГИТ. Другой участок ДНК хламидий совместно амплифицировали в одной и той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется, для измерения НЭД. Уровни ГИТ и НЭД оценивали и использовали для вычисления показателя АЖИТ.
7.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 5 (5.1, 5.2 и 5.3, соответственно). Используемые условия реакции ОТ-ПЦР были такими, как описано в примере 5 (5.5). Данные реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
7.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.2 Протокол обработки В). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А), со следующей модификацией: не проводили этап осаждения обломков клеток в процессе экстракции образцов в данном примере.
7.3 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена и транскриптов omp1 (ГИТ1 и ГИТ2) и одного участка НЭД, совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из культур хламидий. данные культуры обрабатывали антибиотиком или оставляли необработанными (контроль) в экспоненциальной фазе роста и собирали через 1 и 6 часов после обработки (панель i фигуры 7). В таблице 4 показаны значения порогового цикла (Ct), измеренные для ГИТ1/2 и НЭД в каждом образце. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 7. Затем проводили сравнение полученных результатов между реакциями без обработки (контролем) и реакциями после обработки антибиотиком в каждый момент времени (панель ii фигуры 7).
Будет спрогнозировано, что у клеток, чувствительных к обработке антибиотиком, будут сниженные уровни транскрипции, так как будут ожидать, что присутствие антибиотика нарушает нормальное функционирование клеток. В свою очередь это приведет к снижению показателя АЖИТ данных клеток по сравнению с контрольными (необработанными) клетками.
Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных и обработанных групп, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 7). Это согласуется с активной транскрипцией во всех четырех образцах. Кратность изменения и показатели АЖИТ рассчитывали для указанных образцов и различных моментов времени после обработки (таблица 7). Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения в два раза превышала показатели АЖИТ (таблица 7). Сравнение показателей АЖИТ для необработанных и обработанных образцов в оба момента времени продемонстрировало различие в показателях АЖИТ для обработанных образцов, которые были ниже, чем таковые для необработанных образцов (панель ii фигуры 7), что согласуется со снижением транскрипционной активности в присутствии антибиотика. Отношение ΔАЖИТ рассчитывали путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ в присутствии антибиотика.
Результаты из данного примера демонстрируют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Сравнение между показателями АЖИТ для обработанных и необработанных клеток, рассчитанное как отношение ΔАЖИТ, продемонстрировало ответ на присутствие антибиотика. Оно свидетельствует о чувствительности клеток к антибиотику. Кроме того, оно показывает, что такую чувствительность можно выявить в различные моменты времени, включая через 1 ч или 6 ч после обработки.
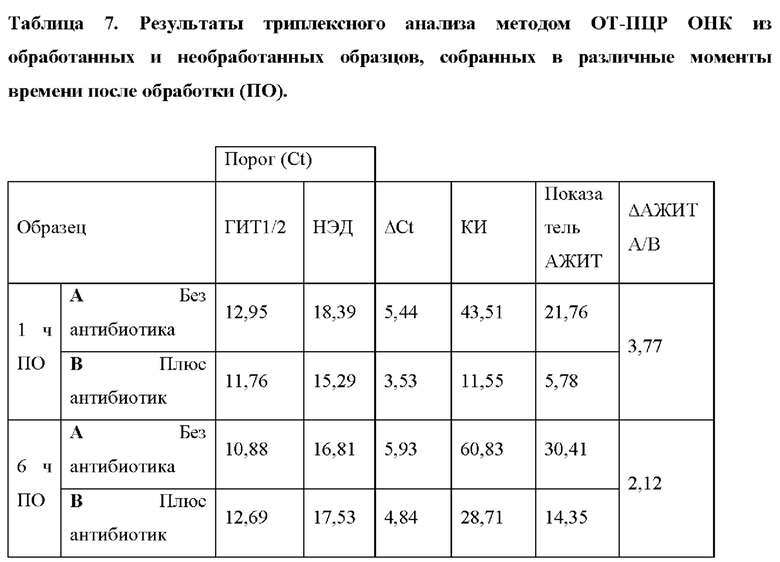
Пример 8. Тестирование чувствительности к антибиотику азитромицину с применением АЖИТ-ПЦР с более коротким периодом инкубации.
В следующем примере оценивали изменение уровней ГИТ по сравнению с НЭД в образцах ОНК, экстрагированных из клеток НЕр-2, которые были инфицированы Chlamydia trachomatis (серовар D). Экстрагировали ОНК из клеток, которые либо обрабатывали антибиотиком при МИК, либо не обрабатывали (контроль), через 24 часа после инфицирования во время экспоненциальной фазы роста. Обрабатывали, как описано в примере 1, Обработка В (1.1.2), применяя азитромицин (0,128 мкг/мл). Для получения меры ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателя АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления отношения ΔАЖИТ.
8.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 5 (5.1, 5.2 и 5.3, соответственно). Используемые условия ОТ-ПЦР были такие, как описано в примере 5 (5.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
8.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.2 Протокол обработки В). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А), со следующей модификацией: не проводили этап осаждения обломков клеток в процессе экстракции образцов в данном примере.
8.3 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена omp и его транскриптов (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из культур хламидий. Данные культуры обрабатывали антибиотиком или оставляли необработанными (контроль) в экспоненциальной фазе роста и собирали через 30 мин или 1 час после обработки 0,128 мкг/мл азитромицина (панель i фигуры 7). В таблице 8 показаны значения порогового цикла (Ct), измеренные для ГИТ1/2 и НЭД в каждом образце. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 8. Затем проводили сравнение полученных результатов между реакциями без обработки (контроль) и реакциями после обработки антибиотиком в каждый момент времени (панель iii фигуры 7).


Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных и обработанных групп, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 8), что свидетельствовало об активной транскрипции во всех образцах. Кратность изменения и показатели АЖИТ рассчитывали для всех образцов во все моменты времени после обработки (таблица 8). Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения в два раза превышала показатели АЖИТ (таблица 8). Сравнение показателей АЖИТ между необработанными и обработанными образцами в каждый момент времени продемонстрировало различие в показателях АЖИТ (панель iii фигуры 7). Это согласуется с нарушением транскрипционной активности клеток в присутствии антибиотика. Отношение ΔАЖИТ рассчитывали путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ в присутствии антибиотика.
Согласно примеру 7, результаты из данного примера демонстрируют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Ответ на присутствие антибиотика детектировали посредством сравнения показателей АЖИТ обработанных и необработанных клеток и рассчитывали как отношение ΔАЖИТ. Оно отражает чувствительность клеток к антибиотику. Оно дополнительно демонстрирует, что чувствительность можно установить в различные моменты времени, включая через 30 мин или 1 ч после обработки антибиотиком азитромицином.
Пример 9. Тестирование чувствительности к антибиотику рифампицину с применением АЖИТ-ПЦР с более коротким периодом инкубации.
В следующем примере оценивали изменение уровней ГИТ по сравнению с НЭД в образцах ОНК, экстрагированных из клеток НЕр-2, которые были инфицированы штаммом 1 и штаммом 5 Chlamydia trachomatis (лабораторный штамм серовара D и штамм серовара L2, устойчивый к рифампицину, соответственно). Экстрагировали ОНК из клеток, которые либо обрабатывали антибиотиком рифампицином при концентрации 0,256 мкг/мл, либо не обрабатывали (контроль), через 20 часов после инфицирования во время экспоненциальной фазы роста. Обрабатывали, как описано в примере 1, Обработка С (1.1.3). Для получения меры ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателя АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления отношения ΔАЖИТ.
9.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Партзимы были разработаны таким образом, чтобы они собирались в два активных МНКзима, когда они связаны с ампликонами, полученными путем амплификации либо гена omp1, либо транскриптов omp1. Данные два МНКзима были способны связываться с двумя различными ампликонами, полученными путем амплификации двух отдельных участков omp1 (участка ГИТ1 и ГИТ2). После сборки оба МНКзима могут расщеплять один и тот же репортерный субстрат Sub102(20)-FB. Третья пара партзимов была разработана таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка ДНК, обозначенного infA_IGR, тем самым позволяя получить меру НЭД. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub72-A1B. Последовательности партзима А и партзима В для каждого МНКзима перечислены ниже, от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.
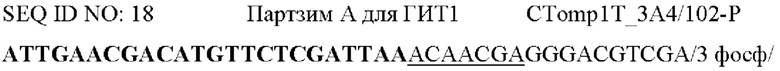

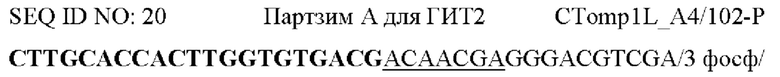

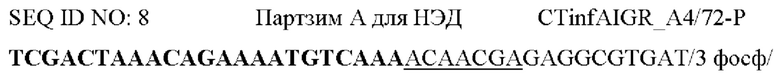

9.2 Репортерные субстраты.
В данном примере использовали два различных репортерных субстрата, каждый из которых был помечен различными флуорофорами. Sub102(20)-FB был помечен по 5'-концу 6-FAM и по 3'-концу IABkFQ, и его расщепление отслеживали на 516 нм с возбуждением при 492 нм. Sub72-A1B был помечен АТТО™ Rho101 по 5'-концу и IAbRQSp по 3'-концу, и его расщепление отслеживали на 609 нм с возбуждением при 592 нм. Репортерные субстраты для данного примера показаны ниже с последовательностью от 5' к 3'. Основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.
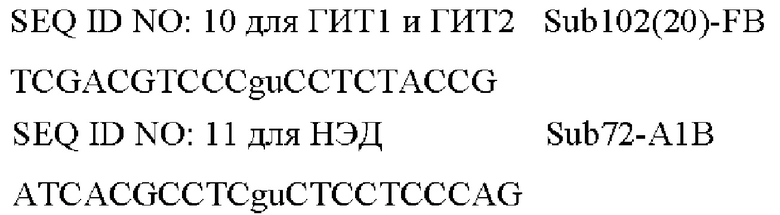
9.3 Прайм еры ПЦР для амплификации ГИТ1, ГИТ2 и НЭД.
Амплификацию in vitro матрицы ОНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Прямой и обратный праймеры применяли для амплификации двух участков гена omp1 и транскриптов (ГИТ1 и ГИТ2) и ДНК infA_IGR (НЭД) с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.






9.4 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.3 Протокол обработки С). Экстракцию проводили, применяя набор для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В) и следуя инструкциям производителя для одновременной экстракции ДНК и РНК.
9.5 Компоненты реакции.
Все реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 400 нМ субстрата SEQ ID NO 10 и 200 нм субстрата SEQ ID NO 11, 1х смесь Probe No-ROX SensiFAST (Bioline), 2 мМ MgCl2 (Bioline), 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline), 0,2 мкл фермента обратной транскриптазы (Bioline) и воду без нуклеазной активности (Ambion) в общем объеме 20 мкл. Все реакции вели в трех повторах на термоциклере CFX96 BioRad®. Параметры циклов были следующими: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (со снижением температуры на 0,5°С на цикл), и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
9.6 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена и транскриптов omp1 (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из культур хламидий. Данные культуры обрабатывали антибиотиком или оставляли необработанными (контроль) в экспоненциальной фазе роста. Их инкубировали в течение либо 5 минут при 37°С (панель iv фигуры 7), либо 15 минут при комнатной температуре (панель v фигуры 7). Антибиотик, применяемый для обработки, представлял собой рифампицин при концентрации 0,256 мкг/мл, эквивалентной в 32 раза большей МИК для чувствительных штаммов и в 32 раза меньшей МИК для устойчивых штаммов. В таблице 9 показаны значения порогового цикла (Ct), измеренные для ГИТ1/2 и НЭД в каждом образце. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 9. Затем проводили сравнение полученных результатов между реакциями без обработки (контроль) и реакциями после обработки антибиотиком в каждый момент времени (панель iv и v фигуры 7).

Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных и обработанных групп, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 9), что свидетельствовало об активной транскрипции во всех образцах. Кратность изменения и показатели АЖИТ рассчитывали для всех образцов во все моменты времени после обработки (таблица 9). Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения в два раза превышала показатели АЖИТ (таблица 9). Уменьшение показателей АЖИТ между необработанными и обработанными образцами анализировали, применяя непарный t-критерий Стьюдента, в каждый момент времени и для каждого условия инкубации.
Результаты показали значительное уменьшение показателей АЖИТ чувствительного штамма 1 (таблица 9, р<0,0001) после 5 минут инкубации с рифампицином при 37°С (панель iv фигуры 7). Это согласуется с нарушением транскрипционной активности клеток в присутствии антибиотика и подтверждает профиль чувствительности данного конкретного серовара. В противоположность этому, показатель АЖИТ устойчивого штамма (штамма 5) не продемонстрировал значимого различия между обработанным и необработанным образцами при таких же данных условиях (таблица 9, панель iv фигуры 7), подтверждая профиль устойчивости данного конкретного серовара. В параллельном эксперименте уменьшение показателей АЖИТ повторных образцов чувствительного штамма 1 (таблица 9, р<0,0001) наблюдали после 15 минут инкубации с рифампицином при комнатной температуре (панель v фигуры 7). Показатель АЖИТ устойчивого штамма 5 не снижался в присутствии рифамицина при таких же условиях, и, в действительности, наблюдали незначительное его повышение.
Результаты из данного примера демонстрируют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Ответ на присутствие антибиотика детектировали посредством сравнения показателей АЖИТ обработанных и необработанных клеток и рассчитывали как отношение ΔАЖИТ. Эти результаты можно применять для точного определения чувствительности или устойчивости клеток к антибиотику, и они дополнительно демонстрируют, что чувствительности можно добиться после коротких периодов инкубации. Различия между чувствительностью и устойчивостью к антибиотикам можно установить уже через 5 минут после обработки антибиотиком. Также продемонстрировали, что нет необходимости в инкубации при стабильных 37°С, и инкубация при комнатной температуре позволяла правильно различить чувствительные и устойчивые организмы.
Пример 10. Тестирование чувствительности к антибиотикам с применением АЖИТ-ПЦР - дозозависимая ответная реакция с применением Протокола экстракции А.
В следующем примере оценивали изменение ГИТ по сравнению с НЭД в образцах ОНК, экстрагированных из клеток НЕр-2, которые были инфицированы Chlamydia trachomatis (серовар D). Экстрагировали ОНК из клеток, которые либо не обрабатывали (контроль), либо обрабатывали антибиотиком (азитромицином) при различных дозах; в частности, при концентрации, в четыре раза превышающей МИК (0,128 мкг/мл), в шесть раз превышающей МИК (0,192 мкг/мл) и в восемь раз превышающей МИК (0,256 мкг/мл). Антибиотик добавляли через 24 часа после инфицирования, когда клетки находились в экспоненциальной фазе роста, как описано в примере 1, Обработка D (1.1.4). Для измерения ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателей АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления отношения ΔАЖИТ.
10.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 5 (5.1, 5.2 и 5.3, соответственно). Используемые условия ОТ-ПЦР были такие, как описано в примере 5 (5.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
10.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.4 Протокол обработки D). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола:хлороформа:изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.1 Протокол экстракции А), со следующей модификацией: не проводили этап осаждения обломков клеток в процессе экстракции образцов в данном примере.
10.3 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена и транскриптов omp1 (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР, применяя ОНК, экстрагированные из культур хламидий. Данные культуры обрабатывали серией доз антибиотика во время экспоненциальной фазы роста или оставляли необработанными (контроль) и собирали после инкубации в течение 1 часа (панель i фигуры 8). В таблице 10 показаны значения порогового цикла (Ct), измеренные для ГИТ1/2 и НЭД в каждом образце. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 10. Затем проводили сравнение полученных результатов между реакциями без обработки (контроль) и реакциями с обработкой различными дозами антибиотика (панель ii фигуры 8).

Спрогнозировали, что у клеток, чувствительных к обработке антибиотиком, будут сниженные уровни транскрипции в присутствии антибиотика, поскольку будут ожидать, что это нарушит нормальное функционирование клеток. Кроме того, спрогнозировали, что более высокие дозы антибиотика приведут к большему нарушению нормального функционирования и, следовательно, уровней транскрипции. Данный эксперимент осуществляют, чтобы это продемонстрировать и установить, соответствует ли уменьшение показателей АЖИТ обработанных клеток применяемой дозе антибиотика.
Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных и обработанных групп, амплифицировали, то значения Ct для ГИТ1/2 были ниже, чем для НЭД (таблица 10), что согласуется с активной транскрипцией во всех четырех образцах. Кратность изменения и показатели АЖИТ рассчитывали для каждого образца (таблица 10). Поскольку для вычисления ГИТ1/2 использовали два участка гена и транскрипта, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения в два раза превышала показатели АЖИТ (таблица 10). Сравнение показателей АЖИТ для необработанных и обработанных образцов продемонстрировало некоторое различие (панель ii фигуры 8). Данное различие было значимым для необработанных (без лекарственного средства) и обработанных (плюс доза 1 лекарственного средства) образцов (р=0,0005, при использовании непарного t-критерия Стьюдента). Для всех обработанных образцов они были не только ниже, чем для необработанных образцов, но и были также последовательно тем ниже, чем более высокую дозу антибиотика применяли во время инкубации (панель ii фигуры 8). В данном эксперименте наблюдали корреляцию между дозой и уменьшением показателей АЖИТ (R2=0,9775, панель ii фигуры 8). Этот результат согласуется со снижением транскрипционной активности в присутствии антибиотика, и чем более высокую дозу антибиотика давали, тем большее нарушение транскрипционной активности наблюдали. Отношение ΔАЖИТ рассчитывали путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ для образцов, обработанных каждой дозой антибиотика (плюс доза 1, доза 2 и доза 3 антибиотика, таблица 10, панель ii фигуры 8).
Результаты из данного примера демонстрируют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Сравнение между показателями АЖИТ для обработанных и необработанных клеток, рассчитанное как отношение ΔАЖИТ, продемонстрировало ответ на присутствие антибиотика. Данный ответ на антибиотики также был больше, когда использовали серию возрастающих доз антибиотика, что указывает на дозозависимую ответную реакцию. Это дополнительно продемонстрировало возможность применения показателей АЖИТ для исследования того, чувствительны ли клетки к антибиотику, и то, что 1 часа инкубации может быть достаточно, чтобы это определить. Ответ на лекарственное средство дозозависимым образом может найти применение в программах изыскания новых лекарственных средств или скрининга лекарственных средств.
Пример 11. Тестирование чувствительности к антибиотику с применением АЖИТ-ПЦР - дозозависимая ответная реакция с применением Протокола экстракции В.
В следующем примере оценивали изменение ГИТ по сравнению с НЭД в образцах ОНК, экстрагированных из клеток НЕр-2, которые были инфицированы Chlamydia trachomatis (серовар D). Экстрагировали ОНК из клеток, которые либо не обрабатывали (контроль), либо обрабатывали антибиотиком азитромицином при различных дозах; в частности, при концентрации, в четыре раза превышающей МИК (0,128 мкг/мл), в шесть раз превышающей МИК (0,192 мкг/мл), в восемь раз превышающей МИК (0,256 мкг/мл) и в шестнадцать раз превышающей МИК (0,512 мкг/мл). Антибиотик добавляли через 20 часов после инфицирования, когда клетки находились в экспоненциальной фазе роста, как описано в примере 1, Обработка D (1.1.4). Для измерения ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Уровни ГИТ и НЭД оценивали и использовали для вычисления показателей АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления отношения ΔАЖИТ.
11.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 9 (9.1, 9.2 и 9.3, соответственно). Используемые условия ОТ-ПЦР были такие, как описано в примере 9 (9.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
11.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.4 Протокол обработки D). Экстракцию проводили, применяя набор для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В), и следуя инструкциям производителя для одновременной экстракции ДНК и РНК.
11.3 Результаты.
Отслеживали совместную амплификацию ДНК и РНК хламидий из 2 участков (ГИТ1 и ГИТ2) и одного участка НЭД в одной реакции ОТ-ПЦР, применяя ОНК, экстрагированные из культур хламидий. Данные культуры обрабатывали серией доз антибиотика во время экспоненциальной фазы роста или оставляли необработанными (контроль) и собирали через 1 час после обработки (панель i фигуры 8). В таблице 11 показаны значения порогового цикла (Ct), измеренные для ГИТ1/2 и НЭД в каждом образце. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 11. Затем проводили сравнение полученных результатов между реакциями без обработки (контроль) и реакциями с обработкой различными дозами антибиотика (панель iii фигуры 8).

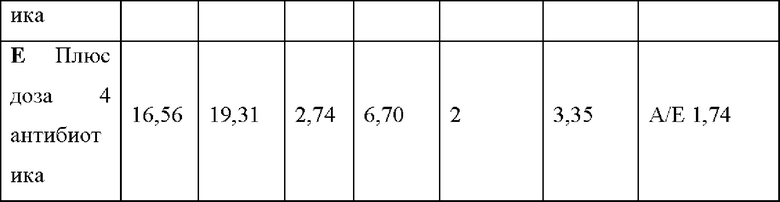
Таким же образом, как описано в примере 10, ожидается, что у клеток, чувствительных к обработке антибиотиком, будут наблюдать снижение уровней транскрипции, так как будут ожидать, что присутствие антибиотика нарушает нормальное функционирование клеток. Прогнозируют, что вызванное нарушение может коррелировать с дозой антибиотика, и, по этой причине, вероятно, чем выше будет доза антибиотика, тем большим будет нарушение нормального функционирования, уровней транскрипции и, в результате, показателей АЖИТ.
Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных и обработанных групп, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 11). Это согласуется с активной транскрипцией во всех образцах. Кратность изменения и показатели АЖИТ рассчитывали для указанных образцов (таблица 11). Кратность изменения была вдвое выше, чем показатели АЖИТ (таблица 11), поскольку для вычисления ГИТ1/2 использовали два участка гена и соответствующего транскрипта, а для вычисления НЭД использовали только один нетранскрибируемый участок. Сравнение показателей АЖИТ необработанного (без лекарственного средства) и обработанного образца (плюс доза 1 лекарственного средства) продемонстрировало значимое различие (фигура 8, панель iii, p<0,05, полученное с применением непарного t-критерия Стьюдента). Все остальные обработанные образцы также отличались от необработанных (фигура 8, панель iii). Для обработанных образцов показатели АЖИТ были ниже, чем для необработанных образцов. Кроме того, при повышении дозы обработки показатели АЖИТ снижались (панель iii фигуры 8). Это согласуется со снижением транскрипционной активности в присутствии антибиотика, и дополнительно свидетельствует о том, что чем большую концентрацию антибиотика применяют, тем большее нарушение транскрипционной активности наблюдают. Такая тенденция также привела к линейной корреляции (R2=0,8325) между показателем АЖИТ и дозой антибиотика (панель iii фигуры 8, таблица 11). Отношение ΔАЖИТ рассчитывали путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ для образцов, обработанных каждой дозой антибиотика (плюс доза 1, доза 2, доза 3 и доза 4 антибиотика). Выявили корреляцию повышения значения отношения ΔАЖИТ с увеличением дозы антибиотика (таблица 11).
Результаты из данного примера дополнительно поясняют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Сравнение между показателями АЖИТ для обработанных и необработанных клеток, рассчитанное как отношение ΔАЖИТ, продемонстрировало ответ на присутствие антибиотика. Ответ на антибиотики линейно коррелировал с дозой, применяемой для обработки, указывая на дозозависимую ответную реакцию. Данный эффект не зависел от способа экстракции, применяемого для получения образцов ОНК. Это дополнительно доказало, как видно из примера 10, возможность использования показателей АЖИТ для изучения того, чувствительны или устойчивы клетки к антибиотику, и что 1-часовой инкубации достаточно. Возможность с помощью АЖИТ-ПЦР отслеживать ответ на лекарственное средство дозозависимым образом может найти применение в программах изыскания новых лекарственных средств или скрининга лекарственных средств.
Пример 12. Тестирование чувствительности к антибиотикам азитромицину и доксициклину с применением АЖИТ-ПЦР.
В следующем примере анализируют чувствительность бактерий к данному лекарственному средству путем оценки изменения уровней ГИТ по сравнению с НЭД в образцах ОНК. Затем их сравнивали между образцами, обработанными антибиотиком и необработанными (контрольными). Образцы получали из клеток НЕр-2, которые были инфицированы различными штаммами Chlamydia trachomatis, про которые известно, что они чувствительны к обоим исследованным лекарственным средствам азитромицину и доксициклину. Экстрагировали ОНК из клеток, которые либо обрабатывали разовой дозой любого антибиотика (0,256 мкг/мл), либо не обрабатывали (контроль), через 20 часов после инфицирования во время экспоненциальной фазы роста и инкубировали в течение одного часа после обработки. Обрабатывали, как описано в примере 1, Обработка E (1.1.5). Для получения меры ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателя АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления отношения ΔАЖИТ.
12.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 9 (9.1, 9.2 и 9.3, соответственно). Используемые условия ОТ-ПЦР были такие, как описано в примере 9 (9.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
12.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из различных штаммов Chlamydia trachomatis, которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.5 Протокол обработки Е). Экстракцию проводили, применяя набор для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В), и следуя инструкциям производителя для одновременной экстракции ДНК и РНК.
12.3 Результаты.
ДНК и РНК хламидий из 2 участков ГИТ и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из культур хламидий. Данные культуры обрабатывали антибиотиком или оставляли необработанными (контроль) в экспоненциальной фазе роста и собирали через 1 час после обработки. В таблицах 12а и 12b представлены значения порогового цикла (Ct) для каждого образца (обработанного или необработанного) для каждого отдельного штамма и антибиотика, применяемого для обработки, а именно азитромицина и доксициклина, соответственно. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблицах 12а и 12b. Затем проводили сравнение полученных результатов между реакциями без обработки (контроль) и реакциями после обработки антибиотиком для каждого штамма. Исследованные антибиотики представляли собой азитромицин (таблица 12а, панель i фигуры 9) и доксициклин (таблица 12b, панель ii фигуры 9).
Поскольку все исследованные штаммы ранее были охарактеризованы как чувствительные к обоим применяемым в данном примере антибиотикам, будут ожидать различие между показателями АЖИТ для обработанных или необработанных образцов. Спрогнозировали, что показатель АЖИТ для обработанных образцов будет ниже, чем для необработанных образцов, так как присутствие антибиотика будет вызывать нарушение нормальной транскрипционной активности клеток. Впоследствии выявили, что все образцы были живыми и активно транскрибировались независимо от обработки. Это наблюдали при амплификации образцов ОНК, экстрагированных из необработанных и обработанных групп, у которых выявили более низкие значения Ct для ГИТ1/2, чем для НЭД независимо от применяемого антибиотика (таблицы 12а и 12b).
Кратность изменения и показатели АЖИТ рассчитывали для всех образцов во все моменты времени после обработки для каждого из применяемых лекарственных средств (таблицы 12а и 12b). Сравнение показателей АЖИТ между необработанными и обработанными образцами в каждый момент времени продемонстрировало значимое различие, при этом показатели АЖИТ для обработанных образцов были ниже, чем для необработанных для всех исследованных штаммов и антибиотиков (р<0,01, применяли непарный t-критерий Стьюдента для каждой группы; таблицы 12а и 12b, фигура 9, панель i и ii). Это согласуется с предсказанными результатами, подтверждая чувствительность штамма к лекарственным средствам, применяемым для обработки и приводящим к нарушению транскрипционной активности. Отношение ΔАЖИТ, рассчитанное путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ в присутствии антибиотика, также оказалось сходным между исследованными штаммами с обработкой одним и тем же антибиотиком, а также между антибиотиками (таблицы 12а и 12b).
Результаты, полученные в данном эксперименте, демонстрируют, что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ и отношений ΔАЖИТ. Отдельные ответы, полученные от каждого исследованного штамма, согласовывались с предсказанной чувствительностью данного штамма к обоим применяемым антибиотикам, выявленной путем анализа показателей АЖИТ для обработанных образцов по сравнению с необработанными. Эти результаты дополнительно подчеркнули возможность использования показателей АЖИТ для исследования чувствительности клеток к антибиотику при краткосрочной инкубации в присутствии и отсутствие интересующего лекарственного средства.

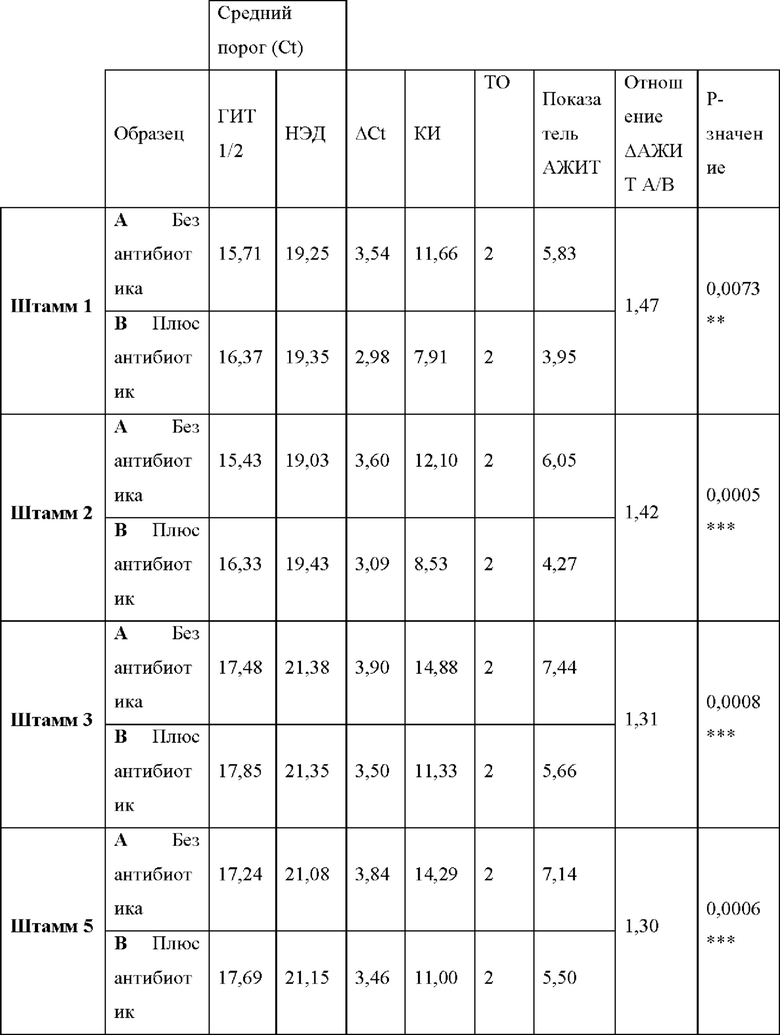

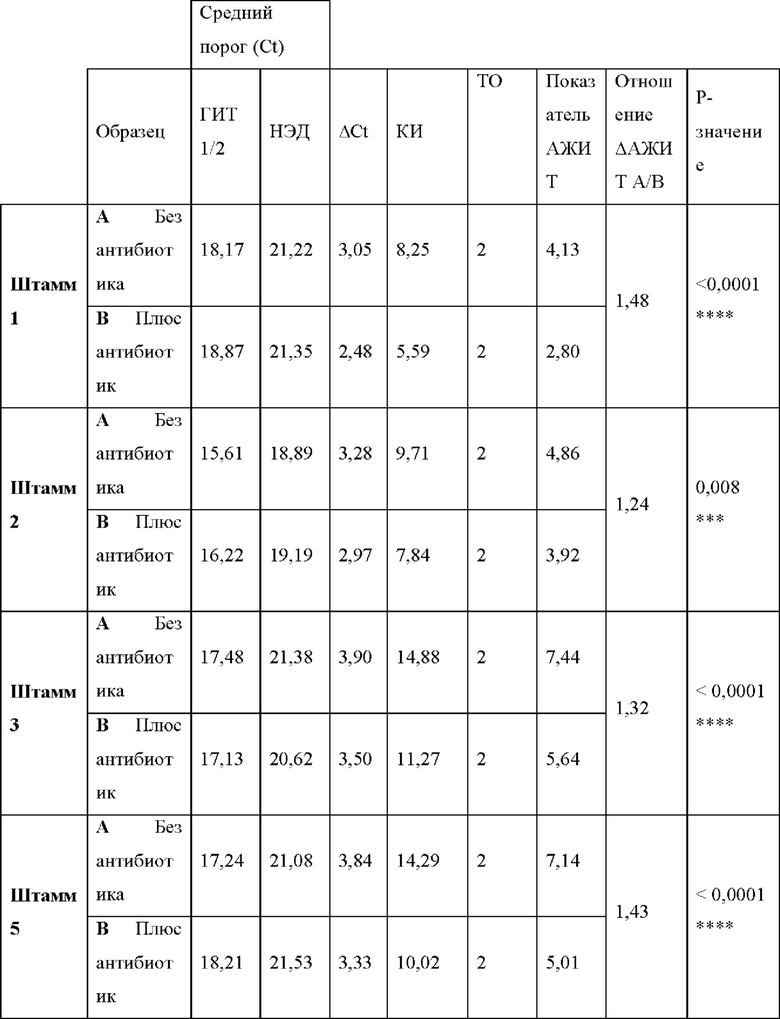
Пример 13. Тестирование чувствительности к антибиотику рифампицину с помощью АЖИТ-ПЦР с применением устойчивых и чувствительных штаммов.
В следующем примере анализировали чувствительность бактерий к данному лекарственному средству путем оценки изменения уровней ГИТ по сравнению с НЭД в образцах ОНК. Затем их сравнивали между образцами, обработанными и необработанными (контроль) антибиотиком. Образцы получали из клеток НЕр-2, которые были инфицированы различными штаммами Chlamydia trachomatis, ранее охарактеризованными в культуре как либо чувствительные к лекарственному средству рифампицину (всего четыре штамма: серовар D, лабораторный штамм (штамм 1), серовар L2, лабораторный штамм дикого типа (штамм 2), серовар L2, устойчивый к триметоприму штамм (штамм 3), и серовар L2, устойчивый к спектиномицину штамм (штамм 4)); либо устойчивые к рифампицину (серовар L2, устойчивый к рифампицину штамм (штамм 5)). Экстрагировали ОНК из клеток, которые либо обрабатывали высокой дозой антибиотика, либо не обрабатывали (контроль), через 20 часов после инфицирования во время экспоненциальной фазы роста. Обрабатывали, как описано в примере 1, Обработка E (1.1.5), применяя однократную концентрацию рифампицина (0,256 мкг/мл), эквивалентную концентрации, в 32 раза большей МИК для чувствительных штаммов и в 32 раза меньшей МИК для устойчивого штамма. Для получения меры ГИТ ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах. Для измерения НЭД другой участок ДНК хламидий совместно амплифицировали в той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателя АЖИТ. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов использовали для вычисления ΔАЖИТ.
13.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 9 (9.1, 9.2 и 9.3, соответственно). Используемые условия ОТ-ПЦР были такие, как описано в примере 9 (9.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
13.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из всех различных штаммов Chlamydia trachomatis (штамма 1, 2, 3, 4 и 5), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.5 Протокол обработки Е). Экстракцию проводили, применяя набор для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В), и следуя инструкциям производителя для одновременной экстракции ДНК и РНК.
13.3 Результаты.
ДНК и РНК хламидий из 2 участков ГИТ и одного участка НЭД совместно амплифицировали и детектировали в одной ОТ-ПЦР с ОНК, экстрагированных из культур хламидий. Данные культуры обрабатывали антибиотиком (рифампицином) или оставляли необработанными (контроль) во время экспоненциальной фазы роста и собирали через один час после обработки. В таблице 13 представлены значения порогового цикла (Ct) для компонентов в каждом образце для каждого отдельного штамма. ΔCt рассчитывали как различия между значениями Ct для сигналов НЭД и ГИТ1/2. В свою очередь, кратность изменения (различие между ГИТ1/2 и НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 13. Полученные результаты сравнивали между реакциями без обработки (контроль) и реакциями после обработки антибиотиком для каждого штамма (панель iii фигуры 9); и сравнивали результаты, полученные для чувствительных и устойчивых штаммов. Кратность изменения и показатели АЖИТ рассчитывали для всех образцов через один час после обработки (таблица 13).
Сравнение показателей АЖИТ между необработанными и обработанными образцами показало значимое различие между показателями АЖИТ для штаммов 1-4 (р<0,0001, применяли непарный t-критерий Стьюдента, таблица 13). Это согласуется с нарушением транскрипционной активности клеток, чувствительных к используемому для обработки антибиотику, и представлено на панели iii фигуры 9. Сравнение показателей АЖИТ для штамма 5 между необработанными и обработанными образцами не выявило значимого различия, показатели АЖИТ были сходны (фигура 9, панель iii, таблица 13). Это указывает на устойчивость к антибиотику рифампицину при инкубации при 37°С в течение 1 ч, что согласуется с небольшим нарушением или отсутствием нарушения транскрипции у данного штамма.
Отношение ΔАЖИТ рассчитывали путем деления показателя АЖИТ (без антибиотика) на показатель АЖИТ в присутствии антибиотика. Отношение ΔАЖИТ было значительно ниже для штамма 5, устойчивого штамма (таблица 13), дополнительно демонстрируя меньшее различие между обработанным и необработанным образцами. Отношение ΔАЖИТ для всех других штаммов было во всех случаях >2,93 (таблица 13). Представление на графике отношения ΔАЖИТ визуально демонстрирует различие между отношением ΔАЖИТ чувствительных и устойчивых штаммов (панель iv фигуры 9). Также определили, что данные различия статистически различны (р<0,0001, непарный t критерий Уэлча). Пороговое значение ΔАЖИТ, равное 1,63, позволяло различить чувствительные и устойчивые штаммы с достоверностью 95% (фигура 9, панель iv).
Результаты, полученные в данном эксперименте, демонстрируют что ГИТ1/2 и НЭД можно измерить в одной реакции, и результаты измерения можно использовать для вычисления показателей АЖИТ. Наряду с этим, сравнение между показателями АЖИТ для обработанных и необработанных клеток, рассчитанное как отношение ΔАЖИТ, дополнительно коррелировало либо с ответом на присутствие антибиотика, либо с отсутствием ответа. Отдельные ответы, полученные для каждого исследованного штамма, согласовались с предсказанной чувствительностью к используемому антибиотику, тогда как отсутствие ответа было связано с профилем устойчивости исследуемого штамма. Эти результаты дополнительно подчеркнули возможность использования показателей АЖИТ для исследования чувствительности или устойчивости клеток к антибиотику при краткосрочной инкубации в присутствии и отсутствие интересующего лекарственного средства.

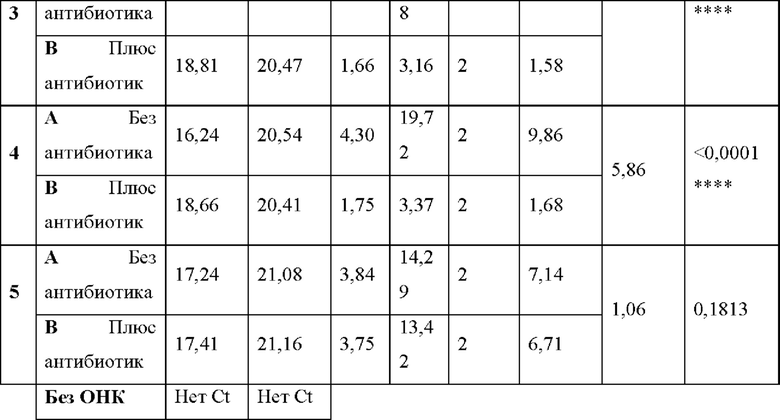
Пример 14. Пример тестирования чувствительности к антибиотикам с применением АЖИТ-ПЦР.
В следующем примере описан процесс, показанный на фигуре 10, который можно применять в качестве основного способа скрининга инфекций, включая инфекции, передающиеся половым путем, и их статуса устойчивости/чувствительности к антибиотику. Клинический образец можно взять у пациента, у которого подозревают наличие инфекций, передающихся половым путем, таких как Neisseria gnorrhea (GC), Chlamydia trachomatis (CT) или Mycoplasma genitalium (MG). Полученный образец можно разделить на аликвоты, одну из которых не будут инкубировать ни с каким антибиотиком, тогда как другую можно инкубировать в присутствии диапазона антибиотиков, применяемых для лечения одной или более из инфекций GC, СТ и MG. После инкубации можно провести анализ общих нуклеиновых кислот в мультиплексной АЖИТ-ПЦР с праймерами, нацеленными на ГИТ и НЭД, специфичные для GC, и/или СТ, и/или MG. Положительный сигнал ГИТ и НЭД конкретного организма может позволить диагностику ИППП, и сравнение показателей АЖИТ в присутствии или отсутствие лекарственных средств может выявить, какую терапию, или методы лечения, можно применять для лечения пациента.
Кроме того, можно проанализировать большую серию образцов и установить пороговые показатели АЖИТ для каждого организма в анализе. Данное пороговое значение затем можно использовать в качестве средства диагностики данных инфекций, передающихся половым путем, и/или в качестве способа контроля излеченности после лечения подходящим антибиотиком. Кроме того, анализ большой серии образцов в присутствии или отсутствие каждого антибиотика может позволить определить порог отношения ΔАЖИТ, позволяющий распознать чувствительность или устойчивость каждого организма к каждому антибиотику. Порог отношения ΔАЖИТ затем можно использовать в качестве средства прогнозирования ответа на конкретный антибиотик в формате, в котором более не будет требоваться аликвота образца или образец в качестве необработанного контроля для сравнения. Кроме того, поскольку в примере 7 показали, что чувствительность и устойчивость можно определить после всего лишь 5 минут инкубации, при сочетании инкубации с протоколом быстрой амплификации он может быть подходящим в качестве быстрого теста на месте оказания медицинской помощи. Наконец, поскольку в примере 7 также продемонстрировали, что инкубацию с лекарственным средством можно провести при комнатной температуре, для такого теста не должно требоваться дополнительное оборудование кроме того, которое необходимо для экстракции и амплификации.
Пример 15. Применение АЖИТ-ПЦР при различных нагрузках жизнеспособным материалом.
В следующем примере оценивали уровни НЭД и ГИТ в образцах с различными нагрузками от жизнеспособных бактерий до мертвых. Экстрагировали ОНК из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D), либо необработанных (живые СТ), либо обработанных высокой дозой 0,512 мкг/мл антибиотика азитромицина в течение 40 часов (мертвые СТ). После сбора их смешивали в различных соотношениях с получением различных нагрузок жизнеспособными бактериями, составляющих 0%, 0,1%, 0,2%, 0,5%, 1%, 10%, 20%, 50% и 100%, как описано в примере 1, Обработка F (1.1.6). ДНК и РНК хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах, для измерения ГИТ. Другой участок ДНК хламидий совместно амплифицировали в одной и той же реакции ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, который не транскрибируется, для измерения НЭД. Оценивали уровни ГИТ и НЭД и использовали их для вычисления показателя АЖИТ.
15.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Олигонуклеотиды партзимов, репортерные субстраты и праймеры ПЦР, используемые для амплификации и детектирования ГИТ1, ГИТ2 и НЭД, были такими, как указано в примере 9 (9.1, 9.2 и 9.3, соответственно). Обратный праймер для НЭД (SEQ ID NO 23) в данном примере заменили на следующий:

Используемые условия ОТ-ПЦР были такие, как описано в примере 9 (9.5), и реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/100), либо не содержали мишень (dH2O).
15.2 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), которые культивировали в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.6 Протокол обработки F). Экстракцию проводили, применяя набор для экстракции FireMonkey PuriSpin, как описано в примере 1 (1.3 Экстракция общих нуклеиновых кислот, 1.3.2 Протокол экстракции В), и следуя инструкциям производителя для одновременной экстракции ДНК и РНК.
15.3 Результаты.
ДНК и РНК (ГИТ) хламидий, или ДНК отдельно (НЭД), совместно амплифицировали в одной реакции ОТ-ПЦР с ОНК, экстрагированными из смеси жизнеспособных необработанных клеток (живых СТ) и клеток, обработанных высокой дозой антибиотика (мертвые СТ), чтобы создать различные нагрузки жизнеспособными хламидиями. В таблице 14 показаны значения порогового цикла (Ct), измеренные для каждой жизнеспособной нагрузки с использованием в реакции либо ГИТ1, либо ГИТ1/2. ΔCt рассчитывали как разницу между значениями Ct сигналов НЭД и ГИТ. В свою очередь, кратность изменения (отношение ГИТ к НЭД), которая теоретически приведет к таким значениям ΔCt, оценили как 2ΔCt и представили в таблице 15, и показатели АЖИТ представили на графике на панели i фигуры 11. Полученные результаты затем сравнивали с процентом жизнеспособности в каждой смеси.
Проводили анализ жизнеспособности, посредством определения инфекционности и иммунофлуоресцентного окрашивания, чтобы подтвердить достоверность нагрузки в каждом смешанном образце. Это позволило визуально подтвердить увеличение количества включений хламидий как процент повышения жизнеспособности (результаты не представлены).
Теоретически, низкие нагрузки жизнеспособными клетками приведут к более низким уровням транскриптов, детектируемым на фоне геномной ДНК, полученной из нежизнеспособных клеток. Если ДНК не деградировала во время обработки, то можно ожидать, что обнаруженное количество ДНК будет больше, чем количество РНК, поскольку ДНК по своей природе более стабильна, чем РНК. Ожидается, что в образцах с высокими нагрузками жизнеспособными клетками, будут присутствовать большие количества транскриптов.
Анализ результатов показал, что когда амплифицировали ОНК, экстрагированные из образца с нагрузкой жизнеспособными бактериями 0%, то значение ΔCt для ГИТ и НЭД было малым (таблица 14), что указывало на низкой уровень или отсутствие активной транскрипции. Для всех образцов с нагрузкой жизнеспособными бактериями 0,2% или более значение Ct для ГИТ было ниже, чем для НЭД (таблица 14), что согласуется с активной транскрипцией. Кратность изменения и показатели АЖИТ рассчитывали для всех нагрузок жизнеспособными бактериями (таблица 14). Показатели АЖИТ значительно различались для образца с нагрузкой жизнеспособными бактериями 0% по сравнению с образцами с нагрузкой жизнеспособными бактериями 0,2% или больше (панель i фигуры 11, таблица 14, p<0,05). Не наблюдали значимых различий между смесями, содержащими нагрузки жизнеспособными бактериями более чем 0,2% (таблица 14, p>0,05). Также исследовали нагрузки жизнеспособными бактериями 0,1% и обнаружили, что показатель АЖИТ значительно отличался от показателя АЖИТ для нагрузки жизнеспособными бактериями 0%, но также значительно отличался от такового для нагрузки жизнеспособными бактериями более 0,2% (результаты не представлены).
Как и ожидали, различные нагрузки жизнеспособными бактериями также приводили к различию между значениями Ct для реакций ГИТ и НЭД, так как значения Ct будут коррелировать с хромосомными копиями Chlamydia trachomatis в каждой смеси. Поскольку клетки из образцов «мертвые СТ» инкубировали с лекарственным средством в течение 40 часов, можно предположить, что может наблюдаться не только остановка активной транскрипции РНК, но также остановка активной репликации бактерий, что влияет на концентрацию ДНК. Также вероятно, что в течение этого времени происходила деградация как ДНК, так и РНК. По этой причине, для более высоких нагрузок жизнеспособными бактериями выявили более низкие значения Ct (более раннее детектирование), чем для более низких нагрузок жизнеспособными бактериями (детектирование в более поздних циклах ПЦР) (панель ii фигуры 11). Эти результаты также коррелируют с анализом жизнеспособности хламидий из смесей (панель i фигуры 11).
Результаты из данного примера демонстрируют, что показатели АЖИТ коррелируют с мерой жизнеспособности и нежизнеспособности популяций, о чем свидетельствует различие между жизнеспособными популяциями при настолько низкой нагрузке как 0,1% и нежизнеспособными популяциями. В данном примере продемонстрировали, что ГИТ и НЭД можно измерять в одной реакции, и полученные результаты можно использовать для вычисления показателей АЖИТ, которые коррелируют с наблюдаемой жизнеспособностью, настолько низкой нагрузкой жизнеспособными бактериями как 0,1% и возможностью отличить их от нежизнеспособных популяций. Наконец, в данном примере продемонстрировали главное преимущество АЖИТ-ПЦР состоящее в том, что нет необходимости определять количество ОНК, которые добавили в реакцию АЖИТ-ПЦР, так как данный способ позволяет определить отношение ГИТ к НЭД независимо от количества исходного материала. Доказательством данного факта является то, что не наблюдают значимого различия между нагрузками жизнеспособными бактериями на протяжении широкого диапазона, исследованного в данном примере.

Пример 16. Влияние размера ампликона и других параметров ОТ-ПЦР на показатели АЖИТ.
В следующем примере оценивали уровни НЭД и ГИТ в образцах ОНК, экстрагированных из клеток НЕр-2, инфицированных Chlamydia trachomatis (серовар D). ОНК экстрагировали из клеток, которые не инкубировали с антибиотиком (необработанные, жизнеспособные клетки), и из клеток, которые инкубировали с антибиотиком при концентрации в восемь раз ниже МИК (<МИК), равной МИК (МИК) или в 8 раз выше МИК (>МИК), как описано в примере 1, протокол обработки А (1.2.1). ДНК и РНК (ГИТ) хламидий амплифицировали с помощью ОТ-ПЦР, применяя праймеры, нацеленные на два различных положения в гене omp1 и его транскриптах (ГИТ1/2). Две пары праймеров, используемых для амплификации двух мишеней omp1 ГИТ в данном эксперименте (раздел 16.3, SEQ ID NO 4 и 24; SEQ ID NO 16 и 25), приводили к образованию более длинных ампликонов, чем образующиеся при применении двух пар праймеров ГИТ, используемых в предшествующих примерах, включая пример 5 (раздел 5.3, SEQ ID NO 4 и 5, SEQ ID NO 16 и 17). Длина полученных ампликонов составляла 215 п.о. и 311 п.о. для ГИТ1 и ГИТ2, соответственно. ДНК хламидий отдельно (НЭД) совместно амплифицировали в той же реакционной смеси для ОТ-ПЦР, применяя праймеры, нацеленные на участок геномной ДНК, обозначенный InfA_IGR, который не транскрибируется. Значения Ct для ГИТ1/2 и НЭД оценивали в реакции ОТ-ПЦР для всех обработок.
16.1 Анализ АЖИТ-ПЦР ГИТ1, ГИТ2 и НЭД.
Партзимы были разработаны таким образом, чтобы они собирались в два активных МНКзима, когда они связаны с ампликонами, полученными путем амплификации либо гена omp1, либо транскриптов omp1. Данные два МНКзима были способны связываться с двумя различными ампликонами, полученными путем амплификации двух отдельных участков omp1 (участок ГИТ1 и ГИТ2). После сборки оба МНКзима могут расщеплять один и тот же репортерный субстрат Sub102(20)-FB. Третья пара партзимов была разработана таким образом, чтобы они собирались в активные МНКзимы, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка ДНК, обозначенного infA_IGR, тем самым позволяя получить меру НЭД. После сборки данный МНКзим мог расщеплять репортерный субстрат Sub72-A1B. Последовательности партзима А и партзима В для каждого МНКзима перечислены ниже, от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.

16.2 Репортерные субстраты.
В данном примере использовали два различных репортерных субстрата, каждый из которых был помечен различными флуорофорами. Sub102(20)-FB был помечен по 5'-концу 6-FAM и по 3'-концу IABkFQ, и его расщепление отслеживали на 516 нм с возбуждением при 492 нм. Sub72-A1B был помечен АТТО™ Rho101 по 5'-концу и IAbRQSp по 3'-концу, и его расщепление отслеживали на 609 нм с возбуждением при 592 нм. Репортерные субстраты для данного примера показаны ниже с последовательностью от 5' к 3'. Основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.

16.3 Праймеры ПЦР для амплификации ГИТ1, ГИТ2 и НЭД.
Амплификацию in vitro матрицы ОНК, экстрагированной из клеток, инфицированных Chlamydia trachomatis, проводили, применяя праймеры, перечисленные ниже. Прямой и обратный праймеры применяли для амплификации двух участков гена omp1 и транскриптов (ГИТ1 и ГИТ2) и ДНК infA_IGR (НЭД) с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.


16.4 Получение ОНК.
РНК и ДНК (ОНК) совместно экстрагировали из Chlamydia trachomatis (серовар D), который был получен с помощью способов in vitro, культивированного в клетках в клетках НЕр-2, как описано в примере 1 (1.1 Культура, 1.1.1 Протокол обработки А). Экстракцию проводили с помощью методики ЖЖЭ с применением фенола : хлороформа : изоамила, также описанной в примере 1 (1.3 Экстракция общих нуклеиновых кислот).
16.5 Компоненты реакции.
Все реакционные смеси содержали 40 нМ каждого прямого праймера, 200 нМ каждого обратного праймера, 200 нМ каждого партзима А, 200 нМ каждого партзима В, 400 нМ субстрата SEQ ID NO 10, 200 нМ субстрата SEQ ID NO 11, 1х смесь Probe No-ROX SensiFAST One-Step (Bioline), 2 мМ MgCl2 (Bioline), 0,2 Ед/мкл ингибитора РНКазы RiboSafe (Bioline), 0,2 мкл фермента обратной транскриптазы (Bioline) и воду без нуклеазной активности (Ambion), в общем объеме 20 мкл. Все реакции вели в трех повторах на термоциклере CFX96 BioRad®. Параметры циклов были следующими: 48°С в течение 10 минут, 95°С в течение 2 мин, 10 циклов по 95°С в течение 5 секунд и 61°С в течение 30 секунд (со снижением температуры на 0,5°С на цикл), и 30 циклов по 95°С в течение 5 секунд и 52°С в течение 50 секунд. Реакционные смеси либо содержали 5 мкл матрицы ОНК (разведение 1/1000), либо не содержали мишень (dH2O).
16.6 Результаты.
ДНК и РНК хламидий из 2 участков внутри гена omp и его транскриптов (ГИТ1 и ГИТ2) и одного участка НЭД совместно амплифицировали в одной реакции ОТ-ПЦР с ОНК, экстрагированными из жизнеспособных необработанных клеток и из клеток, инкубированных с антибиотиком при концентрациях ниже (<МИК), равных (МИК) или выше МИК (>МИК). В таблице 15 показаны значения порогового цикла (Ct), измеренные для НЭД и для объединенных сигналов от ГИТ1 и ГИТ2 (ГИТ1/2) в каждом образце. ΔCt рассчитывали как разницу между значениями Ct для НЭД и ГИТ1/2. В свою очередь, кратность изменения (отношение ГИТ к НЭД), которая теоретически приведет к значениям ΔCt, оценили как 2ΔCt и представили в таблице 15. Показатели АЖИТ рассчитывали путем деления КИ на ТО. Полученные результаты затем сравнивали с жизнеспособностью каждой популяции клеток.
Пары праймеров, применяемые в данном примере, приводили к образованию более длинных ампликонов, чем наблюдаемые в предшествующих примерах. Длины ампликонов составляли 215 п.о. и 311 п.о. для ГИТ1 и ГИТ2, соответственно. Можно ожидать, что применение более длинных ампликонов даст более точную и строгую оценку жизнеспособности исследуемого организма, так как данные наборы праймеров будут амплифицировать меньше коротких остаточных фрагментов, ассоциированных с мертвыми клетками или клетками, в которых экспрессия снижена присутствием антибиотика. Следовательно, будут ожидать, что применение более длинных по сравнению с более короткими ампликонами для ГИТ изменит абсолютные значения, полученные для показателей АЖИТ для каждого из исследованных образцов (необработанных или обработанных различными дозами антибиотика), но не будут ожидать, что оно изменит корреляцию с жизнеспособностью клеток, измеренной с помощью иммунофлуоресцентного окрашивания (панели i и ii фигуры 3), или сведения, которые можно получить, изучая показатели АЖИТ (таблица 15, фигура 12).


Анализ результатов показал, что когда образцы ОНК, экстрагированные из необработанных или обработанных при концентрации ниже МИК образцов, амплифицировали, то значение Ct для ГИТ1/2 было ниже, чем для НЭД (таблица 15), что согласуется с активной транскрипцией в обоих типах образцов. Для ГИТ1/2 и НЭД из ОНК, обработанных при концентрации на уровне МИК или выше, различия в значении Ct были очень низкими (<1) (таблица 15), что указывало на отсутствие активной транскрипции ДНК. Кратность изменения и показатели АЖИТ рассчитывали для указанных четырех типов образцов (таблица 15). Поскольку для вычисления ГИТ1/2 использовали два гена и их транскрипты, а для вычисления НЭД использовали только один нетранскрибируемый участок, то кратность изменения делили на ТО, чтобы вычислить показатели АЖИТ (таблица 15). Полученные результаты демонстрируют, что длинные ампликоны ГИТ приводили к более низким показателям АЖИТ (фигура 12) по сравнению с более короткими ампликонами, применяемыми для детектирования, что наблюдают в примере 5 (панель ii фигуры 5). Это свидетельствует о том, что детектируют меньшее количество частично деградированных фрагментов транскриптов при использовании праймеров для ГИТ, которые образуют более длинные ампликоны.
Результаты из данного примера демонстрируют, что ГИТ и НЭД можно измерять в одной реакции, и полученные результаты использовать для вычисления показателей АЖИТ, которые коррелируют с наблюдаемой жизнеспособностью клеток. Они дополнительно показывают различия в показателях АЖИТ между жизнеспособными и нежизнеспособными образцами, при этом показатели АЖИТ ниже, чем таковые, наблюдаемые для коротких ампликонов для ГИТ1 и ГИТ2. Несмотря на различные параметры, применяемые в данном примере, окончательное различие между жизнеспособными и нежизнеспособными клетками точно выявляется, при этом для всех образцов наблюдают сходные тенденции при сравнении с показателями АЖИТ для более коротких ампликонов для ГИТ1 и ГИТ2.
Пример 17. Примеры тестирования контроля излеченности и чувствительности к антибиотикам для Neisseria gonorrhoeae с применением АЖИТ-ПЦР.
В следующем примере описан анализ, нацеленный на ГИТ и НЭД, применяемый для диагностики, ТОС и AST для Neisseria gonorrhoeae (GC). В данном анализе будут оценивать изменение ГИТ по сравнению с НЭД в образцах ОНК. Для измерения ГИТ ДНК и РНК N.gonorrhoeae будут амплифицировать с помощью ОТ-ПЦР, применяя праймеры, нацеленные на некоторые положения гена и его транскриптов или множества генов и их транскриптов. Для измерения НЭД другой участок ДНК N.gonorrhoeae будут совместно амплифицировать в той же реакции ОТ-ПЦР, применяя пары праймеров, нацеленные на участок геномной ДНК, который не транскрибируется. Можно провести скрининг потенциальных мишеней ГИТ и НЭД согласно примеру 3. Будут оценивать уровни ГИТ и НЭД и использовать для вычисления показателей АЖИТ. Полученные показатели АЖИТ позволят определить жизнеспособность указанного организма в любом данном образце (например, моче, вагинальном мазке, ректальном мазке или мазке из зева). В дополнение к этому, образец также можно использовать для тестирования чувствительности к антибиотикам путем разделения образца и инкубации в присутствии и отсутствие необходимого лекарственного средства или множества лекарственных средств. Уровни ГИТ и НЭД будут оценивать и применять для вычисления показателей АЖИТ для каждого условия. В дополнение к этому, показатели АЖИТ обработанных и необработанных образцов будут применять для вычисления ΔАЖИТ, в конечном счете определяя профиль чувствительности или устойчивости организма. Это поможет в подборе терапии, причем лучший выбранный антибиотик будут давать при первом появлении симптомов.
Потенциальные целевые гены и соответствующие последовательности МНКзимов, репортерных субстратов и пар праймеров, применяемых для их амплификации, перечислены в следующих разделах (17.1, 17.2 и 17.3). Репортерные субстраты отличаются от таковых, исследованных в анализах ГИТ и НЭД, нацеленных на Chlamydia trachomatis, что потенциально позволяет объединить все мишени в мультиплексном анализе, что реализовано в примере 14, фигура 10. Также можно дополнительно включить дополнительные целевые организмы (пример 14, фигура 10). Это позволит осуществить идентификацию, подтверждение статуса инфицирования и тестирование чувствительности к антибиотикам в одной реакции для обоих организмов.
17.1 Кандидатные мишени для ГИТ1, ГИТ2 и НЭД для анализа АЖИТ-ПЦР.
Партзимы были разработаны таким образом, чтобы они собирались в два активных МНКзима, когда они связаны с ампликонами, полученными путем амплификации различных генов, гена ompA или cysK или их транскриптов. Данные два МНКзима разработаны таким образом, чтобы они связывались с двумя различными ампликонами, полученными путем амплификации двух отдельных генов, представляющих ГИТ1 и ГИТ2, соответственно. После сборки оба МНКзима могут расщеплять один и тот же репортерный субстрат Sub97(20)-JB. Третья пара партзимов была разработана таким образом, чтобы они собирались в активный МНКзим, когда они связаны с ампликонами, полученными путем амплификации нетранскрибируемого участка ДНК, обозначенного IGR1109, который является кандидатным для измерения НЭД. После сборки данный МНКзим будет способен расщеплять репортерный субстрат Sub84(20)-CB. Последовательности партзима А и партзима В для каждого МНКзима перечислены ниже от 5' к 3'. Основания, выделенные жирным шрифтом, гибридизуются с мишенью, подчеркнутые основания образуют часть каталитического центра в собранном МНКзиме, и основания, выделенные курсивом, относятся к последовательности, которая гибридизуется с субстратом.

17.2 Репортерные субстраты.
В данном примере два различных репортерных субстрата, меченых различными флуорофорами, будут пригодны для детектирования в системах, включающих партзимы/МНКзим, перечисленные выше. Данные субстраты представляют собой Sub97(20)-JB, меченый по 5'-концу 5-JOEN и по 3'-концу IABkFQ, расщепление которого можно отслеживать на 555 нм с возбуждением при 529 нм, и Sub84(20)-CB, меченый 5Су5 по 5'-концу и IAbRQSp по 3'-концу, расщепление которого можно отслеживать на 668 нм с возбуждением при 648 нм. Данные репортерные субстраты представлены ниже с последовательностью от 5' к 3', где основания в нижнем регистре представляют собой РНК и основания в верхнем регистре представляют собой ДНК.

17.3 Праймеры ПЦР для амплификации ГИТ1, ГИТ2 и НЭД.
Амплификацию ОНК можно провести, применяя праймеры, перечисленные ниже. Прямой и обратный праймеры разработаны таким образом, чтобы они амплифицировали два отдельных гена ompA и cysK и их транскрипты (ГИТ1 и ГИТ2), а также IGR1109 ДНК (НЭД) с помощью ОТ-ПЦР. Все последовательности записаны от 5' к 3'.

Можно провести скрининг праймеров для ГИТ для дополнительных кандидатных генов, включая porB и rpmB, применяя способ, описанный в общих чертах в примере 3.
Пример 18. Влияние эффективности, чувствительности, инклюзивности и специфичности амплификации на показатели АЖИТ.
В следующем примере обсуждаются параметры, которые могут дополнительно влиять на абсолютные значения, наблюдаемые для показателей АЖИТ, полученных для конкретных мультиплексных анализов. Эффективности амплификации в анализах ГИТ и НЭД, включенных в анализ АЖИТ-ПЦР, в идеальном случае должны быть высокими и равными для ГИТ и НЭД. Эффективности амплификации ГИТ1, ГИТ2 и НЭД, нацеленных на Chlamydia trachomatis, применяемых в нескольких примерах, включая пример 5, оценивали, применяя синтетические целевые последовательности, для которых готовили серийные разведения, и обнаружили их сходство друг с другом, при этом эффективности были близки к 100% с R2>0,998 (результаты не представлены). Показали, что когда все компоненты реакции эффективны и сравнимы друг с другом, полученные показатели АЖИТ позволяют точно различить жизнеспособные и нежизнеспособные клетки, что доказано в примере 5 (панель ii фигуры 5).
Другим важным фактором является длина ампликонов, полученных путем амплификации с праймерами для ГИТ и НЭД. Ранее показано (пример 16), что в системах АЖИТ-ПЦР, создающих более длинные ампликоны, могут быть более низкие наблюдаемые значения показателей АЖИТ по сравнению с системами, создающими более короткие ампликоны. Тем не менее, хотя абсолютные значения показателей АЖИТ могут изменяться, корреляция между наблюдаемыми значениями и жизнеспособностью сохраняется.
Факторы, влияющие на эффективность АЖИТ-ПЦР в качестве универсального средства для фундаментальных исследований и клинических исследований, включают чувствительность, инклюзивность и специфичность. Чувствительность влияет на способность детектирования мишени, в частности, на нижнем пределе обнаружения, таком как <10 копий. Инклюзивность будет относиться к способности детектировать все штаммы и серовары, в пределах одного вида организма, с одинаковой эффективностью. Специфичность будет относиться к детектированию мишени, которое специфично только для интересующего организма. Детектирование «нецелевой мишени», но родственного вида, может привести к повышенным показателям АЖИТ, не отражающим жизнеспособность интересующих клетки, организма или вируса.
Также обсуждалось, что мишень, применяемую для ГИТ и НЭД, необходимо тщательно выбирать. В примере 3 показан способ определения, удовлетворяет ли конкретная последовательность указанным критериям, то есть праймеры для ГИТ должны быть нацелены на участок ДНК, который экспрессируется, тогда как праймеры для НЭД должны быть нацелены на участок, который не экспрессируется. Примеры в данном документе показали, что можно использовать более чем один ГИТ в конкретной АЖИТ-ПЦР. В действительности, это весьма желательно, так как определенные гены могут экспрессироваться только во время некоторых стадий цикла развития, например, бактерий. Анализ, включающий множество экспрессированных генов, предпочтительно на высоких уровнях при различных условиях, может гарантировать постоянное детектирование экспрессии при различных условиях.
Наконец, прогнозируют, что выбор мишеней ГИТ будет зависеть от исследуемого организма и антибиотика. Например, в исследованиях другой группой показали, что транскрипты porB и rpmB Neisseria gonorrhoeae экспрессируются на высоком уровне, и уровни их экспрессии изменяются в ответ на антибиотик ципрофлоксацин. Было показано (пример 9), что ген omp1 Chlamydia trachomatis и его транскрипты подходят, чтобы различать устойчивость или чувствительность к рифампицину, и способны отражать жизнеспособность организма.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНОЙ ХИМИОТЕРАПИИ ПАЦИЕНТОВ, СЕРОПОЗИТИВНЫХ ПО ВИЧ, ОСНОВАННЫЙ НА ФЕНОТИПИЧЕСКОЙ ЛЕКАРСТВЕННОЙ ЧУВСТВИТЕЛЬНОСТИ ЧЕЛОВЕЧЕСКИХ ШТАММОВ ВИЧ | 1997 |
|
RU2174014C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ЭКСПРЕССИИ ХИМЕРНОГО ГЕНА Trim5a | 2015 |
|
RU2592675C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТРАНСКРИПЦИИ ГЕНА, КОДИРУЮЩЕГО ХЕМОКИН CCL2 (МСР-1) ЧЕЛОВЕКА И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2522801C2 |
| ЭНХАНСЕР ПАЛОЧКОВИДНОГО ВИРУСА САХАРНОГО ТРОСТНИКА (SCBV) И ЕГО ПРИМЕНЕНИЕ В ФУНКЦИОНАЛЬНОЙ ГЕНОМИКЕ РАСТЕНИЙ | 2013 |
|
RU2639517C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ КЛЕТОК НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКИХ К ДЕЙСТВИЮ ПРЕПАРАТОВ, РЕАКТИВИРУЮЩИХ БЕЛОК р53 | 2012 |
|
RU2509808C1 |
| СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ | 2018 |
|
RU2790291C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ N-3 ПОЛИНЕНАСЫЩЕННОЙ ЖИРНОЙ КИСЛОТЫ В ОБРАЗЦЕ РЫБЬЕГО ЖИРА | 2010 |
|
RU2642292C1 |
| Многопараметрическая диагностическая тест-система для количественного определения уровня мРНК генов RIG-1, IFIT-1, IFIH-1 человека | 2021 |
|
RU2782428C1 |
| БИОЛОГИЧЕСКИЙ СПОСОБ АНАЛИЗА ДЛЯ КОНТРОЛЯ КАЧЕСТВА НУТРИЦЕВТИКОВ И ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2010 |
|
RU2570626C2 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ ПРОЛИФЕРАЦИИ КЛЕТОК С ПОМОЩЬЮ МАРКЕРНЫХ ГЕНОВ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕАЛЬНОМ ВРЕМЕНИ | 2008 |
|
RU2492244C2 |

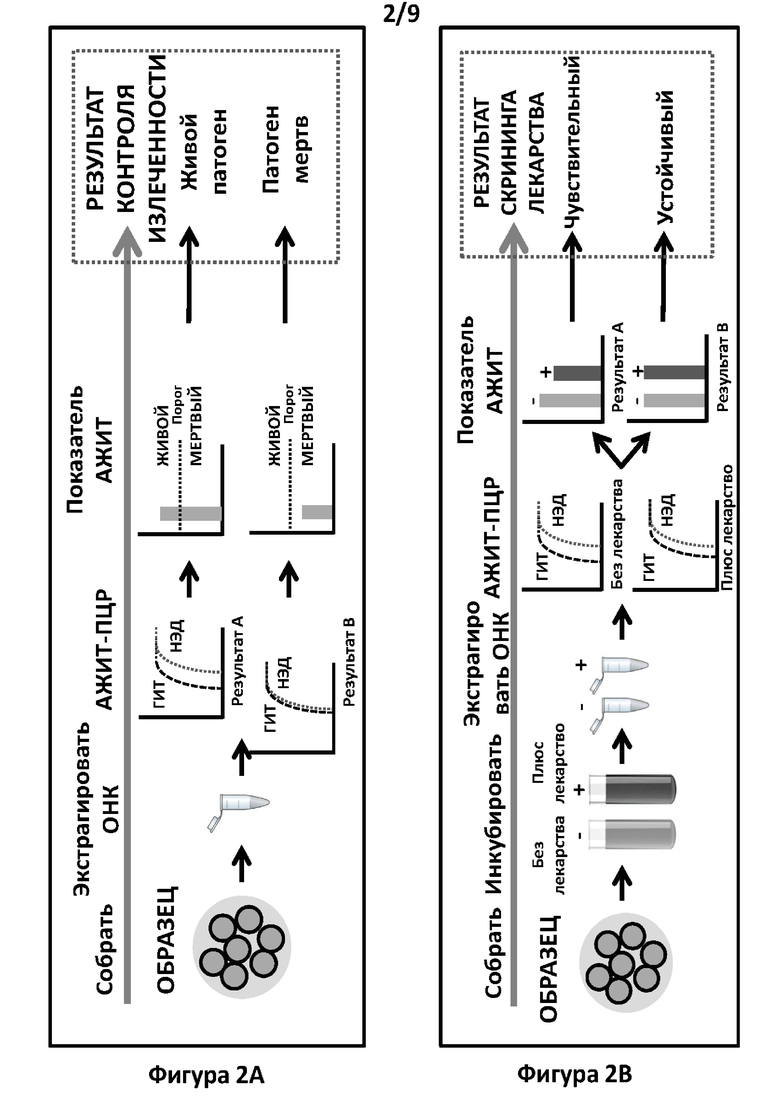

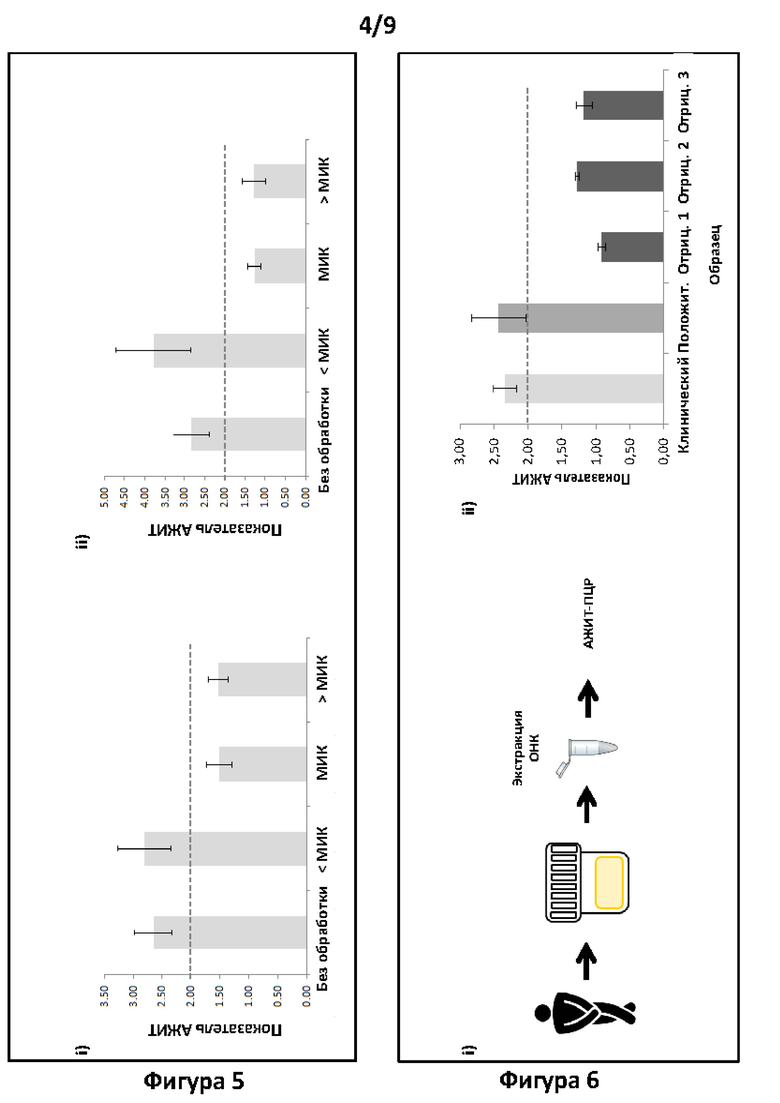
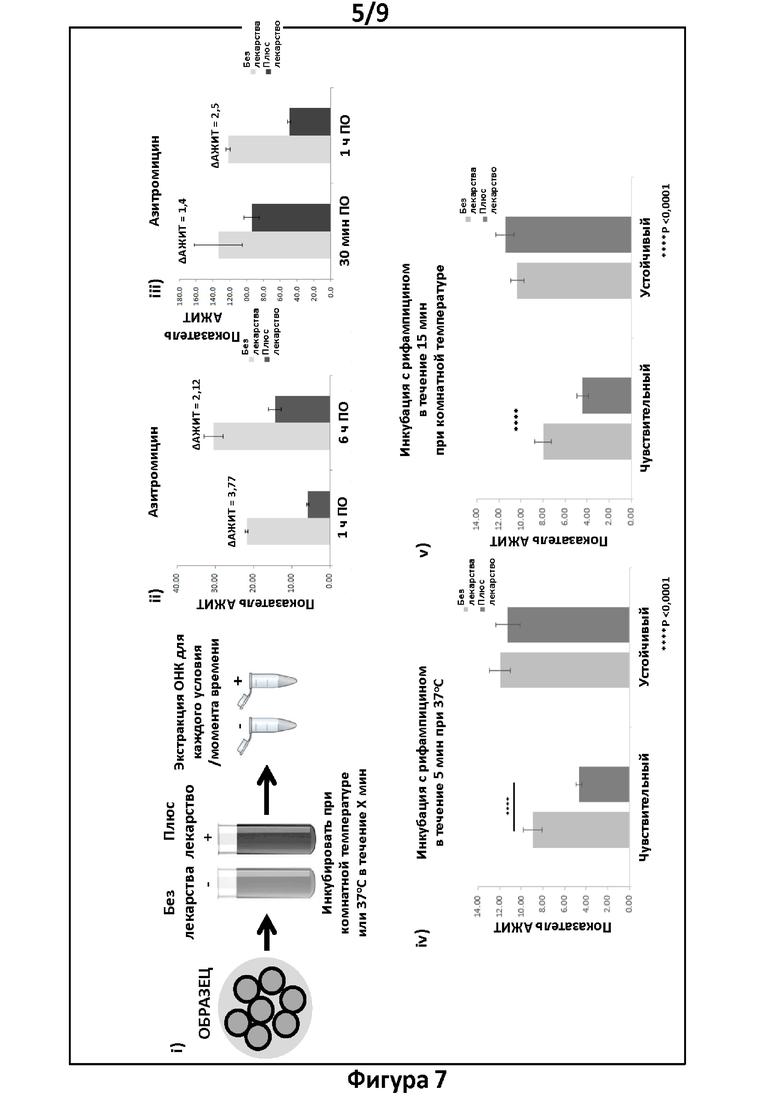
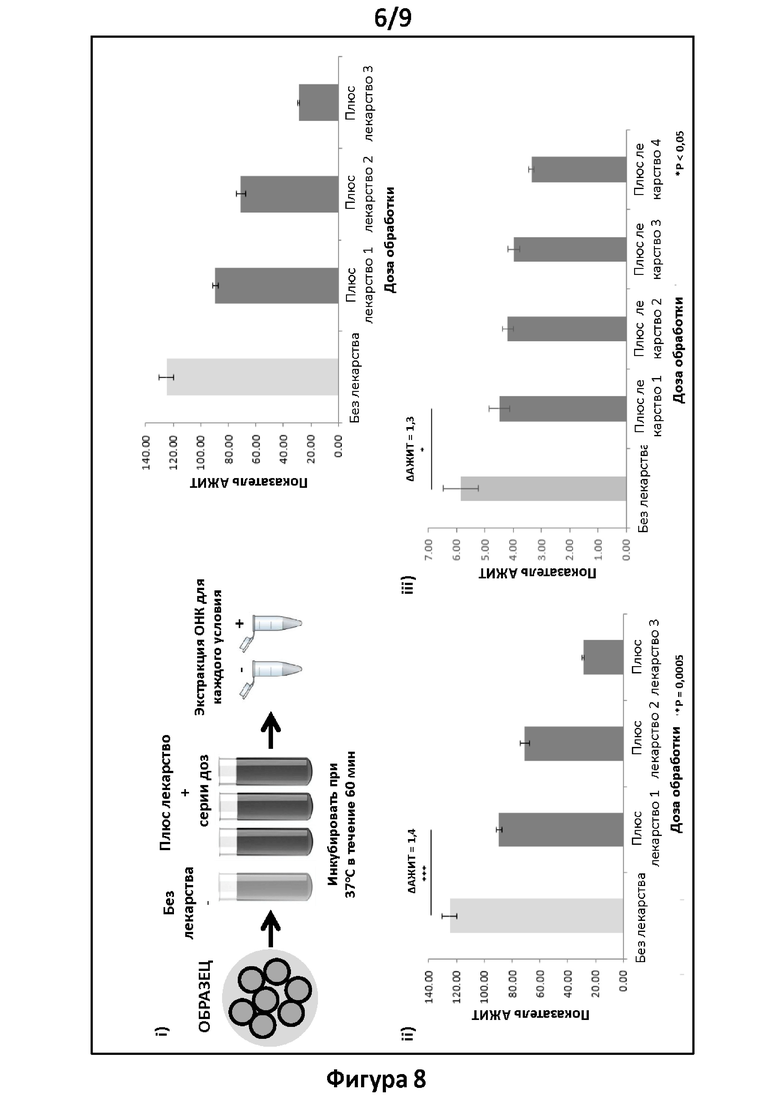


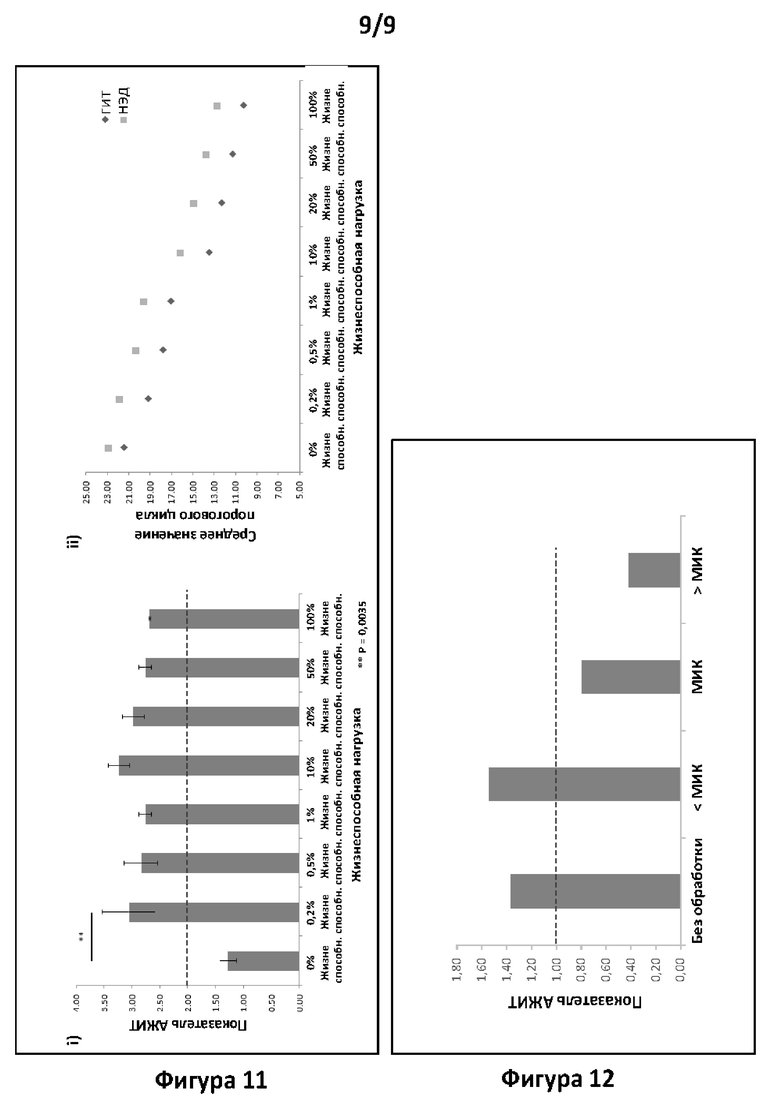
Настоящее изобретение относится к области молекулярной биологии. Описан способ нормировки количественных данных, полученных в результате амплификации нуклеиновых кислот из клетки, организма или вируса, включающий получение количественных данных в результате амплификации геномной ДНК первого гена и РНК, транскрибированной с указанного первого гена, и в результате амплификации последовательности нетранскрибируемой ДНК в указанной клетке, организме или вирусе. А также применение указанных количественных данных для получения нормированного значения, представляющего собой отношение количеств указанных геномной ДНК и транскриптов РНК указанного первого гена к таковым для указанной последовательности нетранскрибируемой ДНК, присутствующих в образце нуклеиновых кислот перед проведением указанной амплификации. Техническим результатом использования изобретения является совместная амплификация в рамках одной количественной реакции ПЦР различных молекул и участков генома ДНК и соответствующей ей РНК из гена, а также последовательность ДНК, которая не транскрибируется, благодаря чему можно нормировать уровни РНК на ДНК, присутствующие в одном образце и тем самым установить уровни транскрипции в клетках, организмах и вирусах. 39 з.п. ф-лы, 13 ил., 18 табл., 18 пр.
1. Способ нормировки количественных данных, полученных в результате амплификации нуклеиновых кислот из клетки, организма или вируса, указанный способ включает:
(i) получение количественных данных
в результате амплификации геномной ДНК первого гена и РНК, транскрибированной с указанного первого гена, и
в результате амплификации последовательности нетранскрибируемой ДНК в указанной клетке, организме или вирусе; и
(ii) применение указанных количественных данных для получения нормированного значения (nV), представляющего собой отношение количеств
указанных геномной ДНК и транскриптов РНК указанного первого гена к таковым для
указанной последовательности нетранскрибируемой ДНК,
присутствующих в образце нуклеиновых кислот перед проведением указанной амплификации, причем указанную геномную ДНК первого гена и РНК, транскрибированную с первого гена, а также указанную последовательность нетранскрибируемой ДНК совместно амплифицируют в одной реакции.
2. Способ по п. 1, отличающийся тем, что указанные количественные данные представляют собой число копий ампликона, и указанный способ включает:
- получение значения A (vA), представляющего собой общее количество ампликонов, полученных в результате амплификации указанных геномной ДНК и транскриптов РНК указанного первого гена, и значения B (vB), представляющего собой общее количество ампликонов, полученных из последовательности нетранскрибируемой ДНК;
- вычисление нормированного значения (nV) с применением уравнения
vA/vB = nV
или эквивалентной его формы.
3. Способ по п. 1, отличающийся тем, что указанные количественные данные представляют собой число копий ампликона, и указанный способ включает:
- получение значения vX, представляющего собой общее количество ампликонов, полученных в результате амплификации геномной ДНК и транскриптов РНК с указанного первого гена и амплификации геномной ДНК и транскриптов РНК с по меньшей мере одного дополнительного гена;
- получение значения B (vB), представляющего собой общее количество ампликонов, полученных с последовательности нетранскрибируемой ДНК;
- вычисление нормированного значения (nV) с применением уравнения
vX / (vB x (X+1)) = nV
или эквивалентной его формы,
где X представляет собой количество указанного(ых) дополнительного(ых) гена(ов).
4. Способ по п. 2 или 3, отличающийся тем, что амплификация представляет собой цифровую полимеразную цепную реакцию (цПЦР).
5. Способ по п. 1, отличающийся тем, что указанные количественные данные представляют собой пороговое значение (Ct), и указанный способ включает:
- получение порогового значения цикла CtA для амплификации указанных геномной ДНК и транскриптов РНК указанного первого гена;
- получение порогового значения цикла CtB для амплификации последовательности нетранскрибируемой ДНК; и
- вычисление нормированного значения (nV) с применением уравнения
2CtB - CtA = nV
или эквивалентной его формы.
6. Способ по п. 1, отличающийся тем, что указанные количественные данные представляют собой пороговое значение (Ct), и указанный способ включает:
- получение порогового значения цикла CtX для амплификации указанных геномной ДНК и транскриптов РНК указанного первого гена и амплификации геномной ДНК и транскриптов РНК с по меньшей мере одного дополнительного гена;
- получение порогового значения цикла CtB для амплификации последовательности нетранскрибируемой ДНК; и
- вычисление нормированного значения (nV) с применением уравнения
2CtB - CtX/ (X +1) = nV
или эквивалентной его формы,
где X представляет собой количество указанного(ых) дополнительного(ых) гена(ов).
7. Способ по п. 5 или 6, отличающийся тем, что амплификация представляет собой количественную полимеразную цепную реакцию (кПЦР).
8. Способ по любому из пп. 1 - 7, отличающийся тем, что последовательность нетранскрибируемой ДНК представляет собой геномную ДНК.
9. Способ по любому из пп. 1 - 8, дополнительно включающий проведение указанной амплификации нуклеиновых кислот из клетки, организма или вируса.
10. Способ по любому из пп. 1 - 9, отличающийся тем, что указанные нуклеиновые кислоты из клетки, организма или вируса представляют собой экстракт общих нуклеиновых кислот.
11. Способ по любому из пп. 1 – 3 или 5 - 7, отличающийся тем, что любую указанную амплификацию проводят, применяя полимеразную цепную реакцию (ПЦР), полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), амплификацию с замещением цепи (SDA), изотермическую амплификацию с формированием петель (LAMP), амплификацию по типу катящегося кольца (RCA), рекомбиназную полимеразную амплификацию (RPA), геликаза-зависимую амплификацию (HDA), амплификацию на основе встраивания в цепь (SIBA), опосредованную транскрипцией амплификацию (TMA), самоподдерживающуюся репликацию последовательностей (3SR), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), или любую комбинацию перечисленных способов амплификации.
12. Способ по любому из пп. 1 - 11, дополнительно включающий применение нормированного значения (nV) для оценки уровня транскрипционной активности в клетке, организме или вирусе.
13. Способ по любому из пп. 1 - 12, дополнительно включающий:
- получение нормированного значения для отсутствия транскрипции (nV-), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности; и
- сравнение нормированного значения (nV), полученного в результате указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для отсутствия транскрипции (nV-), чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
14. Способ по п. 13, отличающийся тем, что нормированное значение для отсутствия транскрипции (nV-) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
15. Способ по п. 13 или 14, отличающийся тем, что:
нормированное значение для отсутствия транскрипции (nV-) используют в качестве исходного значения для оценки наличия или отсутствия транскрипционной активности в клетке, организме или вирусе; и
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или ниже нормированного значения для отсутствия транскрипции (nV-), то это свидетельствует об отсутствии транскрипционной активности; или
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, выше нормированного значения для отсутствия транскрипции (nV-), то это свидетельствует о наличии транскрипционной активности.
16. Способ по любому из пп. 13 - 15, отличающийся тем, что указанное нормированное значение для отсутствия транскрипции (nV-):
- включает статистическую вариабельность в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности; и/или
- обеспечено доверительным интервалом, в котором указанное нормированное значение для отсутствия транскрипции (nV-) позволяет предсказать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе, при этом указанный доверительный интервал больше чем 90% или больше чем 95%.
17. Способ по любому из пп. 13 - 16, дополнительно включающий:
- получение нормированного значения для наличия транскрипции (nV+), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и
- сравнение нормированного значения (nV), полученного в результате указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для наличия транскрипции (nV+), чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
18. Способ по п. 17, отличающийся тем, что указанное нормированное значение для наличия транскрипции (nV+) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
19. Способ по п. 17 или 18, отличающийся тем, что:
нормированное значение для наличия транскрипции (nV+) используют в качестве исходного значения для оценки транскрипционной активности в клетке, организме или вирусе; и
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, ниже нормированного значения для наличия транскрипции (nV+), то это свидетельствует о недостатке или отсутствии транскрипционной активности; или
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или выше нормированного значения для наличия транскрипции (nV+), то это свидетельствует о наличии транскрипционной активности.
20. Способ по любому из пп. 17 - 19, отличающийся тем, что указанное нормированное значение для наличия транскрипции (nV+):
- включает статистическую вариабельность в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и/или
- обеспечено доверительным интервалом, в котором указанное нормированное значение для наличия транскрипции (nV+) позволяет предсказать наличие или отсутствие транскрипционной активности в клетке, организме или вирусе, причем указанный доверительный интервал больше чем 90% или больше чем 95%.
21. Способ по п. 13, дополнительно включающий:
- получение нормированного значения для отсутствия транскрипции (nV-), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них нет транскрипционной активности;
- получение нормированного значения для наличия транскрипции (nV+), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которые известно, что у них есть транскрипционная активность; и
- сравнение нормированного значения (nV), полученного в результате указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для отсутствия транскрипции (nV-) и нормированным значением для наличия транскрипции (nV+), чтобы посредством этого оценить уровень транскрипционной активности в клетке, организме или вирусе.
22. Способ по любому из пп. 12 - 21, отличающийся тем, что уровень транскрипционной активности в клетке, организме или вирусе оценивают с целью определения любого одного или нескольких из следующих признаков:
- жизнеспособности исследуемой клетки или исследуемого организма;
- являются ли исследуемые клетка, организм или вирус живыми или мертвыми;
- нарушения транскрипции в исследуемых клетке, организме или вирусе.
23. Способ по любому из пп. 1 - 11, дополнительно включающий применение нормированного значения (nV) для оценки уровня устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса, отличающийся тем, что:
- указанную клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, и
- указанное нормированное значение (nV) сравнивают с контрольным нормированным значением (cnV), полученным с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они:
(i) устойчивы к указанному лекарственному средству; или
(ii) чувствительны к указанному лекарственному средству,
чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса.
24. Способ по любому из пп. 1 - 11 или 23, дополнительно включающий:
- получение нормированного значения для чувствительности к лекарственному средству (dsV), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они чувствительны к указанному лекарственному средству; и
- сравнение нормированного значения (nV), полученного в результате указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для чувствительности к лекарственному средству (dsV), чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству в клетке, организме или вирусе, при этом указанные клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот.
25. Способ по п. 24, отличающийся тем, что нормированное значение для чувствительности к лекарственному средству (dsV) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
26. Способ по п. 24 или 25, отличающийся тем, что:
нормированное значение для чувствительности к лекарственному средству (dsV) используют в качестве исходного значения для оценки наличия или отсутствия устойчивости или чувствительности к лекарственному средству у клетки, организма или вируса; и
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, выше нормированного значения для чувствительности к лекарственному средству (dsV), то это свидетельствует об устойчивости к лекарственному средству; или
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или ниже нормированного значения для чувствительности к лекарственному средству (dsV), то это свидетельствует о чувствительности к лекарственному средству.
27. Способ по любому из пп. 24 - 26, отличающийся тем, что указанное нормированное значение для чувствительности к лекарственному средству (dsV):
- включает статистическую вариабельность в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они чувствительны к указанному лекарственному средству; и/или
- обеспечено доверительным интервалом, в котором указанное нормированное значение для чувствительности к лекарственному средству (dsV) позволяет предсказать наличие или отсутствие:
(i) устойчивости к лекарственному средству у клетки, организма или вируса; или
(ii) чувствительности к лекарственному средству у клетки, организма или вируса,
причем указанный доверительный интервал больше чем 90% или больше чем 95%.
28. Способ по любому из пп. 1 - 11 или 23, дополнительно включающий:
- получение нормированного значения для устойчивости к лекарственному средству (drV), полученного с применением серии указанных нормированных значений (nV), полученных для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они устойчивы к указанному лекарственному средству; и
- сравнение нормированного значения (nV), полученного в результате указанной амплификации нуклеиновых кислот из клетки, организма или вируса, с нормированным значением для устойчивости к лекарственному средству (drV), чтобы посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству в клетке, организме или вирусе, при этом указанные клетку, организм или вирус подвергают воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот.
29. Способ по п. 28, отличающийся тем, что нормированное значение для устойчивости к лекарственному средству (drV) представляет собой среднее значение, полученное для указанной серии указанных нормированных значений (nV).
30. Способ по п. 28 или 29, отличающийся тем, что:
нормированное значение для устойчивости к лекарственному средству (drV) используют в качестве исходного значения для оценки наличия или отсутствия устойчивости или чувствительности к лекарственному средству у клетки, организма или вируса; и
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, равно или выше нормированного значения для устойчивости к лекарственному средству (drV), то это свидетельствует об устойчивости к лекарственному средству; или
если нормированное значение (nV), полученное путем указанной амплификации нуклеиновых кислот из клетки, организма или вируса, ниже нормированного значения для устойчивости к лекарственному средству (drV), то это свидетельствует о чувствительности к лекарственному средству.
31. Способ по любому из пп. 28 - 30, отличающийся тем, что указанное нормированное значение для устойчивости к лекарственному средству (drV):
- включает статистическую вариабельность в указанной серии нормированных значений (nV) для индивидов из популяции клеток, организмов или вирусов, про которых известно, что они устойчивы к указанному лекарственному средству; и/или
- обеспечено доверительным интервалом, в котором указанное нормированное значение для устойчивости к лекарственному средству (drV) позволяет предсказать наличие или отсутствие:
(i) устойчивости к лекарственному средству у клетки, организма или вируса; или
(ii) чувствительности к лекарственному средству у клетки, организма или вируса,
причем указанный доверительный интервал больше чем 90% или больше чем 95%.
32. Способ согласно одному из пп. 1 - 11, дополнительно включающий применение нормированного значения (nV) для оценки уровня устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса, отличающийся тем, что:
- первую популяцию указанных клеток, организмов или вирусов, которых подвергали воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, используют для получения первого указанного нормированного значения (nV),
- вторую популяцию указанных клеток, организмов или вирусов, которых не подвергали воздействию лекарственного средства перед указанной амплификацией нуклеиновых кислот, используют для получения второго указанного нормированного значения (nV),
- указанное первое нормированное значение (nV) и указанное второе нормированное значение (nV) сравнивают, чтобы оценить уровень транскрипционной активности в клетке, организме или вирусе под воздействием или без воздействия лекарственного средства и посредством этого оценить уровень устойчивости к лекарственному средству или чувствительности к лекарственному средству у клетки, организма или вируса.
33. Способ по п. 32, отличающийся тем, что если указанное первое нормированное значение (nV) ниже, чем указанное второе нормированное значение (nV), то это свидетельствует о чувствительности к указанному лекарственному средству.
34. Способ по любому из пп. 23 - 33, отличающийся тем, что лекарственное средство представляет собой противомикробное средство.
35. Способ по любому из пп. 23 - 34, отличающийся тем, что лекарственное средство представляет собой противомикробное средство класса, выбранного из: аминогликозидов, ансамицинов, карбацефема, карбапенемов, цефалоспоринов, гликопептидов, макролидов, пенициллинов, монобактамов, полипептидов, хинолонов, сульфонамидов, тетрациклинов.
36. Способ по любому из пп. 23 - 35, отличающийся тем, что лекарственное средство представляет собой ципрофлоксацин, азитромицин, рифампицин или доксициклин.
37. Способ по любому из пп. 23 - 36, отличающийся тем, что первый ген представляет собой ген из вида Chlamydia (например, Chlamydia trachomatis), из вида Gonorrhea или из вида Mycoplasma (например, Mycoplasma genitralium).
38. Способ по п. 37, отличающийся тем, что указанная реакция включает применение обратной транскриптазы.
39. Способ по любому из пп. 1 - 38, отличающийся тем, что клетка представляет собой клетку млекопитающего, клетку человека, клетку животного, клетку растения, бактериальную клетку, клетку-хозяина, инфицированную вирусами, или клетку-хозяина, инфицированную бактериями.
40. Способ по любому из пп. 1 - 38, отличающийся тем, что организм представляет собой млекопитающее, человека, растение, бактерию, вирус, гриб, водоросль, архею или простейшее.
| LAURELL H | |||
| ET AL | |||
| Correction of RT-qPCR data for genomic DNA-derived signals with ValidPrime | |||
| Nucleic Acids Research | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| WO 2012171997 A1 (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE; LAURELL H.; KUBISTA М.; IACOVONI J.), 20.12.2012, реферат, формула изобретения | |||
| WO 2011106368 A2 (ILLUMINA, | |||
Авторы
Даты
2023-09-12—Публикация
2018-12-21—Подача