Настоящее изобретение относится к производному пирролидина.
Три типа моноаминов, известных как серотонин, норэпинефрин и допамин, действуют в организме в качестве нейротрансмиттеров. Поэтому фармацевтические препараты, обладающие ингибирующим действием повторного поглощения моноаминов, широко использовались в качестве терапевтических фармацевтических препаратов при заболеваниях центральной и периферической нервной системы.
Многие фармацевтические препараты, используемые до настоящего времени для лечения депрессии, селективно ингибируют повторное поглощение норэпинефрина или серотонина. Примеры таких фармацевтических препаратов включают имипрамин (антидепрессант первого поколения), мапротилин (антидепрессант второго поколения), селективные ингибиторы поглощения серотонина, такие как флуоксетин (SSRI, антидепрессанты третьего поколения), ингибиторы повторного поглощения серотонина и/или норэпинефрина, такие как венлафаксин (SNRI, антидепрессанты четвертого поколения), и тому подобное (см. Sadanori Miura, Rinshoseishinyakuri (Japanese Journal of Clinical Psychopharmacology), 2000, 3: 311-318).
Однако требуется по меньшей мере три недели для проявления указанными фармацевтическими препаратами их терапевтического действия, и, более того, указанные фармацевтические препараты не проявляют в достаточной степени действие у приблизительно 30% пациентов, страдающих депрессией (см. Phil Skolnick, European Journal of Pharmacology, 2001, 375: 31-40).
Целью данного изобретения является разработка фармацевтического препарата, обладающего более широким спектром терапевтического воздействия, чем известные антидепрессанты, и при этом способного проявлять достаточный терапевтический эффект после кратковременного введения.
Авторы настоящего изобретения провели интенсивные исследования для достижения вышеуказанной цели и обнаружили, что производное пирролидина, представленное ниже формулой (1), может быть использовано для получения такого желаемого фармацевтического препарата. Настоящее изобретение было создано на основе данного открытия.
Настоящее изобретение относится к соединению пирролидина, композиции, содержащей указанное соединение, агенту, содержащему указанное соединение, применению указанного соединения, способу лечения нарушения и способу получения указанного соединение, как описано ниже в пунктах 1-14.
Пункт 1. Производное пирролидина общей формулы (1)
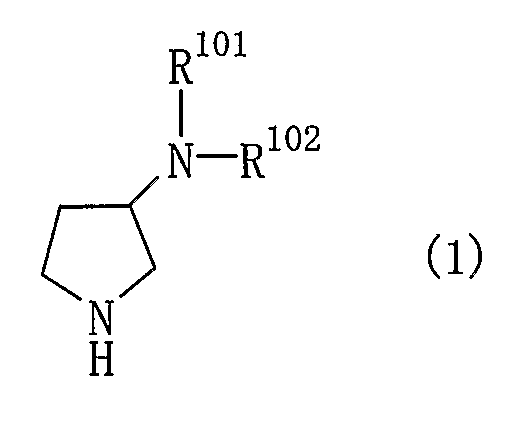
или его соль,
где R101 и R102, каждый независимо, представляют собой одну из следующих групп (1)-(86):
(1) фенильную группу,
(2) пиридильную группу,
(3) бензотиенильную группу,
(4) индолильную группу,
(5) 2,3-дигидро-1H-инденильную группу,
(6) нафтильную группу,
(7) бензофурильную группу,
(8) хинолильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(12) бензотиазолильную группу,
(13) тиено[3,2-b]пиридильную группу,
(14) тиенильную группу,
(15) циклоалкильную группу,
(16) тетрагидропиранильную группу,
(17) пирролильную группу,
(18) 2,4-дигидро-1,3-бензодиоксинильную группу,
(19) 2,3-дигидробензофурильную группу,
(20) 9H-флуоренильную группу,
(21) пиразолильную группу,
(22) пиридазинильную группу,
(23) индолинильную группу,
(24) тиено[2,3-b]пиридильную группу,
(25) тиено[3,2-d]пиримидинильную группу,
(26) тиено[3,2-e]пиримидинильную группу,
(27) 1H-пиразолo[3,4-b]пиридильную группу,
(28) изохинолильную группу,
(29) 2,3-дигидро-1,4-бензоксадинильную группу,
(30) хиноксалинильную группу,
(31) хиназолинильную группу,
(32) 1,2,3,4-тетрагидрохинолильную группу,
(33) циклоалкил низшую алкильную группу,
(34) низший алкилтио низшую алкильную группу,
(35) амино-замещенную низшую алкильную группу, необязательно замещенную одной или двумя низшими алкильными группами на аминогруппе,
(36) фенокси низшую алкильную группу,
(37) пиридинилокси низшую алкильную группу,
(38) низшую алкинильную группу,
(39) фенил низшую алкенильную группу,
(40) 1,3-бензодиоксолильную группу,
(41) 2,3-дигидро-1,4-бензодиоксинильную группу,
(42) 3,4-дигидро-1,5-бензодиоксепинильную группу,
(43) дигидропиридильную группу,
(44) 1,2-дигидрохинолильную группу,
(45) 1,2,3,4-тетрагидроизохинолильную группу,
(46) бензоксазолильную группу,
(47) бензоизотиазолильную группу,
(48) индазолильную группу,
(49) бензоимидазолильную группу,
(50) имидазолильную группу,
(51) 1,2,3,4-тетрагидронафтил низшую алкильную группу,
(52) имидазо[1,2-a]пиридил низшую алкильную группу,
(53) тиазолил низшую алкильную группу,
(54) тетрагидропиранил низшую алкильную группу,
(55) пиперидил низшую алкильную группу,
(56)дифенил низший алкокси-замещенную низшую алкильную группу,
(57) низший алкоксикарбонил-замещенную низшую алкильную группу,
(58) фенил низший алкоксикарбонил-замещенную низшую алкильную группу,
(59) гидрокси-замещенную низшую алкильную группу,
(60) низший алкокси низшую алкильную группу,
(61) карбокси низшую алкильную группу,
(62) карбамоил-замещенную низшую алкильную группу, необязательно замещенную одной или двумя низшими алкильными группами на карбамоильной группе,
(63) низшую алкенильную группу,
(64) морфолинилкарбонил низшую алкильную группу,
(65) бензоил низшую алкильную группу,
(66) фенилтио низшую алкильную группу,
(67) нафтилтио низшую алкильную группу,
(68) циклоалкилтио низшую алкильную группу,
(69) пиридилтио низшую алкильную группу,
(70) пиримидинилтио низшую алкильную группу,
(71) фурилтио низшую алкильную группу,
(72) тиенилтио низшую алкильную группу,
(73) 1,3,4-тиадиазолилтио низшую алкильную группу,
(74) бензимидазолилтио низшую алкильную группу,
(75) бензтиазолилтио низшую алкильную группу,
(76) тетразолилтио низшую алкильную группу,
(77) бензоксазолилтио низшую алкильную группу,
(78) тиазолилтио низшую алкильную группу,
(79) имидазолилтио низшую алкильную группу,
(80) амино-замещенный низший алкилтио низшую алкильную группу, необязательно замещенную одной или двумя низшими алкильными группами на аминогруппе,
(81) фенил-замещенный низший алкилтио низшую алкильную группу,
(82) фурил-замещенный низший алкилтио низшую алкильную группу,
(83) пиридил-замещенный низший алкилтио низшую алкильную группу,
(84) гидрокси-замещенный низший алкилтио низшую алкильную группу,
(85) фенокси-замещенный низший алкилтио низшую алкильную группу и
(86) низший алкоксикарбонил-замещенный низший алкилтио низшую алкильную группу,
и каждая из групп (1)-(32), (37), (39)-(56), (64)-(79), (81)-(83) и (85) может иметь один или несколько заместителей, выбранных из следующих групп (1-1)-(1-37) в циклоалкильном, ароматическом или гетероциклическом кольце, таких как
(1-1) атомы галогена,
(1-2) низшие алкилтиогруппы, необязательно замещенные одним или несколькими атомами галогена,
(1-3) низшие алкильные группы, необязательно замещенные одним или несколькими атомами галогена,
(1-4) низшие алкоксигруппы, необязательно замещенные одним или несколькими атомами галогена,
(1-5) нитрогруппа,
(1-6) низшие алкоксикарбонильные группы,
(1-7) аминогруппы, необязательно замещенные одной или двумя низшими алкильными группами,
(1-8) низшие алкилсульфонильные группы,
(1-9) цианогруппа,
(1-10) карбоксигруппа,
(1-11) гидроксигруппа,
(1-12) тиенильные группы,
(1-13) оксазолильные группы,
(1-14) нафтильные группы,
(1-15) бензоильная группа,
(1-16) феноксигруппы, необязательно замещенные одним-тремя атомами галогена в фенильном кольце,
(1-17) фенил низшие алкоксигруппы,
(1-18) низшие алканоильные группы,
(1-19) фенильные группы, необязательно замещенные в фенильном кольце одним-пятью заместителями, выбранными из группы, содержащей атомы галогена, низшие алкоксигруппы, цианогруппу, низшие алканоильные группы и низшие алкильные группы,
(1-20) фенил низшие алкильные группы,
(1-21) циано низшие алкильные группы,
(1-22) сульфонильные группы, замещенные 5-7-членной насыщенной гетероциклической группой, при этом гетероциклическая группа содержит в гетероциклическом кольце один или два гетероатома, выбранные из группы, содержащей азот, кислород и серу,
(1-23) тиазолильные группы, необязательно замещенные одной или двумя низшими алкильными группами в тиазольном кольце,
(1-24) имидазолильные группы,
(1-25) амино низшие алкильные группы, необязательно замещенные одной или двумя низшими алкильными группами на аминогруппе,
(1-26) пирролидинил низшие алкоксигруппы,
(1-27) изоксазолильные группы,
(1-28) циклоалкилкарбонильные группы,
(1-29) нафтилоксигруппы,
(1-30) пиридильные группы,
(1-31) фурильные группы,
(1-32) фенилтиогруппа,
(1-33) оксогруппа,
(1-34) карбамоильная группа,
(1-35) 5-7-членные насыщенные гетероциклические группы, содержащие один или два гетероатома, выбранные из группы, содержащей азот, кислород и серу, при этом гетероциклическая группа необязательно замещена одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы,
(1-36) оксидогруппа и
(1-37) низшие алкоксидогруппы,
при условии, что R101 и R102 не являются одновременно незамещенным фенилом.
Пункт 2. Производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 1, где
R101 представляет собой
(1) фенильную группу,
(3) бензотиенильную группу,
(4) индолильную группу,
(5) 2,3-дигидро-1H-инденильную группу,
(6) нафтильную группу,
(7) бензофурильную группу,
(8) хинолильную группу,
(12) бензотиазолильную группу,
(18) 2,4-дигидро-1,3-бензодиоксинильную группу,
(19) 2,3-дигидробензофурильную группу,
(20) 9H-флуоренильную группу,
(23) индолинильную группу,
(28) изохинолильную группу,
(29) 2,3-дигидро-1,4-бензоксадинильную группу,
(30) хиноксалинильную группу,
(31) хиназолинильную группу,
(32) 1,2,3,4-тетрагидрохинолильную группу,
(40) 1,3-бензодиоксолильную группу,
(41) 2,3-дигидро-1,4-бензодиоксинильную группу,
(42) 3,4-дигидро-1,5-бензодиоксепинильную группу,
(44) 1,2-дигидрохинолильную группу,
(45) 1,2,3,4-тетрагидроизохинолильную группу,
(46) бензоксазолильную группу,
(47) бензоизотиазолильную группу,
(48) индазолильную группу или
(49) бензоимидазолильную группу,
и каждая из которых может иметь в ароматическом или гетероциклическом кольце один-три заместителя, выбранных из группы (1-1)-(1-37), как указано в пункте 1.
Пункт 3. Производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 2, где
R101 представляет собой
(1) фенильную группу или
(3) бензотиенильную группу,
и каждая из которых может иметь в ароматическом или гетероциклическом кольце один-три заместителя, выбранных из группы, содержащей (1-1) атомы галогена и (1-3) низшие алкильные группы, необязательно замещенные одним-тремя атомами галогена.
Пункт 4. Производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 3, где
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(14) тиенильную группу,
(48) индазолильную группу,
(59) гидрокси-замещенную низшую алкильную группу или
(60) низший алкокси низшую алкильную группу,
и каждая из групп (1), (2), (9), (10), (11), (14) и (48) может иметь в ароматическом или гетероциклическом кольце один-три заместителя, выбранных из группы (1-1)-(1-37), как указано в пункте 1.
Пункт 5. Производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 4, где
R101 представляет собой
моногалогенфенильную группу, дигалогенфенильную группу или фенильную группу, замещенную одним атомом галогена и одной низшей алкильной группой,
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(14) тиенильную группу,
(48) индазолильную группу,
(59) гидрокси-замещенную низшую алкильную группу или
(60) низший алкокси низшую алкильную группу,
и каждая из групп (1), (2), (9), (10), (11), (14) и (48) может иметь в ароматическом или гетероциклическом кольце один или два заместителя, выбранные из группы, содержащей (1-1) атомы галогена, (1-3) низшие алкильные группы, необязательно замещенные одним или несколькими атомами галогена, и (1-9) цианогруппу.
Пункт 6. Производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 5, выбранные из группы, содержащей:
(4-хлорфенил)фенил-(S)-пирролидин-3-иламин,
(4-фторфенил)фенил-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)фенил-(S)-пирролидин-3-иламин,
бис-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-ил-п-толиламин,
4-[(S)-(4-фтор-3-метилфенил)пирролидин-3-иламино]бензонитрил,
бис-(3-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)пиримидин-5-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиразин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(5-хлорпиридин-2-ил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(6-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(3,4-дихлорфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиофен-3-иламин,
(3-хлор-4-фторфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(4-фтор-3-метилфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
2-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]этанол,
1-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]-2-метилпропан-2-ол,
(3-хлор-4-фторфенил)-(2-метоксиэтил)-(S)-пирролидин-3-иламин иламин,
3-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]пропан-1-ол,
(3-хлор-4-фторфенил)-(3-метоксипропил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(1-метил-1H-индазол-5-ил)-(S)-пирролидин-3-иламин,
бензо[b]тиофен-6-ил-(S)-пирролидин-3-илтиофен-3-иламин и
бензо[b]тиофен-5-ил-(S)-пирролидин-3-илтиофен-3-иламин.
Пункт 7. Фармацевтическая композиция, содержащая производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 1 в качестве активного ингредиента и фармацевтически приемлемый носитель.
Пункт 8. Профилактический и/или терапевтический агент при нарушениях, вызванных уменьшением нейротрансмиссии серотонина, норэпинефрина или допамина, содержащий в качестве активного ингредиента производное пирролидина общей формулы (1) или его соль в соответствии с пунктом 1.
Пункт 9. Профилактический и/или терапевтический агент в соответствии с пунктом 8, где нарушение выбрано из группы, включающей гипертензию; депрессию; тревогу; страх; синдром посттравматического стресса; синдром острого стресса; избегающее расстройство личности; дизморфизм тела; преждевременную эякуляцию; нарушения питания; ожирение; пристрастия к химическим веществам, алкоголю, кокаину, героину, фенобарбиталу, никотину и бензодиазепинам; кластерную головную боль; мигрень; болевые расстройства; болезнь Альцгеймера; обсессивно-конвульсивные расстройства; панические расстройства; расстройства памяти; болезнь Паркинсона; эндокринные нарушения; сосудистый спазм; церебральную атаксию; расстройства желудочно-кишечного тракта; отрицательный синдром шизофрении; предменструальный синдром; синдром фибромиалгии; несдержанность в стрессовых ситуациях; синдром Туретта; трихотилломанию; клептоманию; мужскую импотенцию; нарушение внимания с гиперактивностью (ADHD); хроническую парксизмальную гемикранию; хроническую усталость; катаплексию; синдром апноэ во сне и головную боль.
Пункт 10. Профилактический и/или терапевтический агент в соответствии с пунктом 8, где нарушение выбрано из группы, содержащей:
депрессии, выбранные из группы, включающей глубокую депрессию; биполярное расстройство 1; биполярное расстройство 2; смешанный эпизод; дистимические расстройства; «быстрый цикл»; атипичную депрессию; сезонные аффективные расстройства; послеродовую депрессию; слабую депрессию; повторяющиеся краткие депрессивные расстройства; непостоянную депрессию/хроническую депрессию; двойную депрессию; вызванные алкоголем нарушения настроения; смешанную тревогу и депрессивные расстройства; депрессии, вызванные различными физическими нарушениями, выбранными из группы, содержащей болезнь Кушинга; гипотироидизм, синдром гиперпаратироидизма, болезнь Аддисона, синдром отсутствия месячных и лактации, болезнь Паркинсона, болезнь Альцгеймера, кровоизлияние в мозг, диабеты, синдром хронической усталости и рак; депрессию среднего возраста; старческую депрессию; детскую и подростковую депрессию; депрессию, вызванную приемом интерферонов; депрессию, вызванную нарушением адаптации; и беспокойства, выбранные из группы, содержащей беспокойство, вызванное нарушением адаптации, и беспокойство, вызванное невропатией, выбранные из группы, содержащей травму головы, мозговую инфекцию и заболевание внутреннего уха.
Пункт 11. Применение пирролидинового соединения общей формулы (1) или его соли в соответствии с любым из пунктов 1-6 в качестве лекарственного средства.
Пункт 12. Применение производного пирролидина общей формулы (1) или его соли в соответствии с любым из пунктов 1-6 в качестве ингибитора повторного поглощения серотонина и/или ингибитора повторного поглощения норэпинефрина, и/или ингибитора повторного поглощения допамина.
Пункт 13. Способ лечения или предупреждения нарушений, вызванных уменьшением нейротрансмиссии серотонина, норэпинефрина или допамина, включающий введение производного пирролидина общей формулы (1) или его соли в соответствии с любым из пунктов 1-6 человеку или животному.
Пункт 14. Способ получения производного пирролидина общей формулы (1):
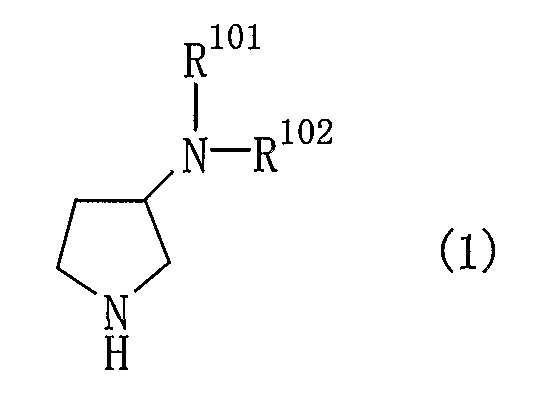
или его соли, где R101 и R102 являются такими, как определено выше в пункте 1,
заключающийся в том, что
(1) соединение общей формулы (2)
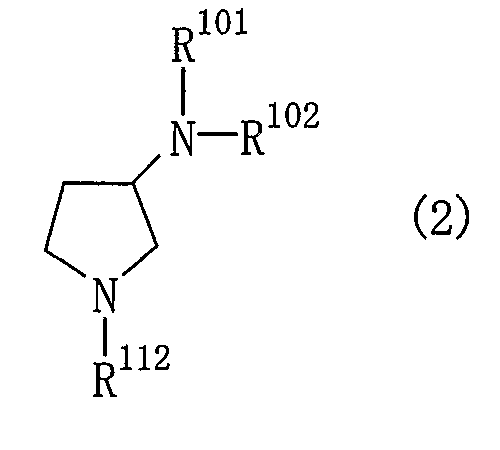
где R101 и R102 являются такими, как определено выше в пункте 1, и R112 представляет собой амино-защитную группу, подвергают реакции элиминирования для удаления амино-защитной группы.
Предпочтительные варианты осуществления производного пирролидина (1) включают соединения, представленные общей формулой (1)
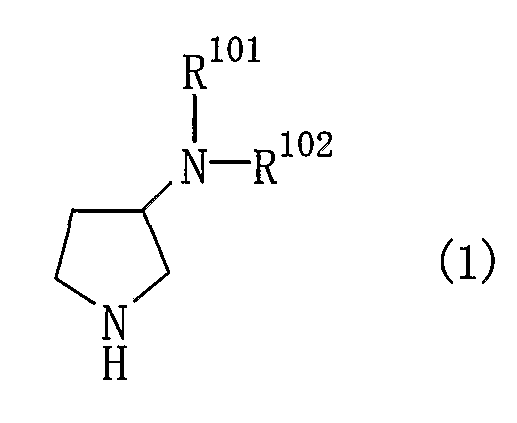
и их соли,
где R101 представляет собой
(1) фенильную группу,
(3) бензотиенильную группу,
(4) индолильную группу,
(5) 2,3-дигидро-1H-инденильную группу,
(6) нафтильную группу,
(7) бензофурильную группу,
(8) хинолильную группу,
(12) бензотиазолильную группу,
(18) 2,4-дигидро-1,3-бензодиоксинильную группу,
(19) 2,3-дигидробензофурильную группу,
(20) 9H-флуоренильную группу,
(23) индолинильную группу,
(28) изохинолильную группу,
(29) 2,3-дигидро-1,4-бензоксадинильную группу,
(30) хиноксалинильную группу,
(31) хиназолинильную группу,
(32) 1,2,3,4-тетрагидрохинолильную группу,
(40) 1,3-бензодиоксолильную группу,
(41) 2,3-дигидро-1,4-бензодиоксинильную группу,
(42) 3,4-дигидро-1,5-бензодиоксепинильную группу,
(44) 1,2-дигидрохинолильную группу,
(45) 1,2,3,4-тетрагидроизохинолильную группу,
(46) бензоксазолильную группу,
(47) бензоизотиазолильную группу,
(48) индазолильную группу или
(49) бензоимидазолильную группу,
и каждая из которых может иметь в ароматическом или гетероциклическом кольце один-пять (предпочтительно один-три) заместителей, выбранных из следующих (1-1)-(1-37):
(1-1) атомы галогена,
(1-2) низшие алкилтиогруппы, необязательно замещенные одним или несколькими (предпочтительно одним-тремя) атомами галогена,
(1-3) низшие алкильные группы, необязательно замещенные одним или несколькими (предпочтительно одним-тремя) атомами галогена,
(1-4) низшие алкоксигруппы, необязательно замещенные одним или несколькими (предпочтительно одним-четырьмя) атомами галогена,
(1-5) нитрогруппа,
(1-6) низшие алкоксикарбонильные группы,
(1-7) аминогруппы, необязательно замещенные одной или двумя низшими алкильными группами,
(1-8) низшие алкилсульфонильные группы,
(1-9) цианогруппа,
(1-10) карбоксигруппа,
(1-11) гидроксигруппа,
(1-12) тиенильные группы,
(1-13) оксазолильные группы,
(1-14) нафтильные группы,
(1-15) бензоильная группа,
(1-16) феноксигруппы, необязательно замещенные одним-тремя атомами галогена в фенильном кольце,
(1-17) фенил низшие алкоксигруппы,
(1-18) низшие алканоильные группы,
(1-19) фенильные группы, необязательно замещенные в фенильном кольце одним-пятью (предпочтительно одним-тремя) заместителями, выбранными из группы, содержащей атомы галогена, низшие алкоксигруппы, цианогруппу, низшие алканоильные группы и низшие алкильные группы,
(1-20) фенил низшие алкильные группы,
(1-21) циано низшие алкильные группы,
(1-22) сульфонильные группы, замещенные 5-7-членной насыщенной гетероциклической группой, при этом гетероциклическая группа содержит в гетероциклическом кольце один или два атома азота (предпочтительно пиперидилсульфонил),
(1-23) тиазолильные группы, необязательно замещенные одной или двумя низшими алкильными группами в тиазольном кольце,
(1-24) имидазолильные группы,
(1-25) амино низшие алкильные группы, необязательно замещенные одной или двумя низшими алкильными группами на аминогруппе,
(1-26) пирролидинил низшие алкоксигруппы,
(1-27) изоксазолильные группы,
(1-28) циклоалкилкарбонильные группы,
(1-29) нафтилоксигруппы,
(1-30) пиридильные группы,
(1-31) фурильные группы,
(1-32) фенилтиогруппа,
(1-33) оксогруппа,
(1-34) карбамоильная группа,
(1-35) 5-7-членные насыщенные гетероциклические группы, содержащие один или два атома азота (предпочтительно пирролидинил, пиперазинил или пиперидил), при этом гетероциклическая группа необязательно замещена одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы,
(1-36) оксидогруппа и
(1-37) низшие алкоксидогруппы,
при условии, что R101 и R102 не являются одновременно незамещенным фенилом.
Более предпочтительные варианты осуществления производного пирролидина (1) включают соединения, представленные общей формулой (1)

и их соли,
где R101 представляет собой
(1) фенильную группу или
(3) бензотиенильную группу,
и каждая из которых может иметь в ароматическом или гетероциклическом кольце один или два заместителя, выбранных из группы, содержащей (1-1) атомы галогена и (1-3) низшие алкильные группы, необязательно замещенные одним-тремя атомами галогена, и
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(3) бензотиенильную группу,
(4) индолильную группу,
(5) 2,3-дигидро-1H-инденильную группу,
(6) нафтильную группу,
(7) бензофурильную группу,
(8) хинолильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(12) бензотиазолильную группу,
(13) тиено[3,2-b]пиридильную группу,
(14) тиенильную группу,
(15) циклоалкильную группу,
(16) тетрагидропиранильную группу,
(17) пирролильную группу,
(18) 2,4-дигидро-1,3-бензодиоксинильную группу,
(19) 2,3-дигидробензофурильную группу,
(20) 9H-флуоренильную группу,
(21) пиразолильную группу,
(22) пиридазинильную группу,
(23) индолинильную группу,
(24) тиено[2,3-b]пиридильную группу,
(25) тиено[3,2-d]пиримидинильную группу,
(26) тиено[3,2-e]пиримидинильную группу,
(27) 1H-пиразолo[3,4-b]пиридильную группу,
(28) изохинолильную группу,
(29) 2,3-дигидро-1,4-бензоксадинильную группу,
(30) хиноксалинильную группу,
(31) хиназолинильную группу,
(32) 1,2,3,4-тетрагидрохинолильную группу,
(40) 1,3-бензодиоксолильную группу,
(41) 2,3-дигидро-1,4-бензодиоксинильную группу,
(42) 3,4-дигидро-1,5-бензодиоксепинильную группу,
(43) дигидропиридильную группу,
(44) 1,2-дигидрохинолильную группу,
(45) 1,2,3,4-тетрагидроизохинолильную группу,
(46) бензоксазолильную группу,
(47) бензоизотиазолильную группу,
(48) индазолильную группу,
(49) бензоимидазолильную группу,
(50) имидазолильную группу,
(59) гидрокси-замещенную низшую алкильную группу или
(60) низший алкокси низшую алкильную группу,
и каждая из групп (1)-(50) может иметь в ароматическом или гетероциклическом кольце один-пять (предпочтительно один-три) заместителей, выбранных из следующих групп (1-37), таких как
(1-1) атомы галогена,
(1-2) низшие алкилтиогруппы, необязательно замещенные одним или несколькими (предпочтительно одним-тремя) атомами галогена,
(1-3) низшие алкильные группы, необязательно замещенные одним или несколькими (предпочтительно одним-тремя) атомами галогена,
(1-4) низшие алкоксигруппы, необязательно замещенные одним или несколькими (предпочтительно одним-четырьмя) атомами галогена,
(1-5) нитрогруппа,
(1-6) низшие алкоксикарбонильные группы,
(1-7) аминогруппы, необязательно замещенные одной или двумя низшими алкильными группами,
(1-8) низшие алкилсульфонильные группы,
(1-9) цианогруппа,
(1-10) карбоксигруппа,
(1-11) гидроксигруппа,
(1-12) тиенильные группы,
(1-13) оксазолильные группы,
(1-14) нафтильные группы,
(1-15) бензоильная группа,
(1-16) феноксигруппы, необязательно замещенные одним-тремя атомами галогена в фенильном кольце,
(1-17) фенил низшие алкоксигруппы,
(1-18) низшие алканоильные группы,
(1-19) фенильные группы, необязательно замещенные в фенильном кольце одним-пятью (предпочтительно одним-тремя) заместителями, выбранными из группы, содержащей атомы галогена, низшие алкоксигруппы, цианогруппу, низшие алканоильные группы и низшие алкильные группы,
(1-20) фенил низшие алкильные группы,
(1-21) циано низшие алкильные группы,
(1-22) сульфонильные группы, замещенные 5-7-членной насыщенной гетероциклической группой, при этом гетероциклическая группа содержит в гетероциклическом кольце один или два атома азота (предпочтительно пиперидилсульфонил),
(1-23) тиазолильные группы, необязательно замещенные одной или двумя низшими алкильными группами в тиазольном кольце,
(1-24) имидазолильные группы,
(1-25) амино низшие алкильные группы, необязательно замещенные одной или двумя низшими алкильными группами на аминогруппе,
(1-26) пирролидинил низшие алкоксигруппы,
(1-27) изоксазолильные группы,
(1-28) циклоалкилкарбонильные группы,
(1-29) нафтилоксигруппы,
(1-30) пиридильные группы,
(1-31) фурильные группы,
(1-32) фенилтиогруппа,
(1-33) оксогруппа,
(1-34) карбамоильная группа,
(1-35) 5-7-членные насыщенные гетероциклические группы, содержащие один или два атома азота (предпочтительно пирролидинил, пиперазинил или пиперидил), при этом гетероциклическая группа необязательно замещена одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы,
(1-36) оксидогруппа и
(1-37) низшие алкоксидогруппы,
при условии, что R101 и R102 не являются одновременно незамещенным фенилом.
В частности, предпочтительные варианты осуществления производного пирролидина (1) включают соединения, представленные общей формулой (1)

и их соли,
где R101 представляет собой
(1) фенильную группу, замещенную в фенильном кольце одним или двумя заместителями, выбранными из группы, содержащей (1-1) атомы галогена и (1-3) низшие алкильные группы, необязательно замещенные одним-тремя атомами галогена, и
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(14) тиенильную группу,
(48) индазолильную группу,
(59) гидрокси-замещенную низшую алкильную группу или
(60) низший алкокси низшую алкильную группу,
и каждая из групп (1), (2), (9), (10), (11), (14) и (48) может иметь в ароматическом или гетероциклическом кольце один или два заместителя, выбранные из группы, содержащей
(1-1) атомы галогена,
(1-3) низшие алкильные группы, необязательно замещенные одним-тремя атомами галогена и
(1-9) цианогруппу.
Примерами конкретных предпочтительных пирролидиновых соединений настоящего изобретения являются следующие:
(4-хлорфенил)фенил-(S)-пирролидин-3-иламин,
(4-фторфенил)фенил-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)фенил-(S)-пирролидин-3-иламин,
бис-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-ил-п-толиламин,
4-[(S)-(4-фтор-3-метилфенил)пирролидин-3-иламино]бензонитрил,
бис-(3-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)пиримидин-5-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиразин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(5-хлорпиридин-2-ил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(6-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(3,4-дихлорфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиофен-3-иламин,
(3-хлор-4-фторфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(4-фтор-3-метилфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
2-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]этанол,
1-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]-2-метил-пропан-2-ол,
(3-хлор-4-фторфенил)-(2-метоксиэтил)-(S)-пирролидин-3-иламин,
3-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]пропан-1-ол,
(3-хлор-4-фторфенил)-(3-метоксипропил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(1-метил-1H-индазол-5-ил)-(S)-пирролидин-3-иламин,
бензо[b]тиофен-6-ил-(S)-пирролидин-3-илтиофен-3-иламин и
бензо[b]тиофен-5-ил-(S)-пирролидин-3-илтиофен-3-иламин.
Конкретными примерами групп в общей формуле (1) являются следующие.
Примеры атомов галогена включают фтор, хлор, бром и йод.
Примеры низших алкилтиогрупп, необязательно замещенных одним или несколькими атомами галогена, включают прямые или разветвленные C1-6алкилтиогруппы, необязательно замещенные одним-тремя атомами галогена, такие как метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, трет-бутилтио, втор-бутилтио, н-пентилтио, изопентилтио, неопентилтио, н-гексилтио, изогексилтио, 3-метилпентилтио, трифторметилтио, трихлорметилтио, хлорметилтио, бромметилтио, фторметилтио, йодметилтио, дифторметилтио, дибромметилтио, 2-хлорэтилтио, 2,2,2-трифторэтилтио, 2,2,2-трихлорэтилтио, 3-хлорпропилтио, 2,3-дихлорпропилтио, 4,4,4-трихлорбутилтио, 4-фторбутилтио, 5-хлорпентилтио, 3-хлор-2-метилпропилтио, 5-бромгексилтио, 5,6-дибромгексилтио и т.д.
Примеры низших алкильных групп, необязательно замещенных одним или несколькими атомами галогена, включают прямые или разветвленные C1-6алкильные группы, необязательно замещенные одним-четырьмя атомами галогена, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, 3-метилпентил, трифторметил, трихлорметил, хлорметил, бромметил, фторметил, йодметил, дифторметил, дибромметил, 2-хлорэтил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 3-хлорпропил, 2,3-дихлорпропил, 4,4,4-трихлорбутил, 4-фторбутил, 5-хлорпентил, 3-хлор-2-метилпропил, 5-бромгексил, 5,6-дибромгексил, 1,1,2,2-тетрафторэтил и т.д.
Примеры низших алкоксигрупп, необязательно замещенных одним или несколькими атомами галогена, включают прямые или разветвленные C1-6алкоксигруппы, необязательно замещенные одним-четырьмя атомами галогена, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, втор-бутокси, н-пентилокси, изопентилокси, неопентилокси, н-гексилокси, изогексилокси, 3-метилпентилокси, трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлорэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-хлорпропокси, 2,3-дихлорпропокси, 4,4,4-трихлорбутокси, 4-фторбутокси, 5-хлорпентилокси, 3-хлор-2-метилпропокси, 5-бромгексилокси, 5,6-дибромгексилокси, 1,1,2,2-тетрафторэтокси и т.д.
Примеры низших алкоксикарбонильных групп включают алкоксикарбонильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, такие как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, втор-бутоксикарбонил, н-пентилоксикарбонил, неопентилоксикарбонил, н-гексилоксикарбонил, изогексилоксикарбонил, 3-метилпентилоксикарбонил и т.д.
Примеры низших алкильных групп включают прямые или разветвленные C1-6алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, 3-метилпентил и т.д.
Примеры низших алканоильных групп включают прямые или разветвленные C1-6алканоилные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, трет-бутилкарбонил, гексаноил и т.д.
Примеры низших алкилсульфонильных групп включают прямые или разветвленные C1-6алкилсульфонильные группы, такие как метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, трет-бутилсульфонил, втор-бутилсульфонил, н-пентилсульфонил, изопентилсульфонил, неопентилсульфонил, н-гексилсульфонил, изогексилсульфонил, 3-метилпентилсульфонил и т.д.
Примеры феноксигрупп, необязательно замещенных одним-тремя атомами галогена в фенильном кольце, включают фенокси, 2-фторфенокси, 3-фторфенокси, 4-фторфенокси, 2-хлорфенокси, 3-хлорфенокси, 4-хлорфенокси, 2-бромфенокси, 3-бромфенокси, 4-бромфенокси, 2-йодфенокси, 3-йодфенокси, 4-йодфенокси, 2,3-дифторфенокси, 3,4-дифторфенокси, 3,5-дифторфенокси, 2,4-дифторфенокси, 2,6-дифторфенокси, 2,3-дихлорфенокси, 3,4-дихлорфенокси, 3,5-дихлорфенокси, 2,4-дихлорфенокси, 2,6-дихлорфенокси, 3,4,5-трифторфенокси, 3,4,5-трихлорфенокси, 2,4,6-трифторфенокси, 2,4,6-трихлорфенокси, 2-фтор-4-бромфенокси, 4-хлор-3-фторфенокси, 2,3,4-трихлорфенокси и т.д.
Примеры фенил низших алкоксигрупп включают фенилалкоксигруппы, где алкокси часть представляет собой прямые или разветвленные C1-6алкоксигруппы, такие как бензилокси, 2-фенилэтокси, 1-фенилэтокси, 3-фенилпропокси, 4-фенилбутокси, 5-фенилпентилокси, 6-фенилгексилокси, 1,1-диметил-2-фенилэтокси, 2-метил-3-фенилпропокси и т.д.
Примеры фенил низших алкильных групп включают фенилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как бензил, 1-фенетил, 2-фенетил, 3-фенилпропил, 2-фенилпропил, 4-фенилбутил, 5-фенилпентил, 4-фенилпентил, 6-фенилгексил, 2-метил-3-фенилпропил, 1,1-диметил-2-фенилэтил и т.д.
Примеры циано низших алкильных групп включают цианоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как цианометил, 2-цианоэтил, 1-цианоэтил, 3-цианопропил, 4-цианобутил, 1,1-диметил-2-цианоэтил, 5-цианопентил, 6-цианогексил, 1-цианоизопропил, 2-метил-3-цианопропил и т.д.
Примеры тиазолильных групп, необязательно замещенных одной или двумя низшими алкильными группами в тиазольном кольце, включают тиазолильные группы, необязательно замещенные одной или двумя прямыми или разветвленными C1-6алкильными группами в тиазольном кольце, такие как (2-, 4- или 5-)тиазолил, 2-метил-(4- или 5-)тиазолил, 4-метил-(2- или 5-)тиазолил, 2-этил-(4- или 5-)тиазолил, 4-н-пропил-(2- или 5-)тиазолил, 5-н-бутил-(2- или 4-)тиазолил, 2-н-пентил-(4- или 5-)тиазолил, 4-н-гексил-(2- или 5-)тиазолил, 2,4-диметил-5-тиазолил и т.д.
Примеры амино низших алкильных групп, необязательно замещенных одной или двумя низшими алкильными группами на аминогруппе, включают аминоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу и которые необязательно замещены на аминогруппе одной или двумя прямыми или разветвленными C1-6алкильными группами, такие как аминометил, 2-аминоэтил, 1-аминоэтил, 3-аминопропил,
4-аминобутил, 5-аминопентил, 6-аминогексил,
1,1-диметил-2-аминоэтил, 2-метил-3-аминопропил,
метиламинометил, 2-этиламиноэтил, 3-пропиламинопропил,
3-изопропиламинопропил, 4-бутиламинобутил,
5-пентиламинопентил, 6-гексиламиногексил,
2-диметиламиноэтил, 2-диизопропиламинопропил,
3-диметиламинопропил, диизопропиламинометил,
3-диизопропиламинопропил, (N-этил-Н-пропиламино)метил,
2-(N-метил-N-гексиламино)метил и т.д.
Примеры пирролидинил низших алкоксигрупп включают пирролидинилалкоксигруппы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, такие как
(1-, 2- или 3-)пирролидинилметокси,
2-[(1-, 2- или 3-)пирролидинил]этокси,
1-[(1-, 2- или 3-)пирролидинил]этокси,
3-[(1-, 2- или 3-)пирролидинил]пропокси,
4-[(1-, 2- или 3-)пирролидинил]бутокси,
5-[(1-, 2- или 3-)пирролидинил]пентилокси,
6-[(1-, 2- или 3-)пирролидинил]гексилокси,
1,1-диметил-2-[(1-, 2- или 3-)пирролидинил]этокси,
2-метил-3-[(1-, 2- или 3-)пирролидинил]пропокси и т.д.
Примеры циклоалкильных групп включают C3-8циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклоокстил и т.д.
Примеры циклоалкилкарбонильных групп включают циклоалкилкарбонильные группы, где циклоалкильная часть представляет собой C3-8циклоалкильную группу, такие как циклопропилкарбонил, циклобутилкарбонил, циклопентилкарбонил, циклогексилкарбонил, циклогептилкарбонил, циклоокстилкарбонил и т.д.
Примеры низших алкоксигрупп включают прямые или разветвленные C1-6алкоксигруппы, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, втор-бутокси, н-пентилокси, изопентилокси, неопентилокси, н-гексилокси, изогексилокси, 3-метилпентилокси и т.д.
Примеры низших алкилтиогрупп включают прямые или разветвленные C1-6алкилтиогруппы, такие как метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, трет-бутилтио, втор-бутилтио, н-пентилтио, изопентилтио, неопентилтио, н-гексилтио, изогексилтио, 3-метилпентилтио и т.д.
Примеры фенильных групп, необязательно замещенных в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы, включают фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и прямые или разветвленные C1-6алкоксигруппы, такие как фенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-этоксифенил, 3-этоксифенил, 4-этоксифенил, 4-изопропоксифенил, 3-бутоксифенил, 4-пентилоксифенил, 4-гексилоксифенил, 3,4-диметоксифенил, 3,4-диэтоксифенил, 2,4-диметоксифенил, 2,5-диметоксифенил, 2,6-диметоксифенил, 3,4,5-триметоксифенил, 2-метокси-4-фторфенил, 4-фторфенил, 2,5-дифторфенил, 2,4-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2,6-дифторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 2,6-дихлорфенил, 3-фторфенил, 2-фторфенил, 3-бромфенил, 4-йодфенил, 2-бромфенил, 4-бромфенил, 3,5-дихлорфенил, 2,4,6-трифторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-йодфенил, 3-йодфенил, 2,3-дибромфенил, 2,4-дийодфенил, 2,4,6-трихлорфенил и т.д.
Примеры 5-7-членных насыщенных гетероциклических групп, содержащих в гетероциклическом кольце один или два гетероатома, выбранные из группы, содержащей азот, кислород и серу, включают пирролидинил, пиперазинил, пиперидинил, морфолино, тиоморфолино, гомопиперазинил, гомопиперидинил, имидазолидинил, тиазолидинил, изотиазолидинил, оксазолидинил, изоксазолидинил, изотиазолидинил и пиразолидинил.
Примеры указанных выше гетероциклических групп, замещенных одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы:
включают указанные выше гетероциклические группы, замещенные одним-тремя заместителями, выбранными из группы, содержащей оксогруппы; прямые или разветвленные C1-6алкильные группы; прямые или разветвленные C1-6алканоильные группы; фенилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и прямые или разветвленные C1-6алкоксигруппы; и пиридильные группы;
такие как 2-оксо-(1-, 3-, 4- или 5-)пирролидинил,
2-оксо-(1-, 3-, 4-, 5- или 6-)пиперазинил,
4-метил-(1-, 2- или 3-)пиперазинил,
4-ацетил-(1-, 2- или 3-)пиперазинил,
4-этил-(1-, 2- или 3-)пиперазинил,
2-метил-(1-, 2-, 3-, 4- или 5-)пирролидинил,
2-метил-(1-, 2-, 3-, 4-, 5- или 6-)пиперидинил,
2,4-диметил-(1-, 2-, 3-, 5- или 6-)пиперидинил,
3-метил-(1-, 2-, 3-, 4- или 5-)пирролидинил,
2,3,4-триметил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
4-ацетил-3-метил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
3-метил-(2-, 3-, 4-, 5- или 6-)морфолино,
2-ацетил-(2-, 3-, 4-, 5- или 6-)морфолино,
4-(2-фенилэтил)-(1-, 2- или 3-)пиперазинил,
4-(3,4-дихлорфенил)-(1-, 2-, 3- или 4-)пиперазинил,
4-(4-метоксифенил)-(1-, 2- или 3-)пиперазинил,
4-(2-хлорфенил)-(1-, 2- или 3-)пиперазинил,
4-[(2-, 3- или 4-)пиридил]-(1-, 2- или 3-)пиперазинил,
4-фенил-(1-, 2- или 3-)пиперазинил,
4-бензил-(1-, 2- или 3-)пиперидинил,
4-(3,4-дихлорфенил)-(1-, 2- или 3-)морфолино,
2-(4-метоксифенил)-(1-, 2-, 3-, 4- или 5-)пирролидинил,
4-(2-хлорфенил)-(1-, 2- или 3-)пиперидинил,
4-[(2-, 3- или 4-)пиридил]-(1-, 2- или 3-)пиперидинил,
4-фенил-(1-, 2- или 3-)пиперидинил,
4-фенил-3-метил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
4-[(2-, 3- или 4-)пиридил]-2-ацетил-(1-, 2-, 3-, 5- или 6-)пиперазинил и т.д.
Примеры циклоалкил низших алкильных групп включают циклоалкильные алкильные группы, где циклоалкильная часть представляет собой C3-8циклоалкильную группу и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как циклопропилметил, циклогексилметил, 2-циклопропилэтил, 1-циклобутилэтил, циклопентилметил, 3-циклопентилпропил, 4-циклогексилбутил, 5-циклогептилпентил, 6-циклоокстилгексил, 1,1-диметил-2-циклогексилэтил, 2-метил-3-циклопропилпропил и т.д.
Примеры низший алкилтио низших алкильных групп включают алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как метилтиометил, 2-метилтиоэтил, 1-этилтиоэтил, 2-этилтиоэтил, 3-н-бутилтиопропил, 4-н-пропилтиобутил, 1,1-диметил-2-н-пентилтиоэтил, 5-н-гексилтиопентил, 6-метилтиогексил, 1-этилтиоизопропил, 2-метил-3-метилтиопропил и т.д.
Примеры фенокси низших алкильных групп включают феноксиалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как феноксиметил, 1-феноксиэтил, 2-феноксиэтил, 3-феноксипропил, 2-феноксипропил, 4-феноксибутил, 5-феноксипентил, 4-феноксипентил, 6-феноксигексил, 2-метил-3-феноксипропил, 1,1-диметил-2-феноксиэтил и т.д.
Примеры пиридилокси низших алкильных групп включают пиридилоксиалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, такие как
[2-, 3- или 4-]пиридилокси]метил,
1-[2-, 3- или 4-]пиридилокси]этил,
2-[2-, 3- или 4-]пиридилокси]этил,
3-[2-, 3- или 4-]пиридилокси]пропил,
2-[2-, 3- или 4-]пиридилокси]пропил,
4-[2-, 3- или 4-]пиридилокси]бутил,
5-[2-, 3- или 4-]пиридилокси]пентил,
4-[2-, 3- или 4-]пиридилокси]пентил,
6-[2-, 3- или 4-]пиридилокси]гексил,
2-метил-3-[2-, 3- или 4-] пиридилокси]пропил,
1,1-диметил-2-[2-, 3- или 4-]пиридилокси]этил и т.д.
Примеры низших алкинильных групп включают прямые или разветвленные C2-6алкинильные группы, такие как этинил, (1- или 2-)пропинил, 1-метил-(1- или 2-)пропинил, 1-этил-(1- или 2-)пропинил, (1-, 2- или 3-)бутинил, (1-, 2-, 3- или 4-)пентинил, (1-, 2-, 3-, 4- или 5-)гексинил и т.д.
Примеры фенил низших алкенильных групп включают фенилалкенильные группы, содержащие одну-три двойных связей, где алкенильная часть представляет собой прямую или разветвленную C2-6алкенильную группу, такие как стирил, 3-фенил-2-пропенил (тривиальное название: циннамил), 4-фенил-2-бутенил, 4-фенил-3-бутенил, 5-фенил-4-пентенил, 5-фенил-3-пентенил, 6-фенил-5-гексенил, 6-фенил-4-гексенил, 6-фенил-3-гексенил, 4-фенил-1,3-бутадиенил, 6-фенил-1,3,5-гексатриенил и т.д.
Примеры циклоалкильных низших алкильных групп включают циклоалкилалкильные группы, где циклоалкильная часть представляет собой C3-8циклоалкильную группу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры низший алкилтио низших алкильных групп включают алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры амино-замещенных низших алкильных групп, необязательно замещенных одной или двумя низшими алкильными группами на аминогруппе, включают амино-замещенные алкильные группы, необязательно замещенные одной или двумя прямыми или разветвленными C1-6алкильными группами на аминогруппе, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фенокси низших алкильных групп включают феноксиалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры пиридилокси низших алкильных групп включают пиридилоксиалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры 1,2,3,4-тетрагидронафтил низших алкильных групп включают 1,2,3,4-тетрагидронафтилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры имидазо[1,2-a]пиридил низших алкильных групп включают имидазо[1,2-a]пиридилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры тиазолил низших алкильных групп включают тиазолилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры тетрагидропиранил низших алкильных групп включают тетрагидропиранилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры пиперидил низших алкильных групп включают пиперидилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры дифенил низший алкокси-замещенных низших алкильных групп включают дифенилалкокси-замещенные алкильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры низший алкоксикарбонил-замещенных низших алкильных групп включают алкоксикарбонил-замещенные алкильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фенил низший алкоксикарбонил-замещенных низших алкильных групп включают фенилалкоксикарбонил-замещенные алкильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры гидрокси-замещенных низших алкильных групп включают гидрокси-замещенные алкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше, имеющую 1-3 гидроксигруппы, такие как гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 2,3-дигидроксипропил, 3-гидроксипропил, 2-гидроксипропил, 4-гидроксибутил, 3,4-дигидроксибутил, 5-гидроксипентил, 4-гидроксипентил, 6-гидроксигексил, 2,2-диметил-3-гидроксипропил, 1,1-диметил-2-гидроксиэтил, 2,3,4-тригидроксибутил и т.д.
Примеры низший алкокси низших алкильных групп включают алкоксиалкильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше, такие как метоксиметил, 1-метоксиэтил, 2-метоксиэтил, 2-этоксипропил, 3-метоксипропил, 3-этоксипропил, 3-пропоксипропил, 4-метоксибутил, 3-метоксибутил, 5-метоксипентил, 4-этоксипентил, 6-метоксигексил, 2,2-диметил-3-метоксипропил, 1,1-диметил-2-метоксиэтил и т.д.
Примеры карбокси низших алкильных групп включают карбоксиалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры карбамоил-замещенных низших алкильных групп, необязательно замещенных одной или двумя низшими алкильными группами на карбамоильной группе, включают карбамоил-замещенные алкильные группы, необязательно замещенные одной или двумя прямыми или разветвленными C1-6алкильными группами на карбамоильной группе, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры морфолинилкарбонил низших алкильных групп включают морфолинилкарбонильные алкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры бензоил низших алкильных групп включают бензоилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фенилтио низших алкильных групп включают фенилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры нафтилтио низших алкильных групп включают нафтилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры циклоалкилтио низших алкильных групп включают циклоалкилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры пиридилтио низших алкильных групп включают пиридилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры пиримидинилтио низших алкильных групп включают пиримидинилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фурилтио низших алкильных групп включают фурилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры тиенилтио низших алкильных групп включают тиенилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры 1,3,4-тиадиазолилтио низших алкильных групп включают 1,3,4-тиадиазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры бензимидазолилтио низших алкильных групп включают бензимидазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры бензтиазолилтио низших алкильных групп включают бензтиазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры тетразолилтио низших алкильных групп включают тетразолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры бензоксазолилтио низших алкильных групп включают бензоксазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры тиазолилтио низших алкильных групп включают тиазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры имидазолилтио низших алкильных групп включают имидазолилтиоалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры амино-замещенный низший алкилтио низших алкильных групп, необязательно замещенных одной или двумя низшими алкильными группами на одной или двух аминогруппах, включают амино-замещенные алкилтиоалкильные группы, необязательно замещенные одной или двумя прямыми или разветвленными C1-6алкильными группами на аминогруппе, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фенил-замещенный низший алкилтио низших алкильных групп включают фенил-замещенные алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фурил-замещенный низший алкилтио низших алкильных групп включают фурил-замещенные алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры пиридил-замещенный низший алкилтио низших алкильных групп включают пиридил-замещенные алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры гидрокси-замещенный низший алкилтио низших алкильных групп включают гидрокси-замещенные алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры фенокси-замещенный низший алкилтио низших алкильных групп включают фенокси-замещенные алкилтиоалкильные группы, где алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры низший алкоксикарбонил-замещенный низший алкилтио низших алкильных групп включают алкоксикарбонил-замещенные алкилтиоалкильные группы, где алкокси часть представляет собой прямую или разветвленную C1-6алкоксигруппу, как указано выше, алкилтио часть представляет собой прямую или разветвленную C1-6алкилтиогруппу, как указано выше, и алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу, как указано выше.
Примеры низших алкенильных групп включают прямые или разветвленные C2-6алкенильные группы, такие как винил,
1-пропенил, аллил, 1-метилаллил, (1-, 2- или 3-)бутенил,
(1-, 2-, 3- или 4-)пентенил и (1-, 2-, 3-, 4- или 5-)гексенил.
Примеры дигидропиридильных групп включают 1,2-дигидропиридил, 3,4-дигидропиридил и тому подобное.
Примеры сульфонильных групп, замещенных 5-7-членной насыщенной гетероциклической группой, где гетероциклическая группа содержит один или два гетероатома, выбранные из группы, содержащей азот, кислород и серу, включают
пирролидинилсульфонил, пиперазинилсульфонил,
пиперидинилсульфонил, морфолиносульфонил, тиоморфолиносульфонил,
гомопиперазинилсульфонил, гомопиперидинилсульфонил,
имидазолидинилсульфонил, тиазолидинилсульфонил,
изотиазолидинилсульфонил, оксазолидинилсульфонил,
изоксазолидинилсульфонил, изотиазолидинилсульфонил,
пиразолидинилсульфонил и т.д.
Примеры низших алкоксидогрупп включают прямые или разветвленные C1-6алкоксидогруппы, такие как метоксидо, этоксидо и т.д.
Производные пирролидина, представленные общей формулой (1), могут быть получены различными способами и, например, способом в соответствии со следующей реакционной схемой 1.
[Реакционная схема 1]
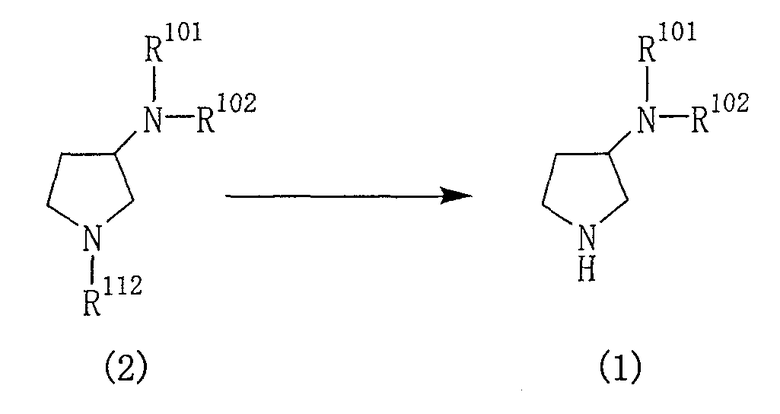
где R101 и R102 являются такими, как указано выше, и R112 представляет собой амино-защитную группу.
Производное пирролидина (1) может быть получено, подвергая соединение (2) реакции элиминирования для удаления амино-защитной группы.
Примеры амино-защитных групп, которые могут использоваться в данном случае, включают низшие алкоксикарбонильные группы, низшие алканоильные группы, арилоксикарбонильные группы, арил-замещенные низшие алкильные группы и т.д.
Примеры низших алкоксикарбонильных групп включают прямые или разветвленные C1-6алкоксикарбонильные группы, такие как метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и т.д.
Примеры низших алканоильных групп включают прямые или разветвленные C1-6алканоильные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, трет-бутилкарбонил, гексаноил и т.д.
Примеры арилоксикарбонильных групп включают фенокси карбонильные группы, необязательно замещенные одним-тремя заместителями; нафтилокси карбонильные группы, необязательно замещенные одним-тремя заместителями; и т.д. Примеры заместителей для арильных групп включают метил, этил, пропил, н-бутил, втор-бутил, трет-бутил, н-пентил, н-гексил, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипропил, 4-гидроксибутил, 1,1-диметил-2-гидроксиэтил, 5,5,4-тригидроксипентил, 5-гидроксипентил, 6-гидроксигексил, 1-гидроксиизопропил, 2-метил-3-гидроксипропил, трифторметил, трихлорметил, хлорметил, бромметил, фторметил, йодметил, дифторметил, дибромметил, 2-хлорэтил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 3-хлорпропил, 2,3-дихлорпропил, 4,4,4-трихлорбутил, 4-фторбутил, 5-хлорпентил, 3-хлор-2-метилпропил, 5-бромгексил, 5,6-дихлоргексил, 3-гидрокси-2-хлорпропил, или подобные прямые или разветвленные C1-6алкильные группы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и гидроксильную группу; метокси, этокси, пропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, н-гексилокси, гидроксиметокси, 2-гидроксиэтокси, 1-гидроксиэтокси, 3-гидроксипропокси, 2,3-дигидроксипропокси, 4-гидроксибутокси, 1,1-диметил-2-гидроксиэтокси, 5,5,4-тригидроксипентилокси, 5-гидроксипентилокси, 6-гидроксигексилокси, 1-гидроксиизопропокси, 2-метил-3-гидроксипропокси, трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлорэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-хлорпропокси, 2,3-дихлорпропокси, 4,4,4-трихлорбутокси, 4-фторбутокси, 5-хлорпентилокси, 3-хлор-2-метилпропокси, 5-бромгексилокси, 5,6-дихлоргексилокси, 3-гидрокси-2-хлорпропокси, или подобные прямые или разветвленные C1-6алкоксигруппы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и гидроксильную группу; атомы галогена, такие как фтор, бром, хлор, и йод; и т.д. Когда имеются два или более заместителей, заместители могут быть одинаковыми или различными.
Примеры арил-замещенных низших алкильных групп включают бензил, 2-фенилэтил, 1-фенилэтил, 3-фенилпропил, 4-фенилбутил, 5-фенилпентил, 6-фенилгексил, 1,1-диметил-2-фенилэтил, 2-метил-3-фенилпропил, α-нафтилметил, β-нафтилметил, 2-(α-нафтил)этил, 1-(β-нафтил)этил, 3-(α-нафтил)пропил, 4-(β-нафтил)бутил, 5-(α-нафтил)пентил, 6-(β-нафтил)гексил, 1,1-диметил-2-(α-нафтил)этил, 2-метил-3-(β-нафтил)пропил, подобные фенил-замещенные прямые или разветвленные C1-6алкильные группы, необязательно замещенные одним-тремя заместителями; или подобные нафтил-замещенные прямые или разветвленные C1-6алкильные группы, необязательно замещенные одним-тремя заместителями. Примеры заместителей для арильных групп включают метил, этил, пропил, н-бутил, втор-бутил, трет-бутил, н-пентил, н-гексил, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипропил, 4-гидроксибутил, 1,1-диметил-2-гидроксиэтил, 5,5,4-тригидроксипентил, 5-гидроксипентил, 6-гидроксигексил, 1-гидроксиизопропил, 2-метил-3-гидроксипропил, трифторметил, трихлорметил, хлорметил, бромметил, фторметил, йодметил, дифторметил, дибромметил, 2-хлорэтил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 3-хлорпропил, 2,3-дихлорпропил, 4,4,4-трихлорбутил, 4-фторбутил, 5-хлорпентил, 3-хлор-2-метилпропил, 5-бромгексил, 5,6-дихлоргексил, 3-гидрокси-2-хлорпропил, или подобные прямые или разветвленные C1-6алкильные группы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и гидроксильную группу; метокси, этокси, пропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, н-гексилокси, гидроксиметокси, 2-гидроксиэтокси, 1-гидроксиэтокси, 3-гидроксипропокси, 2,3-дигидроксипропокси, 4-гидроксибутокси, 1,1-диметил-2-гидроксиэтокси, 5,5,4-тригидроксипентилокси, 5-гидроксипентилокси, 6-гидроксигексилокси, 1-гидроксиизопропокси, 2-метил-3-гидроксипропокси, трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлорэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-хлорпропокси, 2,3-дихлорпропокси, 4,4,4-трихлорбутокси, 4-фторбутокси, 5-хлорпентилокси, 3-хлор-2-метилпропокси, 5-бромгексилокси, 5,6-дихлоргексилокси, 3-гидрокси-2-хлорпропокси, или подобные прямые или разветвленные C1-6алкоксигруппы, необязательно замещенные одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и гидроксильную группу; атомы галогена, такие как фтор, бром, хлор и йод; и т.д. Когда имеются два или более заместителей, заместители могут быть одинаковыми или различными.
Реакцию получения соединения (1) из соединения (2) проводят в подходящем растворителе или без растворителя в присутствии кислотного или основного соединения. На данную реакцию далее в данном описании ссылаются как на “реакцию A”.
Примеры используемых растворителей включают воду; низшие спирты, такие как метанол, этанол, изопропанол и трет-бутанол; кетоны, такие как ацетон и метил этил кетон; простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, момноглим и диглим; алифатические кислоты, такие как уксусная кислота и муравьиная кислота; сложные эфиры, такие как метилацетат и этилацетат; галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан и тетрахлорид углерода; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и N-метилпирролидон; диметилсульфоксид; триамид гексаметилфосфорной кислоты; и смеси таких растворителей.
Примеры используемых кислот включают минеральные кислоты, такие как хлористоводородная кислота, серная кислота и бромистоводородная кислота; и органические кислоты, такие как муравьиная кислота, уксусная кислота, трифторуксусная кислота и п-толуолсульфоновая кислота.
Примеры используемых оснований включают карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия и гидрокарбонат калия; и гидроксиды металлов, такие как гидроксид натрия, гидроксид калия, гидроксид кальция и гидроксид лития.
Кислотное или основное соединение обычно используют в количестве по меньшей мере примерно 1 моль, предпочтительно примерно от 1 до примерно 10 моль, на моль соединения (2). Однако кислота также может быть использована в большом избытке относительно соединения (2).
Обычно реакцию удобно проводить при температуре примерно от 0 до примерно 200°C, предпочтительно примерно от 0 до примерно 150°C, и реакция обычно завершается в течение примерно от 10 минут до примерно 30 часов.
Когда R112 в соединении (2) представляет собой арил-замещенную низшую алкильную группу, также можно получить соединение (1) восстановлением такого соединения (2).
Реакцию восстановления можно осуществить, например, каталитическим гидрированием в подходящем растворителе в присутствии катализатора.
Примеры используемых растворителей включают воду; уксусную кислоту; спирты, такие как метанол, этанол и изопропанол; углеводороды, такие как н-гексан и циклогексан; простые эфиры, такие как диоксан, тетрагидрофуран, диэтиловый эфир и диметиловый эфир этиленгликоля; сложные эфиры, такие как этилацетат и метилацетат; апротонные полярные растворители, такие как диметилформамид; и смеси таких растворители.
Примеры используемых катализаторов включают палладий, палладиевую чернь, палладий на углероде, платину, оксид платины, хромит меди, никель Ренея и их смеси. Катализатор предпочтительно используют в количестве примерно от 0,02 до примерно 1 частей от массы соединения (2).
Реакционная температура при проведении реакции восстановления обычно составляет примерно от -20 до примерно 100°C, предпочтительно примерно от 0 до примерно 80°C, и давление водорода составляет обычно от 1 до 10 атм. Обычно реакция завершается в течение примерно от 0,5 до примерно 20 часов.
Когда R112 в соединении (2) представляет собой арил-замещенную низшую алкильную группу, соединение (2) может быть преобразовано в соединение (1) стадиями (i) обработки соединения (2) деалкилирующим агентом в подходящем растворителе; и (ii) нагреванием полученного соединения в подходящем растворителе.
Растворитель, используемый в реакции на стадии (i), может быть таким, как и любой растворитель, используемый в реакции (A).
Примеры используемых деалкилирующих агентов включают сложные эфиры муравьиной кислоты, такие как 1-хлорэтилхлорформиат, этилхлорформиат и трет-бутилхлорформиат. Деалкилирующий агент обычно используют в количестве по меньшей мере примерно 1 моль соединения (2), предпочтительно примерно от 1 моль до примерно 10 моль, на моль соединения (2).
Обычно реакцию удобно проводить при температуре примерно от 0 до примерно 150°C, предпочтительно при температуре от комнатной температуры до примерно 100°C, и обычно реакция завершается в течение примерно от 1 до примерно 25 часов.
Примеры растворителей, используемых на стадии (ii), включают спирты, такие как метанол, этанол и изопропанол. Нагревание обычно осуществляют при температуре примерно от 0 до примерно 150°C, предпочтительно при температуре от комнатной до примерно 100°C, в течение примерно от 1 до примерно 10 часов.
Соединение общей формулы (2), используемое в качестве исходного вещества, может быть легко получено, например, способом, показанным на реакционной схеме 2:
[Реакционная схема 2]
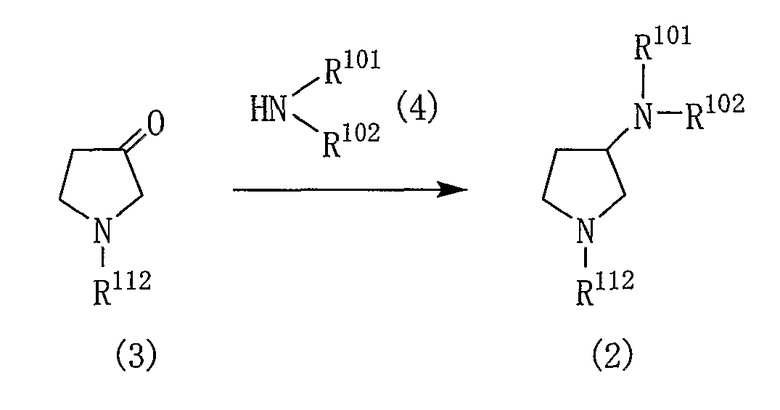
где R101, R102 и R112 являются такими, как указано выше.
Реакцию соединения (3) с соединением (4) проводят, например, без растворителя или в подходящем растворителе в присутствии восстанавливающего агента.
При проведении реакции соединение (4) обычно используют в количестве по меньшей мере примерно 1 моль на моль соединения (3) и предпочтительно от эквивалентного до большого избытка относительно соединения (3).
Примеры используемых растворителей включают воду; низшие спирты, такие как метанол, этанол, изопропанол, бутанол, трет-бутанол и этиленгликоль; ацетонитрил; алифатические кислоты, такие как муравьиная кислота и уксусная кислота; эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, момноглим и диглим; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и тетрахлорид углерода; и смеси таких растворители.
Примеры восстанавливающих агентов включают алифатические кислоты, такие как муравьиная кислота; соли щелочных металлов алифатической кислоты, такие как формиат натрия; гидридные восстанавливающие агенты, такие как боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия, литийалюминийгидрид или смеси таких гидридных восстанавливающих агентов; восстанавливающие агенты для каталитического гидрирования, такие как палладиевая чернь, палладий на углероде, оксид платины, платиновая чернь и никель Ренея.
Когда в качестве восстанавливающего агента используют алифатическую кислоту или соль щелочного металла алифатической кислоты, подходящая температура обычно составляет от комнатной до примерно 200°C, предпочтительно примерно от 50 до примерно 150°C. Обычно реакция завершается в течение примерно от 10 минут до примерно 10 часов. Алифатическую кислоту или соль щелочного металла алифатической кислоты предпочтительно используют в большом избытке относительно соединения (3).
Когда в качестве восстанавливающего агента используют гидридный восстанавливающий агент, подходящая температура реакции обычно составляет примерно от -80 до примерно 100°C, предпочтительно примерно от -80 до примерно 70°C. Обычно реакция завершается в течение примерно от 30 минут до примерно 60 часов. Гидридный восстанавливающий агент обычно используют в количестве примерно от 1 до примерно 20 моль на моль соединения (3), предпочтительно примерно от 1 до примерно 6 моль на моль соединения (3). Когда в качестве гидридного восстанавливающего агента используют литийалюминийгидрид, особенно предпочтительным является использование простых эфиров, таких как диэтиловый эфир, тетрагидрофуран, диоксан, момноглим и диглим, и ароматических углеводородов, таких как бензол, толуол и ксилол, или смеси таких растворителей в качестве растворителей. В реакционную систему могут быть добавлены амин(ы), такие как триметиламин, триэтиламин и N-этилдиизопропиламин, или молекулярные сита, такие как молекулярные сита типа 3Å (MS-3Å) и молекулярные сита типа 4Å (MS-4Å).
Когда в качестве восстанавливающего агента используют восстанавливающий агент для каталитического гидрирования, реакцию обычно проводят при температуре примерно от -30 до примерно 100°C, предпочтительно примерно от 0 до примерно 60°C, в атмосфере водорода при давлении примерно от атмосферного давления до примерно 20 атм, предпочтительно примерно от атмосферного давления до примерно 10 атм, или в присутствии донора водорода, такого как муравьиная кислота, формиат аммония, циклогексен и гидразингидрат. Обычно реакция завершается в течение примерно от 1 до примерно 12 часов. Восстанавливающий агент для каталитического гидрирования обычно используют в количестве примерно от 0,1 до примерно 40 мас.%, предпочтительно примерно от 1 до примерно 20 мас.%, относительно соединения (3).
[Реакционная схема 3]
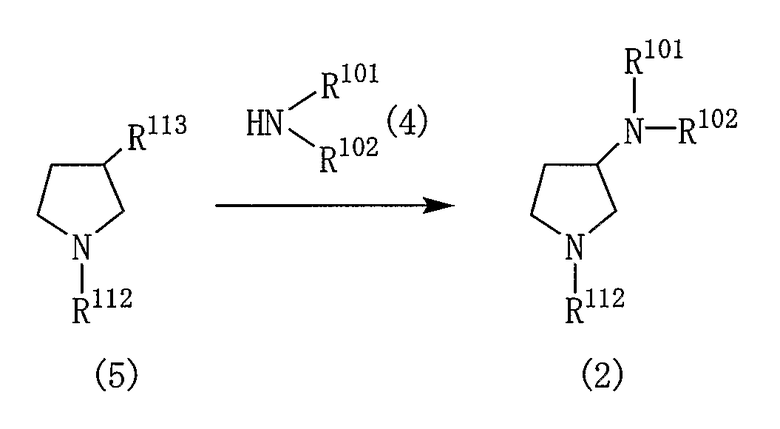
где R101, R102 и R112 являются такими, как указано выше; R113 представляет собой низшую алкилсульфонилоксигруппу, фенилсульфонилоксигруппу, необязательно замещенную в фенильном кольце одним или несколькими низшими алкильными группами или атомом галогена.
Низшая алкилсульфонилоксигруппа представляет собой группу, состоящую из C1-6алкильной группы и сульфонилоксигруппы, примеры которой включают метансульфонилокси, этансульфонилокси, пропансульфонилокси, бутансульфонилокси, пентансульфонилокси и гексансульфонилокси.
Примерами фенилсульфонилоксигруппы, необязательно замещенной в фенильном кольце одним или несколькими низшими алкильными группами, являются бензолсульфонилоксигруппы, которые могут быть замещены одним-тремя прямыми или разветвленными C1-6алкильными группами, такими как бензолсульфонилокси, о-толуолсульфонилокси, м-толуолсульфонилокси, п-толуолсульфонилокси, 2-этилбензолсульфонилокси, 3-этилбензолсульфонилокси, 4-этилбензолсульфонилокси, 2-пропилбензолсульфонилокси, 3-пропилбензолсульфонилокси, 4-пропилбензолсульфонилокси, 2,3-диметилбензолсульфонилокси, 2,4-диметилбензолсульфонилокси и 2,4,6-триметилбензолсульфонилокси.
Примеры атомов галогена включают фтор, бром, хлор и йод атомы.
Реакцию соединения (4) с соединением (5) проводят в подходящем растворителе в присутствии основного соединения.
Примеры используемых инертных растворителей включают воду; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 2-метоксиэтанол, момноглим и диглим; галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ и тетрахлорид углерода; низшие спирты, такие как метанол, этанол, изопропанол, бутанол, трет-бутанол и этиленгликоль; алифатические кислоты, такие как уксусная кислота; сложные эфиры, такие как этилацетат и метилацетат; кетоны, такие как ацетон и метилэтилкетон; ацетонитрил, пиридин, N-метилпирролидон, диметилсульфоксид, N,N-диметилформамид и гексаметилфософорамид; и смеси таких растворители.
Примеры основного соединения включают карбонаты, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и карбонат цезия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и гидроксид кальция; фосфаты, такие как фосфат калия и фосфат натрия; гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; щелочные металлы, такие как калий и натрий; амид натрия; алкоголяты металлов, такие как метилат натрия, этилат натрия и н-бутоксид натрия, трет-бутоксид натрия и трет-бутоксид калия; органические основания, такие как пиридин, имидазол,
N-этилдиизопропиламин, диметиламинопиридин, триэтиламин,
триметиламин, диметиланилин, N-метилморфолин,
1,5-диазабицикло[4.3.0]нонен-5 (DBN),
1,8-диазабицикло[5.4.0]ундецен-7 (DBU) и
1,4-диазабицикло[2.2.2]октан (DABCO); и смеси таких оснований.
Соединение (5) обычно используют в количестве по меньшей мере примерно 0,1 моль на моль соединения (4), предпочтительно примерно от 0,1 до примерно 10 моль на моль соединения (4).
Основное соединение (основание) обычно используют в количестве по меньшей мере примерно 1 моль на моль соединения (4), предпочтительно примерно от 1 до примерно 10 моль на моль соединения (4).
При проведении реакции вместо добавления основного соединения может быть использовано в большом избытке соединение (4).
При проведении реакции в реакционную систему могут быть добавлены соединения галогенидов щелочных металлов, такие как йодид натрия и йодид калия.
Реакцию обычно проводят при температуре примерно от 0 до примерно 200°C, предпочтительно примерно от 0 до примерно 150°C, и обычно реакция завершается в течение примерно от 5 минут до примерно 80 часов.
[Реакционная схема 4]
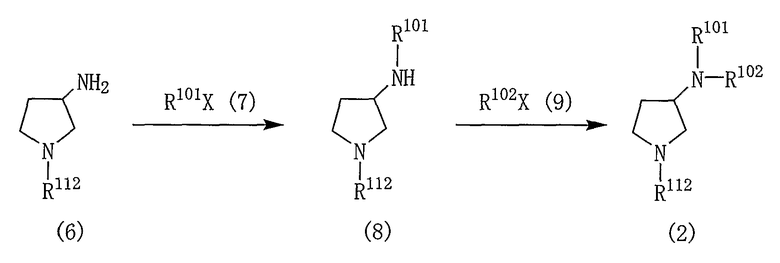
где R101, R102 и R112 являются такими, как указано выше, и X представляет собой атом галогена.
Реакцию между соединениями (6) и (7) и реакцию между соединениями (8) и (9) проводят в таких же условиях, как описано для реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Когда R101 или R102 в соединении (6) представляют собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (6) и соединением (7) проводят в подходящем растворителе в присутствии основного соединения и катализатора. Подобным образом, когда R101 или R102 в соединении (8) представляет собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (8) и соединением (9) проводят в подходящем растворителе в присутствии основного соединения и катализатора.
Растворитель и основание, используемые при проведении реакции, каждый может быть таким, как используемые при проведении реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Примеры катализаторов включают соединения палладия, такие как ацетат палладия,
бис(трибутилолово)/бис(дибензилиденацетон)палладий,
йодид меди/2,2'-бипиридил, бис(дибензилиденацетон)палладий,
трис(дибензилиденацетон)дипалладий,
[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) и
тетракис(трифенилфосфин)палладий; бинафтильные соединения, такие как R-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (R-BINAP), S-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (S-BINAP) и RAC-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (RAC-BINAP); ксантеновые соединения, такие как 4,5-бис(дифенилфосфино)-9,9-диметилксантен; бораты, такие как три-трет-бутилфосфинтетрафторборат; 2,2-бис(дифенилимидазолидинилиден); и их смеси.
Основание обычно используют в количестве по меньшей мере примерно 0,5 моль на моль соединения (6) или (8), предпочтительно примерно от 0,5 до примерно 40 моль на моль соединения (6) или (8).
Катализатор может быть использован в обычном каталитическом количестве для соединения (6) или (8).
Соединения (7) и (9) обычно используют в количествах по меньшей мере примерно от 0,5 моль на моль соединения (6) и (8) соответственно, предпочтительно примерно от 0,5 до примерно 3 моль на моль соединения (6) и (8).
Указанные реакции обычно удобно проводить при температуре от комнатной до примерно 200°C, предпочтительно от комнатной температуры до примерно 150°C, и обычно реакция завершается в течение примерно от 0,5 до примерно 20 часов.
Когда R101 или R102 в соединении (6) представляют собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (6) и соединением (7) проводят в подходящем растворителе в присутствии основного соединения, йодида меди и этиленгликоля. Подобным образом, когда R101 или R102 в соединении (8) представляет собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (8) и соединением (9) проводят в подходящем растворителе в присутствии основного соединения, йодида меди и этиленгликоля.
Растворитель и основание, используемые при проведении реакции, каждый может быть таким, как используемые при проведении реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Йодид меди и этиленгликоль, каждый, может быть обычно в количестве примерно от 0,1 до 3 моль, предпочтительно примерно от 0,05 до примерно 1 моль, на моль соединения (6) или (7).
Соединения (7) и (9) обычно используют в количествах по меньшей мере примерно 1 моль на моль соединений (6) и (8) соответственно, предпочтительно примерно от 1 до примерно 2 моль на моль соединений (6) и (8).
Указанные реакции обычно удобно проводить при температуре от комнатной до примерно 200°C, предпочтительно от комнатной температуры до примерно 150°C, и обычно реакция завершается в течение примерно от 0,5 до примерно 50 часов.
Когда R101 или R102 в соединении (6) представляют собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (6) и соединением (7) проводят в подходящем растворителе в присутствии соединения силана, такого как бис(триметилсилил)амид натрия. Подобным образом, когда R101 или R102 в соединении (8) представляют собой любую из групп, представленных (1)-(14), (17)-(32) и (40)-(50), реакцию между соединением (8) и соединением (9) проводят в подходящем растворителе в присутствии соединения силана, такого как бис(триметилсилил)амид натрия.
Растворитель, используемый при проведении реакции, может быть таким, как используемый при проведении реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Соединение силана обычно используют в количестве примерно от 0,1 до примерно 3 моль, предпочтительно примерно от 0,1 до примерно 2 моль, на моль соединений (6) или (7).
Соединения (7) и (9) обычно используют в количествах по меньшей мере примерно 1 моль на моль соединений (6) и (8) соответственно, предпочтительно примерно от 1 до примерно 2 моль на моль соединений (6) и (8).
Указанные реакции обычно удобно проводить при температуре примерно от 0 до примерно 200°C, предпочтительно примерно от 0 до примерно 150°C, и обычно реакция завершается в течение примерно от 0,5 до примерно 20 часов.
В зависимости от вида используемых соединений (7) взаимодействие соединения (6) и соединения (7) дает, вместо соединения (8), соединение (10), представленное ниже:
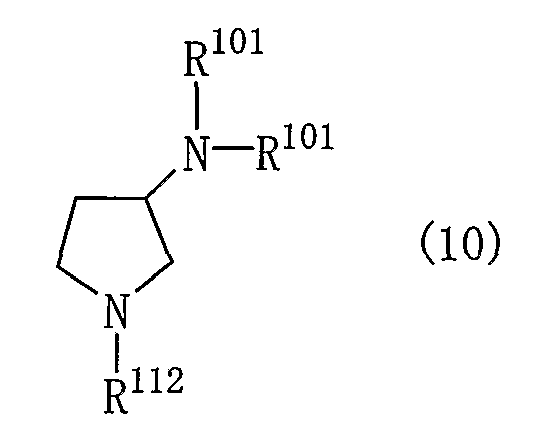
где R101 и R112 являются такими, как указано выше.
[Реакционная схема 5]
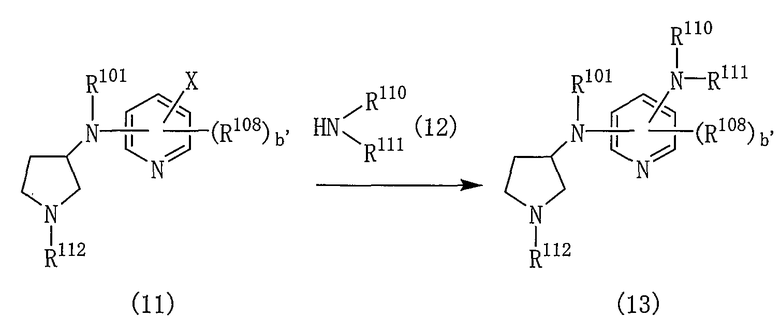
где R101 и X являются такими, как указано выше, R108 представляет собой любую из групп, представленных (1-1)-(1-37), как указано в общей формуле (1), R110 и R111 связаны вместе с образованием вместе с атомом азота, к которому они присоединены, 5-7-членной, содержащей один атом азота, насыщенной гетероциклической группы, которая может иметь один гетероатом, выбранный из группы, содержащей азот, кислород и серу, при этом гетероциклическая группа необязательно замещена одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы,
и b' представляет собой целое число от 0 до 3.
Примеры 5-7-членной, содержащей один атом азота, насыщенной гетероциклической группы, которая может иметь один гетероатом, выбранный из группы, содержащей азот, кислород и серу, включают пирролидинил, пиперазинил, пиперидинил, морфолино, тиоморфолино, гомопиперазинил, гомопиперидинил, имидазолидинил, тиазолидинил, изотиазолидинил, оксазолидинил, изоксазолидинил, изотиазолидинил и пиразолидинил.
Примеры указанных выше гетероциклических групп, замещенных одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; низшие алкильные группы; низшие алканоильные группы; фенил низшие алкильные группы; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и низшие алкоксигруппы; и пиридильные группы:
включают указанные выше гетероциклические группы, замещенные одним-тремя заместителями, выбранными из группы, содержащей оксогруппы; прямые или разветвленные C1-6алкильные группы; прямые или разветвленные C1-6алканоильные группы; фенилалкильные группы, где алкильная часть представляет собой прямую или разветвленную C1-6алкильную группу; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена, и прямые или разветвленные C1-6алкоксигруппы; и пиридильные группы;
такие как 2-оксо-(1-, 3-, 4- или 5-)пирролидинил,
2-оксо-(1-, 3-, 4-, 5- или 6-)пиперазинил,
4-метил-(1-, 2- или 3-)пиперазинил,
4-ацетил-(1-, 2- или 3-)пиперазинил,
4-этил-(1-, 2- или 3-)пиперазинил,
2-метил-(1-, 2-, 3-, 4- или 5-)пирролидинил,
2-метил-(1-, 2-, 3-, 4-, 5- или 6-)пиперидинил,
2,4-диметил-(1-, 2-, 3-, 5- или 6-)пиперидинил,
3-метил-(1-, 2-, 3-, 4- или 5-)пирролидинил,
2,3,4-триметил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
4-ацетил-3-метил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
3-метил-(2-, 3-, 4-, 5- или 6-)морфолино,
2-ацетил-(2-, 3-, 4-, 5- или 6-)морфолино,
4-(2-фенилэтил)-(1-, 2- или 3-)пиперазинил,
4-(3,4-дихлорфенил)-(1-, 2-, 3- или 4-)пиперазинил,
4-(4-метоксифенил)-(1-, 2- или 3-)пиперазинил,
4-(2-хлорфенил)-(1-, 2- или 3-)пиперазинил,
4-[(2-, 3- или 4-)пиридил]-(1-, 2- или 3-)пиперазинил,
4-фенил-(1-, 2- или 3-)пиперазинил,
4-бензил-(1-, 2- или 3-)пиперидинил,
4-(3,4-дихлорфенил)-(1-, 2- или 3-)морфолино,
2-(4-метоксифенил)-(1-, 2-, 3-, 4- или 5-)пирролидинил,
4-(2-хлорфенил)-(1-, 2- или 3-)пиперидинил,
4-[(2-, 3- или 4-)пиридил]-(1-, 2- или 3-)пиперидинил,
4-фенил-(1-, 2- или 3-)пиперидинил,
4-фенил-3-метил-(1-, 2-, 3-, 5- или 6-)пиперазинил,
4-[(2-, 3- или 4-)пиридил]-2-ацетил-(1-, 2-, 3-, 5- или 6-)пиперазинил и т.д.
Реакцию между соединением (11) и соединением (12) проводят в таких же условиях, как описано для реакции между соединениями (6) и (7), приведенной на реакционной схеме 4.
[Реакционная схема 6]
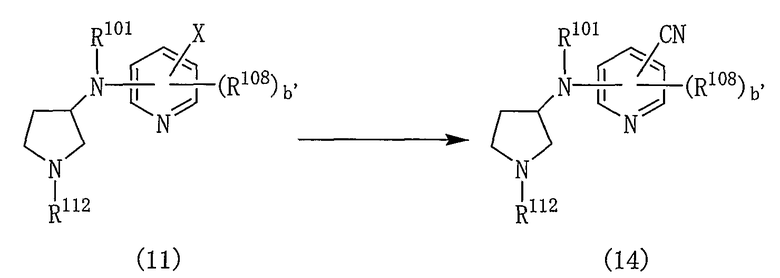
где R101, R108, b' и X являются такими, как указано выше.
Соединение (14) получают взаимодействием соединения (11) с соединением цианида металла в подходящем растворителе в присутствии катализатора.
Примеры соединений цианида металла включают цианид натрия, цианид калия, цианид цинка, цианид меди и т.д.
Растворитель и катализатор, используемые при проведении реакции, каждый может быть таким, как используемые при проведении реакции между соединениями (6) и (7), приведенной на реакционной схеме 4. Для соединения (11) катализатор может быть использован в обычном каталитическом количестве.
Соединение цианида металла обычно используют в количестве по меньшей мере примерно 1 моль на моль соединения (11), предпочтительно примерно от 1 до примерно 3 моль на моль соединения (11).
Реакцию удобно проводить обычно при температуре от комнатной до примерно 200°C, предпочтительно при комнатной температуре до примерно 150°C, и обычно реакция завершается в течение примерно от 0,5 до примерно 20 часов.
[Реакционная схема 7]

где R101, R108, b' и X являются такими, как указано выше, и R114 представляет собой любую из групп, представленных (1-3), (1-12), (1-14), (1-19), (1-23), (1-30) и (1-31) в общей формуле (1).
Реакцию между соединением (11) и соединением (15) проводят в таких же условиях, как описано для реакции между соединениями (6) и (7), приведенной на реакционной схеме 4.
[Реакционная схема 8]
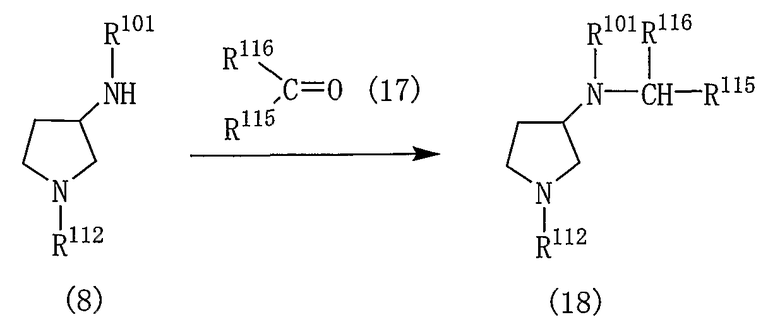
где R101 и R112 являются такими, как указано выше; R115 представляет собой фенильную группу, фенил низшую алкильную группу, циклоалкильную группу, циклоалкил низшую алкильную группу, низший алкилтио низшую алкильную группу, амино-замещенную низшую алкильную группу, необязательно замещенную на аминогруппе одной или двумя низшими алкильными группами, фенокси низшую алкильную группу или пиридил низшую алкильную группу; и R116 представляет собой атом водорода или низшую алкильную группу. Альтернативно, R115 и R116 могут быть связаны вместе с образованием циклоалкильной группы при условии, что общее число атомов углерода во фрагменте CH(R116)(R115) в боковой цепи -(R101)CH(R116)(R115) соединения (18) не превышает 6.
Реакцию между соединением (8) и соединением (17) проводят в таких же условиях, как описано для реакции между соединениями (3) и (4), приведенной на реакционной схеме 2, за исключением того, что соединение (17) используют обычно в количестве по меньшей мере 1 моль на моль соединения (8), предпочтительно 1-5 моль на моль соединения (8).
[Реакционная схема 9]
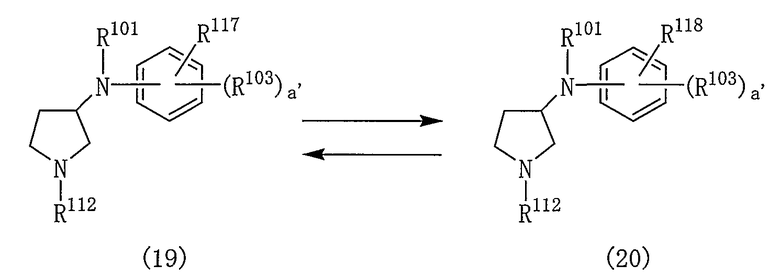
где R101 и R112 являются такими, как указано выше; a' представляет собой целое число от 0 до 4; R103 представляет собой любую из групп, представленных (1-1)-(1-37), как указано в общей формуле (1), R117 представляет собой низшую алкоксикарбонильную группу; и R118 представляет собой карбоксигруппу.
Соединение (20) получают гидролизом соединения (19).
Гидролиз соединения (19) проводят в подходящем растворителе или без растворителя в присутствии кислотного или основного соединения.
Примеры используемых растворителей включают воду; низшие спирты, такие как метанол, этанол, изопропанол и трет-бутанол; кетоны, такие как ацетон и метилэтилкетон; простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, момноглим и диглим; алифатические кислоты, такие как уксусная кислота и муравьиная кислота; сложные эфиры, такие как метилацетат и этилацетат; галогенированные углеводороды, такие как хлороформ, дихлорметан, дихлорэтан и тетрахлорид углерода; диметилсульфоксид, N,N-диметилформамид и гексаметилфософортриамид; и смеси таких растворители.
Примеры кислот включают минеральные кислоты, такие как хлористоводородная кислота, серная кислота и бромистоводородная кислота; и органические кислоты, такие как муравьиная кислота, уксусная кислота и сульфоновые кислоты, такие как трифторуксусная кислота и п-толуолсульфоновая кислота. Такие кислоты могут быть использованы отдельно или в сочетании.
Примеры оснований включают карбонаты, такие как карбонат натрия, калия карбонат, гидрокарбонат натрия и гидрокарбонат калия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и гидроксид лития; гидроксиды щелочноземельных металлов, такие как гидроксид кальция; и другие подобные основные соединения. Такие основные соединения могут быть использованы отдельно или в сочетании.
Реакцию гидролиза обычно удобно проводить при температуре примерно от 0 до примерно 200°C, предпочтительно примерно от 0 до примерно 150°C, и обычно реакция завершается в течение примерно от 10 минут до примерно 30 часов.
Соединение (19) получают взаимодействием соединения (20) с соединением, представленным общей формулой (21):
где R119 представляет собой низшую алкильную группу.
Условия, выбираемые обычно для реакций этерификации, являются такими, которые приемлемы для осуществления взаимодействия между соединениями (20) и (21). Например, реакция между соединениями (20) и (21) может быть проведена в присутствии минеральной кислоты, такой как хлористоводородная кислота и серная кислота; или галогенирующего агента, такого как тионилхлорид, оксихлорид фософора, пентахлорид фософора и трихлорид фософора. Соединение (21) используют в большом избытке относительно соединения (20). Реакцию обычно удобно проводить при температуре примерно от 0 до примерно 150°C, предпочтительно примерно от 50 до примерно 100°C, и обычно реакция завершается в течение примерно от 1 до примерно 10 часов.
[Реакционная схема 10]

где R101, R103, a' и R112 являются такими, как указано выше; R120 представляет собой низшую алкилтиогруппу; и R121 представляет собой низшую алкилсульфонильную группу.
Реакцию получения соединения (23) из соединения (22) проводят в подходящем растворителе в присутствии окисляющего агента.
Примеры используемых растворителей включают воду; алифатические кислоты, такие как муравьиная кислота, уксусная кислота и трифторуксусная кислота; спирты, такие как метанол и этанол; галогенированные углеводороды, такие как хлороформ и дихлорметан; и смеси таких растворители.
Примеры используемых окисляющих агентов включают перкислоты, такие как пермуравьиная кислота, перуксусная кислота, пертрифторуксусная кислота, пероксибензойные кислоты, м-хлорпероксибензойная кислота и о-карбоксипероксибензойная кислота; пероксид водорода; метапериодат натрия; дихроматы, такие как дихромовая кислота, дихромат натрия и дихромат калия; перманганаты, такие как пермарганцевая кислота, перманганат натрия и перманганат калия; соли свинца, такие как тетраацетат свинца.
Окисляющий агент обычно используют в количестве по меньшей мере примерно 2 моль на моль соединения (22), предпочтительно примерно от 2 до 4 моль на моль соединения (22).
Реакцию обычно проводят при температуре примерно от -10 до примерно 150°C, предпочтительно примерно от -10 до примерно 100°C, и обычно реакция завершается в течение примерно от 1 до примерно 10 часов.
[Реакционная схема 11]
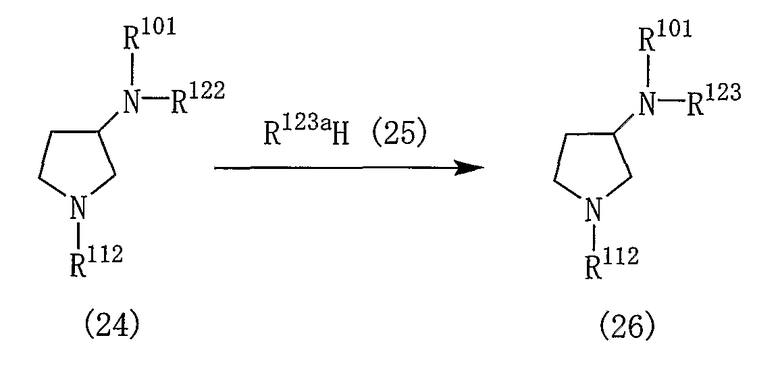
где R101 и R112 являются такими, как указано выше; R122 представляет собой низшую алкильную группу, содержащую один или несколько атомов галогена; R123 представляет собой амино-замещенную низшую алкильную группу, необязательно замещенную на аминогруппе одной или двумя низшими алкильными группами; и R123a представляет собой аминогруппу, необязательно замещенную на аминогруппе одной или двумя низшими алкильными группами.
Реакцию между соединением (24) и соединением (25) проводят в таких же условиях, как описано для реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Соединения (7) и (9), используемые в качестве исходных веществ, могут быть легко получены, например, способом, показанным на реакционной схеме ниже:
[Реакционная схема 12]
где X является таким, как указано выше, и R124 представляет собой низшую алкильную группу, содержащую один или несколько атомов галогена.
Реакцию между соединением (27) и соединением (28) проводят в таких же условиях, как описано для реакции между соединениями (5) и (4), приведенной на реакционной схеме 3.
Соединение (8), используемое в качестве исходного вещества, могут быть получено, например, способом, показанным на реакционной схеме 13 ниже:
[Реакционная схема 13]
где R103, a', X и R112 являются такими, как указано выше.
Реакцию получения соединение (31) из соединения (30) проводят, например, без растворителя или в подходящем растворителе в присутствии восстанавливающего агента.
Примеры используемых растворителей включают воду; низшие спирты, такие как метанол, этанол, изопропанол, бутанол, трет-бутанол и этиленгликоль; ацетонитрил; алифатические кислоты, такие как муравьиная кислота и уксусная кислота; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, момноглим и диглим; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, дихлорэтан, хлороформ и тетрахлорид углерода; и смеси таких растворители.
Примеры восстанавливающего агента включают восстанавливающие агенты для каталитического гидрирования, такие как палладиевая чернь, палладий на углероде, оксид платины, платиновая чернь и никель Ренея и тому подобное.
Восстанавливающий агент для каталитического гидрирования обычно используют в количестве примерно от 0,1 до 40 мас.%, предпочтительно примерно от 0,1 до примерно 20 мас.% относительно соединения (30).
Реакцию удобно проводить путем добавления к реакционной системе при проведении реакции основного соединения(ий), такого как гидроксид натрия.
Реакцию обычно проводят при температуре примерно от -30 до примерно 100°C, предпочтительно примерно от 0 до примерно 60°C, в атмосфере водорода при давлении от атмосферного до примерно 20 атм, предпочтительно от атмосферного давления до примерно 10 атм. Реакция обычно завершается в течение примерно от 1 до примерно 12 часов.
Соединения (3), (5) и (6), используемые в качестве исходных веществ, могут быть легко получены, например, в соответствии с реакционной схемой, представленной ниже:
[Реакционная схема 14]

где R112 и X являются такими, как указано выше, и R125 представляет собой оксогруппу, группу, представленную R113, или аминогруппу, где R113 имеет значения, указанные выше.
Реакцию между соединениями (32) и (33) проводят в таких же условиях, как описано для реакции между соединениями (5) и (4), приведенной на реакционной схеме 3 выше.
Соединение (4), используемое в качестве исходного вещества, легко получают, например, способом, показанным на реакционной схеме ниже:
[Реакционная схема 15]
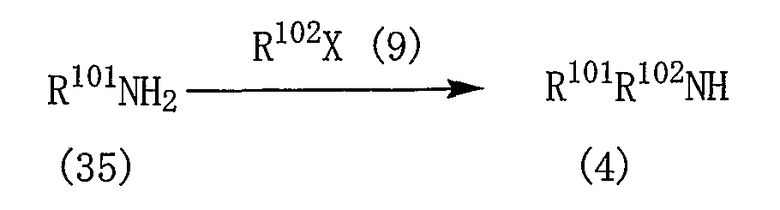
где R101, R102 и X являются такими, как указано выше.
Реакцию соединения (35) с соединением (9) проводят в таких же условиях, как описано для реакции соединения (6) с соединением (7), приведенной на реакционной схеме 4.
Соединения (2), (8), (13), (14), (16), (18), (19), (20), (23) и (26), в каждом из которых R112 представляет собой атом водорода, могут быть получены заменой R112 атомом водорода в соединениях (3), (5), (6), (8), (11), (19), (20), (22) и (24), которые используются в качестве исходных, в каждой реакции, приведенной на реакционных схемах 2-11, используя полученное таким образом соединение в качестве исходного вещества и подвергая исходное вещество взаимодействию в таких же условиях, как описано для реакций, приведенных на реакционных схемах 2-11.
Если в качестве исходного вещества (соединения (5), (6), (8), (11), (19), (20), (22) и (24)) в реакциях, приведенных на реакционных схемах 3-11, используют оптически активное вещество, то оптически активные соединения (2), (8), (13), (14), (16), (18), (19), (20), (23) и (26) могут быть получены реакцией соединения в таких же условиях, как описано для реакции, приведенной на реакционных схемах 3-11.
Возможно также получать соединение (1) настоящего изобретения, используя соединения (2), (8), (13), (14), (16), (18), (19), (20), (23) или (26), образующиеся в реакциях по реакционным схемам 2-11, используя их в качестве исходного вещества в реакции по реакционной схеме 1, без их выделения.
Каждое из целевых соединений, полученное в соответствии с указанной выше реакционной схемой, может быть выделено из реакционной смеси и очищено, например, после охлаждения реакционной смеси, выделение осуществляют методами, такими как фильтрование, концентрирование, экстракция и т.д., для выделения неочищенного продукта реакции и затем подвергают неочищенный продукт реакции обычными методами очистки, такими как колоночная хроматография, перекристаллизация и т.д.
Соединение общей формулы (1) в соответствии с настоящим изобретением включает его стереоизомеры и оптические изомеры.
Некоторые исходные соединения и целевые пирролидиновые соединения настоящего изобретения, имеющие основную группу или группы, могут образовывать соли с общеизвестными фармацевтически приемлемыми кислотами. Примеры таких кислот включают хлористоводородную кислоту, бромистоводородную кислоту, азотную кислоту, серную кислоту, фосфорную кислоту и другие неорганические кислоты; метансульфоновую кислоту, п-толуолсульфоновую кислоту, уксусную кислоту, лимонную кислоту, винную кислоту, малеиновую кислоту, фумаровую кислоту, яблочную кислоту, молочную кислоту и другие органические кислоты и т.д.
Некоторые исходные соединения и целевые пирролидиновые соединения настоящего изобретения, имеющие кислотную группу или группы, могут образовывать соли с общеизвестными фармацевтически приемлемыми основаниями. Примеры таких оснований включают гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия и т.д.
Кроме того, к исходным соединениям и целевым соединениям, представленным в каждой из реакционных формул, добавлены соединения в форме сольватов (например, гидрат, этанолат, и т.д.), и они включены к каждую из общих формул.
Фармацевтические препараты, содержащие соединение настоящего изобретения в качестве активного ингредиента, рассмотрены ниже.
Такие фармацевтические препараты получают путем включения соединения настоящего изобретения в стандартные фармацевтические препараты, используя обычно применяемые разбавители и/или эксципиенты, такие как заполнители, наполнители, связующие агенты, увлажняющие агенты, дезинтегранты, поверхностно-активные вещества, лубриканты и т.д.
Форма таких фармацевтических препаратов может быть выбрана из различными форм согласно целям терапии. Конкретные примеры включают таблетки, пилюли, порошки, растворы, суспензии, эмульсии, гранулы, капсулы, суппозитории, инъекции (растворы, суспензии и т.д.) и тому подобное.
При получении таблеток могут быть использованы любые из различных известных носителей, включая, например, лактозу, белый сахар, хлорид натрия, глюкозу, мочевину, крахмал, карбонат кальция, каолин, кристаллическую целлюлозу и другие эксципиенты; воду, этанол, пропанол, простой сироп, растворы глюкозы, растворы крахмала, желатиновые растворы, карбоксиметилцеллюлозу, шеллак, метилцеллюлозу, фосфат калия, поливинилпирролидон и другие связующие агенты; сухой крахмал, альгинат натрия, порошок агара, порошок ламинарана, гидрокарбонат натрия, карбонат кальция, эфиры жирных кислот и полиоксиэтилэтиленсорбитана, лаурилсульфат натрия, моноглицериды стеариновой кислоты, крахмал, лактозу и другие дезинтегранты; белый сахар, стеарин, масло какао, гидрированные масла и другие ингибиторы разложения; четвертичные аммониевые основания, лаурилсульфат натрия и другие усилители абсорбции; глицерин, крахмал и другие увлажняющие агенты; крахмал, лактозу, каолин, бентонит, коллоидную кремниевую кислоту и другие адсорбенты; очищенный тальк, стеараты, порошок борной кислоты, полиэтиленгликоль и другие лубриканты; и т.д.
Такие таблетки, при необходимости, могут быть покрыты обычными веществами для покрытий для получения, например, таблеток, покрытых сахаром, таблеток, покрытых желатином, таблеток с покрытием, устойчивым в желудочном соке, таблеток, покрытых пленкой, таблеток с дву- или мультислойным покрытием и т.д.
При получении пилюль могут быть использованы любые из различных известных носителей, включая, например, глюкозу, лактозу, крахмал, масло какао, гидрированные растительные масла, каолин, тальк и другие эксципиенты; порошок гуммиарабика, порошок трагаканта, желатин, этанол и другие связующие агенты; ламинаран, агар и другие дезинтегранты; и т.д.
При получении суппозиториев могут быть использованы любые из различных известных носителей, включая, например, полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и т.д.
При получении инъекции, раствора, эмульсии или суспензии их стерилизуют и предпочтительно делают изотоничными по отношению к крови. Для получения раствора, эмульсии или суспензии Могут быть использованы любые из различных известных широкоиспользуемых разбавителей. Примеры таких разбавителей включают воду, этанол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, эфиры жирных кислот и полиоксиэтилэтиленсорбитана и т.д. В этом случае фармацевтический препарат может содержать хлорид натрия, глюкозу или глицерин в количестве, достаточном для приготовления изотоничного раствора, и может содержать обычные солюбилизаторы, буферы, аналгезирующие агенты и т.д. и дополнительно, при необходимости, окрашивающие агенты, консерванты, ароматизаторы, подслащивающие агенты и т.д., и/или другие лекарственные средства.
Количественное содержание соединения настоящего изобретения в фармацевтическом препарате не ограничивается и может быть соответствующим образом выбрано из широкой области. Обычно предпочтительно, чтобы фармацевтический препарат содержал соединение настоящего изобретения в количестве от 1 до 70 мас.%.
Путь введения фармацевтического препарата настоящего изобретения не ограничивается, и препарат вводят таким путем, который является подходящим для формы препарата, возраста и пола пациента, статуса болезни и других условий. Например, таблетки, пилюли, растворы, суспензии, эмульсии, гранулы и капсулы вводят перорально. Инъекции вводят внутривенно отдельно или в виде смешанных с обычными инъекционными растворами, такими как растворы глюкозы, растворы аминокислот или тому подобное, или вводят отдельно внутримышечно, внутрикожно, подкожно или внутрибрюшинно, при необходимости. Суппозитории вводят ректально.
Дозировку фармацевтического препарата выбирают походящим образом в соответствии со способом применения, возраста и пола пациента, серьезности заболевания и других условий, и она составляет обычно примерно от 0,001 до примерно 100 мг/кг массы тела/день, предпочтительно 0,001-50 мг/кг массы тела/день, в виде разовой или раздельных доз.
Поскольку дозировка изменяется в зависимости от различными условий, может быть достаточной дозировка меньше, чем указано выше, или может применяться более высокий уровень доз, чем указано выше.
Производное пирролидина настоящего изобретения обладает ингибирующим действием повторного поглощения одного, двух или трех видов моноаминов (т.е. серотонина, норэпинефрина, допамина).
Производное пирролидина настоящего изобретения проявляет значительно более сильную ингибирующую активность поглощения в отношении представителя указанных трех моноаминов по сравнению с известными соединениями, обладающими ингибирующей активностью поглощения в отношении моноаминов в экспериментах in vitro или ex vivo. В микродиализном исследовании производное пирролидина настоящего изобретения также проявляет значительно более сильное действие при усилении одного из указанных трех моноаминов в мозге крыс по сравнению с известными соединениями, обладающими ингибирующей активностью поглощения в отношении моноаминов.
Производное пирролидина настоящего изобретения обладает более широким спектром для медицинского лечения, чем известные антидепрессанты.
Производное пирролидина настоящего изобретения проявляет достаточное терапевтическое действие даже после кратковременного введения.
Производное пирролидина настоящего изобретения обладает превосходной биодоступностью, слабой подавляющей метаболизм ферментов в печени активностью, небольшими побочными эффектами и является весьма безопасным.
Производное пирролидина настоящего изобретения проявляет сильную активность у мышей в тесте принудительного плавания/подвешивания за хвост, которые используют при скрининге антидепрессантов. Производное пирролидина настоящего изобретения также проявляет сильную активность у крыс в тесте принудительного плавания, который используют при скрининге антидепрессантов. Производное пирролидина настоящего изобретения также проявляет сильную активность на модели индуцированной резерпином гипотермии, которую используют при скрининге антидепрессантов.
Производное пирролидина настоящего изобретения также проявляет сильную активность у мышей в тесте поведенческой беспомощности (marble-burying behavior test) и на модели стресса, обусловленного страхом, которые являются моделями болезней, связанных с беспокойством или стрессом.
Производное пирролидина настоящего изобретения обладает ингибирующим действием повторного поглощения одного, двух или трех видов моноаминов (т.е. серотонина, норэпинефрина, допамина), и поэтому является эффективным при лечении различных нарушений, вызванных уменьшением нейротрансмиссии серотонина, норэпинефрина или допамина.
Примеры таких заболеваний включают гипертензию, депрессии (т.е. глубокую депрессию, биполярное расстройство 1, биполярное расстройство 2, смешанный эпизод, дистимические расстройства, «быстрый цикл», атипичную депрессию, сезонные аффективные расстройства, послеродовую депрессию, слабую депрессию, повторяющиеся краткие депрессивные расстройства, непостоянную депрессию/хроническую депрессию, двойную депрессию, вызванную алкоголем нарушения настроения, смешанную тревогу и депрессивные расстройства; депрессии, вызванные различными физическими нарушениями, такие как болезнь Кушинга, гипотироидизм, синдром гиперпаратироидизма, болезнь Аддисона, синдром отсутствия месячных и лактации, болезнь Паркинсона, болезнь Альцгеймера, кровоизлияние в мозг, диабеты, синдром хронической усталости и рака; депрессию среднего возраста, старческую депрессию, детскую и подростковую депрессию, депрессию, вызванную приемом лекарств, таких как интерфероны, депрессию, вызванную нарушением адаптации, тревогу, вызванную нарушением адаптации, тревогу, вызванную различными физическими нарушениями (т.е. невропатия (травма головы, мозговая инфекция, заболевание внутреннего уха), сердечно-сосудистые патологии (остановка сердечной деятельности, аномальный сердечный ритм), эндокринные нарушения (гиперфункция надпочечников, экзофтальмическая кахексия), проблемы с дыханием (астма, хроническая обструктивная болезнь легких)), расстройства, вызванные тревогой, страхи (т.е. агорафобия, социальная фобия и простые фобии), синдром посттравматического стресса, синдром острого стресса, избегающее расстройство личности, расстройство дизморфизм тела, преждевременная эякуляция, нарушения питания (т.е. нервная анорексия и нервная булимия), ожирение, пристрастия к химическим веществам (т.е. к алкоголю, кокаину, героину, фенобарбиталу, никотину и бензодиазепинам), кластерную головную боль, мигрень, болевые расстройства, болезнь Альцгеймера, обсессивно-конвульсивные расстройства, панические расстройства, расстройства памяти (т.е. деменция, амнезия и связанное со старением ослабление обучаемости (ARCD)), болезнь Паркинсона (т.е. деменция, вызванная болезнью Паркинсона, синдром Паркинсона, вызванный нейролептическим агентом, поздняя дискинезия), эндокринные нарушения (т.е.,гиперпролактинемия), сосудистый спазм (в частности, в кровеносной системе головного мозга), церебральную атаксию, расстройства желудочно-кишечного тракта (включая изменение в сокращении и секреции), отрицательный синдром шизофрении, предменструальный синдром, синдром фибромиалгии, несдержанность в стрессовых ситуациях, синдром Туретта, трихотилломанию, клептоманию, мужскую импотенцию, нарушение внимания с гиперактивностью (ADHD), хроническую парксизмальную гемикранию, хроническую усталость, катаплексию, синдром апноэ во сне и головную боль (относящуюся к ангиопатии).
Пример получения, ссылочные примеры, примеры и Фармакологические примеры исследования представлены ниже.
Пример получения 1
Соединение настоящего изобретения (100 г), 40 г Avicel (торговое название, производится фирмой Asahi Kasei Corporation), 30 г кукурузного крахмала и 2 г стеарата магния смешивали, растирали и затем таблетировали, используя пробивной штамп диаметром 10,0 мм для покрытых сахаром таблеток. На полученные таким образом таблетки наносили покрытие, используя агент для нанесения пленки, содержащий 10 г TC-5 (торговое название, Shin-Etsu Chemical Co., Ltd., гидроксипропилметилцеллюлоза), 3 г полиэтиленгликоль 6000, 40 г касторового масла, и подходящее количество этанола, получая покрытые пленкой таблетки, содержащие указанные выше ингредиенты.
Ссылочный пример 1
Синтез трет-бутилового эфира 3-[(3,4-дихлорфенил)-(4-фторфенил)амино]пирролидин-1-карбоновой кислоты
Гидрид натрия (0,19 г, 60%-ный в масле) добавляли к 10 мл диметилсульфоксида (ДМСО) и перемешивали при 60°C в течение одного часа. Далее к смеси добавляли 1,0 г (3,4-дихлорфенил)-(4-фторфенил)амина и перемешивали при 60°C в течение одного часа. Постепенно к смеси добавляли раствор ДМСО, содержащий 2,0 г трет-бутилового эфира 3-(толуол-4-сульфонилокси)пирролидин-1-карбоновой кислоты, и перемешивали при 60°C в течение 15 часов. К реакционному раствору добавляли этилацетат. Раствор затем промывали водой и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=20:1). Растворитель, используемый в качестве элюента, отгоняли при пониженном давлении, получая таким образом 0,29 г коричневого маслянистого продукта, трет-бутилового эфира 3-[(3,4-дихлорфенил)-(4-фторфенил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,74-1,92 (1H, м), 2,04-2,22 (1H, м), 3,10-3,35 (3H, м), 3,61-3,85 (1H, м), 4,31-4,48 (1H, м), 6,42 (1H, дд, J=2,9 Гц, J=8,9 Гц), 6,67 (1H, д, J=2,8 Гц), 6,90-7,22 (5H, м).
Ссылочный пример 2
Синтез трет-бутилового эфира 3(S)-[(3,4-дихлорфенил)фениламино]пирролидин-1-карбоновой кислоты
К 20 мл диметилсульфоксида (ДМСО) добавляли гидрид натрия (0,36 г, 60%-ный в масле) и перемешивали при 60°C в течение одного часа. Далее к смеси добавляли 2,0 г 3,4-дихлорфенилфениламина и перемешивали при 60°C в течение одного часа. Постепенно к смеси добавляли раствор ДМСО, содержащий 1,5 г трет-бутилового эфира 3(R)-метансульфонилоксипирролидин-1-карбоновой кислоты, и перемешивали при 60°C в течение 15 часов. К реакционному раствору добавляли этилацетат, реакционный раствор затем промывали водой и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=20:1). Растворитель, используемый в качестве элюента, отгоняли при пониженном давлении, получая таким образом 0,13 г светло-коричневого аморфного твердого продукта, трет-бутилового эфира 3(S)-[(3,4-дихлорфенил)фениламино]пирролидин 1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,42 (9H, с), 1,73-1,93 (1H, м), 2,05-2,23 (1H, м), 3,10-3,36 (3H, м), 3,61-3,83 (1H, м), 4,33-4,50 (1H, м), 6,48 (1H, дд, J=2,9 Гц, J=10,3 Гц), 6,74 (1H, д, J=2,8 Гц), 6,96-7,07 (2H, м), 7,16-7,34 (2H, м), 7,35-7,46 (2H, м).
Ссылочный пример 3
Синтез ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)амина
Толуольный раствор, содержащий 2,2 г (S)-1-бензилпирролидин-3-иламина (12,5 ммоль), 2,2 г 3-бромфторбензола (12,5 ммоль), 0,31 г 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (BINAP, 0,51 ммоль), 0,14 г бис(дибензилиденацетон)палладия (Pd(dba)2, 0,22 ммоль) и 1,3 г трет-бутоксида натрия (13,2 ммоль) нагревали при кипении с обратным холодильником в атмосфере азота в течение 3 часов. Реакционный раствор фильтровали для удаления нерастворенных продуктов и к фильтрату добавляли этилацетат и воду для разделения раствора на слои. Органический слой промывали водой, растворитель отгоняли при пониженном давлении, и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=20:1→1:1). Растворитель, используемый в качестве элюента, отгоняли при пониженном давлении, получая таким образом 3,0 г маслянистого бесцветного продукта, ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)амина.
1H-ЯМР (CDCl3) δ м.д.:: 1,59-1,78 (2H, м), 2,21-2,38 (1H, м), 2,39-2,50 (1H, м), 2,55 (1H, дд, J=3,3 Гц, J=9,7 Гц), 2,71-2,85 (2H, м), 3,63 (2H, с), 3,90-4,10 (1H, м), 6,24 (1H, дт, J=2,3 Гц, J=11,6 Гц), 6,29-6,41 (2H, м), 7,02-7,11 (1H, м), 7,21-7,39 (5H, м).
Ссылочный пример 4
Синтез ((S)-1-бензилпирролидин-3-ил)фениламина
((S)-1-Бензилпирролидин-3-ил)-фениламин синтезировали, используя (S)-1-бензилпирролидин-3-иламин и бромбензол, аналогично методике ссылочного примера 3.
Маслянистое коричневое вещество
1H-ЯМР (CDCl3) δ м.д.:: 1,56-1,78 (2H, м), 2,22-2,39 (1H, м), 2,41-2,58 (1H, м), 2,70-2,84 (2H, м), 3,63 (2H, с), 4,01 (1H, с), 6,57 (2H, д, J=8,5 Гц), 6,64-6,73 (1H, м), 7,11-7,19 (2H, м), 7,21-7,36 (5H, м).
Ссылочный пример 5
Синтез ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)-(4-трифторметилфенил)амина
Толуольный раствор, содержащий 0,7 г ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)амина (2,6 ммоль), 0,59 г 4-бромбензотрифторида (2,6 ммоль), 65 мг BINAP (0,1 ммоль), 23 мг ацетата палладия (0,1 ммоль) и 0,28 г трет-бутоксида натрия (2,9 ммоль) нагревали при кипении с обратным холодильником в атмосфере азота в течение 3 часов. Реакционный раствор фильтровали для удаления нерастворенных продуктов и к фильтрату добавляли этилацетат и воду для разделения раствора на слои. Органический слой промывали водой и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=20:1→10:1). Растворитель, используемый в качестве элюента, отгоняли при пониженном давлении, получая таким образом 0,48 г маслянистого бесцветного продукта, ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)-(4-трифторметилфенил)амина.
1H-ЯМР (CDCl3) δ м.д.:: 1,82-2,01 (1H, м), 2,17-2,31 (1H, м), 2,61-2,78 (3H, м), 3,45 (1H, д, J=12,9 Гц), 3,64 (1H, д, J=12,9 Гц), 4,55 (1H, м), 6,78-6,86 (3H, м), 6,88-6,96 (2H, м), 7,19-7,36 (6H, м).
Ссылочный пример 6
Синтез трет-бутилового эфира 3(S)-(3-хлор-4-фторфениламино)пирролидин-1-карбоновой кислоты
К 50 мл толуольного раствора, содержащего 5,0 г трет-бутилового эфира 3(S)-аминопирролидин-1-карбоновой кислоты (27 ммоль) и 5,7 г 4-бром-2-хлор-1-фторбензола (27 ммоль), добавляли 1,7 г BINAP (2,7 ммоль), 0,30 г ацетата палладия (1,3 ммоль) и 3,5 г трет-бутоксида натрия (36 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 8 часов и затем охлаждали до комнатной температуры. К реакционному раствору добавляли воду и экстрагировали этилацетатом. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из диэтилового эфира, получая таким образом 4,76 г белого порошкообразного продукта, трет-бутилового эфира 3(S)-(3-хлор-4-фторфениламино)пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,47 (9H, с), 1,78-1,96 (1H, м), 2,10-2,28 (1H, м), 2,10-2,28 (1H, м), 3,11-3,30 (1H, м), 3,30-3,56 (2H, м), 3,57-3,79 (2H, м), 3,85-4,03 (1H, м), 6,38-6,47 (1H, м), 6,60 (1H, дд, J=6,0 Гц, J=2,9 Гц), 6,90-7,00 (1H, м).
Ссылочный пример 7
Синтез трет-бутилового эфира 3(S)-(3-хлор-4-фторфениламино)пирролидин-1-карбоновой кислоты
К 50 мл раствора в изопропиловом спирте, содержащем 15,0 г трет-бутилового эфира 3(S)-аминопирролидин-1-карбоновой кислоты (80,5 ммоль) и 24,8 г 2-хлор-1-фтор-4-йодбензола (96,7 ммоль), добавляли 1,54 г йодида меди (I) (8,1 ммоль), 9,0 мл этиленгликоля (10,1 ммоль) и 34,2 г фосфата калия (161 ммоль) и нагревали при кипении с обратным холодильником в атмосфере азота в течение 46 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали, используя целит. Оставшийся продукт на фильтре промывали этилацетатом, фильтрат концентрировали при пониженном давлении вместе с промывками и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из диэтилового эфира, получая таким образом 15,9 г белого порошкообразного продукта, трет-бутилового эфира 3(S)-(3-хлор-4-фторфениламино)пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,47 (9H, с), 1,78-1,96 (1H, м), 2,10-2,28 (1H, м), 2,10-2,28 (1H, м), 3,11-3,30 (1H, м), 3,30-3,56 (2H, м), 3,57-3,79 (2H, м), 3,85-4,03 (1H, м), 6,38-6,47 (1H, м), 6,60 (1H, дд, J=6,0 Гц, J=2,9 Гц), 6,90-7,00 (1H, м).
Ссылочный пример 8
Синтез трет-бутилового эфира 3(S)-(3-цианофениламино)пирролидин-1-карбоновой кислоты
К толуольному раствору (7 мл), содержащему 2,82 г трет-бутилового эфира 3(S)-аминопирролидин-1-карбоновой кислоты (15 ммоль) и 1,82 г 3-бромбензонитрила (10 ммоль), добавляли 68,5 мг BINAP (0,11 ммоль), 22,5 мг ацетата палладия (0,1 ммоль) и 3,91 г карбоната цезия (12 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 8 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду и экстрагировали дихлорметаном. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая таким образом 1,56 г светло-желтого порошкообразного продукта, трет-бутилового эфира 3(S)-(3-цианофениламино)пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,46 (9H, с), 1,8-2,0 (1H, м), 2,1-2,3 (1H, м), 3,1-3,6 (3H, м), 3,6-3,8 (1H, м), 3,9-4,1 (2H, м), 6,7-6,9 (2H, м), 6,99 (1H, д, J=7,6 Гц), 7,23 (1H, дд, J=7,6 Гц, J=8,4 Гц).
Ссылочный пример 9
Синтез трет-бутилового эфира 3(S)-(3-хлор-4-метоксифениламино)пирролидин-1-карбоновой кислоты
К 5 мл толуольного раствора, содержащего 0,20 г трет-бутилового эфира 3(S)-аминопирролидин-1-карбоновой кислоты (1,1 ммоль) и 0,238 г 2-хлор-3-броманизола (1,1 ммоль), добавляли 67,0 мг BINAP (0,11 ммоль), 24 мг трис(дибензилиденацетон)дипалладия (0,027 ммоль) и 144 мг трет-бутоксида натрия (1,5 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота при 100°C в течение одного часа. После охлаждения до комнатной температуры реакционный раствор фильтровали, используя целит. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=10:1→3:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая таким образом 0,28 г светло-желтого аморфного твердого продукта, трет-бутилового эфира 3(S)-(3-хлор-4-метоксифениламино)пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,47 (9H, с), 1,80-1,90 (1H, м), 2,10-2,20 (1H, м), 3,10-3,25 (1H, м), 3,38-3,75 (3H, м), 3,83 (3H, с), 3,92-3,96 (1H, м), 6,47 (1H, дд, J=2,8 Гц, J=8,8 Гц), 6,67 (1H, д, J=2,8 Гц), 6,81 (1H, д, J=8,8 Гц).
Ссылочный пример 10
Синтез трет-бутилового эфира 3(S)-(4-метоксифениламино)пирролидин-1-карбоновой кислоты
К 10 мл этанольного раствора, содержащего 0,28 г трет-бутилового эфира 3(S)-(3-хлор-4-метоксифениламино)пирролидин-1-карбоновой кислоты, добавляли 0,2 мл 5н. раствора гидроксида натрия и 0,1 г 10% палладия на углероде. Каталитическое восстановление проводили при комнатной температуре и атмосферном давлении (нормальное давление). Реакционный раствор фильтровали, используя целит, и концентрировали при пониженном давлении. К остатку добавляли воду и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и концентрировали досуха при пониженном давлении, получая таким образом 0,25 г желтого аморфного твердого продукта, трет-бутилового эфира 3(S)-(4-метоксифениламино)пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,46 (9H, с), 1,79-1,88 (1H, м), 2,10-2,22 (1H, м), 3,12-3,25 (1H, м), 3,30-3,52 (3H, м), 3,60-3,75 (4H, м), 3,88-4,00 (1H, м), 6,50-6,58 (2H, м), 6,72-6,80 (2H, м).
Ссылочный пример 11
Синтез трет-бутилового эфира 3(S)-[бис-(3-фторфенил)амино]пирролидин-1-карбоновой кислоты
К 10 мл толуольного раствора, содержащего 1,0 г трет-бутилового эфира 3(S)-аминопирролидин-1-карбоновой кислоты (5,3 ммоль) и 2,3 г 3-бром-1-фторбензола (13 ммоль), добавляли 32 мг тетрафторбората три-трет-бутилфосфина (0,11 ммоль), 24 мг ацетата палладия (0,11 ммоль) и 1,5 г трет-бутоксида натрия (16 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 8 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду и экстрагировали этилацетатом. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая таким образом 1,56 г желтого маслянистого продукта, трет-бутилового эфира 3(S)-[бис-(3-фторфенил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,78-1,95 (1H, м), 2,02-2,26 (1H, м), 3,12-3,39 (3H, м), 3,65-3,83 (1H, м), 4,35-4,51 (1H, м), 6,61 (2H, дт, J=2,1 Гц, J=11,0 Гц), 6,61-6,68 (2H, м), 6,77 (2H, т, J=8,0 Гц), 7,18-7,31 (2H, м).
Ссылочный пример 12
Синтез трет-бутилового эфира 3(S)-[(3,4-дихлорфенил)тиазол-2-иламино] пирролидин-1-карбоновой кислоты
К 150 мл толуольного раствора, содержащего 20,0 г трет-бутилового эфира 3(S)-(3,4-дихлорфениламино)пирролидин-1-карбоновой кислоты (60,4 ммоль) и 15,0 г 2-бромтиазола (91,5 ммоль), добавляли 1,86 г тетрафторбората три-трет-бутилфосфина (6,4 ммоль), 2,88 г трис(дибензилиденацетон)дипалладия (3,15 ммоль) и 11,6 г трет-бутоксида натрия (120 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 9 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали, используя целит. К фильтрату добавляли воду и экстрагировали этилацетатом. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая таким образом 7,94 г желтого порошкообразного продукта, трет-бутилового эфира 3(S)-[(3,4-дихлорфенил)тиазол-2-иламино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,83-2,03 (1H, м), 2,11-2,35 (1H, м), 3,18-3,42 (3H, м), 3,73-3,87 (1H, м), 4,97-5,09 (1H, м), 6,53 (1H, д, J=3,5 Гц), 7,14 (1H, дд, J=2,5 Гц, J=8,5 Гц), 7,22 (1H, ушир.с), 7,39 (1H, д, J=2,5 Гц), 7,56 (1H, ушир.д, J=8,5 Гц).
Ссылочный пример 13
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)пиридин-3-иламино]пирролидин-1-карбоновой кислоты
К 10 мл толуольного раствора, содержащего 1,0 г трет-бутилового эфира 3(S)-(3-хлор-4-фторфениламино)пирролидин-1-карбоновой кислоты (3,2 ммоль) и 0,75 г 3-бромпиридина (4,75 ммоль), добавляли 50 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена (XANTPHOS, 0,09 ммоль), 21,4 мг ацетата палладия (0,10 ммоль) и 11,6 г трет-бутоксида натрия (120 ммоль). Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 9 часов. После охлаждения до комнатной температуры реакционный раствор фильтровали, используя целит. К фильтрату добавляли воду и экстрагировали этилацетатом. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=1:1). Очищенный продукт концентрировали при пониженном давлении, получая таким образом 1,14 г светло-желтого маслянистого продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)пиридин-3-иламино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,79-1,98 (1H, м), 2,08-2,29 (1H, м), 3,12-3,41 (3H, м), 3,65-3,85 (1H, м), 4,38-4,51 (1H, м), 6,83-6,91 (1H, м), 7,00-7,23 (4H, м [включая 7,04 м.д.: (дд, J=2,7 Гц, J=6,4 Гц)]), 8,14 (1H, с), 8,22 (1H, д, J=4,4 Гц).
Ссылочный пример 14
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)циклогексиламино]пирролидин-1-карбоновой кислоты
3 мл раствора уксусной кислоты, содержащего 0,60 г трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (1,9 ммоль) и 0,56 г циклогексанона (5,7 ммоль), перемешивали при комнатной температуре в течение ночи. К смеси добавляли 1,21 г триацетоксиборгидрида натрия (5,7 ммоль), затем перемешивали при комнатной температуре в течение 8 часов. К реакционному раствору добавляли дихлорметан, реакционный раствор промывали водой и насыщенным водным раствором гидрокарбоната натрия и затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=10:1). Растворитель отгоняли из очищенного продукта при пониженном давлении, получая таким образом 0,24 г бесцветного маслянистого продукта, трет-бутилового эфира 3-[(S)-(3-хлор-4-фторфенил)циклогексиламино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 0,81-1,32 (6H, м), 1,44 (9H, с), 1,60-2,00 (6H, м), 2,79-2,93 (1H, м), 2,98-3,10 (1H, м), 3,16-3,31 (1H, м), 3,35-3,70 (2H, м), 3,35-3,70 (2H, м), 3,85-4,07 (1H, м), 6,85-7,13 (3H, м).
Ссылочный пример 15
Синтез трет-бутилового эфира 3(S)-[(4-карбоксифенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты
К этанольному раствору, содержащему 1,7 г трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-этоксикарбонилфенил)амино]пирролидин-1-карбоновой кислоты (3,7 ммоль), добавляли 6 мл 5н. раствора гидроксида натрия, затем перемешивали при комнатной температуре в течение 15 часов. К реакционному раствору добавляли дихлорметан и уксусную кислоту для подкисления реакционного раствора. После промывания водой три раза и насыщенным водным раствором гидрокарбоната натрия один раз растворитель отгоняли при пониженном давлении, получая таким образом 1,50 г белого порошкообразного продукта, трет-бутилового эфира 3(S)-[(4-карбоксифенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,33 (9H, с), 1,72-1,88 (1H, м), 2,06-2,26 (1H, м), 2,99-3,23 (3H, м), 3,61 (1H, дд, J=6,4 Гц, J=11,3 Гц), 4,53-4,69 (1H, м), 6,57-6,65 (2H, м), 7,19-7,28 (1H, м), 7,46-7,58 (2H, м), 7,68-7,78 (2H, м), 12,3 (1H, ушир.с).
Ссылочный пример 16
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-метансульфонилфенил)амино]пирролидин-1-карбоновой кислоты
К дихлорметановому раствору, содержащему 0,45 г трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-метансульфанилфенил)амино]пирролидин-1-карбоновой кислоты (1,0 ммоль), добавляли 0,54 г метахлорпероксибензойной кислоты (3,1 ммоль) при 0°C, затем перемешивали при 0°C в течение 2 часов. Реакционный раствор промывали водой, сушили над сульфатом магния и растворитель отгоняли при пониженном давлении. Далее остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=5:1→1:1). Из очищенного продукта при пониженном давлении отгоняли растворитель, получая таким образом 0,42 г светло-желтого маслянистого продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-метансульфонилфенил)амино]пирролидин 1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,80-1,91 (1H, м), 2,11-2,29 (1H, м), 3,01 (3H, с), 3,16-3,40 (3H, м), 3,70-3,86 (1H, м), 4,49-4,61 (1H, м), 6,62 (2H, д, J=9,0 Гц), 7,03 (1H, ддд, J=2,6 Гц, J=4,1 Гц, J=8,6 Гц), 7,01-7,06 (1H, м), 7,19-7,23 (1H, м), 7,24-7,31 (1H, м), 7,66-7,74 (2H, м).
Ссылочный пример 17
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(6-цианопиридин-2-ил)амино]пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-[(6-бромпиридин-2-ил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (500 мг, 1,06 ммоль), цианид цинка (250 мг, 2,12 ммоль) и тетракис(трифенилфосфин)палладия (122 мг, 0,106 ммоль) суспендировали в 8 мл диметилформамида (ДМФА), затем перемешивали в атмосфере азота при 110°C в течение 9 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли этилацетат и воду для разделения раствора на слои. Органический слой промывали водой и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=6:1→3:1). Из очищенного продукта при пониженном давлении отгоняли растворитель, получая таким образом 398 мг маслянистого бесцветного продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(6-цианопиридин-2-ил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,44 (9H, с), 1,74-1,84 (1H, м), 2,03-2,24 (1H, м), 3,08-3,32 (3H, м), 3,76-3,86 (1H, м), 5,28-5,38 (1H, м), 6,21 (1H, д, J=8,7 Гц), 7,04-7,11 (2H, м), 7,23-7,42 (3H, м).
Ссылочный пример 18
Синтез трет-бутилового эфира 3(S)-{(3-хлор-4-фторфенил)-[5-(4-фторфенил)пиридин-2-ил]амино}пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-[(5-бромпиридин-2-ил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (300 мг, 0,64 ммоль), 4-фторфенилборную кислоту (98 мг, 0,7 ммоль), тетракис(трифенилфосфин)палладий (23 мг, 0,02 ммоль) и 2M водный раствора карбонат натрия (0,83 мл) добавляли к толуолу (3 мл), затем перемешивали в атмосфере азота при 100°C в течение 10 часов. После охлаждения до комнатной температуры этилацетат и воду добавляли к реакционному раствору для разделения раствора на слои. Органический слой промывали насыщенным раствором соли, затем сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=5:1). Из очищенного продукта при пониженном давлении отгоняли растворитель, получая таким образом 255 мг белого твердого продукта, трет-бутилового эфира 3(S)-{(3-хлор-4-фторфенил)-[5-(4-фторфенил)пиридин-2-ил]амино}пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,44 (9H, с), 1,78-1,89 (1H, м), 2,05-2,23 (1H, м), 3,07-3,31 (3H, м), 3,85 (1H, дд, J=7,1, 10,8 Гц), 5,31-5,42 (1H, м), 6,08 (1H, д, J=8,8 Гц), 7,06-7,14 (3H, м), 7,20-7,28 (2H, м), 7,41-7,50 (3H, м), 8,37-8,41 (1H, м).
Ссылочный пример 19
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-тиофен-3-илфенил)амино]пирролидин-1-карбоновой кислоты
Используя трет-бутиловый эфир 3(S)-[(4-бромфенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты и 3-тиофенборную кислоту, синтезировали трет-бутиловый эфир (S)-[(3-хлор-4-фторфенил)-(4-тиофен-3-илфенил)амино]пирролидин-1-карбоновой кислоты аналогично методике ссылочного примера 93.
Бесцветное маслянистое вещество
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,83-1,88 (1H, м), 2,05-2,20 (1H, м), 3,18-3,31 (3H, м), 3,63-3,84 (1H, м), 4,40-4,51 (1H, м), 6,71-6,80 (1H, м), 6,85-6,88 (2H, м), 6,94 (1H, дд, J=2,8 Гц, J=6,4 Гц), 7,05-7,10 (1H, м), 7,30-7,45 (3H, м), 7,50-7,55 (2H, м).
Ссылочный пример 20
Синтез трет-бутилового эфира (S)-{(3-хлор-4-фторфенил)-[6-(4-метилпиперазин-1-ил)пиридин-2-ил]амино}пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-[(6-бромпиридин-2-ил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (200 мг, 0,43 ммоль), 1-метилпиперазин (0,61 мл, 0,55 ммоль), 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (XANTPHOS, 12 мг, 0,02 ммоль), трис(дибензилиденацетон)дипалладия (9 мг, 0,01 ммоль) и трет-бутоксида натрия (61 мг, 0,63 ммоль) добавляли к толуолу (5 мл), затем перемешивали в атмосфере азота при 100°C в течение 8 часов. Нерастворенные продукты удаляли фильтрованием и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Из очищенного продукта при пониженном давлении отгоняли растворитель, получая таким образом 102 мг маслянистого бесцветного продукта, трет-бутилового эфира (S)-{(3-хлор-4-фторфенил)-[6-(4-метилпиперазин-1-ил)пиридин-2-ил]амино}пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,44 (9H, с), 1,74-1,89 (1H, м), 2,03-2,21 (1H, м), 2,36 (3H, с), 2,51-2,55 (4H, м), 3,08-3,31 (3H, м), 3,54 (4H, ушир.с), 3,64-3,90 (1H, м), 5,10-5,23 (1H, м), 5,32 (1H, д, J=8,1 Гц), 6,01 (1H, д, J=8,1 Гц), 7,03-7,08 (1H, м), 7,19-7,25 (3H, м).
Ссылочный пример 21
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(4-пиперидин-1-илфенил)амино]пирролидин-1-карбоновой кислоты
Используя трет-бутиловый эфир 3(S)-[(4-бромфенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты и пиперидин, трет-бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)-(4-пиперидин-1-илфенил)амино]пирролидин-1-карбоновой кислоты синтезировали аналогично методике ссылочного примера 11.
Маслянистое бесцветного продукта вещество
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,55-1,62 (2H, м), 1,68-1,73 (4H, м), 1,74-1,90 (1H, м), 2,02-2,18 (1H, м), 3,16-3,29 (7H, м), 3,61-3,81 (1H, м), 4,23-4,38 (1H, м), 6,40-6,46 (1H, м), 6,59-6,62 (1H, м), 6,86-6,92 (5H, м).
Ссылочный пример 22
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-цианофенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты
К безводному толуольному раствору, содержащему трет-бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (0,50 г, 1,6 ммоль) и 2-хлор-4-фторбензонитрил (0,30 г, 1,9 ммоль), добавляли 1,45 мл тетрагидрофуранового раствора, содержащего бис(триметилсилил)амид натрия (1,1M), используя шприц. Смесь нагревали при кипении с обратным холодильником в атмосфере азота в течение 8 часов и охлаждали до комнатной температуры. К реакционному раствору добавляли воду и экстрагировали диэтиловым эфиром. После сушки над сульфатом натрия и концентрирования при пониженном давлении остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая таким образом 0,56 г белого аморфного твердого продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-цианофенил)-(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,43 (9H, с), 1,76-1,93 (1H, м), 2,11-2,27 (1H, м), 3,15-3,39 (3H, м), 3,66-3,87 (1H, м), 4,39-4,55 (1H, м), 6,42 (1H, дд, J=2,5 Гц, J=9,0 Гц), 6,57 (1H, д, J=2,5 Гц), 6,98-7,04 (1H, м), 7,20 (1H, дд, J=2,5 Гц, J=6,5 Гц), 7,23-7,32 (1H, м), 7,40 (1H, д, J=8,5 Гц).
Ссылочный пример 23
Синтез 2-(4-хлорбутокси)пиридина
К раствору в ДМФА (110 мл), содержащему 2-пиридинол (10 г, 105 ммоль) и 1-бром-4-хлорбутан (36 мл, 315 ммоль), добавляли карбоната калия (16 г, 116 ммоль), затем перемешивали при комнатной температуре в течение 8 часов. К реакционному раствору добавляли воду (300 мл) и затем экстрагировали этилацетатом (300 мл). Органический слой промывали водой (300 мл) дважды и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=5:1). Очищенный продукт концентрировали при пониженном давлении, получая таким образом 3,32 г маслянистого бесцветного продукта, 2-(4-хлорбутокси)пиридина.
Ссылочный пример 24
Синтез трет-бутилового эфира 3(S)-[4-(пиридин-2-илокси)бутиламино]пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-аминопирролидин-1-карбоновой кислоты (0,93 г, 5,0 ммоль), 2-(4-хлорбутокси)пиридин (0,93 г, 5,0 ммоль), карбонат калия (0,83 г, 6,0 ммоль) и йодид натрия (0,83 г, 5,5 ммоль) суспендировали в ацетонитриле (20 мл) и нагревали при кипении с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду (50 мл) и экстрагировали этилацетатом (50 мл). Органический слой промывали водой дважды и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=3:1). Очищенный продукт концентрировали при пониженном давлении, получая таким образом 372 мг маслянистого бесцветного продукта, трет-бутилового эфира 3(S)-[4-(пиридин-2-илокси)бутиламино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,46 (9H, с), 1,5-1,9 (6H, м), 1,95-2,15 (1H, м), 2,68 (2H, т, J=7 Гц), 2,95-3,15 (1H, м), 3,25-3,65 (4H, м), 4,30 (2H, т, J=6,5 Гц), 6,71 (1H, д, J=8,5 Гц), 6,85 (1H, дд, J=5,5 Гц, J=6,5 Гц), 7,5-7,65 (1H, м), 8,14 (1H, дд, J=2 Гц, J=5 Гц).
Ссылочный пример 25
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(3-хлорпропил)амино]пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (3 г, 9,5 ммоль), 1-бром-3-хлорпропан (4,7 мл, 48 ммоль) и карбонат калия (1,97 г, 14,3 ммоль) суспендировали в N-метилпирролидон (NMP, 15 мл), затем перемешивали при 100°C в течение 8 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду и экстрагировали этилацетатом. После сушки органического слоя над сульфатом натрия растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=3:1) и очищенный продукт концентрировали при пониженном давлении, получая таким образом 1,0 г маслянистого бесцветного продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(3-хлорпропил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,46 (9H, с), 1,7-2,1 (4H, м), 3,1-3,35 (4H, м), 3,35-3,7 (4H, м), 3,8-4,1 (1H, м), 6,7-6,9 (1H, м), 6,9-7,1 (2H, м).
Ссылочный пример 26
Синтез трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(3-диметиламинопропил)амино]пирролидин-1-карбоновой кислоты
трет-Бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)-(3-хлорпропил)амино]пирролидин-1-карбоновой кислоты (0,5 г, 1,24 ммоль), 50%-ный раствор диметиламина (1 мл) и йодид натрия (0,37 г, 2,5 ммоль) суспендировали в ДМФА (3 мл), затем перемешивали при 60°C в течение 4 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду и экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем отгоняли растворитель при пониженном давлении. Остаток очищали основной колоночной хроматографией на силикагеле (этилацетат) и очищенный продукт затем концентрировали при пониженном давлении, получая таким образом, 0,36 г маслянистого бесцветного продукта, трет-бутилового эфира 3(S)-[(3-хлор-4-фторфенил)-(3-диметиламинопропил)амино]пирролидин-1-карбоновой кислоты.
1H-ЯМР (CDCl3) δ м.д.:: 1,46 (9H, с), 1,5-1,75 (4H, м), 1,75-2,1 (2H, м), 2,19 (6H, с), 3,0-3,3 (4H, м), 3,3-3,75 (2H, м), 3,8-4,2 (1H, м), 6,6-6,8 (1H, м), 6,8-7,1 (2H, м).
Соединения, приведенные ниже, получали по методикам, аналогично указанным в вышеприведенных ссылочных примерах.
Пример 1
Синтез дигидрохлорида (3,4-дихлорфенил)фенилпирролидин-3-иламина
Раствор уксусной кислоты (15 мл), содержащий трет-бутиловый эфир, содержащий 3-оксопирролидин-1-карбоновой кислоты (0,67 г) и (3,4-дихлорфенил)фениламин (0,94 г), перемешивали при комнатной температуре в течение ночи. К смеси добавляли 1,5 г триацетоксиборгидрида натрия, затем перемешивали при комнатной температуре в течение 8 часов. К реакционному раствору добавляли дихлорметан и промывали водой, затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=20:1). Из очищенного продукта отгоняли при пониженном давлении растворитель, остаток растворяли в смеси 1н. хлористоводородная кислота-этанол и нагревали при кипении с обратным холодильником в течение одного часа. Реакционный раствор концентрировали досуха, получая таким образом 50 мг коричневого аморфного твердого продукта, дигидрохлорида (3,4-дихлорфенил)фенилпирролидин-3-иламина.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,50-1,68 (1H, м), 2,10-2,29 (1H, м), 2,74-2,90 (1H, м), 3,02-3,22 (2H, м), 3,51-3,66 (1H, м), 4,61-4,79 (1H, м), 6,58 (1H, дд, J=2,9 Гц, J=9,0 Гц), 6,87 (1H, д, J=2,9 Гц), 7,13-7,19 (2H, м), 7,29-7,44 (2H, м), 7,45-7,54 (2H, м), 9,03 (2H, ушир.с).
Пример 2
Синтез дигидрохлорида (S)-(3,4-дихлорфенил)фенилпирролидин-3-иламина
трет-Бутиловый эфир 3(S)-[(3,4-дихлорфенил)фениламино]пирролидин-1-карбоновой кислоты (0,13 г) растворяли в смеси 1н. хлористоводородная кислота-этанол и нагревали при кипении с обратным холодильником в течение одного часа. Реакционный раствор концентрировали досуха, получая таким образом 0,11 г коричневого аморфного твердого продукта, гидрохлорида 3(S)-(3,4-дихлорфенил)фенилпирролидин-3-иламина.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,50-1,68 (1H, м), 2,10-2,29 (1H, м), 2,75-2,90 (1H, м), 3,02-3,23 (2H, м), 3,51-3,65 (1H, м), 4,60-4,80 (1H, м), 6,58 (1H, дд, J=2,9 Гц, J=9,0 Гц), 6,87 (1H, д, J=2,9 Гц), 7,12-7,19 (2H, м), 7,29-7,44 (2H, м), 7,45-7,54 (2H, м), 9,05 (2H, ушир.с).
Пример 3
Синтез дифумарата (3-фторфенил)-(S)-пирролидин-3-ил(4-трифторметилфенил)амина
К 1,2-дихлорметановому раствору (1 мл), содержащему ((S)-1-бензилпирролидин-3-ил)-(3-фторфенил)-(4-трифторметилфенил)амин (0,48 г, 1,1 ммоль), добавляли 1-хлорэтилхлорформиат (0,82 г, 5,8 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов и нагревали при кипении с обратным холодильником в течение 3 часов. Растворитель отгоняли при пониженном давлении, затем к остатку добавляли 5 мл метанола и нагревали при кипении с обратным холодильником в течение 3 часов. После отгонки растворителя при пониженном давлении остаток затем растворяли в дихлорметане и промывали насыщенным водным раствором гидрокарбоната натрия. После сушки над сульфатом магния растворитель отгоняли при пониженном давлении. Остаток растворяли в этаноле, затем добавляли фумаровую кислоту (128 мг, 1,1 ммоль), получая однородный раствор. Растворитель отгоняли при пониженном давлении и кристаллы, образовавшиеся при добавлении к остатку дихлорметана, отделяли фильтрованием и сушили, получая 0,24 г светло-коричневого порошкообразного продукта, дифумарата (3-фторфенил)-(S)-пирролидин-3-ил-(4-трифторметилфенил)амина.
Температура плавления 144,0-146,2°C.
Пример 4
Синтез гидрохлорида (3-хлор-4-фторфенил)-(4-метансульфонилфенил)-(S)-пирролидин-3-иламина
трет-Бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)-(4-метансульфонилфенил)амино]пирролидин-1-карбоновой кислоты (0,42 г, 0,9 ммоль) добавляли к смеси 4н. хлористоводородная кислота/этилацетат, затем перемешивали при комнатной температуре в течение одного часа. Реакционный раствор концентрировали досуха при пониженном давлении, получая, таким образом, 0,35 г белого порошкообразного продукта, гидрохлорида (3-хлор-4-фторфенил)-(4-метансульфонилфенил)-(S)-пирролидин-3-иламина.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,56-1,68 (1H, м), 2,19-2,29 (1H, м), 2,82-2,94 (1H, м), 3,08 (3H, с), 3,10-3,20 (2H, м), 3,57-3,68 (1H, м), 4,70-4,85 (1H, м), 6,69-6,75 (2H, м), 7,32-7,37 (1H, м), 7,58-7,64 (1H, м), 7,65-7,69 (3H, м), 9,10-9,45 (2H, м).
Пример 5
Синтез дифумарата (3-хлор-4-фторфенил)-[4-(пиридин-2-илокси)бутил]-(S)-пирролидин-3-иламина
К толуольному раствору (4 мл), содержащему трет-бутиловый эфир 3(S)-[4-(пиридин-2-илокси)бутиламино]пирролидин-1-карбоновой кислоты (0,2 г, 0,6 ммоль) и 4-бром-2-хлор-1-фторбензол (0,8 мл, 0,65 ммоль), добавляли тетрафторборат три-трет-бутилфосфина (14 мг, 0,05 ммоль), трис(дибензилиденацетон)дипалладий (11 мг, 0,012 ммоль) и трет-бутоксид натрия (110 мг, 1,2 ммоль) и нагревали при кипении с обратным холодильником в атмосфере азота в течение 12 часов. После охлаждения до комнатной температуры к реакционному раствору добавляли воду и экстрагировали этилацетатом. Экстракт сушили над сульфатом магния, концентрировали при пониженном давлении и остаток затем очищали хроматографией на колонке с силикагелем (н-гексан:этилацетат=3:1). Из очищенного продукта отгоняли при пониженном давлении растворитель. Остаток растворяли в 0,4 мл дихлорметан и добавляли трифторуксусную кислоту (0,06 мл, 0,8 ммоль), затем перемешивали при комнатной температуре в течение 3 часов. После концентрирования при пониженном давлении остаток очищали ВЭЖХ. После отбора соответствующих фракций растворитель отгоняли при пониженном давлении, к остатку добавляли 10% водный раствор карбоната калия и затем экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния, концентрировали при пониженном давлении и к остатку (этанольный раствор) добавляли этанольный раствор, содержащий фумаровую кислоту (8,1 мг), получая таким образом однородный раствор. После концентрирования при пониженном давлении к остатку добавляли воду (3 мл), затем сушили вымораживанием, получая таким образом 19 мг белого твердого продукта, дифумарата (3-хлор-4-фторфенил)-[4-(пиридин-2-илокси)бутил]-(S)-пирролидин-3-иламина.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,45-1,55 (2H, м), 1,65-1,8 (2H, м), 1,8-1,95 (1H, м), 2,05-2,15 (1H, м), 2,6-4,05 (11H, м), 4,25 (2H, т, J=6,5 Гц), 4,3-4,4 (1H, м), 6,55 (4H, с), 6,77 (1H, д, J=8,5 Гц), 6,8-6,9 (1H, м), 6,9-7,0 (1H, м), 7,03 (1H, дд, J=3 Гц, J=6,5 Гц), 7,22 (1H, дд, J=9 Гц, J=9 Гц), 7,65-7,7 (1H, м), 8,1-8,15 (1H, м).
Пример 6
Синтез гидрохлорида (3-хлор-4-фторфенил)-(3-метилсульфанилпропил)-(S)-пирролидин-3-иламина
Раствор уксусной кислоты (3 мл), содержащий трет-бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)амино]пирролидин-1-карбоновой кислоты (0,60 г, 1,9 ммоль) и 3-метилтиопропионовый альдегид (0,6 г, 5,7 ммоль), перемешивали при комнатной температуре в течение ночи. К смеси добавляли триацетоксиборгидрид натрия (0,81 г, 3,8 ммоль), затем перемешивали при комнатной температуре в течение 15 часов. К реакционному раствору добавляли дихлорметан, реакционный раствор промывали водой и насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток затем растворяли в смеси 1н. хлористоводородная кислота-этанол (10 мл) и нагревали при кипении с обратным холодильником в течение одного часа. Реакционный раствор концентрировали досуха, получая таким образом 0,16 г желтого аморфного твердого продукта, гидрохлорида (3-хлор-4-фторфенил)-(3-метилсульфанилпропил)-(S)-пирролидин-3-иламина.
1H-ЯМР (ДМСО-d6) δ м.д.:: 1,52-1,70 (2H, м), 1,80-2,18 (включая 5H, м [2,07 м.д.: (с)]), 2,40-2,51 (2H, м), 2,84-3,49 (6H, м), 4,29-4,49 (1H, м), 6,85-6,95 (1H, м), 7,05-7,35 (2H, м), 9,30-9,79 (2H, м).
Пример 7
Синтез диметансульфоната (3-хлор-4-фторфенил)пиридин-3-ил-(S)-пирролидин-3-иламина
К дихлорметановому раствору (100 мл), содержащему трет-бутиловый эфир 3(S)-[(3-хлор-4-фторфенил)пиридин-3-иламино]пирролидин-1-карбоновой кислоты (16,0 г, 41 ммоль), добавляли трифторуксусную кислоту (20 мл), затем перемешивали при комнатной температуре в течение 3 часов. Растворитель отгоняли при пониженном давлении, к остатку добавляли насыщенный водный раствор гидрокарбоната натрия для подщелачивания остатка и затем экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния, растворитель отгоняли при пониженном давлении и остаток очищали основной колоночной хроматографией на силикагеле (дихлорметан:метанол=10:1). Из очищенного продукта отгоняли при пониженном давлении растворитель. К этанольному раствору, содержащему остаток, добавляли метансульфоновую кислоту (9,2 г) и растворитель затем отгоняли при пониженном давлении. Остаток перекристаллизовывали этанола, получая таким образом 16,9 г белого порошкообразного продукта, диметансульфоната (3-хлор-4-фторфенил)пиридин-3-ил-(S)-пирролидин-3-иламина.
Температура плавления 194,0-195,0°C.
Соединения примеров 8-1180, представленные в таблицах ниже, могут быть получены по методикам, аналогично указанным в примерах выше, используя соответствующие исходные соединения. В следующих таблицах соединения с указанными физико-химическими характеристиками, такими как кристаллическая форма, т.пл. (температура плавления), соль, 1H-ЯМР и МС (масс спектр), были действительно получены.
Фармакологическое исследование 1
Оценка ингибирующей активности исследуемого соединения в отношении поглощения серотонина (5-HT) в синаптосому мозга крыс
Самцов крыс Вистар декапитировали, мозг удаляли и отсекали лобную часть головного мозга. Отделенную лобную часть головного мозга гомогенизировали в 20 объемах 0,32M раствора сахарозы с помощью гомогенизатора типа гомогенизатора Поттера. Гомогенат центрифугировали при 1000g при температуре 4°C в течение 10 минут и супернатант затем центрифугировали при 20000g при температуре 4°C в течение 20 минут. Осадок ресуспендировали в инкубационном буфере (20 мМ HEPES буфер (pH 7,4)), содержащем 10 мМ глюкозы, 145 мМ хлорида натрия, 4,5 мМ хлорида калия, 1,2 мМ хлорида магния и 1,5 мМ хлорида кальция), и использовали в качестве неочищенных синаптосомных фракций.
Реакционную смесь для поглощения суспендировали в конечном объеме 200 мкл, содержащем паргилин (конечная концентрация 10 мкМ) и аскорбат натрия (конечная концентрация 0,2 мг/мл) в каждой лунке 96-луночного планшета с круглым дном.
В каждую лунку добавляли растворитель, немеченый 5-HT, и серийно разведенные исследуемые соединения и добавляли синаптосомные фракции в количестве 1/10 объема от конечного объема. Спустя 10 минут предварительной инкубации при температуре 37°C поглощение инициировали добавлением раствора 5-HT, меченного тритием (конечная концентрация 8 нМ), при температуре 37°C. Поглощение останавливали через 10 минут вакуумным фильтрованием через 96-луночный фильтровальный планшет со стеклянными волокнами. После промывания фильтра холодным физиологическим раствором и сушки добавляли Microscint-O (Perkin-Elmer) и измеряли остаточную радиоактивность на фильтре.
Общую активность поглощения только с одним растворителем принимали за 100% и неспецифическую активность поглощения с немеченым 5-HT (конечная концентрация 10 мкМ) принимали за 0%. 50%-ные ингибирующие концентрации рассчитывали на основе концентраций исследуемых соединений и их ингибирующей активности. Результаты представлены в таблице 160.
Фармакологическое исследование 2
Оценка ингибирующей активности исследуемого соединения в отношении поглощения норэпинефрина (NE) в синаптосому мозга крыс
Самцов крыс Вистар декапитировали, мозг удаляли и отсекали гиппокамп. Отделенный гиппокамп гомогенизировали в 20 объемах 0,32M раствора сахарозы с помощью гомогенизатора типа гомогенизатора Поттера. Гомогенат центрифугировали при 1000g при температуре 4°C в течение 10 минут и супернатант затем центрифугировали при 20000g при температуре 4°C в течение 20 минут. Осадок ресуспендировали в инкубационном буфере (20 мМ HEPES буфер (pH 7,4)), содержащем 10 мМ глюкозы, 145 мМ хлорида натрия, 4,5 мМ хлорида калия, 1,2 мМ хлорида магния и 1,5 мМ хлорида кальция), и использовали в качестве неочищенных синаптосомных фракций.
Реакционную смесь для поглощения суспендировали в конечном объеме 200 мкл, содержащем паргилин (конечная концентрация 10 мкМ) и аскорбат натрия (конечная концентрация 0,2 мг/мл) в каждой лунке 96-луночного планшета с круглым дном.
В каждую лунку добавляли растворитель, немеченый NE, и серийно разведенные исследуемые соединения и добавляли синаптосомные фракции в количестве 1/10 объема от конечного объема. Спустя 10 минут предварительной инкубации при температуре 37°C поглощение инициировали добавлением раствора NE, меченного тритием (конечная концентрация 12 нМ), при температуре 37°C. Поглощение останавливали через 10 минут вакуумным фильтрованием через 96-луночный фильтровальный планшет со стеклянными волокнами. После промывания фильтра холодным физиологическим раствором и сушки добавляли Microscint-O (Perkin-Elmer) и измеряли остаточную радиоактивность на фильтре.
Общую активность поглощения только с одним растворителем принимали за 100%, и неспецифическую активность поглощения с немеченым NE (конечная концентрация 10 мкМ) принимали за 0%. 50%-ные ингибирующие концентрации рассчитывали на основе концентраций исследуемых соединений и их ингибирующей активности. Результаты представлены в таблице 161.
Фармакологическое исследование 3
Оценка ингибирующей активности исследуемого соединения в отношении поглощения допамина (DA) в синаптосому мозга крыс
Самцов крыс Вистар декапитировали, мозг удаляли и отсекали полосатое тело. Отделенное полосатое тело гомогенизировали в 20 объемах 0,32M раствора сахарозы с помощью гомогенизатора типа гомогенизатора Поттера. Гомогенат центрифугировали при 1000g при температуре 4°C в течение 10 минут и супернатант затем центрифугировали при 20000g при температуре 4°C в течение 20 минут. Осадок ресуспендировали в инкубационном буфере (20 мМ HEPES буфер (pH 7,4)), содержащем 10 мМ глюкозы, 145 мМ хлорида натрия, 4,5 мМ хлорида калия, 1,2 мМ хлорида магния и 1,5 мМ хлорида кальция), и использовали в качестве сырых синаптосомных фракций
Реакционную смесь для поглощения суспендировали в конечном объеме 200 мкл, содержащем паргилин (конечная концентрация 10 мкМ) и аскорбат натрия (конечная концентрация 0,2 мг/мл) в каждой лунке 96-луночного планшета с круглым дном.
В каждую лунку добавляли растворитель, немеченый DA, и серийно разведенные исследуемые соединения и добавляли синаптосомные фракции в количестве 1/10 объема от конечного объема. Спустя 10 минут предварительной инкубации при температуре 37°C поглощение инициировали добавлением раствора DA, меченного тритием (конечная концентрация 28 нМ), при температуре 37°C.
Поглощение останавливали через 10 минут вакуумным фильтрованием через 96-луночный фильтровальный планшет со стеклянными волокнами. После промывания фильтра холодным физиологическим раствором и сушки добавляли Microscint-O (Perkin-Elmer) и измеряли остаточную радиоактивность на фильтре.
Активность поглощения только с одним растворителем принимали за 100%, и неспецифическую активность поглощения с немеченым DA (конечная концентрация 10 мкМ) принимали за 0%. 50%-ные ингибирующие концентрации рассчитывали на основе концентраций исследуемых соединений и их ингибирующей активности. Результаты представлены в таблице 162.
Фармакологическое исследование 4
Тест принудительного плавания
Тест принудительного плавания проводили на основе способа, описанного Porsolt, R.D., et al. (Porsolt, R.D., et al., Behavioural despair in mice: primary screening test for antidepressants. Arch. Int. Pharmacodyn., 229, pp 327-336 (1977) с некоторыми модификациями.
Исследуемое соединение суспенди./об.) и затем вводили перорально самцам мышей ICR (от фирмы Clea Japan Inc., 5-6-недельные). Через один час после введения мышей бросали в резервуар, содержащий 9,5 см воды, поддерживая температуру 21-25°C. Затем мышей принуждали плавать в течение 6 минут. На протяжении последних четырех минут исследования определяли период времени, в течение которого мыши не двигались (т.е. время отсутствия подвижности). Анализ и обработку данных по времени отсутствия подвижности проводили, используя систему SCANET MV-20 AQ (название продукта фирмы Melquest Co., Ltd.).
В этом исследовании животное, обработанное исследуемым соединением, демонстрировало уменьшение времени отсутствия подвижности. Поэтому ясно, что исследуемое соединение является эффективным в качестве антидепрессанта.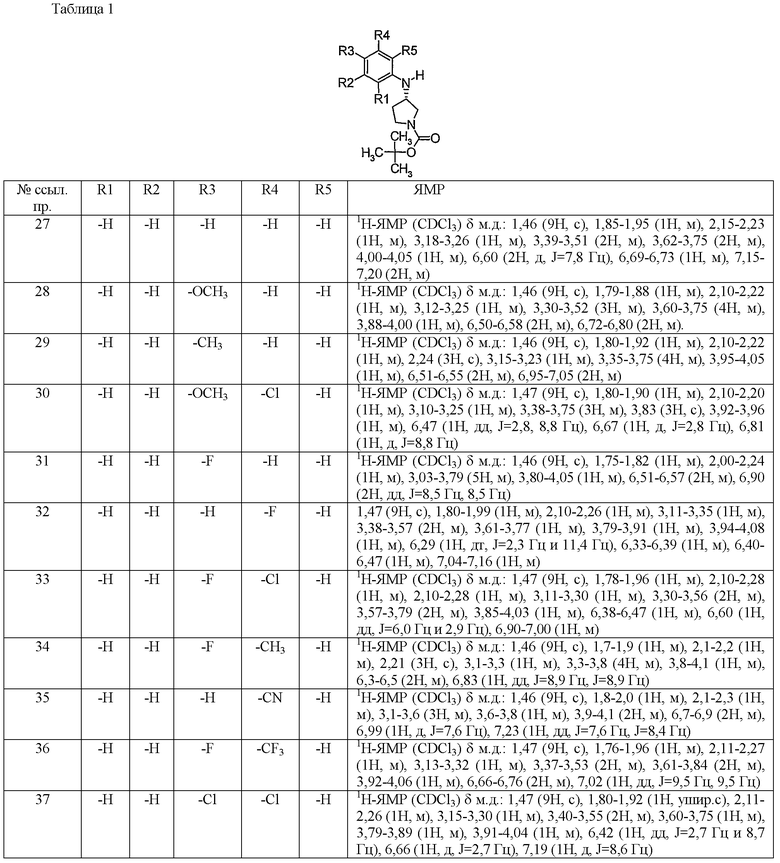
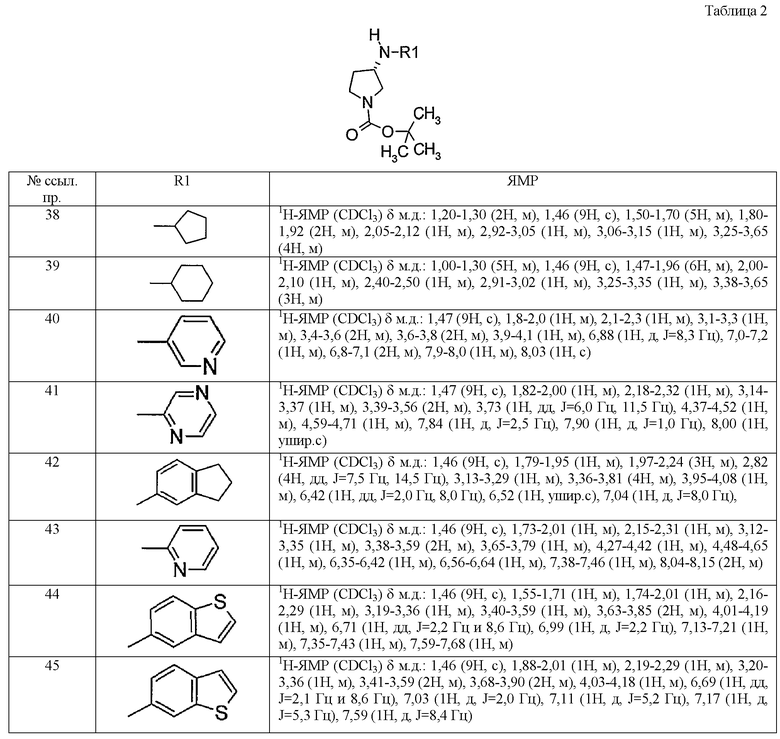
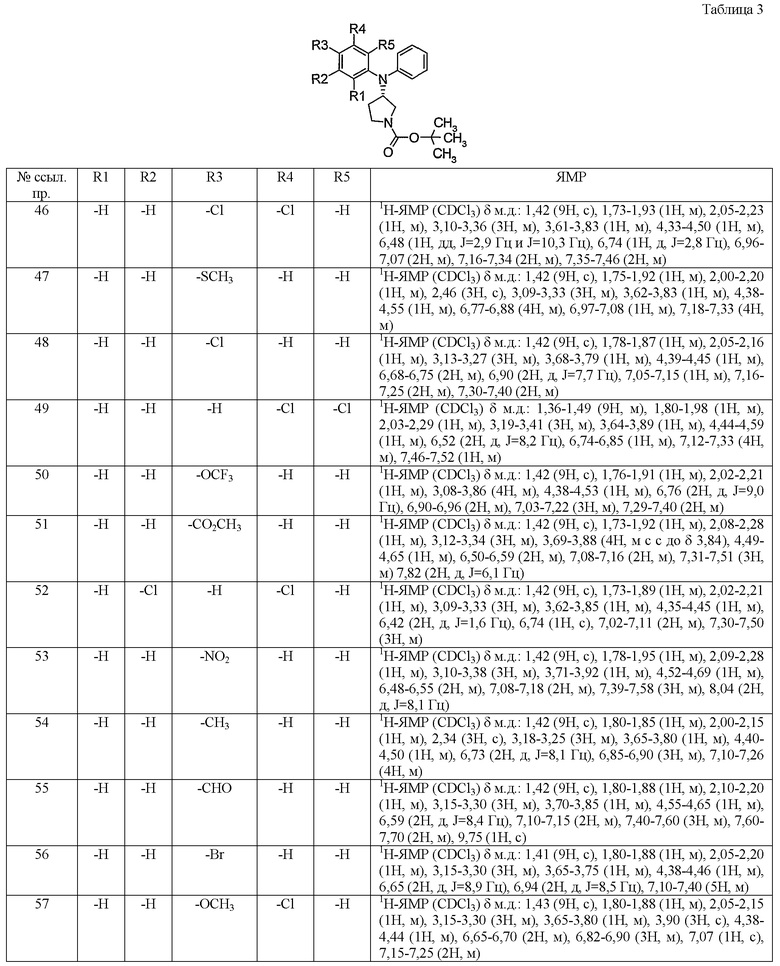
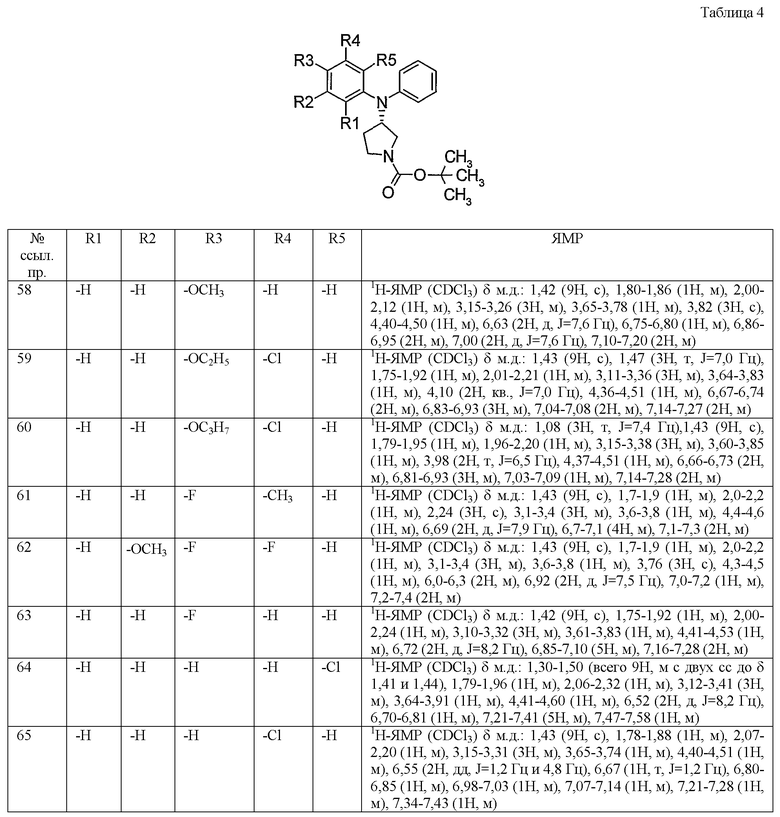
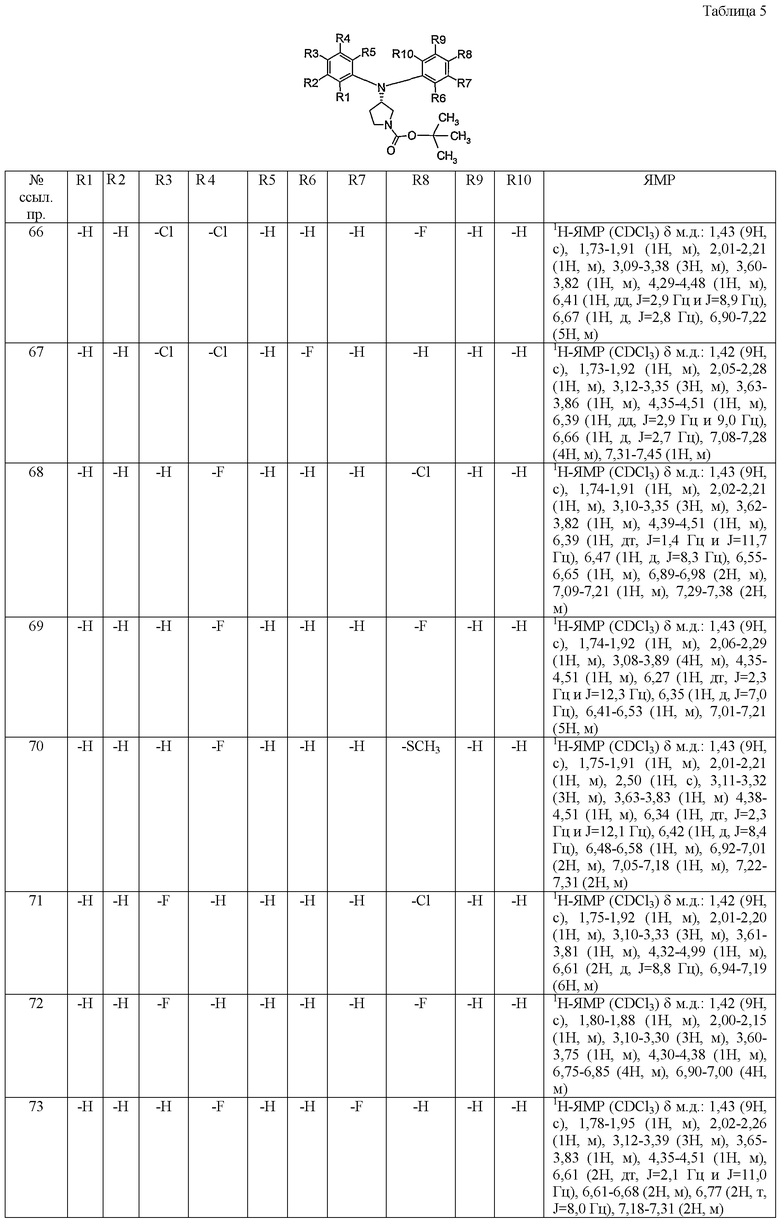
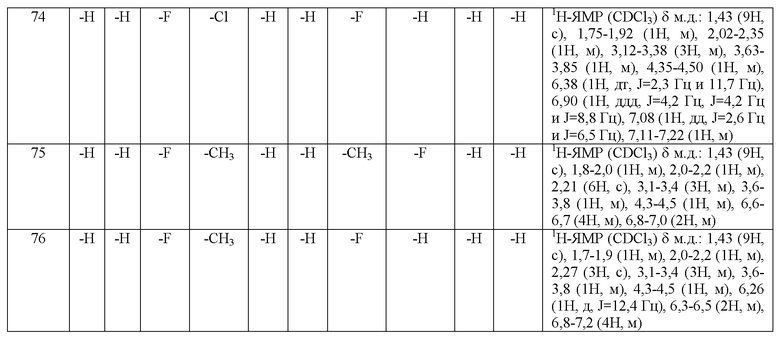
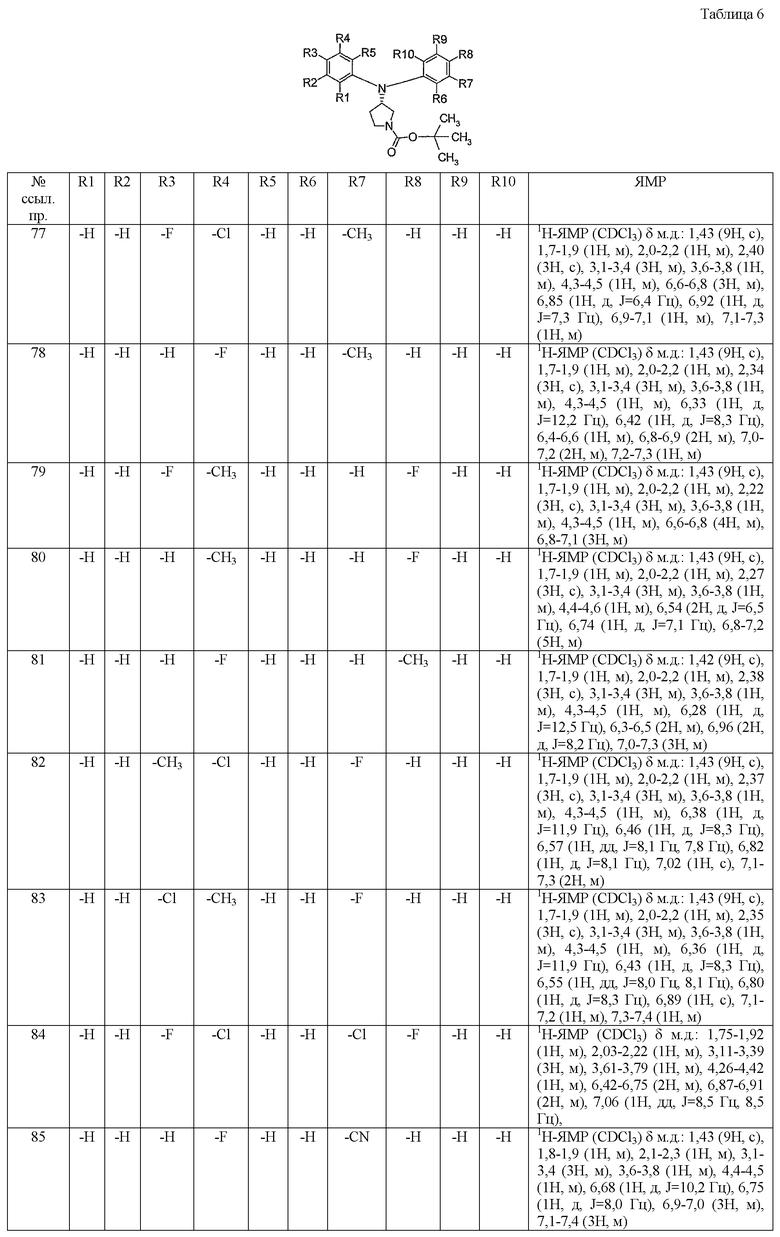
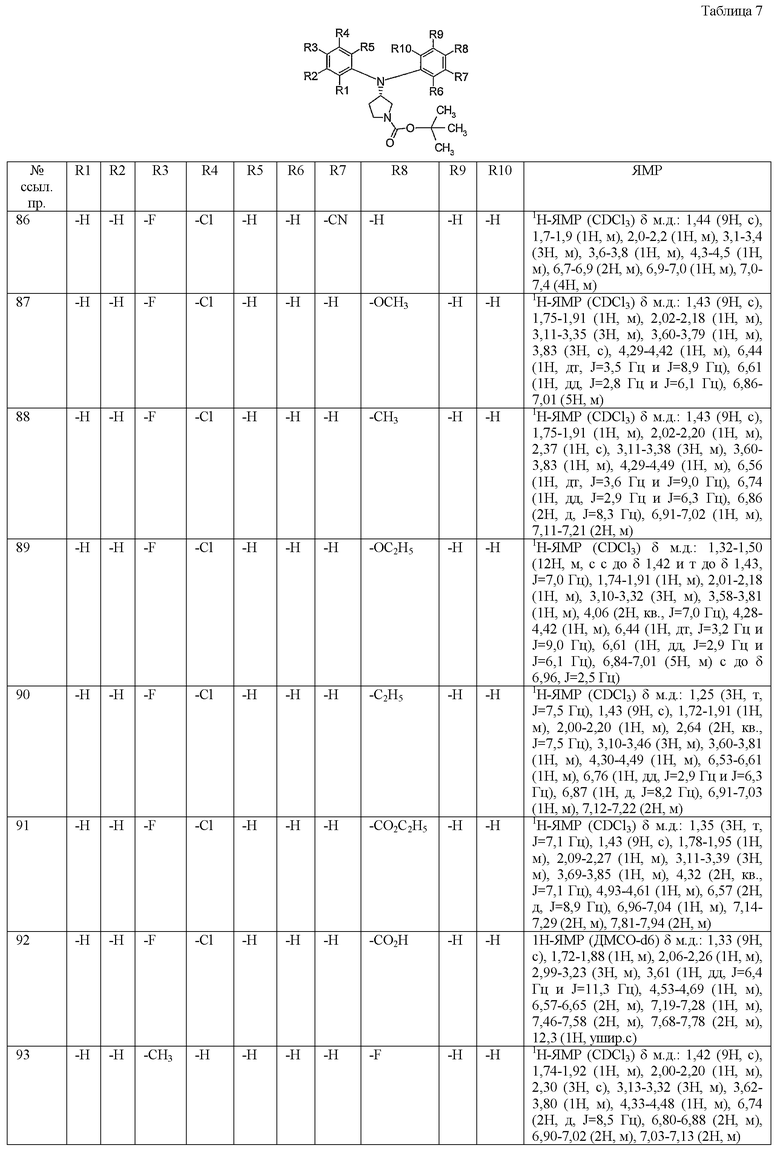
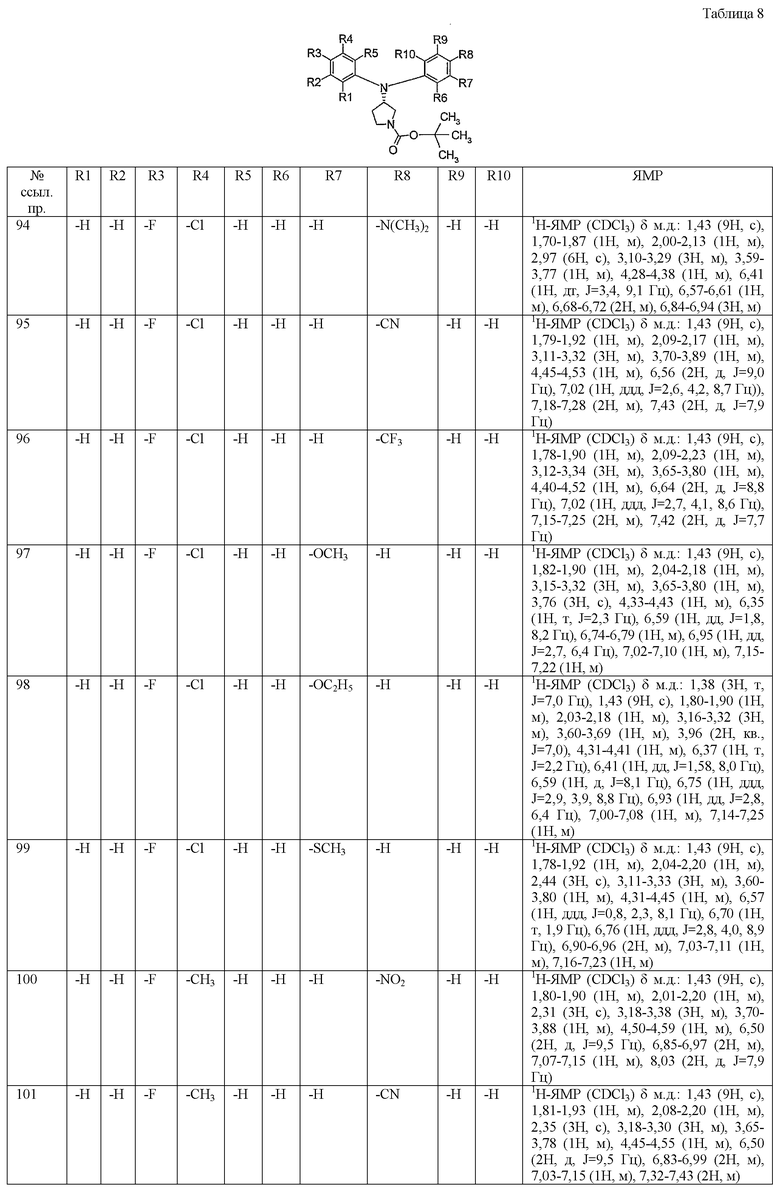
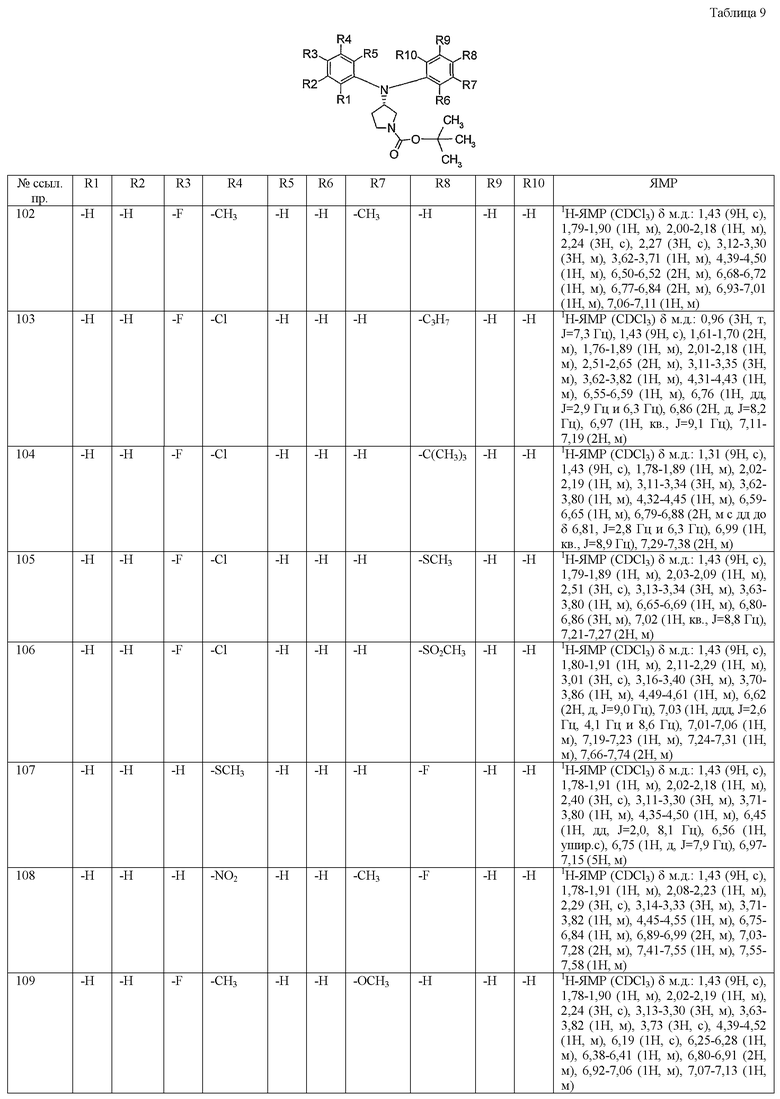
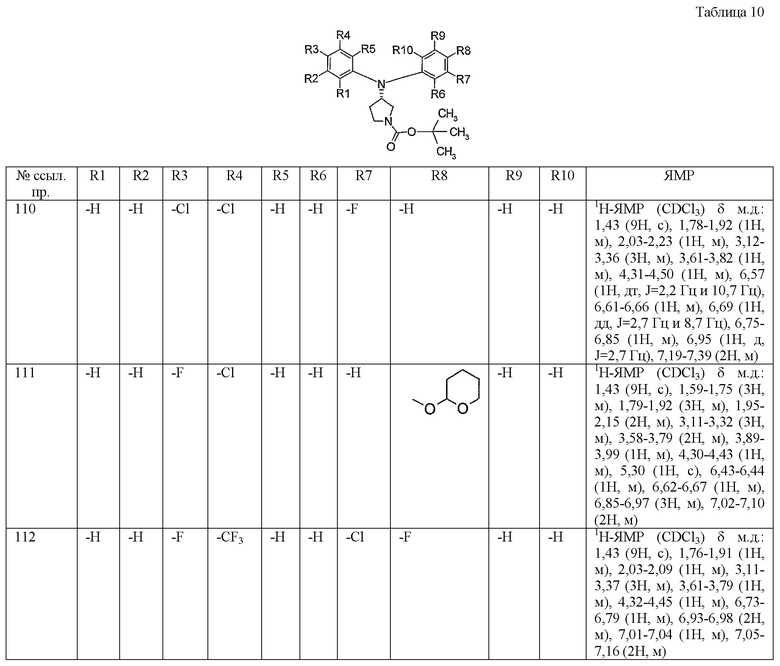
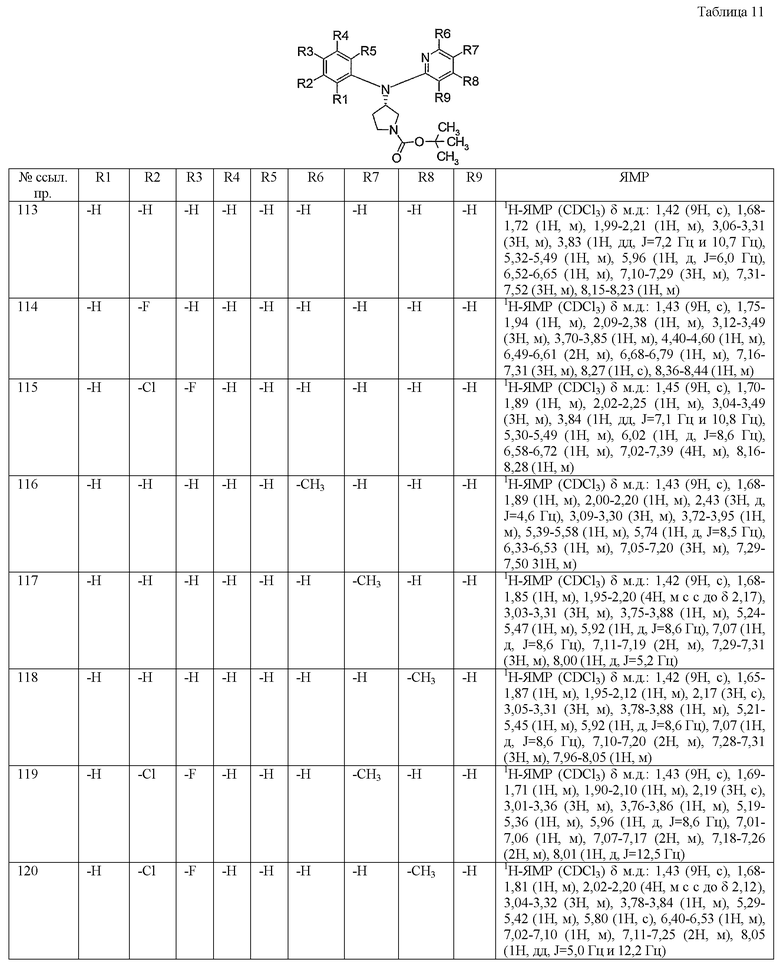
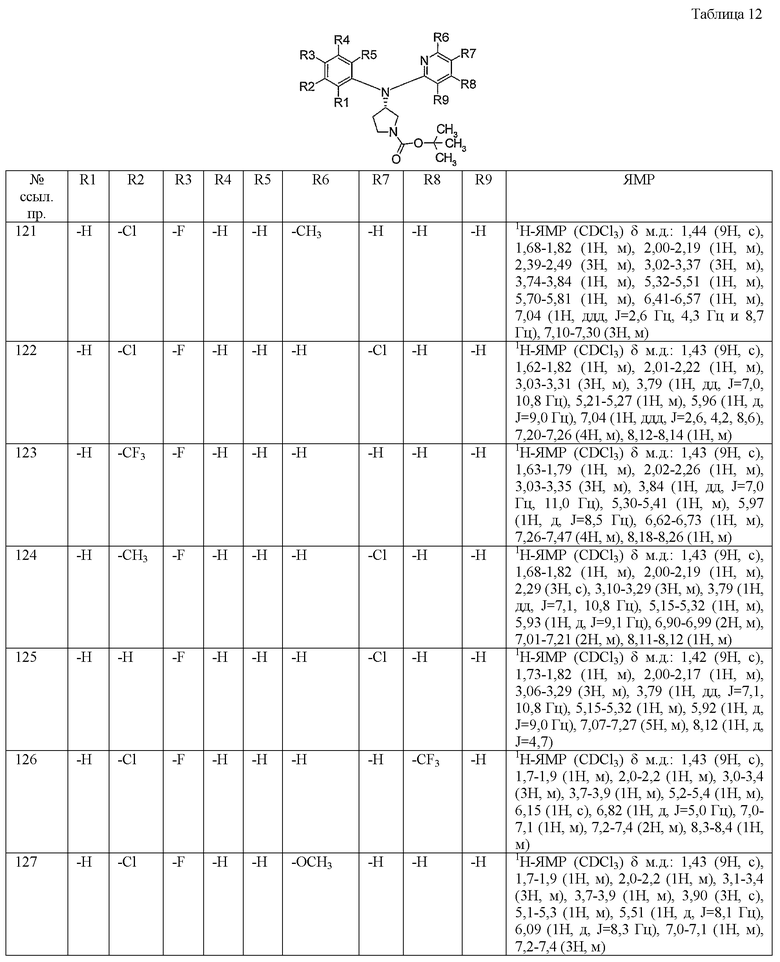
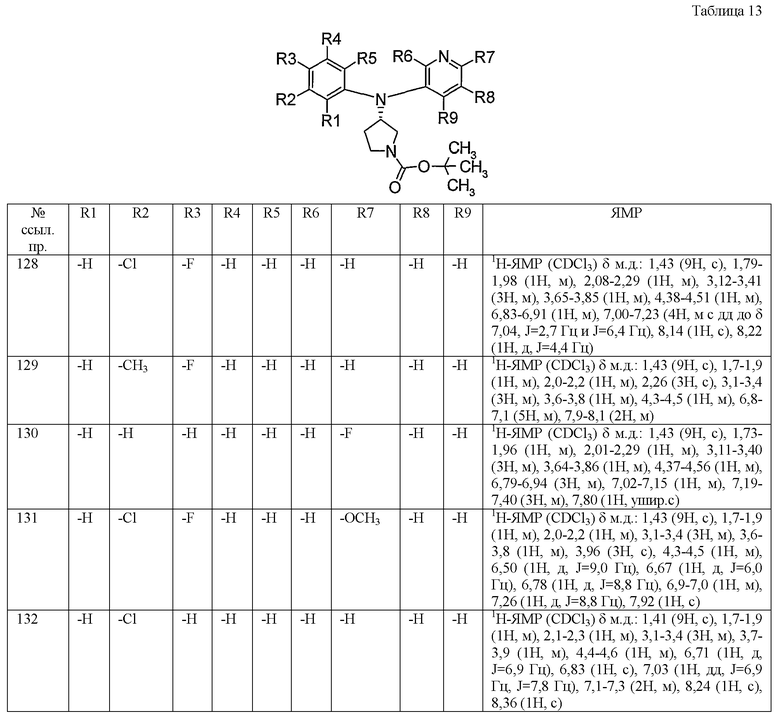
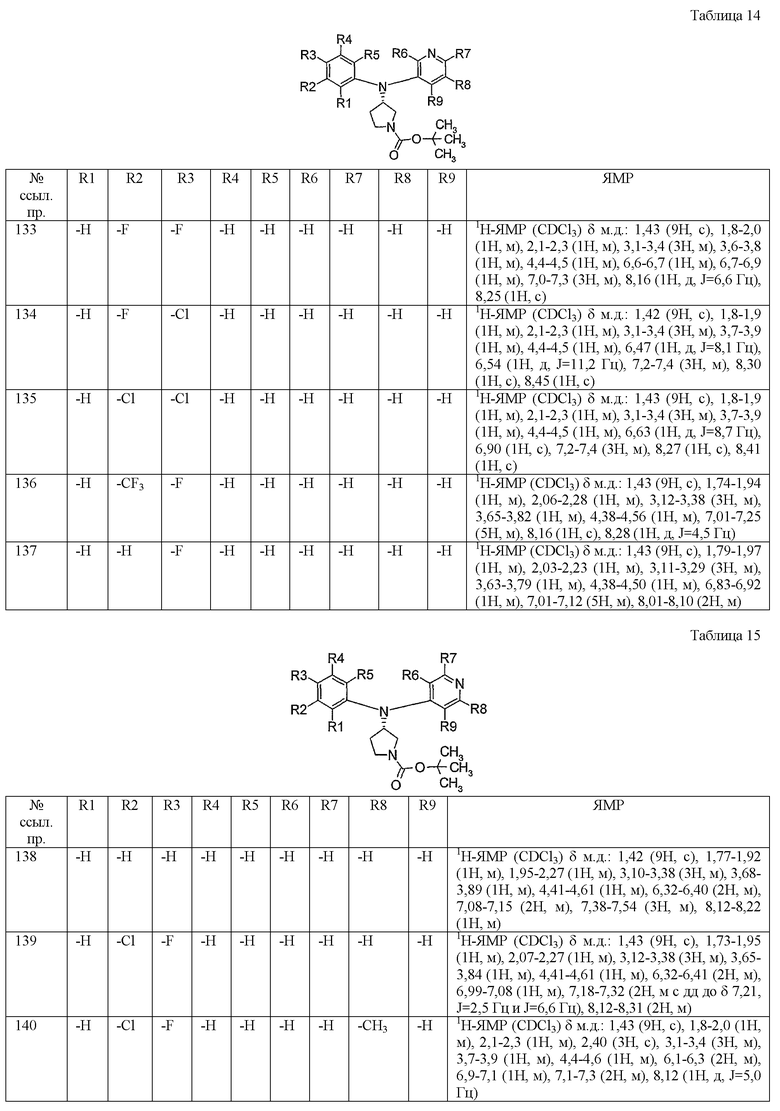
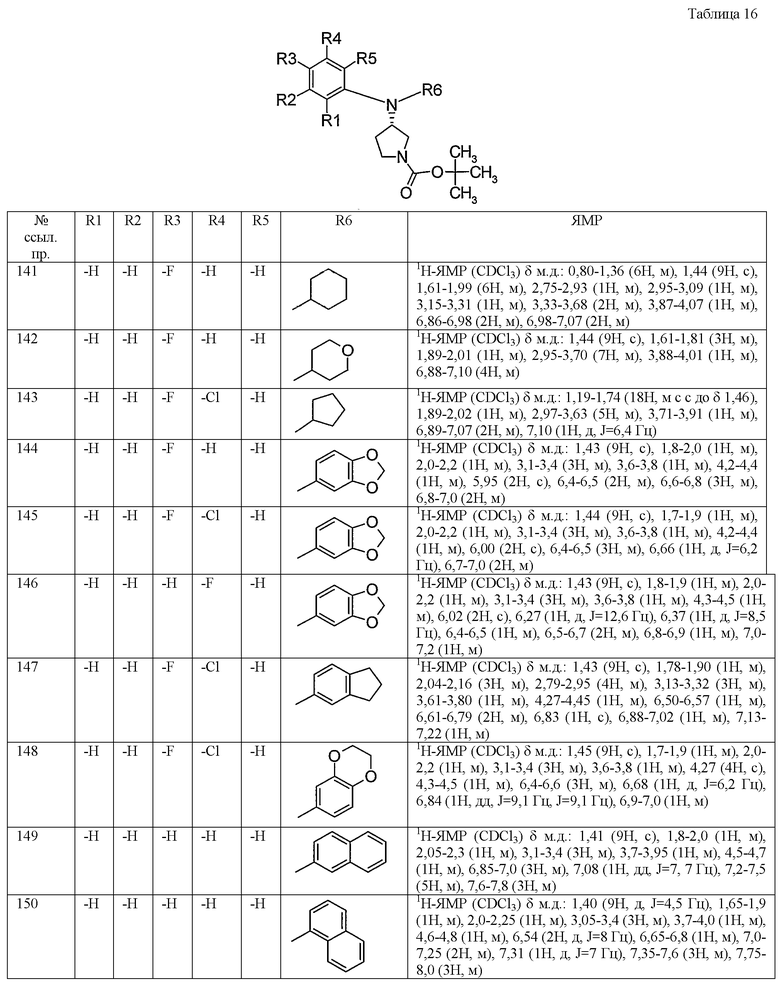

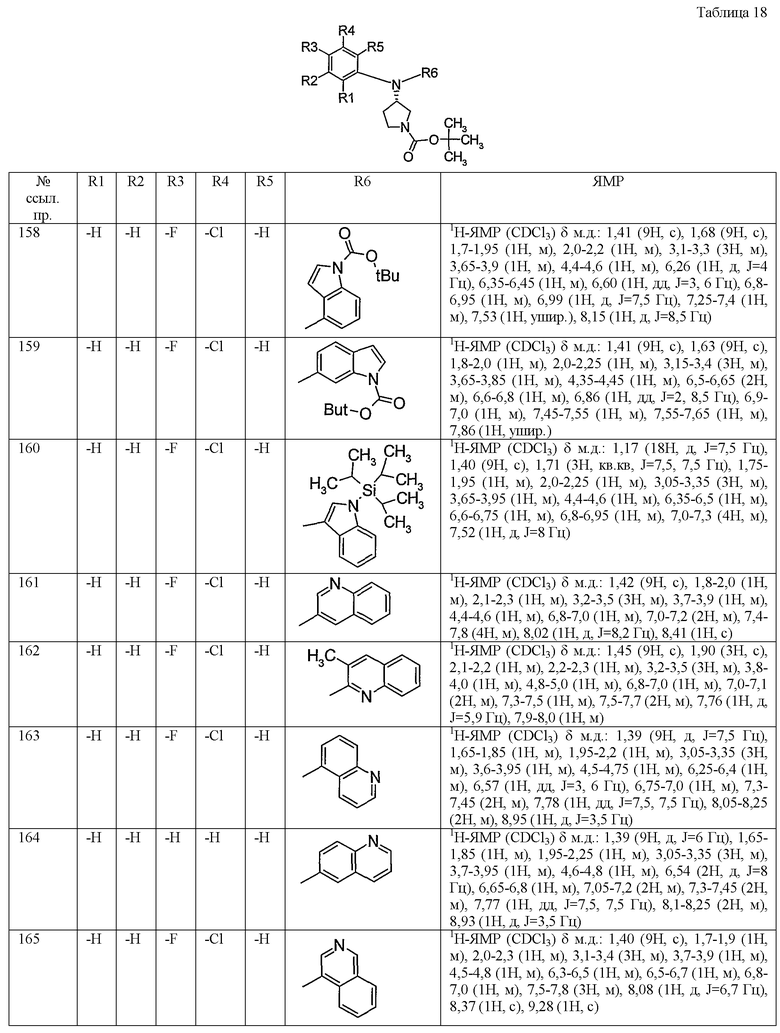
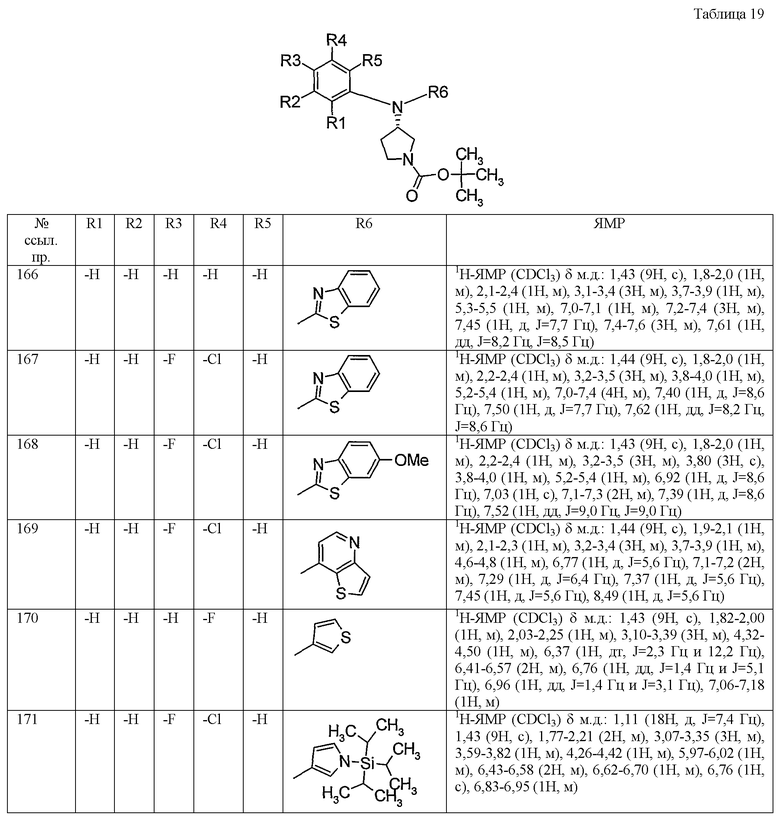
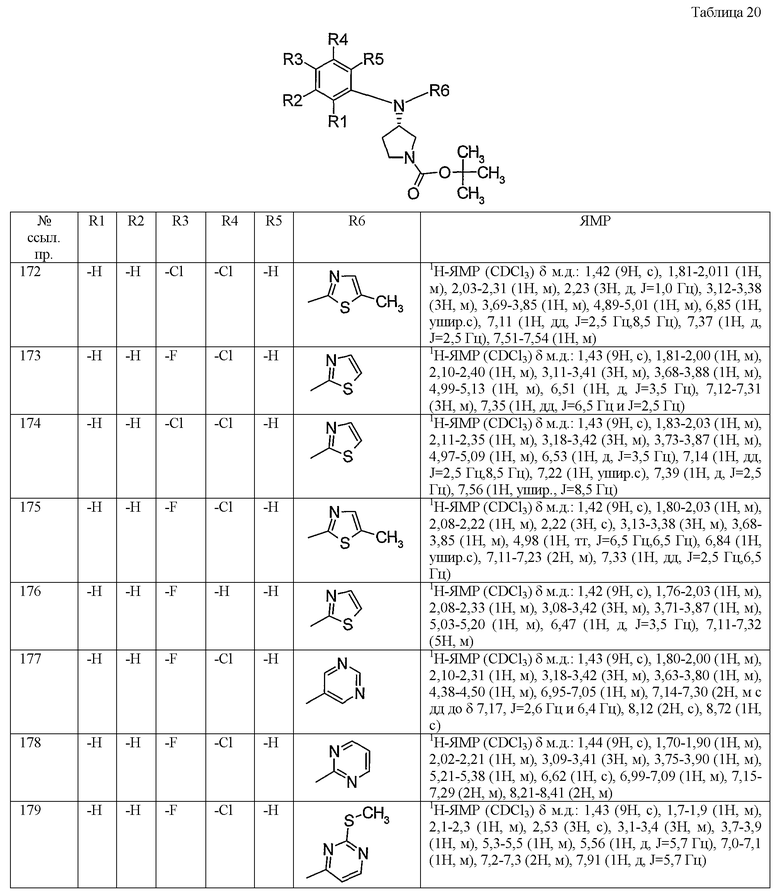
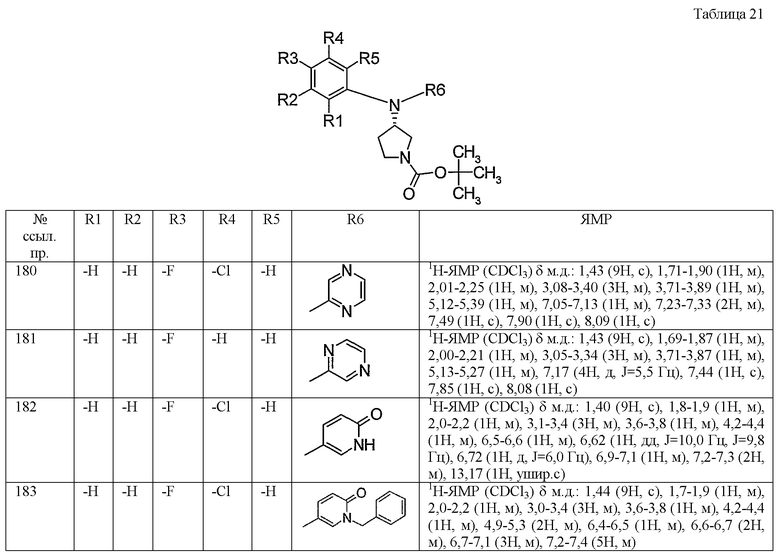
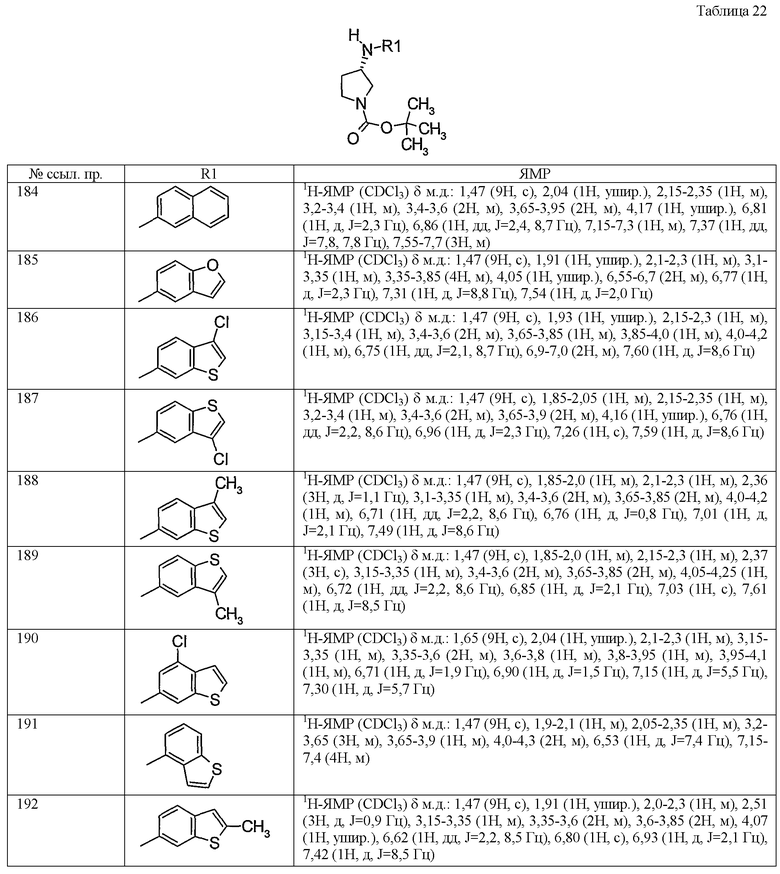
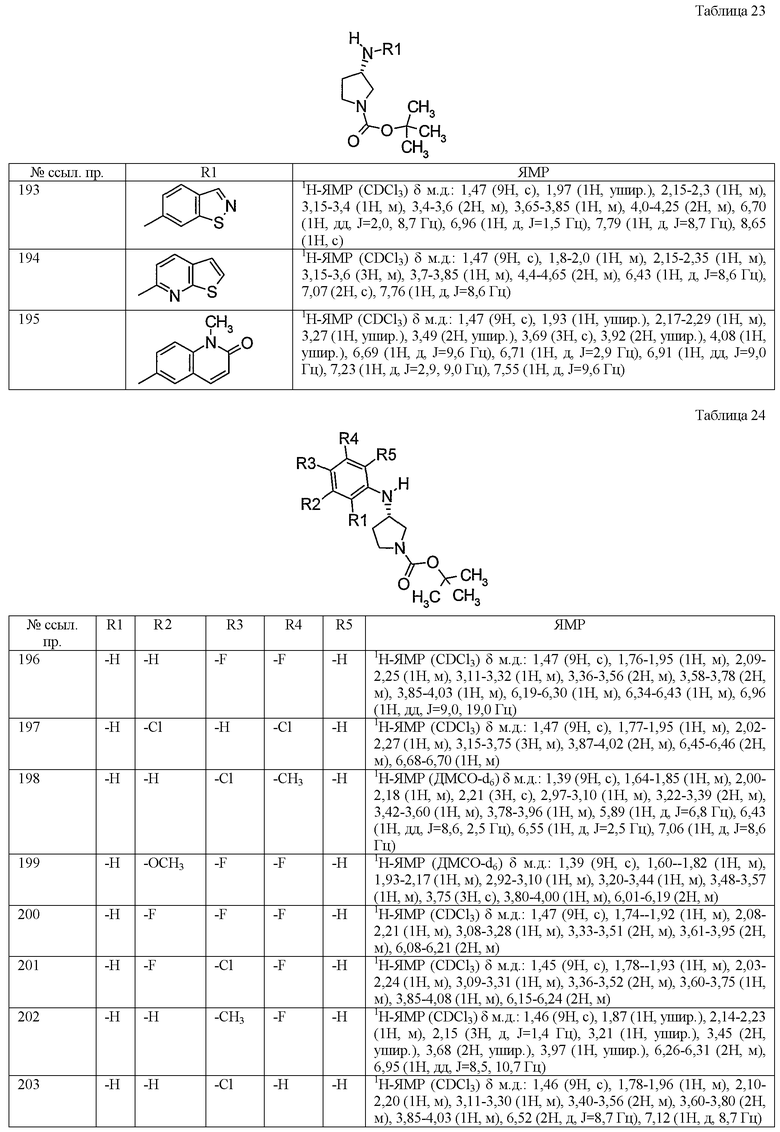
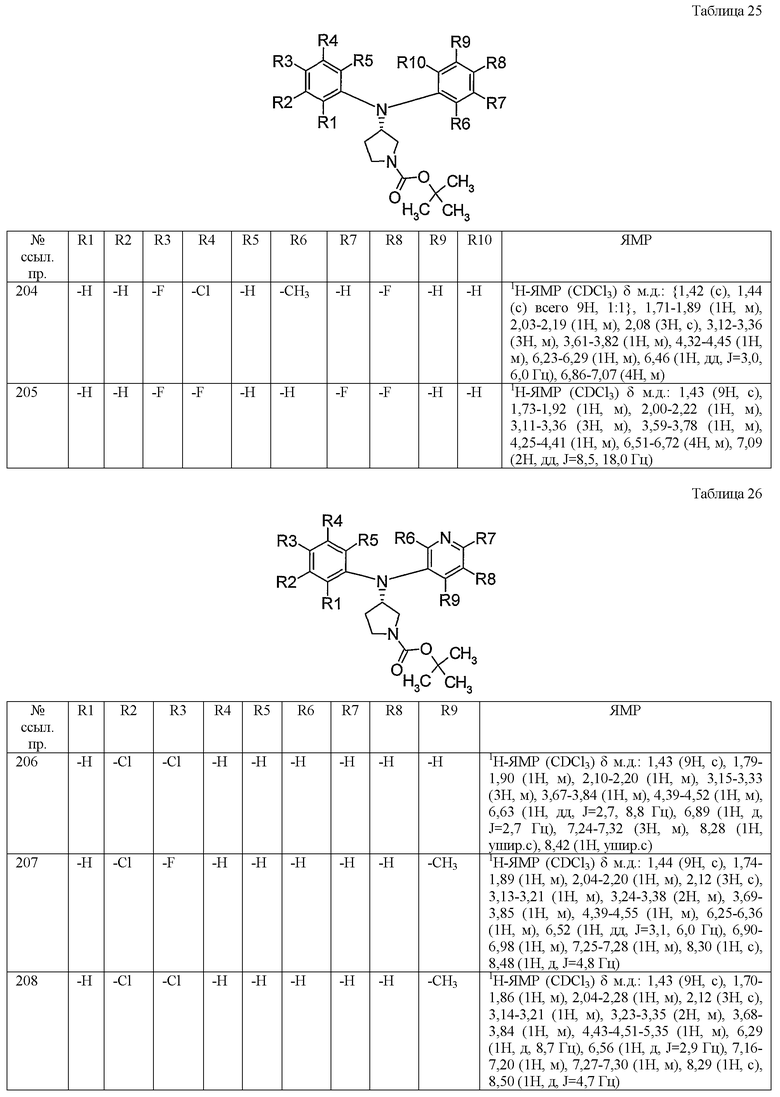
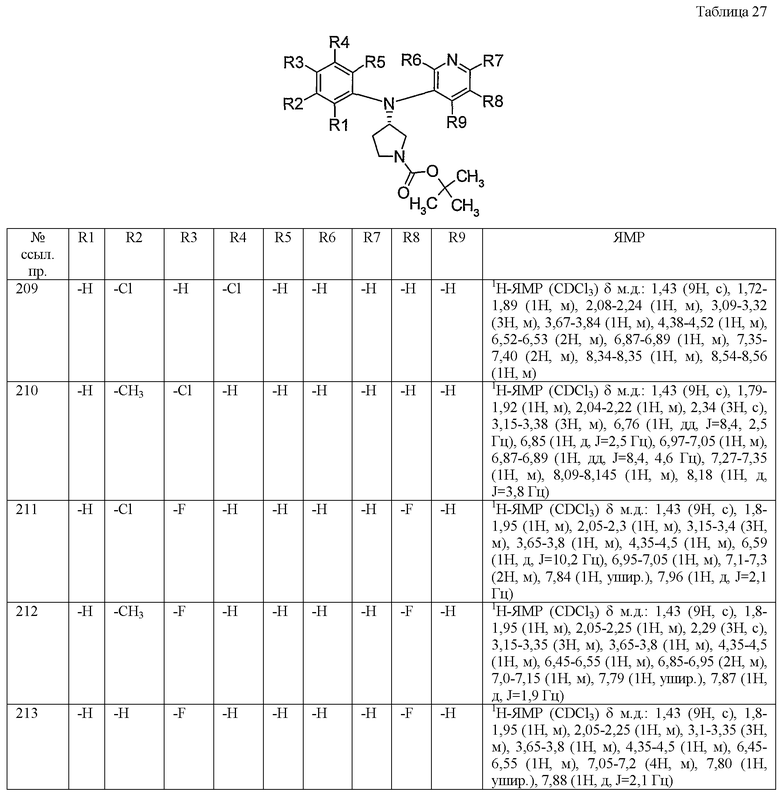
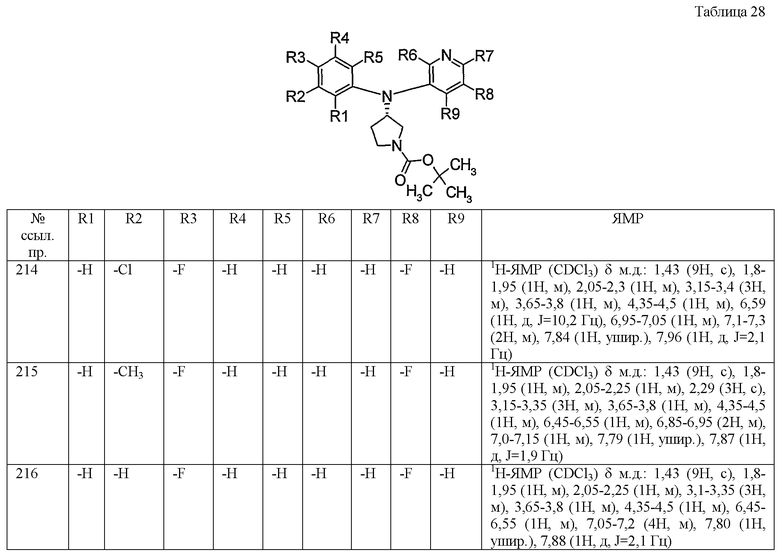
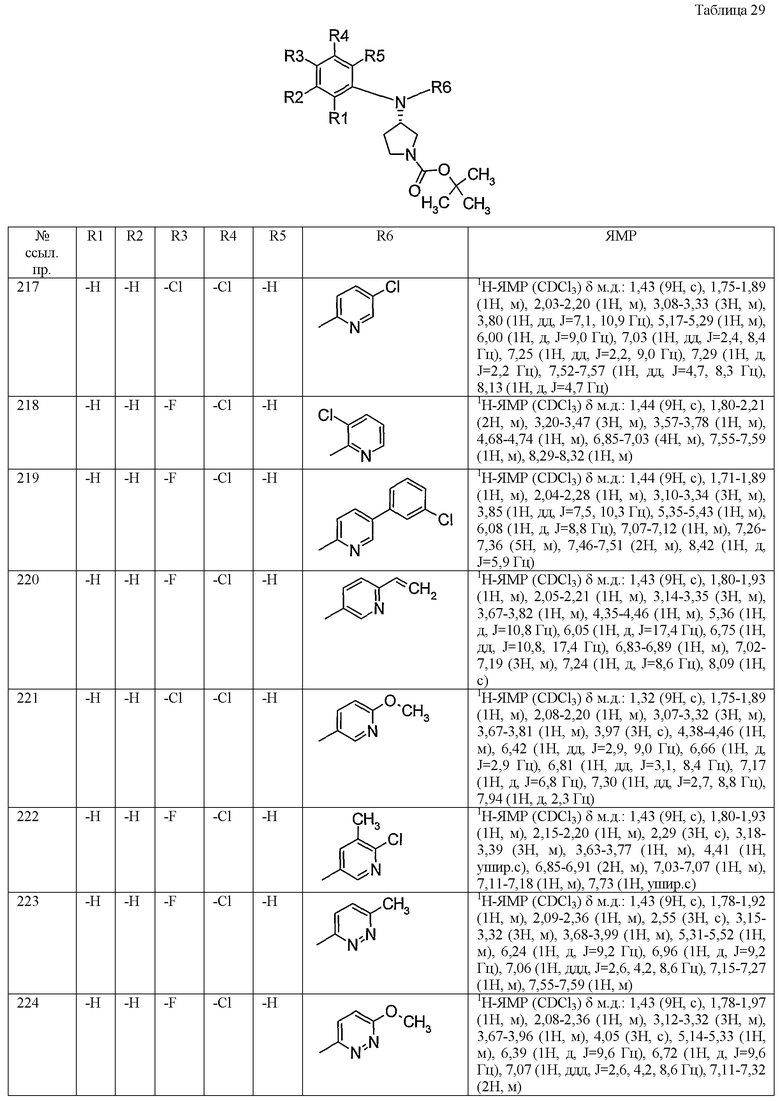


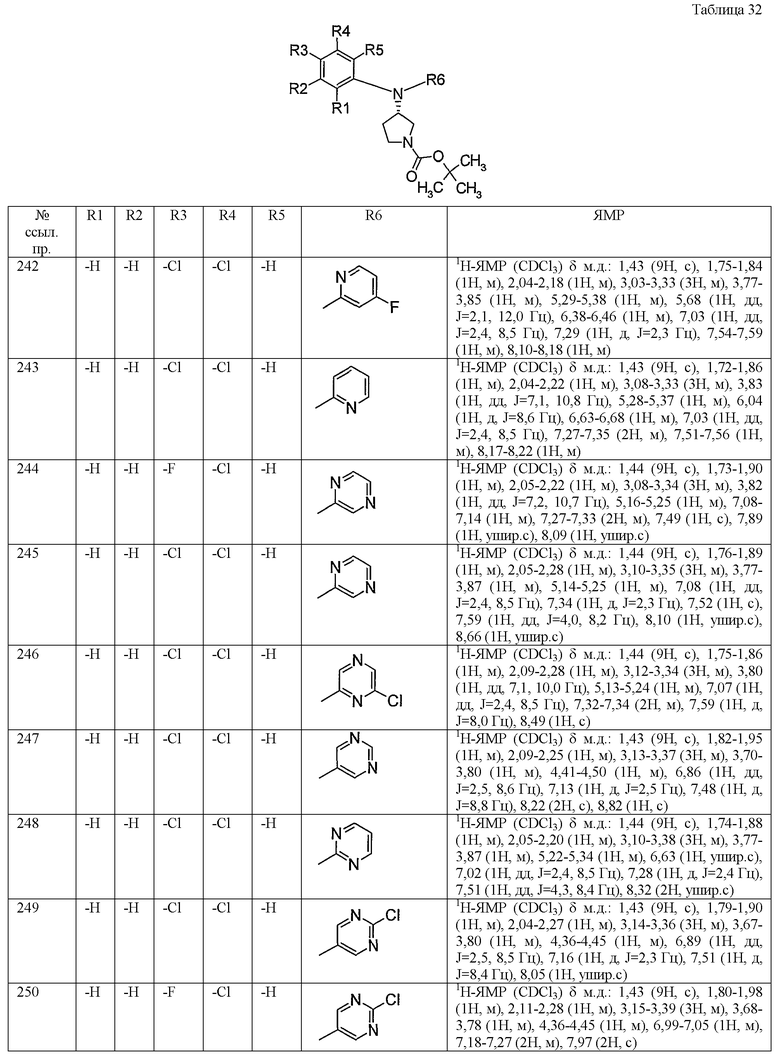



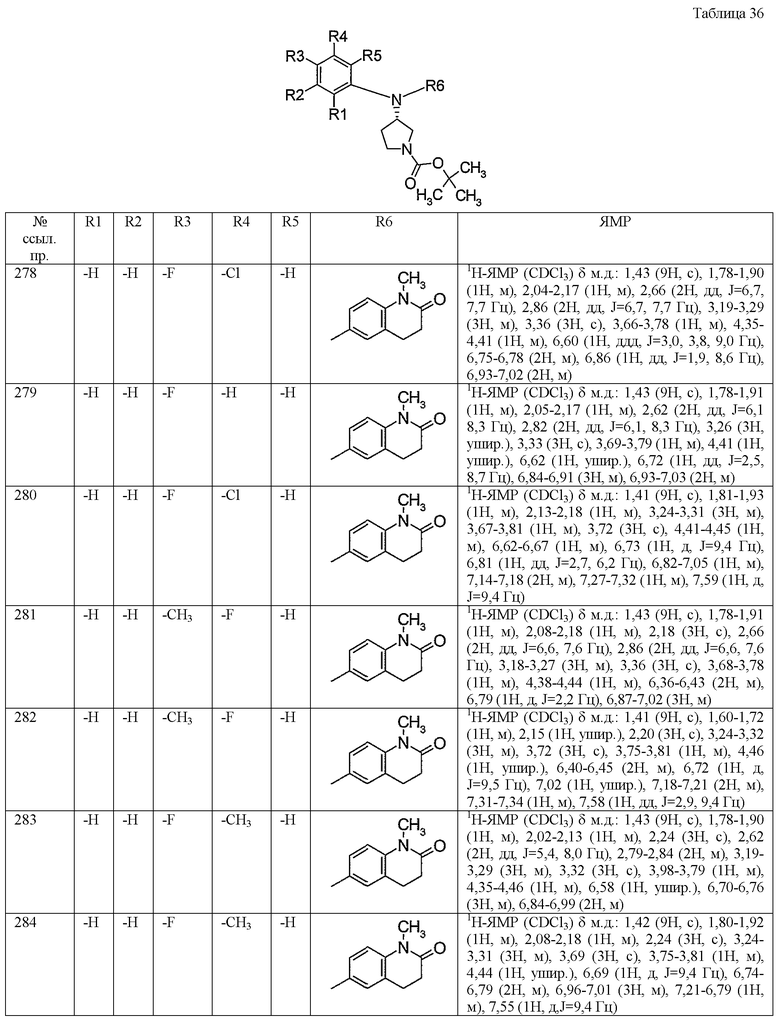
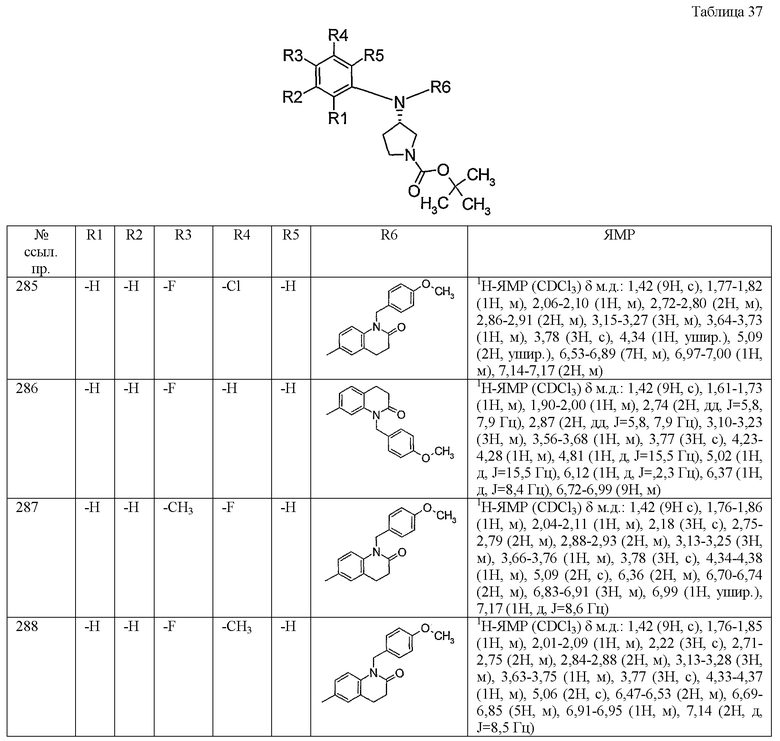
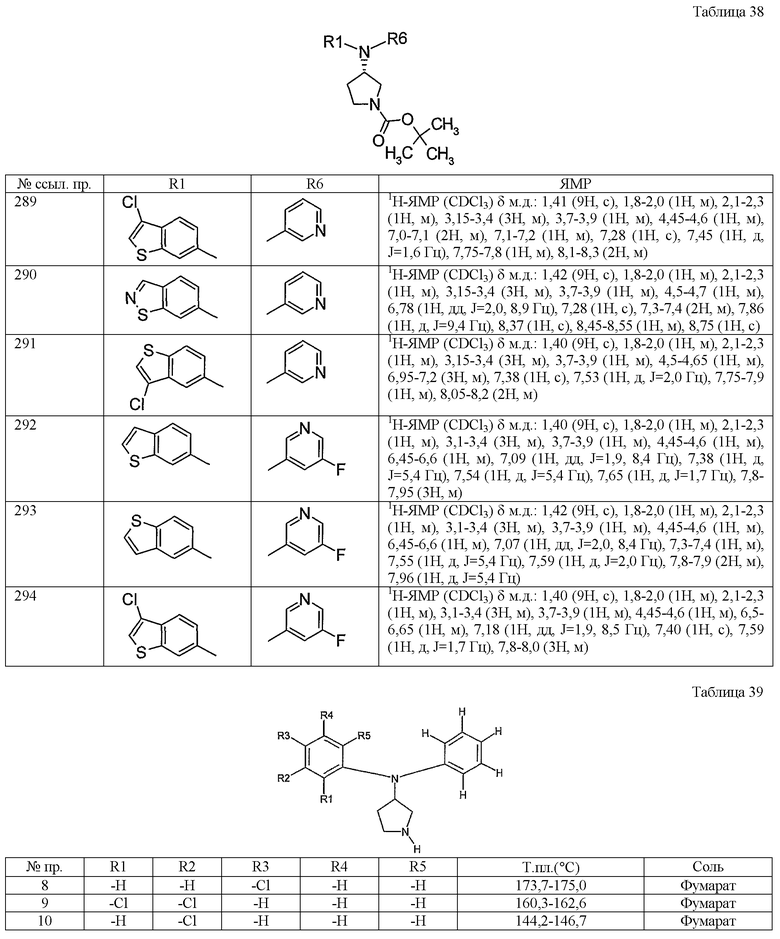
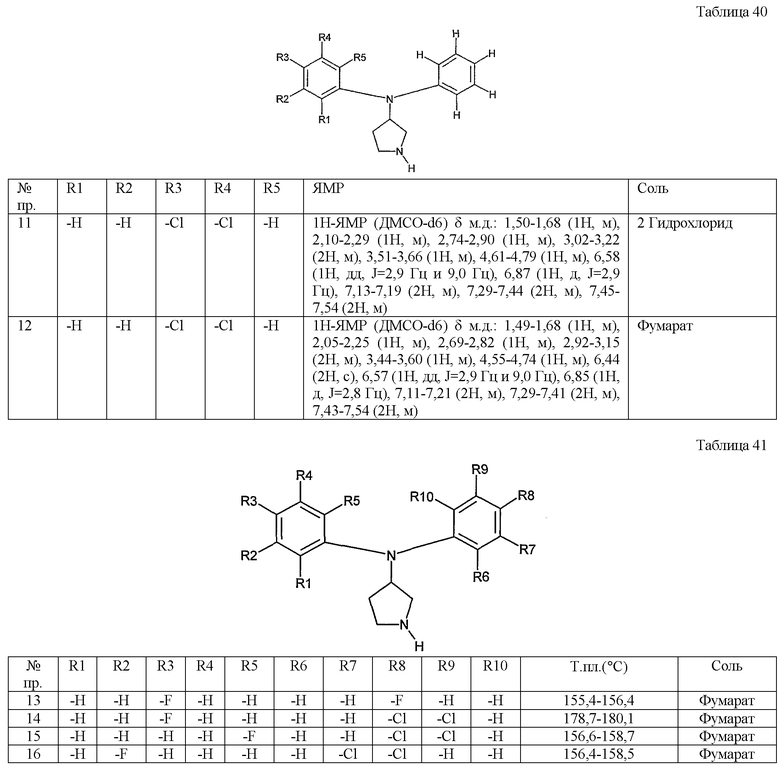

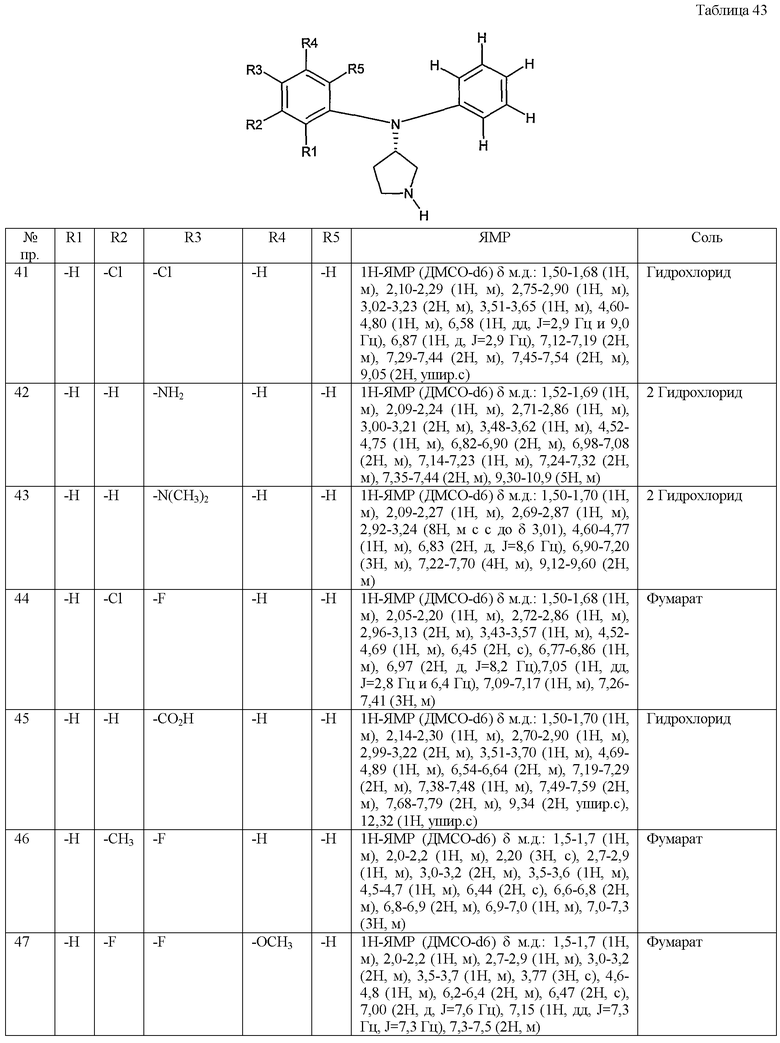
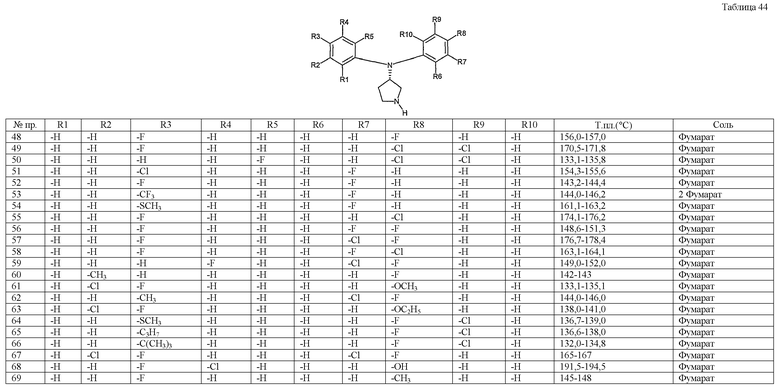

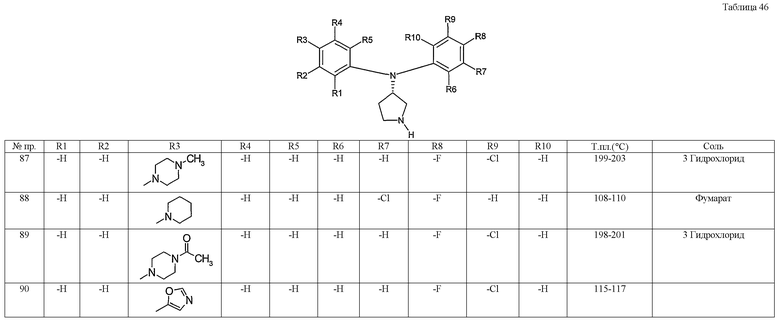
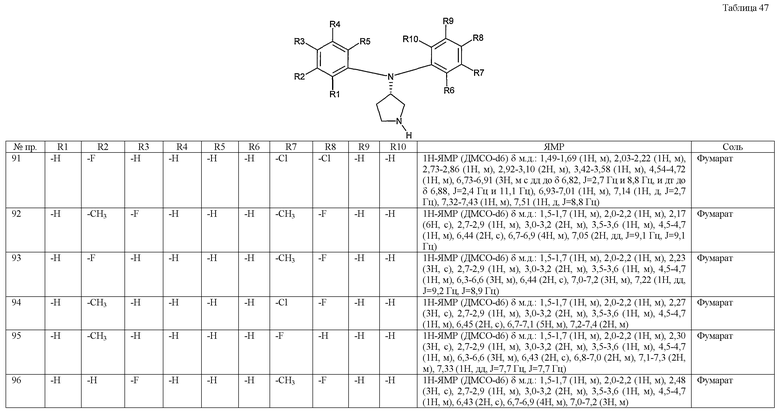
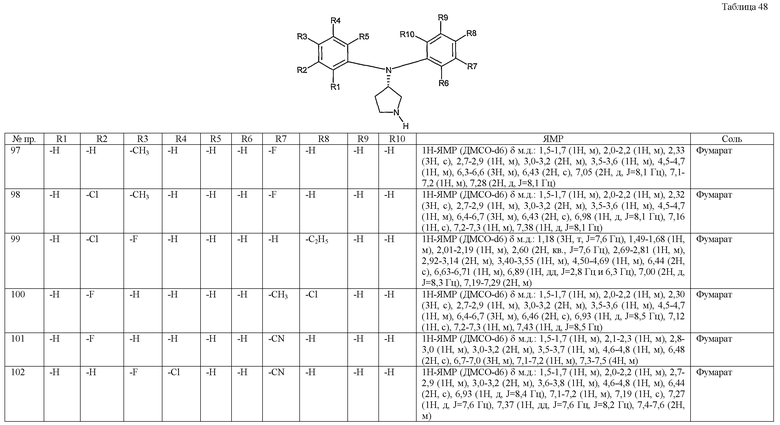
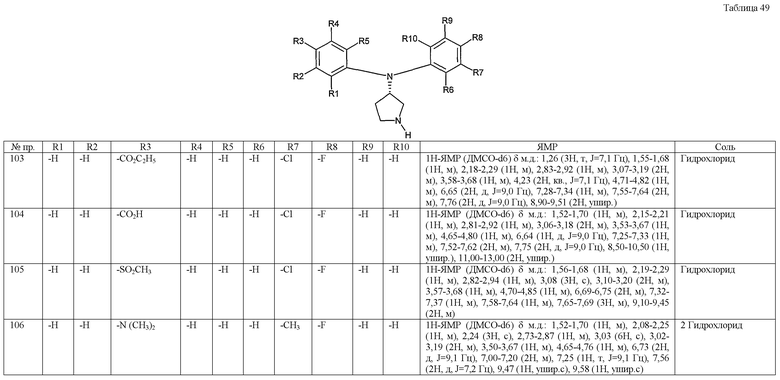
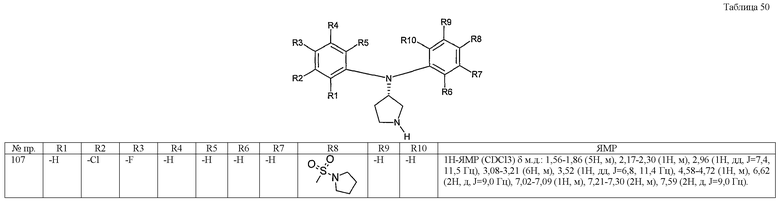

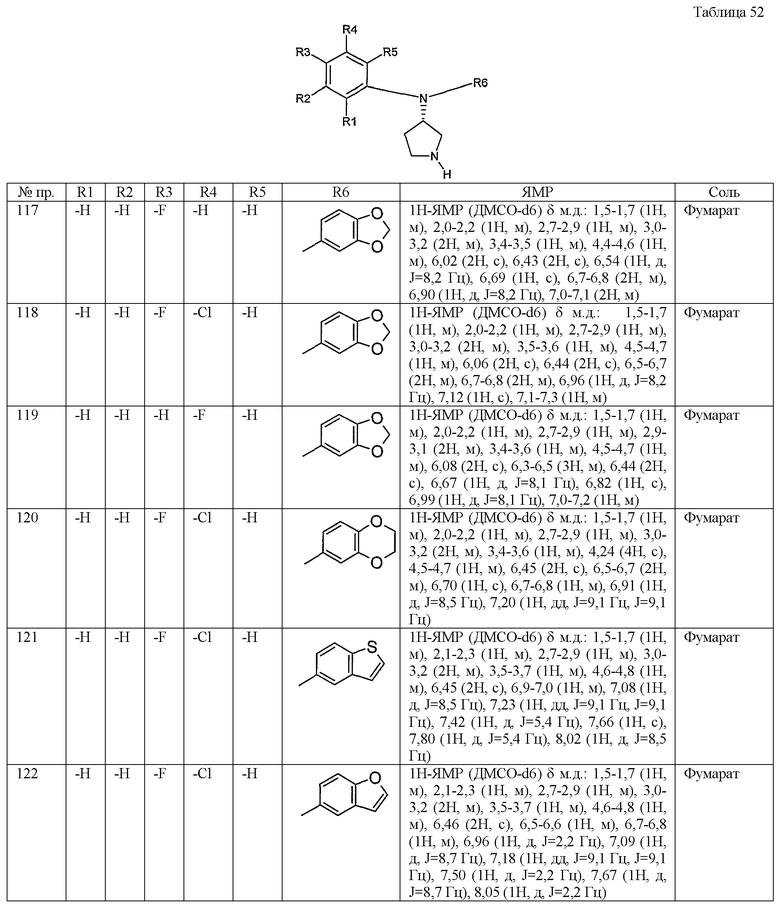
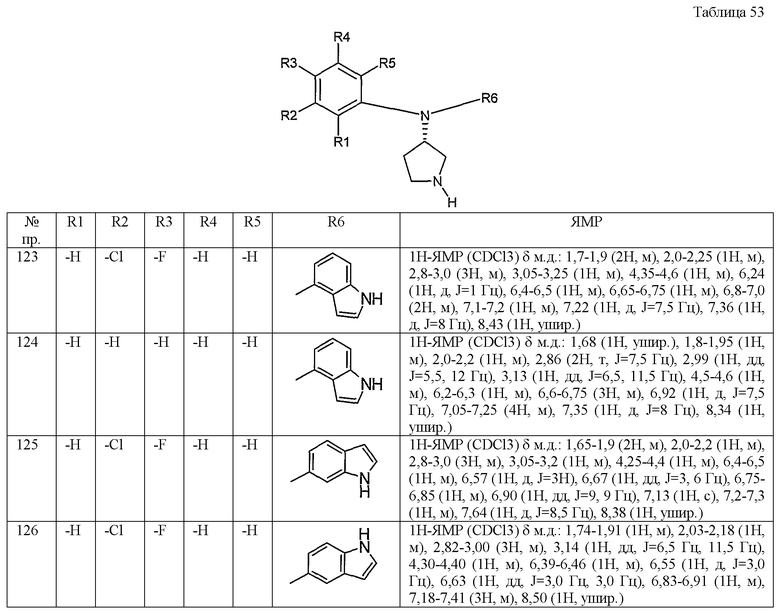
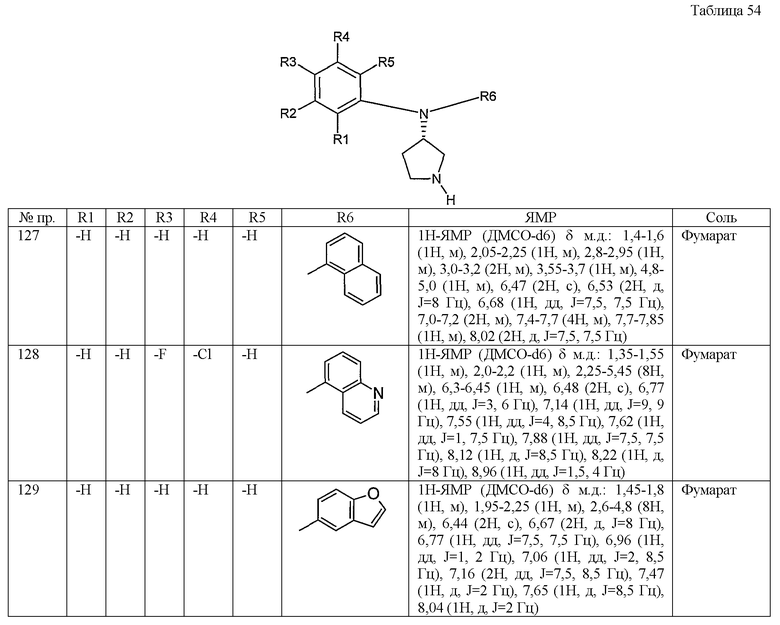
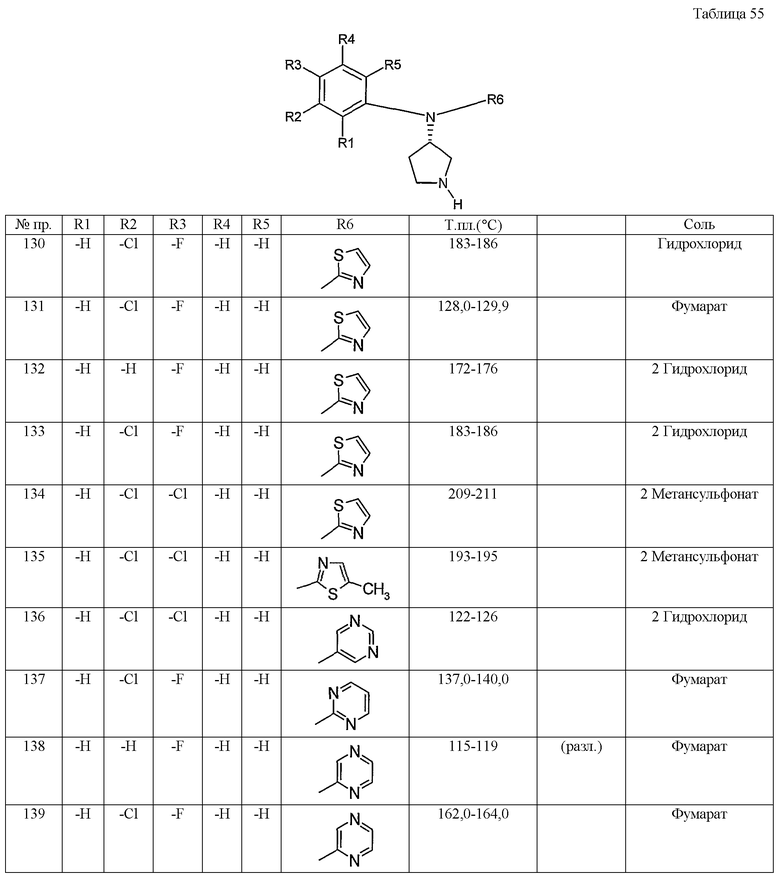
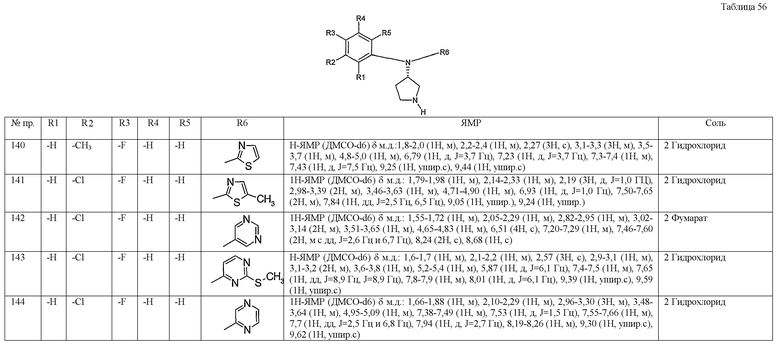


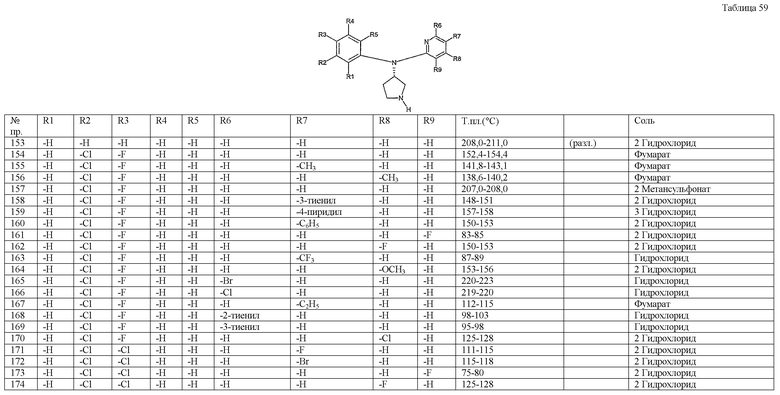

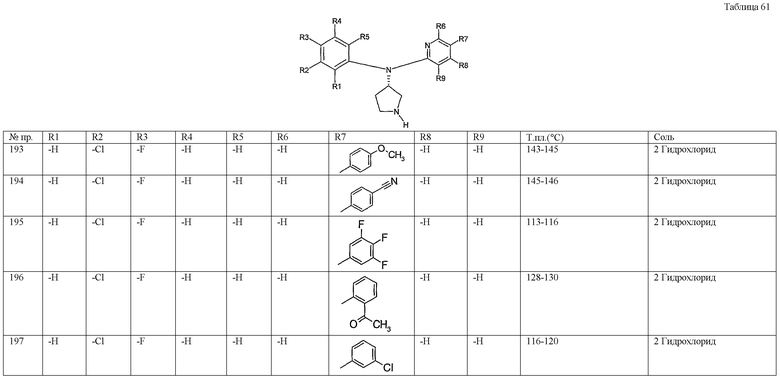
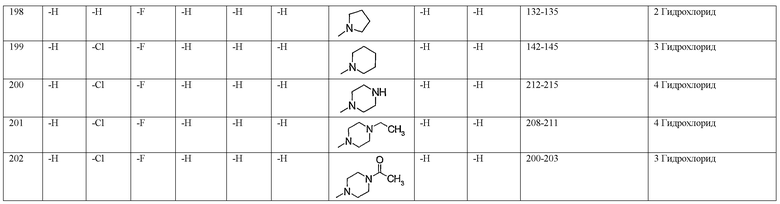
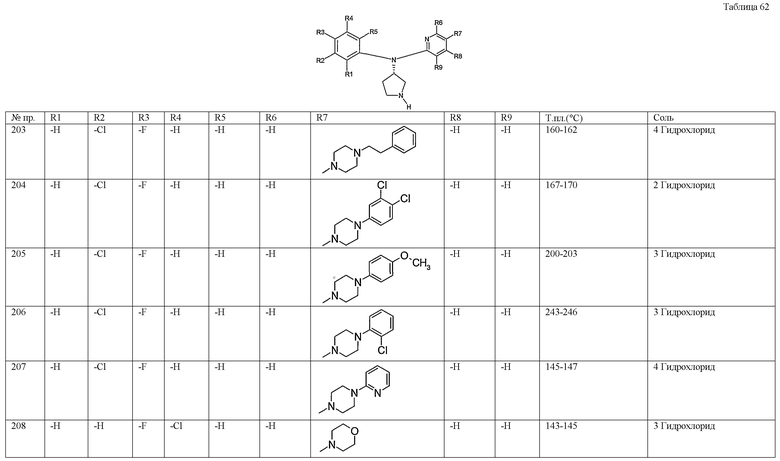
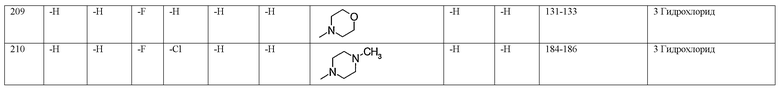
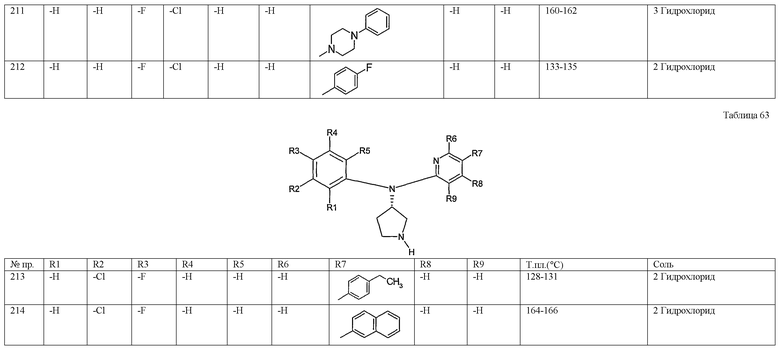

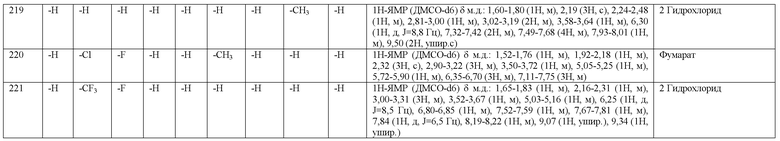
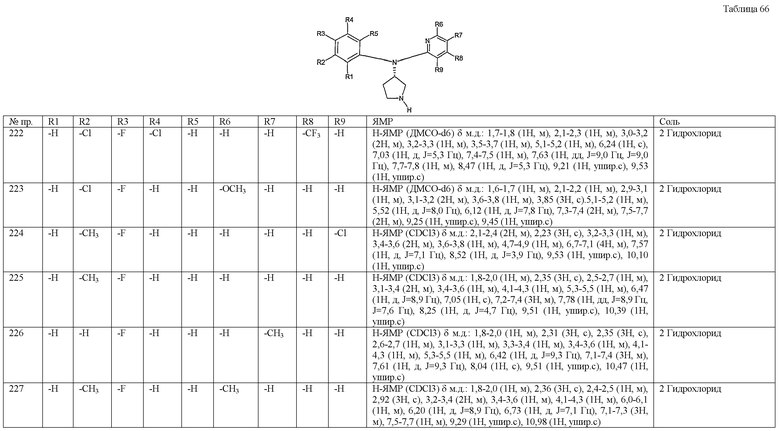

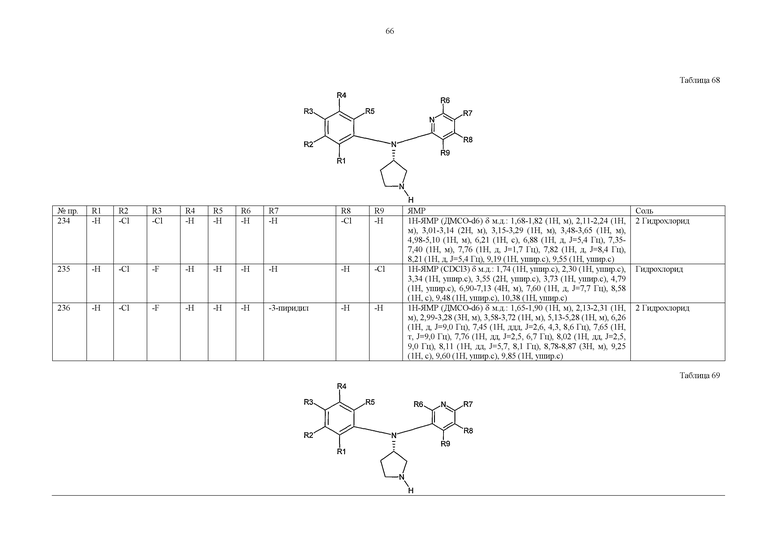

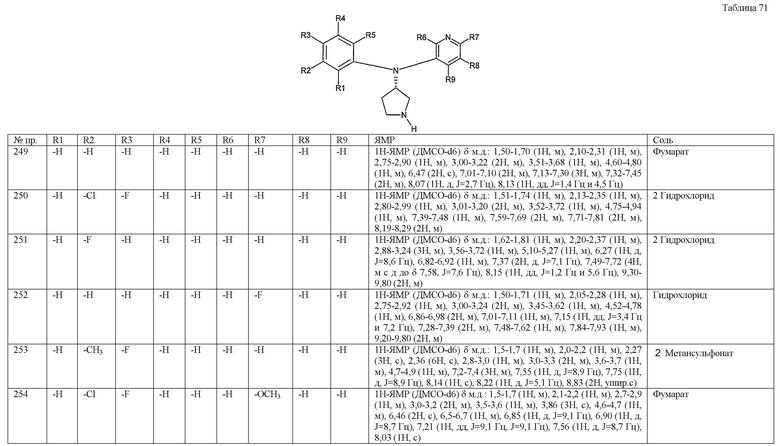
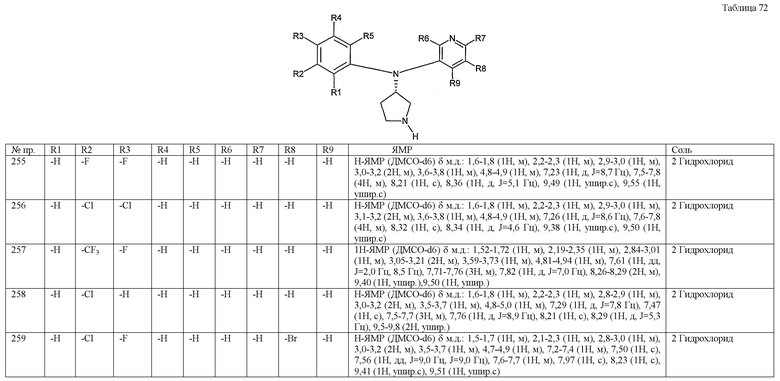
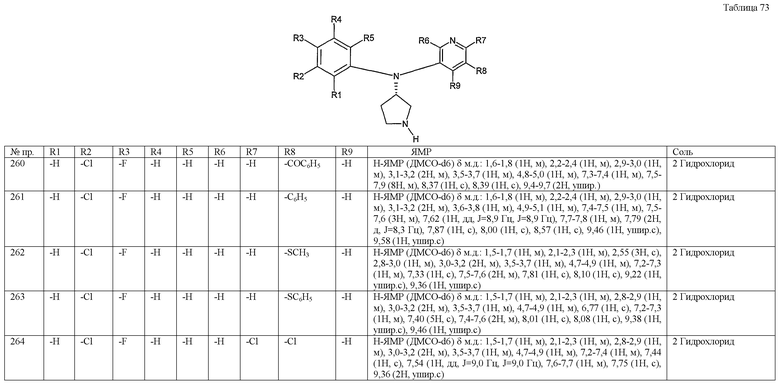

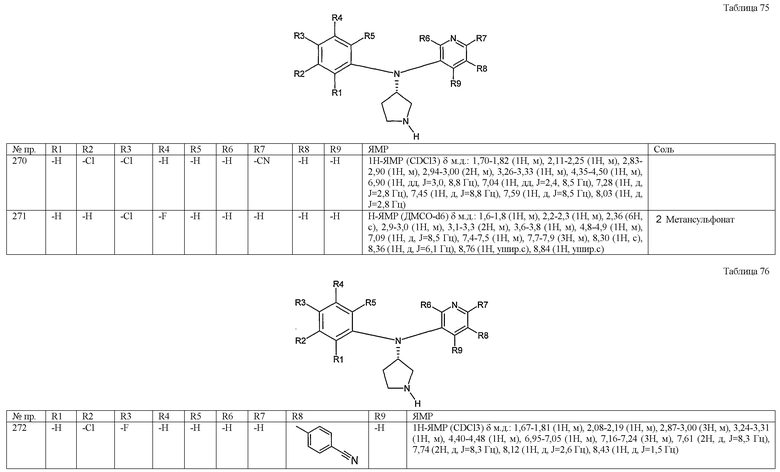
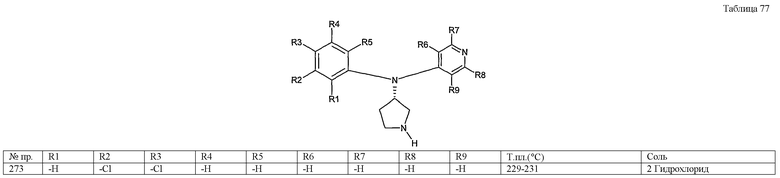
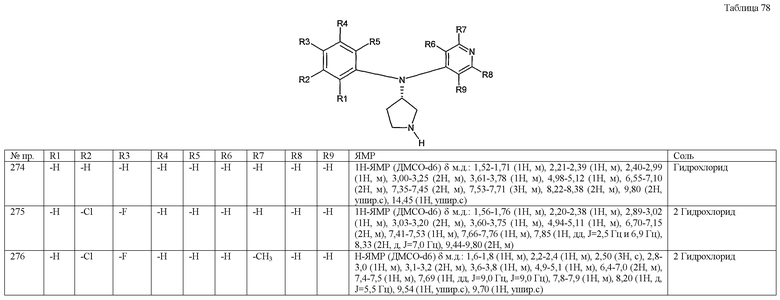
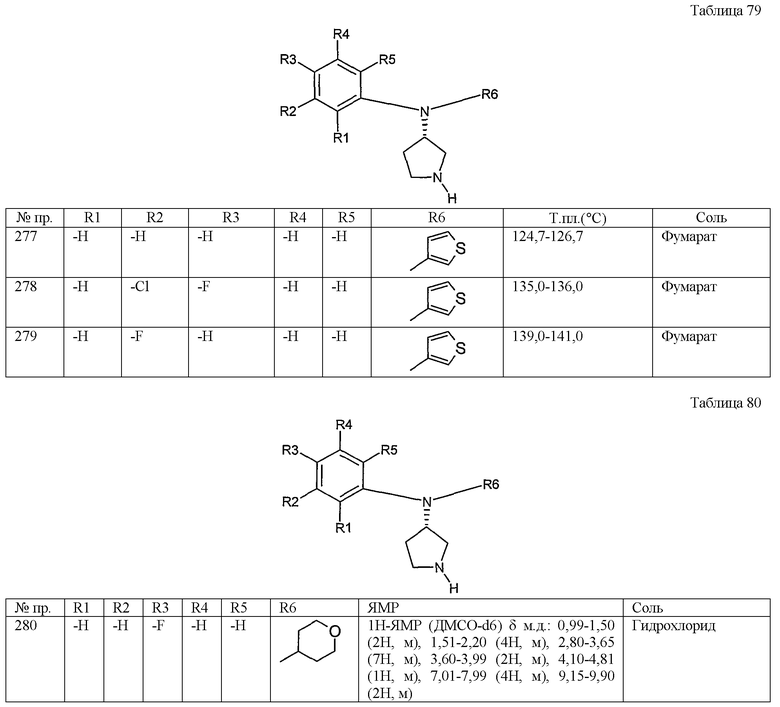

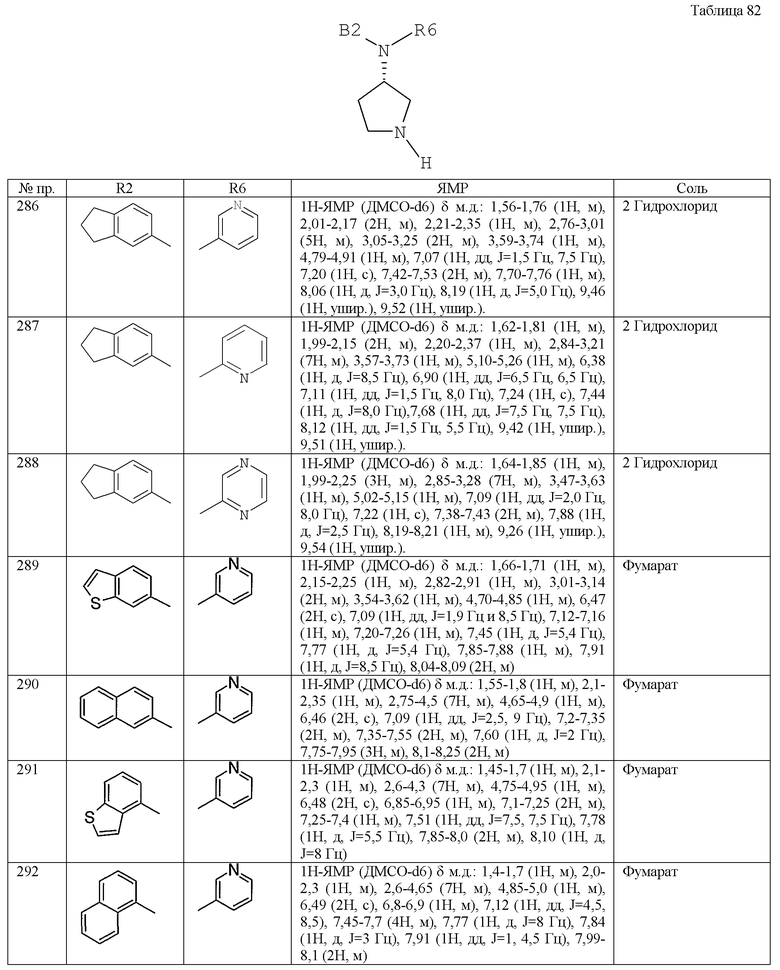
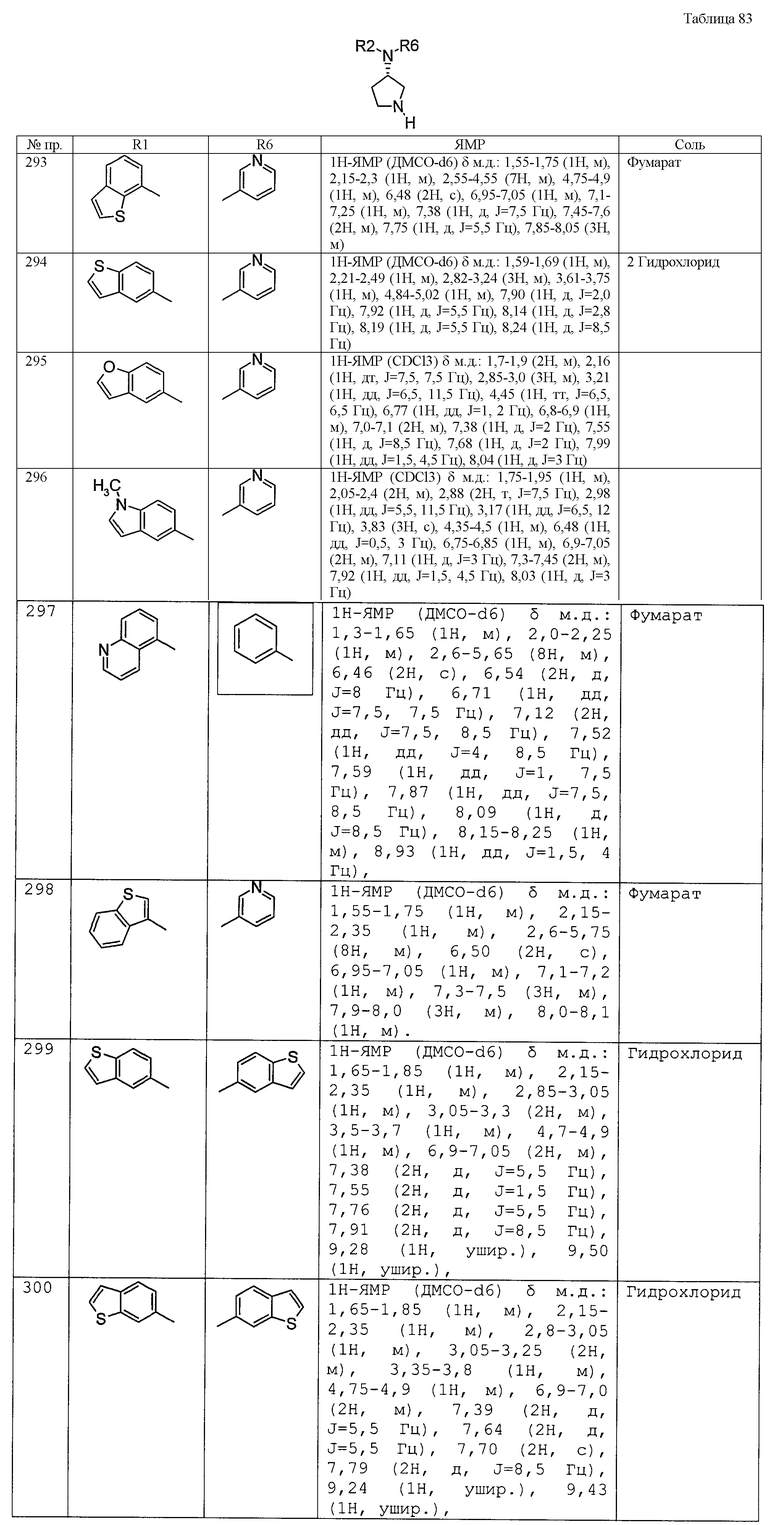
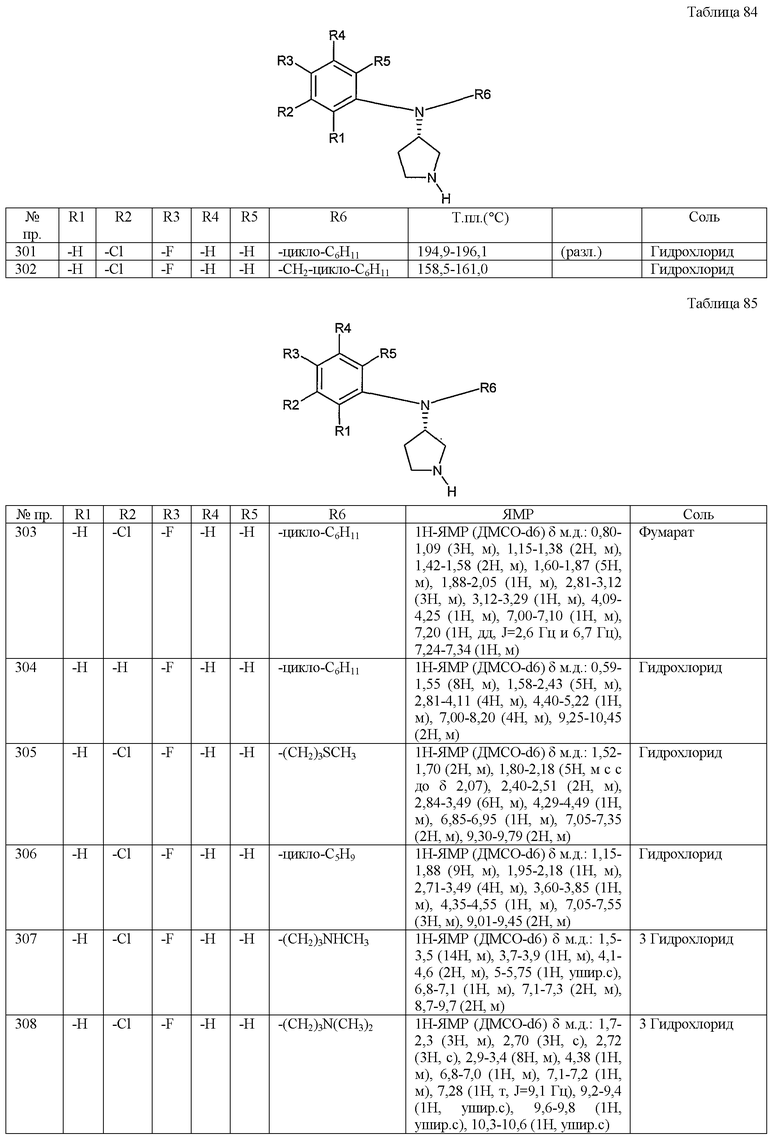
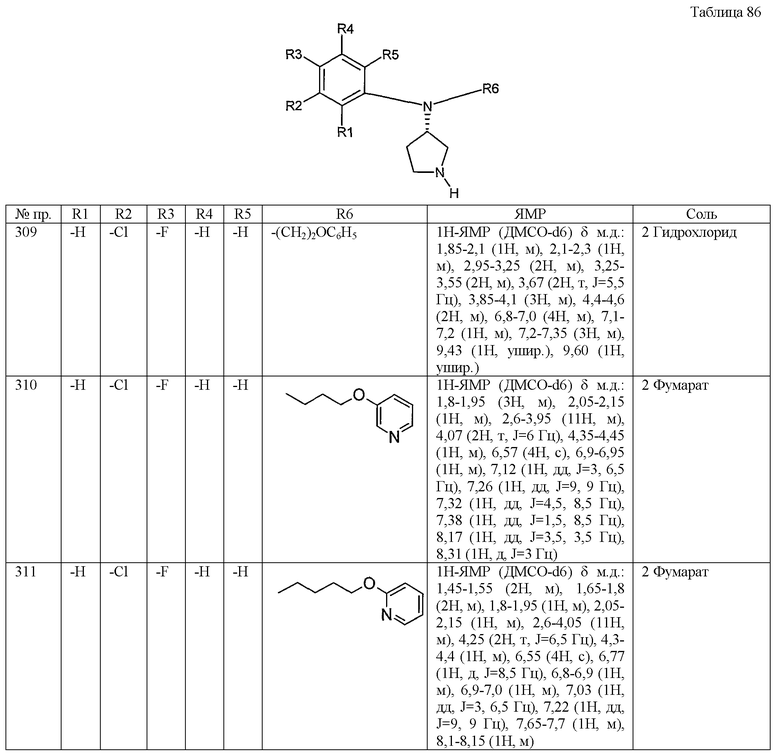
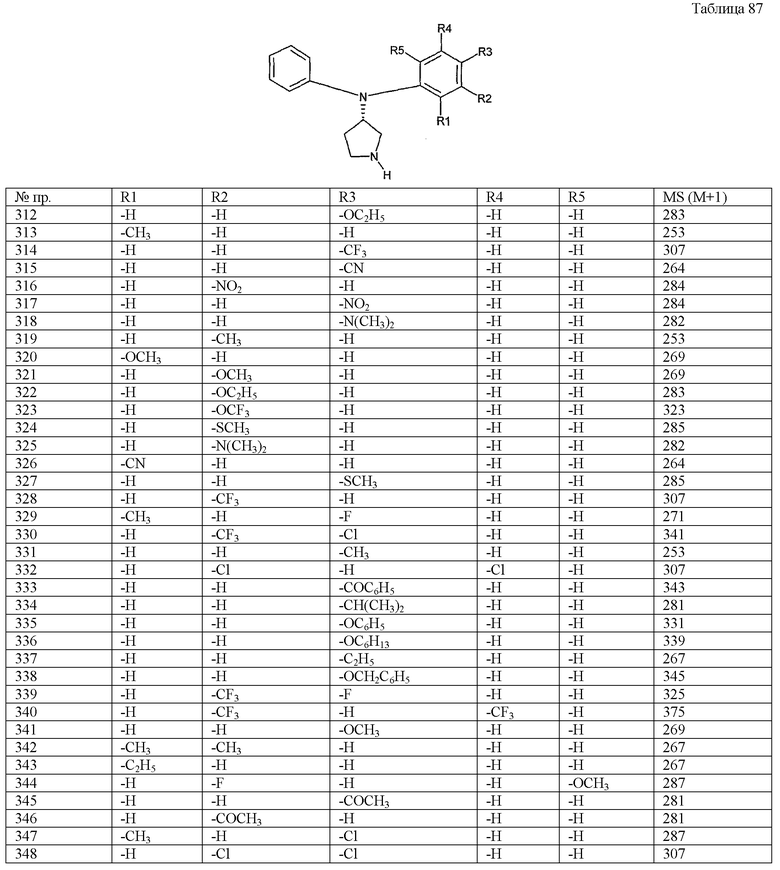
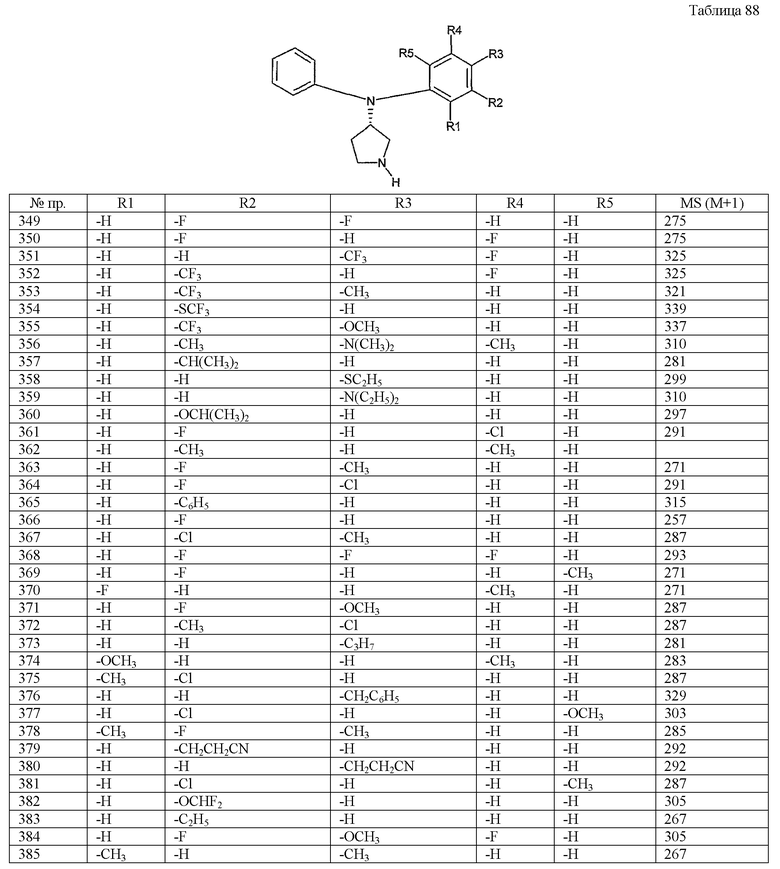


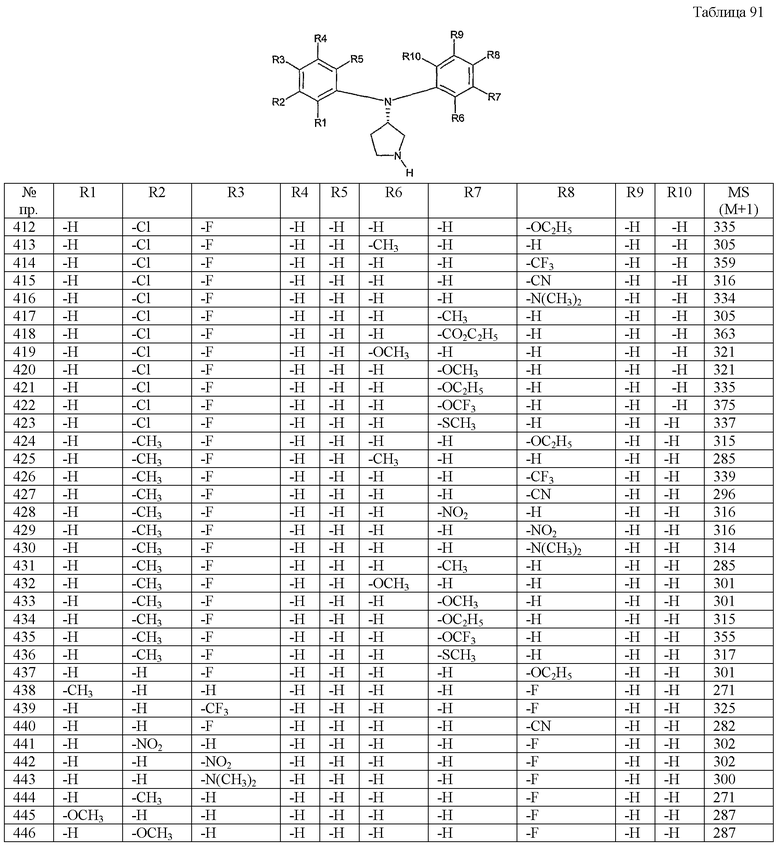
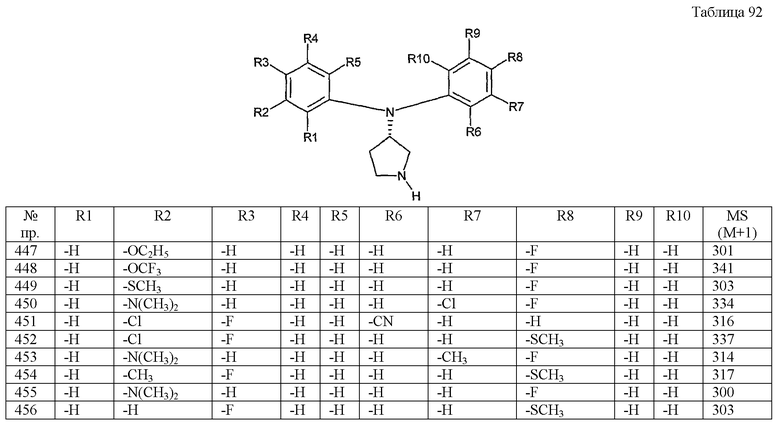
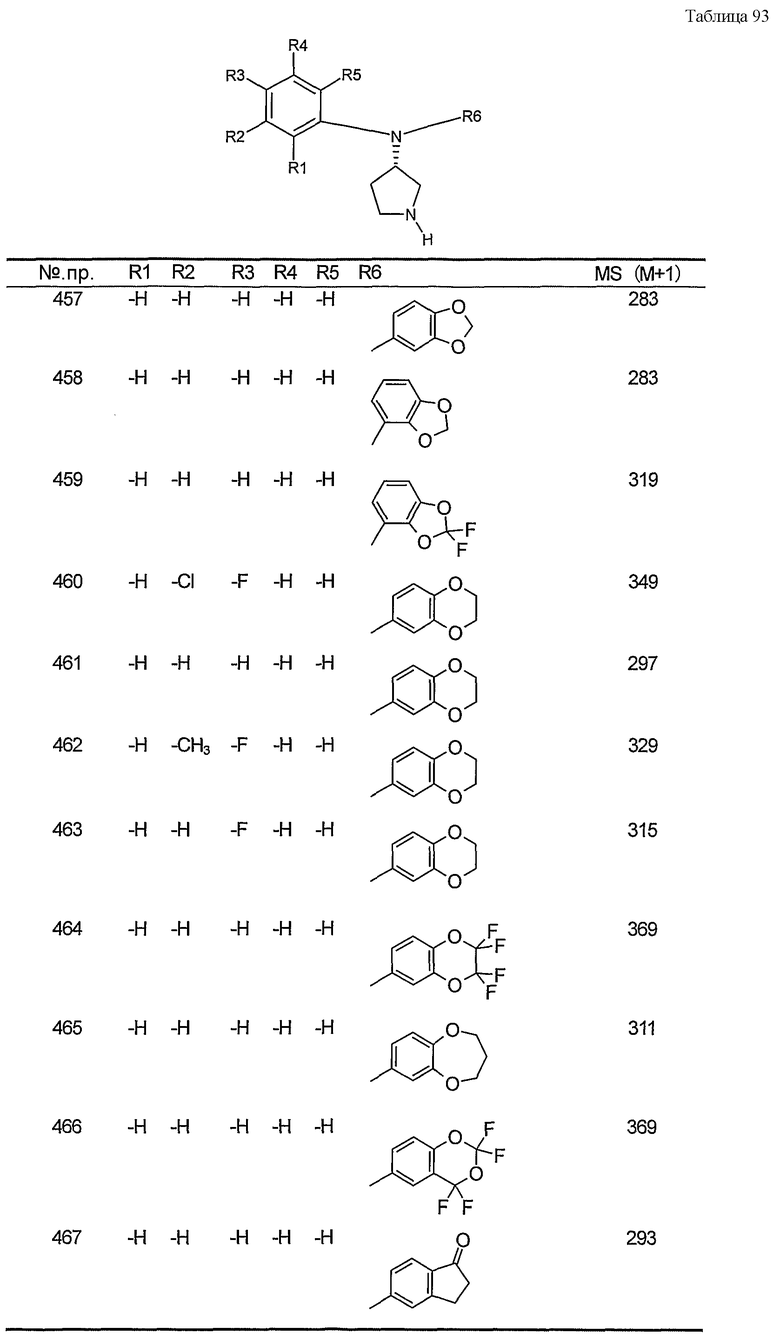
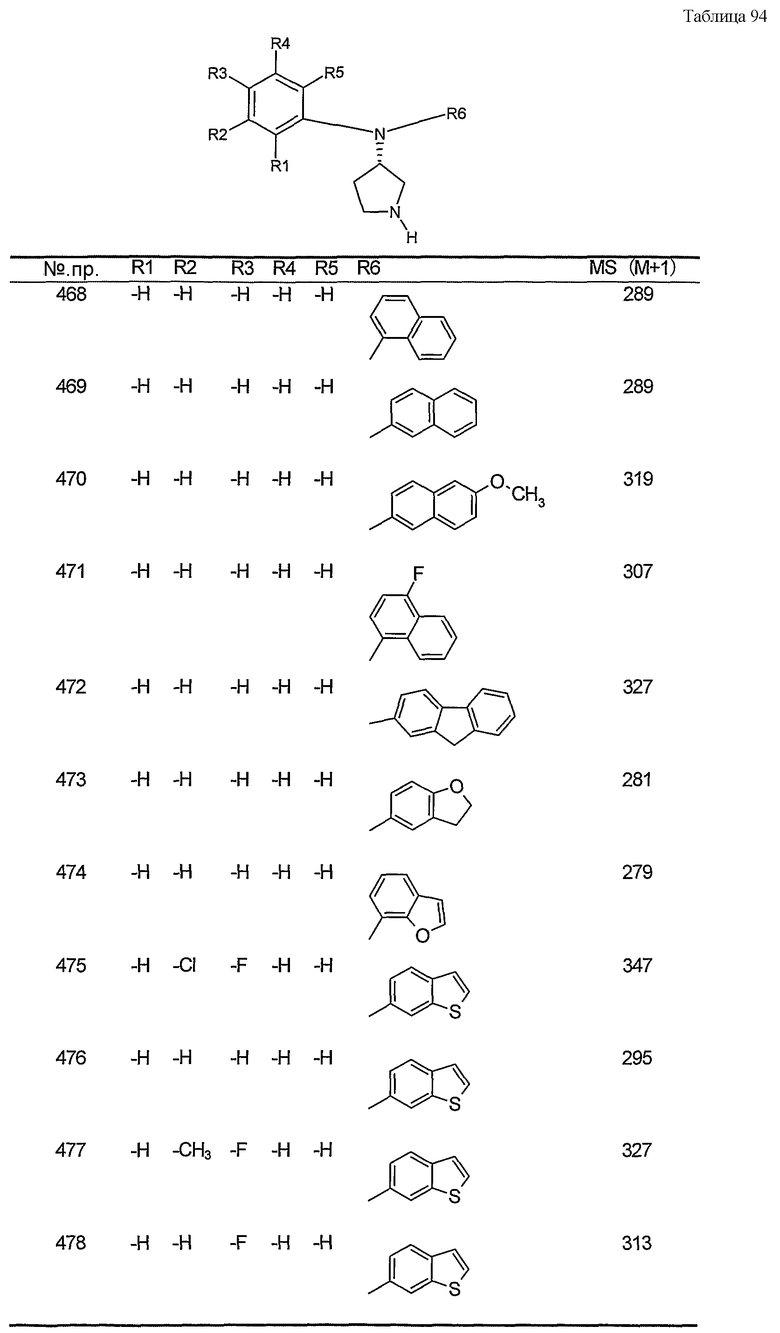

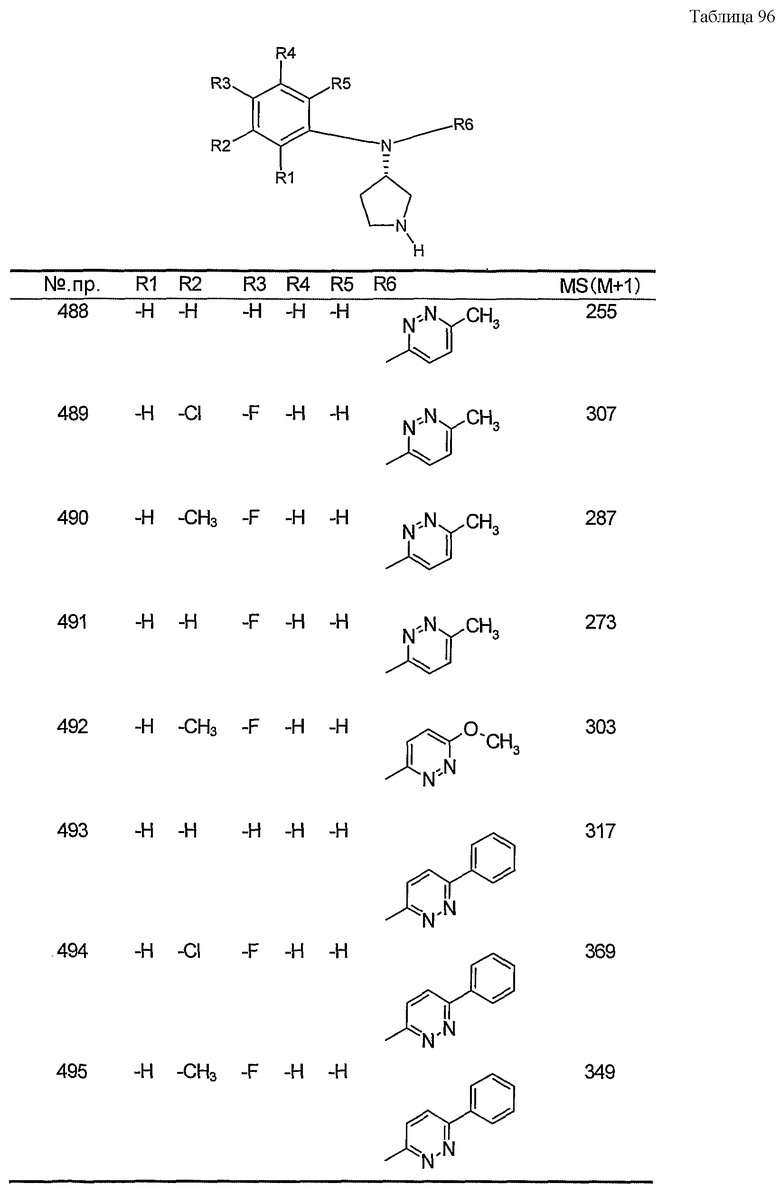
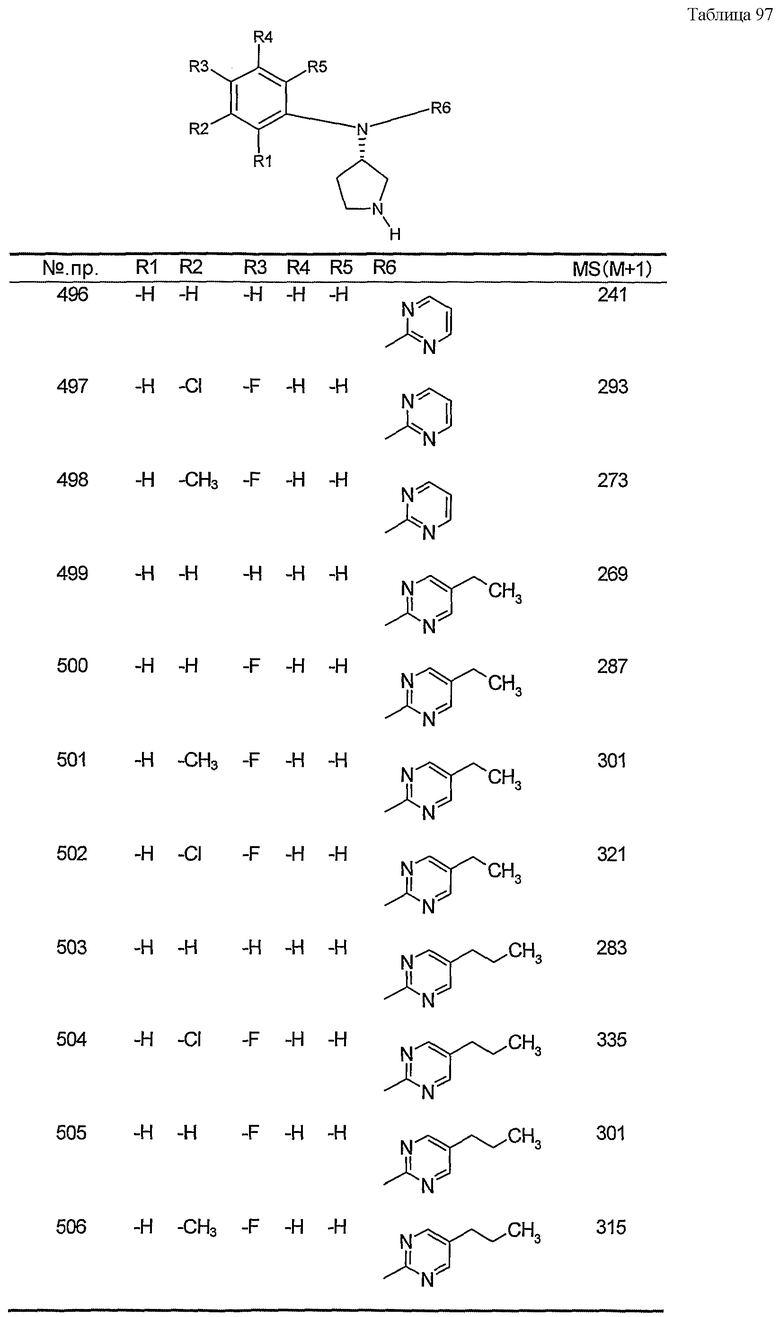
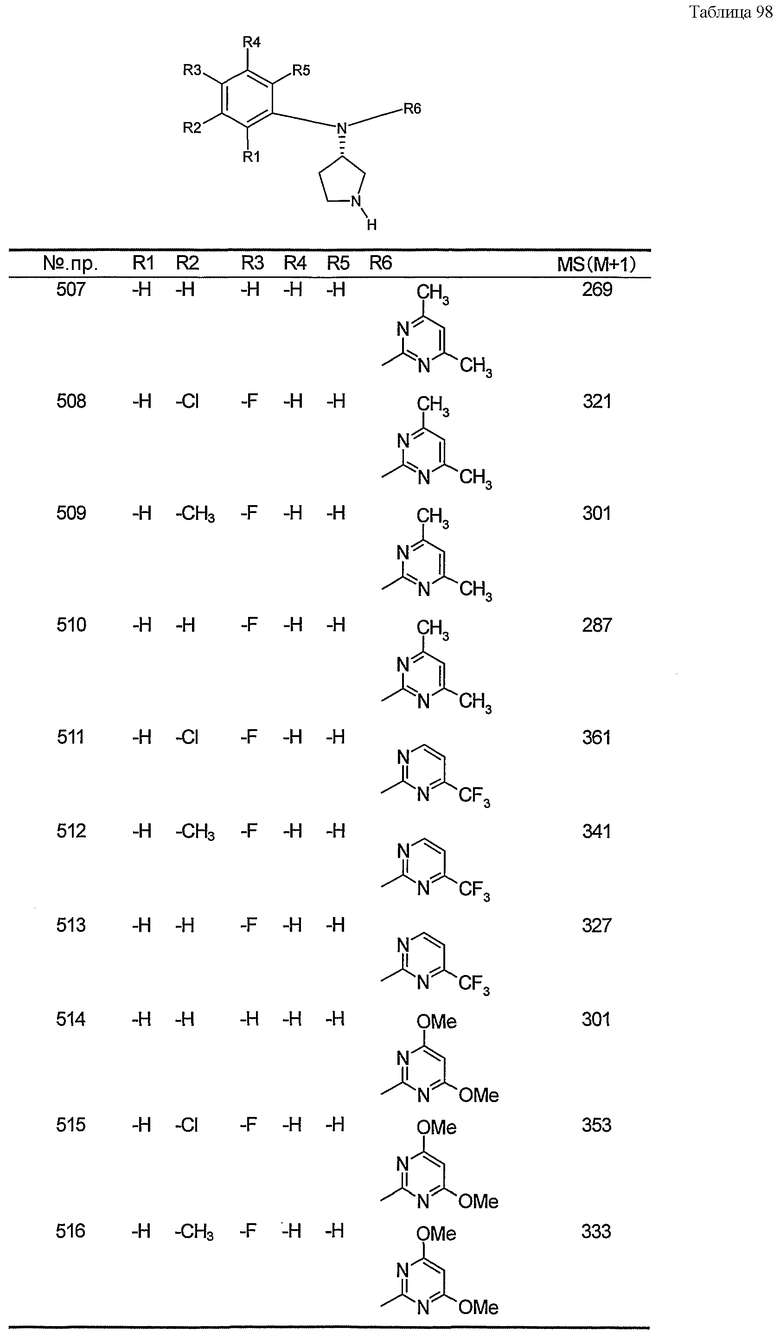
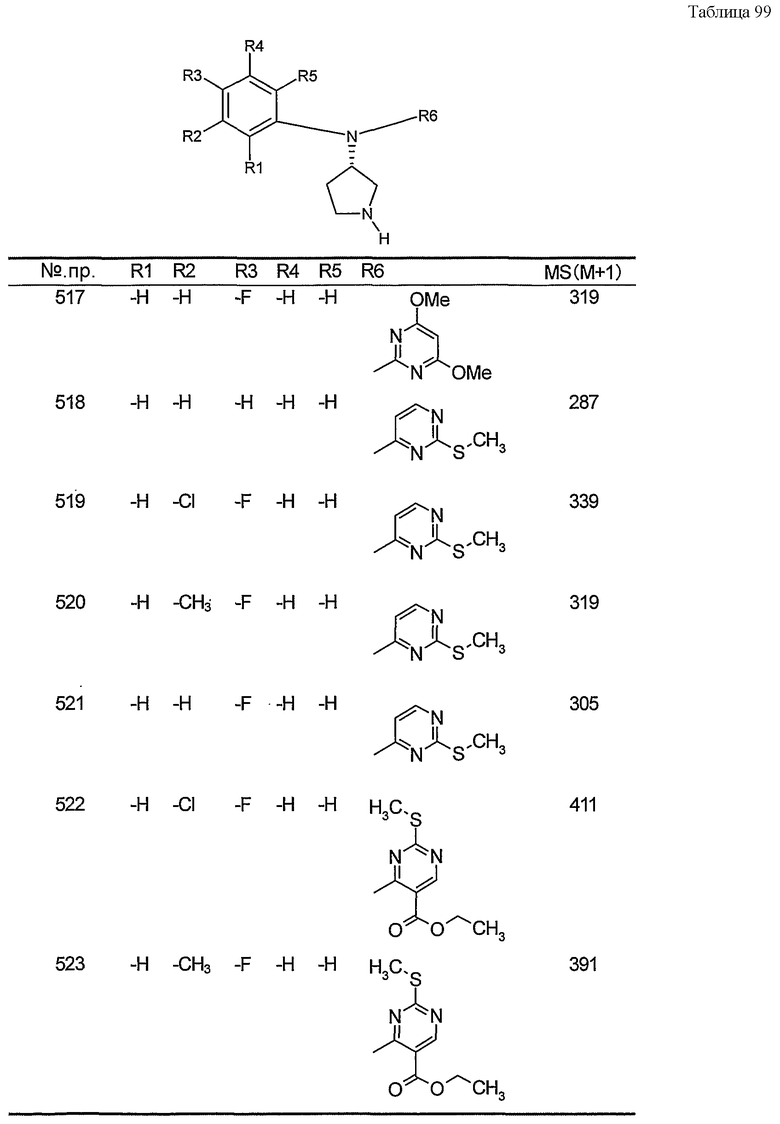
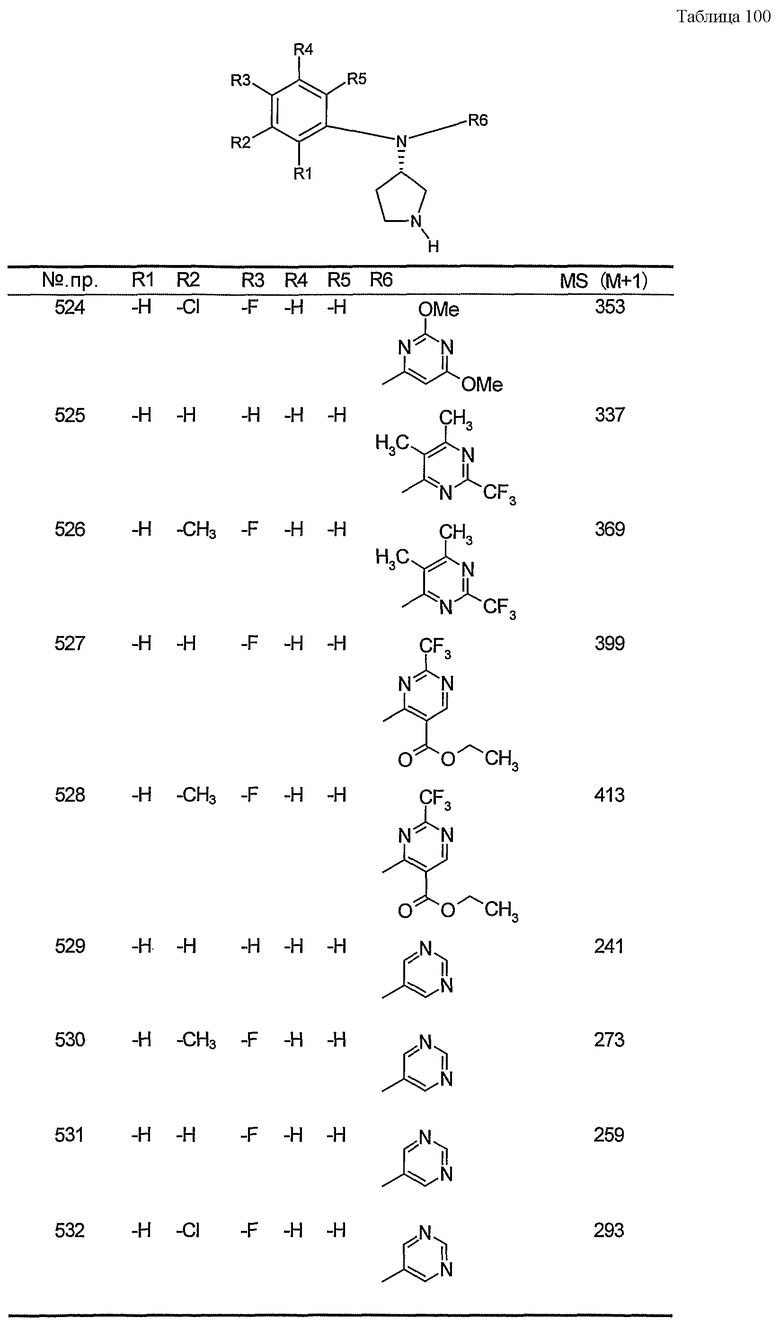


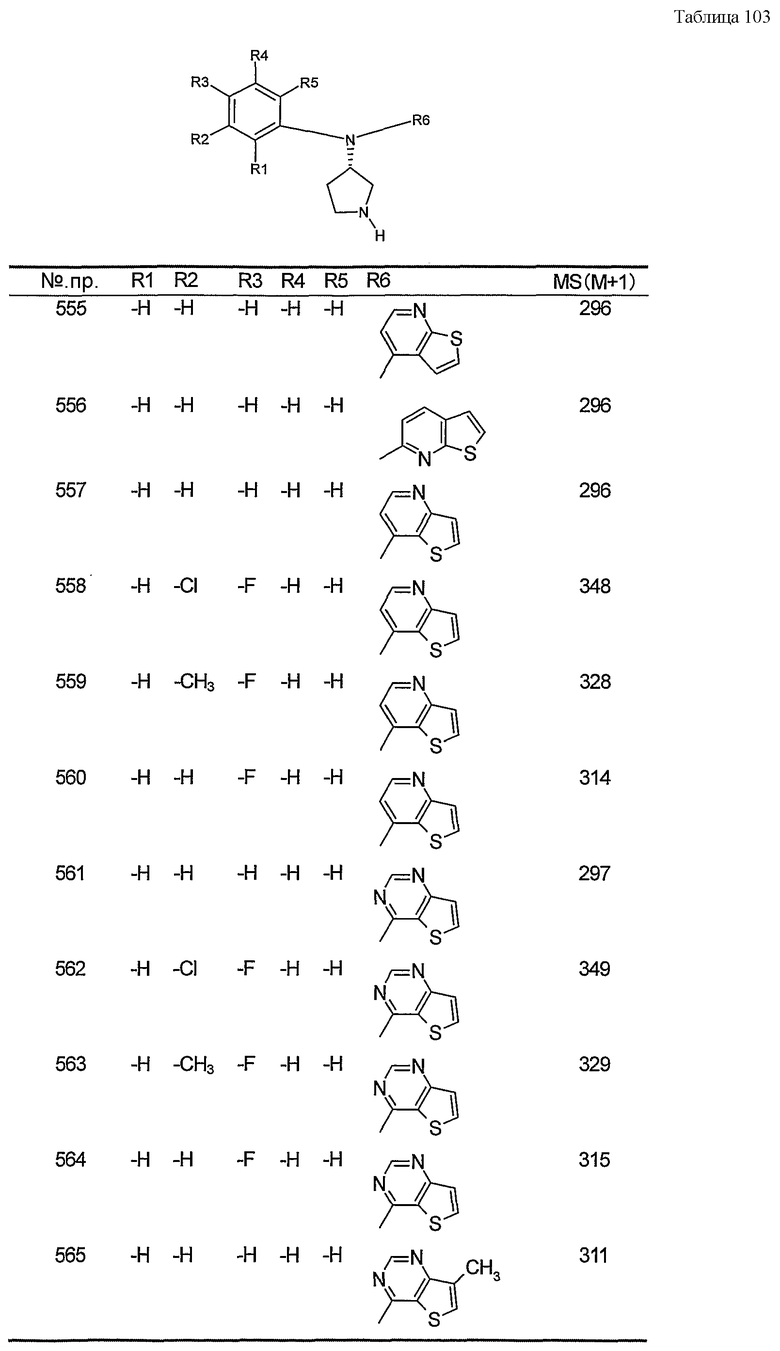
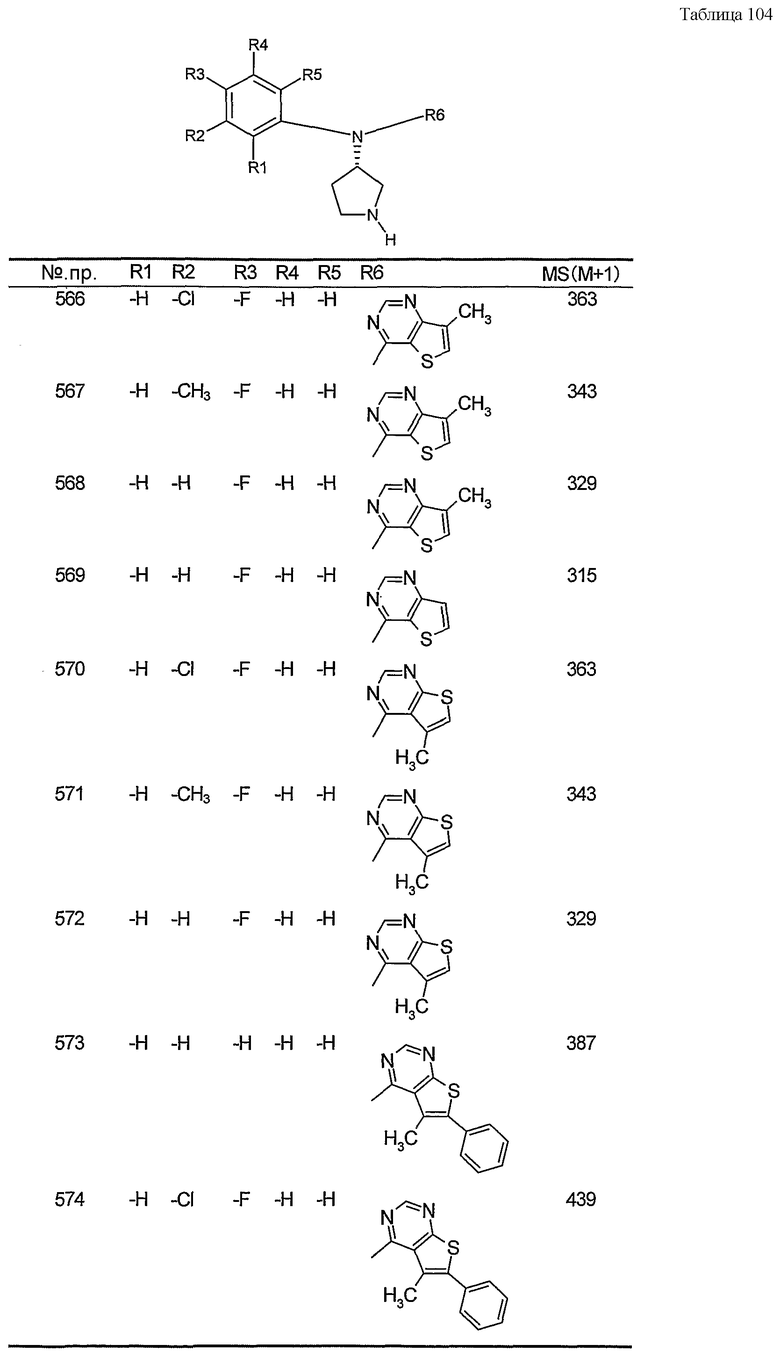
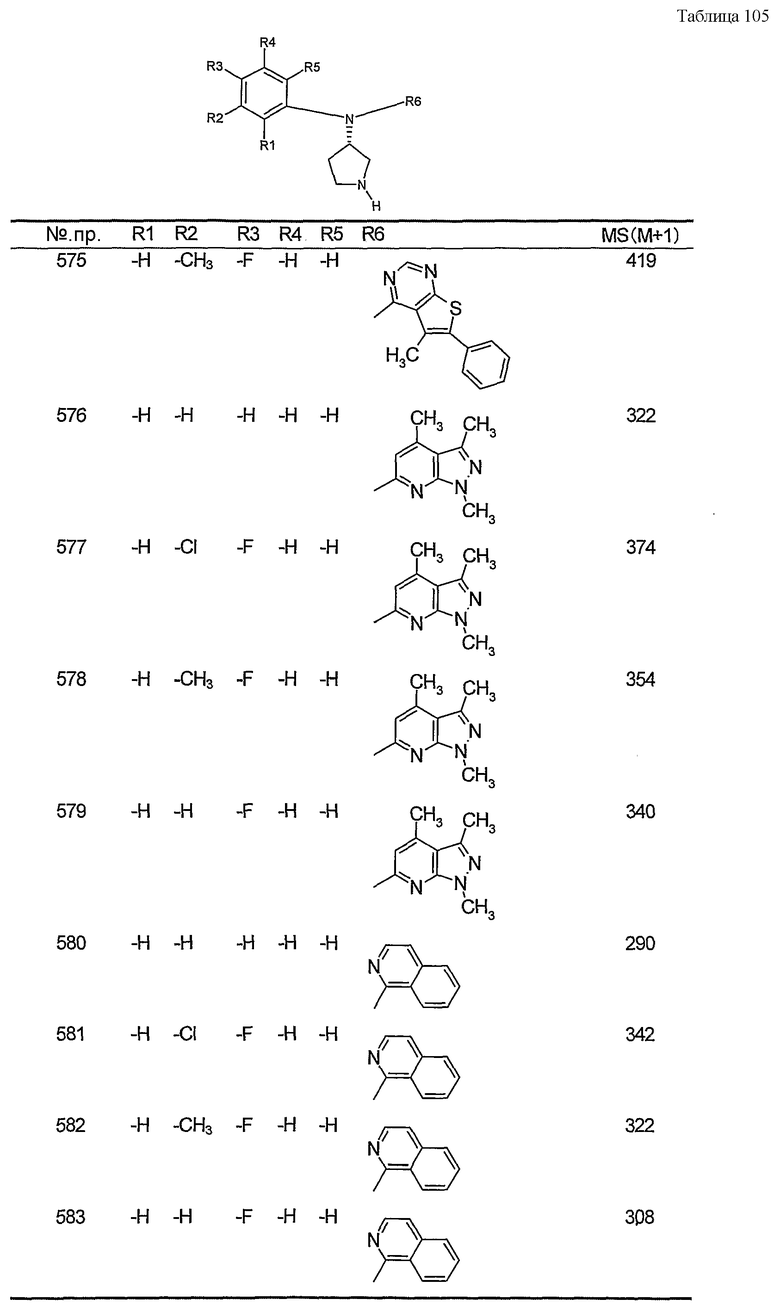
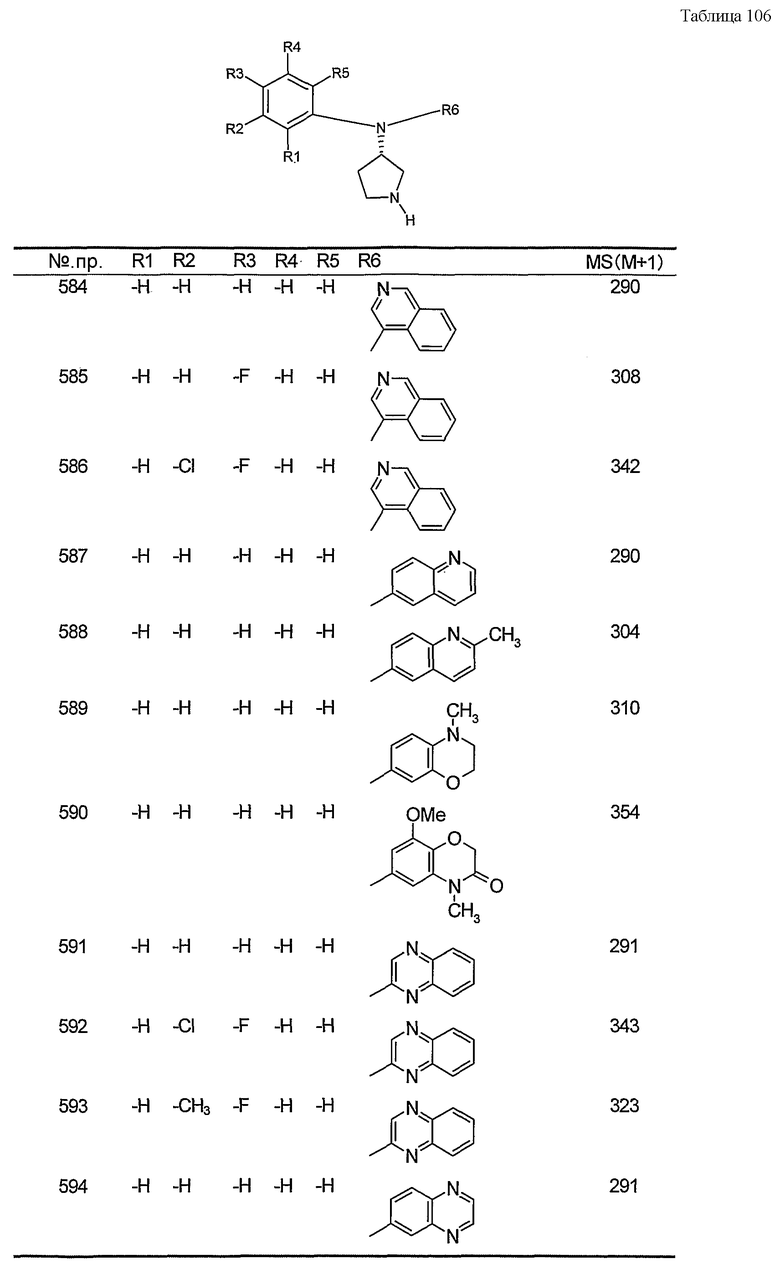
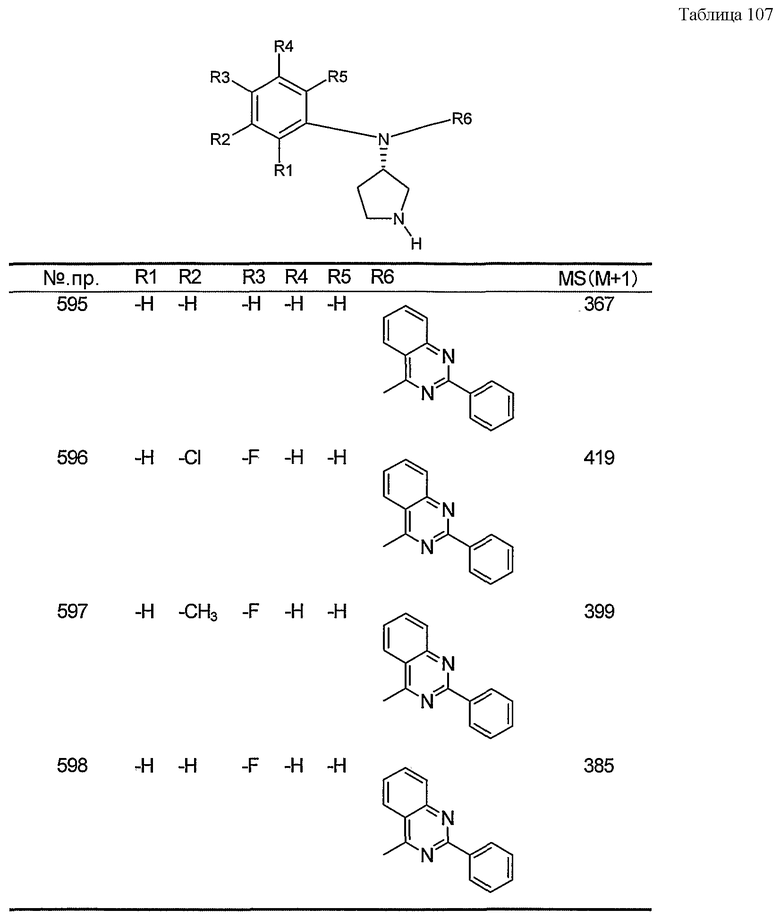
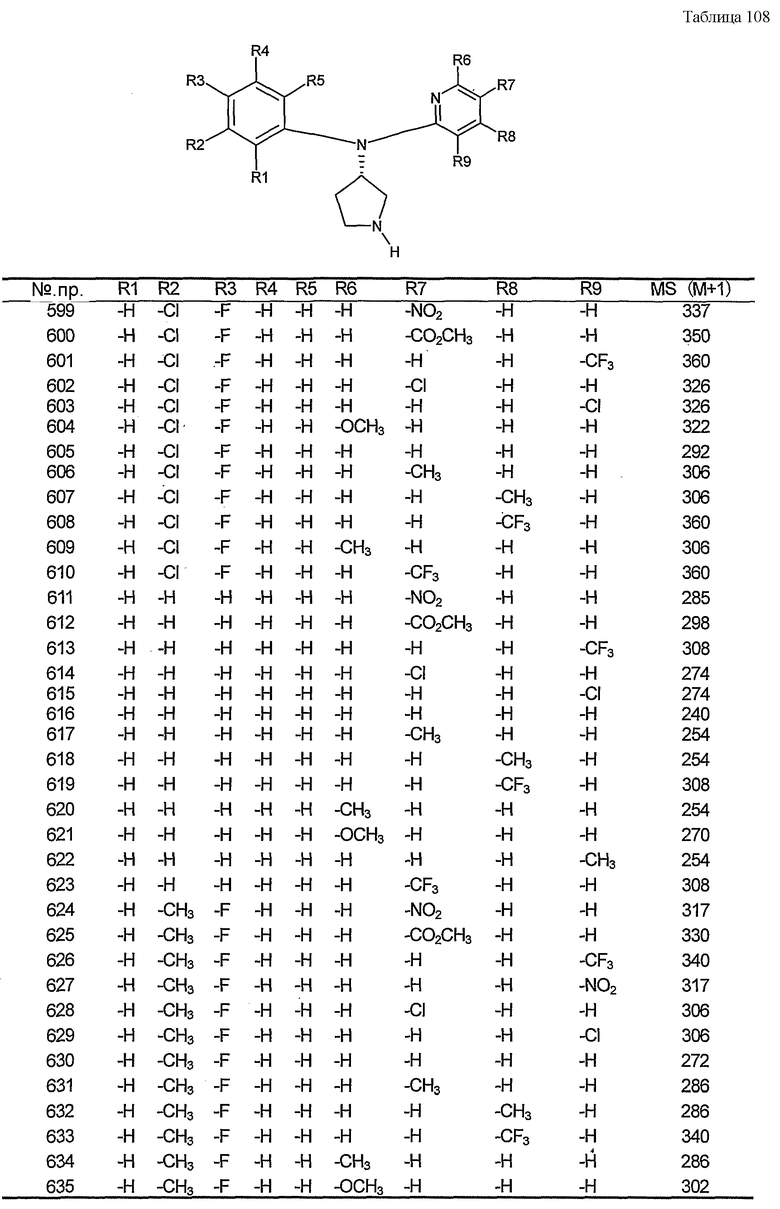
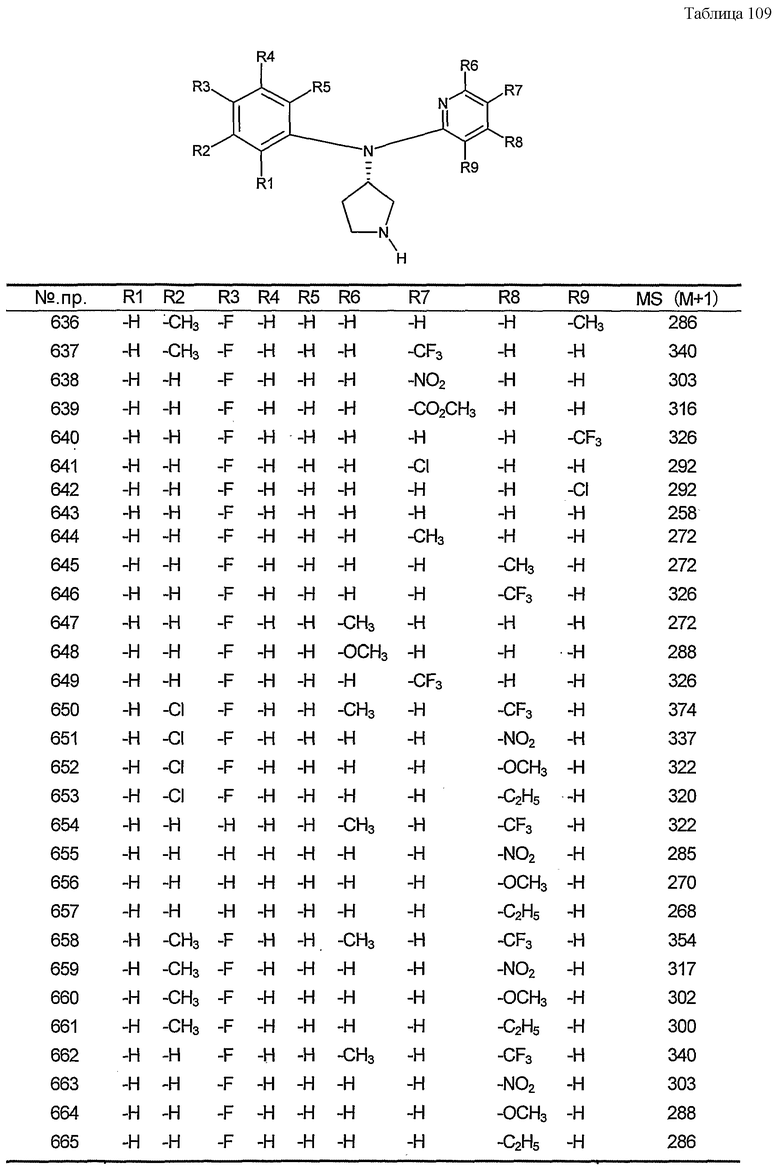


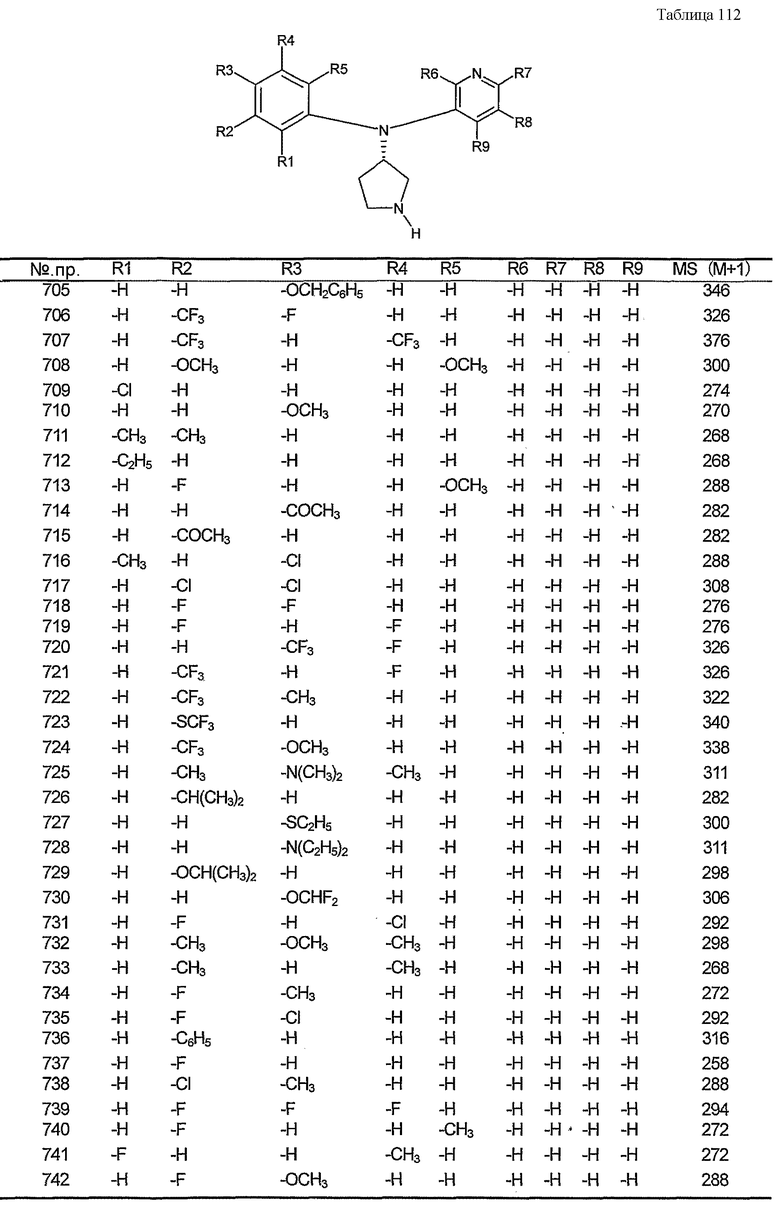
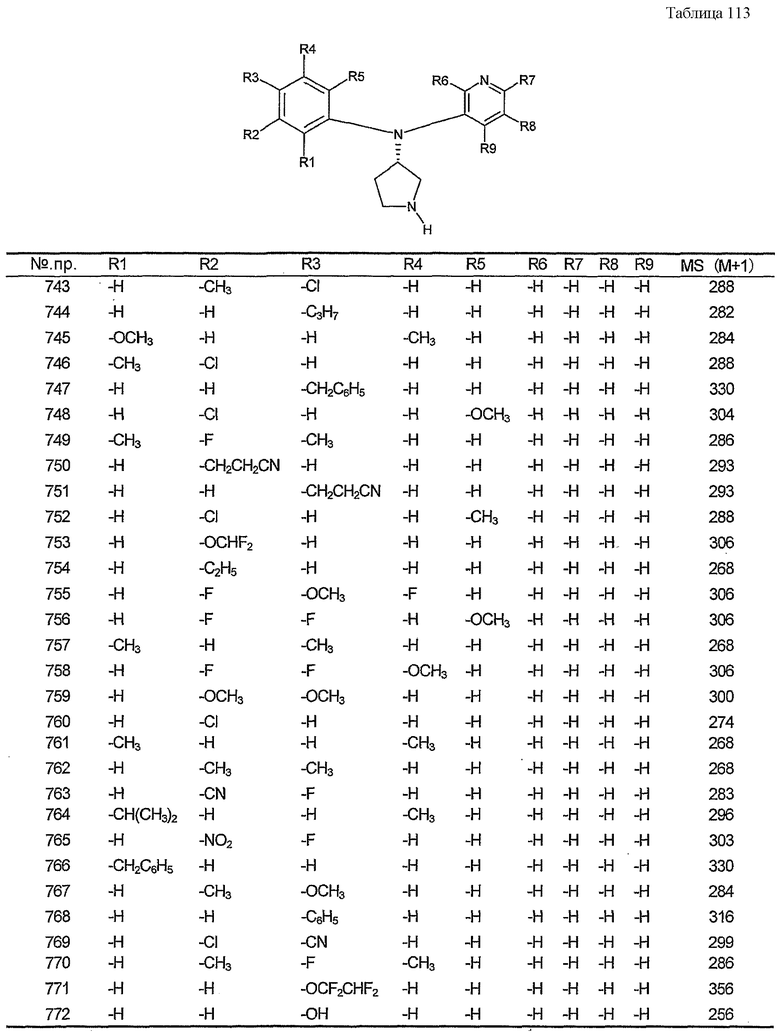
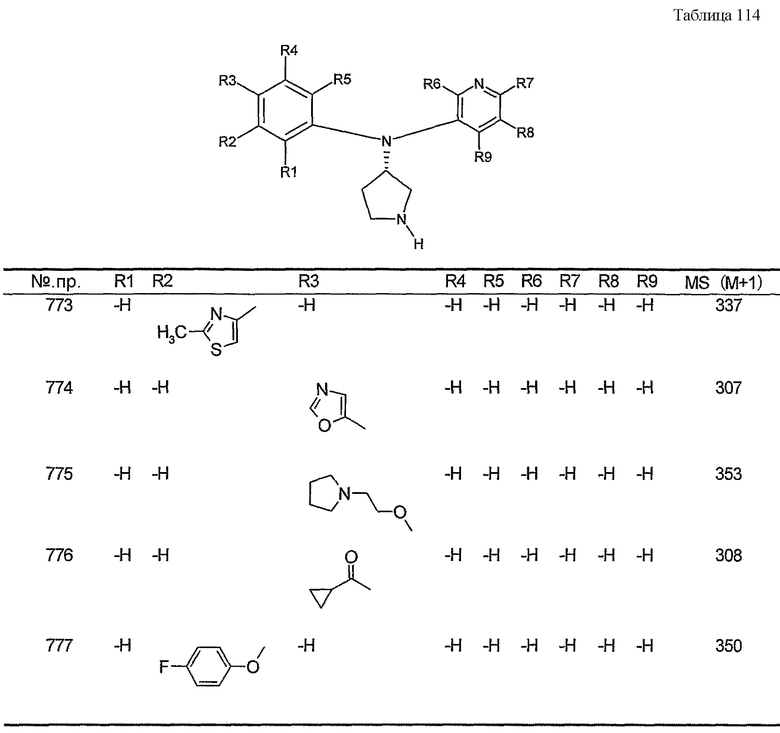

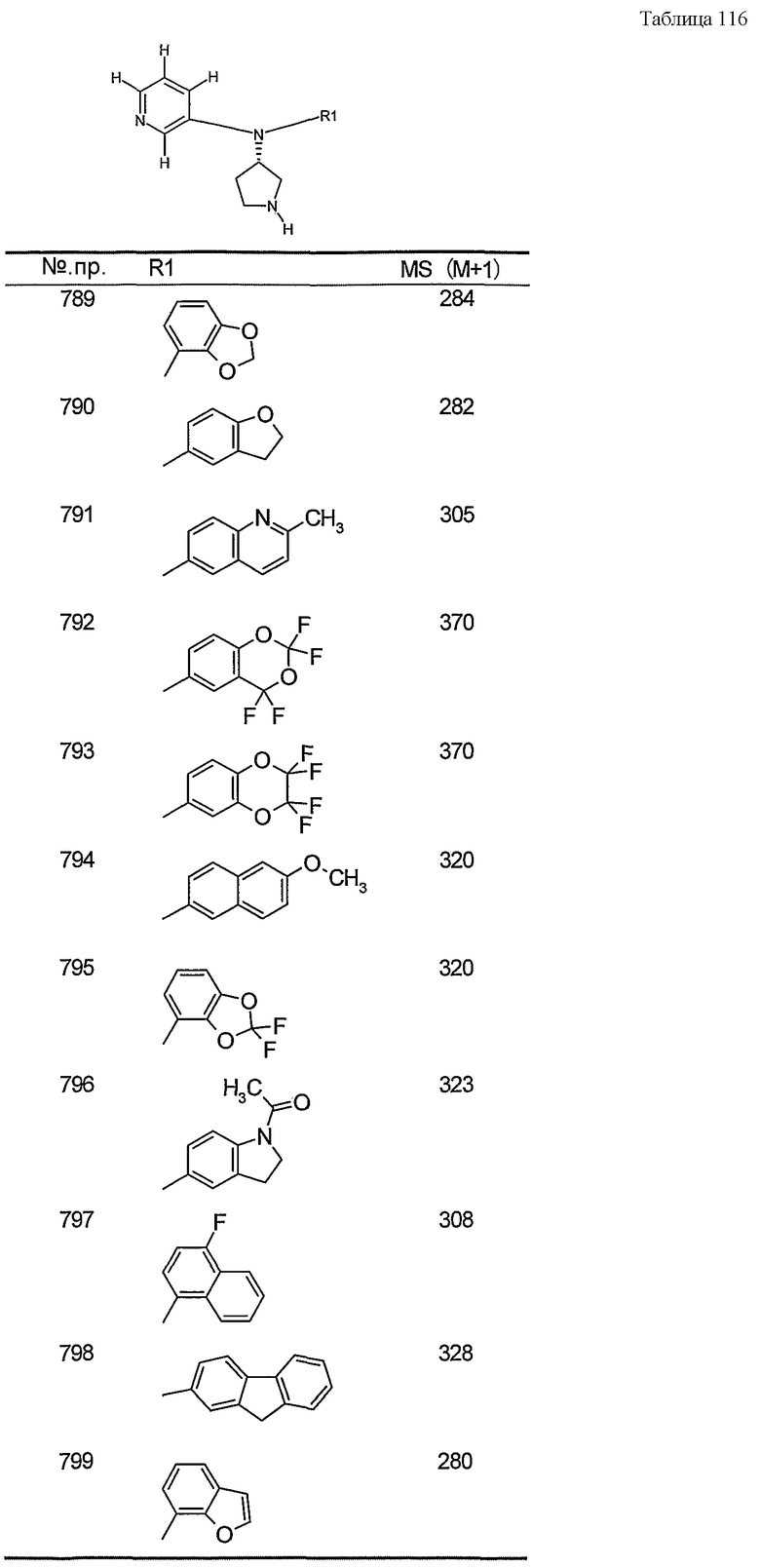
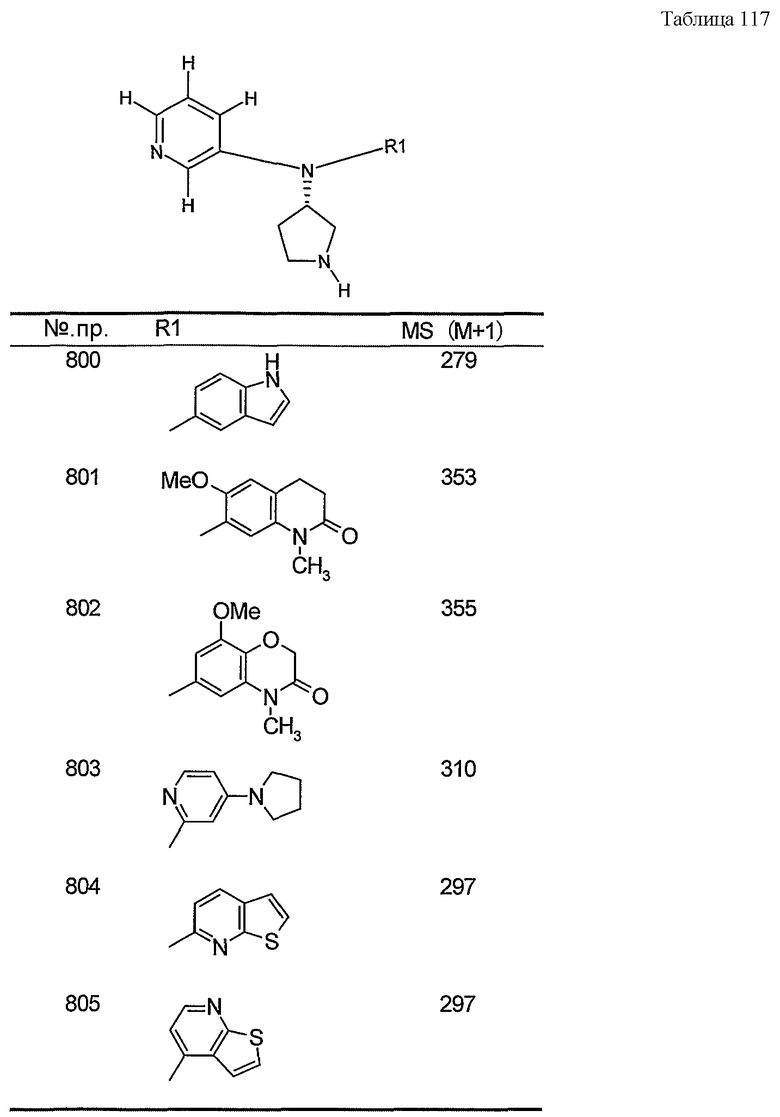


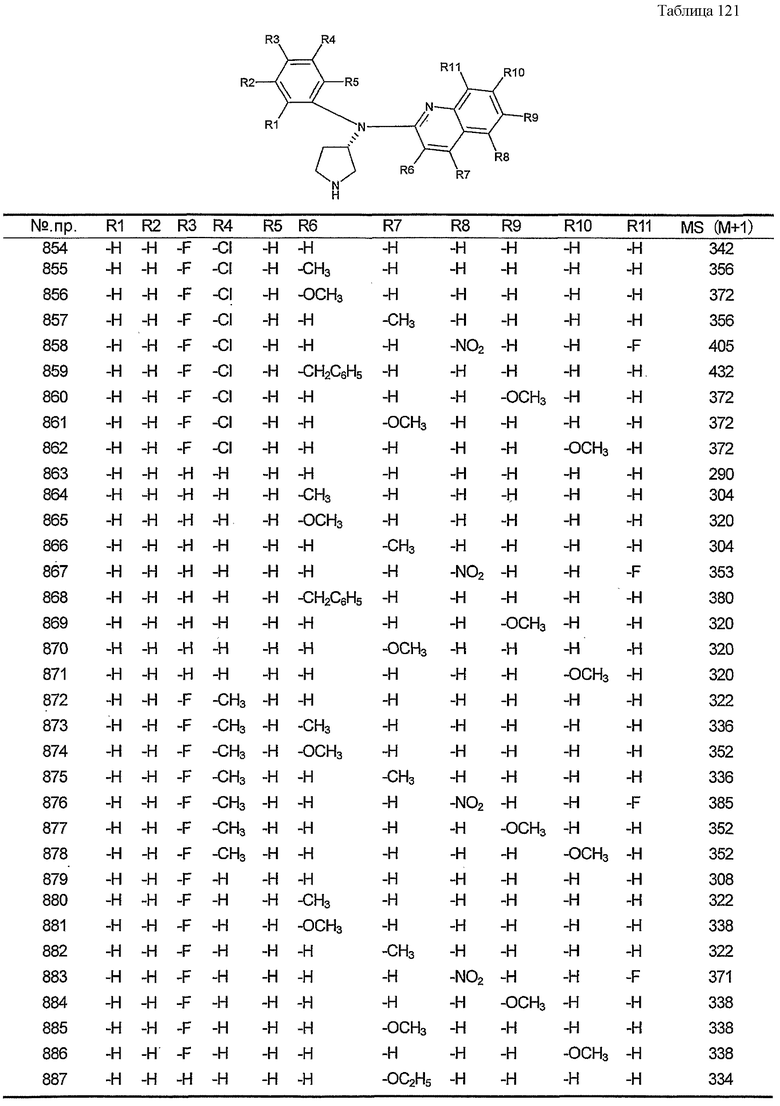
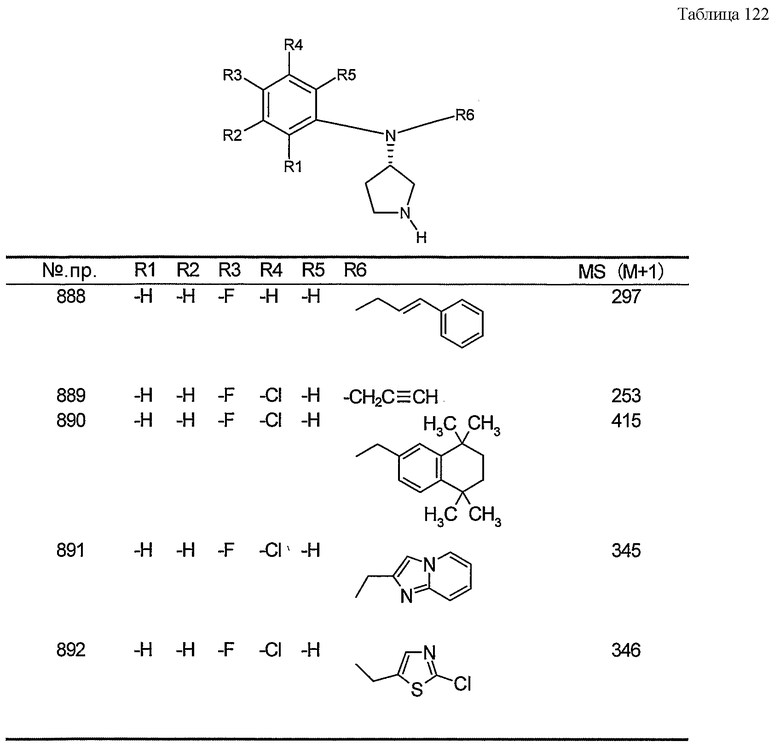
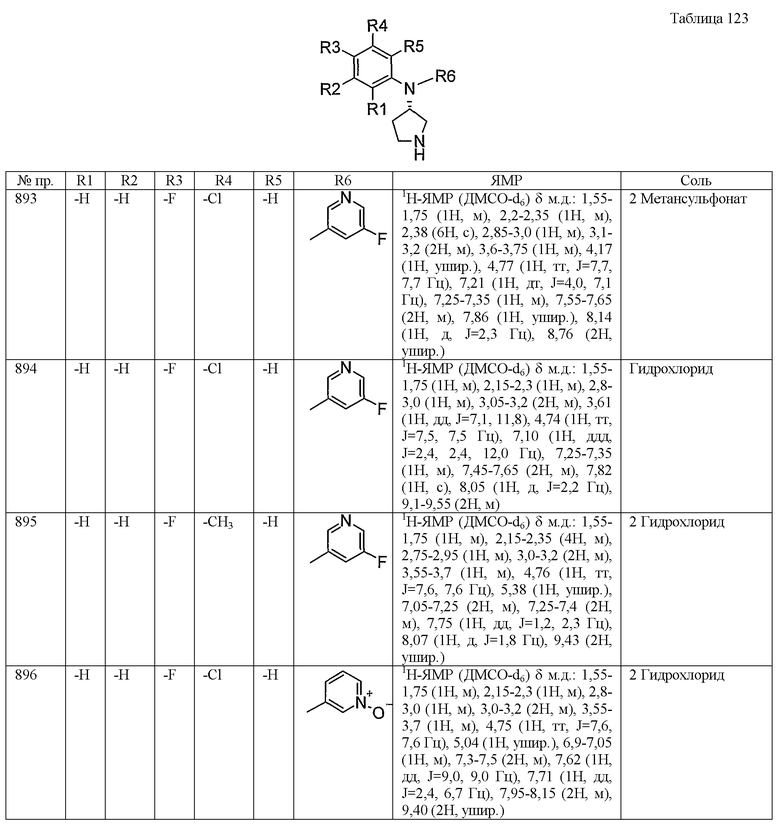
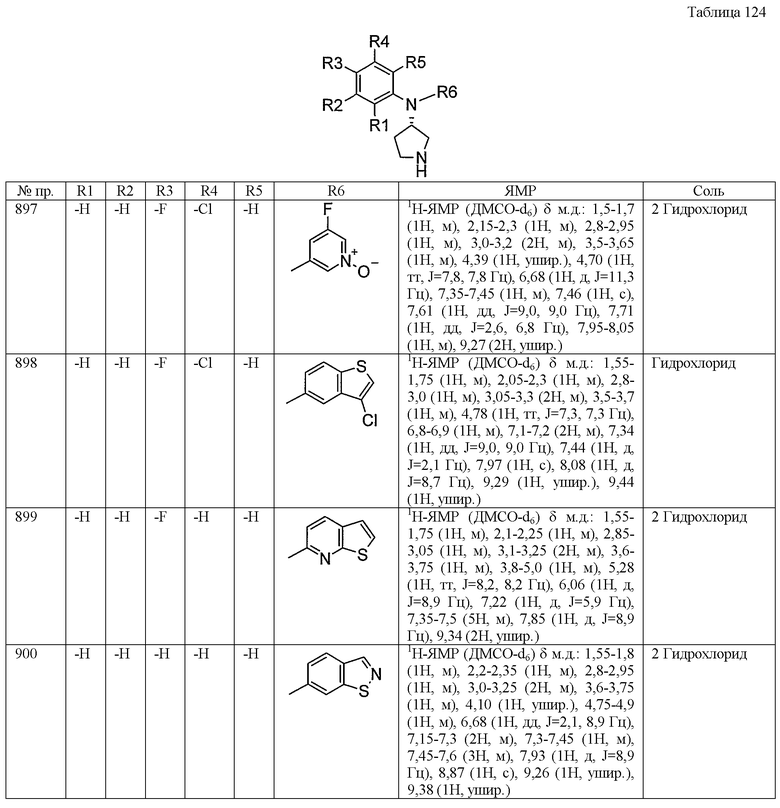
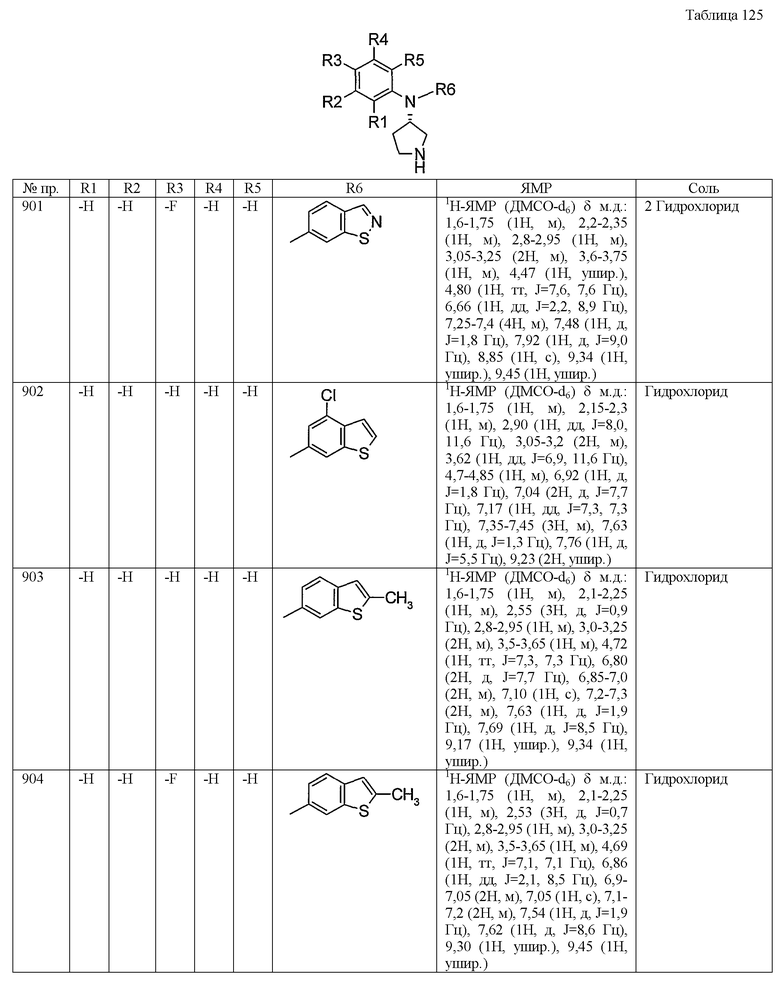
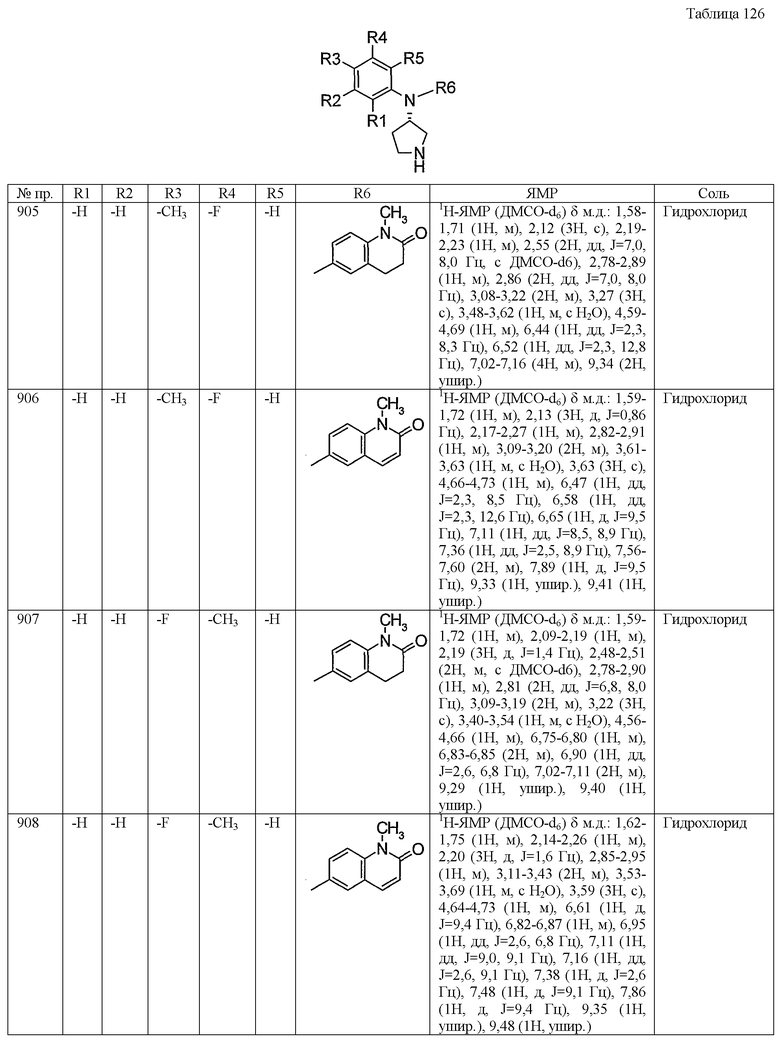
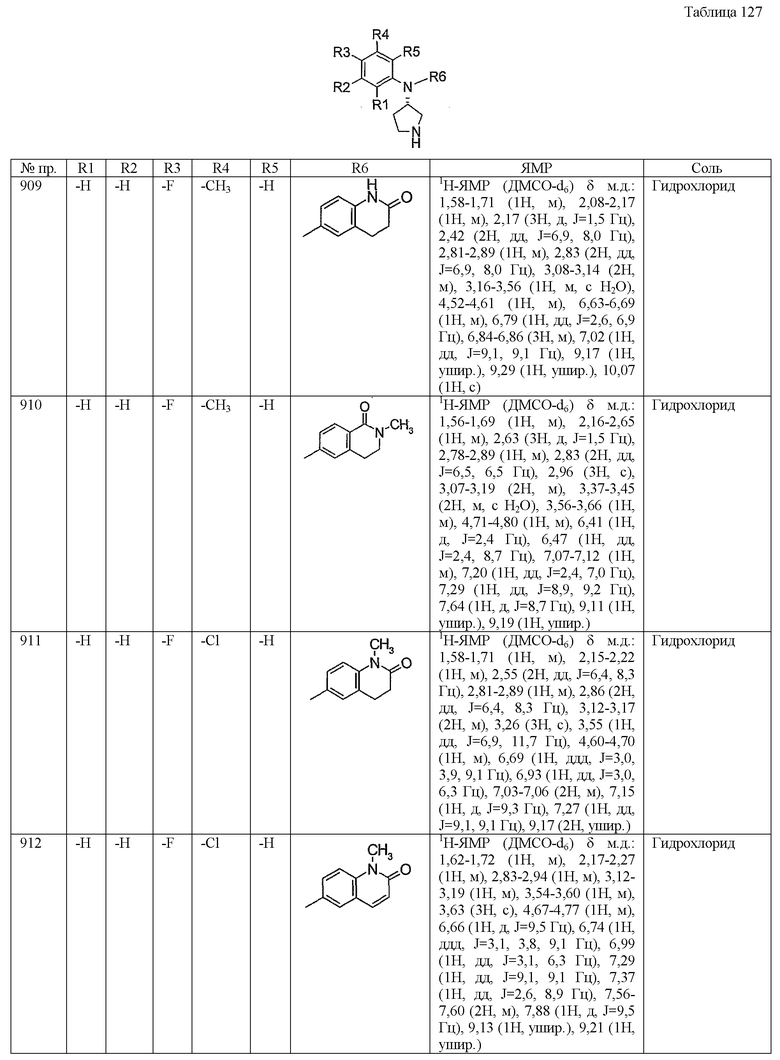
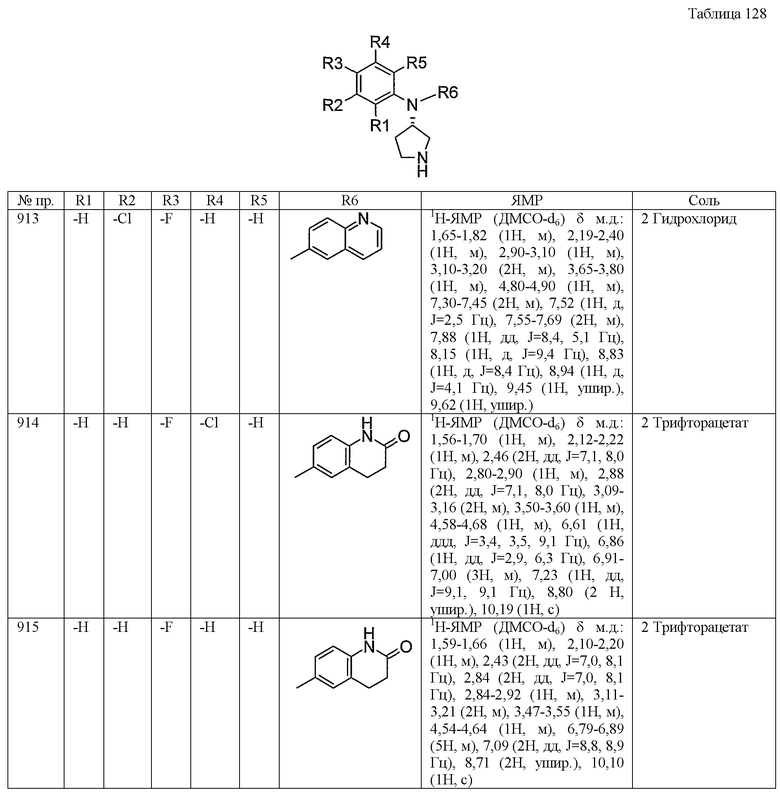
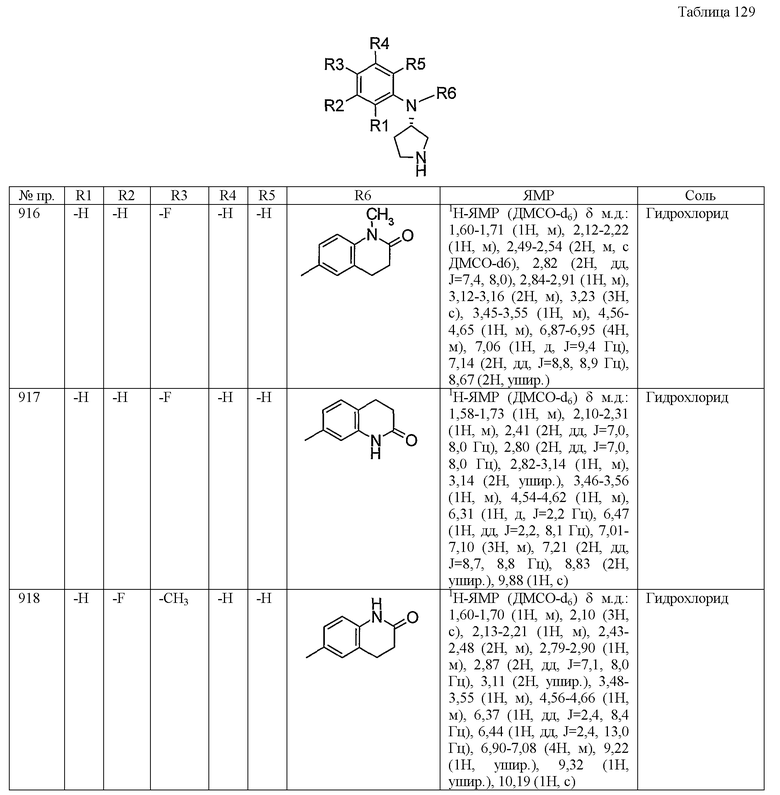


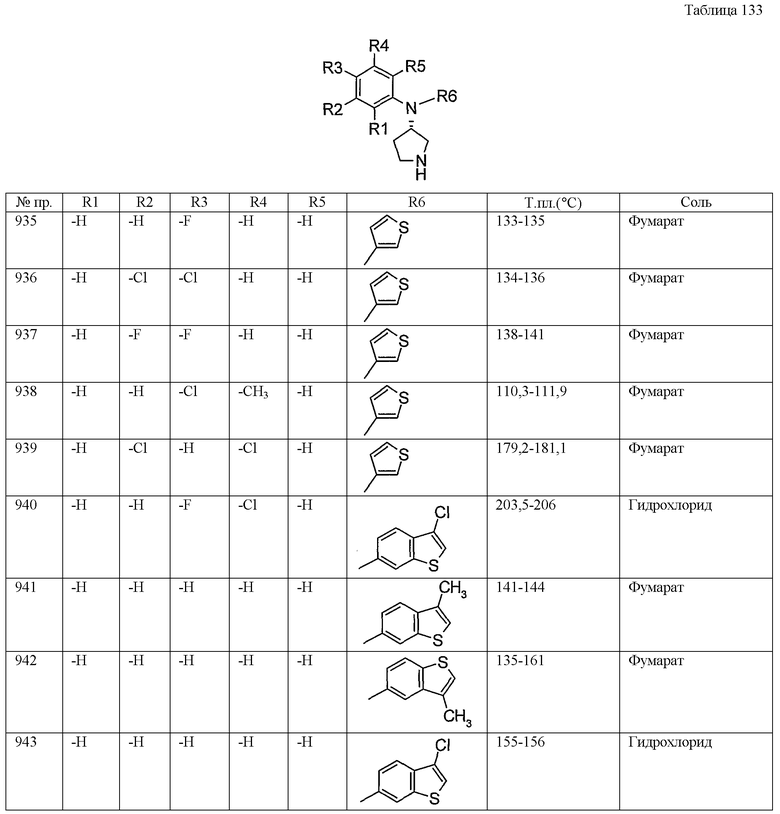
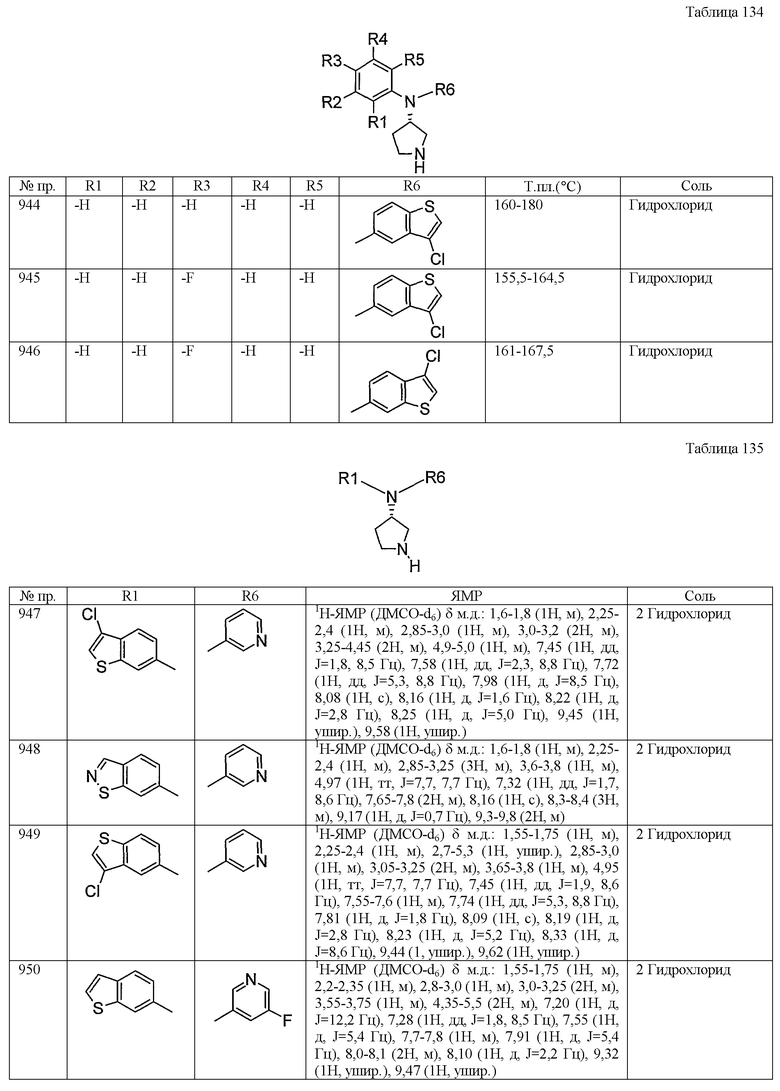
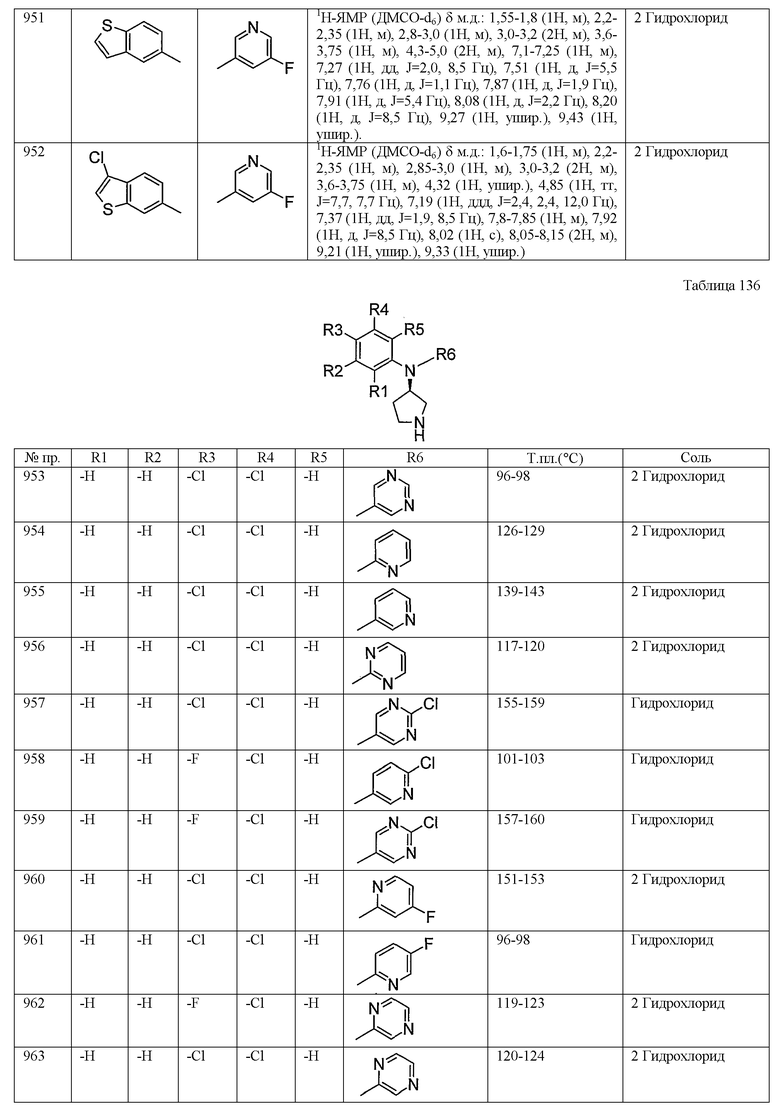
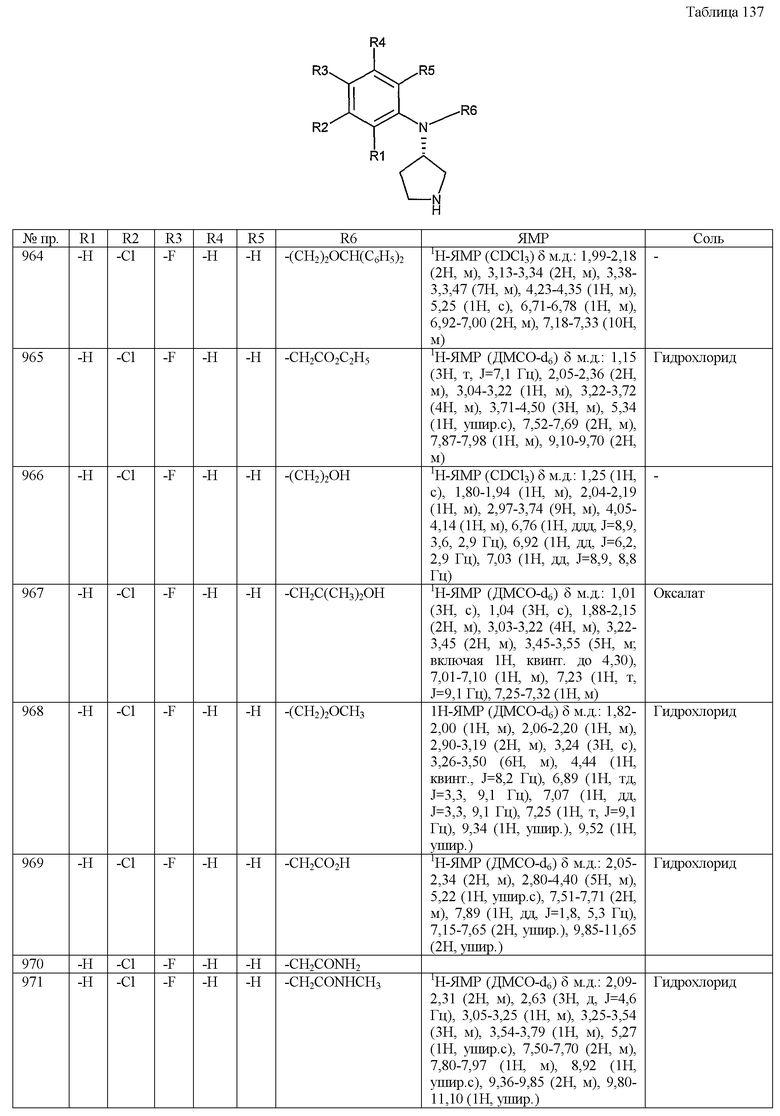
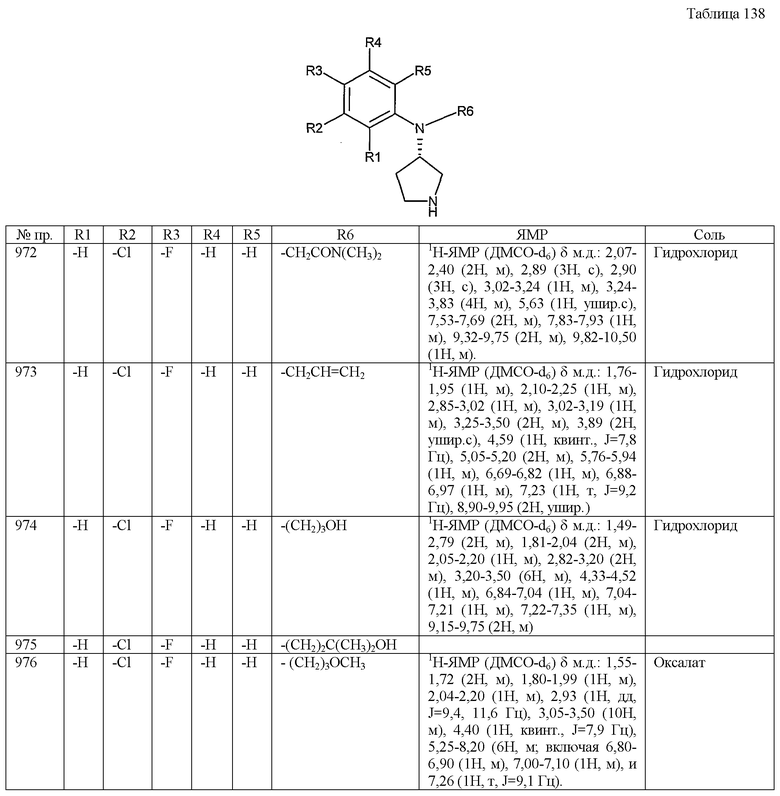
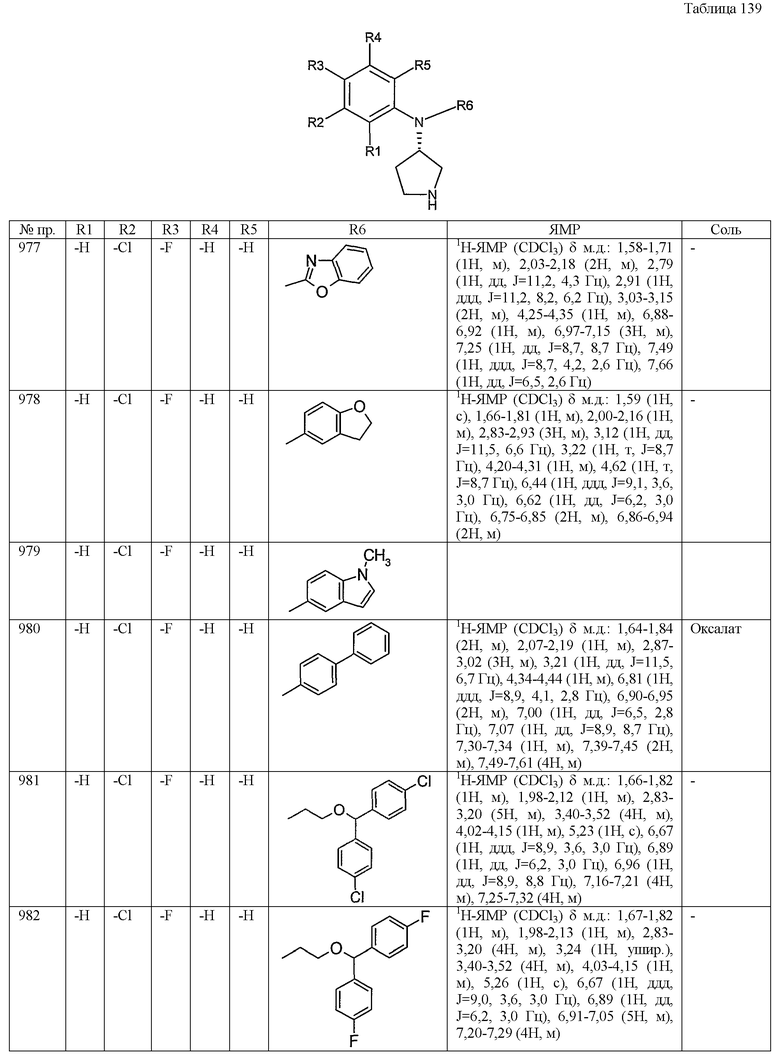
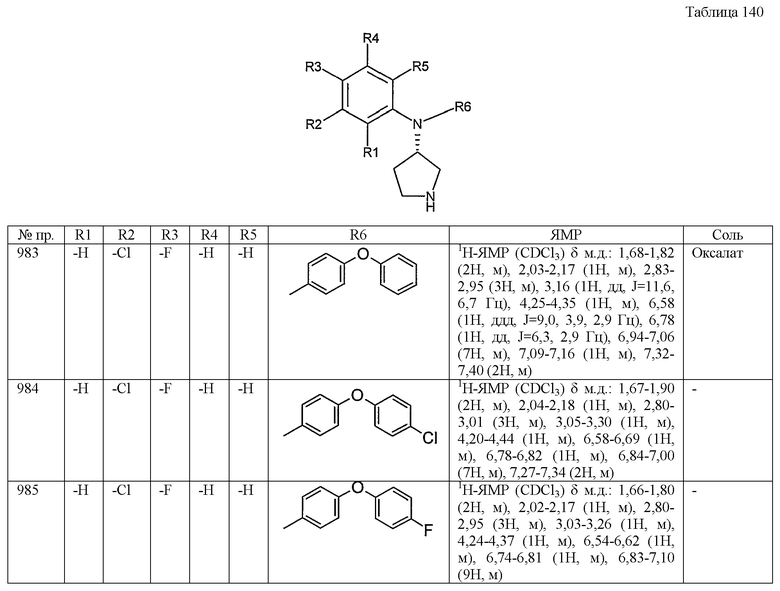
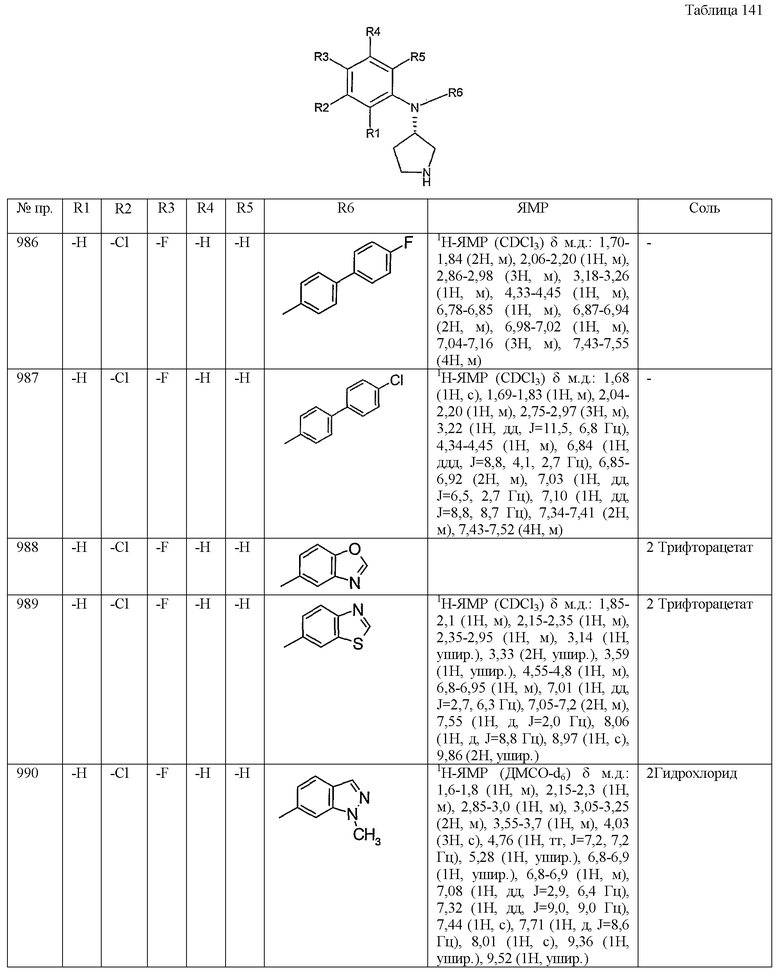
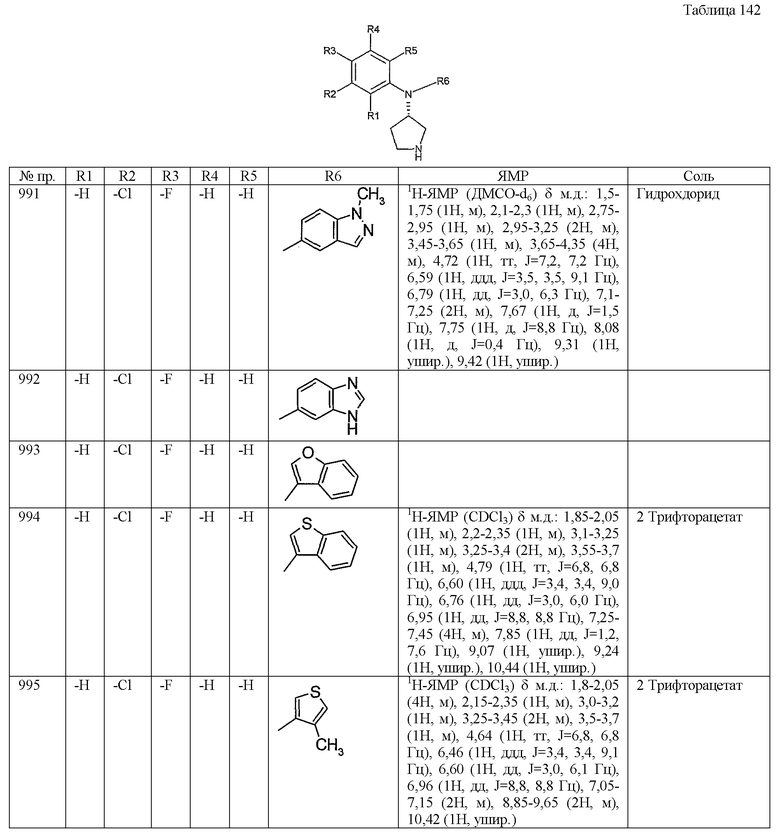
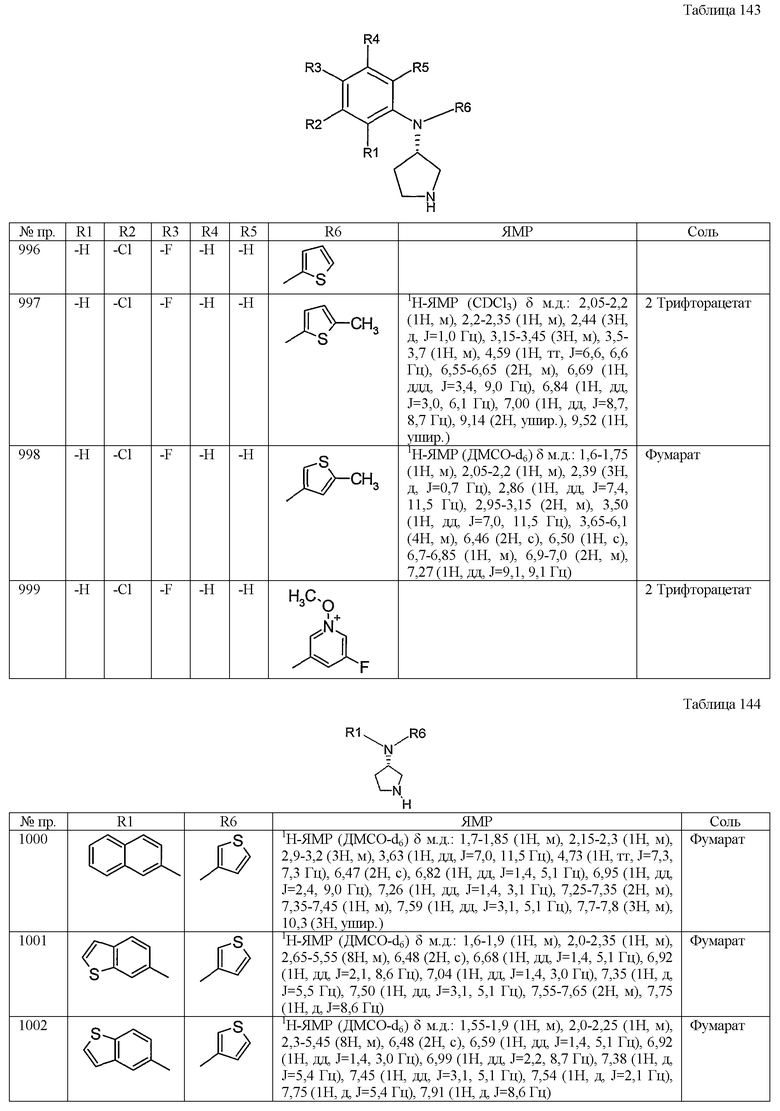
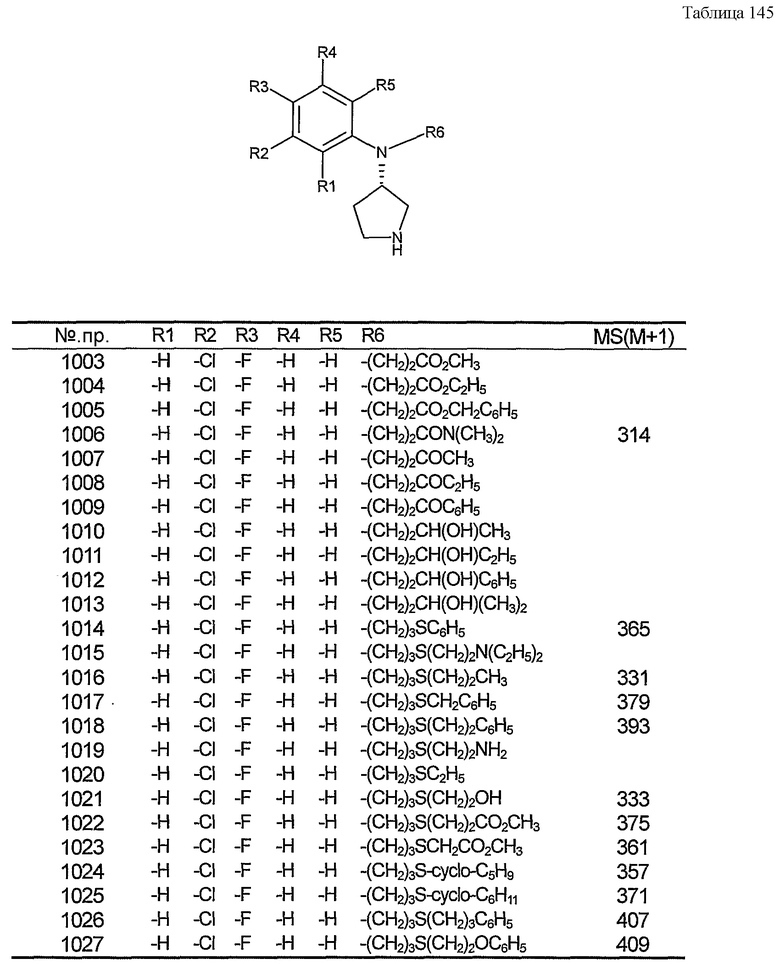

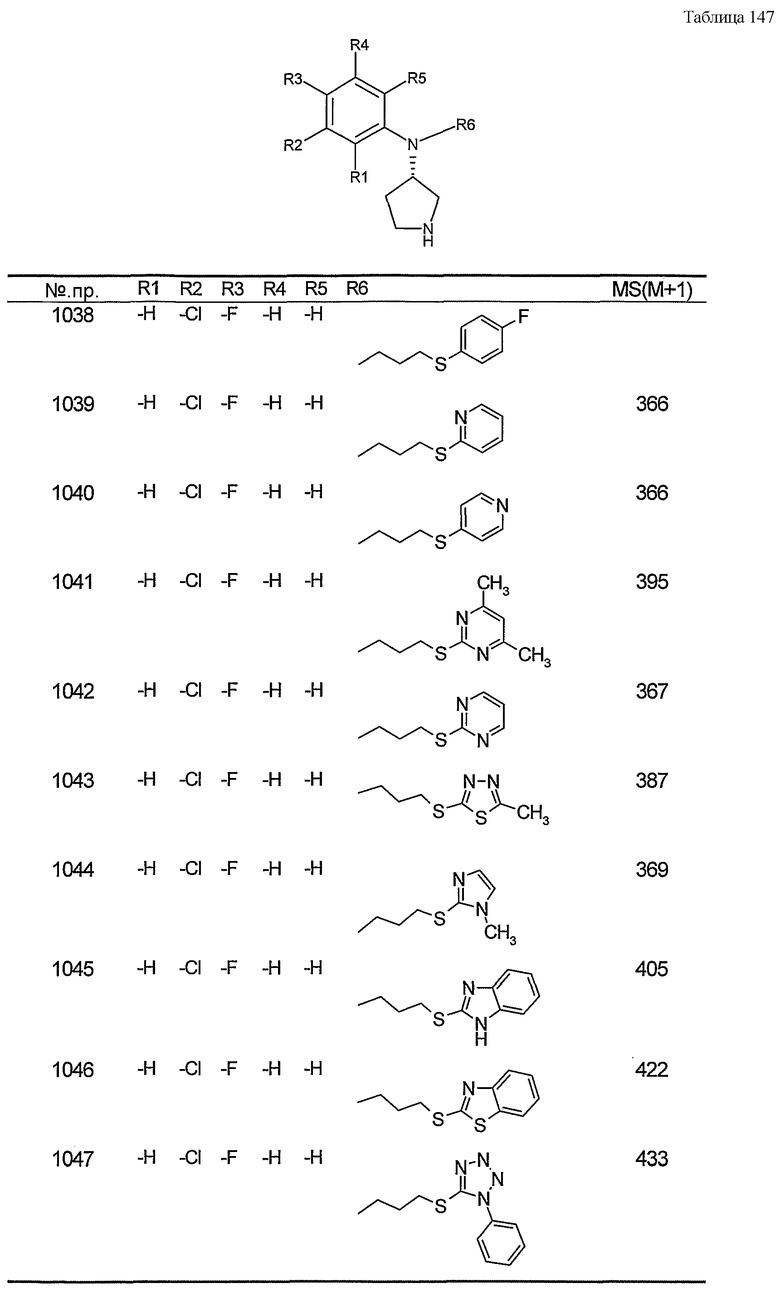
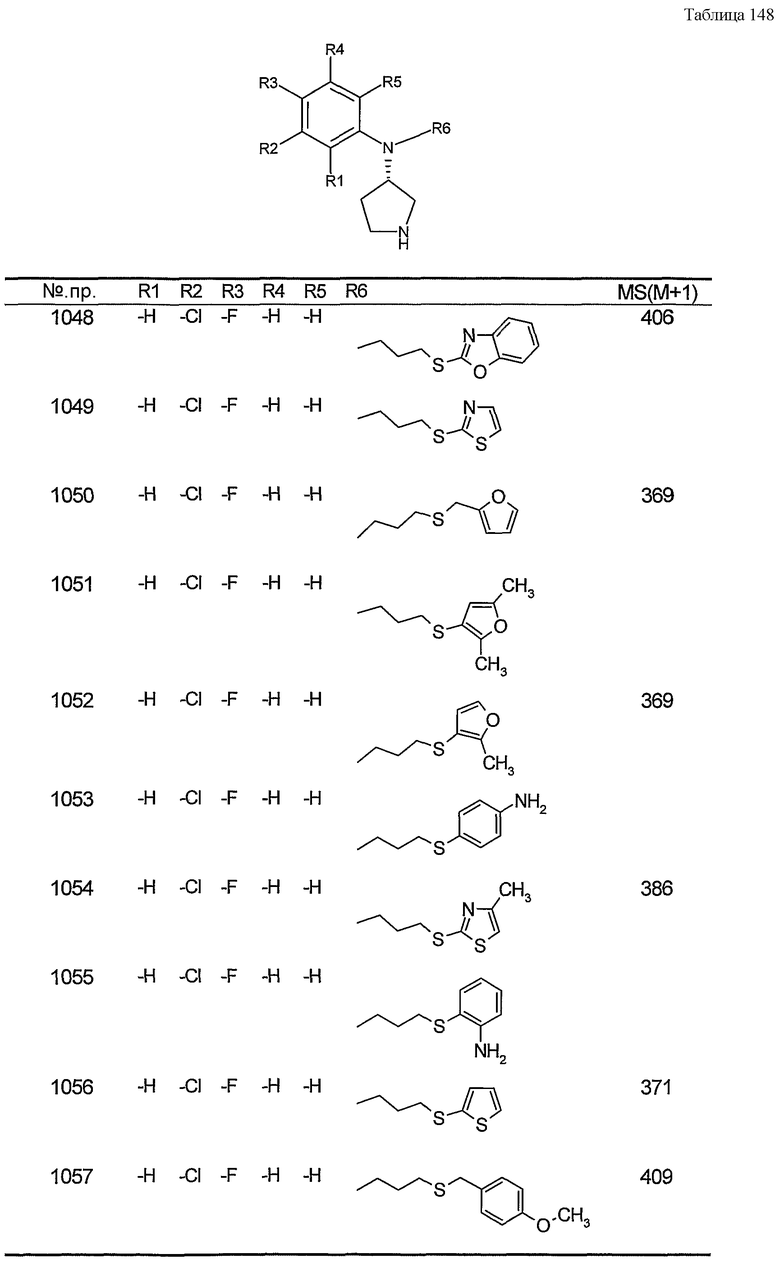
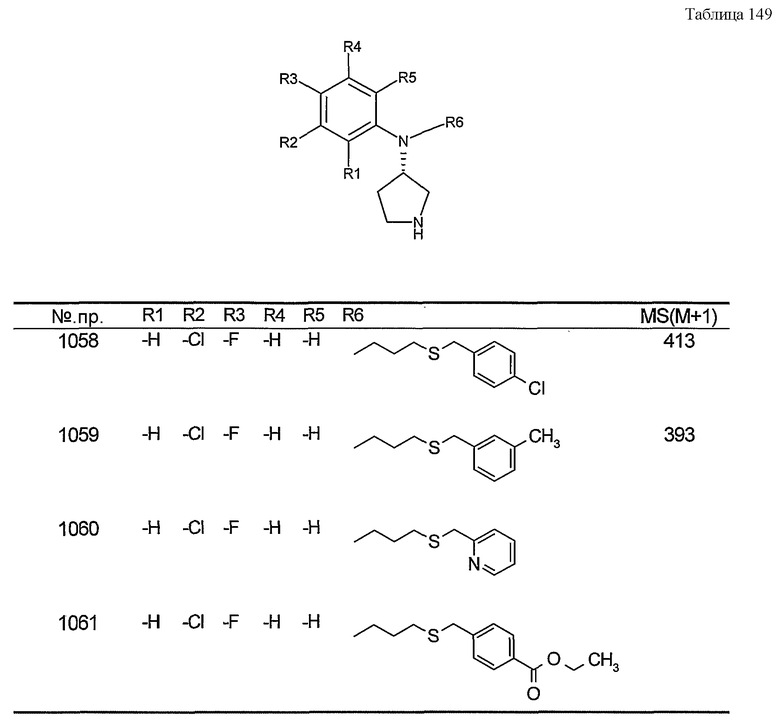
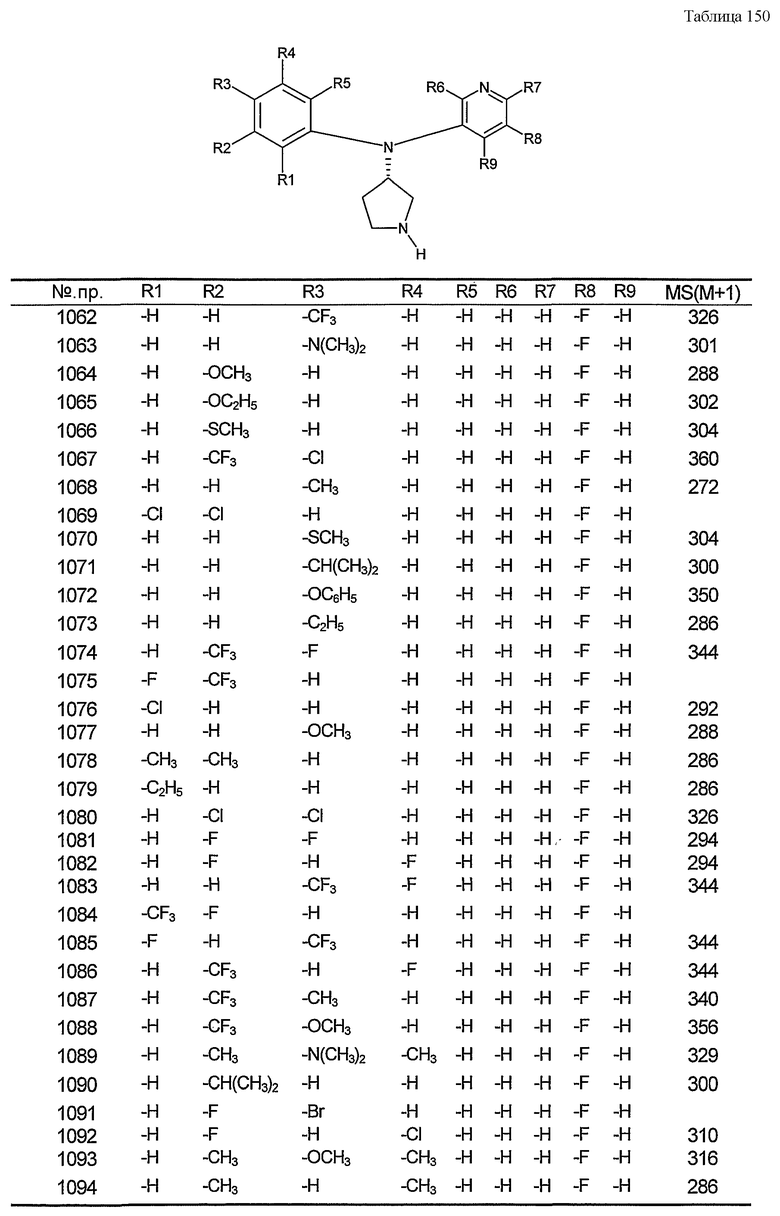
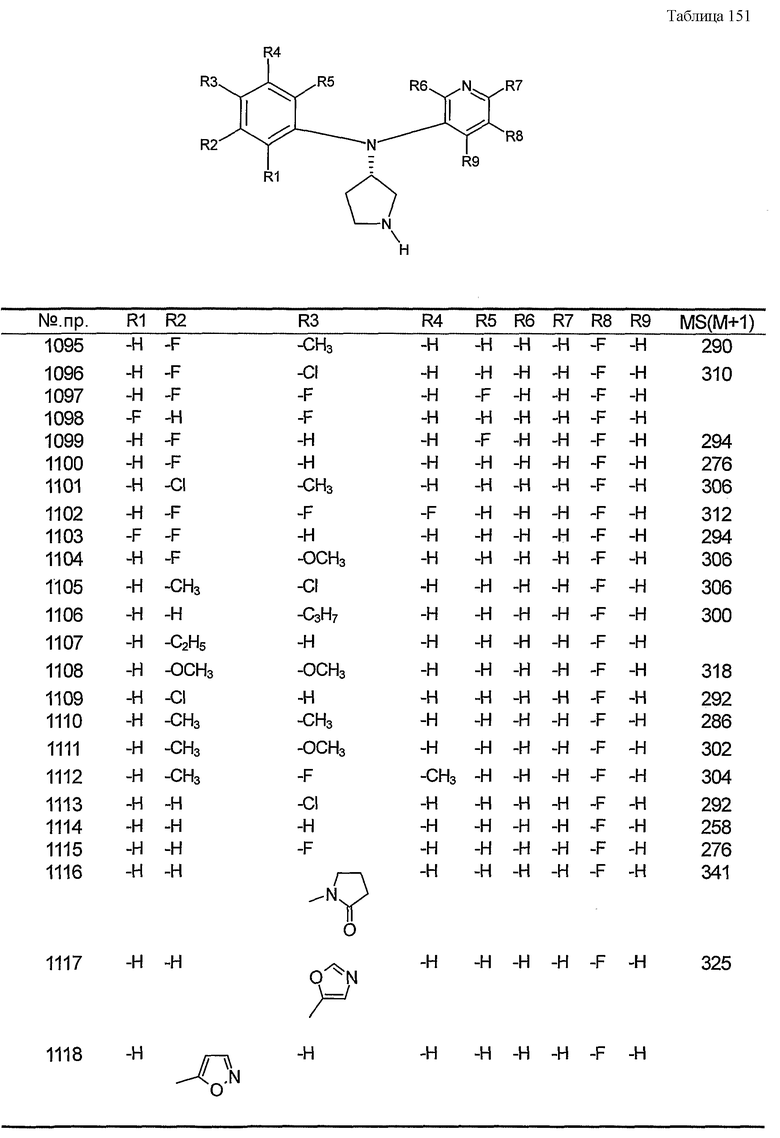
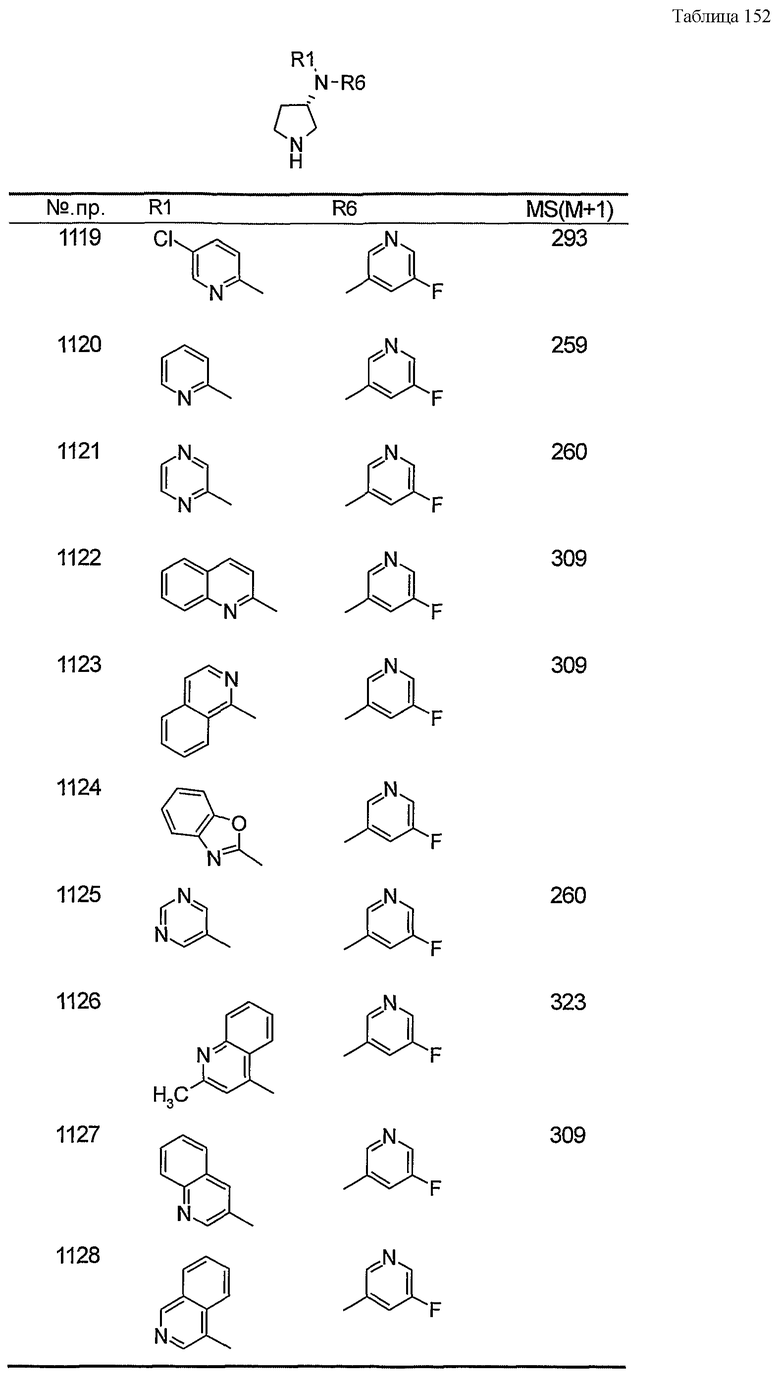
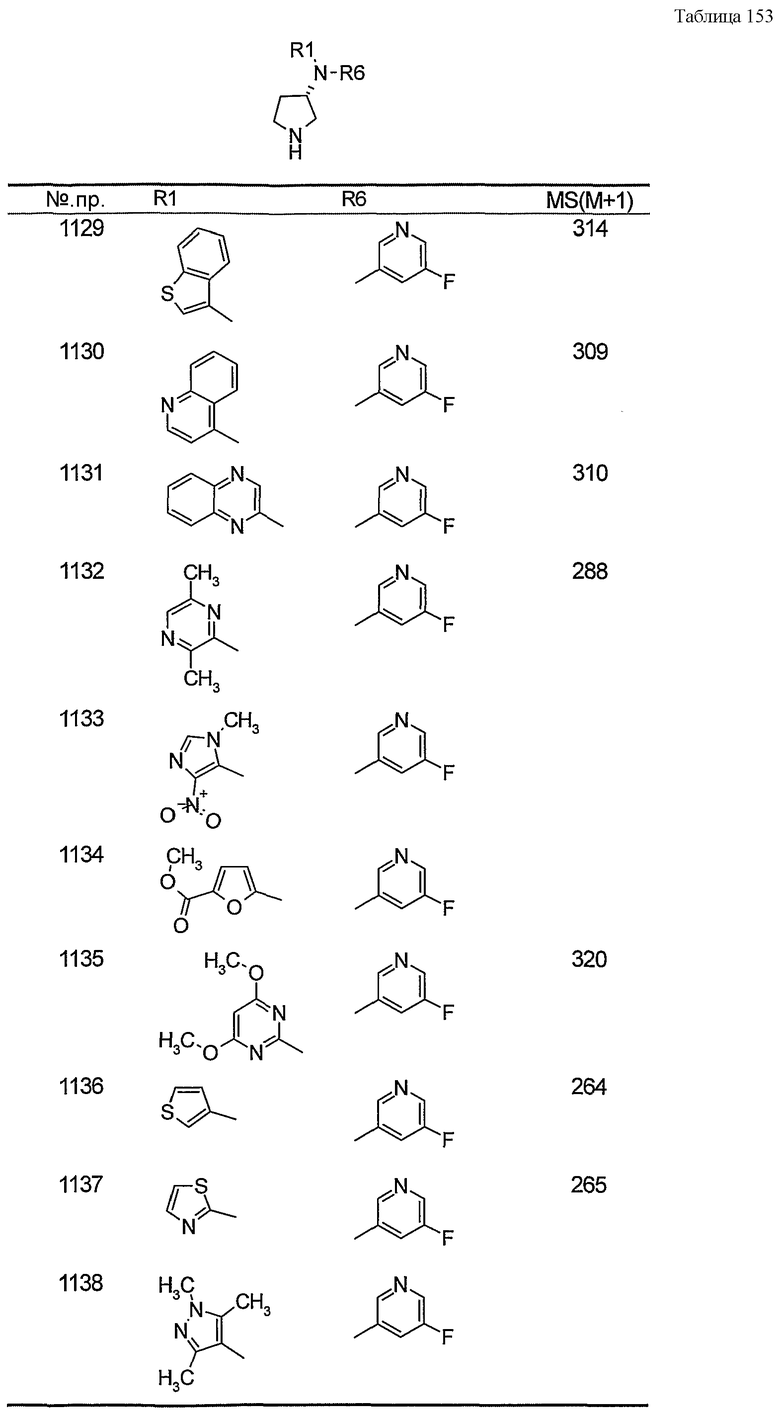
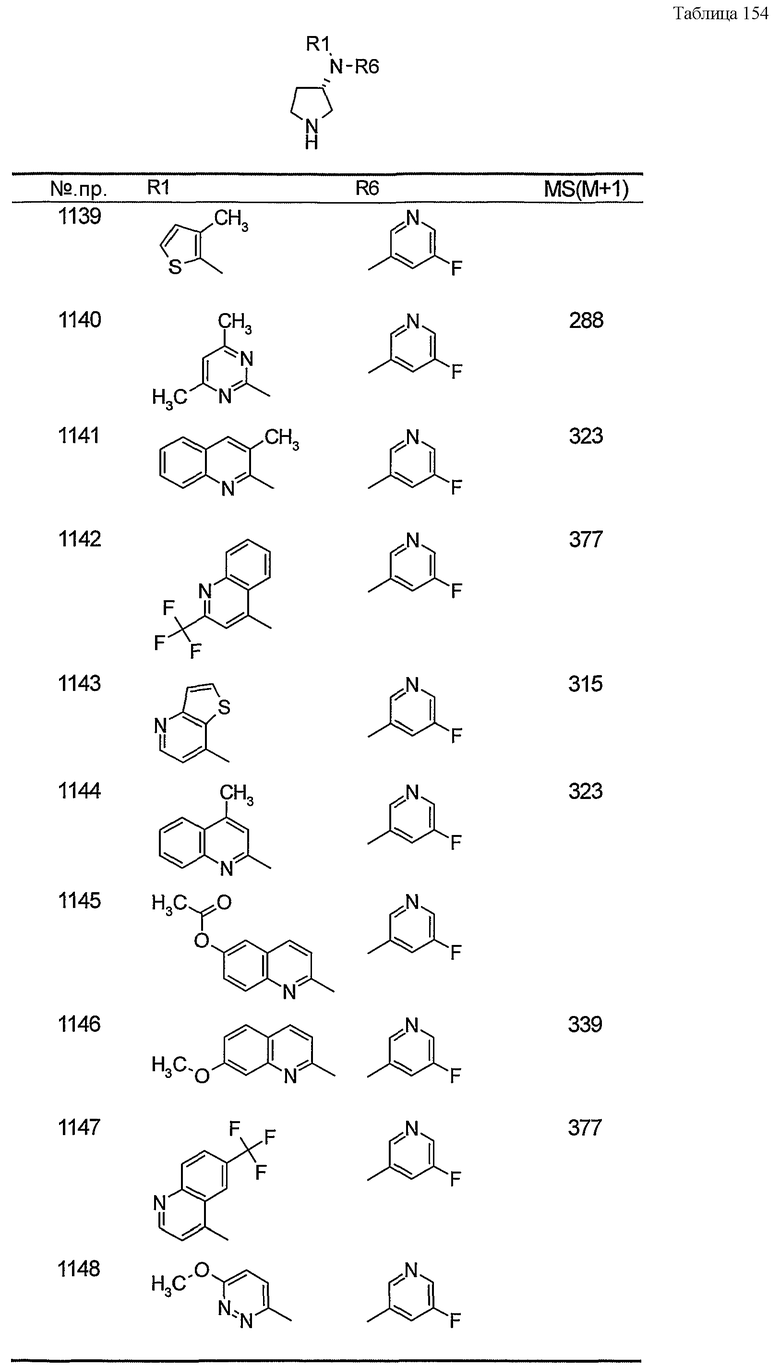
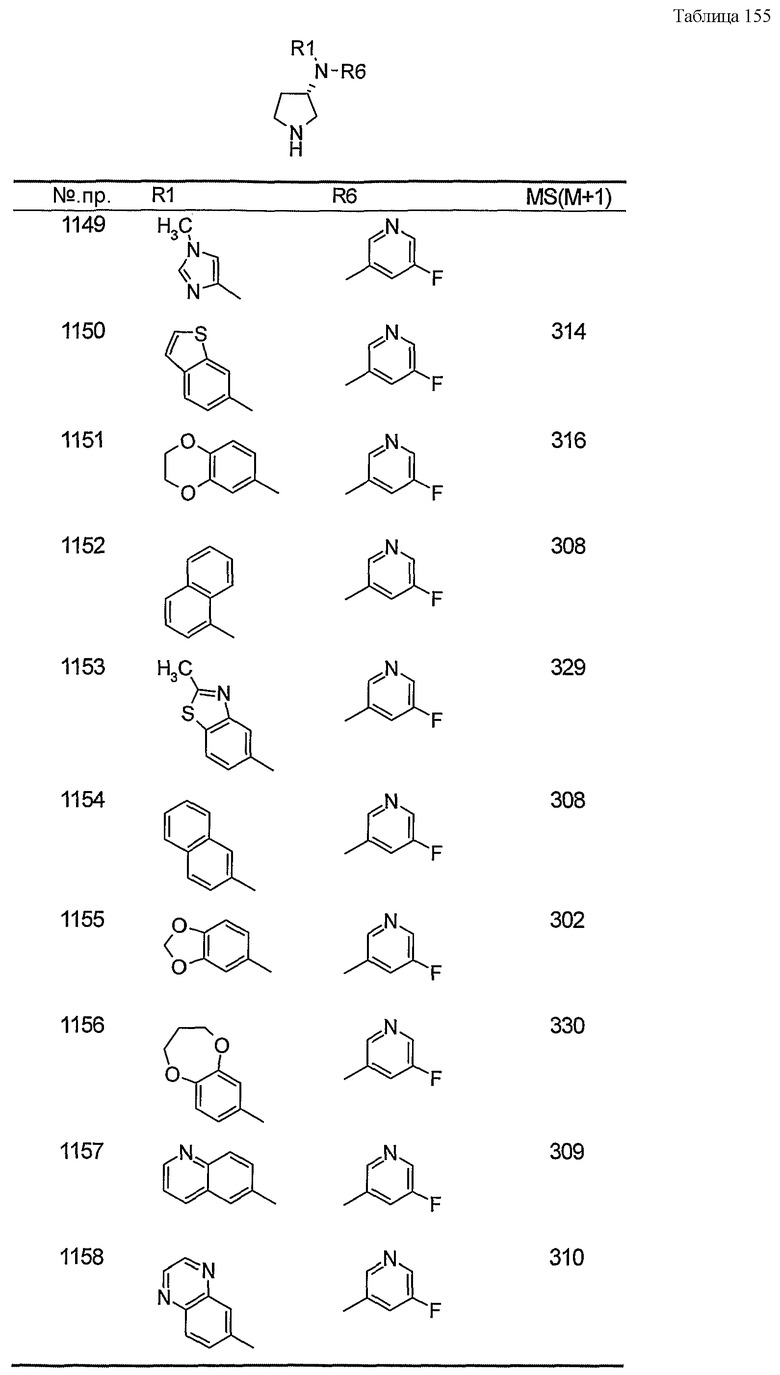

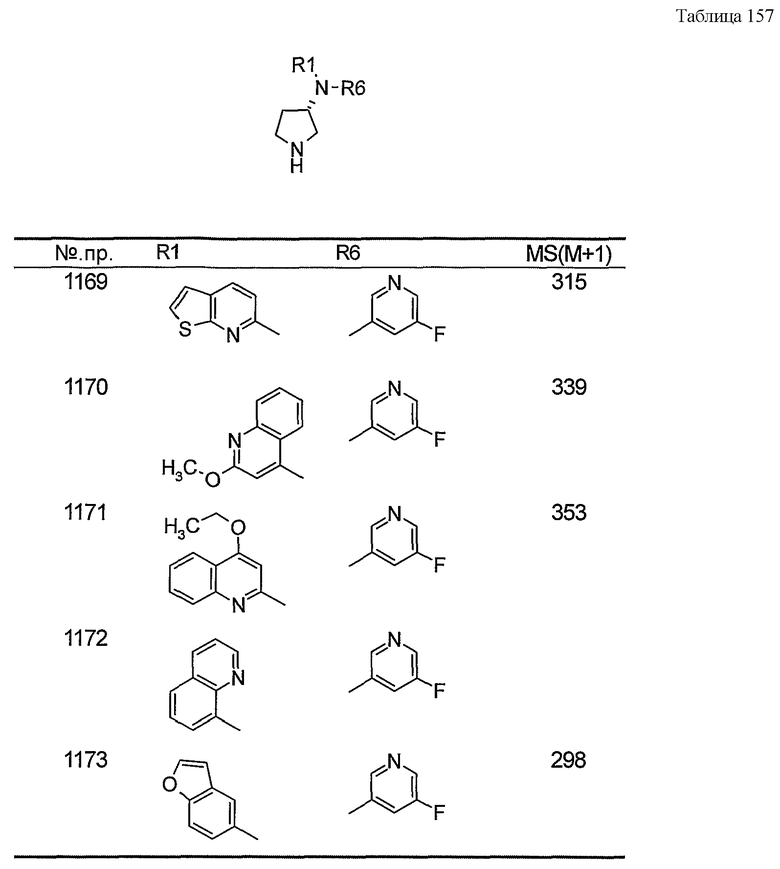
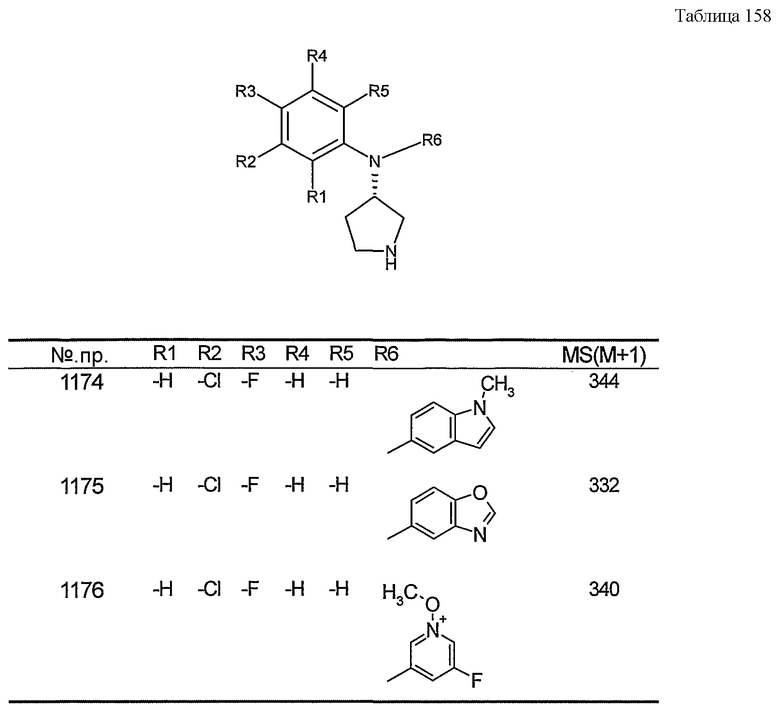
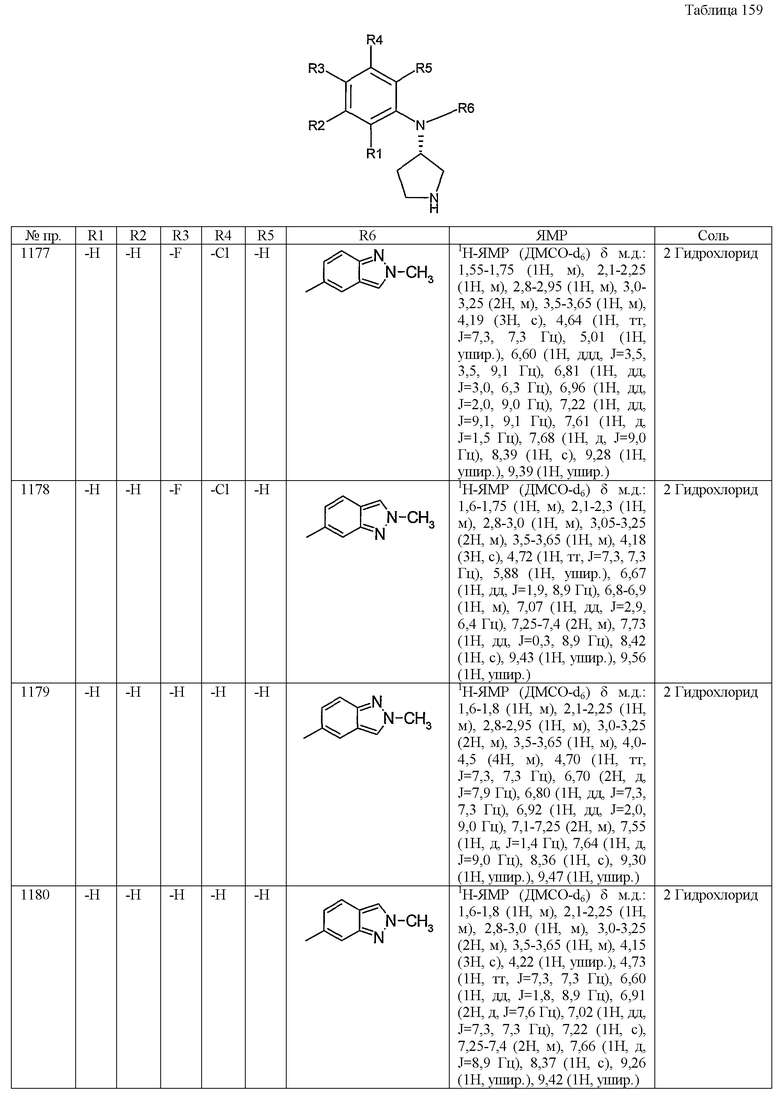
| название | год | авторы | номер документа |
|---|---|---|---|
| N,N-ЗАМЕЩЕННЫЕ 3-АМИНОПИРРОЛИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОВТОРНОГО ПОГЛОЩЕНИЯ МОНОАМИНОВ | 2006 |
|
RU2574406C2 |
| КАРБОСТИРИЛЬНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2430920C2 |
| N-ПИРИДИН-3-ИЛ ИЛИ N-ПИРАЗИН-2-ИЛ КАРБОКСАМИДЫ В КАЧЕСТВЕ АГЕНТОВ, ПОВЫШАЮЩИХ УРОВЕНЬ ХОЛЕСТЕРИНА ЛПВП | 2011 |
|
RU2540069C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ГОЛОВНОГО МОЗГА | 2018 |
|
RU2797548C2 |
| НОВОЕ ПРОИЗВОДНОЕ АМИНОПИРИДИНА С ИНГИБИТОРНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ SYK. | 2006 |
|
RU2363699C2 |
| ЗАМЕЩЕННЫЕ N-(ИНДОЛ-2-КАРБОНИЛ)-ГЛИЦИНАМИДЫ И ИХ ПРОИЗВОДНЫЕ, СПОСОБЫ ЛЕЧЕНИЯ И ФАРМКОМПОЗИЦИЯ | 1996 |
|
RU2143424C1 |
| ПРОИЗВОДНЫЕ АЗАБИЦИКЛООКТАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2007 |
|
RU2447063C2 |
| НОВЫЕ ПИРИМИДИНИМИДАЗОЛАМИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ КИНАЗЫ | 2015 |
|
RU2690679C2 |
| ФЕНОКСИЗАМЕЩЕННЫЕ ПИРИМИДИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2554870C2 |
Изобретение относится к новым производным пирролидина общей формулы (1)
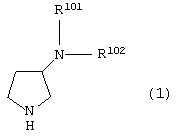
или его фармацевтически приемлемым солям, где значения R101 и R102 определены в формуле изобретения. Соединения ингибируют повторное поглощение серотонина, и/или норэпинефрина, и/или допамина, что позволяет использовать их для лечения депрессии и тревожных расстройств. Описан способ их получения. 6 н. и 4 з.п. ф-лы, 162 табл.
1. Производное пирролидина общей формулы (1)

или его фармацевтически приемлемая соль,
где R101 представляет собой (1) фенильную группу, и R102 представляет собой одну из следующих групп (1)-(86):
(1) фенильную группу,
(2) пиридильную группу,
(3) бензотиенильную группу,
(4) индолильную группу,
(5) 2,3-дигидро-1Н-инденильную группу,
(6) нафтильную группу,
(7) бензофурильную группу,
(8) хинолильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(12) бензотиазолильную группу,
(13) тиено[3,2-b]пиридильную группу,
(14) тиенильную группу,
(15) С3-8циклоалкильную группу,
(16) тетрагидропиранильную группу,
(17) пирролильную группу,
(18) 2,4-дигидро-1,3-бензодиоксинильную группу,
(19) 2,3-дигидробензофурильную группу,
(20) 9Н-флуоренильную группу,
(21) пиразолильную группу,
(22) пиридазинильную группу,
(23) индолинильную группу,
(24) тиено[2,3-b]пиридильную группу,
(25) тиено[3,2-d]пиримидинильную группу,
(26) тиено[3,2-е]пиримидинильную группу,
(27) 1H-пиразоло[3,4-b]пиридильную группу,
(28) изохинолильную группу,
(29) 2,3-дигидро-1,4-бензоксадинильную группу,
(30) хиноксалинильную группу,
(31) хиназолинильную группу,
(32) 1,2,3,4-тетрагидрохинолильную группу,
(33) С3-8циклоалкил C1-6алкильную группу,
(34) C1-6алкилтио C1-6алкильную группу,
(35) амино-замещенную C1-6алкильную группу, необязательно замещенную одной или двумя C1-6алкильными группами на аминогруппе,
(36) фенокси C1-6алкильную группу,
(37) пиридинилокси C1-6алкильную группу,
(38) С2-6алкинильную группу,
(39) фенил С2-6алкенильную группу,
(40) 1,3-бензодиоксолильную группу,
(41) 2,3-дигидро-1,4-бензодиоксинильную группу,
(42) 3,4-дигидро-1,5-бензодиоксепинильную группу,
(43) дигидропиридильную группу,
(44) 1,2-дигидрохинолильную группу,
(45) 1,2,3,4-тетрагидроизохинолильную группу,
(46) бензоксазолильную группу,
(47) бензоизотиазолильную группу,
(48) индазолильную группу,
(49) бензоимидазолильную группу,
(50) имидазолильную группу,
(51) 1,2,3,4-тетрагидронафтил C1-6алкильную группу,
(52) имидазо [1,2-a]пиридил C1-6алкильную группу,
(53) тиазолил C1-6алкильную группу,
(54) тетрагидропиранил C1-6алкильную группу,
(55) пиперидил C1-6алкильную группу,
(56) дифенил C1-6алкокси C1-6алкильную группу,
(57) C1-6алкоксикарбонил C1-6алкильную группу,
(58) фенил C1-6алкоксикарбонил C1-6алкильную группу,
(59) гидрокси C1-6алкильную группу,
(60) C1-6алкокси C1-6алкильную группу,
(61) карбокси C1-6алкильную группу,
(62) карбамоил C1-6алкильную группу, необязательно замещенную одной или двумя C1-6алкильными группами на карбамоильной группе,
(63) С2-6алкенильную группу,
(64) морфолинилкарбонил C1-6алкильную группу,
(65) бензоил C1-6алкильную группу,
(66) фенилтио C1-6алкильную группу,
(67) нафтилтио C1-6алкильную группу,
(68) С3-8циклоалкилтио C1-6алкильную группу,
(69) пиридилтио C1-6алкильную группу,
(70) пиримидинилтио C1-6алкильную группу,
(71) фурилтио C1-6алкильную группу,
(72) тиенилтио C1-6алкильную группу,
(73) 1,3,4-тиадиазолилтио C1-6алкильную группу,
(74) бензимидазолилтио C1-6алкильную группу,
(75) бензтиазолилтио C1-6алкильную группу,
(76) тетразолилтио C1-6алкильную группу,
(77) бензоксазолилтио C1-6алкильную группу,
(78) тиазолилтио C1-6алкильную группу,
(79) имидазолилтио C1-6алкильную группу,
(80) амино C1-6алкилтио C1-6алкильную группу, необязательно замещенную одной или двумя C1-6алкильными группами на аминогруппе,
(81) фенил C1-6алкилтио C1-6алкильную группу,
(82) фурил C1-6алкилтио C1-6алкильную группу,
(83) пиридил C1-6алкилтио C1-6алкильную группу,
(84) гидрокси C1-6алкилтио C1-6алкильную группу,
(85) фенокси C1-6алкилтио C1-6алкильную группу и
(86) C1-6алкоксикарбонил C1-6алкилтио C1-6алкильную группу,
и каждая из групп (1)-(32), (37), (39)-(56), (64)-(79), (81)-(83) и (85) может иметь один или несколько заместителей, выбранных из следующих групп (1-1)-(1-37), на циклоалкильном, ароматическом или гетероциклическом кольце, таких как:
(1-1) атомы галогена,
(1-2) C1-6алкилтиогруппы, необязательно замещенные одним или несколькими атомами галогена,
(1-3) C1-6алкильные группы, необязательно замещенные одним или несколькими атомами галогена,
(1-4) C1-6алкоксигруппы, необязательно замещенные одним или несколькими атомами галогена,
(1-5) нитрогруппа,
(1-6) C1-6алкоксикарбонильные группы,
(1-7) аминогруппы, необязательно замещенные одной или двумя C1-6алкильными группами,
(1-8) C1-6алкилсульфонильные группы,
(1-9) цианогруппа,
(1-10) карбоксигруппа,
(1-11) гидроксигруппа,
(1-12) тиенильные группы,
(1-13) оксазолильные группы,
(1-14) нафтильные группы,
(1-15) бензоильная группа,
(1-16) феноксигруппы, необязательно замещенные одним-тремя атомами галогена в фенильном кольце,
(1-17) фенил C1-6алкоксигруппы,
(1-18) C1-6алканоильные группы,
(1-19) фенильные группы, необязательно замещенные в фенильном кольце одним-пятью заместителями, выбранными из группы, содержащей атомы галогена, C1-6алкоксигруппы, цианогруппу, C1-6алканоильные группы и C1-6алкильные группы,
(1-20) фенил C1-6алкильные группы,
(1-21) циано C1-6алкильные группы,
(1-22) сульфонильные группы, замещенные 5-членной насыщенной гетероциклической группой с одним атомом азота в кольце,
(1-23) тиазолильные группы, необязательно замещенные одной или двумя C1-6алкильными группами в тиазольном кольце,
(1-24) имидазолильные группы,
(1-25) амино C1-6алкильные группы, необязательно замещенные одной или двумя низшими алкильными группами на аминогруппе,
(1-26) пирролидинил C1-6алкоксигруппы,
(1-27) изоксазолильные группы,
(1-28) С3-8циклоалкилкарбонильные группы,
(1-29) нафтилоксигруппы,
(1-30) пиридильные группы,
(1-31) фурильные группы,
(1-32) фенилтиогруппа,
(1-33) оксогруппа,
(1-34) карбамоильная группа,
(1-35) 5-членная насыщенная гетероциклическая группа, содержащая один атом азота, которая может дополнительно содержать второй гетероатом, выбранный из азота или кислорода, при этом гетероциклическая группа необязательно замещена одним-тремя заместителями, выбранными из группы, содержащей оксогруппу; C1-6алкильные группы; C1-6алканоильные группы; фенил C1-6алкильные группы; фенильные группы, необязательно замещенные в фенильном кольце одним-тремя заместителями, выбранными из группы, содержащей атомы галогена и C1-6алкоксигруппы; и пиридильные группы/или его фармацевтически приемлемые соли;
(1-36) оксидогруппа и
(1-37) C1-6алкоксидогруппы,
при условии, что R101 и R102 не являются одновременно незамещенным фенилом.
2. Производное пирролидина (1) или его фармацевтически приемлемая соль по п.1, где
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу
(14) тиенильную группу,
(48) индазолильную группу,
(59) гидрокси C1-6алкильную группу или
(60) C1-6алкокси C1-6алкильную группу,
и каждая из групп (1), (2), (9), (10), (11), (14) и (48) может иметь в ароматическом или гетероциклическом кольце один-три заместителя, выбранных из группы (1-1)-(1-37), как указано в п.1.
3. Производное пирролидина общей формулы (1) или его фармацевтически приемлемая соль по п.2, где
R101 представляет собой моногалогенфенильную группу, дигалогенфенильную группу или фенильную группу, замещенную одним атомом галогена и одной C1-6алкильной группой,
R102 представляет собой
(1) фенильную группу,
(2) пиридильную группу,
(9) тиазолильную группу,
(10) пиримидинильную группу,
(11) пиразинильную группу,
(14) тиенильную группу,
(48) индазолильную группу,
(59) гидрокси C1-6алкильную группу или
(60) C1-6алкокси C1-6алкильную группу,
и каждая из групп (1), (2), (9), (10), (11), (14) и (48) может иметь в ароматическом или гетероциклическом кольце один или два заместителя, выбранных из группы, содержащей (1-1) атомы галогена, (1-3) C1-6алкильные группы, необязательно замещенные одним или несколькими атомами галогена, и (1-9) цианогруппу.
4. Производное пирролидина общей формулы (1) или его фармацевтически приемлемая соль по п.3, выбранные из группы, содержащей:
(4-хлорфенил)фенил-(S)-пирролидин-3-иламин,
(4-фторфенил)фенил-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)фенил-(S)-пирролидин-3-иламин,
бис-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3,4-дифторфенил)-(4-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-ил-п-толиламин,
4-[(S)-(4-фтор-3-метилфенил)пирролидин-3-иламино]бензонитрил,
бис-(3-фторфенил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(4-фторфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)-(S)-пирролидин-3-илтиазол-2-иламин,
(3,4-дихлорфенил)пиримидин-5-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиразин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(5-хлорпиридин-2-ил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-2-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(6-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(3,4-дихлорфенил)пиридин-3-ил-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(S)-пирролидин-3-илтиофен-3-иламин,
(3-хлор-4-фторфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
(4-фтор-3-метилфенил)-(5-фторпиридин-3-ил)-(S)-пирролидин-3-иламин,
2-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]этанол,
1-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]-2-метил-пропан-2-ол,
(3-хлор-4-фторфенил)-(2-метоксиэтил)-(S)-пирролидин-3-иламин,
3-[(S)-(3-хлор-4-фторфенил)пирролидин-3-иламино]пропан-1-ол,
(3-хлор-4-фторфенил)-(3-метоксипропил)-(S)-пирролидин-3-иламин,
(3-хлор-4-фторфенил)-(1-метил-1Н-индазол-5-ил)-(S)-пирролидин-3-иламин,
бензо[b]тиофен-6-ил-(S)-пирролидин-3-илтиофен-3-иламин и
бензо[b]тиофен-5-ил-(S)-пирролидин-3-илтиофен-3-иламин.
5. Фармацевтическая композиция, ингибирующая повторное поглощение серотонина и/или норэпинефрина и/или допамина, содержащая производное пирролидина общей формулы (1) или его фармацевтически приемлемую соль по п.1 в качестве активного ингредиента и фармацевтически приемлемый носитель.
6. Ингибитор повторного поглощения серотонина и/или норэпинефрина и/или допамина, содержащий в качестве активного ингредиента производное пирролидина общей формулы (1) или его фармацевтически приемлемую соль по п.1.
7. Ингибитор повторного поглощения серотонина и/или норэпинефрина и/или допамина по п.6 для лечения депрессии и тревожных расстройств.
8. Применение производного пирролидина общей формулы (1) или его фармацевтически приемлемой соли соли в соответствии с любым из пп.1-4 в качестве ингибитора повторного поглощения серотонина и/или ингибитора повторного поглощения норэпинефрина, и/или ингибитора повторного поглощения допамина.
9. Способ лечения депрессии и тревожных расстройств за счет ингибирования повторного поглощения серотонина и/или норэпинефрина и/или допамина, включающей введение производного пирролидина общей формулы (1) или его фармацевтически приемлемой соли в соответствии с любым из пп.1-4 человеку или животному.
10. Способ получения производного пирролидина общей формулы (1):

или его фармацевтицески приемлемой соли, где R101 и R102 определены выше в п.1,
заключающийся в том, что
(1) соединение общей формулы (2)
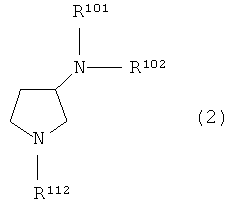
где R101 и R102 являются такими, как указано выше в п.1, и R112 представляет собой амино-защитную группу,
подвергают реакции элиминирования для удаления амино-защитной группы.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА ДЛЯ КОНВЕРСИИ СИНТЕЗ-ГАЗА ПО ФИШЕРУ-ТРОПШУ | 2005 |
|
RU2295387C1 |
| ПРОИЗВОДНЫЕ АЗЕТИДИНА И ПИРРОЛИДИНА | 1998 |
|
RU2198873C2 |
Авторы
Даты
2011-03-20—Публикация
2006-05-12—Подача