Настоящее изобретение относится к нефтехимическому органическому синтезу, а именно к способу получения ортозамещенных моно- и диизопропил-п-ксилола альтернативного сырья для производства внутримолекулярных ангидридов тримеллитовой кислоты (ТМА) и диангидрида пиромеллитовой кислоты (ПМДА). Указанные ангидриды используются в промышленных синтезах полимерных материалов, обладающих высокой термостойкостью, устойчивостью в коррозионных средах, радиационной устойчивостью и другими ценными физико-химическими характеристиками.
В настоящее время в качестве исходного сырья для получения ТМА и ПМДА используют соответственно псевдокумол и дурол, выделяемые из продуктов переработки нефти или же синтезируемые из углеводородного сырья достаточно сложными и дорогостоящими способами. Это, прежде всего, относится к технологии получения чистого дурола из ароматических концентратов переработки нефти с повышенным содержанием трудноотделяемых алкилароматических углеводородов (пренитола, изодурола, изомеров диэтил- и диэтилметилбензола и др.). Одним из источников получения концентрата дурола является ароматическая фракция С10, содержащаяся в бензине каталитического риформинга (≈1%). В конечном счете из высокоароматизированного бензина риформинга можно выделить до 0,15 вес.% дурола. В целях увеличения выхода целевого продукта изучалась возможность превращения углеводородной фракции С9-С10 в дурол методом диспропорционирования [Пат. США №2874200, опубл. 1959 г.] и изомеризацией [Пат. США №1910514, опубл. 1959 г.]. Но поскольку эти реакции являются обратимыми, то в процессе их проведения с использованием специфичных катализаторов, концентрации реагентов приближаются к термодинамическому равновесию. Это явление существенно затрудняет увеличение выхода дурола изомеризацией. Так, по экспериментальным данным удалось повысить выход дурола в два раза и довести его выход с последующим извлечением низкотемпературной кристаллизацией до 15,7% на исходное сырье (дурольный концентрат).
При осуществлении процесса изомеризации маточного раствора на алюмосиликатном катализаторе (Т=370°С) концентрация дурола в продуктах реакции может быть повышена с 2% до 13 мас.%. Но даже при применении такого комбинированного процесса выход дурола не превышает 33%. Фракция ароматических углеводородов с температурой отгонки 160-177°С, полученная из бензина каталитического риформинга, содержит, мас.%:
- этилтолуолы - 16;
- мезитилен - 24;
- псевдокумол - 48;
- гемимеллитол - 12.
При применении алюмосиликатмолибденового катализатора (1% MoO2) в условиях Т=425°С, Р=80 кг/см2, объемной скорости 1,0 час-1 и циркуляции водородсодержащего газа 1000 м3/м3 сырья достигается содержание дурола в продуктах реакции 32,0%. Ниже приведены данные, подтвержденные результатами эксперимента, (мас.%):
Как видно из приведенных данных, содержание побочных (нецелевых) продуктов, полученных вышеописанным способом из фракции, выкипающей в температурном интервале 160-177°С, достаточно большое: концентрация изодурола (мас.%) 64, парафиновых и нафтеновых углеводородов 8,0, пренитол - 4,0. Это снижает эффективность предложенного способа.
В целях решения проблемы упрощения технологии и удешевления нефтехимического сырья для получения ТМА и ПМДА взамен псевдокумола и дурола предложены способы синтеза альтернативных сырьевых источников, таких как изопропил-п-ксилол взамен псевдокумола, 2,5-диизопропил-п-ксилол и 2,4,5-триметилкумол (1-изопропил-2,4,5-триметилкумол, 1-изопропилпсевдо-кумол).
Так, согласно патенту США [№5808169, опубл. 1998 г.] предложен способ получения 1,2,4,5-диметилдиизопропилбензола алкилированием п-ксилола пропиленом с использованием катализатора на основе гетерополикислот и/или их солей. Указанный катализатор может содержать любую гетерокислоту или ее соль, например додекакремневольфрамовую кислоту (H4SiW12O40); додекафосфорновольфрамовую кислоту (H3PW12O40), додекафосфорномолибденовую кислоту (H3PMo12O40), додекагермановольфрамовую кислоту (H3GeW12O40) и додекагерманомолибденовую кислоту (H3GeMo12O40). Примерами использования гетерокислой соли являются соединения, полученные путем частичного или полного замещения атомов водорода в указанных гетерополикислотах щелочными металлами или аминами. В качестве носителя можно использовать силикагель, оксид титана, активированный уголь и т.п. Можно использовать пропитку для получения указанного катализатора на основе гетерополикислоты и/или катализатора на основе гетерополикислой соли. Количество гетерополикислоты в носителе может варьироваться от 1 до 50 вес.% относительно общего веса катализатора. Что касается условий реакции, то молекулярное соотношение пропилена и п-ксилола может составлять 1,0-5,0; температура реакции может быть от 70 до 200°С; рабочее давление может быть от нормального до 10 кг/см2. В случае использования реактора для непрерывной реакции исходные вещества могут подаваться в зону реакции со скоростью 0,1-10 час-1 (вес. ед./час).
Основной продукт реакции - диметилдиизопропилбензол. Реакционный раствор содержит непрореагировавшие исходные вещества и такие побочные продукты, как диметилизопропилбензол и диметилтриизопропилбензол. Диметилдиизопропилбензол содержит изомеры, а также 1,2,4,5-диметилдиизопропилбензол. Независимо от состава реакционного раствора целевой продукт можно кристаллизовать и очистить до требуемого качества. Но концентрация 1,2,4,5-диметилдиизопропилбензола в реакционном продукте составляет не менее 60 вес.%, что указывает на необходимость повышенных затрат при выделении и очистке продукта. Продукт реакции предлагается подвергнуть обработке для отделения катализатора и других нежелательных компонентов с последующей кристаллизацией, а также перегонке реакционного раствора перед кристаллизацией. Перегонка при температуре 150-300°С должна обеспечить отделение диметилдиизопропилбензола от других фракций.
Значительное содержание в продуктах алкилирования побочных соединений указывает на низкий выход целевого продукта и сложность схемы его выделения. Отсутствие данных по возможности (если таковая имеется) регенерации или рециркуляции достаточно сложного по составу катализатора на основе гетерополикислот или их солей не позволяет сделать однозначный вывод об эффективности предложенного катализатора и способа в целом.
Согласно патентным данным [Пат. США №2754341, 1958] при алкилировании изомеров ксилола пропиленом в присутствии BF3·H3PO4, нанесенного на силикатный катализатор, образуются как моно-, так и диизопропилбензолы, выход которых составляет соответственно 55% и 8%. Диизопропилксилолы с ксилолами в реакции алкилирования пропиленом с применением катализатора BF3·H3PO4 в температурном интервале 60-80°С подвергаются медленному переалкилированию в изопропилксилолы. При подходящих условиях проведения реакции алкилирования можно достигнуть выхода изопропилксилола 90%. Образующиеся изомеры изопропилксилола в присутствии BF3·H3PO4 практически не диспропорционируют.
Применение достаточно токсичного катализатора, сложность схемы его регенерации является одним из существенных недостатков этого способа, не нашедшего широкого развития и применения в промышленной практике.
В другом патенте США [Пат. США №3992418, 1976 г.] предложен способ получения пиромеллитового диангидрида из псевдокумола методом алкилирования пропиленом в присутствии безводного HF при температуре <150°С. Соотношение псевдокумола к пропилену равно 1:1,1-2, (предпочтительней 1:1,5). В результате алкилирования получают смесь 2,4,5-триметилкумола, 3,5- и 3,6-диизопропил-псевдокумола. Полученную смесь окисляют O2-содержащим газом при 100-500°С в присутствии катализатора V2O5, нанесенного на неорганический носитель - Al2O3. Продуктами окисления являются изомеры бензолполикарбоновых кислот. Методом декарбоксилирования побочных соединений при повышенной температуре 270-400°С и давлении ниже атмосферного удается превратить изомерную смесь в целевой продукт - пиромеллитовый диангидрид.
Указанный способ имеет преимущества в сравнении с известными процессами (через дурол) в части применения нового более доступного источника сырья - псевдокумола. В то же время применение на стадии алкилирования летучей фторводородной кислоты в качестве катализатора (агрессивный продукт), а также неизбежное образование изомерных смесей полиалкилбензольных кислот, которые частично декарбоксилируются при парофазном окислении (400-500°С) и тем самым существенно снижают эффективность этого процесса. Кроме того, наличие в реакционной среде свободной (несвязанной) фторводородной кислоты (HF) требует применения дорогостоящей аппаратуры из легированных сталей и сплавов и необходимых мер по обеспечению безопасных условий работы обслуживающего персонала.
Известен способ получения 1,3-диметил-3-изопропилбензола и тетраалкилбензолов методом алкилирования смеси изомеров ксилола пропиленом в присутствии AlCl3 при пониженной температуре процесса алкилирования 45-55°С [Пат. США №3636184, 1972 г.].
Предложенный способ включает:
(а) контактирование смеси ксилолов и диметилдиизопропилбензола в присутствии хлорида алюминия в течение 7-12 часов при температуре 45-55°С при молекулярном соотношении ксилола и диметилдиизопропилбензола от 65:35 до 75:25 и смеси ксилолов, состоящей, по меньшей мере, из 60 вес.% мета-ксилола, 0-2 вес.% орто-ксилола и баланса пара-ксилола;
(б) добавление пропилена в смесь (а) при молярном соотношении пропилена, ксилола и диметилдиизопропилбензола, первоначально добавленного на стадию (а) на уровне 0,85:1,0-1,05:1,0 при сохранении температуры в пределах 45-55°С в течение 50-80 минут;
в) выделение диметилизопропилбензола и диметилдиизопропилбензола из реакционной смеси. На стадии (в) диметилизопропилбензол содержит, по крайней мере, 97 вес.% 1,3-диметил, 5-изопропилбензола.
Смесь ксилолов состоит в основном из 68 вес.% мета-ксилола и 32 вес.% пара-ксилола. Часть диметилдиизопропилбензола, выделенного на стадии (в), используют как реагент на стадии (а). На стадии (в) диметилдиизопропилбензол содержит, по крайней мере, 80 вес.% 1,2,4,5-тетраалкилбензола;
Конечный продукт реакции содержит 1,5÷0,4 моль диметилдиизопропилбензола на моль диметилизопропилбензола.
Наиболее близким по технической сущности является способ одновременного (совместного) получения изомеров моно- и диизопропилксилолов алкилированием ксилольной фракции в присутствии катализатора Фриделя-Крафта [Пат. Великобритании №1286295, 1972 г.].
Предложенный способ основан на алкилировании пропиленом ксилольной фракции, обогащенной до 68% м-ксилолом, в присутствии AlCl3 с получением изомерной смеси моно- и диизопропилксилолов. Этот способ позволяет регулировать соотношение изомеров в смеси моно- и диизопропилксилолов проведением дополнительных операций предварительного разделения продуктов алкилирования на фракцию с повышенным содержанием изомеров диизопропилксилолов (фракция-2) и фракцию с повышенным содержанием изомеров моноизопропилксилолов (фракция-1).
Фракцию 2 переалкилируют с ксилолом в присутствии катализатора Фриделя-Крафта в течение 7-12 часов при температуре 45-55°С с последующей обработкой полученной смеси пропиленом в течение 50-80 минут при температуре 45-85°С. Как альтернативный вариант фракцию-2 смешивают с ксилолом в молярном соотношении 40:60-60:40 в присутствии AlCl3 при температуре 70-80°С в течение 3 часов, после чего полученную смесь обрабатывают дополнительно пропиленом при 45-60°С до достижения молярного соотношения моноизопропилксилолов к диизопропилксилолам 45:55-35:65.
Основным недостатком предложенного способа является то, что применение ксилольной фракции усложняет изомерную смесь продуктов алкилирования, разделение которой на необходимые алкилбензолы для синтеза тримеллитового ангидрида (необходим только 2-изопропил-п-ксилол) или пиромеллитового диангидрида (необходим только 2,5-диизопропил-п-ксилол) достаточно сложен и требует значительных затрат.
Выделить из указанной сложной изомерной смеси чистые 2-изопропил и 2,5-диизопропилксилолы - альтернативные сырьевые источники - проблематично, так как температуры кипения ряда изомерных компонентов весьма близки, поэтому способ усложняют дополнительными стадиями переалкилирования, изомеризации, трансалкилирования и ректификации многокомпонентных смесей, образующихся в реакции алкилирования ксилольных фракций.
Целью предлагаемого способа является упрощение процесса получения моно-изопропил-п-ксилола и 2,5-диизопропил-п-ксилола и повышения выхода целевых продуктов.
Указанная цель достигается тем, что алкилированию подвергают п-ксилол при температуре 70-90°С и на первой ступени алкилирование проводят в присутствии катализатора AlCl3 до достижения конверсии исходного углеводорода в пределах 40-90% и накопления в алкилате индивидуального моно-изопропил-п-ксилола 30-50%, далее 5-моно-изопропил-п-ксилол подвергают алкилированию на 2-й ступени в присутствии AlCl2·H3PO4 таким образом, что после достижения в алкилате суммарного содержания изомеров 2,5-, 2,3-, 2,6-диизопропил-п-ксилола 30-50% прекращают подачу пропилена и выдерживают полученный алкилат при температуре 70-90°С в течении 2-6 часов до достижения концентрации 2,5-диизопропил-п-ксилола не менее 95% с последующим выделением целевого продукта известными приемами.
Чертеж: Схема пилотной установки алкилирования п-ксилола пропиленом.
Таблица 1: Условия и результаты алкилирования п-ксилола (п-КС) и моно-изопропил-п-ксилола (моно-ИП-п-КС) в присутствии разных катализаторов на I и II ступенях.
В состав пилотной установки непрерывного действия, изготовленной из титана, входит сборник исходной реакционной смеси (Ct, п-ксилол) 1, дозирующий насос 2, капсула для ввода реагентов (катализатора) 3, реактор алкилирования 4, снабженный турбинной мешалкой, конденсатор 5, декантатор (флорентийский сосуд) 6, сборник алкилата 7, баллон с пропиленом 8, гидрозатвор 9, пробоотборник 10.
Принцип работы установки в непрерывном режиме. Исходная реакционная смесь дозирующим насосом 2 непрерывно дозируется в реактор алкилирования 4, в который из баллона 8 в необходимом количестве вводится пропилен. Быстрое смешение вводимых реагентов (2-6 сек) в реакционной зоне реактора достигается перемешиванием турбинной мешалкой с переменным числом оборотов. Температурный режим (40-100°С) выдерживают регулятором температуры.
Алкилат после заданного времени пребывания в реакторе перетекает в декантатор 6. Осажденный комплексный катализатор перетекает из нижней части декантатора обратно в реактор 4, а осветленный алкилат перетекает в сборник алкилата 7. Уносимые с инертным газом легкие продукты, образующиеся в ходе процесса алкилирования, после охлаждения в конденсаторе 5 промываются в гидрозатворе 9. В ходе реакции алкилат для проведения анализов отбирался из реактора через пробоотборник 10.
Ниже приводятся примеры по алкилированию п-ксилола на пилотной установке.
Пример 1.
В реактор алкилирования, снабженный мешалкой, патрубками ввода пропилена и отвода инертных газов, загружают:
AlCl3 - 5 г (0,038 моль),
п-ксилол - 160 г (0,186 мл; 1,51 моль)
и при включенной мешалке путем изменения числа оборотов достигают время смешения (гомогенизации) смеси реагентов 5 сек.
В условиях перемешивания содержимое реактора нагревают до 70°С при протоке инертного газа (азота). После достижения указанной температуры прекращают подачу инертного газа и в нижнюю зону реактора подают пропилен с одновременным подъемом температуры реакционной массы в зоне реакции до 78°С.
Процесс алкилирования проводят в течение 30 минут до достижения суммарного расхода пропилена 46,5 г (24,8 нл) при объемной скорости его подачи 1,55 г/мин (0,83 нл/мин).
Выгружено 211,5 г алкилата.
После отделения из него (декантированием) катализаторного раствора, нейтрализации и промывки водой получено 206,5 г осветленного алкилата следующего состава, %:
Выход моноизопропил-п-ксилола на прореагировавший п-ксилол составил 74,3%, изомеров диизопропил-п-ксилола - 25,2%.
Из полученного осветленного алкилата методом ректификации отделяют:
1) п-ксилол, идущий в качестве рециклового потока на стадию алкилирования;
2) 99%-ный моно-изопропилбензол - альтернативное исходное сырье для получения тримеллитовой кислоты (ТМК) и ее внутримолекулярного ангидрида (ТМА), а также частично для алкилирования и переалкилирования на второй ступени до 2,5-диизопропил-п-ксилола - исходного альтернативного сырья для получения пиромеллитовой кислоты (ПМК) и ее внутримолекулярного диангидрида (ПМДА);
3) фракцию изомеров диизопропил-п-ксилола, которую использовали частично для приготовления катализатора на 1-й ступени алкилирования п-ксилола и как компонент для второй ступени алкилирования моно-изопропил-п-ксилола и переалкилирования;
4) высококипящая фракция в виде кубового остатка отгонки (выделения) изомеров диизопропил-п-ксилола является органическим отходом и представляет собой изомерную смесь продуктов глубокого алкилирования (в основном три-изопропил-п-ксилол).
Условия и результаты примера 1 и последующих примеров приведены в таблице 1.
Пример 2 (сравнительный).
Опыт проводят в условиях примера 1 с той лишь разницей, что концентрацию AlCl3 увеличили в 2 раза, объемный расход пропилена повысили с 1,55 г/мин на 165 г реакционной массы до 3,15 г/мин на 170 г реакционной массы (с 3,14 нл/мин на л реакционной массы до 5,1 нл/мин на л реакционной массы).
После завершения реакции из алкилатора выгружено 264,5 г реакционной массы, из которой после отделения катализатора, нейтрализации и промывки водой получено 254,5 г алкилата следующего состава:
Выход моноизопропил-п-ксилола на прореагировавший п-ксилол составил 42,8%, а выход изомеров диизопропил-п-ксилола на прореагировавший п-ксилол за вычетом его расхода на образование моноизопропил-п-ксилола достиг 47,4%.
Из полученного результата следует, что повышенная в 2 раза концентрация AlCl3 и увеличение удельной объемной скорости подачи пропилена приводит к возрастанию конверсии (степени превращения) п-ксилола в моно-ди- и три-изопропил-п-ксилола в 3 раза. При этом содержание в алкилате моноизопропил-п-ксилола снизилось с 43,5% до 31,8% (на 11,7%), изомеров диизопропил-п-ксилола повысилось с 18,9% до 45,1% (т.е. возросло 2,4 раза), а концентрация продуктов глубокого алкилирования (в основном три-изопропил-п-ксидола и примесей) увеличилась с 0,4% до 11,3%, т.е. возросла более чем в 28 раз.
Пример 3.
Опыт проводят в условиях примера 1 с той лишь разницей, что концентрацию AlCl3 снижают в 2,5 раза (на 160 г п-ксилола загружено 2 г AlCl3 вместо 5 г), а время алкилирования увеличили с 30 мин до 60 мин, т.е. в два раза. Расход пропилена за время реакции выдержан в соизмеримом количестве с опытом 1 при удельной объемной скорости и его подаче 0,66 г/мин на 162 г реакционной смеси (или 1,4 нл/мин на л реакционной смеси).
После завершения реакции выгружено из алкилатора 201,6 г реакционной массы, из которой после отделения катализатора, нейтрализации и промывки выделено 199,6 г алкилата следующего состава, %:
Полученные результаты показывают, что в условиях пониженной в 2,5 раза концентрации катализатора скорость реакции, оцениваемая общим временем алкилирования, снижается в 2-2,3 раза. Некоторое снижение степени конверсии (превращения) п-ксилола в продукты пропиленирования, оцениваемой возрастанием остаточного его содержания в алкилате с 37,1% до 43,1%, приводит к изменению выходов моно- и диизопропил-п-ксилола на прореагировавший п-ксилол в сравнении с примером 1:
по моноизопропил-п-ксилолу с 74,3% до 79,6%
по диизопропил-п-ксилолу с 25,2% до 20,1%.
Однако содержание в алкилате изомерной смеси продуктов глубокого алкилирования (примесей) при прочих равных или сопоставимых условиях снижается в 2 раза, что указывает на протекание процесса с повышенной селективностью.
Пример 4 (сравнительный).
Опыт проводят в условиях примера 1 с той лишь разницей, что температуру реакции алкилирования повышают с 78°С до 105°С при увеличении продолжительности процесса с 30 минут до 60 минут.
Объемную скорость подачи пропилена устанавливают таким образом, чтобы она была соизмерима или ниже объемной скорости пропилена в опыте 1 в целях избежания резкого увеличения мольного соотношения пропилен: п-ксилол при увеличении в два раза продолжительности алкилирования.
Выгружено из алкилатора 290,7 г реакционной массы, из которой после вышеописанной обработки получено 285,7 г алкилата следующего состава, %:
Выход моноизопропил-п-ксилола на прореагировавший п-ксилол составил 28,2%.
Выход изомеров диизопропил-п-ксилола на прореагировавший п-ксилол за вычетом его расхода на образование моноизопропил-п-ксилола достиг 46,3%.
Содержание изомерной смеси продуктов глубокого алкилирования и примесей возросло с 0,4% до 30%, т.е. увеличилось более чем в 75 раз.
Пример 5.
Опыт проводят в условиях примера 1 с той лишь разницей, что температуру процесса алкилирования понизили с 78°С до 50°С, а продолжительность реакции увеличили с 30 минут до 60 минут.
Объемную скорость подачи пропилена выдерживали на уровне 0,368 г/мин или 0,2 нл/мин, что соответствовало удельному его расходу 0,855 нл/мин на л реакционной смеси.
Из реактора выгружено 187,1 г реакционной массы, из которой после соответствующей обработки получено 182,1 г алкилата следующего состава, %:
Выход моноизопропил-п-ксилола на прореагировавший п-ксилол составил 92,4%.
Выход изомеров диизопропил-п-ксилола на прореагировавший п-ксилол за вычетом его расхода на образование моноизопропил-п-ксилола достиг 7,6%.
Продукты глубокого алкилирования в алкилате не обнаружены.
Приведенные в опыте 5 данные показывают, что при малом расходе пропилена и пониженной до 50°С температуре при прочих равных условиях реакция протекает с пониженной конверсией п-ксилола (до 37%) с образованием практически только моно-изопропил-п-ксилола. Содержание в алкилате изомеров диизопропил-п-ксилола на порядок ниже, чем моноизопропил-п-ксилола. Условия примера 5 приемлемы в том случае, когда необходимо получать только один целевой продукт моноизопропил-п-ксилол - альтернативное сырье для синтеза тримеллитовой кислоты и тримеллитового ангидрида.
В то же время следует учитывать, что пониженная конверсия (превращение) п-ксилола приводит к повышению его рецикла и возрастанию энергетических затрат для его осуществления.
Пример 6.
Опыт по алкилированию второй ступени проводят в условиях примера 1 с той лишь разницей, что в качестве исходного (алкилируемого) углеводорода используют моно-изопропил-п-ксилол, полученный и выделенный из осветленного алкилата-1 на первой ступени. Для осуществления процесса 2-й ступени алкилирования используют комплексное соединение AlCl2·Н2РО4. Остальные условия соответствуют условиям примера 1.
После завершения реакции алкилирования выгружено 203 г реакционной массы, из которой после соответствующей ранее описанной обработки выделено 198 г алкилата следующего состава, %:
Методом ректификации под вакуумом из полученного алкилата-2 отделили сначала моноизопропил-п-ксилол, а затем изомерную фракцию диизопропил-п-ксилола (содержащую преимущественно 2,5-диизопропил-п-ксилол), которую смешали с тем же катализатором AlCl2·H2PO4 и выдерживали в условиях перемешивания при температуре 78-82°С в течение 6 часов.
После отделения катализаторной массы, нейтрализации и промывки водой получен осветленный концентрат алкилата состава, %:
По качественным показателям указанный концентрат 2,5-диизопропил-п-ксилол возможно использовать как альтернативное сырье для получения пиромеллитовой кислоты и внутримолекулярного диангидрида на ее основе.
Пример 7 (сравнительный).
Опыт проводят в условиях примера 6 с той лишь разницей, что время алкилирования увеличивают с 30 минут до 50 минут, а время выдержки снижают с 6 часов до 2-х часов.
После завершения реакции на 2-й ступени алкилирования из реактора выгружено 214,2 г реакционной массы, из которой путем соответствующей обработки, изложенной в примере 6, получен алкилат-2 следующего состава, %:
Из полученного алкилата-2 методом ректификации отогнан не прореагировавший моноизопропил-п-ксилол, а затем отобрана фракция изомерной смеси диизопропил-п-ксилола с преимущественным содержанием 2,5-диизопропил-п-ксилола.
Выделенную фракцию смешивают с катализаторным комплексом AlCl2·H3PO4 и выдерживают при температуре 80°С в течение 6 часов, после чего отделяют катализаторную массу, нейтрализуют и промывают водой.
Получен концентрат 2,5-диизоизопропил-п-ксилола следующего состава, %:
Качество полученного продукта не удовлетворяет требованиям, необходимым для синтеза из него пиромеллитовой кислоты и ее внутримолекулярного диангидрида.
тор
ак., мин
лена на опыт, г
ржки, час
ры)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВНУТРИМОЛЕКУЛЯРНЫХ АНГИДРИДОВ БЕНЗОЛПОЛИКАРБОНОВЫХ КИСЛОТ | 2009 |
|
RU2412178C1 |
| СПОСОБ СЕЛЕКТИВНОГО ПОЛУЧЕНИЯ МЕТА-ДИАЛКИЛБЕНЗОЛОВ | 2011 |
|
RU2459796C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОЙ ИЗОФТАЛЕВОЙ КИСЛОТЫ И СОПУТСТВУЮЩИХ ПРОДУКТОВ ИЗ ИЗОМЕРОВ ЦИМОЛА И ДИИЗОПРОПИЛБЕНЗОЛА | 2009 |
|
RU2415836C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОЙ ИЗОФТАЛЕВОЙ КИСЛОТЫ И СОПУТСТВУЮЩИХ ПРОДУКТОВ ИЗ КСИЛОЛЬНЫХ ФРАКЦИЙ | 2009 |
|
RU2430911C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ ПИРОМЕЛЛИТОВОГО ДИАНГИДРИДА | 2004 |
|
RU2314301C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛАРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 1971 |
|
SU310898A1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,4-ДИМЕТИЛ-2,5- ДИИЗОПРОПИЛБЕНЗОЛА | 1967 |
|
SU195436A1 |
| Способ получения изопропилбензола алкилированием бензола пропиленом | 2021 |
|
RU2770585C1 |
| СПОСОБ АЛКИЛИРОВАНИЯ АРОМАТИЧЕСКОГО СОЕДИНЕНИЯ | 1991 |
|
RU2014316C1 |
| Способ получения цимола | 1987 |
|
SU1479449A1 |
Изобретение относится к способу получения 2-изопропил-п-ксилола и 2,5-диизопропил-п-ксилола путем алкилирования п-ксилола пропиленом в жидкой фазе, характеризующемуся тем, что алкилированию подвергают п-ксилол при температуре 70-90°С и на первой ступени алкилирование проводят в присутствии катализатора AlCl3 до достижения конверсии исходного углеводорода в присутствии катализаторов AlCl3 до достижения конверсии исходного углеводорода в пределах 40-90% и накопления в алкилате индивидуального моно-изопропил-п-ксилола 30-50%, далее 5-моно-изопропил-п-ксилол подвергают алкилированию на 2-й ступени в присутствии AlCl2·H2PO4 таким образом, что после достижения в алкилате суммарного содержания изомеров 2,5-, 2,3-, 2,6-ди-изопропил-п-ксилола 30-50% прекращают подачу пропилена и выдерживают полученный алкилат при температуре 70-90°С в течение 2-6 часов до достижения концентрации 2,5-ди-изопропил-п-ксилола не менее 95% с последующим выделением целевого продукта известными приемами. Таким образом, заявленное техническое решение позволяет упростить получение моноизопропил-п-ксилола и 2,5-диизопропил-п-ксилола и повысить выход целевых продуктов. 1 табл., 1 ил.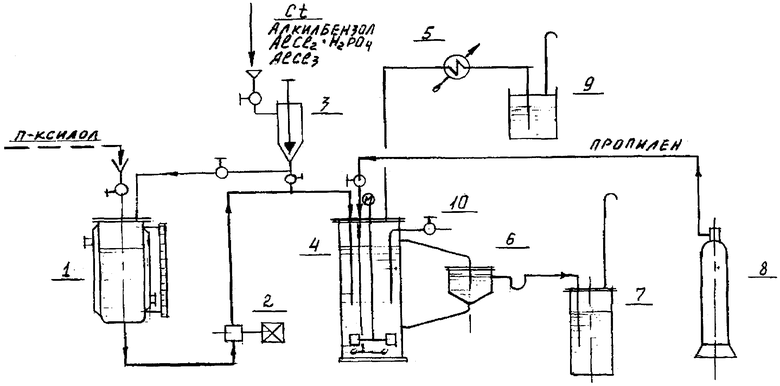
Способ получения 2-изопропил-п-ксилола и 2,5-диизопропил-п-ксилола путем алкилирования п-ксилола пропиленом в жидкой фазе, причем алкилированию подвергают п-ксилол при температуре 70-90°С, и на первой ступени алкилирование проводят в присутствии катализатора AlCl3 до достижения конверсии исходного углеводорода в присутствии катализаторов AlCl3 до достижения конверсии исходного углеводорода в пределах 40-90% и накопления в алкилате индивидуального моно- изопропил-п-ксилола 30-50%, далее 5-моно-изопропил-п-ксилол подвергают алкилированию на 2-й ступени в присутствии AlCl2·H2PO4 таким образом, что после достижения в алкилате суммарного содержания изомеров 2,5-, 2,3-, 2,6-ди-изопропил-п-ксилола 30-50% прекращают подачу пропилена и выдерживают полученный алкилат при температуре 70-90°С в течение 2-6 ч до достижения концентрации 2,5-ди-изопропил-п-ксилола не менее 95% с последующим выделением целевого продукта известными приемами.
| Способ получения алкилароматических соединений | 1980 |
|
SU958404A1 |
| Способ получения низших алкилбензолов | 1978 |
|
SU789464A1 |
| DE 1812782 A1, 18.06.1970 | |||
| Машина для шлихтования текстильных нитей | 1984 |
|
SU1175989A1 |
| GB 1094223 A, 06.12.1967. | |||
Авторы
Даты
2011-03-27—Публикация
2009-09-25—Подача