Группа изобретений относится к фармакологии и медицине и касается способа получения из животного сырья средства, представляющего собой пептидный комплекс, обладающий тканеспецифической активностью, которое может найти применение в медицинской практике в качестве средства для поддержания функций органов, в отношении которых он проявляет специфическую активность.
Известен способ получения из животного сырья обладающего тканеспецифическим действием нуклеопротеинового комплекса [патент РФ №2075944, 1996] с молекулярной массой входящих в него нуклеопротеиновых компонентов от 10000 до 90000 Да. Способ, описанный в патенте РФ №2075944, предусматривает экстракцию предварительно подготовленного (измельченного и замороженного) животного сырья с использованием в качестве экстрагента 1-2,5% раствора углекислого натрия (соды) при pH 10,4-10,8 в течение 2-4 ч с добавлением 0,1-0,5% хлористого магния при соотношении объемов экстрагируемой ткани и раствора соды в диапазоне 1:8-1:20, отделение осадка фильтрацией, подкисление экстракта до pH 3,8-5,5, удаление балластных веществ, промывание осадка органическими растворителями, высушивание осадка при температуре не выше 55°С. Целевой продукт, получаемый известным способом, содержит нуклеопротеиновые комплексы, обладающие специфичностью действия и тропностью по отношению к органам и тканям, являющимся источником их получения.
Известный способ имеет ряд недостатков, среди которых необходимо отметить то, что порошок нуклепротеинового комплекса, полученный этим способом из органов и тканей, относится к группе малорастворимых веществ, что требует определенных технологических приемов для применения в медицинской практике. Кроме того, целевой продукт, полученный известным способом, состоит из двух групп молекулярных ассоциатов: достаточно большого количества высокомолекулярных компонентов, среди которых присутствуют белки класса амилоидов, в состав которых входят прионы (мол. мас. от 27000 до 31000 Да), а также нуклеинового компонента, наличие которого несет в себе опасность присутствия в целевом продукте протоонкогенов.
Наиболее близким техническим решением является способ получения средства для поддерживающей терапии, обладающего тканеспецифической активностью, и средство, полученное данным способом (варианты) [патент ЕА №010720, 2008], который характеризуется тем, что органы телят не старше 12-месячного возраста или свиней измельчают, добавляют 3%-ный раствор уксусной кислоты при 20±5°С, экстракцию проводят при постоянном помешивании, через 30 минут добавляют 1%-ный раствор хлористого цинка, охлаждают при постоянном помешивании до 7-16°С, затем перемешивают по 1 ч через каждые 4 ч отстаивания в течение 48 ч, экстракт отделяют от балластных веществ сепарированием, к экстракту добавляют ацетон в объемном соотношении 1:5, выдерживают при 3-5°С в течение 4 ч, образовавшийся осадок промывают двукратным объемом охлажденного до 7-16°С ацетона, промытый осадок протирают через металлическое сито, полученный целевой продукт, представляющий собой пептидный комплекс с содержанием низкомолекулярной пептидной фракции от 70 до 90%, высушивают при 18±2°С.
При этом в качестве целевого продукта, полученного согласно способу, принятому в качестве прототипа [патент ЕА №010720, 2008], получают пептидный комплекс с содержанием низкомолекулярной пептидной фракции от 70 до 90% с молекулярной массой входящих в него пептидных компонентов в пределах от 1000 до 12000 Да, содержащий аминокислоты, минеральные вещества, микроэлементы и витамины в биологически связанной форме, проявляющий выраженную тканеспецифическую активность.
В технологическом отношении способ, описанный в патенте ЕА №010720, является несовершенным из-за присутствия в целевом продукте пептидных фракций с молекулярной массой более 5000 Да, в связи с чем целевой продукт, полученный этим способом, проявляет заниженную тканеспецифическую активность, что выражается в проявлении положительных тестов в органотипических культурах, близких по строению тканей.
Задача, на решение которой направлено настоящее изобретение, состоит в разработке технологии выделения пептидного комплекса с молекулярной массой входящих в него пептидных компонентов не более 5200 Да, очищенного от белковых, нуклеиновых и липидных примесей, и получении по этой технологии средства, обладающего повышенными регуляторными свойствами, основанными на тканеспецифической активности целевого продукта.
Технический результат заключается в том, что согласно предлагаемому способу, включающему определенную последовательность технологических операций и условия их осуществления, получают средство, представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов от 75 до 5200 Да, проявляющий выраженную тканеспецифическую активность, вследствие чего пептидный компонент полученного комплекса не денатурирует и сохраняет свои регуляторные свойства, что позволяет считать полученное непосредственно этим способом средство показанным для использования в качестве средства для поддержания функций органов, в отношении которых он проявляет специфическую активность.
Для решения поставленной задачи и достижения указанного технического результата предложена группа изобретений, объединенных общим изобретательским замыслом.
Одним из аспектов предлагаемой группы изобретений является способ получения средства, обладающего тканеспецифической активностью, предусматривающий измельчение замороженных органов телят не старше 12-месячного возраста или свиней, последующую экстракцию и удаление балластных веществ и характеризующийся тем, что замораживание органов животных осуществляют не позднее чем через 2 часа после сбора сырья при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев, после чего к измельченному замороженному сырью добавляют 5% раствор уксусной кислоты в объемном соотношении 10 объемов раствора уксусной кислоты к 1 объему измельченного сырья, повышают температуру суспензии до 60÷70°С и проводят экстракцию пептидов в раствор при постоянном перемешивании в течение не менее 2 часов, затем надосадочную жидкость сифонируют и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц размером более 5 мкм, после чего очищенный экстракт направляют на тангенциальную микрофильтрацию, которую проводят с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3÷0,4 мкм при скорости рециркуляции суспензии в камере концентрата 30÷38 л/ч и скорости фильтрации 1,8÷2,5 л/ч; полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента, сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8÷10 моль %; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник насосом снизу в режиме рециркуляции со скоростью 3÷4 л/ч при температуре 25÷30°С таким образом, что сорбент находится в форме взвешенного слоя; твердофазную экстракцию проводят в течение 3-х часов, после чего осуществляют вытеснение фильтрата из экстрактора и отмывку сорбента в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, которую подают в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора; после получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер и таким образом укладывают сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой, проводят десорбцию пептидов с катионита в режиме вытеснительной ионообменной хроматографии, при этом в качестве вытеснителя используют катион аммония, а вытеснение осуществляют вначале нейтральным аммиачным буферным раствором при pH 5,5 и затем щелочным буферным раствором при pH 12,5, а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, на выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку при температуре в системе не выше 42±3°С, после чего полученный целевой продукт, характеризующийся pH 6,0÷7,5, содержанием пептидных компонентов с молекулярной массой не более 5200 Да, лиофилизируют.
Другим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани сердца и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 150 до 3200 Да, поддерживающий функцию миокарда.
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани поджелудочной железы и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 2200 Да, поддерживающий функцию поджелудочной железы,
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани слизистой оболочки бронхов и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 100 до 2350 Да, поддерживающий функцию бронхов.
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани надпочечников и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 5200 Да, поддерживающий функцию надпочечников.
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани предстательной железы и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 2250 Да, поддерживающий функцию предстательной железы.
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани слизистой оболочки желудка и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 1850 Да, поддерживающий функцию желудка.
Следующим аспектом изобретения является средство, обладающее тканеспецифической активностью, полученное вышеописанным способом из ткани костного мозга и представляющее собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 150 до 3700 Да, поддерживающий функцию костного мозга.
Необходимо отметить, что средство, полученное непосредственно предлагаемым способом, в отличие от известных позволяет получить пептидный комплекс с молекулярной массой входящих в него пептидных компонентов от 75 до 5200 Да, обладающий выраженной тканеспецифической активностью, что достигается предлагаемой последовательностью технологических операций с использованием микрофильтрационного оборудования и условиями их осуществления, включая температурные, временные и иные характеристики, а также использование веществ, включая исходное сырье, определенный экстрагент и сорбент.
Сущность изобретения поясняется таблицами.
В Таблице 1 показано влияние пептидного комплекса, выделенного из сердца, на развитие эксплантатов в органотипической культуре сердца.
В Таблице 2 показано влияние пептидного комплекса, выделенного из сердца, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 3 показано влияние пептидного комплекса, выделенного из поджелудочной железы, на развитие эксплантатов в органотипической культуре поджелудочной железы.
В Таблице 4 показано влияние пептидного комплекса, выделенного из поджелудочной железы, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 5 показано влияние пептидного комплекса, выделенного из слизистой оболочки бронхов, на развитие эксплантатов в органотипической культуре слизистой оболочки бронхов.
В Таблице 6 показано влияние пептидного комплекса, выделенного из слизистой оболочки бронхов, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 7 показано влияние пептидного комплекса, выделенного из надпочечников, на развитие эксплантатов в органотипической культуре надпочечников.
В Таблице 8 показано влияние пептидного комплекса, выделенного из надпочечников, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 9 показано влияние пептидного комплекса, выделенного из предстательной железы, на развитие эксплантатов в органотипической культуре предстательной железы.
В Таблице 10 показано влияние пептидного комплекса, выделенного из предстательной железы, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 11 показано влияние пептидного комплекса, выделенного из слизистой оболочки желудка, на развитие эксплантатов в органотипической культуре слизистой оболочки желудка.
В Таблице 12 показано влияние пептидного комплекса, выделенного из слизистой оболочки желудка, на развитие эксплантатов в органотипических культурах различных тканей.
В Таблице 13 показано влияние пептидного комплекса, выделенного из костного мозга, на развитие эксплантатов в органотипической культуре костного мозга.
В Таблице 14 показано влияние пептидного комплекса, выделенного из костного мозга, на развитие эксплантатов в органотипических культурах различных тканей.
Ниже приведены примеры получения пептидных комплексов из животного сырья, в качестве которого используют замороженные различные органы и ткани телят не старше 12-месячного возраста или свиней (пример 1 - из сердца, пример 3 - из поджелудочной железы, пример 5 - из слизистой оболочки бронхов, пример 7 - из надпочечников, пример 9 - из предстательной железы, пример 11 - из слизистой оболочки желудка, пример 13 - из костного мозга), а также примеры, подтверждающие тканеспецифическое действие полученных пептидных комплексов (пример 2 - тканеспецифической активности пептидного комплекса, выделенного из сердца, пример 4 - тканеспецифической активности пептидного комплекса, выделенного из поджелудочной железы, пример 6 - тканеспецифической активности пептидного комплекса, выделенного из слизистой оболочки бронхов, пример 8 - тканеспецифической активности пептидного комплекса, выделенного из надпочечников, пример 10 - тканеспецифической активности пептидного комплекса, выделенного из предстательной железы, пример 12 - тканеспецифической активности пептидного комплекса, выделенного из слизистой оболочки желудка, пример 14 - тканеспецифической активности пептидного комплекса, выделенного из костного мозга.
Пример 1. Способ получения пептидного комплекса, выделенного из сердца, обладающего тканеспецифической активностью
В качестве животного сырья используют сердца телят (не старше 12-месячного возраста) или свиней, которые не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сифонируют и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт сердца затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов сердца с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из сердца) составляет 5,5 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из сердца) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,8.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из сердца, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb C18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса, выделенного из сердца, составляет от 100 до 5000 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. В качестве вещества сравнения используют воду. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) - Д275/Д260 - должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из сердца, - соотношение оптических плотностей Д275/Д260 составило 1,11.
Пример 2. Тканеспецифическая активность пептидного комплекса, выделенного из сердца
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из сердца, исследовали влияние целевого продукта на рост органотипической культуры миокарда молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты мышцы сердца крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из сердца, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций.
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из сердца, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата.
Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%. При использовании пептидного комплекса, выделенного из сердца, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 21-36% у молодых животных и на 18-30% - у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 1.
В Таблице 2 показано влияние пептидного комплекса, выделенного из сердца, в эффективной концентрации 10 нг/мл на органотипические культуры разных тканей.
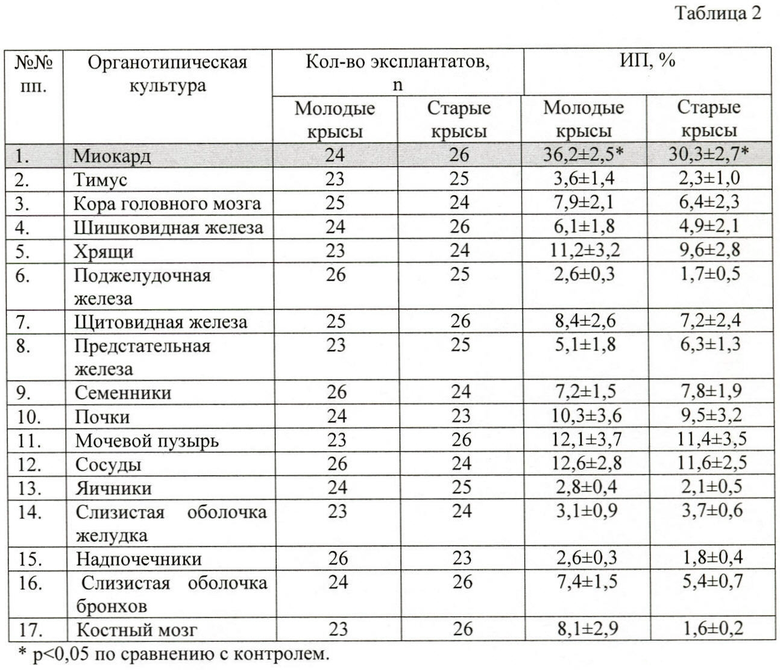
Важно отметить, что добавление пептидного комплекса, выделенного из сердца, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, поджелудочной железы, щитовидной железы, предстательной железы, семенников, почек, мочевого пузыря, сосудов, яичников, слизистой оболочки бронхов, слизистой оболочки желудка, надпочечников, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 2, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из сердца, на другие ткани.
Таким образом, в отношении ткани миокарда пептидный комплекс, выделенный из сердца, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию миокарда.
Пример 3. Способ получения пептидного комплекса, выделенного из поджелудочной железы, обладающего тканеспецифической активностью.
В качестве животного сырья используют поджелудочные железы телят (не старше 12-месячного возраста) или свиней, которые не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт поджелудочной железы затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов поджелудочной железы с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из поджелудочной железы) составляет 6,8 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из поджелудочной железы) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,3.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из поджелудочной железы, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb C18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса, выделенного из поджелудочной железы, составляет от 75 до 2200 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из поджелудочной железы, - соотношение оптических плотностей Д275/Д260 составило 1,09.
Пример 4. Тканеспецифическая активность пептидного комплекса, выделенного из поджелудочной железы
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из поджелудочной железы, исследовали влияние целевого продукта на рост органотипической культуры поджелудочной железы молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты поджелудочной железы крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из поджелудочной железы, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций.
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из поджелудочной железы, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата.
Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%.
При использовании пептидного комплекса, выделенного из поджелудочной железы, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 23-43% у молодых животных и на 20-38% - у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 3.
В Таблице 4 показано влияние пептидного комплекса, выделенного из поджелудочной железы, в эффективной концентрации 10 нг/мл на органотипические культуры разных тканей.
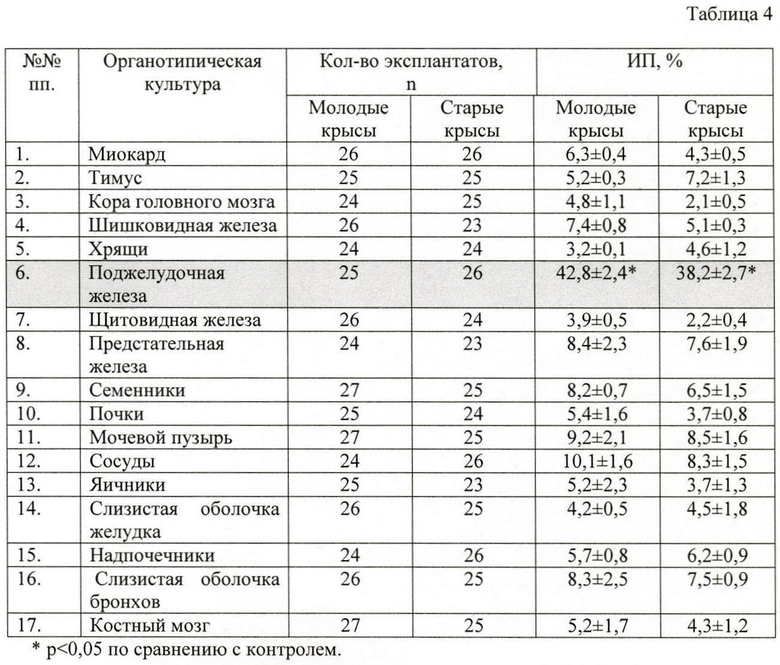
Важно отметить, что добавление пептидного комплекса, выделенного из поджелудочной железы, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, предстательной железы, семенников, почек, мочевого пузыря, сосудов, яичников, слизистой оболочки бронхов, слизистой оболочки желудка, надпочечников, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 4, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из поджелудочной железы, на другие ткани.
Таким образом, в отношении ткани поджелудочной железы пептидный комплекс, выделенный из поджелудочной железы, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию поджелудочной железы.
Пример 5. Способ получения пептидного комплекса, выделенного из слизистой оболочки бронхов, обладающего тканеспецифической активностью
В качестве животного сырья используют слизистую оболочку бронхов телят (не старше 12-месячного возраста) или свиней, которую не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт слизистой оболочки бронхов затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов слизистой оболочки бронхов с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из слизистой оболочки бронхов) составляет 3,4 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из слизистой оболочки бронхов) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,5.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из слизистой оболочки бронхов, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb С18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса составляет от 100 до 2350 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из слизистой оболочки бронхов, соотношение оптических плотностей Д275/Д260 составило 1,12.
Пример 6. Тканеспецифическая активность пептидного комплекса, выделенного из слизистой оболочки бронхов
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из слизистой оболочки бронхов, исследовали влияние целевого продукта на рост органотипической культуры слизистой оболочки бронхов молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты слизистой оболочки бронхов крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из слизистой оболочки бронхов, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций.
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из слизистой оболочки бронхов, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата.
Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%.
При использовании пептидного комплекса, выделенного из слизистой оболочки бронхов, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 18-25% у молодых животных и на 18-22% у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 5.
В таблице 6 показано влияние пептидного комплекса, выделенного из слизистой оболочки бронхов, в эффективной концентрации 0,5 нг/мл на органотипические культуры разных тканей.
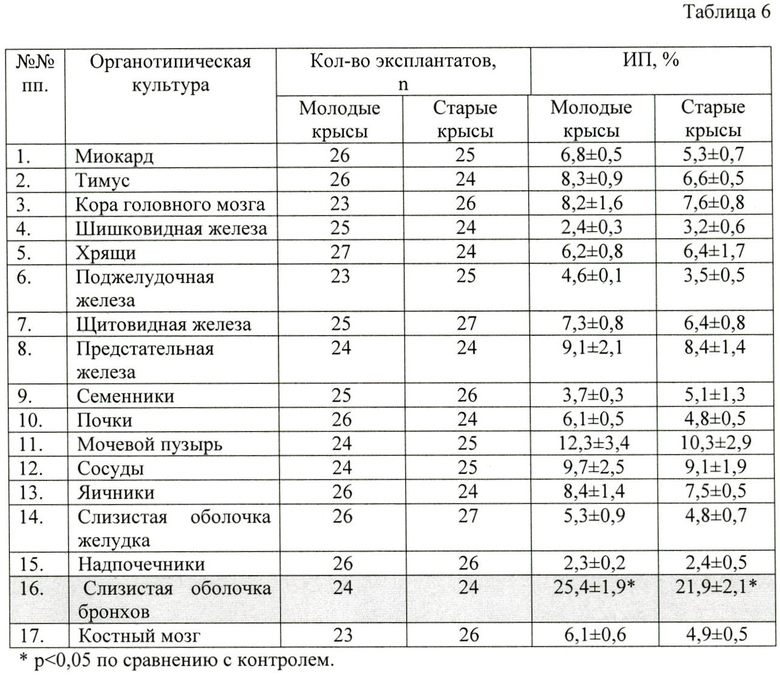
Важно отметить, что добавление пептидного комплекса, выделенного из слизистой оболочки бронхов, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, поджелудочной железы, предстательной железы, семенников, почек, мочевого пузыря, сосудов, яичников, слизистой оболочки желудка, надпочечников, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 6, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из слизистой оболочки бронхов, на другие ткани.
Таким образом, в отношении ткани бронхов пептидный комплекс, выделенный из слизистой оболочки бронхов, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию бронхов.
Пример 7. Способ получения пептидного комплекса, выделенного из надпочечников, обладающего тканеспецифической активностью
В качестве животного сырья используют надпочечники телят (не старше 12-месячного возраста) или свиней, которые не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт надпочечников затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов надпочечников с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из надпочечников) составляет 6,7 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из надпочечников) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,3.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из надпочечников, входят вещества с молекулярной массой не более 6000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb C18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса составляет от 75 до 5200 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из надпочечников, соотношение оптических плотностей Д275/Д260 составило 1,02.
Пример 8. Тканеспецифическая активность пептидного комплекса, выделенного из надпочечников
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из надпочечников, исследовали влияние целевого продукта на рост органотипической культуры надпочечников молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты надпочечников крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед/мл гентамицина. Исследуемый пептидный комплекс, выделенный из сердца, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций,
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из надпочечников, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата.
Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%.
При использовании пептидного комплекса, выделенного из надпочечников, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 26-48% у молодых животных и на 20-42% у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 7.
В таблице 8 показано влияние пептидного комплекса, выделенного из надпочечников, в эффективной концентрации 0,5 нг/мл на органотипические культуры разных тканей.

Важно отметить, что добавление пептидного комплекса, выделенного из надпочечников, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, поджелудочной железы, предстательной железы, семенников, почек, мочевого пузыря, сосудов, яичников, слизистой оболочки желудка, слизистой оболочки бронхов, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 8, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из надпочечников, на другие ткани.
Таким образом, в отношении ткани надпочечников пептидный комплекс, выделенный из надпочечников, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию надпочечников.
Пример 9. Способ получения пептидного комплекса, выделенного из предстательной железы, обладающего тканеспецифической активностью.
В качестве животного сырья используют предстательные железы половозрелых бычков, которые не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт предстательной железы затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов предстательной железы с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из предстательной железы) составляет 5,8 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из предстательной железы) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,9.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из предстательной железы, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb C18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса составляет от 75 до 2250 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из предстательной железы, соотношение оптических плотностей Д275/Д260 составило 1,06.
Пример 10. Тканеспецифическая активность пептидного комплекса, выделенного из предстательной железы
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из предстательной железы, исследовали влияние целевого продукта на рост органотипической культуры предстательной железы молодых (3-месячных) половозрелых самцов крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты предстательной железы крыс самцов разделяли на более мелкие части величиной около 1 мм, которые помещали в чашки Петри с коллагеновьм покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из предстательной железы, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций. В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из предстательной железы, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата. Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%,
При использовании пептидного комплекса, выделенного из предстательной железы, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 27-52% у молодых животных и на 23-48% у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 9.
В Таблице 10 показано влияние пептидного комплекса, выделенного из предстательной железы, в эффективной концентрации 10 нг/мл на органотипические культуры разных тканей.
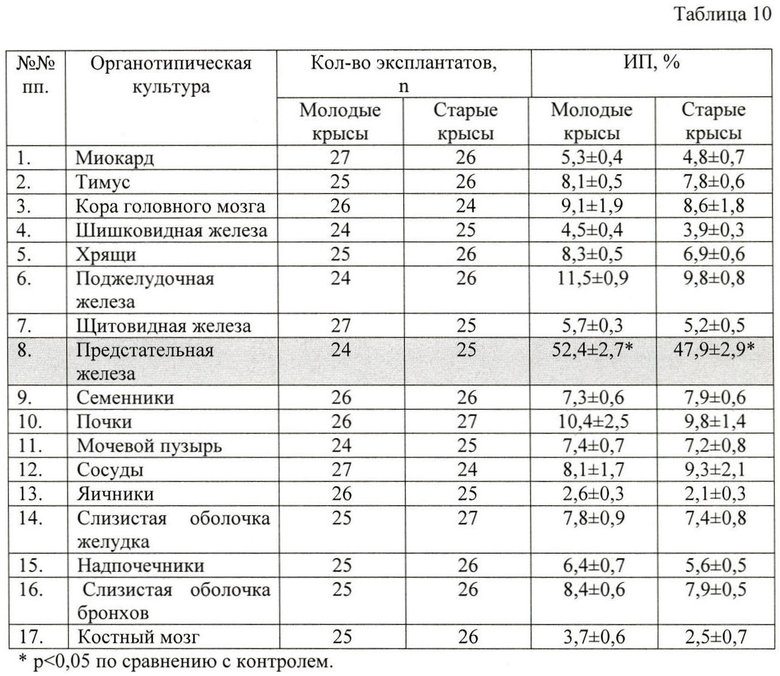
Важно отметить, что добавление пептидного комплекса, выделенного из предстательной железы, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, поджелудочной железы, надпочечников, семенников, почек, мочевого пузыря, сосудов, яичников, слизистой оболочки желудка, слизистой оболочки бронхов, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 10, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из предстательной железы, на другие ткани.
Таким образом, в отношении ткани предстательной железы пептидный комплекс, выделенный из предстательной железы, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию предстательной железы.
Пример 11. Способ получения пептидного комплекса, выделенного из слизистой оболочки желудка, обладающего тканеспецифической активностью.
В качестве животного сырья используют слизистую оболочку желудка телят (не старше 12-месячного возраста) или свиней, которую не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт слизистой оболочки желудка затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов слизистой оболочки желудка с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из слизистой оболочки желудка) составляет 3,9 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из слизистой оболочки желудка) представляет собой порошок от светло-кремового до коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 6,1.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из слизистой оболочки желудка, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb Cig», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса составляет от 75 до 1850 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из слизистой оболочки желудка - соотношение оптических плотностей Д275/Д260 составило 1,14.
Пример 12. Тканеспецифическая активность пептидного комплекса, выделенного из слизистой оболочки желудка
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из слизистой оболочки желудка, исследовали влияние целевого продукта на рост органотипической культуры слизистой оболочки желудка молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты слизистой оболочки желудка крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из слизистой оболочки желудка, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций.
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из слизистой оболочки желудка, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата. Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%. При использовании пептидного комплекса, выделенного из сердца, в концентрациях 0,05, 0,1 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 19-28% у молодых животных и на 24-26% у старых крыс по сравнению с соответствующими контрольными значениями ИП.
Полученные данные представлены в Таблице 11.
В Таблице 12 показано влияние пептидного комплекса, выделенного из слизистой оболочки желудка, в эффективной концентрации 10 нг/мл на органотипические культуры разных тканей.

Важно отметить, что добавление пептидного комплекса, выделенного из слизистой оболочки желудка, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, поджелудочной железы, надпочечников, семенников, почек, мочевого пузыря, сосудов, яичников, предстательной железы, слизистой оболочки бронхов, костного мозга) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 12, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из слизистой оболочки желудка, на другие ткани.
Таким образом, в отношении ткани слизистой оболочки желудка пептидный комплекс, выделенный из слизистой оболочки желудка, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию слизистой оболочки желудка.
Пример 13. Способ получения пептидного комплекса, выделенного из костного мозга, обладающего тканеспецифической активностью
В качестве животного сырья используют костный мозг телят (не старше 12-месячного возраста) или свиней, который не позднее чем через 2 часа после сбора сырья замораживают при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев.
Измельченное замороженное сырье в количестве 350 г помещают в стеклянную термостатируемую емкость с мешалкой объемом 4 л и заливают 5% водным раствором уксусной кислоты до суммарного объема 3 л. Затем повышают температуру суспензии до 60-70°С и при постоянном перемешивании проводят экстракцию в течение не менее 2-х часов.
Надосадочную жидкость сливают (сифонируют) и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц (размером более 5 мкм) из экстракта. Полученный очищенный экстракт костного мозга затем направляют на тангенциальную микрофильтрацию с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3-0,4 мкм, при этом скорость рециркуляции суспензии в камере концентрата составляет 30-38 л/ч, а скорость фильтрации - 1,8-2,5 л/ч.
Полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента - сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8-10 мол.%; при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник перистальтическим насосом снизу в режиме рециркуляции со скоростью 3-4 л/ч при температуре 25-30°С так, что сорбент находится в форме взвешенного слоя для однородного обтекания гранул сорбента. Твердофазную экстракцию проводят в течение 3-х часов, затем отбирают пробу из циркулирующего раствора и сохраняют ее при температуре 2-4°С для последующего анализа. Вытеснение фильтрата из экстрактора и отмывку сорбента проводят в условиях взвешенного слоя сорбента 5% водным раствором уксусной кислоты, подавая его в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора. После получения прозрачного промывочного раствора 5% водный раствор уксусной кислоты подают в массообменник через верхний штуцер, укладывая сорбент на нижний дренаж ровным слоем; затем последовательно замещают раствор кислоты деминерализованной водой.
Десорбцию пептидов костного мозга с катионита проводят в режиме вытеснительной ионообменной хроматографии, используя катион аммония в качестве вытеснителя, причем вытеснение осуществляют аммиачными буферными растворами в две стадии - вначале нейтральным (pH 5,5) и затем щелочным (pH 12,5), а хроматографию осуществляют со скоростями, не превышающими 4 мл/ч·см2 сечения колонки, что позволяет значительно сконцентрировать целевые пептиды. На выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку для удаления летучих компонентов и воды при температуре в системе не выше 42±3°С, после чего полученный целевой продукт лиофилизируют.
Выход целевого продукта (пептидного комплекса, выделенного из костного мозга) составляет 2,8 г на 1 кг исходного сырья.
Целевой продукт (пептидный комплекс, выделенный из костного мозга) представляет собой порошок от кремового до темно-коричневого цвета и содержит биологически активные пептидные компоненты. Целевой продукт умеренно растворим в воде, pH раствора 7,2.
Для более подробной характеристики пептидного комплекса, полученного предлагаемым способом, проведено изучение его состава, основных физико-химических свойств, специфической биологической активности.
Молекулярную массу пептидных компонентов, входящих в пептидный комплекс, определяют методом гель-хроматографии на сефадексах G-25 и G-50 («Pharmacia», Швеция). Для калибровки колонки 1,6×60 см используют набор маркеров Peptide Molecuar Weight Kit MS III («Serva», Германия). Установлено, что в состав пептидного комплекса, выделенного из костного мозга, входят вещества с молекулярной массой не более 5000 Да. С помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в градиенте ацетонитрила (сорбент «Lichrosorb C18», колонка 2×62 мм) установлено, что в состав пептидного комплекса входят преимущественно низкомолекулярные пептидные фракции (от 70 до 90%), а высокомолекулярные компоненты в пептидном комплексе отсутствуют. По данным электрофореза в 15%-ном полиакриламидном геле молекулярная масса пептидных компонентов пептидного комплекса составляет от 150 до 3700 Да.
Для определения подлинности пептидного комплекса навеску целевого продукта 10 мг помещают в пробирку, растворяют при тщательном перемешивании в 5 мл воды. Раствор фильтруют через бумажный фильтр. Для приготовления биуретового реактива растворяют 90 г калия-натрия тартрата в 400 мл 0,2 н. раствора едкого натрия, прибавляют 10 г меди сернокислой 5-водной, после растворения добавляют 10 г йодида калия и доводят объем раствора 0,2 н. раствором едкого натра до 2 л. К исследуемому раствору добавляют 5 мл биуретового реактива. Окрашивание раствора в фиолетовый цвет свидетельствует об имеющихся в комплексе пептидных связях. В качестве вещества сравнения используют воду.
Идентификацию активного пептидного комплекса проводят с помощью ультрафиолетовой спектрофотометрии. Для этого 10 мг пептидного комплекса растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки. На спектрофотометре измеряют ультрафиолетовый спектр пептидного комплекса в кварцевых кюветах с толщиной слоя 10 мм в области длин волн от 250 до 300 нм. В качестве раствора сравнения используют воду. Спектр должен иметь выраженный максимум при длине волны 270±5 нм. Соотношение оптических плотностей при длинах волн 275 нм (Д275) и 260 нм (Д260) Д275/Д260 должно быть не менее 1,0. В полученном целевом продукте - пептидном комплексе, выделенном из поджелудочной железы, соотношение оптических плотностей Д275/Д260 составило 1,1.
Пример 14. Тканеспецифическая активность пептидного комплекса, выделенного из костного мозга
Для изучения тканеспецифической активности пептидного комплекса, выделенного предлагаемым способом из костного мозга, исследовали влияние целевого продукта на рост органотипической культуры костного мозга молодых (3-месячных) половозрелых крыс линии «Wistar" с массой тела 150-200 г и старых животных (24-месячных) с массой тела 420-450 г.
Отпрепарированные в стерильных условиях фрагменты костного мозга крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки, 5% куриного эмбрионального экстракта, 0,6% глюкозы, 100 ед./мл гентамицина. Исследуемый пептидный комплекс, выделенный из костного мозга, вводили в культуральную среду в концентрациях от 0,01 до 20 нг/мл для выявления его эффективных концентраций.
В чашки Петри с экспериментальными эксплантатами добавляли по 3 мл питательной среды, содержащей пептидный комплекс, выделенный из костного мозга, в исследуемой концентрации, а в чашки Петри с контрольными эксплантатами - по 3 мл питательной среды; таким образом, экспериментальные и контрольные эксплантаты развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37±0,5°С и через 3 сут просматривали под фазово-контрастным микроскопом. Определяли индекс площади (ИП), который рассчитывали в условных единицах как отношение площади всего эксплантата вместе с зоной выселяющихся клеток к площади центральной зоны эксплантата.
Для визуализации эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 "Альфа-Телеком", Россия). Для расчета индекса площади эксплантатов использовали программу Photo M 1.2. Достоверность различий в индексах площади контрольных и экспериментальных эксплантатов оценивали с помощью t-критерия Стьюдента. Значения индекса площади выражали в процентах, контрольное значение ИП принимали за 100%.
При использовании пептидного комплекса, выделенного из костного мозга, в концентрациях 0,05, 0,1, 0,5 и 10 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 22-35% у молодых животных и на 19-31% у старых крыс по сравнению с соответствующими контрольными значениями ИП. Полученные данные представлены в Таблице 13.
В Таблице 14 показано влияние пептидного комплекса, выделенного из костного мозга, в эффективной концентрации 0,5 нг/мл на органотипические культуры разных тканей.
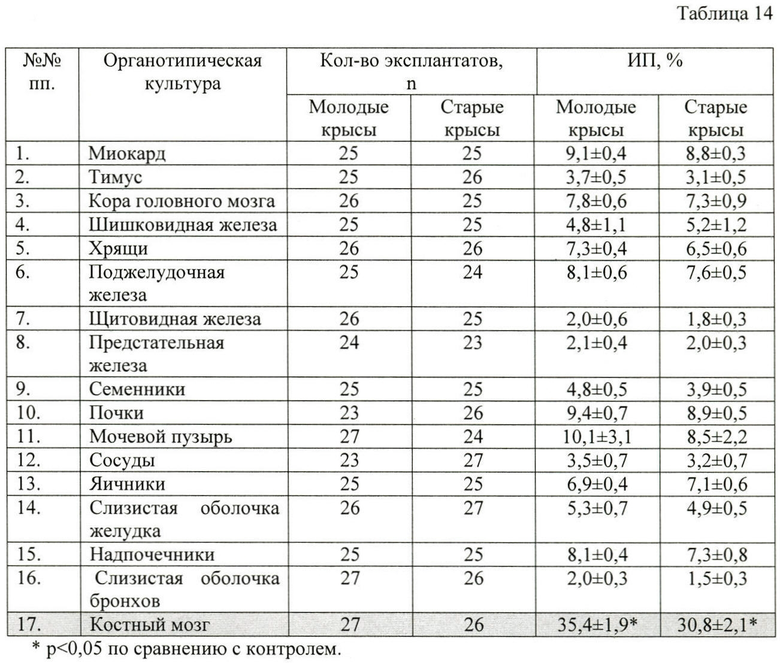
Важно отметить, что добавление пептидного комплекса, выделенного из костного мозга, в эффективной концентрации в питательную среду органотипических культур других тканей крысы (хрящей, тимуса, коры головного мозга, шишковидной железы, сердца, щитовидной железы, поджелудочной железы, надпочечников, семенников, почек, мочевого пузыря, сосудов, яичников, предстательной железы, слизистой оболочки бронхов, слизистой оболочки желудка) не приводило к достоверному увеличению ИП эксплантатов.
Данные, представленные в Таблице 14, свидетельствуют об отсутствии неспецифического действия пептидного комплекса, выделенного из костного мозга, на другие ткани.
Таким образом, в отношении ткани костного мозга пептидный комплекс, выделенный из костного мозга, оказывает тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов, что подтверждается в опытах на крысах, это позволяет считать показанным использование его в качестве средства, поддерживающего функцию костного мозга.
Приведенные выше примеры убедительно подтверждают, что полученный целевой продукт, представляющий собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75-5200 Да, проявляет тканеспецифическую активность в отношении органов и тканей, из которых он выделен.
Анализ результатов проведенных исследований по изучению тканеспецифической активности полученного предлагаемым способом средства (целевого продукта), представляющего собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов от 75 до 5200 Да, позволяет сделать вывод о целесообразности его использования в медицинской практике в качестве средства для поддержания функций органов, в отношении которых он проявляет специфическую активность.
Группа изобретений относится к фармакологии и медицине. Для получения средства, обладающего тканеспецифической активностью, осуществляют замораживание органов животных не позднее чем через 2 часа после сбора сырья при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев. К измельченному замороженному сырью добавляют 5% раствор уксусной кислоты, доводят температуру суспензии до 60÷70°С и проводят экстракцию пептидов в раствор при постоянном перемешивании в течение не менее 2 часов. Надосадочную жидкость сифонируют и фильтруют через ткань, после чего очищенный экстракт направляют на тангенциальную микрофильтрацию. Полученный фильтрат направляют на твердофазную экстракцию. Осуществляют хроматографию и на выходе из колонок собирают фракции растворов. Фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку, после чего полученный целевой продукт лиофилизируют. Использование способа позволяет получить пептидный комплекс с молекулярной массой входящих в него пептидных компонентов от 75 до 5200 Да, проявляющий выраженную тканеспецифическую активность. 8 н.п. ф-лы, 14 табл.
1. Способ получения средства, обладающего тканеспецифической активностью, предусматривающий измельчение замороженных органов телят не старше 12-месячного возраста или свиней, последующую экстракцию и удаление балластных веществ, отличающийся тем, что замораживание органов животных осуществляют не позднее чем через 2 ч после сбора сырья при температуре не менее минус 40°С, выдерживают при температуре минус 20÷22°С в течение не менее двух месяцев, после чего к измельченному замороженному сырью добавляют 5%-ный раствор уксусной кислоты в объемном соотношении 10 объемов раствора уксусной кислоты к 1 объему измельченного сырья, повышают температуру суспензии до 60÷70°С и проводят экстракцию пептидов в раствор при постоянном перемешивании в течение не менее 2 ч, затем надосадочную жидкость сифонируют и фильтруют через ткань, имеющую плотность не менее 125 г/м2, для удаления макрочастиц размером более 5 мкм, после чего очищенный экстракт направляют на тангенциальную микрофильтрацию, которую проводят с использованием микрофильтрационных модулей на основе трековых мембран с номинальным размером пор 0,3÷0,4 мкм при скорости рециркуляции суспензии в камере концентрата 30÷38 л/ч и скорости фильтрации 1,8÷2,5 л/ч; полученный фильтрат направляют на твердофазную экстракцию, которую проводят с использованием ионообменного сорбента, сульфированного сополимера стирола и дивинилбензола с содержанием дивинилбензола 8÷10 моль %, при этом для проведения твердофазной экстракции сорбент помещают в массообменники колоночного типа, а фильтрат подают на массообменник насосом снизу в режиме рециркуляции со скоростью 3÷4 л/ч при температуре 25÷30°С таким образом, что сорбент находится в форме взвешенного слоя; твердофазную экстракцию проводят в течение 3 ч, после чего осуществляют вытеснение фильтрата из экстрактора и отмывку сорбента в условиях взвешенного слоя сорбента 5%-ным водным раствором уксусной кислоты, которую подают в колонку снизу тем же насосом, до выхода из колонки прозрачного бесцветного раствора; после получения прозрачного промывочного раствора 5%-ным водный раствор уксусной кислоты подают в массообменник через верхний штуцер и, таким образом, укладывают сорбент на нижний дренаж ровным слоем, затем последовательно замещают раствор уксусной кислоты деминерализованной водой, проводят десорбцию пептидов с катионита в режиме вытеснительной ионообменной хроматографии, при этом в качестве вытеснителя используют катион аммония, а вытеснение осуществляют вначале нейтральным аммиачными буферным раствором при рН 5,5 и затем щелочным буферным раствором при рН 12,5, а хроматографию осуществляют со скоростями, не превышающими 4 мл/(ч·см2 сечения колонки), на выходе из колонок собирают фракции растворов, при этом фракции, содержащие пептидные компоненты, объединяют и направляют на вакуум-выпарную установку при температуре в системе не выше (42±3)°С, после чего полученный целевой продукт, характеризующийся рН 6,0÷7,5, содержанием пептидных компонентов с молекулярной массой не более 5200 Да, лиофилизируют.
2. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани сердца и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 150 до 3200 Да, поддерживающий функцию миокарда.
3. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани поджелудочной железы и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 2200 Да, поддерживающий функцию поджелудочной железы.
4. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани слизистой оболочки бронхов и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 100 до 2350 Да, поддерживающий функцию бронхов.
5. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани надпочечников и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 5200 Да, поддерживающий функцию надпочечников.
6. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани предстательной железы и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 2250 Да, поддерживающий функцию предстательной железы.
7. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани слизистой оболочки желудка и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 75 до 1850 Да, поддерживающий функцию желудка.
8. Средство, обладающее тканеспецифической активностью, характеризующееся тем, что оно получено способом по п.1 из ткани костного мозга и представляет собой пептидный комплекс с молекулярной массой входящих в него пептидных компонентов в пределах от 150 до 3700 Да, поддерживающий функцию костного мозга.
Авторы
Даты
2011-04-10—Публикация
2009-12-09—Подача