Область изобретения
Серийное производство фармацевтических композиций ставит множество задач перед химиками и технологами. В то время как многие задачи связаны с обработкой большого числа реагентов и управлением химическими реакциями, протекающими в больших объемах, одна из главных задач связана с природой самого активного конечного продукта. Продукт должен не только быть получен с высоким выходом, быть стабильным и легко выделяемым, но и обладать свойствами, которые бы подходили для тех типов фармацевтических препаратов, в которых предполагается его использование. Стабильность активного ингредиента фармацевтического препарата должна быть обеспечена на каждой из стадий производственного процесса, включая синтез, выделение, хранение, приготовление лекарственного средства и лекарственной формы. На каждой из этих стадий может оказывать влияние состояние внешней среды (температура и влажность).
Для приготовления фармацевтических композиций должны использоваться фармацевтически активные вещества очень высокой чистоты, которые также должны обладать достаточной химической стабильностью, чтобы обеспечить надежное долгосрочное хранение препарата в различных условиях. Это совершенно необходимо для того, чтобы предотвратить образование нежелательных продуктов распада в фармацевтических композициях, поскольку эти продукты могут быть потенциально токсичными или приводить к снижению активности композиции.
Основной задачей серийного производства фармацевтических композиций является сохранение полиморфной стабильности активного вещества в процессе его обработки с целью обеспечения сохранения рабочих параметров и качества лекарственного препарата. В зависимости от характеристик стабильности фармацевтического соединения последний может подвергнуться изменениям в процессе производства и/или хранения, что может вызвать нарушения качества и технологии приготовления лекарственного препарата. Такие изменения могут отрицательно сказаться на воспроизводимости производственного процесса и таким образом привести к созданию препаративных форм, которые, возможно, не будут удовлетворять строгим требованиям к высокому качеству, предъявляемым соответствующими органами контроля технологий приготовления лекарственных средств. Опираясь на вышесказанное, можно сделать вывод, что, как минимум, выбор фармацевтического соединения с улучшенными характеристиками физической стабильности может обеспечить ряд преимуществ такой формы по сравнению с другими менее стабильными формами.
Настоящее изобретение фармакологически активного антагониста рецептора простагландина D2 относится к первичному кислому фосфату (соли), имеющему наиболее предпочтительные физические свойства. Соединение используется в качестве антагониста DP для лечения пациента, подверженного патологическим (заболеваниям) состояниям, опосредованным PGD2, включая, но не ограничиваясь, аллергическое заболевание (например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма и пищевая аллергия), системный мастоцитоз, нарушения, сопровождающиеся системной активацией мастоцитов, анафилактический шок, бронхоконстрикцию, бронхит, крапивницу, экзему, заболевания, сопровождающиеся зудом (например, атопический дерматит и крапивница), заболевания (например, катаракта, отслоение сетчатки, воспаление, инфекция и нарушения сна), которые возникают в качестве вторичных заболеваний в результате состояния, сопровождающегося зудом (например, расчесывания и растирания), воспаления, хронические обструктивные заболевания легких, ишемическое реперфузионное повреждение, расстройство мозгового кровообращения, хронический ревматоидный артрит, плеврит, неспецифический язвенный колит и подобные заболевания.
Уровень техники
Показано, что локальная стимуляция аллергеном пациентов с аллергическим ринитом, бронхиальной астмой, аллергическим конъюнктивитом и атопическим дерматитом приводит к быстрому росту уровня простагландина D2 (PGD2) в назальной и бронхиальной смывной жидкости, слезах и кожной полостной жидкости. PGD2 может оказывать разное воспалительное действие, например повышать проницаемость сосудов в конъюнктиве и коже, повышать сопротивление дыхательных путей носа, сужение дыхательных путей и проникновение эозинофилов в конъюнктиву и трахеи.
PGD2 - основной циклооксигеназный продукт арахидоновой кислоты, производимый мастоцитами при иммунологическом стимулировании [Lewis, R.A., Soter N.A., Diamond P.T., Austen K.F., Oates J.A., Roberts L.J. II, Prostaglandin D2 generation after activation of rat and human mast cells with anti-IgE, J. Immunol 129, 1627-1631, 1982]. Активированные мастоциты, один из главных источников PGD2, играют одну из ключевых ролей в возникновении аллергической реакции при таких заболеваниях, как астма, аллергический ринит, аллергический конъюнктивит, аллергический дерматит и другие заболевания [Brightling C.E., Bradding P., Pavord I.D., Wardlaw A.J., New Insights into the role of the mast cell in asthma, Clin. Exp. Allergy 33, 550-556, 2003].
Многие воздействия PGD2 опосредуются его действием на рецептор простагландина D (DP)-рецептор, связанный с G-белком, экспрессируемый на эпителии и в гладких мышцах.
При астме респираторный эпителий уже давно считается главным источником воспалительных цитокинов и хемокинов, которые определяют развитие заболевания [Holgate S., Lackie P., Wilson S., Roche W., Davies D., Bronchial Epithelium as a Key Regulator of Airway Allergen Sensitization and Remodelling in Asthma, Am. J. Respir. Crit. Care Med. 162, 113-117, 2000]. В экспериментальной модели астмы мышей при стимулировании антигеном происходит резкая активация рецептора DP на эпителии дыхательных путей [Matsuoka T., Hirata M., Tanaka H., Takahashi Y., Murata T., Kabashima K., Sugimoto Y., Kobayashi T., Ushikubi F., Aze Y., Eguchi N., Urade Y., Yoshida N., Kimura K., Mizoguchi A., Honda Y., Nagai H., Narumiya S., prostaglandin D2 as a mediator of allergic asthma, Science 287, 2013-2017, 2000]. У нокаутных мышей с отсутствующим рецептором DP заметно снижается гиперреактивность дыхательных путей и хроническое воспаление - два важнейших признака астмы человека [Matsuoka T., Hirata M., Tanaka H., Takahashi Y., Murata T., Kabashima K., Sugimoto Y., Kobayashi T., Ushikubi F., Aze Y., Eguchi N., Urade Y., Yoshida N., Kimura K., Mizoguchi A., Honda Y., Nagai H., Narumiya S., Prostaglandin D2 as a mediator of allergic asthma, Science 287, 2013-2017, 2000].
Считается также, что рецептор DP задействован в аллергическом рините человека, распространенном аллергическом заболевании, характеризующемся такими симптомами, как чихание, зуд, ринорея и заложенность носа. Местное применение PGD2 в носу вызывает зависимое от дозы увеличение заложенности носа [Doyle W.J., Boehm S, Skoner D.P., Physiologic responses to intranasal dose-response challenges with histamine, methacholine, bradykinin, and prostaglandin in adult volunteers with and without nasal allergy, J. Allergy Clin. Immunol. 86(6 Pt 1), 924-35, 1990].
Было показано, что антагонисты рецептора DP снижают воспаление дыхательных путей в экспериментальной модели астмы морских свинок [Arimura A., Yasui K., Kishino J., Asanuma F., Hasegawa H., Kakudo S., Ohtani M., Arita H., Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751, J. Pharmacol. Exp. Ther. 298(2), 411-9, 2001]. Таким образом, PGD2, по-видимому, действует на рецептор DP и играет важную роль в проявлении основных особенностей аллергической астмы.
Было показано, что антагонисты DP могут эффективно ослаблять симптомы аллергического ринита у многих видов, в частности, было показано, что они могут подавлять индуцированную антигенами заложенность носа, наиболее явный симптом аллергического ринита [Jones, T.R., Savoie, C., Robichaud, A., Sturino, C., Scheigetz, J., Lachance, N., Roy, B., Boyd, M., Abraham, W., Studies with a DP receptor antagonist in sheep and guinea pig models of allergic rhinitis, Am. J. Resp. Crit. Care Med. 167, A218, 2003; и Arimura A., Yasui K., Kishino J., Asanuma F., Hasegawa H., Kakudo S., Ohtani M., Arita H., Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751. J. Pharmacol. Exp. Ther. 298(2), 411-9, 2001].
Антагонисты DP также эффективны в экспериментальных моделях аллергического конъюнктивита и аллергического дерматита [Arimura A., Yasui K., Kishino J., Asanuma F., Hasegawa H., Kakudo S., Ohtani M., Arita H., Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751, J Pharmacol. Exp. Ther. 298(2), 411-9, 2001; и Torisu K., Kobayashi K., Iwahashi M., Nakai Y., Onoda T., Nagase T., Sugimoto I., Okada Y., Matsumoto R., Nanbu F., Ohuchida S., Nakai H., Toda M., Discovery of a new class of potent, selective, and orally active prostaglandin D2 receptor antagonists, Bioorg. & Med. Chem. 12, 5361-5378, 2004].
В заявке на патент WO 2006044732 (далее «заявка '732»), которая в виде ссылки на нее включена в настоящую заявку, раскрывает пиримидины, имеющие полезные фармацевтические свойства, включая, в частности, способность связываться с DP рецептором и регулировать его. В заявке '732 раскрывались пиримидины формулы (I)

их получение, содержащие эти соединения фармацевтические композиции и их фармацевтическое применение для лечения патологических состояний, которые можно контролировать ингибированием рецептора простагландина D2. Кроме того, в заявке '732 описана 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовая кислота (далее “свободная форма”). В заявке '732 также дано общее описание широкого разнообразия солей, образованных при присоединении кислот и оснований к соединениям, являющимся предметом настоящего изобретения, приведены демонстрационные примеры приготовления хлористоводородных и натриевых солей, более конкретно хлористоводородной и натриевой солей 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты. Однако в заявке '732 не была раскрыта информация непосредственно о соли первичном кислом фосфате 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты.
Краткое описание изобретения
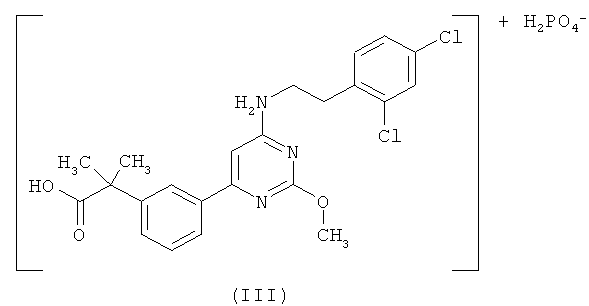
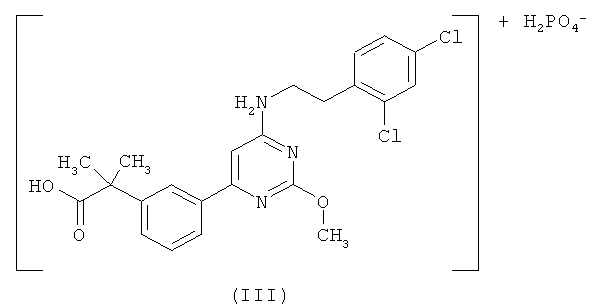
Настоящее изобретение относится к первичной кислой фосфатной соли 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты формулы (III) (далее «первичная кислая фосфатная соль»)
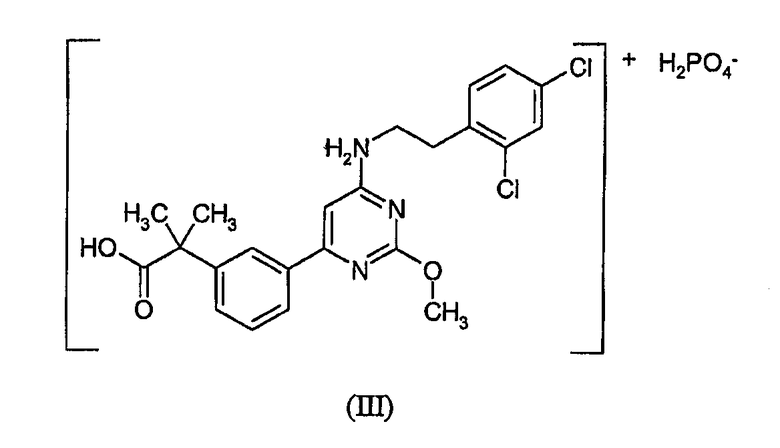
Другим аспектом настоящего изобретения является фармацевтическая композиция, включающая фармацевтически эффективное количество первичной кислой фосфатной соли.
Другим аспектом настоящего изобретения является способ лечения пациента, страдающего нарушением, опосредованным PGD2, в том числе, в частности, аллергическим заболеванием (например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма и пищевая аллергия), системным мастоцитозом, нарушениями, сопровождающимися системной активацией мастоцитов, анафилактическим шоком, бронхоконстрикцией, бронхитом, крапивницей, экземой, заболеваниями, сопровождающимися зудом (например, атопический дерматит и крапивница), заболеваниями (например, катаракта, отслоение сетчатки, воспаление, инфекция и нарушения сна), которые возникают в качестве вторичных заболеваний в результате состояния, сопровождающегося зудом (например, расчесывание и растирание), воспалением, хроническими обструктивными заболеваниями легких, ишемическими реперфузионными повреждениями, расстройствами мозгового кровообращения, хроническим ревматоидным артритом, плевритом, неспецифическим язвенным колитом и подобными заболеваниями, посредством введения пациенту фармацевтически эффективного количества первичной кислой соли 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты.
Более подробное обсуждение настоящего изобретения и соответствующие поясняющие чертежи приводятся ниже.
Краткое описание чертежей
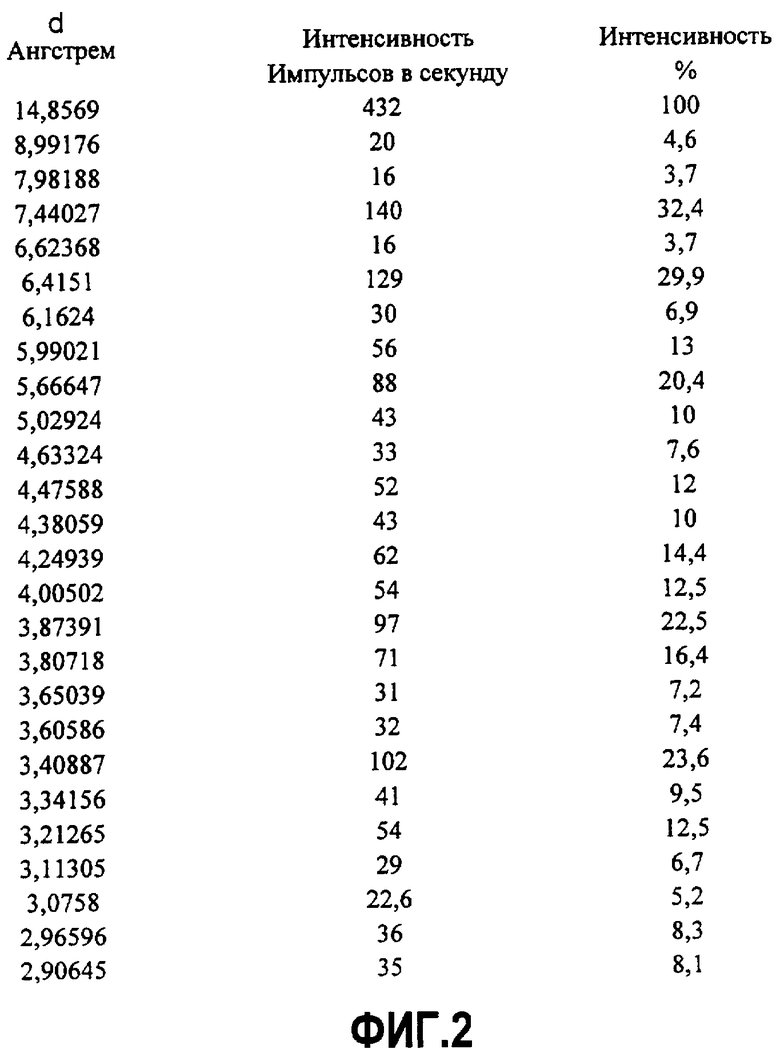
Фиг.1. Порошковая рентгенограмма (ПР) первичного кислого фосфата (соли).
Фиг.2. Таблица значений межплоскостных расстояний d и относительных интенсивностей пиков порошковой рентгенограммы, представленной на фиг.1.
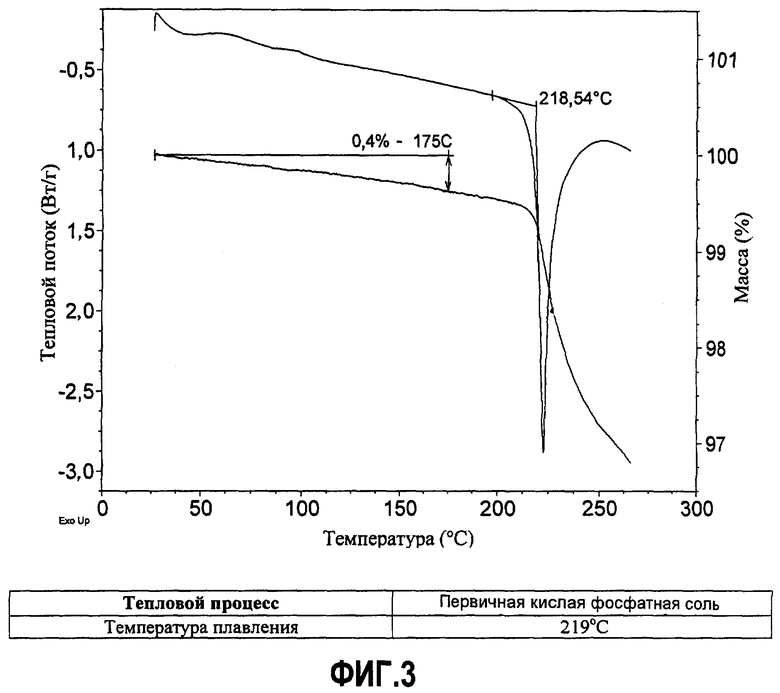
Фиг.3. Термограмма первичного кислого фосфата, полученная методами дифференциальной сканирующей калориметрии и термогравиметрического анализа (ДСК-ТГА). Данные ТГА показывают общую потерю массы, составляющую приблизительно 0,4%, при нагревании от комнатной температуры до 175°C. Результат ДСК содержит информацию о плавлении кристаллической фазы. Разложение исходного вещества начинается при температуре плавления.
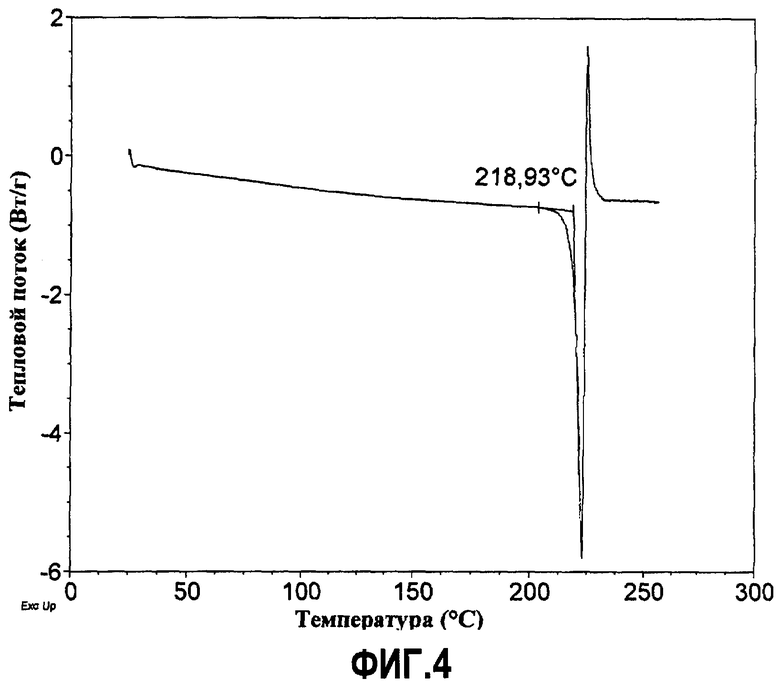
Фиг.4. ДСК-термограмма первичного кислого фосфата. Из термограммы видно, что плавление вещества начинает происходить при температуре 219°C.
Фиг.5. Сорбционная изотерма первичного кислого фосфата, полученная с помощью анализатора динамической сорбции водяного пара (ДСВП), и соответствующая таблица данных для профиля сорбции воды. Результаты измерений показывают увеличение веса образца во время сорбции (приблизительно на 0,9%) при относительной влажности 94% и незначительный гистерезис, возможно обусловленный слабой связью с поверхностью поглощения воды.
Фиг.6. Порошковые рентгенограммы первичного кислого фосфата до и после процедуры динамической сорбции водяного пара. Образец готовят и запись рентгенограммы начинают в течение 2 минут после извлечения образца из анализатора динамического поглощения паров воды, где он в течение ~12 часов находился при нулевой относительной влажности. Полученные данные демонстрируют незначительное изменение интенсивностей пиков и межплоскостного расстояния d в результате эксперимента ДСВП, что означает отсутствие каких-либо существенных изменений в кристаллической структуре.
Фиг.7. Микрофотография первичного кислого фосфата. Поверхность составляют главным образом частицы вытянутой формы и в форме игл длиной приблизительно 30 микрон.
Фиг.8. Микрофотографии первичного кислого фосфата до и после размалывания и количественное распределение частиц по размерам, показывающее, что при измельчении частиц физико-химические свойства вещества не изменяются. Микрофотографирование после размалывания вещества позволяет сделать вывод, что первичный кислый фосфат является тонкоизмельченным. Измерения, выполненные примерно в тридцати различных положениях при 100-кратном увеличении, показывают, что размеры частиц кристаллической фазы не превышают 10 микрон. Установлено, что распределение по размерам частиц микронизированного первичного кислого фосфата одномодально. Средний размер частиц [x(50)] составляет 2,0 микрона, 90% всех частиц имеют размер 4,7 микрона или меньше. Процесс микронизации таким образом позволяет уменьшить средний размер частиц (составлял 5,8 микрон до измельчения) и размер 90% частиц (до измельчения составлял ~16 микрон). Порошковая рентгенограмма, т.е. (интенсивности пиков, их положение (межплоскостное расстояние d) и ширина) до и после микронизации первичной кислой фосфатной соли не изменяется.
Фиг.9. Изотерма сорбции водяного пара первичным кислым фосфатом после микронизации демонстрирует отсутствие аморфизации.
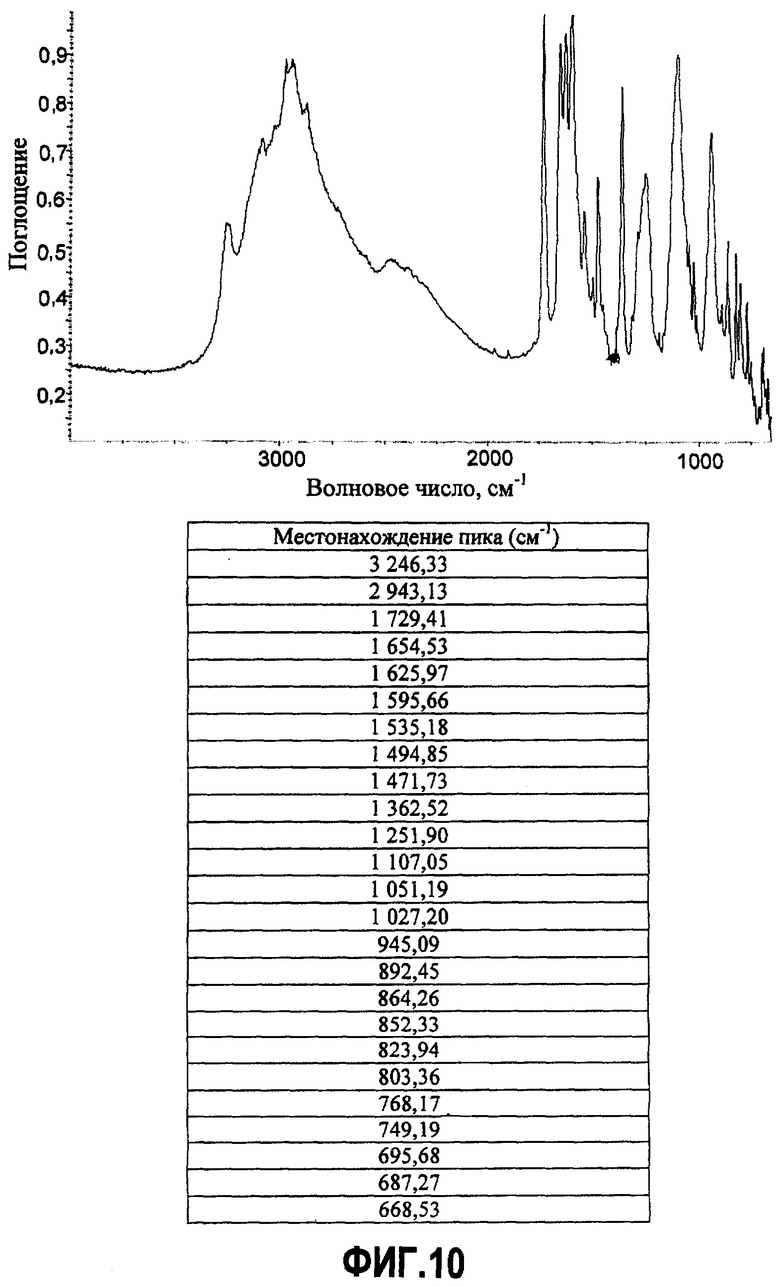
Фиг.10. Инфракрасный Фурье-спектр первичного кислого фосфата и соответствующая таблица ИК Фурье пиков.
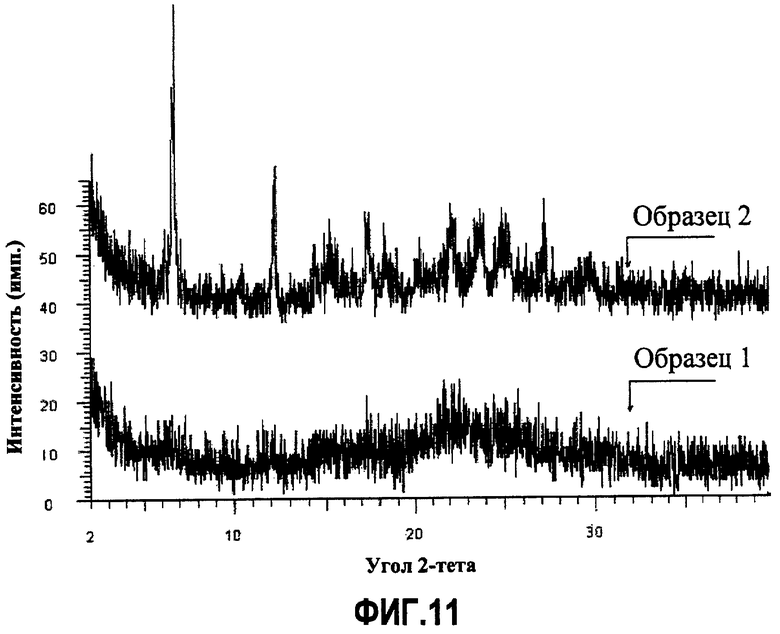
Фиг.11. Совмещение порошковых рентгенограмм для двух образцов натриевой соли, приготовленных разными способами. Образец 1 приготавливался перекристаллизацией из смеси этанол/этилацетат, образец 2 - перекристаллизацией из смеси метанол/этилацетат.
Фиг.12. Совмещение порошковых рентгенограмм для двух образцов хлористоводородной соли, приготовленных перекристаллизацией из ацетона.
Подробное описание изобретения
Определения и сокращения
Используемые выше и во всем тексте описания изобретения следующие сокращения, если не указано иначе, имеют следующие значения:
DMSO диметилсульфоксид
cAMP циклический аденозинмонофосфат
IBMX 3-изобутил-1-метилксантин
SPA SPA-анализ (сцинтилляционный анализ)
ATTC Американская коллекция типовых культур
МПС минимальная поддерживающая среда
FBS эмбриональная телячья сыворотка
имп/мин количество импульсов в минуту
Используемые выше и во всем тексте описания изобретения следующие термины, если не указано иначе, имеют следующие значения.
«Лечение» или «терапия» означает предотвращение, частичное облегчение или излечение заболевания. Соединение и препарат настоящего изобретения полезны при лечении нарушения, опосредованного PGD2, в том числе, в частности, аллергического заболевания (например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма и пищевая аллергия), системного мастоцитоза, нарушений, сопровождающихся системной активацией мастоцитов, анафилактического шока, бронхоконстрикции, бронхита, крапивницы, экземы, заболеваний, сопровождающихся зудом (например, атопический дерматит и крапивница), заболеваний (например, катаракта, отслоение сетчатки, воспаление, инфекция и нарушения сна), которые возникают в качестве вторичных заболеваний в результате состояния, сопровождающегося зудом (например, расчесывания и растирания), воспаления, хронических обструктивных заболеваний легких, ишемического реперфузионного повреждения, расстройства мозгового кровообращения, хронического ревматоидного артрита, плеврита, неспецифического язвенного колита и подобных заболеваний, посредством введения такому пациенту фармацевтически эффективного количества соединения формулы (III).
«Пациент» означает человека и других млекопитающих.
«Фармацевтически эффективное количество» означает количество соединения, композиции лекарственного средства или иного активного ингредиента, которое является эффективным для получения желаемого терапевтического эффекта.
Конкретные варианты осуществления настоящего изобретения
Одним конкретным вариантом осуществления настоящего изобретения является соединение формулы (III) в кристаллическом виде.
Соединение, составляющее предмет настоящего изобретения, является антагонистом рецептора простагландина D2 и может использоваться как активное фармакологическое вещество. Соответственно, оно включается в фармацевтические композиции и используется для лечения пациентов, страдающих определенными медицинскими нарушениями.
Соединение, составляющее предмет настоящего изобретения, является антагонистом рецептора простагландина D2 согласно тестам, описанным в литературе, а также описанным в приведенном ниже разделе о фармакологических исследованиях, результаты которых, как считается, коррелируют с фармакологическим действием в организме человека и других млекопитающих. Таким образом, в еще одном варианте осуществления настоящего изобретения представлено соединение, являющееся предметом настоящего изобретения и композиции, содержащие их, которые могут использоваться в лечении пациентов, страдающих заболеваниями или подверженных заболеваниям, которые можно облегчить введением антагониста PGD2. Например, соединение, составляющее предмет настоящего изобретения, может использоваться для лечения разнообразных нарушений, опосредованных PGD2, включающих без ограничения, аллергическое заболевание (например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма и пищевая аллергия), системный мастоцитоз, нарушения, сопровождающиеся системной активацией мастоцитов, анафилактический шок, бронхоконстрикцию, бронхит, крапивницу, экземы, заболевания, сопровождающиеся зудом (например, атопический дерматит и крапивница), заболевания (например, катаракта, отслоение сетчатки, воспаление, инфекция и нарушения сна), которые возникают в качестве вторичных заболеваний в результате состояния, сопровождающегося зудом (например, расчесывание и растирание), воспаления, хронические обструктивные заболевания легких, ишемическое реперфузионное повреждение, расстройства мозгового кровообращения, хронический ревматоидный артрит, плеврит, неспецифический язвенный колит и подобные заболевания.
Одним частным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение аллергического ринита.
Еще одним частным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение бронхиальной астмы.
Еще одним частным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение ХОЗЛ.
Еще одним частным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение аллергического конъюнктивита.
Еще одним частным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение аллергического дерматита.
Включенные в описание ссылки на лечение включают как профилактическую терапию, так и лечение установленных заболеваний.
Кроме того, соединение, составляющее предмет настоящего изобретения, может использоваться для лечения в сочетании с одним или более из следующих препаратов:
(i) антигистаминами, такими как фексофенадин, дезлоратадин, лоратадин и цитиризин, для лечения аллергического ринита;
(ii) антагонистами лейкотриена, такими как монтелукаст и зафируласт, для лечения аллергического ринита, ХОЗЛ, аллергического дерматита, аллергического конъюнктивита и т.д. - точную информацию см. в формуле изобретения WO 01/78697 A2;
(iii) бета-агонистами, такими как альбутерол, сальбутерол и тербуталин, для лечения астмы, ХОЗЛ, аллергического дерматита, аллергического конъюнктивита и т.д.;
(iv) антигистаминами, такими как фексофенадин, лоратадин и цитиризин, для лечения астмы, ХОЗЛ, аллергического дерматита, аллергического конъюнктивита и т.д.;
(v) ингибиторами PDE4 (фосфодиэстеразы 4), такими как рофлумиласт и циломиласт, для лечения астмы, ХОЗЛ, аллергического дерматита, аллергического конъюнктивита и т.д.; или
(vi) с антагонистами TP (рецептора тромбоксана A2) или антагонистами CrTh2 (молекулы, гомологичной рецептору хемоаттрактанта, экспрессируемой на Th2 клетках), такими как раматробран (BAY-u3405), для лечения ХОЗЛ, аллергического дерматита, аллергического конъюнктивита и т.д.
Настоящее изобретение относится также к фармацевтической композиции, включающей фармацевтически эффективное количество соединения, являющегося предметом настоящего изобретения, в смеси с фармацевтически приемлемым носителем.
На практике соединения, составляющие предмет настоящего изобретения, могут вводиться в виде фармацевтически приемлемых лекарственных форм человеку и другим млекопитающим посредством местного или системного применения, в том числе перорального, ингаляционного, ректального, назального, буккального, сублингвального, вагинального, кишечного, парентерального (в том числе подкожного, внутримышечного, внутривенного, внутрикожного, интратекального и эпидурального), интрацистернального и внутрибрюшинного. Следует принимать во внимание, что конкретный способ введения может меняться, например, в зависимости от физиологического состояния пациента.
«Фармацевтически приемлемыми лекарственными формами» называются лекарственные формы соединения, составляющего предмет данного изобретения, которые включают, например, таблетки, драже, порошки, эликсиры, сиропы, жидкие составы, в том числе суспензии, спреи, ингалянты, таблетки, лепешки, эмульсии, растворы, гранулы, капсулы и суппозитории, также жидкие составы для инъекций, в том числе липосомные препараты. Общее описание методов и составов можно найти в последнем издании Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA.
Особый аспект настоящего изобретения предусматривает введение соединения, составляющего предмет настоящего изобретения, в форме фармацевтической композиции.
Фармацевтически приемлемые носители включают по крайней мере один из компонентов, выбранный из группы, включающей фармацевтически приемлемые носители, разбавители, оболочки, адъюванты, эксципиенты или носители, такие как консерванты, наполнители, разрыхлители, смачивающие вещества, эмульгаторы, стабилизаторы эмульсий, суспендирующие вещества, изотонические вещества, подсластители, вкусовые добавки, ароматизаторы, красители, бактерицидные средства, противогрибковые средства, другие терапевтические вещества, смазывающие вещества, вещества, замедляющие или ускоряющие всасывание, и распыляющие вещества, в зависимости от особенностей способа введения и лекарственной формы.
Примерами суспендирующих веществ являются этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ.
Примерами бактерицидных и противогрибковых веществ, предотвращающих действие микроорганизмов, являются парабены, хлорбутанол, фенол, сорбиновая кислота и подобные им вещества.
Примерами изотонических веществ являются сахара, хлорид натрия и подобные им вещества.
Примерами веществ, замедляющих и продлевающих всасывание, являются моностеарат алюминия и желатин.
Примерами веществ, ускоряющих и стимулирующих абсорбцию, являются диметилсульфоксид и его аналоги.
Примерами разбавителей, растворителей, носителей, солюбилизирующих веществ, эмульгаторов и стабилизаторов эмульсии являются вода, хлороформ, сахароза, этанол, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, тетрагидрофурфуриловый спирт, бензилбензоат, полиолы, пропиленгликоль, 1,3-бутиленгликоль, глицерин, полиэтиленгликоли, диметилформамид, Tween® 60, Span® 60, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия, сложные эфиры сорбитана и жирных кислот, растительные масла (такие как хлопковое масло, арахисовое масло, оливковое масло, касторовое масло и кунжутное масло) и инъецируемые органические сложные эфиры, такие как этилолеат и ему подобные, или подходящие смеси этих соединений.
Примерами формообразующих наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция и дикальцийфосфат.
Примерами разрыхлителей являются крахмал, альгиновые кислоты и некоторые сложные силикаты.
Примерами смазывающих веществ являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоли с высоким молекулярным весом.
Выбор фармацевтически приемлемого носителя, в целом, определяется в соответствии с химическими свойствами активного соединения, такими как растворимость, способ применения и указания, которые необходимо соблюдать в фармацевтической практике.
Фармацевтические композиции, составляющие предмет настоящего изобретения, пригодные для перорального применения, могут представлять собой отдельные единицы, такие как твердые лекарственные формы, такие как капсулы, облатки или таблетки, каждая из которых содержит определенное количество активного ингредиента, либо такие как порошки или гранулы, или жидкие лекарственные формы, такие как растворы или суспензии в водной или неводной жидкой среде, или жидкие эмульсии масла в воде или воды в масле. Активный ингредиент также может иметь форму болюса, электуария или пасты.
«Твердая лекарственная форма» означает лекарственную форму соединения, составляющего предмет данного изобретения, в виде твердого вещества, например капсулы, таблетки, пилюли, порошки, драже или гранулы. В таких лекарственных формах соединение, составляющее предмет данного изобретения, добавлено в как минимум один традиционно используемый инертный наполнитель (или носитель), например цитрат натрия или дикальцийфосфат, или (a) наполнители или среды, такие как, например, крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (b) связующие вещества, например карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, (c) увлажняющие вещества, такие как, например, глицерин, (d) разрыхлители, такие как, например, агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные сложные силикаты и карбонат натрия, (e) растворы-замедлители, такие как, например, парафин, (f) ускорители абсорбции, такие как, например, четвертичные аммониевые соединения, (g) увлажняющие вещества, такие как, например, цетиловый спирт и глицеринмоностеарат, (h) адсорбенты, такие как, например, каолин или бентонит, (i) скользящие вещества, такие как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, (j) замутняющие компоненты, (k) буферные вещества, отсроченно высвобождающие соединение, составляющее предмет настоящего изобретения, в определенной части кишечного тракта.
Таблетка может быть приготовлена прессованием или формовкой и может иметь один или несколько вспомогательных компонентов. Прессованные таблетки можно получать прессованием в подходящем аппарате активного ингредиента в сыпучей форме, такой как порошок или гранулы, которая может быть смешана со связующим веществом, скользящим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Могут использоваться такие инертные наполнители, как лактоза, цитрат натрия, карбонат кальция, дикальцийфосфат и разрыхлители, такие как крахмал, альгиновые кислоты и определенные сложные силикаты, смешанные со скользящими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк. Смесь порошкообразных соединений, смоченную инертным жидким разбавителем, можно формовать на подходящем автомате для получения формованных таблеток. Таблетки могут иметь покрытия или насечки, а также могут иметь состав, обеспечивающий медленное или контролируемое выделение содержащегося в них активного ингредиента.
Твердые составы также могут использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких инертных наполнителей, как лактоза или молочный сахар, а также полиэтиленгликолей с большим молекулярным весом и подобных им веществ.
В случае необходимости, а также для более эффективного распределения соединение может быть микроинкапсулировано в системах медленного или направленного высвобождения (или присоединено к таким системам), таких как биосовместимые, биоразложимые полимерные матрицы (например, сополимер d,l-лактида с гликолидом), липосомы и микросферы для подкожного и внутримышечного инъецирования методом, называемым подкожной или внутримышечной инъекцией замедленного всасывания, обеспечивающей непрерывное медленное высвобождение соединения или соединений в течение 2 недель или дольше. Соединения могут быть стерилизованы, например, фильтрацией через задерживающий бактерии фильтр или добавлением стерилизующих веществ в форме стерильных твердых составов, которые могут быть растворены в стерильной воде, или другой стерильной инъецируемой среде непосредственно перед применением.
«Жидкая лекарственная форма» означает форму активного соединения, которая вводится пациенту в жидкой форме, например в виде фармацевтически приемлемых эмульсий, растворов, суспензий, сиропов или эликсиров. Помимо активного соединения жидкие лекарственные формы могут содержать обычно применяемые в данной области инертные разбавители, такие как растворители, солюбилизирующие вещества и эмульгаторы.
Водные суспензии могут содержать эмульгаторы или вещества, способствующие образованию суспензии.
Фармацевтические композиции, пригодные для местного применения, - это составы в форме, допускающей местное введение пациенту. Составы могут иметь форму мазей местного применения, бальзамов, порошков, спреев и ингалянтов, гелей (на водной или спиртовой основе), кремов, обычно используемых в данной области, или быть включенными в матричную основу для применения в качестве пластыря, обеспечивающего контролируемое высвобождение соединения через кожный барьер. В форме мази активные ингредиенты могут использоваться с парафиновыми или водорастворимыми основами. В альтернативном варианте активные ингредиенты могут иметь форму крема с масляно-водной основой. Составы, предназначенные для местного применения через глаза, представляют собой глазные капли, в которых активный ингредиент растворен или взвешен в подходящем носителе, как правило, водном растворителе. Составы, предназначенные для местного применения через слизистую рта, включают лекарственные леденцы, имеющие в своем составе активный ингредиент во вкусовой добавке, как правило, сахарозе и камеди или трагаканте; пастилки, имеющие в своем составе активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и камедь; и составы для полоскания рта, имеющие в своем составе активный ингредиент в подходящем жидком носителе.
Масляная фаза эмульсионных фармацевтических композиций может быть получена обычным способом из известных ингредиентов. Эта фаза может иметь в своем составе только эмульгатор (также называемый эмульгирующим веществом), однако желательно, чтобы в нее также входил как минимум один эмульгатор, содержащий жир или масло, или эмульгатор, содержащий и жир, и масло. В конкретном осуществлении изобретения в состав включен гидрофильный эмульгатор, наряду с липофильным эмульгатором, который действует как стабилизатор. Эмульгатор(ы) вместе со стабилизатором(ами) или без него образуют эмульгирующийся воск, а вместе с маслом или жиром образуют эмульгирующуюся основу мази, которая является масляной диспергированной фазой кремовых составов.
При необходимости водная фаза кремовой основы может включать, например, не менее 30 вес.% многоатомного спирта, то есть спирта с двумя или более гидроксильными группами, например пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин или полиэтиленгликоль (в том числе PEG 400) и их смеси. Составы для местного применения могут, если нужно, иметь в своем составе соединение, стимулирующее всасывание или проникновение активного ингредиента через кожу или другие пораженные зоны.
Выбор подходящих масел или жиров для использования в композиции зависит от свойств, которые необходимо получить. Так, в особенности крем должен быть нежирным, не оставляющим пятен и смываемым продуктом подходящей консистенции, не допускающей утечки из тюбиков и других емкостей. Могут использоваться линейные и разветвленные одно- и двухосновные алкиловые эфиры, такие как диизопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь эфиров с разветвленной цепью, известная как Crodamol CAP. Они могут использоваться отдельно или в смесях, в зависимости от желаемых свойств. В качестве альтернативы могут использоваться липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин и другие минеральные масла.
Фармацевтические композиции для ректального или вагинального применения означают пресс-формы, которые допускают ректальное или вагинальное введение пациенту и которые содержат как минимум одно соединение, составляющее предмет данного изобретения. Суппозитории представляют собой одну из форм таких составов, которую можно получить смешиванием соединений, составляющих предмет данного изобретения, с подходящими нераздражающими инертными средами или носителями, например масло какао, полиэтиленгликоль или восковая основа суппозитория, которые находятся в твердом состоянии при обычных температурах, но становятся жидкими при температуре тела и поэтому плавятся при ректальном или вагинальном введении и высвобождают активный ингредиент.
Фармацевтические композиции, вводимые посредством инъекции, могут вводиться внутримышечно, внутривенно, внутрибрюшинно и/или подкожно. Композиции, составляющие предмет настоящего изобретения, готовят в жидких растворах, в частности в физиологически совместимых буферах, таких как раствор Ханка или раствор Рингера. Кроме того, композиции могут быть приготовлены в твердой форме и растворены или взвешены непосредственно перед применением. Возможны также лиофилизированные формы. Препаративные формы являются стерильными и включают эмульсии, суспензии, водные и неводные растворы для инъекций, которые могут содержать суспендирующие вещества, загустители и антиоксиданты, буферы, бактериостаты и добавки, делающие состав изотоническим, и иметь правильно подобранный уровень pH, соответствующий показателю крови пациента, которому будет вводиться препарат.
Фармацевтическими композициями, составляющими предмет настоящего изобретения, пригодными для назального или ингаляционного применения, являются фармацевтические композиции, форма которых пригодна для введения пациенту назально или ингаляционно. Композиция может содержать носитель в форме порошка с размером частиц, например, в диапазоне от 1 до 500 микрон (в том числе с размерами частиц в диапазоне от 20 до 500 микрон с шагом 5 микрон, то есть с размерами 30 микрон, 35 микрон и т.д.). К подходящим композициям с жидким носителем для применения, например, в качестве спрея или капель для носа относятся водные или масляные растворы активного ингредиента. Композиции, пригодные для аэрозольного введения, могут быть получены в соответствии с традиционными методами и вводиться другими терапевтическими веществами. Для проведения ингаляционной терапии могут использоваться дозирующие ингаляторы или любые сухие порошковые ингаляторы, такие как Eclipse, Spinhaler® или Ultrahaler®, согласно описанию в патентной заявке WO2004/026380 и в патенте US № 5176132.
Фактическая дозировка активного ингредиента(ов) в композициях, составляющих предмет данного изобретения, может варьироваться с целью получения количества активного ингредиента(ов), эффективного для получения желаемого терапевтического эффекта для определенного состава и способа его введения пациенту. Поэтому дозировка, выбираемая для каждого пациента, зависит от множества факторов, таких как желаемый терапевтический эффект, способ введения, желаемая длительность лечения, этиология и тяжесть заболевания, состояние пациента, вес, пол, диета и возраст, тип и активность каждого активного ингредиента, скорости абсорбции, метаболизм и/или выделение и других факторов.
Полная дневная доза соединения, составляющего предмет настоящего изобретения, вводимая пациенту в виде одной или нескольких доз, может составлять, например, от примерно 0,001 до примерно 100 мг/кг веса тела в день, в частности от 0,01 до 10 мг/кг/день. Например, для взрослого дозы, как правило, составляют от примерно 0,01 до примерно 100, в частности от примерно 0,01 до примерно 10, мг/кг веса тела в день при ингаляции, от примерно 0,01 до примерно 100, в частности от 0,1 до 70, желательно от 0,5 до 10, мг/кг веса тела в день при пероральном введении, и от примерно 0,01 до примерно 50, в частности от 0,01 до 10, мг/кг веса тела в день при внутривенном введении. Процентное содержание активного ингредиента в составе может быть разным, но оно должно входить в такой пропорции, чтобы обеспечивать получение оптимальной дозировки. Лекарственные формы могут содержать дольные единицы дозы, позволяющие получить желаемую дневную дозу. Очевидно, что возможно практически одновременное введение нескольких стандартных доз. Введение доз может быть настолько частым, насколько необходимо для достижения желаемого терапевтического эффекта. Некоторые пациенты могут быстро реагировать на большие или меньшие дозы, и для них может оказаться адекватной более слабая поддерживающая доза. Для других пациентов может потребоваться длительное лечение с интенсивностью от 1 до 4 доз в день в соответствии с физиологическими потребностями каждого пациента. Само собой разумеется, для других пациентов может потребоваться не более одной или двух доз в день.
Стандартные дозы составов могут быть получены любым из традиционно используемых в фармацевтике методов. Такие методы включают стадию связывания фармацевтически активного ингредиента с носителем, состоящим из одного или нескольких вспомогательных ингредиентов. Как правило, составы получают однородным и тесным связыванием активного ингредиента с жидкими носителями, или мелкозернистыми твердыми носителями, или обоими, с последующим формованием продукта, если это необходимо.
Составы могут быть в упаковках по одной дозе или по несколько доз, например в запаянных ампулах и пузырьках с эластичными пробками, и могут храниться в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Индивидуальные растворы для инъекций и суспензии могут быть приготовлены из стерильных порошков, гранул или таблеток описанных выше типов.
Соединение, составляющее предмет настоящего изобретения, может быть проанализировано при помощи следующих аналитических методов.
Жидкостная хроматография высокого давления - масс-спектрометрия (ЖХМС)
Эксперименты ЖХМС для определения времени удерживания (RT) и соответствующих масс ионов проводят с использованием следующего метода. Масс-спектры (МС) записывают на масс-спектрометре Micromass LCT. Метод включает ионизацию положительным электрораспылением и сканирование массы m/z от 100 до 1000. Жидкостную хроматографию осуществляют при помощи бинарного насоса и дегазатора Hewlett Packard 1100 Series Binary Pump & Degasser; неподвижная фаза: колонка Phenomenex Synergi 2µ Hydro-RP 20×4,0 мм, подвижная фаза: A=0,1% муравьиная кислота (FA) в воде, B=0,1% FA в ацетонитриле. Вводят объем 5 мкл при помощи системы CTC Analytical PAL. Скорость потока элюента составляет 1 мл/мин. Градиент составляет от 10% B до 90% B за 3 минуты и от 90% B до 100% B за 2 минуты. Вспомогательные детекторы: УФ-детектор Hewlett Packard 1100 Series, длина волны = 220 нм, и испарительный детектор светорассеяния (ELS) Sedere SEDEX 75, температура = 46°C, давление азота = 4 бар.
Спектры ядерного магнитного резонанса (ЯМР) 1 H
Спектры ЯМР 300 МГц 1H записывают при комнатной температуре на спектрометре Varian Mercury (300 МГц) с 5 мм датчиком ASW. В ЯМР химический сдвиг (δ) выражен в м.д. относительно тетраметилсилана. Величины химического сдвига указаны в миллионных долях (м.д.) относительно тетраметилсилана (TMS) в качестве внутреннего стандарта.
Рентгеновская порошковая дифрактометрия (РПД)
РПД-измерения проводят на дифрактометре Siemens-Bruker D5000, используя схему фокусировки по Брэггу-Брентано (тета - 2-тета). Первичную кислую фосфатную соль помещают на пластину монокристаллического кремния с поверхностью, ориентированной по кристаллографической плоскости (510). В качестве источника рентгеновского излучения используют излучение с медной мишени рентгеновской трубки (45 кВ/40 мА) на линии K-альфа меди (1,54056 ангстрем), излучение на линии Cu K-бета отфильтровывают с помощью монохроматора в отраженном пучке. В качестве детектора используют сцинцилляционный счетчик. Размеры щелей устанавливают следующими: отклоняющая щель 0,6 мм, предотвращающая рассеяние щель 0,6 мм, щель монохроматора 0,1 мм, приемная щель детектора 0,6 мм. Рентгенограммы записывают в следующих условиях: сканирование в интервале 2-40 градусов (угол 2-тета) со временем счета на одном шаге в 1 секунду, с шагом 0,02 градуса, при нормальных температуре, давлении и относительной влажности.
Анализ сольватации/гидратации методом термогравиметрии
Термический анализ проводят с использованием совмещенного ДСК/ТГА-анализатора (дифференциальный сканирующий калориметр/термогравиметрический анализатор) TA Instruments Model Q-600 в атмосфере сухого азота. Калибровку по температуре ТГА-анализатора проводят по индиевому стандарту. Первичную кислую фосфатную соль помещают в алюминиевую кювету (номер 900793.901). Термограммы записывают при линейном нагреве со скоростью 10°C в минуту.
Дифференциальная сканирующая калориметрия (ДСК)
ДСК-анализ выполняют с помощью дифференциального сканирующего калориметра TA Instruments Model Q-1000 с системой охлаждения в атмосфере сухого азота. Для калибровки ДСК-прибора используют индиевый стандарт. Первичную кислую фосфатную соль помещают в алюминиевую кювету с крышкой, зафиксированной на кювете холодной сваркой, на крышке имеется небольшое отверстие, сформированное лазером (номера кюветы и крышки 900793.901 и 900860.901 соответственно). Термограмму ДСК записывают при линейном нагреве со скоростью 10°C в минуту.
Микрофотографии
Получение микрофотографий производят с помощью микроскопа Olympus BX-41 с перекрестной поляризацией. Образцы приготавливают посредством диспергирования в минеральном масле.
Распределение частиц по размерам
Распределение частиц по размерам измеряют с помощью лазерного дифракционного анализатора размеров частиц Sympatec HELOS-BF с измерительной линзой R3, диспергатором сухих порошков RODOS и на длине волны лазера 632,8 нм. Калибровку системы проводят с использованием стандартов карбида кремния. Порошок диспергируют с помощью диспергирующего устройства RODOS для сухих порошков при исходном давлении 3,0 бар и при максимальном снижении давления. Распределение частиц по размерам, исходя из их объема, рассчитывают по методу Фраунгофера с помощью программного обеспечения Sympatec Windox (Version 4.0).
Динамическая сорбция водяного пара (ДСВП)
Профиль сорбции воды определяют с помощью анализатора динамической сорбции водяного пара, модель DVS-1 (SMS Instruments) или SGA-100 (VTI Instruments). Калибровку по относительной влажности и весу выполняют с использованием соответствующих стандартов. Перед проведением эксперимента первичную кислую фосфатную соль помещают в прибор и сушат при относительной влажности ≤1% в течение 2,5 часов. Относительную влажность ступенчато увеличивают от приблизительно 0 до 95%. Предполагается, что вес образца на каждой стадии не изменяется, если в течение 5 минут относительное изменение массы составляет менее 0,005% при минимальном времени установления равновесия 15 минут.
Инфракрасная спектроскопия с Фурье-преобразованием
ИК Фурье-спектры записывают с помощью спектрометра Nicolet Magna-IR Spectrometer 55, сопряженного с ИК-микроскопом Nicolet Nic-Plan. Исследуемый твердый образец помещают на диск KBr. Каждый спектр записывают после 32-кратного сканирования в диапазоне 4000-400 см-1 с разрешением 4 см-1.
Ниже иллюстрируются способ приготовления и свойства соединения, составляющего предмет данного изобретения.
ПРИМЕР
Первичная кислая фосфатная соль 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты
Стадия 1. Раствор 4,6-дихлор-2-метоксипиримидина (0,7 г), 2,4-дихлорфенэтиламина (0,82 г) и гидрокарбоната натрия (0,88 г) в этаноле (25 мл) нагревали при 80°C в течение трех часов и вливали в 400 мл воды. Образовавшуюся твердую фазу отфильтровывали и сушили на воздухе, получив (6-хлор-2-метоксипиримидин-4-ил)-[2-(2,4-дихлорфенил)этил]амин.
Стадия 2. К раствору диизопропиламида лития в смеси тетрагидрофуран/н-гептан/этилбензол (1,8 М, 17 мл) при 0°C по каплям в течение 15 минут добавляли раствор 2-(3-бромфенил)пропионовой кислоты (3 г, 13,9 ммоль) в тетрагидрофуране (5 мл). Полученную смесь перемешивали в течение 1 часа, после чего по каплям в течение 10 минут добавляли йодистый метил (4,93 г, 34,8 ммоль) в тетрагидрофуране (5 мл). Реакционную смесь перемешивали в течение 15 часов, гасили 2 N HCl, концентрировали в вакууме и разбавляли диэтиловым эфиром (150 мл). Слой эфира промывали 2 N HCl и три раза экстрагировали 2 N NaOH (50 мл). Объединенные слои NaOH окисляли 6 N HCl до pH 1 и экстрагировали три раза диэтиловым эфиром (75 мл). Объединенные органические слои промывали рассолом, сушили над сульфатом натрия и концентрировали с получением твердой 2-(3-бромфенил)-2-метилпропионовой кислоты (3,08 г, 91%), которая использовалась без дополнительной очистки. ЖХ/МС: 243 (M+H).
Стадия 3. К раствору 2-(3-бромфенил)-2-метилпропионовой кислоты (2,18 ммоль) в безводном эфире (20 мл) по каплям добавляли трет-бутил лития (1,7 M раствор в пентане, 5,4 мл, 9,16 ммоль) при -78°C, полученную смесь перемешивали в течение 30 минут и обрабатывали трибутилборатом (2,34 мл, 8,72 ммоль). Реакционной смеси давали нагреться до комнатной температуры, затем ее перемешивали в течение 15 часов, разбавляли эфиром и гасили 1 M H3PO4. После перемешивания в течение 30 минут отделяли слой эфира и экстрагировали три раза 2 N NaOH (20 мл). Объединенные экстракты NaOH окисляли 6 N HCl до pH 1 и экстрагировали три раза диэтиловым эфиром (50 мл). Объединенные органические экстракты промывали рассолом, сушили над сульфатом натрия и концентрировали с получением 3-(1-карбокси-1-метилэтил)фенилбороновой кислоты, которая использовалась без дополнительной очистки. МС: 209 (M+H).
Стадия 4. Раствор (6-хлор-2-метоксипиримидин-4-ил)-[2-(2,4-дихлорфенил)этил]амина (0,51 ммоль) и 3-(1-карбокси-1-метилэтил)фенилбороновой кислоты (0,61 ммоль) в ацетонитриле (2,5 мл) и водном растворе карбоната натрия (0,4 M, 2,5 мл) дегазировали с продувкой азотом в течение 5 минут, после чего к нему добавляли тетракис(трифенилфосфин)палладий(0) (29,5 мг, 5 мол.%). Реакционный сосуд герметизировали и нагревали в микроволновой печи до 130°C в течение 30 минут. К реакционной смеси добавляли 2 мл воды, затем, используя 2 N водный раствор HCl, устанавливали pH, приблизительно равный 7, после этого смесь экстрагировали три раза этилацетатом (30 мл). Объединенные экстракты промывали рассолом, сушили над сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением твердой 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты (205 мг, 75%). ЖХ/МС: RT=2,39 мин, МС: 460 (M+H); 1H ЯМР [300 МГц, (CD3)2SO]: δ 12,38 (1H, с), 7,36-8,00 (7H, м), 6,58 (1H, с), 3,84 (3H, с), 3,58 (2H, м), 2,98 (2H, м), 1,54 (6H, с).
Стадия 5. Фосфорную кислоту (3,21 мл, 1,49 N водный раствор) добавляли к раствору 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты (2,1 г, 4,56 ммоль) в тетрагидрофуране (45 мл), полученную смесь перемешивали в течение 10 минут. Затем по каплям постепенно добавляли воду до тех пор, пока смесь не превратилась в прозрачный раствор, после этого продолжали перемешивание в течение 1,5 часов при комнатной температуре. Смесь концентрировали в вакууме, остаток перекристаллизовывали из ацетона с получением дигидрогенфосфатной соли 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты в виде порошка (2,4 г, 94%). ЖХ/МС: RT=2,41 мин; МС: 462 (М+Н); 1H ЯМР [300 МГц, (CD3SO)2SO]: δ 7,95 (1Н, ушир.), 7,8 (1Н, ушир.), 7,6 (2Н, ушир.), 7,45 (2Н, ушир., J=2 Гц), 7,35 (2Н, с), 6,55 (1Н, с), 3,85 (3Н, с), 3,55 (2Н, ушир.), 2,95 (2Н, т, J=2 Гц), 1,5 (6H, с).
Фармакологический анализ
Ингибиторное действие соединения, составляющего предмет настоящего изобретения, оценивают при помощи функционального анализа на DP человека. Применяется анализ цАМФ с использованием линии клеток человека LS174T, экспрессирующих эндогенный рецептор DP. Протокол аналогичен описанному ранее (Wright D.H., Ford-Hutchinson A.W., Chadee K., Metiers K.M., The human prostanoid DP receptor stimulates mucin secretion in LS174T cells, Br. J. Pharmacol. 131(8); 1537-45 (2000)).
Протокол SPA-анализа цАМФ в клетках LS174 T человека
Материалы
- PGD2 (Cayman Chemical, кат. № 12010)
- IBMX (Sigma кат. № 5879)
- Система прямого скринингового SPA-анализа цАМФ (код Amersham RPA 559)
- 96-луночные планшеты для клеточных культур (Wallac кат. № 1450-516)
- Сцинтилляционный счетчик Wallac 1450 Microplate Trilux (PerkinElmer)
- Приспособления для герметизации планшет
- Центрифужные пробирки Eppendorf
- Физраствор в фосфатном буфере (PBS) Дульбекко (Invitrogen кат. № 14040-133)
- Дистиллированная вода
- Встряхиватель
- Магнитная мешалка и набор якорей
Подготовка реагентов:
Перед разбавлением все реагенты должны быть доведены до комнатной температуры.
Аналитический буфер 1X
Перенесите содержимое бутылки в 500-мл мензурку многократным промыванием дистиллированной водой. Доведите полный объем до 500 мл, добавив дистиллированную воду, и тщательно перемешайте.
Лизирующий реагент 1 & 2
Растворите каждый из лизирующих реагентов 1 и 2 в 200 мл аналитического буфера соответственно. Оставьте на 20 минут при комнатной температуре для растворения.
Гранулы антител кролика для SPA-анализа
Добавьте в бутылку 30 мл лизирующего буфера 2. Осторожно встряхивайте бутылку в течение 5 минут.
Иммунная сыворотка
Добавьте 15 мл лизирующего буфера 2 в каждый сосуд и осторожно перемешивайте содержимое до полного растворения.
Индикатор (I 125 -цАМФ)
Добавьте 14 мл лизирующего буфера 2 в каждый сосуд и осторожно перемешивайте содержимое до полного растворения.
Подготовка иммунореагента
1) Добавьте равные объемы индикатора, иммунной сыворотки и SPA-реагента антител кролика в сосуд, проследив за тем, чтобы был приготовлен достаточный объем для нужного количества лунок (150 мкл на лунку).
2) Тщательно перемешайте.
3) Необходимо готовить свежий раствор иммунореагента перед каждым анализом и не использовать его повторно.
Стандарт
1) Добавьте 1 мл лизирующего буфера 1 и осторожно перемешивайте содержимое до полного растворения.
2) Конечный раствор содержит цАМФ в концентрации 512 пмоль/мл.
3) Пометьте 7 полипропиленовых или полистирольных пробирок «0,2 пмоль», «0,4 пмоль», «0,8 пмоль», «1,6 пмоль», «3,2 пмоль», «6,4 пмоль» и «12,8 пмоль».
4) Пипеткой добавьте 500 мкл лизирующего буфера 1 во все пробирки.
5) В пробирку «12,8 пмоль» добавьте пипеткой 500 мкл стандартной смеси (512 пмоль/мл) и тщательно перемешайте. Перенесите 500 мкл из пробирки «12,8 пмоль» в пробирку «6,4 пмоль» и тщательно перемешайте. Повторите процедуру разбавления вдвое с остальными пробирками.
6) Порции по 50 мкл в двух экземплярах из каждого последовательного разбавления и стандарт исходного раствора позволят получить 8 стандартных уровней цАМФ в диапазоне от 0,2 до 25,6 пмоль.
Буфер разбавления соединения
Добавьте 50 мкл 1 мМ IBMX в 100 мл PBS, чтобы получить конечную концентрацию 100 мкМ, и обрабатывайте ультразвуком при 30°C в течение 20 минут.
Подготовка PGD2
Растворите 1 мг PGD2 (FW, 352,5) в 284 мкл DMSO, чтобы получить исходный раствор 10 мМ, и храните его при 20°C. Перед каждым анализом необходимо готовить свежий раствор. Добавьте 3 мкл 10 мМ исходного раствора в 20 мл DMSO, тщательно перемешайте и перенесите 10 мл в 40 мл PBS.
Разбавление соединения
Несколько образцов соединения, составляющего предмет настоящего изобретения, тестируют в 96-луночном планшете. Каждый образец соединения занимает один ряд 96-луночного планшета.
Разбавление соединения проводят в Biomex 2000 (Beckman) при помощи метода 11 точек 1_цАМФ DP.
5 мкл каждого соединения из 10 мМ планшет стандартных растворов соединения переносят в лунки 96-луночной планшеты, как указано ниже.
Наполните планшет 45 мкл DMSO, кроме колонки 7, куда добавляют 28 мкл DMSO. Тщательно отмерьте пипеткой содержимое колонки 1 и перенесите 12 мкл параллельно в колонку 7. Выполните последовательное разбавление 1:10 от колонки 1 к колонке 6 и от колонке 7 к колонке 11, перенося от 5 мкл до 45 мкл DMSO, чтобы получить следующие концентрации:
Добавьте в новый 96-луночный планшет 247,5 мкл буфера разбавления соединения. Перенесите 2,5 мкл последовательно разбавленных соединений из приготовленного выше планшета в новый (разбавление 1:100) следующим образом:
Рост клеток
1. LS174 T всегда выращивают в MEM (ATCC кат. № 30-2003), 10% FBS (ATCC кат. № 30-2020) и дополнительных 2 мМ L-глутамина, при 37°C и 5% CO2.
2. Нагрейте 0,05% трипсина и версина (Invitrogen кат. № 25300-054) при 37°C на водяной бане.
3. Удалите среду для роста из клеток. Клетки в колбе T165 дважды промойте 4 мл трипсина, а затем инкубируйте при 37°C и 5% CO2 в течение 3 минут.
4. Добавьте 10 мл среды и пипеткой тщательно отделите и пересчитайте клетки.
5. Доведите плотность клеток до 2,25×105 клеток на мл и посейте 200 мкл клеток на лунку (45000 клеток на лунку) в 96-луночном планшете за 1 день до анализа.
Порядок проведения анализа
ДЕНЬ 1
Посейте 45000 клеток на лунку в 200 мкл среды в 96-луночных планшетах. Инкубируйте планшеты с клетками при 37°C, 5% CO2 и 95% влажности в течение ночи.
ДЕНЬ 2
1. Выполните разбавление соединения.
2. Приготовьте аналитический буфер, лизирующие буферы 1 и 2, PGD2 и стандарт.
3. Удалите среду из клеток отсасыванием и добавьте 100 мкл раствора соединения, следуя протоколу цАМФ DP Zymark Sciclone-ALH/FD.
4. Инкубируйте клетки при 37°C, 5% CO2 и 95% влажности в течение 15 минут.
5. Добавьте 5 мкл 300 нМ PGD2 (20×15 нМ конечной концентрации) в каждую лунку при помощи протокола Zymark цАМФ DP PGD2 и инкубируйте клетки при 37°C, 5% CO2 и 95% влажности еще 15 минут.
6. Удалите среду из клеток отсасыванием и добавьте 50 мкл лизирующего буфера 1, следуя протоколу Zymark цАМФ DP лизиса, и инкубируйте при комнатной температуре со встряхиванием в течение 30 минут.
7. Добавьте в лунки 150 мкл иммунореагента (полный объем 200 мкл на лунку).
8. Герметизируйте планшет, встряхивайте в течение 2 минут и поместите в камеру сцинтилляционного счетчика для микротитровальных планшет Wallac на 16 часов.
ДЕНЬ 3
Считайте количество [125I] цАМФ в течение 2 минут в сцинтилляционном счетчике 1450 Trilux.
Обработка данных
Отложите стандартную зависимость цАМФ от количества импульсов в минуту.
Типичные данные анализа для стандарта
Концентрации цАМФ (пмоль/мл) неизвестных образцов вычисляют по стандартной зависимости цАМФ от количества импульсов в минуту. Процент ингибирования вычисляют по следующей формуле:

Результаты
Первичная кислая фосфатная соль дает 50-процентное ингибирование в SPA-анализе цАМФ в T-клетках LS174 человека при концентрации 0,3 нМ.
Первичная кислая фосфатная соль имеет более высокую растворимость в воде по сравнению со свободной формой и хлористоводородной солью. Ниже приведены растворимости свободной формы, хлористоводородной соли и первичной кислой фосфатной соли при 25°C в фосфатном буфере (PBS pH 7,4, смесь 19% 0,1M раствора первичного кислого фосфата натрия и 81% 0,1M раствора вторичного кислого фосфата натрия) и растворимости свободной формы и первичной кислой фосфатной соли при 37°C в модельном кишечном соке в условиях голодания (“FaSSIF”, приготавливают методом, описанным в работе Dressman J.B., Amidon G.L., Reppas C. and Shah V.P., Dissolution testing as a prognostic tool for oral drug absorption: immediate release dosage forms, Pharmaceutical Research: 1998, Vol.15, № 1, 11-22).
Оказалось, что первичная кислая фосфатная соль обладает рядом полезных свойств, которые могут найти применение при серийном производстве и приготовлении лекарственных средств. Во-первых, первичная кислая фосфатная соль имеет высокую степень кристалличности. На порошковой рентгенограмме первичной кислой фосфатной соли, представленной на фиг.1, пики имеют среднюю интенсивность и разрешение. Отсутствие гало на среднем участке значений 2-тета свидетельствует об отсутствии или малом содержании аморфной фазы. Помимо этого, микрофотографии, сделанные до и после измельчения первичной кислой фосфатной соли, представленные на фиг.8, свидетельствуют о значительном уменьшении размера частиц и неизменности физико-химических свойств в результате измельчения.
Тем не менее, натриевая соль имеет низкую степень кристалличности. Как видно из порошковой рентгенограммы, приведенной на фиг.11, полученной для образца 2 натриевой соли, пики уширены и имеют низкие интенсивности, что свидетельствует о слабой кристалличности. Порошковая рентгенограмма для образца 1 натриевой соли демонстрирует, что вещество находится в основном в аморфной форме. Кроме того, присутствие гало на рентгенограммах обоих образцов на среднем участке значений 2-тета указывает на очень слабую кристалличность вещества.
Кроме того, показано, что первичная кислая фосфатная соль существует только в одной полиморфной форме. Однако хлористоводородная соль, как было показано, существует в трех полиморфных формах, которые при определенных условиях могут взаимно превращаться одна в другую. Одна из полиморфных форм хлористоводородной соли (см. рентгенограмму для образца 2 на фиг.12) слабокристаллична, так как пики на рентгенограмме широкие и имеют низкую интенсивность. Другая из полиморфных форм хлористоводородной соли (см. рентгенограмму для образца 1 на фиг.12) имеет хорошую кристалличность.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЕ АМИНОПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРОВ ПРОСТАГЛАНДИНА D2 | 2007 |
|
RU2431631C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ АНТАГОНИСТОВ CRTH2 | 2009 |
|
RU2503672C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ | 2006 |
|
RU2426733C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ CRTH2 РЕЦЕПТОРА | 2008 |
|
RU2451019C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛОКСАДИАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PGDS | 2010 |
|
RU2572608C2 |
| АМИНОВЫЕ СОЛИ АНТАГОНИСТА CRTH2 | 2008 |
|
RU2468013C2 |
| АНТАГОНИСТ DP | 2019 |
|
RU2803243C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ CRTH2 В ТЕРАПИИ | 2004 |
|
RU2412934C2 |
| СОЕДИНЕНИЯ ФЕНИЛУКСУСНОЙ КИСЛОТЫ | 2008 |
|
RU2470926C2 |







Настоящее изобретение относится к новой кислой дигидрогенфосфатной соли 2-(3-{6-[2-(2,4-дихлорфенил)этиламино]-2-метоксипиримидин-4-ил}фенил)-2-метилпропионовой кислоты формулы (III)
возможно в кристаллической форме, обладающей свойствами ингибитора цАМФ. Соединение может найти применение для лечения заболеваний, связанных с клеточной экспрессией простагландина D2 при таких заболеваниях, как аллергический ринит, бронхиальная астма, аллергический конъюктивит и др. Изобретение также относится к фармацевтической композиции. 1 н. и 2 з.п. ф-лы, 12 ил., 1 табл.
1. Соединение формулы (III)
2. Соединение по п.1 в кристаллической форме.
3. Фармацевтическая композиция, обладающая свойствами ингибитора цАМФ, включающая фармацевтически эффективное количество соединения по п.1, в смеси с фармацевтически приемлемым носителем.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ получения производных пиримидина или их солей | 1986 |
|
SU1574171A3 |
Авторы
Даты
2011-05-27—Публикация
2006-10-12—Подача