Настоящее изобретение касается ряда 6-амино-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-онов. Более конкретно, оно касается ряда 6-(арил-1-метилалкил)амино-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-онов. Соединения действуют как агонисты адренергических бета-2-рецепторов и могут быть использованы в качестве анаболических агентов для скота.
ПРЕДПОСЫЛКИ
Основной задачей в животноводческом производстве остается эффективность, достигаемая оптимизацией конверсии корма в нежирное мясо. Корм составляет высокую долю общих экономических вложений на финальных стадиях животноводства, и следовательно, имеется постоянная потребность в агентах, которые повышают коэффициент конверсии корма (FCR). Наиболее эффективным путем повышения FCR являются метаболические манипуляции с целью повышения потенциала животных по отложению мышечного белка, что также обеспечивает очевидные преимущества в получаемом качестве и составе мясной туши.
Один подход к получению высококачественного мяса и увеличению производства мяса включает введение агентов, которые являются бета-2-блокаторами. Примерами агентов, зарегистрированных для такого применения у скота, являются Zilmax™ (зилпатерол) и Optaflexx™ (рактопамин). Зилпатерол представляет собой (±)-транс-6-(изопропиламино)-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он. Зилпатерол и схожие с ним аналоги впервые были раскрыты в FR 2534257 и позже обсуждалось их применение в качестве пищевых добавок животным в FR 2608046 и EP 272976. Рактопамин представляет собой (±)-4-(3-{[2-гидрокси-2-(4-гидроксифенил)этил]амино}бутил)фенол и был впервые открыт исследователями van Dijk и Moed (Recl. Trav. Chim. Pays Bas, 1973, 92, 1281-1279). Его применение в качестве пищевой добавки описано в GB 2133986. Оба вещества, зилпатерол и рактопамин, вводятся на последних стадиях жизни продуктивных животных и вызывают активацию биологического каскадного механизма, стартующего с взаимодействия по адренергическому бета-2-рецептору, который промотирует и усиливает рост мышечной массы. Недавно в US-6841563 раскрыт ряд арилоксипропаноламинов для повышения производительности животноводства.
Существует постоянная потребность в альтернативных бета-2-блокаторах для применения в качестве агентов, повышающих производство мяса у скота и, в особенности, в агонистах с улучшенными свойствами. По причинам экономии агент предпочтительно должен обеспечивать желательное повышение производства мяса при низкой дозе. Он также должен не давать каких-либо нежелательных эффектов у рассматриваемого животного. В конечном счете, продуцируемое животным мясо должно быть безопасным для употребления человеком, это предполагает, что в мясе должны быть минимизированы остаточные уровни реагента. Следовательно, идеальный агент будет иметь высокую афинность к адренергическим бета-2-рецепторам животных заданного вида и являться вполне эффективным их агонистом. Он должен иметь высокую степень селективности относительно этого рецептора и быстро выводиться из организма животного, чтобы минимизировать присутствие остатков в мясе без необходимости продолжительного периода выведения. Нулевой период выведения обеспечивает фермеру максимальное экономическое преимущество. Таким образом, целью данного изобретения является получение соединений, которые обладают высокой афинностью, селективностью, агонистической эффективностью и/или активностью к адренергическим бета-2-рецепторам животных, важных для животноводства, и/или которые быстро выводятся из организма животного метаболическим путем.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение касается соединения формулы (I)
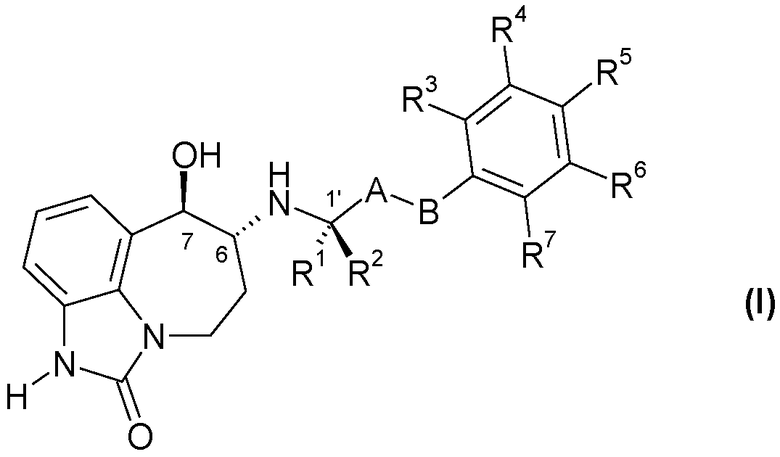
или его фармацевтически приемлемой соли, где:
A представляет собой -CH2-; и
B представляет собой -CH2-, -C(CH3)2-, -O-, -CH2-CH2-, -CH2-O- или -O-CH2-; или
-A-B- представляет собой -CH=CH-;
один из R1 и R2 представляет собой CH3 и другой представляет собой H;
R3, R4, R5, R6 и R7, каждый независимо выбран из H, R8 и R9; или
R4 и R5 вместе представляют собой -O-CH2-CH2-, -CH2-CH2-O- или -O-CH2-O-, и R3, R6 и R7, каждый независимо выбран из H, R8 и R9;
R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, -CH2OH, -O-(C1-C4 алкил), -O-CH2-(C3-C5)циклоалкил, -CO2H, -CO2(C1-C4 алкил), -CONH2, -CONH(C1-C4 алкил), -CONH(C1-C4 галогеналкил), -CONH(C3-C6 циклоалкил) или NH2; и
R9 представляет собой -OH, -NHSO2(C1-C3 алкил), -NHCO(C1-C4 алкил), -NHCO(C1-C4 галогеналкил), -NHSO2(C1-C3 галогеналкил) или -NHSO2(фенил).
В другом аспекте настоящее изобретение касается пищевой добавки для сельскохозяйственного животного, содержащей соединение формулы (I) или его фармацевтически приемлемую соль.
В еще одном аспекте настоящее изобретение касается способа повышения мясной продуктивности или качества мяса у сельскохозяйственного животного, включающего введение указанному сельскохозяйственному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение касается применения соединения формулы (I) или его фармацевтически приемлемой соли в качестве лекарственного средства.
В еще одном аспекте настоящее изобретение касается фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для целей настоящего описания используются следующие определения.
“Алкил” означает насыщенный моновалентный углеводородный радикал CnH2n+1, который может быть линейным или разветвленным. C1-C4 алкил включает метил, этил, н-пропил, изопропил (1-метилэтил), н-бутил, втор-бутил (1-метилпропил), изобутил (2-метилпропил) и трет-бутил (1,1-диметилэтил).
“Циклоалкил” означает насыщенный моновалентный моноциклический или мостиковый или сконденсированный полициклический углеводородный радикал. C3-C5 циклоалкил включает циклопропил, циклобутил и циклопентил.
“Галоген” включает фтор, хлор, бром и йод.
“Галогеналкил” означает алкильную группу, которая определена выше, где один или более атомов водорода замещены атомами галогенов, выбранными из фтора, хлора, брома и йода. Если группа содержит более одного атома галогена, то эти атомы могут быть одинаковыми или различными. Галогеналкил включает пергалогеналкил, т.е. алкильную группу, в которой все атомы водорода замещены атомами галогенов. C1-C4 галогеналкильные группы включают фторметил, дифторметил, трифторметил, хлордифторметил, 2-бромэтил, 2,2,2-трифторэтил, 3-йодпропил и 2,2,2-трихлор-1,1-диметилэтил.
Соединения формулы (I) имеют в структурной формуле три асимметричных атома углерода (хиральных центра), помеченных 1′, 6 и 7. Некоторые варианты заместителей от R3 до R7 могут включать дополнительные хиральные центры. Если не указано по-другому, формула (I) изображает относительную стереохимию на трех центрах: C-1′, C-6 и C-7. Предполагается, что изображение формулы (I) не следует принимать как выражение абсолютной стереохимии на этих центрах. Следовательно, настоящее изобретение включает индивидуальные энантиомеры соединений формулы (I) и их смесей, включая рацематы. Если имеется дополнительный хиральный центр в заместителе, то изобретение включает диастереомерные смеси, а также индивидуальные стереоизомеры.
Соединения формулы (I), в которых -A-B- представляет собой -CH=CH-, могут существовать в виде геометрических изомеров. Если не указано по-другому, данное изображение не предполагает конкретной геометрии. Следовательно, настоящее изобретение включает такие соединения в виде цис- (Z-) или транс- (E-) конфигурации, а также смеси этих геометрических изомеров.
Некоторые соединения формулы (I) могут существовать в более чем одной таутомерной форме. Настоящее изобретение включает все такие таутомеры, а также их смеси.
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения формулы (I), в которых один или более атомов замещены атомами, имеющими те же атомные номера, но атомную массу или массовый номер, отличный от атомной массы или массового номера, преобладающего в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Некоторые изотопно-меченные соединения формулы (I), например, соединения, включающие радиоактивный изотоп, полезны при исследованиях распределения лекарственных средств и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3H, и углерод-14, т.е. 14C, являются особенно полезными для этих целей ввиду простоты их включения и состояния готовности к детекции.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечить некоторые терапевтические преимущества в результате большей метаболической стабильности, например, увеличенный период полураспада in vivo или требование пониженной дозы и, следовательно, может быть предпочтительным в некоторых обстоятельствах.
Замещение позитрон-излучающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным при исследованиях методом позитронной эмиссионной топографии (PET) с целью изучения занятости рецепторов субстратом.
Изотопно-меченные соединения формулы (I) обычно можно получить по обычным методикам, известным специалистам в данной области, или способами, аналогичными способам, описанным в сопутствующих примерах и получениях, используя подходящий изотопно-меченный реагент вместо применяемого ранее немеченого реагента.
Соединения формулы (I) способны образовывать аддитивные соли с кислотами. Некоторые соединения формулы (I), которые имеют кислотную функциональную группу, способны образовывать соли с подходящими основаниями. Такие соли включены в область настоящего изобретения в той степени, в которой они приемлемы для ветеринарного или фармацевтического применения.
Подходящие аддитивные соли кислот получают из кислот, которые образуют нетоксичные соли. Примеры включают следующие соли: ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, хибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглютамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат.
Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка.
Могут также образовываться полусоли кислот и оснований, например, полусульфаты и полукальциевые соли.
Обзор подходящих солей смотрите в Handbook of Pharmaceutical Salts: Properties, Selection, and Use, Stahl and Wermuth (Wiley-VCH, 2002).
Фармацевтически приемлемые соли соединений формулы (I) можно получить одним или несколькими из следующих трех способов:
(i) взаимодействие соединения формулы (I) с заданной кислотой или основанием;
(ii) удаление кислото- или основно-лабильной защитной группы из подходящего предшественника соединения формулы (I) или открытие цикла подходящего циклического предшественника, например, лактона или лактама, с использованием заданной кислоты или основания; или
(iii) преобразование одной соли соединения формулы (I) в другую соль посредством взаимодействия с подходящей кислотой или основанием или при использовании подходящей ионообменной колонны.
Все три реакции обычно проводят в растворе. Результирующую соль можно осадить и собрать фильтрованием или можно выделить при выпаривании растворителя.
Соединения формулы (I) и их соли могут существовать в разнообразных твердых состояниях: от полностью аморфных до полностью кристаллических. Термин «аморфный» относится к состоянию, при котором материал не имеет дальнего порядка на молекулярном уровне и в зависимости от температуры может демонстрировать физические свойства твердого вещества или жидкости. Обычно такие материалы не дают характеристических картин рентгеновской дифракции и, демонстрируя свойства твердого вещества, более формально описываются как жидкости. При нагревании происходит изменение свойств от свойств твердого вещества до свойств жидкого вещества, что обычно характеризуется фазовым переходом второго рода («стеклование»). Термин «кристаллический» относится к твердой фазе, в которой материал имеет регулярную внутреннюю структуру на молекулярном уровне и дает характеристическую картину рентгеновской дифракции с определенными пиками. Такие материалы при достаточном нагревании также демонстрируют свойства жидкости, но изменение от твердого состояния к жидкому обычно характеризуется фазовым переходом первого рода («точка плавления»).
Соединения формулы (I) и их соли могут также существовать в несольватированном и сольватированном виде. Термин «сольват» используют здесь для описания молекулярного комплекса, включающего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например, этанола. Термин «гидрат» применяют, если указанный растворитель является водой.
Принятая в настоящее время система классификации органических гидратов представляет собой систему, которая определяет гидраты, координированные по изолированным местам, в каналах или по иону металла - смотрите Polymorphism in Pharmaceutical Solids, K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Гидраты на изолированных местах представляют собой гидраты, в которых молекулы воды не имеют прямого контакта друг с другом и отделены находящимися между ними органическими молекулами. В гидратах в каналах молекулы воды лежат в каналах решетки, где они располагаются рядом с другими молекулами воды. В гидратах с координированными ионами металлов молекулы воды связаны с ионом металла.
Если растворитель или вода связаны прочно, комплекс будет иметь четко определяемую стехиометрию, независимо от влажности. Однако, если растворитель или вода связаны слабо, как в сольватах в каналах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях нестехиометрия является нормой.
Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, в которых растворитель кристаллизации может быть изотопно замещенным, например, D2O, d6-ацетон, d6-ДМСО.
В область изобретения включены также многокомпонентные комплексы (отличные от солей и сольватов), в которых лекарственное средство и по меньшей мере один другой компонент присутствуют в стехиометрических или нестехиометрических количествах. Комплексы этого типа включают клатраты (комплексы включения лекарственное средство-хозяин) и сокристаллы. Последние обычно определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны вместе посредством нековалентных взаимодействий, но также может быть комплекс нейтральной молекулы с солью. Сокристаллы можно получить кристаллизацией расплава, перекристаллизацией из растворителей или физическим перемалыванием компонентов вместе - смотрите Chem Commun, 17, 1889-1896, O. Almarsson and M. J. Zaworotko (2004). Общий обзор многокомпонентных комплексов смотрите в J Pharm Sci, 64 (8), 1269-1288, Haleblian (август 1975 г.).
При воздействии подходящих условий соединения формулы (I) и их соли также могут существовать в мезоморфном состоянии (мезофаза или жидкий кристалл). Мезоморфное состояние является промежуточным между истинным кристаллическим состоянием и истинным жидким состоянием (расплавом или раствором). Мезоморфизм, появляющийся в результате изменения температуры, описывают как «термотропный», и мезоморфизм, появляющийся в результате добавления второго компонента, такого как вода или другой растворитель, описывают как «лиотропный». Соединения, которые имеют возможность образовывать лиотропные мезофазы, описываются как «амфифильные» и содержат молекулы, которые имеют ионную (например, -COO-Na+, -COO-K+ или -SO3 -Na+) или неионную (например, -N-N+(CH3)3) полярную головную группу. Более подробную информацию смотрите в Crystals and the Polarizing Microscope, N. H. Hartshorne и A. Stuart, 4th Edition (Edward Arnold, 1970).
Здесь далее все ссылки на соединения формулы (I) включают ссылки на их соли, сольваты, многокомпонентные комплексы и жидкие кристаллы и сольваты, многокомпонентные комплексы и жидкие кристаллы их солей.
Настоящее изобретение также включает так называемые «пролекарства» соединений формулы (I). Таким образом, некоторые производные соединений формулы (I), которые сами по себе могут иметь низкую фармакологическую активность или не обладать таковой вовсе, при введении внутрь или применении на теле могут превращаться в соединения формулы (I), обладающие желательной активностью, например, посредством гидролитического расщепления. Такие производные обозначают как «пролекарства». Дополнительную информацию по применению пролекарств можно найти в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (Ed. E. B. Roche, American Pharmaceutical Association).
В соответствии с изобретением пролекарства можно получить, например, замещая подходящие функциональные возможности, присутствующие в соединении формулы I, определенными фрагментами, известными специалистам в данной области как «профрагменты», которые описаны, например, в Design of Prodrugs, H. Bundgaard (Elsevier, 1985).
Примеры пролекарств в соответствии с изобретением включают:
(i) производные C-7 гидроксильной функции, такие как сложные эфиры и ацилоксиметиловые простые эфиры, где атом водорода гидроксильной группы замещен ацильной группой, такие как (C1-C6 алкил)CO- или (необязательно замещенный арил)CO-, или ацилоксиметильной группой, такие как (C1-C6 алкил)CO2CH2-; и
(ii) производные C-6 вторичной аминной функции, такие как амиды и карбаматы, в которых атом водорода аминогруппы замещен ацильной группой, такие как (C1-C6 алкил)CO-, или алкилоксикарбонильной группой, такие как (C1-C6 алкил)OCO-.
Некоторые варианты радикалов с R3 по R7 также могут быть ответственны за образование пролекарства.
В еще одном аспекте настоящее изобретение касается способов получения соединения формулы (I) или его соли, приемлемой с точки зрения фармацевтики, ветеринарии или сельского хозяйства, или его сольвата, приемлемого с точки зрения фармацевтики, ветеринарии или сельского хозяйства (включая гидрат) любого состава, как проиллюстрировано ниже.
Специалистам в данной области понятно, что во время синтеза соединений по изобретению может потребоваться введение и снятие защиты чувствительных функциональных групп. Этого можно достичь общеизвестными способами, например, как описано в “Protective Groups in Organic Synthesis”, T.W. Greene и P.G.M. Wuts, John Wiley & Sons Inc (1999), и приведенных в ней ссылках.
Следующие способы являются иллюстрациями общих синтетических методик, которые можно принять для получения соединений по изобретению.
Если один или более из R3, R4, R5, R6 и R7 содержат реакционноспособные функциональные группы, то во время синтеза соединений формулы (I) можно обеспечить дополнительную защиту согласно стандартным методикам. В описанных ниже способах для всех синтетических предшественников, используемых при синтезе соединений формулы (I), предполагается, что определения R3, R4, R5, R6 и R7 (где R3, R4, R5, R6 и R7 являются такими, как описано для формулы (I)) необязательно включают подходящим образом защищенные варианты P3, P4, P5, P6 и P7. Такие подходящие защитные группы для этих функциональных возможностей описаны в перечисленных ниже ссылках, и как специально подразумевается, применение этих защитных групп, где необходимо, включено в область способов, описанных в настоящем изобретении для получения соединений формулы (I) и их предшественников. Если используются подходящие защитные группы, то для получения соединений формулы (I) требуется их удаление. Удаление защиты можно осуществить по стандартным методикам, включая методики, описанные в перечисленных ниже ссылках.
1. Получение соединений формулы (I)
1.1. Восстановительное аминирование
Соединения формулы (I) можно синтезировать способом восстановительного аминирования метилкетонов формулы (II), где R3, R4, R5, R6, R7, A и B имеют такие значения, которые определены для формулы (I), используя аминоспирт формулы (III), как показано на схеме A:
Схема A
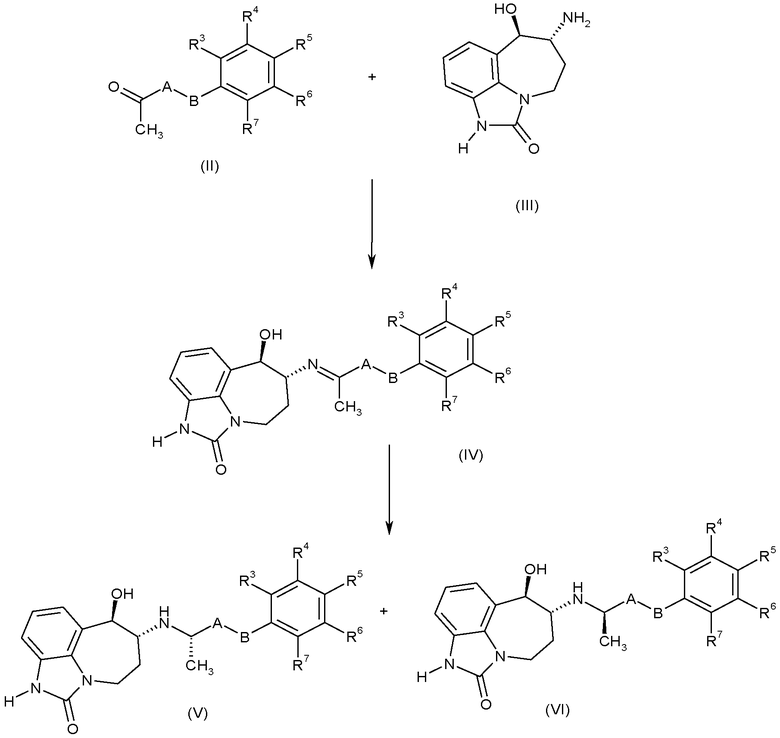
где клиновидные и пунктирные связи показывают относительную стереохимию 6-амино- и 7-гидроксизаместителей. Специалисту понятно, что для реакции восстановительного аминирования можно использовать индивидуальные энантиомеры или рацемат формулы (III).
Можно использовать разнообразные реакционные условия. Вообще, взаимодействие аминоспирта (III) с кетонами формулы (II) дает имин (IV), который можно восстановить на месте с получением соединений формулы (I). Образование имина достигается стандартными методами, например, взаимодействием аминоспирта (III) с кетонами (II) в спиртовом растворителе, предпочтительно метаноле, в присутствии основания, такого как триэтиламин или гидроксид калия. Реакционные условия можно варьировать от комнатной температуры до 50°C в течение периода от 10 минут до 60 часов, необязательно в атмосфере азота и необязательно при нагревании в микроволновой печи. Затем можно получить соединения формулы (I) воосстановлением имина на месте, обычно используя боргидрид натрия или цианоборгидрид натрия при температурах от 0 до 60°C в течение 1-60 часов, обычно в течение ночи.
Восстановление имина протекает с образованием набора диастереоселективностей, хотя предсказательных тенденций пока не наблюдается.
Соединения формулы (I), где A-B представляет собой CH=CH, можно получить, используя условия, аналогичные условиям, описанным выше для восстановительного аминирования аминоспирта (III) α,β-ненасыщенными енонами формулы (VII), где R3, R4, R5, R6 и R7 имеют такие значения, которые определены для формулы (I), как показано на схеме B.
Схема B
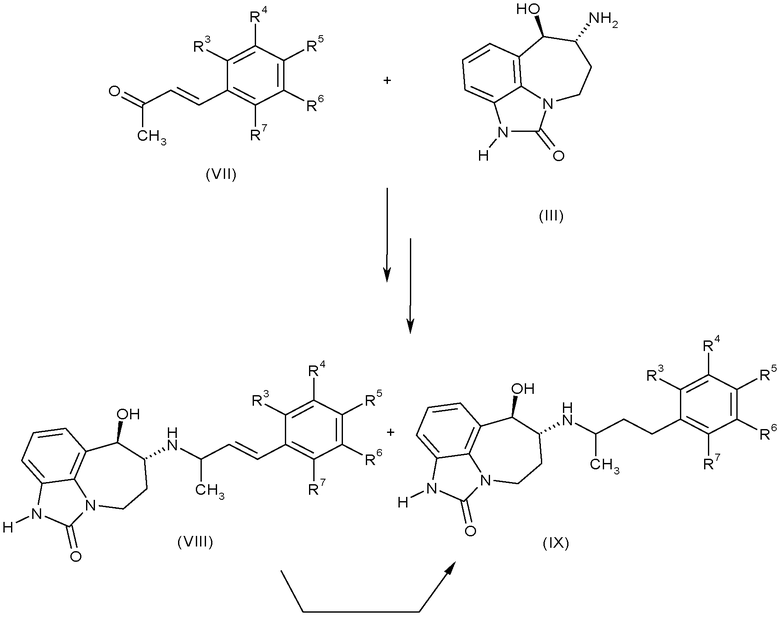
Использование избытка боргидридного восстановителя будет также восстанавливать двойную связь, таким образом, использование енонов формулы (VII) может давать соединения формулы (I), в которых A-B представляет собой CH2-CH2 или A-B представляет собой CH=CH, т.е. соединения формулы (IX) или соединения формулы (VIII).
Соединения формулы (I), в которых A-B представляет собой CH2-CH2, можно также получить из соединений формулы (I), в которых A-B представляет собой CH=CH, используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, например, катализатора Уилкинсона, палладия на угле или оксида платины, в протонном растворителе, например, метаноле, или катализаторы, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser.
2. Получение трициклических промежуточных продуктов
2.1 Аминоспирт (III)
Аминоспирт формулы (III) можно получить, как показано на схеме C.
Схема C
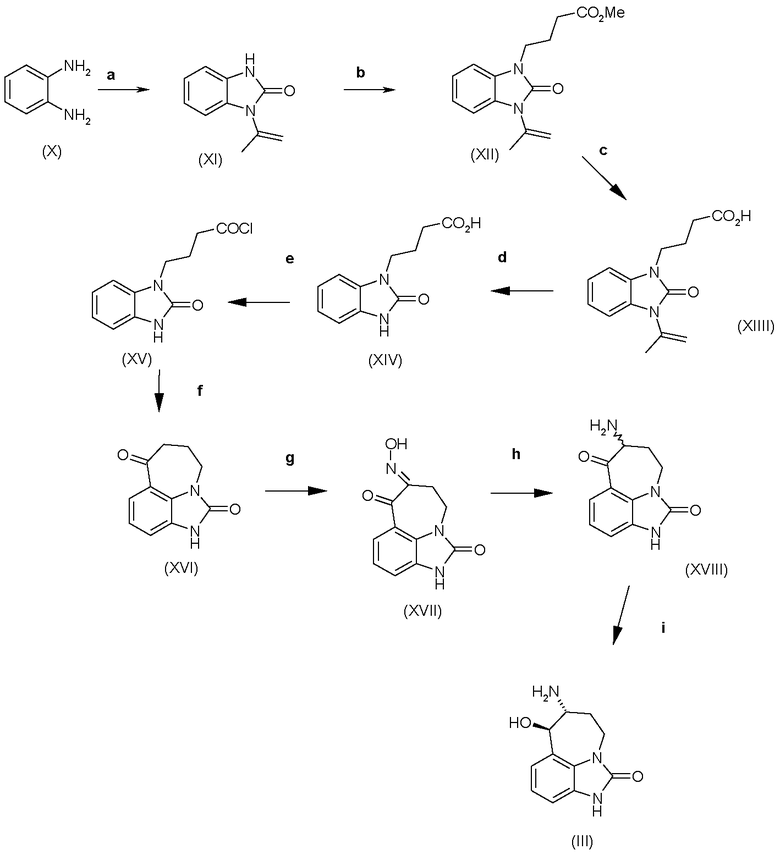
а) этилацетоацетат, ксилены, 150°C; b) метиловый эфир 4-броммасляной кислоты, K2CO3, ацетон, кипячение с обратным холодильником; c) 15% NaOH, ТГФ, кипячение с обратным холодильником; d) концентрированная HCl, ТГФ; e) SOCl2, ДХМ; f) AlCl3, ДХМ, кипячение с обратным холодильником; g) трет-BuONO, HCl, AcOH, 40ºC; h) Pd/C, H2, MeOH, концентрированная HCl, 1,5 атм.; i) NaBH4, MeOH, 0ºC.
Получение соединений формул (XI), (XII), (XIII), (XIV), (XV) и (XVI) раскрыто в Tetrahedron Letters, 1995, 36, 9, 1387. Получение соединений формул (XVII) и (III) раскрыто в патенте США US-4585770.
Энантиомеры аминоспирта (III) можно разделить методом хиральной ВЭЖХ. N-защита облегчает разделение. Специалисту в данной области понятно, что можно использовать разнообразные N-защищенные соединения, например, трет-бутилоксикарбамат, получаемый при взаимодействии аминоспирта (III) с трет-BOC-ангидридом в подходящем растворителе, таком как метанол, в присутствии основания, такого как триэтиламин. После разделения методом хиральной ВЭЖХ, можно удалить трет-BOC-защитную группу посредством кислотного гидролиза, например, при перемешивании в смеси 4 н. HCl/диоксан при комнатной температуре в течение нескольких часов, обычно 1 часа.
Требуемый энантиомер аминоспирта (III) можно также получить путем энантиоселективного восстановления кетооксима (XVII). Специалисту в данной области понятно, что степень энантиоселективности зависит от катализатора, лиганда, растворителя и реакционной температуры. Особо подходящие условия используют водород в присутствии металлического катализатора, такого как димер хлор(норборнадиен)родия, в комплексе с таким лигандом, как 1-[(S)-ферроценил-2-(R)-этил-1-диметиламино)фенил]-(S)-фосфино-1'-дициклогексилфосфино-ферроцен (Solvias AG), в протонном растворителе, обычно водном метаноле, при повышенных температурах, обычно 80°C, в течение 10-40 часов, обычно 16 часов.
3. Получение кетонов (II)
Многие из метилкетонов формулы (II), используемых в методике восстановительного аминирования, являются коммерчески доступными. Специалисту в данной области понятно, что другие соединения можно получить по экспериментальным методикам, которые описаны в литературе.
3.1 Соединения, в которых A-B представляет собой CH=CH
Еноны формулы (VII) можно получить согласно способу, показанному на схеме D, из бензальдегидов формулы (XVII), где R3, R4, R5, R6 и R7 имеют такие значения, которые определены для формулы (I), посредством катализируемой основанием конденсации с ацетоном, обычно используя в качестве основания гидроксид натрия при 0°C.
Схема D
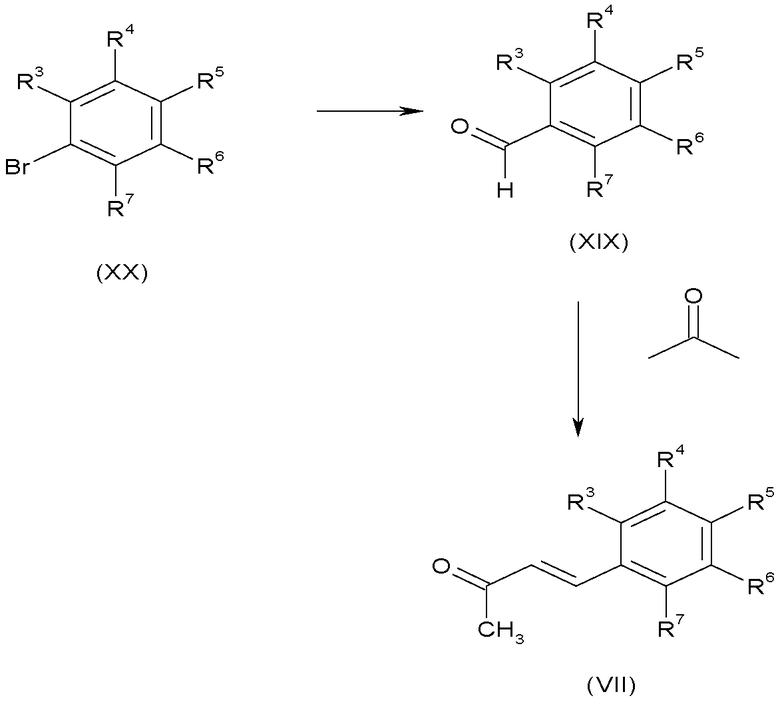
Замещенные бензальдегиды формулы (XIX) можно получить литиированием арилбромидов (XX), используя, например, н-бутиллитий в тетрагидрофуране, с последующим взаимодействием ариллитиевого реагента с N,N-диметилформамидом. По-другому, еноны формулы (VII) можно получить взаимодействием альдегидов формулы (XIX) с 1-трифенилфосфоранилиден-2-пропаноном при кипении с обратным холодильником в подходящем растворителе, таком как тетрагидрофуран, в течение 5-20 часов, обычно 12 часов.
3.2 Соединения, в которых A-B представляет собой CH 2 -CH 2
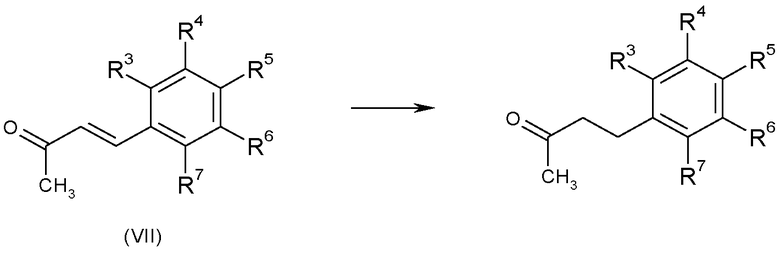
Кетоны формулы (II), в которых A-B представляет собой CH2-CH2, можно получить из енонов формулы (VII), в которых A-B представляет собой CH=CH, используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, такого как палладий на оксиде алюминия, в подходящем растворителе, например, этилацетате, или восстановители, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser, как показано на схеме E.
Схема E
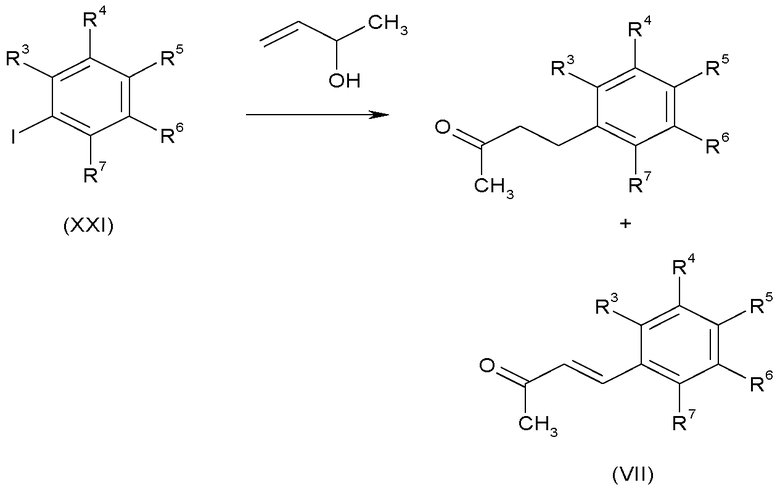
Кетоны формулы (II), в которых A-B представляет собой CH2-CH2, можно также получить реакцией сочетания Хека, сочетания йодсодержащего соединения (XXI) с бут-3-ен-2-олом, используя Pd(OAc)2 в качестве катализатора в подходящем растворителе, таком как N,N-диметилформамид, в присутствии основания, такого как триэтиламин, с необязательным добавлением неорганических солей, например, хлорида лития, как показано на схеме F. α,β-енон (VII) можно получить как побочный продукт реакции сочетания Хека.
Схема F
Соединения, в которых R3 и R7 оба представляют собой H, и R5 представляет собой OH, т.е. кетоны формулы (XXII), в которых R4 и R6 имеют такие значения, которые определены для формулы (I), можно получить взаимодействием фенолов формулы (XXIII) с метилвинилкетоном в подходящем растворителе, таком как толуол, в присутствии кислотного катализатора, обычно серной кислоты, как показано на схеме G. Предпочтительно, если добавление реагента происходит при 0°C с последующим перемешиванием реакционной смеси в течение 2-24 часов, обычно в течение ночи.
Схема G

Соединения формулы (XXVIII), в которых W представляет собой -SO2 или -CO, и R10 является таким, как определено для формулы (I), можно получить, как показано на схеме Н.
Схема H
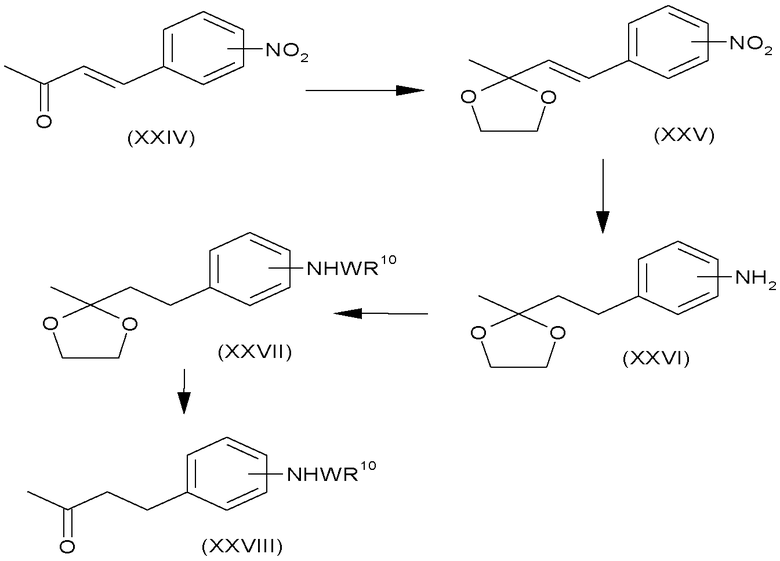
В еноны формулы (XXIV) можно ввести защиту посредством образования этиленкеталей формулы (XXV) взаимодействием с этиленгликолем в подходящем растворителе, таком как толуол, в присутствии кислотного катализатора, такого как пара-толуолсульфоновая кислота, при нагревании до кипения с обратным холодильником в аппарате Дина-Старка в течение нескольких часов, обычно 5 часов. Амины формулы (XXVI) можно получить из соединений формулы (XXV), используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, такого как 10% палладий на угле, в подходящем растворителе, например, в метаноле, используя проточный гидрогенизатор H-Cube, или восстановители, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser. Амины формулы (XXVI) можно ацилировать и сульфонилировать, используя стандартные описанные в литературе условия, хорошо известные специалисту в данной области. Можно удалить защиту с кеталей формулы (XXVII) посредством катализируемого кислотой гидролиза, например, при перемешивании в смеси концентрированная HCl/метанол при комнатной температуре в течение нескольких часов, обычно 2 часов.
3.3 Соединения, в которых A-B представляет собой CH 2 -C(CH 3 ) 2
Кетоны формулы (II), в которых A-B представляет собой -CH2C(CH3)2-, можно получить восстановительным арилированием 4-метилпент-3-ен-2-она (XXIX) солями бензолдиазония формулы (XXX) в подходящем апротонном растворителе, таком как N,N-диметилформамид, в присутствии кислоты Льюиса в качестве катализатора, например, тетрахлорида титана, как показано на схеме I.
Схема I
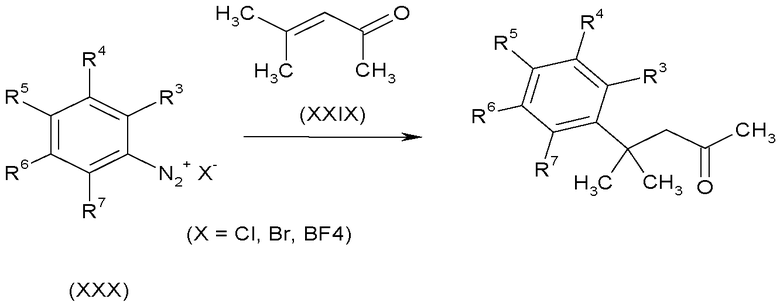
Соединения, в которых R3 представляет собой OH, т.е. метилкетоны (XXXI), можно получить, выполняя последовательность взаимодействий, показанную на схеме J.
Схема J
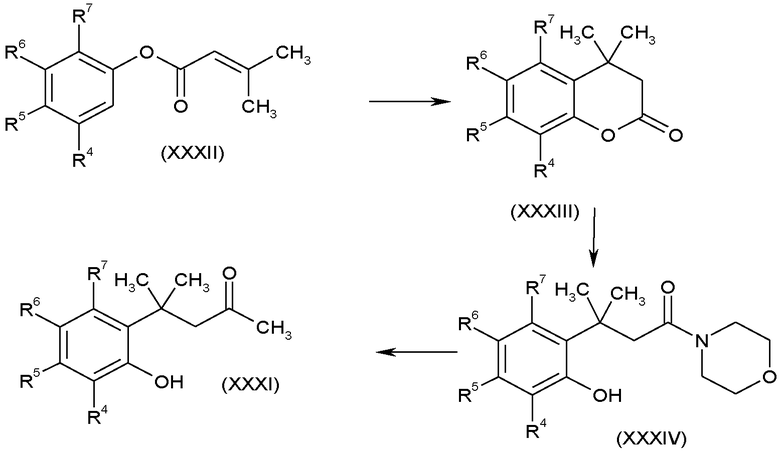
Хроманоны формулы (XXXIII) можно получить, перемешивая раствор соединений (XXXII) в подходящем растворителе, обычно дихлорэтане, в присутствии кислоты Льюиса, например, хлорида алюминия, в атмосфере азота в течение 5-24 часов, обычно в течение ночи. Морфолинамиды (XXXIV) получают при нагревании (XXXIII) в морфолине при повышенной температуре, обычно 85°C, в течение нескольких часов, например, 2 часов. Взаимодействие морфолинамидов (XXXIV) с метиллитием в подходящем растворителе, таком как тетрагидрофуран, при пониженной температуре, обычно -60°C, в атмосфере азота дает кетоны формулы (XXXI).
3.4 Соединения, в которых A-B представляет собой CH 2 -O
Алкилирование моногалогенацетона фенолами формулы (XXXV) или соответствующим фенолят-анионом в подходящем апротонном растворителе, таком как ацетонитрил, необязательно в присутствии основания, например, триэтиламина, дает кетоны формулы (II), в которых A-B представляет собой -CH2O-, как показано на схеме K.
Схема K
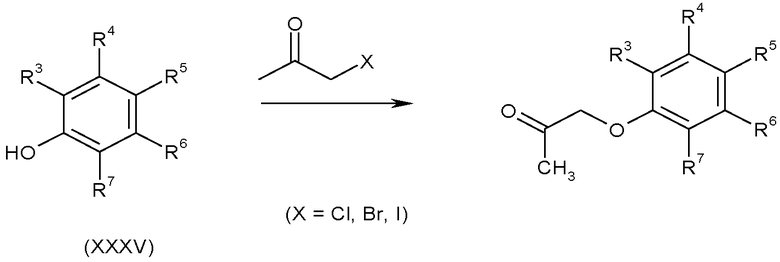
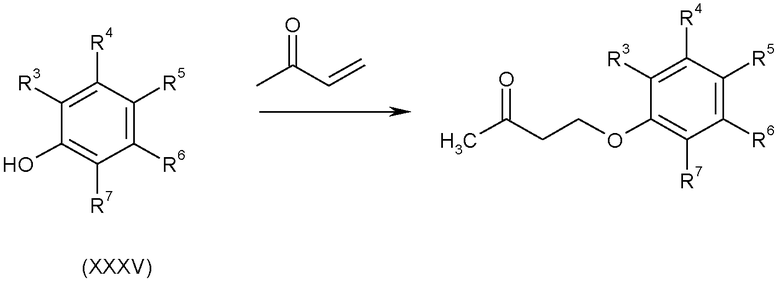
3.5 Соединения, в которых A-B представляет собой CH 2 -CH 2 -O
Кетоны формулы (II), в которых A-B представляет собой -CH2CH2O-, можно получить взаимодействием фенолов формулы (XXXV) с метилвинилкетоном, используя методики, аналогичные методикам, описанным в J. Amer. Chem. Soc., 1971, 93, 4, 985, как показано на схеме L.
Схема L
3.6 Соединения, в которых A-B представляет собой CH 2 -O-CH 2
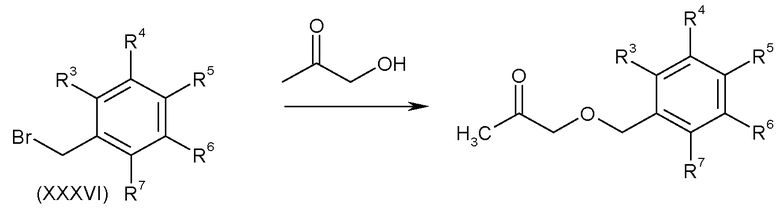
Кетоны формулы (II), в которых A-B представляет собой -CH2OCH2-, можно получить алкилированием гидроксиацетона подходящим бензилбромидом (XXXVI) способами, аналогичными способам, описанным в US-5360819, пример 36, как показано на схеме M.
Схема M
3.7 Соединения, в которых A-B представляет собой CH 2 -CH 2 -CH 2
Кетоны формулы (II), в которых A-B представляет собой -CH2CH2CH2-, можно получить взаимодействием с участием металлорганических соединений, например, цинкорганического реагента формулы (XXXVII) с 4-хлор-2-бутаноном необязательно в присутствии медного катализатора и соли лития, как показано на схеме N. Специалисту в данной области понятно, что можно использовать другие металлорганические реагенты.
Схема N
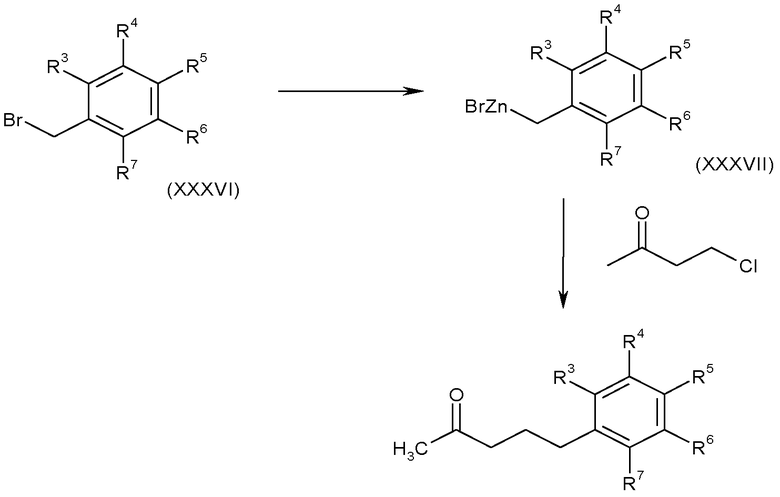
Цинкорганические реагенты формулы (XXXVII) можно получить из соответствующих бензилбромидов, используя стандартные методики, известные в литературе.
4. Разнообразные преобразования
Понятно, что некоторые из заместителей на фенильном кольце соединений формулы (II) подлежат преобразованию посредством дополнительных химических манипуляций. Например, способы, показанные на схемах G и I, обеспечивают продукты, которые содержат фенольную гидроксильную группу. Если требуются соответствующие простые эфиры, то O-алкилирование этих фенолов можно осуществить посредством взаимодействия с подходящими органическими галогенидами, используя основание, например, карбонат калия, в подходящем растворителе, например, ацетоне. Реакционные смеси перемешивают при повышенных температурах, обычно при кипении с обратным холодильником, в течение нескольких часов, обычно в течение ночи.
Фенолы формулы (XXXVIII), в которых A и B имеют такие значения, которые определены для формулы (I), легко подвергаются воздействию стандартных реакций замещения.
Схема O
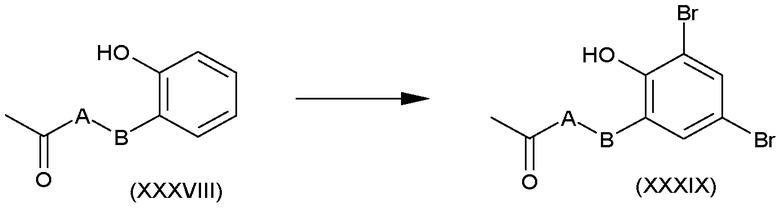
Например, соединения формулы (XXXIX) можно получить взаимодействием соединений формулы (XXXVIII) с N-бромсукцинимидом в подходящем растворителе, таком как N,N-диметилформамид, при комнатной температуре в течение 10-25 часов, обычно 18 часов, как показано на схеме O.
Амиды формулы (XLI), в которых A и B имеют такие значения, которые определены для формулы (I), можно получить из кислот формулы (XL), как показано на схеме P.
Схема P
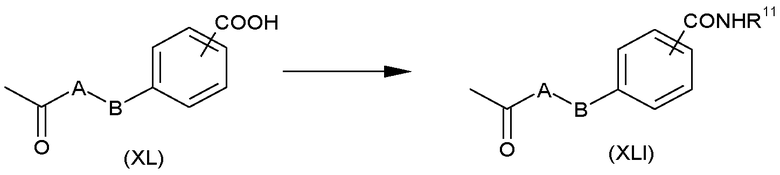
Специалисту в данной области понятно, что можно использовать многие стандартные известные из литературы реакционные условия для осуществления процесса с образованием такого амида; некоторые из них рассмотрены в “Amid bond formation and peptide coupling” C.A.G.N.Montalbetti и V.Falque, Tetrahedron, 2005, 61, 10827-10852. Например, кислоты формулы (XL) можно преобразовать в соответствующие хлорангидриды кислот при взаимодействии с оксалилхлоридом в подходящем растворителе, таком как N,N-диметилформамид. Можно провести взаимодействие этих хлорангидридов кислот с аминами формулы R11NH2 в подходящем растворителе, таком как дихлорметан.
Специалисту в данной области также понятно, что в рамках некоторых из описанных способов порядок используемых синтетических стадий может варьировать и, среди прочего, будет зависеть от таких факторов, как природа других функциональных групп, присутствующих в конкретном субстрате, возможность получения ключевых промежуточных продуктов и стратегия использования принимаемых защитных групп (если таковые используются). Понятно, что такие факторы также будут влиять на выбор реагента для применения на указанных синтетических стадиях.
Специалисту в данной области понятно, что соединения по изобретению можно получить способами, отличными от описанных здесь способов, при адаптации описанных здесь способов и/или адаптации способов, известных в данной области, например, в описанной здесь области, или используя стандартные руководства, например, «Comprehensive Organic Transformations - A Guide to Functional Group Transformations», RC Larock, Wiley-VCH (1999 г. или более поздние издания).
Понятно, что упоминаемые здесь способы синтетических преобразований являются только иллюстративными и их можно осуществлять, варьируя различными последовательностями, чтобы можно было эффективно собрать желаемые соединения. Квалифицированный химик использует свое авторитетное мнение и мастерство в отношении наиболее эффективной последовательности взаимодействий для синтеза данного целевого соединения.
В предпочтительном варианте -A- представляет собой -CH2- и -B- представляет собой -CH2- или -C(CH3)2-; или -A-B- представляет собой -CH=CH-. В более предпочтительном варианте -A- представляет собой -CH2- и -B- представляет собой -CH2-.
Если -A-B- представляет собой -CH=CH-, то двойная связь предпочтительно имеет транс- (или E-) конфигурацию.
В другом предпочтительном варианте соединений формулы (I) R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, -CH2OH, -O-(C1-C4 алкил) или -O-CH2-(C3-C5)циклоалкил, и R9 представляет собой -OH или -NHSO2(C1-C3 алкил).
В другом предпочтительном варианте соединений формулы (I), R1 представляет собой H и R2 представляет собой метил, так что соединение формулы (I) имеет 1′R, 6R, 7R относительную конфигурацию. Более предпочтительно, если соединение формулы (I) имеет 1′R, 6R, 7R абсолютную конфигурацию.
В другом предпочтительном варианте соединений формулы (I) R3, R4, R5, R6 и R7, каждый независимо выбран из H, R8 и R9, при условии, что по меньшей мере два из R3, R4, R5, R6 и R7 представляют собой H; или R4 и R5 вместе представляют собой -O-CH2-CH2-, -CH2-CH2-O- или -O-CH2-O-, и R3, R6 и R7 представляют собой H; R8 представляет собой галоген, -CN, C1-C4 алкил, -CF3, -CH2OH, -O-(C1-C4 алкил) или -O-CH2-(C3-C5)циклоалкил; и R9 представляет собой -OH или -NHSO2(C1-C3 алкил).
В другом предпочтительном варианте соединений формулы (I) один из R3, R4, R5, R6 и R7 представляет собой R8 или R9, другие два из R3, R4, R5, R6 и R7 представляют собой H или R8, и еще два из R3, R4, R5, R6 и R7 представляют собой H; R8 представляет собой галоген, -CN, C1-C4 алкил, -CF3, -CH2OH, -O-(C1-C-4 алкил) или -O-CH2-(C3-C5)циклоалкил; и R9 представляет собой -OH или -NHSO2(C1-C3 алкил). Более предпочтительно, если R9 представляет собой -OH.
Другим предпочтительным вариантом является соединение формулы (IA)
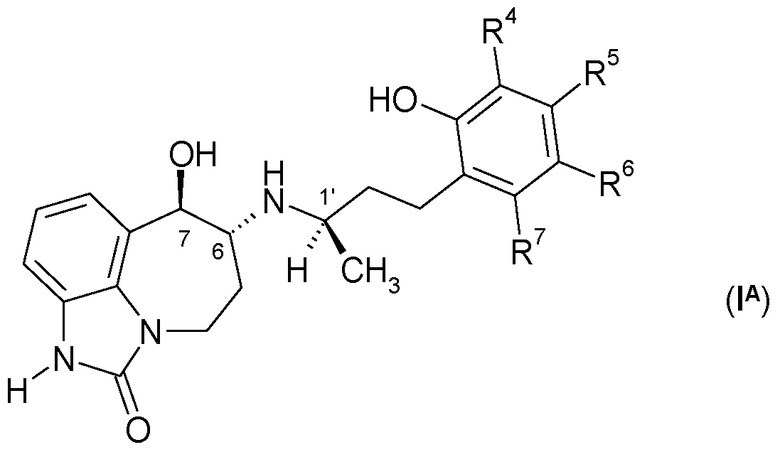
или его фармацевтически приемлемая соль, где два из R4, R5, R6 и R7 представляют собой H или R8, и другие два из R4, R5, R6 и R7 представляют собой H; и R8 представляет собой галоген, -CN, C1-C-4 алкил, -CF3, -CH2OH, -O-(C1-C-4 алкил) или -O-CH2-(C3-C5)циклоалкил.
Другим предпочтительным вариантом является соединение формулы (IA) или его фармацевтически приемлемая соль, которые имеют 1′R, 6R, 7R абсолютную конфигурацию.
Другим предпочтительным вариантом является соединение формулы (IB)
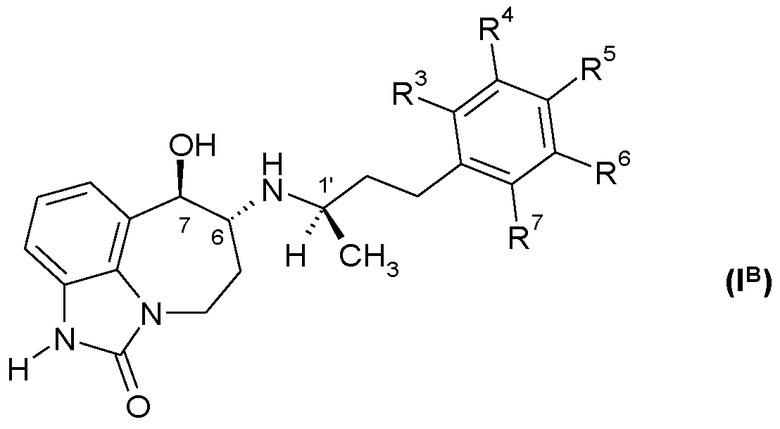
или его фармацевтически приемлемая соль, где один из R3, R4, R5, R6 и R7 представляет собой R8 или R9, и другие четыре из R3, R4, R5, R6 и R7 представляют собой H; R8 представляет собой галоген, -CN, (C1-C4)алкил, -CF3, -O-(C1-C4 алкил) или -O-CH2-(C3-C5)циклоалкил; и R9 представляет собой -OH.
Другим предпочтительным вариантом является соединение формулы (IB) или его фармацевтически приемлемая соль, которые имеют 1′R, 6R, 7R абсолютную конфигурацию.
В вариантах соединений формул (I), (IA) и (IB), где R8 представляет собой галоген, он предпочтительно является фтором или хлором. В вариантах соединений формул (I), (IA) и (IB), где R8 представляет собой (C1-C4)алкил, он предпочтительно является метилом, этилом, пропилом или изопропилом и более предпочтительно метилом. В вариантах соединений формул (I), (IA) и (IB), где R8 представляет собой (C1-C4) галогеналкил, он предпочтительно является трифторметилом. В вариантах соединений формул (I), (IA) и (IB), где R8 представляет собой -O-(C1-C4)алкил, он предпочтительно является метокси, этокси, пропокси или изопропокси и более предпочтительно метокси. В вариантах соединений формул (I), (IA) и (IB), где R8 представляет собой -O-CH2-(C3-C5)циклоалкил, он предпочтительно является циклопропилметокси.
Предпочтительными индивидуальными соединениями формулы (I) являются:
(6R*,7R*)-7-гидрокси-6-{[(1R*)-1-метил-3-фенилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-1-метил-3-фенилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-1-метил-3-фенилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-1-метил-3-фенилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-1-метил-3-фенилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(2-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(2-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(2-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-3-(2-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(3-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(3-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(3-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-3-(3-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-3-(3-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(4-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(4-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(4-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-3-(4-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-3-(4-гидроксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(4-метоксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(4-метоксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(4-метоксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-3-(4-метоксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-3-(4-метоксифенил)-1-метилпропил]-амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1R*)-3-(4-(циклопропилметилокси)фенил)-1-метил-пропил]-амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1S*)-3-(4-(циклопропилметилокси)фенил)-1-метил-пропил]-амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1RS)-3-(4-(циклопропилметилокси)фенил)-1-метилпропил]-амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1R)-3-(4-(циклопропилметилокси)фенил)-1-метилпропил]-амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он и
(6R,7R)-6-{[(1S)-3-(4-(циклопропилметилокси)фенил)-1-метилпропил]-амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он.
Кроме того, предпочтительными индивидуальными соединениями формулы (I) являются:
(6R*,7R*)-7-гидрокси-6-{(1R*)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{(1S*)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{(1RS)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{(1S)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{(1R)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1R)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-7-гидрокси-6-{[(1S)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1R*)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1S*)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1RS)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1R)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1S)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1R*)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R*,7R*)-6-{[(1S*)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1RS)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он;
(6R,7R)-6-{[(1R)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он и
(6R,7R)-6-{[(1S)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он.
Соединения формулы (I) являются агонистами адренергических бета-2-рецепторов. В частности, они имеют хорошую эффективность относительно коровьих и/или свиных адренергических бета-2-рецепторов, как показано в исследованиях, изложенных ниже в примерах.
Соединения формулы (I) можно использовать для повышения производства мяса у сельскохозяйственных животных. Примеры сельскохозяйственных животных включают жвачных животных, таких как коровы, быки, телки, бычки, козы, овцы и второстепенные виды, например, буйволы, бизоны и антилопы. Другие примеры включают свиней, кабанов, подсвинков, свиноматок и птицу, например, цыплят, уток, гусей и индеек. Предпочтительным является применение для повышения производства мяса крупного рогатого скота, свиней и домашней птицы.
Сообщается также, что бета-2-агонисты улучшают производство мышечной массы и эффективность использования кормов при разведении рыбы. Следовательно, соединения формулы (I) могут найти применение в производстве рыбы, например, тунца, лосося и форели.
Соединения формулы (I) можно вводить животному любым подходящим путем. Предпочтительным путем введения с целью повышения производства мяса у сельскохозяйственных животных является пероральный путь. Для такого введения соединения формулы (I) можно добавлять к корму животных, в питьевую воду или в любой другой материал, проглатываемый животными, например, соляной источник.
Соединения формулы (I) можно добавлять непосредственно в корм или питьевую воду, или можно представить в виде концентрата для добавления к корму или питьевой воде.
Концентрат может быть твердым или жидким. Твердые концентраты включают простые смеси соединений с твердым разбавителем, таким как кукурузный крахмал, и композиции, в которых соединения адсорбированы на разбавителе. Примеры других разбавителей включают муку люцерны, рисовые отруби, крупу из кукурузных початков, костную муку, соевую муку, молотое зерно; неорганические разбавители, такие как известняк, хлорид натрия; смеси витаминов и минералов. Жидкие концентраты включают растворы и суспензии в воде или другом подходящем носителе, например, масле, в особенности, в растительном масле.
Подходящий концентрат для добавления в корм содержит:
Концентрацию соединения формулы (I) в корме или воде следует регулировать таким образом, чтобы каждое животное принимало максимально эффективное количество. Для крупного рогатого скота подходящим может быть потребление от 0,1 до 1000 мг/животное/день, в особенности, от 0,1 до 100 мг/животное/день. Предпочтительным может быть количество от 0,5 до 50 мг/животное/день и более предпочтительным от 1 до 25 мг/животное/день. Для крупного рогатого скота, потребляющего 10 кг корма в день, таких норм введения можно достичь, добавляя в корм соединения формулы (I) при уровне включения от 0,01 до 100 млн.д., от 0,01 до 10 млн.д., от 0,05 до 5 млн.д. и от 0,1 до 2,5 млн.д., соответственно.
Соединения по настоящему изобретению можно вводить индивидуально или в комбинации с одним или несколькими другими соединениями по изобретению, или в комбинации с одним или несколькими другими лекарственными средствами (или в виде любой их комбинации).
Например, соединения формулы (I) можно использовать в комбинации с другими пищевыми добавками, используемыми в животноводческом производстве; например, полиэфирными ионофорами, такими как монензин, салиномицин, наразин, лазалоцид и лаидломицин; антибиотиками, такими как тетрациклины, бацитрацин, тилозин, тиамулин, линкомицин, виржиниамицин, хинолоновые антибактериальные агенты и карбадокс; меленгестерол ацетат; агентами для профилактики или лечения подострого ацидоза рубца, такими как бикарбонат натрия, акарбоза и другие ингибиторы амилаз и глюкозидаз; агентами для качества туши/анаболиками, такими как рактопамин, сальбутамол, альметерол и другие адренергические бета-лиганды; ферментами, минералами, витаминами и другими добавками. Специалисту в данной области понятно, что перечисленные выше агенты являются примерами широкого набора пищевых добавок, которые можно использовать в комбинации с соединениями формулы (I). Другие примеры рассмотрены в «2006 Feed Fdditive Companion» и «Handbook of Feed Additives 2006».
Соединения формулы (I) можно также использовать в комбинации с анаболическими агентами, такими как зеаранол, тренболонацетат и эстрадиол; и гормонами роста, такими как коровий соматотропин и свиной соматотропин. Соединения формулы (I) можно также использовать в комбинации с агентами, используемыми для здоровья животных; например эндектоцидами, такими как ивермектин, дорамектин, моксидектин, абамектин и другие макроциклические лактоны; антигельминтными препаратами, такими как левамизол, альбендазол и другие бензимидазолкарбаматы, морантел, пирантел; средствами против эктопаразитов, такими как пиретроиды, арилпиразолы, неоникотиноиды.
Соединения формулы (I) можно также использовать при лечении заболеваний животных, при которых бета-2-агонисты имеют или могут иметь благотворное действие. В частности, соединения формулы (I) можно использовать при лечении респираторных заболеваний животных, включая лечение запала у лошадей.
Соединения формулы (I) также обладают агонистической активностью относительно человеческих адренергических бета-2-рецепторов и, таким образом, являются потенциально полезными в медицине человека.
В настоящее время бета-2-агонисты применяются для лечения аллергических и неаллергических заболеваний дыхательных путей, таких как астма и хроническая обструктивная болезнь дыхательных путей (COPD). Рекомендации по лечению этих заболеваний включают бета-2-агонисты краткого и длительного действия, вводимые посредством ингаляции. Кратко- и быстродействующие бета-2-агонисты используют для «спасительной» бронходилатации, тогда как формы длительного действия обеспечивают продолжительное облегчение и используются как поддерживающая терапия.
Бронходилатация опосредована агонизмом адренергических бета-2-рецепторов, экспрессируемых в клетках гладких мышц дыхательных путей, в результате чего происходит релаксация и, следовательно, бронходилатация. Таким образом, бета-2-агонисты как функциональные антагонисты могут предупреждать и обращать эффекты всех веществ-бронхоконстрикторов, включая лейкотриен D4 (LTD4), ацетилхолин, брадикинин, простагландины, гистамин и эндотелины. Так как бета-2-рецепторы широко распространены в дыхательных путях, бета-2-агонисты могут также воздействовать на другие типы клеток, которые играют какую-либо роль при астме. Например, сообщается, что бета-2-агонисты могут стабилизировать тучные клетки. Ингибирование высвобождения веществ-бронхоконстрикторов может происходить как блокада бета-2-агонистами бронхоконстрикции, индуцированной аллергенами, тренировкой и холодным воздухом. Кроме того, бета-2-агонисты ингибируют холинергическую нейротрансмиссию в дыхательных путях человека, в результате чего происходит снижение холинергической рефлекторной бронхоконстрикции.
Следовательно, еще один аспект настоящего изобретения касается соединений формулы (I) или их фармацевтически приемлемых солей для использования при лечении заболеваний, расстройств и состояний, в которые вовлечен бета-2-рецептор. Более конкретно, настоящее изобретение также касается соединений формулы (I) или их фармацевтически приемлемых солей для использования при лечении заболеваний, расстройств и состояний, выбранных из группы, включающей следующие расстройства:
- астма любого типа, этиологии или патогенеза, в частности, астма, которая выбрана из группы, включающей: атопическую астму, неатопическую астму, аллергическую астму, атопическую бронхиальную IgE-опосредованную астму, бронхиальную астму, эссенциальную астму, настоящую астму, наследственную астму, вызванную патофизиологическими нарушениями, приобретенную астму, вызванную экологическими факторами, эссенциальную астму неизвестной или неясной причины, бронхитическую астму, эмфизематозную астму, астму, вызванную физическими упражнениями, астму, вызванную аллергеном, астму, вызванную холодным воздухом, профессиональную астму, инфекционную астму, вызванную бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергическую астму, начальную форму астмы, астматический синдром новорожденных и бронхиолит,
- хроническая или острая бронхоконстрикция, хронический бронхит, непроходимость малых дыхательных путей и эмфизема,
- обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза, в частности, обструктивное или воспалительное заболевание дыхательных путей, которое выбрано из группы, включающей: хроническую эозинофильную пневмонию, хроническую обструктивную болезнь легких (COPD), COPD, которая включает хронический бронхит, эмфизему легких или одышку, связанную или не связанную с COPD, COPD, которая характеризуется необратимой, прогрессирующей непроходимостью дыхательных путей, острый респираторный дистресс-синдром у взрослых (ARDS), обострение гиперреактивности дыхательных путей в результате лечения другими лекарственными средствами и болезнь дыхательных путей, которая связана с легочной гипертензией,
- бронхит любого типа, этиологии или патогенеза, в частности, бронхит, который выбран из группы, включающей острый бронхит, острый гортанно-трахеальный бронхит, арахидный бронхит, катаральный бронхит, крупозный бронхит, сухой бронхит, инфекционный астматический бронхит, продуктивный бронхит, стафилококковый или стрептококковый бронхит и везикулярный (пузырчатый) бронхит,
- острое легочное поражение (поражение легких),
- бронхоэктаз любого типа, этиологии или патогенеза, в частности, бронхоэктаз, который выбран из группы, включающей цилиндрический бронхоэктаз, осумкованный бронхоэктаз, веретенообразный бронхоэктаз, капиллярный бронхоэктаз, кистозный бронхоэктаз, сухой бронхоэктаз и фолликулярный бронхоэктаз.
Установлено также, что адренергические бета-2-рецепторы экспрессируются не только в дыхательных путях, но и в других органах и тканях, и таким образом, соединения формулы (I) могут найти применение при лечении других заболеваний, таких как (но не ограничиваясь этим) заболевания нервной системы, преждевременные роды, застойная сердечная недостаточность, депрессия, воспалительные и аллергические кожные заболевания, псориаз, пролиферативные кожные заболевания, глаукома, и при состояниях, когда есть польза в снижении кислотности желудка, в особенности, при язве желудка и пептической язве.
При применении для терапии человека соединения формулы (I) и их фармацевтически приемлемые соли обычно вводят в виде препарата в ассоциации с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин «эксципиент» используют здесь для описания любого ингредиента, отличного от соединения по изобретению. Выбор наполнителя в большой степени зависит от конкретного пути введения.
Соединения по изобретению можно вводить перорально. Пероральное введение может включать заглатывание, так что соединение входит в желудочно-кишечный тракт, или можно применять буккальное или подъязычное введение, при котором соединение входит непосредственно в систему кровообращения через рот.
Составы, подходящие для перорального введения, включают: твердые составы, такие как таблетки; капсулы, содержащие частицы, жидкости или порошки; лепешки (в том числе с жидким наполнением); и жевательные резинки; мульти- и наночастицы; гели; твердые растворы; липосомы; пленки, овулы, спреи и жидкие составы.
Жидкие составы включают суспензии, растворы, сиропы и эликсиры. Такие составы можно использовать в качестве наполнения для мягких или твердых капсул, и обычно они содержат, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более эмульгаторов и/или суспендирующих агентов. Жидкие составы можно также получить посредством разведения твердых веществ, например, из саше.
Соединения по изобретению можно также использовать в виде быстрорастворимых, быстрораспадающихся дозированных форм, таких как формы, описанные в Expert Opinion, Therapeutic Patents, 11 (6), 981-986, Liang и Chen (2001).
Для лекарственных форм в виде таблеток лекарственное средство может составлять от 1 до 80 мас.% лекарственной формы, чаще от 5 до 60 мас.% лекарственной формы в зависимости от дозы. Кроме лекарственного средства таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают крахмалгликолят натрия, натрий карбоксиметилцеллюлозу, кальций карбоксиметилцеллюлозу, натрий кроскармелозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, (низший алкил)-замещенную гидроксипропилцеллюлозу, крахмал, предварительно желатинированный крахмал и альгинат натрия. Обычно разрыхлитель составляет от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% лекарственной формы.
Для придания когезионных свойств составу в виде таблеток обычно используют связующие. Подходящие связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, моногидрат, высушенный распылением, безводная и подобные), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция.
Таблетки также могут содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и агенты для скольжения, такие как диоксид кремния и тальк. Поверхностно-активные вещества, если таковые присутствуют, могут составлять от 0,2 до 5 мас.% таблетки, и агенты скольжения могут составлять от 0,2 до 1 мас.% таблетки.
Обычно таблетки также содержат лубриканты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки.
Другие возможные ингредиенты включают антиоксиданты, красители, вкусовые агенты, консерванты и агенты, маскирующие вкус.
Типичные примеры таблеток содержат примерно до 80% лекарственного средства, от приблизительно 10 до приблизительно 90 мас.% связующего, от приблизительно 0 до приблизительно 85 мас.% разбавителя, от приблизительно 2 до приблизительно 10 мас.% разрыхлителя и от приблизительно 0,25 до приблизительно 10 мас.% лубриканта.
Смеси для таблеток можно подвергать прямому прессованию или прессовать при помощи вальцов с получением таблеток. По-другому, перед таблетированием смеси для таблеток или части смесей можно гранулировать во влажном состоянии, сухом состоянии или из расплава, коагулировать из расплава или экструдировать. Конечный препарат может содержать один или более слоев и может иметь или не иметь покрытия; его даже можно заключить в капсулы.
Состав таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol. 1, by H. Lieberman and L. Lachman (Marcel Dekker, New York, 1980).
В потребляемых людьми пероральных пленках обычно используются лекарственные формы в виде пластичных водорастворимых или набухающих в воде тонких пленок, которые могут быстро растворяться или могут быть мукоадгезионными и обычно содержат соединение формулы (I), пленкообразующий полимер, связующее, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, агент для модификации вязкости и растворитель. Некоторые компоненты препарата могут выполнять более одной функции.
Соединение формулы (I) может быть растворимым или нерастворимым в воде. Водорастворимое соединение обычно составляет от 1 до 80 мас.%, чаще от 20 до 50 мас.% растворяемых веществ. Менее растворимые соединения могут составлять большую часть композиции, обычно до 88 мас.% растворяемых веществ. По-другому, соединение формулы (I) может быть в виде гранул, состоящих из множества частиц.
Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов и обычно присутствует в количестве от 0,01 до 99 мас.%, чаще от 30 до 80 мас.%.
Другие возможные ингредиенты включают антиоксиданты, красители, вкусовые агенты и усилители вкуса, консерванты, агенты, стимулирующие слюноотделение, охлаждающие агенты, сорастворители (включая масла), смягчающие средства, агенты для увеличения объема, противопенные агенты, ПАВ и агенты, маскирующие вкус.
В соответствии с изобретением пленки обычно получают сушкой выпариванием тонких водных пленок, нанесенных на легко отслаивающуюся несущую подложку или бумагу. Это можно выполнять в сушильной печи или трубе, обычно в комбинированной сушилке для нанесения покрытий или посредством сушки при замораживании или вакуумировании.
Твердые составы для перорального введения можно приготовить как составы с немедленным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением.
Подходящие составы с модифицированным высвобождением для целей изобретения описаны в патенте США № 6106864. Подробности других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии, осмотические частицы и частицы с покрытием, следует искать в Pharmaceutical Technology On-line, 25(2), 1-14, Verma и др. (2001). Использование жевательной резинки для осуществления регулируемого высвобождения описано в WO 00/35298.
Соединения по изобретению также можно вводить непосредственно в систему кровообращения, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, внутриматочное, внутригрудинное, внутричерепное, внутримышечное и подкожное введение. Подходящие устройства для парентерального введения включают инжекторы с иглами (в том числе с микроиглами), инжекторы, не имеющие игл, и устройства для инфузий.
Парентеральные составы обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, карбогидраты и буферные агенты (предпочтительно с pH от 3 до 9), но для некоторых использований их можно приготовить более подходящим образом в виде стерильных неводных растворов или высушенных форм для использования в сопряжении с подходящим наполнителем, например, стерильной водой, не содержащей пирогенов.
Получение парентеральных составов в стерильных условиях, например, лиофилизацией, можно легко выполнить, используя стандартные фармацевтические методики, хорошо известные специалистам в данной области.
Растворимость соединений формулы (I), используемых при получении растворов для парентерального введения, можно повысить, используя подходящие методики приготовления, например, включение агентов, повышающих растворимость.
Можно получить составы для парентерального введения с немедленным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением. Таким образом, соединения по изобретению можно приготовить в твердой, полутвердой форме или в форме тиксотропной жидкости для введения в качестве имплантируемого депо-состава, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких составов включают эндопротезы с нанесенным лекарственным средством и PGLA-микросферы из поли(dl-молочной-согликолевой)кислоты (PGLA).
Соединения по изобретению также можно использовать топически на коже или слизистой оболочке, то есть дермально или трансдермально. Типичные составы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, тонкодисперсные порошки, повязки, пены, пленки, кожные пластыри, облатки, имплантаты, губки, нити, бинты и микроэмульсии. Можно также использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно включать усилители проницаемости - смотрите, например, J Pharm Sci, 88 (10), 955-958, Finnin и Morgan (октябрь 1999 г.).
Другие способы топического применения включают доставку посредством электропорации, ионтофореза, фонофореза, сонофореза и инъекции с применением микроигл или без использования игл (например, Powderject™, Bioject™ и др.).
Можно приготовить составы для наружного введения с немедленным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением.
Соединения по изобретению также можно вводить внутриносовым способом или посредством ингаляции, обычно в виде сухого порошка (самого по себе или смеси, например, в виде сухой смеси с лактозой или смешанных частиц компонентов, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора с сухим порошком или в виде аэрозольного спрея из контейнера, находящегося под давлением, посредством помпы, спрея, распылителя (предпочтительно, распылителя, использующего электординамические свойства, для получения мелкой дымки) или пульверизатора с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для внутриносового применения порошок может содержать биоадгезионный агент, например, хитозан или циклодекстрин.
Контейнер под давлением, помпа, спрей, распылитель или пульверизатор содержит раствор или суспензию соединения(ий) по изобретению, включающую, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения или продолжительного высвобождения активного агента, пропеллент(ы) в качестве растворителя и необязательное ПАВ, например, сорбиттриолеат, олеиновую кислоту или олигомолочную кислоту.
Перед применением состава в виде сухого порошка или суспензии полученное лекарственное средство тонко измельчают до размера частиц, подходящего для доставки посредством ингаляции (обычно менее 5 микрон). Этого можно достичь подходящим способом измельчения, таким как перемалывание на спиральной струйной мельнице, струйной мельнице с псевдоожиженным слоем, обработка сверхкритической жидкости с образованием наночастиц, гомогенизация при высоком давлении или сушка распылением.
Можно приготовить капсулы (сделанные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения по изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор эффективности, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в виде моногидрата, предпочтителен последний вариант. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящий состав в виде раствора для использования в распылителе, использующем электродинамические свойства для получения мелкой дымки, может содержать от 1 мкг до 20 мг соединения по изобретению на одно включение, и рабочий объем может варьировать от 1 мкл до 100 мкл. Типичный состав может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
К этим составам по изобретению, предназначенным для введения посредством ингаляции/внутриносового введения, можно добавлять подходящие вкусовые агенты, например, ментол и левоментол, или подсластители, такие как сахарин или сахарин натрий.
Можно приготовить составы для введения посредством ингаляции/внутриносового введения с немедленным и/или модифицированным высвобождением, используя, например, PGLA. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением.
В случае ингаляторов для сухого порошка и аэрозолей стандартную дозу определяют при помощи клапана, который поставляет отмеренное количество. Агрегаты в соответствии с изобретением обычно налаживают таким образом, чтобы вводить отмеренную дозу или «пуск», содержащий от 0,001 до 10 мг соединения формулы (I). Общая суточная доза обычно составляет от 0,001 до 40 мг, которые можно вводить одной дозой или чаще поделенными дозами в течение дня.
Соединения формулы (I) особенно подходят для введения посредством ингаляции.
Соединения по изобретению можно вводить ректально или вагинально, например, в виде суппозитория, пессария или клизмы. Традиционной основой для суппозиториев является масло какао, но можно применять различные альтернативы, которые подходят.
Можно приготовить составы для ректального/вагинального введения с немедленным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением.
Соединения по изобретению также можно вводить непосредственно в глаз или ухо, обычно в виде капель тонкой суспензии или раствора в изотоническом стерильном физиологическом растворе с отрегулированным pH. Другие составы, подходящие для глазного и ушного введения, включают мази, биологически разрушаемые (например, рассасывающиеся гелевые губки, коллаген) и неразрушаемые биологически (например, силиконовые) имплантаты, облатки, линзы и сыпучие или визикулярные системы, такие как ниосомы или липосомы. Вместе с консервантом, таким как бензалконийхлорид, можно включить полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, гелановая камедь. Такие составы также можно доставить посредством ионтофореза.
Можно приготовить составы для глазного/ушного введения с немедленным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают составы с замедленным, длительным, импульсным, регулируемым, целевым и программируемым высвобождением.
Соединения по изобретению можно объединять с растворимыми макромолекулярными объектами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, чтобы улучшить их растворимость, скорость растворения, маскировку вкуса, биодоступность и/или стабильность для применения любым из упоминаемых выше способов введения.
Например, обнаружено, что комплексы лекарственное средство-циклодекстрин обычно пригодны для большинства лекарственных форм и путей введения. Можно использовать формы как комплексов включения, так и комплексов без включения. В качестве альтернативы прямому комплексообразованию с лекарственным средством можно использовать циклодекстрин в качестве вспомогательной добавки, то есть носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных патентных заявках № WO 91/11172, WO 94/02518 и WO 98/55148.
Для введения пациентам-людям общая суточная доза соединений по изобретению обычно составляет от 0,001 до 5000 мг, конечно, в зависимости от пути введения. Например, внутривенная суточная доза может составлять только от 0,001 до 40 мг. Общую суточную дозу можно вводить в виде единой дозы или поделенных доз и по усмотрению лечащего врача величина дозы может выходить за пределы данного здесь типичного диапазона.
Эти дозировки основаны на средней массе пациента-человека от приблизительно 65 до 70 кг. Лечащий врач способен легко определить дозы для пациентов, масса которых выходит за пределы этого диапазона, например, детей и пожилых людей.
При применении с целью лечения заболевания дыхательных путей человека соединения формулы (I) и их фармацевтически приемлемые соли можно использовать в комбинации со вторым фармакологически активным агентом. Примеры таких агентов включают: H3-антагонисты, антагонисты мускариновых рецепторов M3, PDE4-ингибиторы, глюкокортикостероиды, агонисты аденозиновых рецепторов A2a, модуляторы цитокиновых сигнальных путей, такие как p38 MAP киназа или syk киназа, и антагонисты лейкотриенов (LTRA), включая антагонисты LTB4, LTC4, LTD4 и LTE4.
Особенно предпочтительными агентами для такой комбинационной терапии являются:
- глюкокортикостероиды, в частности, глюкокортикостероиды, вводимые путем ингалации, с пониженными системными побочными эффектами, включая преднизон, преднизолон, флунизолид, триамцинолон ацетонид, беклометазон дипропионат, будезонид, флутиказон пропионат, циклезонид и мометазон фуроат, и
- антагонисты мускариновых M3-рецепторов или антихолинергические агенты, включая, в частности, соли ипратропия, а именно, бромид, соли тиотропия, а именно, бромид, соли окситропия, а именно, бромид, перензепин и телензепин.
ПРИМЕРЫ
Следующие неограничительные примеры иллюстрируют получение соединений формулы (I).
Что касается приведенных далее экспериментальных подробностей: данные спектроскопии ядерного магнитного резонанса получают, используя спектрометры Varian Inova 300, Varian Inova 400, Varian Mercury 400, Varian Unityplus 400, Bruker AC 300 МГц, Bruker AM 250 МГц или Varian T60 МГц, наблюдаемые химические сдвиги согласуются с предполагаемыми структурами. Химические сдвиги ЯМР выражают в м.д. в слабое поле от тетраметилсилана. В представленных ниже данных для некоторых соединений перечислены только ключевые сигналы. В следующих примерах, где соединение примера указано как смесь диастереомеров, показанные ЯМР-интегралы касаются относительного соотношения интегралов для приведенного химического сдвига. Масс-спектральные данные получены на спектрометре Finnigan Masslab Navigator, Fisons Instrument Trio 1000 или Hewlett Packard GCMS System Model 5971. Приведенные рассчитанные и наблюдаемые ионы относятся к изотопному составу наименьшей массы. ВЭЖХ означает высокоэффективную жидкостную хроматографию. Где указано, используются следующие аналитические ВЭЖХ-методы:
ВЭЖХ-метод A:
Система Gilson, колонка 150×4,6 мм Gemini C18 5 мкм;
ацетонитрил:0,1% водный аммиак [от 5:95 до 95:5], 1 мл/мин.
ВЭЖХ-метод B:
Система Gilson, колонка 150×4,6 мм LUNA C18(2) 5 мкм;
ацетонитрил:формиат аммония (20 мМ) [от 5:95 до 98:2], 1 мл/мин.
ВЭЖХ-метод C:
Система Gilson, колонка 250×4,6 мм Chiracel OD-H 5 мкм;
этанол:гексан [20:80], 1 мл/мин.
ВЭЖХ-метод D:
Система Gilson, колонка 250×4,6 мм ID Chiralpak AD-H, 5 мкм;
метанол:этанол:гексан [5:15:80] с 0,1% об./об. триэтиламина, 1 мл/мин.
ВЭЖХ-метод E:
Система Gilson, колонка 250×4,6 мм ID Chiralpak OD-H, 5 мкм;
этанол:гексан [20:80] с 0,1% об./об. триэтиламина, 1 мл/мин.
ВЭЖХ-метод F:
Система Gilson, колонка 250×4,6 мм ID Chiralpak OD-H, 5 мкм;
этанол:гексан [20:80], 1 мл/мин.
Биологический тест
Обнаружено, что соединения по настоящему изобретению проявляют активность в цАМФ-исследовании, селективно относительно коровьих и свиных адренергических бета-2-рецепторов.
Клетки CHO, трансфицированные с использованием коровьих или свиных адренергических бета-2-рецепторов, выдерживают в культуре в среде DMEM/HAMS F12+10% FBS+2 мМ глутамина+500 мкг/мл генетицина (для свиных рецепторов среду дополняют 1,5 мМ HEPES) при 37°C в атмосфере 5% CO2.
Клетки высевают в 96-луночные планшеты с прозрачным дном ViewPlate в среду и инкубируют в течение ночи при 37°C в атмосфере 5% CO2. Клетки предварительно инкубируют с 0,5 мМ IBMX в PBS в течение 30 минут до инкубации с повышенными концентрациями экспериментального соединения (от 5×10-12 до 10-5 M) в течение 30 минут при 37°C в атмосфере 5% CO2. В конце периода инкубации соединение удаляют и исследуют клетки на цАМФ, используя исследовательский набор DiscoveRx Hit Hunter cAMP II™.
Для каждого экспериментального соединения образцы дублируют и полученные данные анализируют, используя программное обеспечение Graphpad Prism для анализа EC50.
Комнатная температура соответствует температуре от 20 до 25°C. Д/О указывает, что данные отсутствуют.
В следующих примерах структуры изображают следующим образом:
Пока не определено по-другому, клиновидные и пунктирные связи показывают только относительную стереохимию. В частности, 7-гидроксил и 6-N-заместитель ориентированы как в транс-конфигурации, но структуры включают оба стереоизомера 6R,7R и 6S,7S. Формула (A) представляет соединение, которое является смесью эпимеров по атому углерода, несущему метильный заместитель. Формула (B) изображает соединение, которое представляет собой отдельный неидентифицированный эпимер по атому углерода, несущему метильный заместитель. Формулы (C) и (D) изображают отдельные эпимеры известной относительной конфигурации. Таким образом, формула (A) изображает соединение, которое представляет собой смесь (C) и (D), тогда как (B) изображает соединение, которое представляет собой либо (C), либо (D).
Пример 1
6-({3-[4-(циклопропилметокси)фенил]-1-метилпропил}амино)-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
Смесь соединения получения 1 (100 мг, 0,4 ммоль), триэтиламина (80 мкл, 0,6 ммоль) и соединения получения 12 (204 мг, 0,9 ммоль) в метаноле (2 мл) перемешивают при комнатной температуре в течение 18 часов. Аккуратно добавляют боргидрид натрия (44 мг, 1,2 ммоль) и реакционную смесь перемешивают при комнатной температуре еще в течение 18 часов. Смесь разбавляют метанолом (8 мл) и добавляют ионообменную смолу Amberlyst® 15 (3 г, получена согласно J. Org. Chem. 1998, 63, 3471-3473). Смесь встряхивают в течение ночи и раствор отфильтровывают. Смолу промывают метанолом (3×20 мл) и обрабатывают аммиаком в метаноле (2 н., 5 мл) для высвобождения захваченных аминоспиртов. После встряхивания в течение 2 часов раствор отфильтровывают и смолу промывают аммиаком в метаноле (2 н., 2×5 мл). Объединенные метанол/аммиачные смывы концентрируют в вакууме, получая сырой продукт. Остаток растворяют в смеси ацетонитрил:вода (1:1, 1 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini 5 мкм), 20 мл/мин, используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (1:9):ацетонитрил:0,1% водный аммиак (9:1) [от 100:0 до 20:80, 2-20 мин; от 20:80 до 0:100, 20-25 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 1a (60 мг) в виде смеси 4 диастереоизомеров.
Альтернативный способ
К суспензии соединения получения 1 (15,5 г, 60,5 ммоль) в метаноле (80 мл) добавляют гидроксид калия (1,0 г, 18,2 ммоль). После перемешивания в течение 30 минут добавляют раствор соединения получения 12 (14,5 г, 66,5 ммоль) в метаноле (80 мл) и реакционную смесь охлаждают до 0°C. Добавляют цианборгидрид натрия (5,7 г, 90,7 ммоль) и реакционную смесь перемешивают при 0°C в течение 30 минут и затем при комнатной температуре в течение 48 часов. Реакционную смесь гасят водой (30 мл) и концентрируют в вакууме. Часть остатка очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M, смоченный дихлорметаном) с градиентным элюированием, дихлорметан:метанол [от 1:0 до 8:2]. Подходящие фракции объединяют и концентрируют, получая соединение примера 1b (540 мг) в виде пары энантиомеров.
К раствору соединения примера 1b (540 мг, 1,3 ммоль) в метаноле (5 мл) добавляют по капле хлористый водород в диэтиловом эфире (1 M, 1,3 мл). После перемешивания в течение 1 часа, добавляют по капле диэтиловый эфир (3 мл) и осадок собирают фильтрованием и промывают диэтиловым эфиром. Твердое вещество повторно растворяют в теплом метаноле (8 мл) и осаждают диэтиловым эфиром. После промывания диэтиловым эфиром твердое вещество сушат в вакуумной печи, получая соединение примера 1c (255 мг).
EC50, нМ
Пример 1a
1H-ЯМР (CD3OD): 0,30-0,35 (2H), 0,49-0,60 (2H), 1,10-1,15 (3H), 1,20-1,22 (1H), 4,60-4,68 (1H), 6,75-6,85 (2H), 7,00-7,10 (4H), 7,14-7,20 (1H).
Пример 1c
1H-ЯМР (CD3OD): 0,30-0,35 (2H), 0,58-0,62 (2H), 1,17-1,22 (1H), 1,35-1,43 (3H), 2,03-2,11 (2H), 4,80-4,84 (1H), 6,80-6,85 (2H), 7,04-7,06 (1H), 7,10-7,18 (3H), 7,29-7,32 (1H).
Пример 2
7-гидрокси-6-{[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
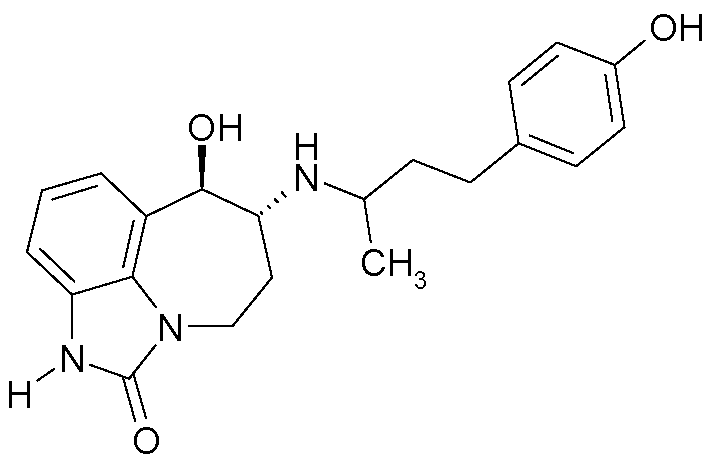
К суспензии соединения получения 1 (18,3 г, 71,5 ммоль) в метаноле (300 мл) добавляют триэтиламин (24,9 мл, 179 ммоль) и соединение получения 106 (12,9 г, 78,6 ммоль) в метаноле. Реакционную смесь перемешивают при комнатной температуре в течение 60 часов, охлаждают до 0°C и добавляют частями боргидрид натрия (4,1 г, 107,2 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь гасят водой и добавляют диоксид кремния (100 г). Смесь концентрируют в вакууме и смесь продукт/диоксид кремния загружают на колонку с диоксидом кремния (предварительно смоченным дихлорметаном); колонку элюируют смесью дихлорметан:метанол [от 1:0 до 4:6]. Подходящие фракции объединяют и концентрируют, получая соединение примера 2a (25,2 г) в виде смеси 4 диастереомеров.
Соединение примера 2a (3,0 г, 8,2 ммоль) очищают, используя систему Biotage™ с градиентным элюированием смесью дихлорметан:метанол [от 1:0 до 7:3]. Подходящие фракции объединяют и концентрируют, получая твердое вещество. Это твердое вещество дополнительно очищают, используя систему Biotage с градиентным элюированием смесью дихлорметан:метанол [от 85:15 до 65:35]. Подходящие фракции объединяют и концентрируют, получая соединение примера 2b (300 мг) в виде пары энантиомеров. ВЭЖХ метод B - время удерживания 11,74 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 2c (323 мг) в виде пары энантиомеров. ВЭЖХ метод B - время удерживания 12,00 мин.
Соединение примера 2c (148 мг, 0,4 ммоль) растворяют в смеси этанол:гексан (1:4) и энантиомеры разделяют методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 250×21,4 мм Chiralcel OD-H, 10 мкм, 10 мл/мин), используя смесь этанол:гексан [1:4] в качестве подвижной фазы. Подходящие фракции объединяют и концентрируют, получая соединение примера 2d (68 мг) в виде единственного энантиомера. ВЭЖХ-метод C - время удерживания 14,96 мин.
EC50, нМ
Пример 2a
1H-ЯМР (d6-ДМСО): 1,00-1,18 (3H), 4,60-4,65 (1H), 6,60-6,66 (2H), 6,84-6,89 (1H), 6,90-7,00 (3H), 7,00-7,11 (1H).
Пример 2b
1H-ЯМР (CD3OD): 1,21-1,28 (3H), 4,72-4,77 (1H), 6,62-6,68 (2H), 6,96-7,04 (3H), 7,08-7,10 (1H), 7,11-7,13 (1H).
Пример 2c
1H-ЯМР (d6-ДМСО): 0,90-1,00 (3H), 4,50-4,55 (1H), 6,79-6,85 (2H), 6,80-6,87 (1H), 6,90-6,96 (3H), 7,00-7,05 (1H).
Пример 2d
1H-ЯМР (CD3OD): 1,10-1,13 (3H), 1,74-1,82 (2H), 4,63-4,66 (1H), 6,62-6,66 (2H), 6,97-7,09 (4H), 7,20-7,22 (1H).
Пример 3
6-{[3-(2,3-дигидро-1-бензофуран-5-ил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
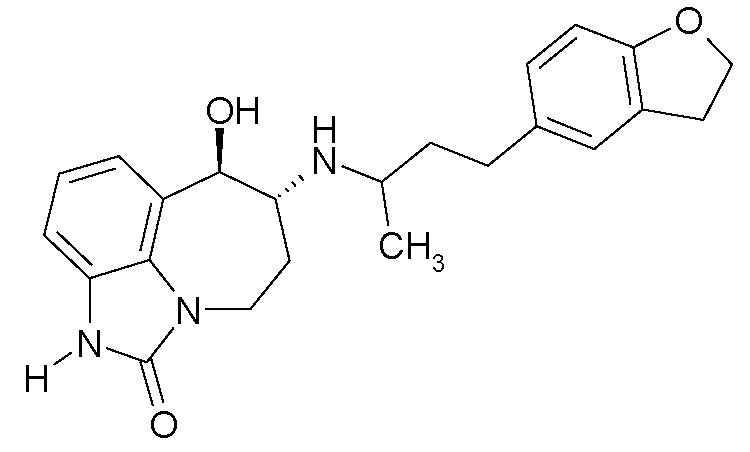
Смесь соединения получения 1 (117 мг, 0,5 ммоль), триэтиламина (100 мкм, 0,7 ммоль) и соединения получения 170 (190 мг, 1,0 ммоль) в метаноле (2 мл) нагревают при 80°C в микроволновой печи (300 Вт) в течение 40 минут. Реакционную смесь перемешивают в течение ночи при комнатной температуре перед добавлением боргидрида натрия (120 мг, 3,2 ммоль). После перемешивания при комнатной температуре в течение 18 часов смесь разбавляют метанолом (8 мл) и добавляют ионообменную смолу Amberlyst® 15 (4 г, приготовлена согласно J. Org. Chem. 1998, 63, 3471-3473). Смесь встряхивают в течение ночи и раствор отфильтровывают. Смолу промывают метанолом (3×20 мл) и обрабатывают аммиаком в метаноле (2 н., 15 мл). После встряхивания в течение 2 часов раствор отфильтровывают и смолу промывают аммиаком в метаноле (2 н., 2×15 мл). Объединенные метанол/аммиачные смывы концентрируют в вакууме и остаток повторно растворяют в метаноле (5 мл). Этот раствор фильтруют и концентрируют в вакууме. Остаток растворяют в смеси ацетонитрил:вода (1:1, 1,4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×19 мм XTERRA C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (1:9):ацетонитрил:0,1% водный аммиак (9:1) [от 1:0 до 0:1, 0-20 мин; 0:1, 20-25 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 3a (74 мг) в виде смеси 4 диастереомеров.
Альтернативный синтез
К суспензии соединения получения 1 (0,95 г, 3,7 ммоль) в метаноле (25 мл) добавляют соединение получения 170 (776 мг, 4,1 ммоль) в метаноле (25 мл), а затем триэтиламин (0,16 мл, 1,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и добавляют частями цианборгидрид натрия (0,58 г, 9,27 ммоль). После перемешивания при комнатной температуре в течение 60 часов реакционную смесь гасят водой (1 мл) и концентрируют в вакууме. Остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M, смоченный дихлорметаном) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 100:0 до 84:16]. Подходящие фракции объединяют и концентрируют, получая соединение примера 3b (578 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,97 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 3c (563 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 14,25 мин.
EC50, нМ
Пример 3a
1H-ЯМР (CD3OD): 1,08-1,18 (3H), 3,16-3,21 (2H), 4,42-4,48 (2H), 4,61-4,64 (1H), 6,55-6,60 (1H), 6,80-6,84 (1H), 6,99-7,05 (3H), 7,18-7,20 (1H).
Пример 3b
1H-ЯМР (CD3OD): 1,14-1,19 (3H), 3,75-3,84 (1H), 3,93-4,00 (1H), 4,44-4,51 (2H), 4,63-4,66 (1H), 6,54-6,58 (1H), 6,80-6,85 (1H), 6,98-7,08 (3H), 7,15-7,19 (1H).
Пример 3c
1H-ЯМР (CD3OD): 1,10-1,15 (3H), 3,81-4,00 (2H), 4,41-4,50 (2H), 4,63-4,69 (1H), 6,56-6,60 (1H), 6,83-6,90 (1H), 7,00-7,10 (3H), 7,19-7,21 (1H).
Пример 4
7-гидрокси-6-{[3-(2-гидроксифенил)-1,3-диметилбутил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
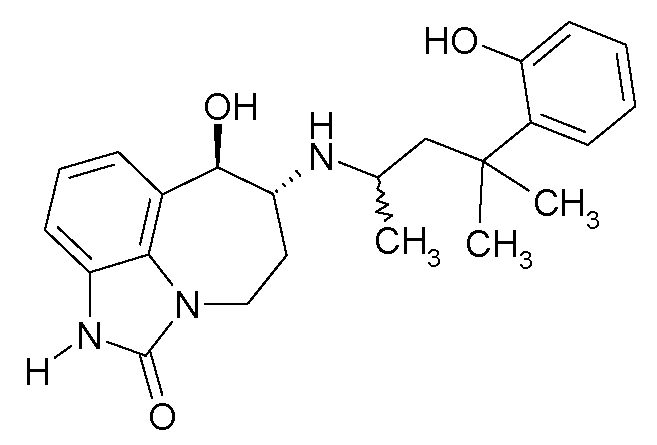
К раствору соединения получения 1 (144 мг, 0,6 ммоль) и соединения получения 13 (130 мг, 0,7 ммоль) в метаноле (10 мл) добавляют триэтиламин (24 мкл, 0,2 ммоль). Смесь перемешивают при комнатной температуре в течение 1 часа перед добавлением цианборгидрида натрия (53 мг, 0,9 ммоль). После перемешивания при комнатной температуре в течение 60 часов реакционную смесь нагревают при 60°C в течение 48 часов и затем гасят водой и концентрируют в вакууме. Остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 25+M) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 80:20]. Подходящие фракции объединяют и концентрируют и остаток растворяют в смеси ацетонитрил:вода (9:1, 1 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 1:0 до 0:1, 0-20 мин; 0:1, 20-25 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 4 (3 мг) в виде пары энантиомеров.
EC50, нМ
Пример 4
1H-ЯМР (CD3OD): 0,90-0,97 (3H), 1,22-1,28 (6H), 4,47-4,50 (1H), 6,19-6,21 (1H), 6,50-6,53 (1H), 6,67-6,71 (1H), 6,99-7,02 (4H).
Пример 5
6-{[3-(3-хлор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
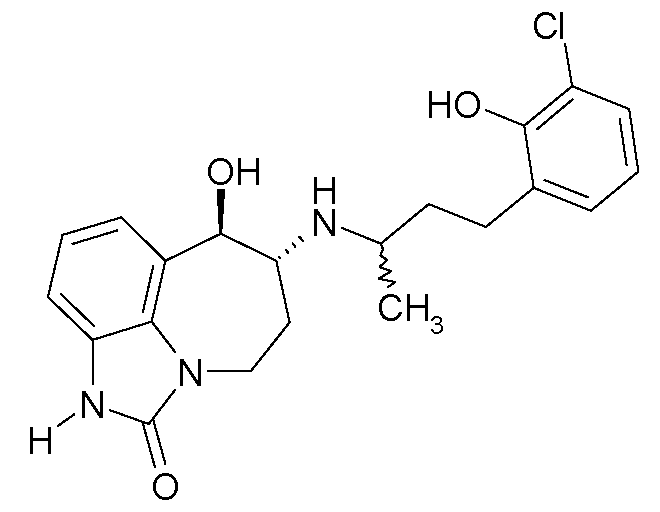
К раствору соединения получения 1 (591 мг, 2,3 ммоль) в метаноле (10 мл) добавляют соединение получения 16 (500 мг, 2,5 ммоль) в метаноле (10 мл), а затем триэтиламин (97 мкл, 0,7 ммоль). Смесь перемешивают при комнатной температуре в течение 1 часа перед добавлением цианборгидрида натрия (363 мг, 5,8 ммоль). После перемешивания при комнатной температуре в течение 5 дней реакционную смесь гасят водой (2 мл) перед первым добавлением лимонной кислоты (1 г) и затем гидрокарбонатом натрия (3 г). Смесь концентрируют в вакууме и остаток смешивают с диоксидом кремния, растворяют в метаноле (50 мл) и повторно концентрируют. Остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M, кондиционированный смесью дихлорметан:2,5% аммиак в метаноле) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 91:9]. Подходящие фракции объединяют и концентрируют, получая соединение примера 5a (166 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,43 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 5b (50 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 14,36 мин.
Часть соединения примера 5b (150 мг, 0,4 ммоль) растворяют в смеси этанол:метанол (1:1, 4 мл) и нагревают при 120°C в микроволновой печи (CEM, 300 Вт) в течение 2 минут для повышения растворимости. Энантиомеры разделяют методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 500×50 мм ID Chiralpak AD-H, 20 мкм, 50 мл/мин), используя в качестве подвижной фазы смесь метанол:этанол:гексан [5:15:80] с 0,1% об./об. триэтиламина. Подходящие фракции объединяют и концентрируют, получая соединение примера 5c (100 мг) в виде единственного энантиомера. ВЭЖХ метод D - время удерживания 17,97 мин.
EC50, нМ
Пример 5a
1H-ЯМР (CD3OD): 1,14-1,18 (3H), 1,71-1,86 (2H), 4,66-4,69 (1H), 6,64-6,69 (1H), 6,93-7,05 (3H), 7,07-7,10 (1H), 7,14-7,18 (1H).
Пример 5b
1H-ЯМР (CD3OD): 1,07-1,10 (3H), 1,75-1,85 (2H), 4,74-4,77 (1H), 6,65-6,70 (1H), 6,96-7,10 (4H), 7,23-7,27 (1H).
Пример 5c
(6R,7R)-6-{[3-(3-хлор-2-гидроксифенил)-(1R)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
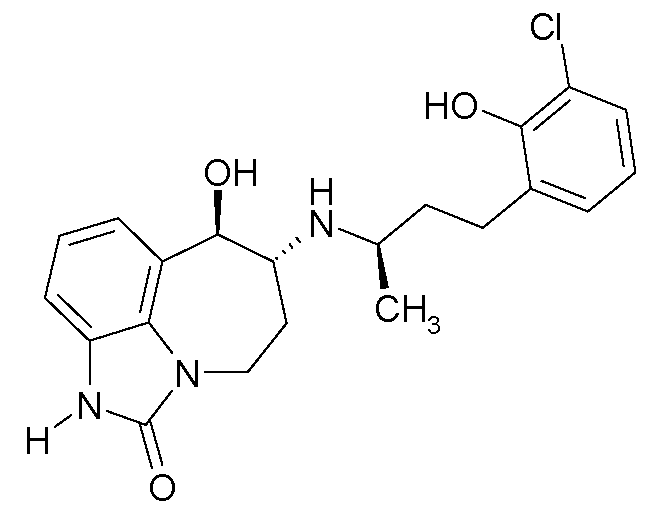
1H-ЯМР (CD3OD): 1,10-1,15 (3H), 4,77-4,81 (1H), 6,68-6,73 (1H), 6,98-7,03 (2H), 7,06-7,13 (2H), 7,26-7,30 (1H).
Пример 6
7-гидрокси-6-{[3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
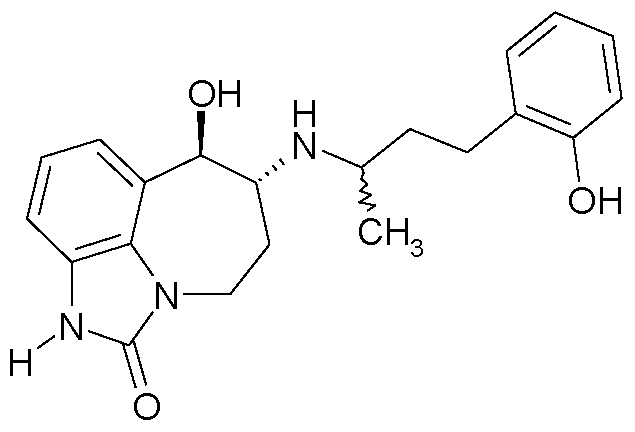
К раствору соединения получения 100 (7,0 г, 43,2 ммоль) в метаноле (200 мл) добавляют соединение получения 1 (10,0 г, 39,2 ммоль), а затем гидроксид калия (0,7 г, 43,2 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (6,2 г, 98,1 ммоль) и реакционную смесь нагревают при 60°C в течение 60 часов. Смесь гасят водой (10 мл) и концентрируют в вакууме. Остаток подвергают азеотропной перегонке с метанолом, предварительно абсорбируют на диоксиде кремния (60 г) и очищают методом колоночной хроматографии (диоксид кремния, 280 г) с градиентным элюированием смесью 2% аммиак в метаноле:дихлорметан [от 0:1 до 4:96]. Подходящие фракции объединяют и концентрируют, получая соединение примера 6a (2,0 г) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,38 мин.
К раствору соединения примера 6a (5,0 г, 13,7 ммоль) в метаноле (30 мл) добавляют по капле хлористый водород в диэтиловом эфире (1 M, 13,7 мл). После перемешивания в течение 2 часов добавляют диэтиловый эфир (200 мл) и осадок собирают фильтрованием, промывая смесью метанол:диэтиловый эфир (15:85, 100 мл). Твердое вещество растворяют в изопропиловом спирте (22 мл) и воде (1,3 мл) при 98°C, затем охлаждают до 0°C и перемешивают в течение 45 минут. Полученное твердое вещество собирают фильтрованием, промывают холодным изопропиловым спиртом и диэтиловым эфиром и сушат в вакуумной печи, получая соль гидрохлорид, соединение примера 6b (1,21 г).
Соединение примера 6a (1,1 г, 3,1 ммоль) растворяют в смеси этанол:метанол (3:1, 20 мл) и нагревают для повышения растворимости. Энантиомеры разделяют методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 500×50 мм ID Chiralcel OD, 20 мкм, 50 мл/мин), используя в качестве подвижной фазы смесь метанол:этанол:гексан [5:5:90] с 0,1% об./об. триэтиламина. Подходящие фракции объединяют и концентрируют, получая соединение примера 6c (432 мг) в виде единственного энантиомера. ВЭЖХ метод E - время удерживания 8,46 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 6d (502 мг) в виде единственного энантиомера. ВЭЖХ метод E - время удерживания 9,88 мин.
К раствору соединения примера 6c (378 мг, 1,0 ммоль) в метаноле (6 мл) при 0°C добавляют по капле хлористый водород в диэтиловом эфире (1 M, 1,2 мл). После перемешивания в течение 1,5 часа добавляют диэтиловый эфир (34 мл) и осадок собирают фильтрованием. Полученное твердое вещество промывают диэтиловым эфиром (2×40 мл) и сушат в вакуумной печи при 50°C, получая соль гидрохлорид, соединение примера 6e (394 мг).
К раствору соединения примера 6d (419 мг, 1,1 ммоль) в метаноле (6 мл) при 0°C добавляют по капле хлористый водород в диэтиловом эфире (1 M, 1,3 мл). После перемешивания в течение 1,5 часа добавляют диэтиловый эфир (34 мл) и осадок собирают фильтрованием. Полученное твердое вещество промывают диэтиловым эфиром (2×40 мл) и сушат в вакуумной печи при 50°C, получая соль гидрохлорид, соединение примера 6f (418 мг).
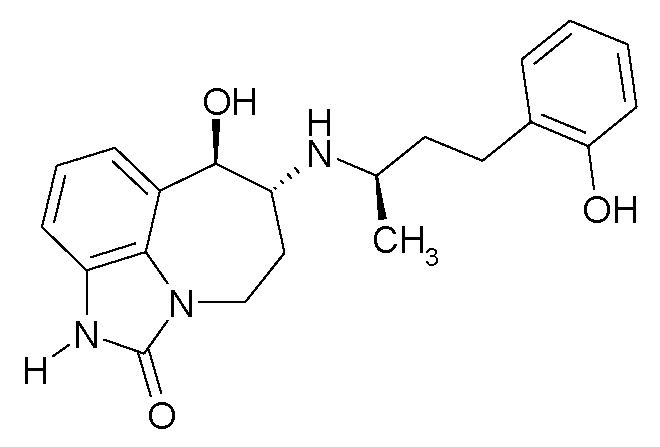
Пример 6f - абсолютная стереохимия
Альтернативный синтез
К раствору соединения получения 1 (5,0 г, 19,6 ммоль) в метаноле (100 мл) в атмосфере азота добавляют соединение получения 41 (5,5 г, 33,5 ммоль), а затем триэтиламин (0,8 мл, 5,9 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (1,8 г, 29,3 ммоль) и реакционную смесь нагревают при 50°C в течение 40 часов. Смесь концентрируют в вакууме и остаток растворяют в смеси дихлорметан:2% аммиак в метаноле (4:1, 50 мл) и фильтруют через подложку из диоксида кремния. Фильтрат концентрируют в вакууме и остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i, кондиционированный смесью дихлорметан:2% аммиак в метаноле, с градиентным элюированием смесью дихлорметан:2% аммиак в метаноле [от 94:6 до 87:13]. Подходящие фракции объединяют и концентрируют, получая соединение примера 6a (2,14 г) в виде пары энантиомеров.
EC50, нМ
Пример 6a
1H-ЯМР (CD3OD): 1,08-1,12 (3H), 4,63-4,66 (1H), 6,65-6,70 (2H), 6,92-7,00 (3H), 7,02-7,06 (1H), 7,19-7,22 (1H).
Пример 6b
1H-ЯМР (CD3OD): 1,38-1,42 (3H), 4,87-4,91 (1H), 6,72-6,77 (2H), 6,99-7,04 (2H), 7,07-7,12 (2H), 7,26-7,30 (1H).
Пример 6d
1H-ЯМР (CD3OD): 1,38-1,44 (3H), 2,01-2,18 (2H), 4,87-4,91 (1H), 6,72-6,77 (2H), 6,98-7,04 (2H), 7,06-7,11 (2H), 7,25-7,29 (1H).
Пример 6f
1H-ЯМР (CD3OD): 1,38-1,41 (3H), 2,01-2,17 (2H), 4,88-4,92 (1H), 6,74-6,78 (2H), 6,99-7,04 (2H), 7,06-7,10 (2H), 7,25-7,29 (1H).
Пример 7
6-{[3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
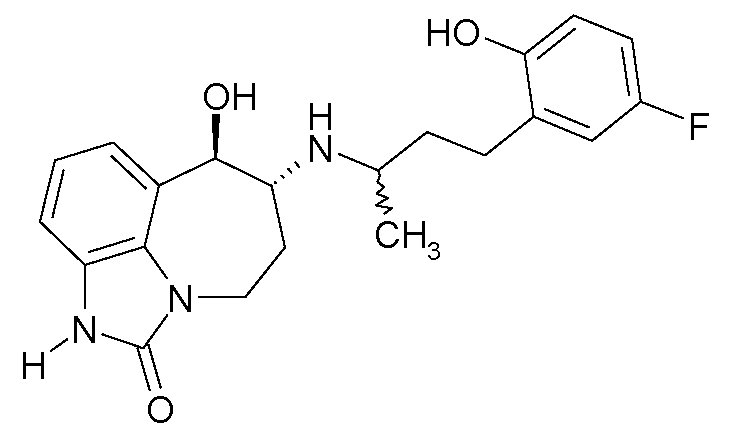
К раствору соединения получения 1 (1,7 г, 6,6 ммоль) в метаноле (34 мл) добавляют соединение получения 42 (1,2 г, 6,6 ммоль), а затем триэтиламин (0,3 мл, 2,0 ммоль). После перемешивания при 50°C в течение 30 минут добавляют цианборгидрид натрия (662 мг, 10,5 ммоль) и реакционную смесь нагревают при 50°C в течение 18 часов. Смесь концентрируют в вакууме и остаток растворяют в смеси метанол:дихлорметан (1:4) и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i, кондиционированный смесью дихлорметан:2% аммиак в метаноле) с градиентным элюированием смесью дихлорметан:2% аммиак в метаноле [от 96:4 до 85:15]. Подходящие фракции объединяют и концентрируют, получая соединение примера 7a (900 мг) в виде пары энантиомеров. Время удерживания 13,23 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 7b (1,07 г) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,89 мин.
EC50, нМ
Пример 7a
1H-ЯМР (CD3OD): 1,21-1,26 (3H), 2,52-2,64 (2H), 4,67-4,70 (1H), 6,60-6,71 (2H), 6,79-6,82 (1H), 6,98-7,06 (2H), 7,18-7,21 (1H).
Пример 7b
1H-ЯМР (CD3OD): 1,09-1,13 (3H), 1,70-1,85 (2H), 4,62-4,66 (1H), 6,60-6,66 (2H), 6,77-6,80 (1H), 6,95-7,05 (2H), 7,18-7,21 (1H).
Пример 8
7-гидрокси-6-{[3-(2-гидрокси-3-метоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
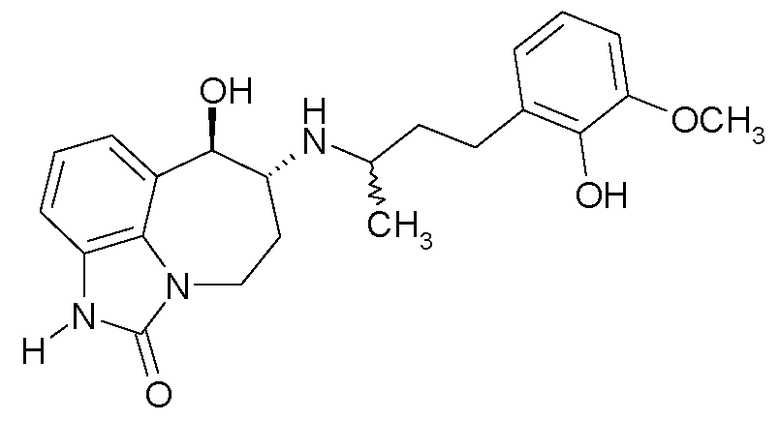
К раствору соединения получения 1 (0,6 г, 2,4 ммоль) в метаноле (10 мл) добавляют соединение получения 20 (500 мг, 2,6 ммоль) в метаноле (5 мл), а затем триэтиламин (99 мкл, 0,7 ммоль). После перемешивания в течение 1 часа добавляют цианборгидрид натрия (372 мг, 5,2 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь гасят водой (1 мл), перемешивают в течение 60 минут и концентрируют в вакууме. Остаток растворяют в смеси ацетонитрил:вода (9:1, 4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 250×50 мм Gemini C18(2), 120 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 100:0 до 75:25, 0-32 мин; от 75:25 до 0:100, 32-33 мин; 0:100, 33-36 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 8a (118 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 12,99 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 8b (150 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,46 мин.
EC50, нМ
Пример 8a
1H-ЯМР (CD3OD): 1,12-1,16 (3H), 3,79-3,80 (3H), 4,58-4,61 (1H), 6,58-6,66 (2H), 6,70-6,73 (1H), 6,95-7,05 (2H), 7,16-7,19 (1H).
Пример 8b
1H-ЯМР (CD3OD): 1,09-1,12 (3H), 3,79-3,80 (3H), 4,63-4,66 (1H), 6,62-6,68 (2H), 6,70-6,73 (1H), 6,98-7,06 (2H), 7,19-7,21 (1H).
Пример 9
7-гидрокси-6-[(1-метил-3-фенилпропил)амино]-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
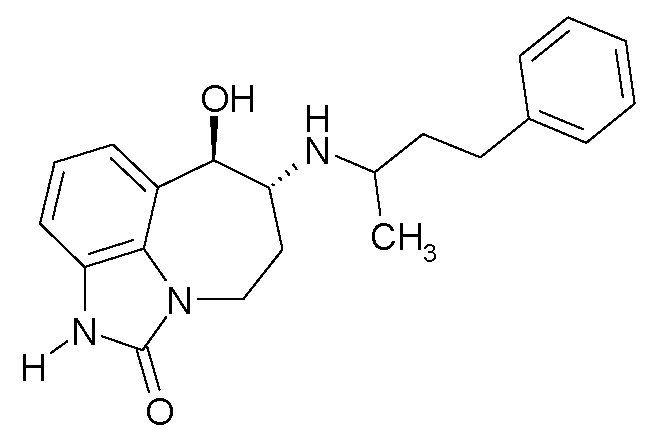
Смесь соединения получения 1 (117 мг, 0,5 ммоль), триэтиламина (100 мкл, 0,7 ммоль) и соединения получения 112 (135 мг, 1,0 ммоль) в метаноле (2 мл) нагревают при 80°C в микроволновой печи (300 Вт) в течение 40 минут. Реакционную смесь перемешивают в течение ночи при комнатной температуре перед добавлением боргидрида натрия (120 мг, 3,2 ммоль). После перемешивания при комнатной температуре в течение 18 часов смесь разбавляют метанолом (8 мл) и добавляют ионообменную смолу Amberlyst® 15 (4 г, приготовлена согласно J. Org. Chem. 1998, 63, 3471-3473). Смесь встряхивают в течение ночи и раствор отфильтровывают. Смолу промывают метанолом (3×20 мл) и обрабатывают аммиаком в метаноле (2 н., 15 мл). После встряхивания в течение 2 часов раствор отфильтровывают и смолу промывают аммиаком в метаноле (2 н., 2×15 мл). Объединенные метанол/аммиачные смывы концентрируют в вакууме и остаток повторно растворяют в метаноле (5 мл). Этот раствор фильтруют и концентрируют в вакууме. Остаток растворяют в смеси ацетонитрил:вода (1:1, 1,2 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×19 мм XTERRA C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (1:9):ацетонитрил:0,1% водный аммиак (9:1) [от 1:0 до 0:1, 0-20 мин; 0:1, 20-25 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 9a (97 мг) в виде смеси 4 диастереомеров.
К раствору соединения примера 9a (350 мг, 1,0 ммоль) в метаноле (7 мл) добавляют по капле хлористый водород в диэтиловом эфире (1 M, 1,0 мл). После перемешивания в течение 45 минут добавляют по капле диэтиловый эфир (30 мл) и раствор оставляют стоять в течение ночи. К смеси добавляют смесь метанол:диэтиловый эфир (1:4, 20 мл) и осадок собирают фильтрованием. Полученное твердое вещество промывают смесью метанол:диэтиловый эфир (1:4, 3×15 мл) и диэтиловым эфиром (3×15 мл) и сушат в вакуумной печи при 50°C, получая соль гидрохлорид, соединение примера 9b (183 мг).
Соединение примера 9a (3,0 г, 8,6 ммоль) растворяют в смеси дихлорметан:метанол (9:1, 12 мл) и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i) с градиентным элюированием смесью дихлорметан:2% аммиак в метаноле [от 94:6 до 90:10]. Подходящие фракции объединяют и концентрируют, получая соединение примера 9c (0,8 г) в виде пары энантиомеров.
К раствору соединения примера 9c (2,5 г, 7,1 ммоль) в метаноле (38 мл) при 0°C добавляют по капле хлористый водород в диэтиловом эфире (1 M, 7,1 мл). После перемешивания в течение 45 минут медленно добавляют диэтиловый эфир (205 мл) и осадок собирают фильтрованием. Полученное твердое вещество промывают диэтиловым эфиром (3×200 мл) и сушат в вакуумной печи, получая соль гидрохлорид, соединение примера 9d (2,6 г).
Соединение примера 9c (1,0 г, 2,9 ммоль) растворяют в этаноле (30 мл) и нагревают для повышения растворимости. Энантиомеры разделяют методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 500×50 мм ID Chiralcel OD-H, 20 мкм), используя этанол:гексан [15:85] в качестве подвижной фазы. Подходящие фракции объединяют и концентрируют, получая соединение примера 9e (527 мг) в виде единственного энантиомера ВЭЖХ метод F - время удерживания 12,43 мин.
EC50, нМ
Пример 9b
1H-ЯМР (d6-ДМСО): 1,00-1,05 (3H), 4,50-4,57 (1H), 6,80-6,95 (2H), 7,01-7,04 (1H), 7,10-7,15 (3H), 7,20-7,25 (2H).
Пример 9d
1H-ЯМР (CD3OD): 1,41-1,43 (3H), 2,69-2,85 (2H), 4,95-4,98 (1H), 7,02-7,04 (1H), 7,10-7,15 (1H), 7,19-7,21 (1H), 7,23-7,30 (5H).
Пример 9e
1H-ЯМР (CD3OD): 1,10-1,13 (3H), 4,59-4,61 (1H), 6,98-7,05 (2H), 7,08-7,21 (6H).
Пример 10
6-{[3-(3,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он

К раствору соединения получения 1 (2,0 г, 7,9 ммоль) в метаноле (40 мл) добавляют соединение получения 48 (1,6 г, 7,9 ммоль), а затем триэтиламин (330 мкл, 2,4 ммоль). После перемешивания в течение 25 минут добавляют цианборгидрид натрия (744 мг, 11,8 ммоль) и реакционную смесь перемешивают при 50°C в течение 80 часов. Смесь концентрируют в вакууме, получая соединение примера 10a (4,8 г) в виде смеси 4 диастереомеров.
Раствор соединения примера 10a (4,8 г, 11,8 ммоль) в смеси дихлорметан:2,5% аммиак в метаноле (2:1, 45 мл) очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i, кондиционированный смесью дихлорметан:2,5% аммиак в метаноле [98:2]) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 97:3 до 88:12]. Подходящие фракции объединяют и концентрируют, получая соединение примера 10b (1,1 г) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 12,69 мин.
EC50, нМ
Пример 10b
1H-ЯМР (CD3OD): 1,11-1,14 (3H), 1,74-1,80 (2H), 4,70-4,74 (1H), 6,63-6,71 (2H), 6,99-7,01 (1H), 7,04-7,08 (1H), 7,22-7,24 (1H).
Пример 11
6-{[3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он

К раствору соединения получения 1 (2,7 г, 10,6 ммоль) в метаноле (25 мл) добавляют соединение получения 18 (2,9 г, 11,7 ммоль) в метаноле (25 мл). К суспензии добавляют триэтиламин (0,5 мл, 3,2 ммоль) и смесь перемешивают при 45°C в течение 1 часа, перед добавлением цианборгидрида натрия (1,7 г, 26,6 ммоль). Реакционную смесь нагревают при 45°C в течение 5 дней и затем гасят, добавляя воду (4 мл), лимонную кислоту (2,0 г, 10,4 ммоль) и затем гидрокарбонат натрия (6,0 г). Смесь концентрируют в вакууме и к остатку добавляют метанол (100 мл) и диоксид кремния. Суспензию концентрируют в вакууме и смесь продукт/диоксид кремния элюируют смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Подходящие фракции объединяют и концентрируют и остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M, кондиционированный смесью дихлорметан:2,5% аммиак в метаноле [96:4]) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 91:9]. Подходящие фракции объединяют и концентрируют и остаток растворяют в ацетонитриле и диметилсульфоксиде (1:1, 4 мл) и затем очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 250×50 мм Gemini C18(2), 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 9:1 до 7:3 (в течение 10 минут), затем от 7:3 до 5:95 (в течение 16 минут)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 11a (44 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 13,6 мин.
EC50, нМ
1H-ЯМР (CD3OD): 1,32-1,35 (3H), 1,98-2,05 (2H), 4,18-4,22 (1H), 6,59-6,64 (1H), 6,99-7,06 (2H), 7,09-7,12 (1H), 7,29-7,32 (1H).
Следующие примеры получают способами, аналогичными способам, описанным выше для примеров 1-11:
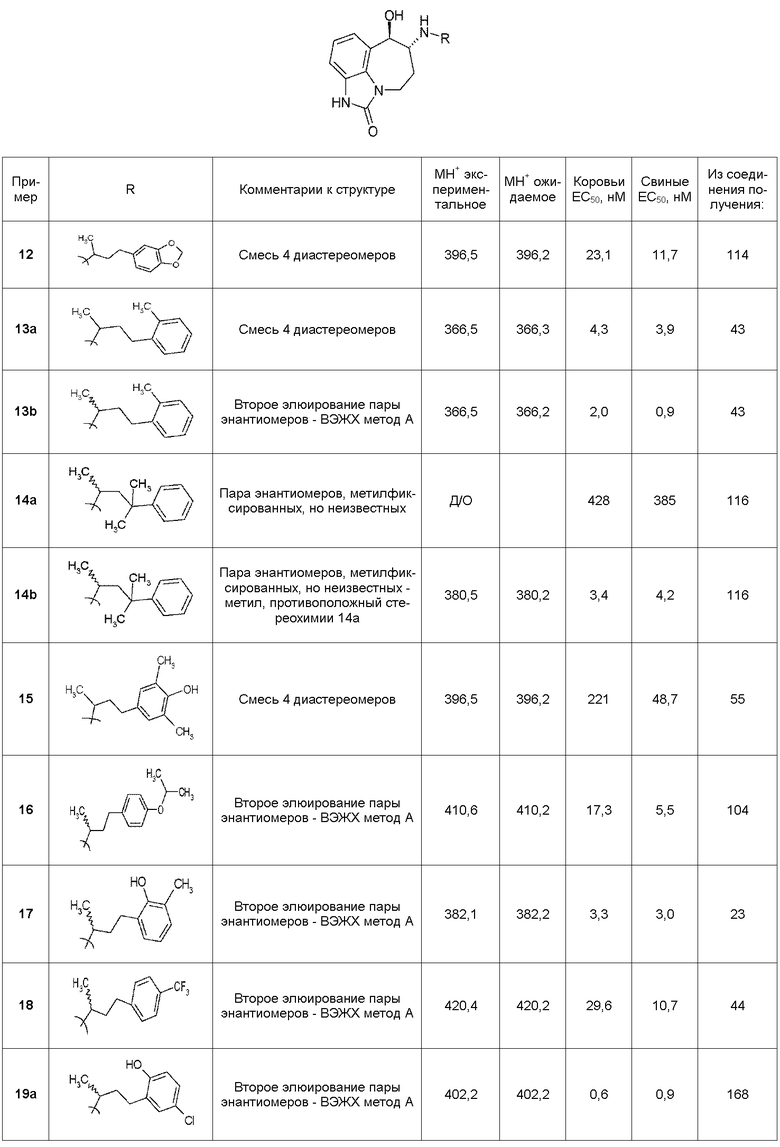
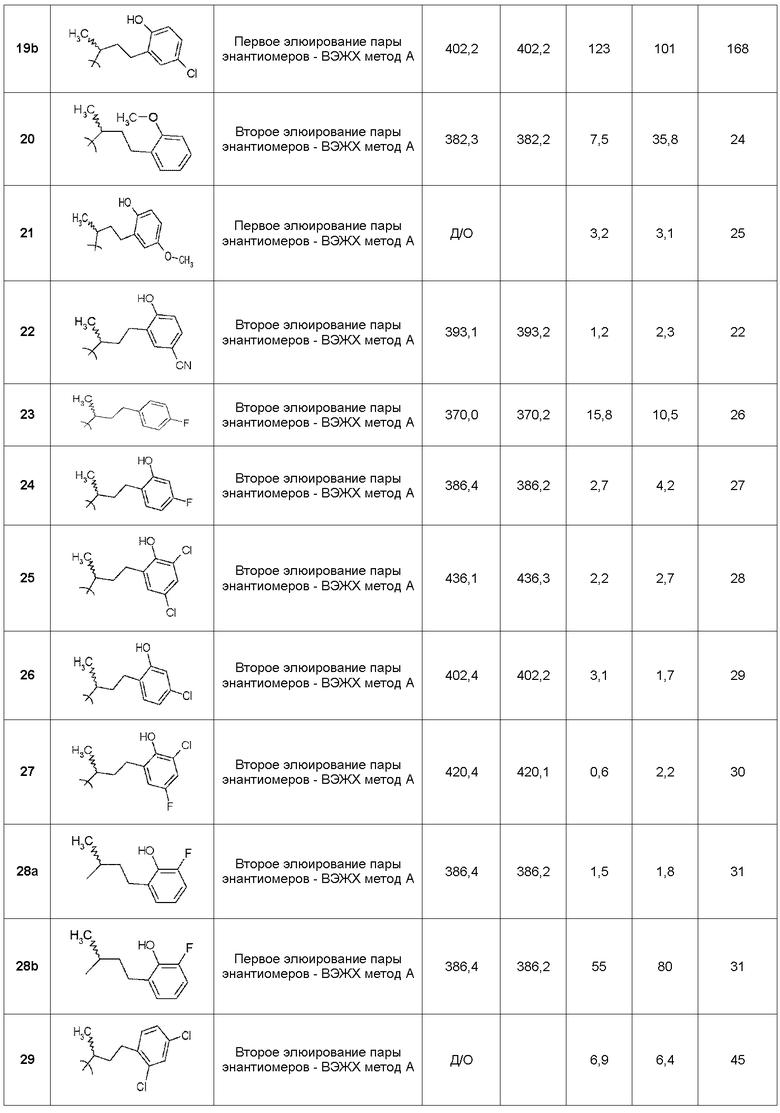
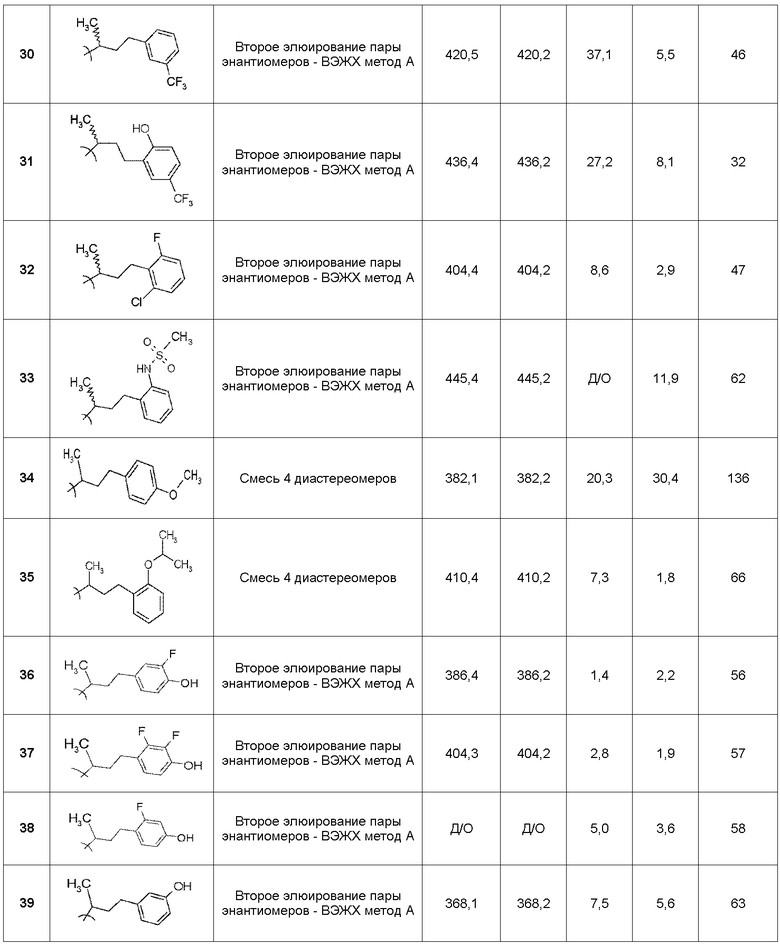
Пример 12
6-{[3-(1,3-бензодиоксол-5-ил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,08-1,20 (3H), 4,61-4,68 (1H), 5,82-5,90 (2H), 6,50-6,70 (3H), 6,98-7,10 (2H), 7,17-7,22 (1H).
Пример 13a
7-гидрокси-6-{[1-метил-3-(2-метилфенил)пропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,17-1,22 (3H), 2,21-2,24 (3H), 3,80-4,00 (2H), 4,65-4,70 (1H), 7,00-7,12 (6H), 7,18-7,21 (1H).
Пример 13b
7-гидрокси-6-{[1-метил-3-(2-метилфенил)пропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (d6-ДМСО): 1,00-1,09 (3H), 2,22-2,23 (3H), 4,50-4,52 (1H), 6,81-6,83 (1H), 6,90-6,94 (1H), 7,01-7,11 (5H).
Пример 14a
6-[(1,3-диметил-3-фенилбутил)амино]-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 0,99-1,05 (3H), 1,13-1,19 (6H), 4,69-4,73 (1H), 6,96-7,03 (5H), 7,04-7,08 (1H), 7,08-7,12 (2H).
Пример 14b
6-[(1,3-диметил-3-фенилбутил)амино]-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 0,89-0,95 (3H), 1,20-1,23 (3H), 1,35-1,40 (3H), 4,45-4,50 (1H), 6,80-6,85 (1H), 6,95-7,10 (5H), 7,20-7,26 (2H).
Пример 15
7-гидрокси-6-{[3-(4-гидрокси-3,5-диметилфенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,09-1,15 (3H), 1,70-1,81 (2H), 2,15-2,17 (6H), 4,60-4,62 (1H), 6,70-6,73 (2H), 6,99-7,07 (2H), 7,18-7,20 (1H).
Пример 16
7-гидрокси-6-{[3-(4-изопропоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,10-1,18 (3H), 1,25-1,29 (6H), 4,62-4,68 (1H), 6,75-6,81 (2H), 6,99-7,10 (4H), 7,19-7,22 (1H).
Пример 17
7-гидрокси-6-{[3-(2-гидрокси-3-метилфенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,39-1,43 (3H), 2,16-2,19 (3H), 4,86-4,90 (1H), 6,67-6,72 (1H), 6,90-6,96 (2H), 7,00-7,04 (1H), 7,06-7,12 (1H), 7,25-7,29 (1H).
Пример 18
7-гидрокси-6-({1-метил-3-[4-(трифторметил)фенил]пропил}амино)-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,15-1,17 (3H), 1,78-1,86 (2H), 4,62-4,64 (1H), 6,98-7,06 (2H), 7,18-7,21 (1H), 7,38-7,41 (2H), 7,55-7,59 (2H).
Пример 19a
6-{[3-(5-хлор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,39-1,43 (3H), 2,61-2,80 (2H), 4,88-4,92 (1H), 6,70-6,73 (1H), 6,97-7,04 (2H), 7,09-7,12 (2H), 7,27-7,31 (1H).
Пример 19b
6-{[3-(5-хлор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,15-1,19 (3H), 1,70-1,87 (2H), 4,63-4,67 (1H), 6,63-6,66 (1H), 6,91-7,05 (4H), 7,15-7,18 (1H).
Пример 20
7-гидрокси-6-{[3-(2-метоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,13-1,17 (3H), 3,73-3,75 (3H), 4,65-4,68 (1H), 6,78-6,87 (2H), 6,98-7,15 (4H), 7,17-7,21 (1H).
Пример 21
7-гидрокси-6-{[3-(2-гидрокси-5-метоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,16-1,19 (3H), 3,66-3,69 (3H), 4,69-4,74 (1H), 6,58-6,61 (1H), 6,63-6,66 (2H), 6,99-7,09 (2H), 7,22-7,24 (1H).
Пример 22
4-гидрокси-3-(3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил)бензонитрил
1H-ЯМР (CD3OD): 1,15-1,19 (3H), 1,74-1,82 (2H), 4,71-4,75 (1H), 6,79-6,82 (1H), 6,99-7,09 (2H), 7,25-7,28 (1H), 7,35-7,39 (1H), 7,42-7,44 (1H).
Пример 23
6-{[3-(4-фторфенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,08-1,13 (3H), 1,71-1,81 (2H), 4,60-4,64 (1H), 6,88-6,99 (3H), 7,00-7,06 (1H), 7,12-7,19 (3H).
Пример 24
6-{[3-(4-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,09-1,12 (3H), 1,70-1,80 (2H), 4,65-4,70 (1H), 6,40-6,48 (2H), 6,99-7,11 (3H), 7,22-7,25 (1H).
Пример 25
6-{[3-(3,5-дихлор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,09-1,12 (3H), 1,80-1,88 (2H), 4,80-4,83 (1H), 7,00-7,03 (2H), 7,04-7,12 (2H), 7,27-7,29 (1H).
Пример 26
6-{[3-(4-хлор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,12-1,17 (3H), 1,70-1,80 (2H), 4,63-4,66 (1H), 6,61-6,63 (1H), 6,77-6,79 (1H), 6,99-7,10 (3H), 7,20-7,22 (1H).
Пример 27
6-{[3-(3-хлор-5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,09-1,12 (3H), 4,75-4,78 (1H), 6,80-6,82 (1H), 6,91-6,94 (1H), 7,00-7,03 (1H), 7,07-7,10 (1H), 7,25-7,30 (1H).
Пример 28a
6-{[3-(3-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,12-1,15 (3H), 1,74-1,81 (2H), 4,70-4,72 (1H), 6,63-6,66 (1H), 6,80-6,87 (2H), 6,99-7,10 (2H), 7,23-7,25 (1H).
Пример 28b
6-{[3-(3-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,16-1,20 (3H), 1,70-1,80 (2H), 4,65-4,68 (1H), 6,62-6,66 (1H), 6,80-6,89 (2H), 6,99-7,08 (2H), 7,18-7,21 (1H).
Пример 29
6-{[3-(2,4-дихлорфенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,12-1,15 (3H), 1,70-1,80 (2H), 4,61-4,63 (1H), 6,96-7,04 (2H), 7,16-7,20 (2H), 7,22-7,24 (1H), 7,36-7,38 (1H).
Пример 30
7-гидрокси-6-({1-метил-3-[3-(трифторметил)фенил]пропил}амино)-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,14-1,17 (3H), 1,78-1,87 (2H), 4,62-4,64 (1H), 6,99-7,09 (2H), 7,20-7,22 (1H), 7,41-7,50 (3H), 7,51-7,52 (1H).
Пример 31
7-гидрокси-6-({3-[2-гидрокси-5-(трифторметил)фенил]-1-метилпропил}амино)-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,38-1,41 (3H), 2,00-2,10 (2H), 4,19-4,23 (1H), 6,88-6,91 (1H), 7,01-7,04 (1H), 7,10-7,14 (1H), 7,30-7,35 (2H), 7,40-7,44 (1H).
Пример 32
6-{[3-(2-хлор-6-фторфенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (d6-ДМСО): 1,00-1,06 (3H), 4,50-4,55 (1H), 6,81-6,85 (1H), 6,90-6,96 (1H), 7,01-7,05 (1H), 7,12-7,19 (1H), 7,20-7,26 (2H).
Пример 33
N-[2-(3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил)фенил]метансульфонамид
1H-ЯМР (CD3OD): 1,10-1,13 (3H), 2,90-2,92 (3H), 4,90-4,92 (1H), 6,99-7,01 (1H), 7,06-7,08 (1H), 7,16-7,21 (2H), 7,25-7,34 (2H), 7,39-7,41 (1H).
Пример 34
7-гидрокси-6-{[3-(4-метоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,07-1,15 (3H), 3,69-3,72 (3H), 4,59-4,64 (1H), 6,71-6,77 (2H), 6,96-7,05 (4H), 7,12-7,17 (1H).
Пример 35
7-гидрокси-6-{[3-(2-изопропоксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,10-1,14 (3H), 1,25-1,30 (6H), 4,50-4,52 (1H), 4,62-4,64 (1H), 6,75-6,79 (1H), 6,83-6,86 (1H), 7,00-7,11 (4H), 7,18-7,20 (1H).
Пример 36
6-{[3-(3-фтор-4-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,15-1,18 (3H), 1,75-1,82 (2H), 4,63-4,65 (1H), 6,77-6,80 (2H), 6,85-6,87 (1H), 7,00-7,02 (1H), 7,05-7,07 (1H), 7,20-7,22 (1H).
Пример 37
6-{[3-(2,3-дифтор-4-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,20-1,22 (3H), 1,80-1,86 (2H), 4,73-4,75 (1H), 6,60-6,64 (1H), 6,79-6,82 (1H), 7,00-7,02 (1H), 7,05-7,07 (1H), 7,21-7,23 (1H).
Пример 38
6-{[3-(2-фтор-4-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,14-1,16 (3H), 1,75-1,81 (2H), 4,63-4,65 (1H), 6,78-6,80 (2H), 6,86-6,88 (1H), 7,00-7,02 (1H), 7,03-7,05 (1H), 7,20-7,22 (1H).
Пример 39
7-гидрокси-6-{[3-(3-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,10-1,13 (3H), 1,75-1,82 (2H), 4,62-4,64 (1H), 6,57-6,59 (1H), 6,71-6,74 (2H), 6,98-7,05 (3H), 7,19-7,22 (1H).
Пример 40
6-{[3-(2-фторфенил)-1-метилпроп-2-ен-1-ил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
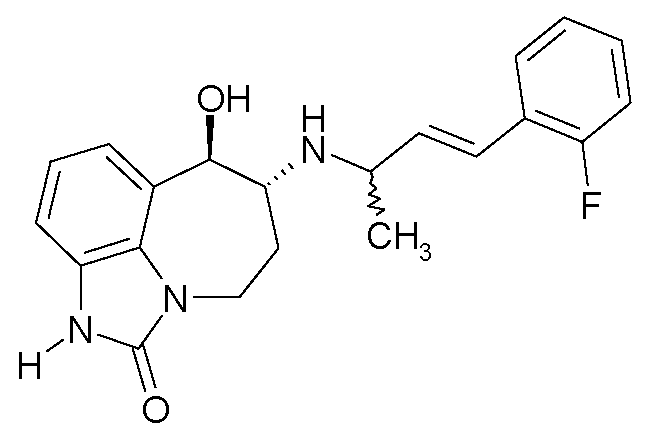
К раствору соединения получения 1 (535 мг, 2,1 ммоль) в метаноле (10 мл) добавляют соединение получения 33 (378 мг, 2,3 ммоль) в метаноле (5 мл), а затем триэтиламин (88 мкл, 0,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, перед добавлением цианборгидрида натрия (329 мг, 5,2 ммоль). После перемешивания в течение 72 часов добавляют боргидрид натрия (40 мг, 1,1 ммоль) и смесь гасят, добавляя воду. Смесь перемешивают еще 1 час и затем концентрируют в вакууме. Остаток экстрагируют этилацетатом (3×15 мл) и объединенные экстракты сушат (MgSO4) и концентрируют в вакууме. Остаток растворяют в дихлорметане и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 25M, кондиционированный смесью дихлорметан:2,5% аммиак в метаноле) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 93:7]. Подходящие фракции объединяют и концентрируют и остаток растворяют в смеси ацетонитрил:вода (9:1, 4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [30:70, 0-32 мин; от 30:70 до 5:95, 32-33 мин; 5:95, 33-36 мин]. Подходящие фракции объединяют и концентрируют, получая соединение примера 40a (9 мг) в виде пары энантиомеров. ВЭЖХ метод A - 14,14 мин. Другие подходящие фракции объединяют и концентрируют, получая соединение примера 40b (14 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 14,41 мин.
EC50, нМ
Пример 40a
1H-ЯМР (CD3OD): 1,21-1,24 (3H), 4,62-4,66 (1H), 6,10-6,16 (1H), 6,62-6,69 (1H), 6,95-7,10 (4H), 7,15-7,21 (2H), 7,45-7,50 (1H).
Пример 40b
1H-ЯМР (CD3OD): 1,19-1,23 (3H), 4,73-4,77 (1H), 6,20-6,28 (1H), 6,70-6,76 (1H), 6,96-7,10 (4H), 7,18-7,22 (2H), 7,45-7,50 (1H).
Аналогично получают:
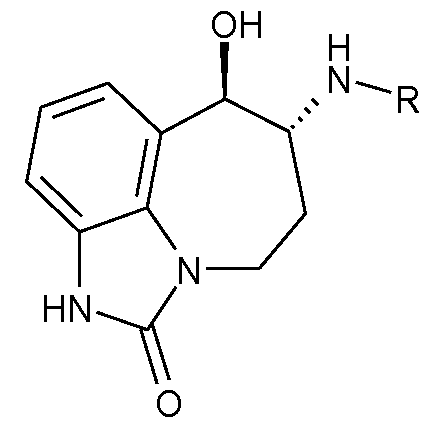
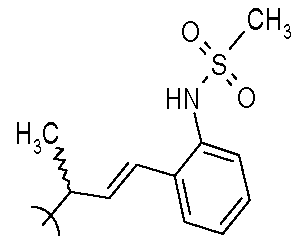
Пример 41
7-гидрокси-6-{[3-(3-гидроксифенил)-1-метилпроп-2-ен-1-ил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,20-1,30 (3H), 4,65-4,76 (1H), 5,95-6,10 (1H), 6,40-6,50 (1H), 6,60-6,70 (1H), 6,80-6,90 (2H), 7,00-7,15 (3H), 7,20-7,26 (1H).
Пример 42
N-{2-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бут-1-ен-1-ил]фенил}метансульфонамид
1H-ЯМР (CD3OD): 1,24-1,28 (3H), 2,90-2,92 (3H), 4,66-4,68 (1H), 6,03-6,09 (1H), 6,97-7,05 (3H), 7,20-7,26 (3H), 7,30-7,32 (1H), 7,61-7,63 (1H).
Пример 43
7-гидрокси-6-{[3-(3-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
Смесь соединения примера 41 (15 мг, 40,2 мкмоль) и палладия (10% на угле, 4 мг) в метаноле (2 мл) гидрируют (4,22 кг/см2, 60 фунт/дюйм2) в течение 1 часа. Реакционную смесь фильтруют через Celite® и фильтрат концентрируют в вакууме, получая соединение примера 43 (15 мг) в виде смеси 4 диастереомеров.
EC50, нМ
Пример 43
1H-ЯМР (CD3OD): 1,10-1,20 (3H), 4,60-4,70 (1H), 6,58-6,70 (3H), 6,95-7,10 (3H), 7,15-7,22 (1H).
Пример 44
7-гидрокси-6-({3-[3-(гидроксиметил)фенил]-1-метилпропил}амино)-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
Смесь соединения получения 1 (100 мг, 0,4 ммоль), триэтиламина (0,1 мл, 0,6 ммоль) и соединения получения 34 (138 мг, 0,8 ммоль) в метаноле (3 мл) перемешивают при комнатной температуре в течение 18 часов. Затем добавляют боргидрид натрия (44 мг, 1,2 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют метанолом (8 мл) и добавляют ионообменную смолу Amberlyst® 15 (3,5 г, приготовлена согласно J. Org. Chem. 1998, 63, 3471-3473). Смесь встряхивают в течение ночи и раствор отфильтровывают. Смолу промывают метанолом (100 мл) и обрабатывают аммиаком в метаноле (2 н., 5 мл). После встряхивания в течение 2 часов раствор отфильтровывают и смолу промывают аммиаком в метаноле (2 н., 2×5 мл). Объединенные метанол/аммиачные смывы концентрируют в вакууме и остаток растворяют в смеси ацетонитрил:вода (1:1, 1,5 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini 5 мкм, 20 мл/мин), используя градиентное элюирование смесью 0,1% водный аммиак:ацетонитрил (9:1):0,1% водный аммиак:ацетонитрил (1:9) [от 1:0 до 0:1, 0-20 мин; 0:1, 20-25 мин]. Подходящие фракции объединяют и концентрируют, получая ненасыщенное промежуточное соединение указанного соединения (14 мг).
Смесь ненасыщенного промежуточного соединения указанного соединения (14 мг, 0,04 ммоль) и оксида платины(IV) (1 мг) в воде (0,5 мл) и изопропиловом спирте (0,5 мл) встряхивают в атмосфере водорода (4,22 кг/см2, 60 фунт/дюйм2) в течение 30 минут. Реакционную смесь фильтруют через Arbocel®, промывая изопропиловым спиртом (0,5 мл), и фильтрат концентрируют в вакууме, получая соединение примера 44 (10 мг).
EC50, нМ
Пример 44
1H-ЯМР (CD3OD): 1,10-1,20 (3H), 4,50-4,60 (2H), 4,63-4,66 (1H), 6,90-7,10 (3H), 7,11-7,25 (3H).
Пример 45
6-{[3-(4-аминофенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
Раствор соединения получения 67 (500 мг, 1,3 ммоль) в метаноле (5 мл) пропускают через гидрогенизатор H-Cube (8 мл/мин, 1 атм, 55°C), используя палладиевый катализатор (10% на угле). Раствор концентрируют в вакууме и остаток растворяют в ацетонитриле (2 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21 мм Gemini C18 5 мкм, 25 мл/мин), используя градиентное элюирование смесью 1% водный аммиак:ацетонитрил [от 5:95 до 40:60 (0-6 мин), до 98:2 (10-10,5 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 45 (4 мг) в виде единственного энантиомера.
EC50, нМ
Пример 45
1H-ЯМР (d6-ДМСО): 0,97-1,00 (3H), 2,61-2,65 (1H), 2,98-3,01 (1H), 4,77-4,79 (1H), 6,42-6,45 (2H), 6,79-6,82 (2H), 6,82-6,84 (1H), 6,90-6,92 (1H), 7,03-7,05 (1H).
ВЭЖХ метод A - время удерживания 11,80 мин.
Аналогично получают следующее соединение:
Пример 46
6-{[3-(3-аминофенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
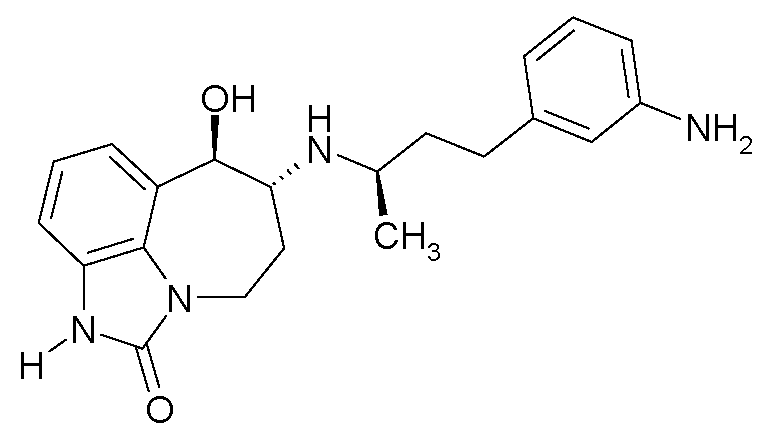
льное
ВЭЖХ метод A - время удерживания 11,98 мин.
Пример 47
6-{[3-(3,5-дибром-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он
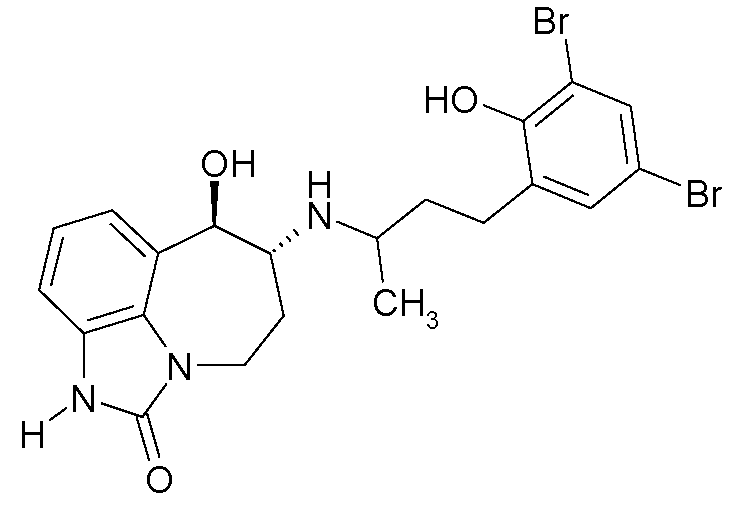
К раствору соединения получения 69 (2,1 г, 5,7 ммоль) в N,N-диметилформамиде (10 мл) и дихлорметане (40 мл) добавляют по капле соединение получения 148 (3,6 г, 17,2 ммоль) в N,N-диметилформамиде (20 мл). Реакционную смесь перемешивают в течение 1,5 часа перед добавлением дихлорметана (100 мл) и насыщенного водного раствора гидрокарбоната натрия (10 мл). После перемешивания в течение 10 минут доводят pH раствора до 7, добавляя твердую лимонную кислоту, и добавляют водный раствор тиосульфата натрия (50 мл). Раствор концентрируют в вакууме и к остатку добавляют метанол (150 мл) и диоксид кремния (50 г). Суспензию концентрируют в вакууме и смесь диоксид кремния/продукт пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и остаток растирают в дихлорметане (50 мл). К остатку добавляют метанол (50 мл) и диоксид кремния (10 г) и суспензию концентрируют в вакууме. Смесь продукт/диоксид кремния очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i c диоксидом кремния) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 90:10]. Подходящие фракции объединяют и концентрируют, получая соединение примера 48 (300 мг) в виде пары энантиомеров. ВЭЖХ метод A - время удерживания 12,8 мин.
1H-ЯМР (d6-ДМСО): 0,99-1,02 (3H), 4,64-4,68 (1H), 6,85-6,87 (1H), 6,92-6,94 (1H), 7,15-7,17 (1H), 7,20-7,22 (1H), 7,42-7,43 (1H).
EC50, нМ
Пример 48
Соль гидрохлорид 7-гидрокси-6-{[3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-она
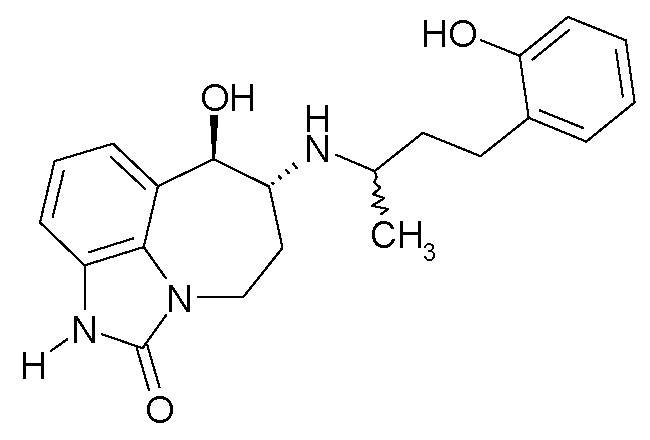
К смеси соединения получения 9 (7,2 г, 28,2 ммоль) и триэтиламина (1,2 мл, 8,5 ммоль) в метаноле (40 мл) добавляют соединение получения 41 (5,6 г, 33,8 ммоль), а затем цианборгидрид натрия (2,7 г, 42,3 ммоль). Реакционную смесь нагревают при 50°C в течение 18 часов перед добавлением воды (3 мл), лимонной кислоты (3,0 г) и гидрокарбоната натрия (3,0 г). После перемешивания в течение 30 минут раствор концентрируют в вакууме и к остатку добавляют метанол (250 мл) и диоксид кремния. Суспензию концентрируют в вакууме и смесь диоксид кремния/продукт пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65M c диоксидом кремния) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 95:5 до 93:7]. Подходящие фракции объединяют и концентрируют и остаток растворяют в ацетонитриле (4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 250×50 мм Gemini C18 10 мкм, 120 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 90:10 до 50:50 (3-10 мин), до 40:60 (18-20 мин), до 5:95 (20-21 мин)]. Подходящие фракции объединяют и концентрируют, получая свободное основание соединения примера 48 (1,1 г) в виде единственного энантиомера. К раствору свободного основания соединения примера 48 (419 мг, 1,1 ммоль) в метаноле (6 мл) при 0°C добавляют по капле хлористый водород в диэтиловом эфире (1 M, 1,30 мл). После перемешивания в течение 1,5 часа добавляют диэтиловый эфир (34 мл) и осадок собирают фильтрованием. Полученное твердое вещество промывают диэтиловым эфиром (2×40 мл) и сушат в вакуумной печи при 50°C, получая соль гидрохлорид, соединение примера 48 (418 мг). ВЭЖХ метод A - время удерживания 13,1 мин.
EC50, нМ
Пример 48
1H-ЯМР (CD3OD): 1,38-1,41 (3H), 2,01-2,17 (2H), 4,88-4,92 (1H), 6,74-6,78 (2H), 6,99-7,04 (2H), 7,06-7,10 (2H), 7,25-7,29 (1H).
Пример 49
6-{[3-(3,5-дибром-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
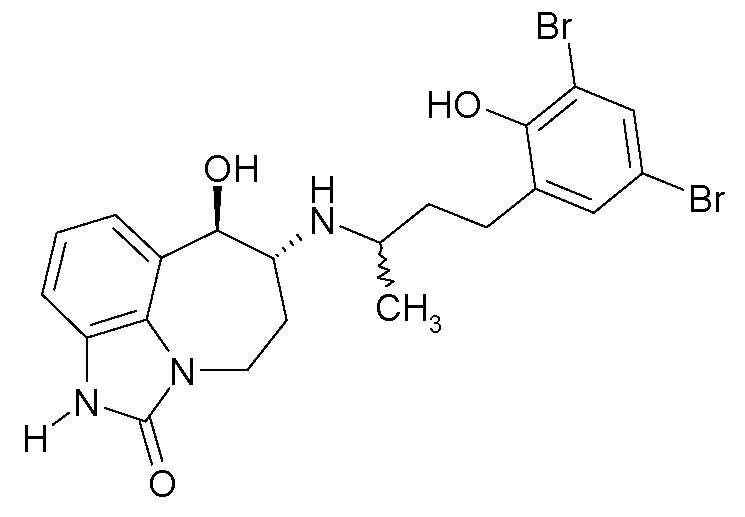
К смеси соединения получения 9 (2,5 г, 9,8 ммоль) и триэтиламина (0,4 мл, 2,9 ммоль) в метаноле (15 мл) добавляют соединение получения 70 (3,7 г, 11,0 ммоль), а затем цианборгидрид натрия (0,9 г, 14,7 ммоль). Реакционную смесь нагревают при 50°C в течение 18 часов, охлаждают и гасят лимонной кислотой. Доводят pH смеси до 7, добавляя гидрокарбонат натрия, и концентрируют в вакууме. Остаток предварительно абсорбируют на диоксиде кремния и пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i c диоксидом кремния) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 97:3 до 94:6]. Подходящие фракции объединяют и концентрируют, получая соединение примера 49 (765 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 12,70 мин.
EC50, нМ
Пример 49
1H-ЯМР (d6-ДМСО): 0,97-1,00 (3H), 4,68-4,70 (1H), 6,85-6,87 (1H), 6,94-6,97 (1H), 7,17-7,19 (1H), 7,20-7,22 (1H), 7,40-7,41 (1H).
Пример 50
6-{[3-(2-хлор-3-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
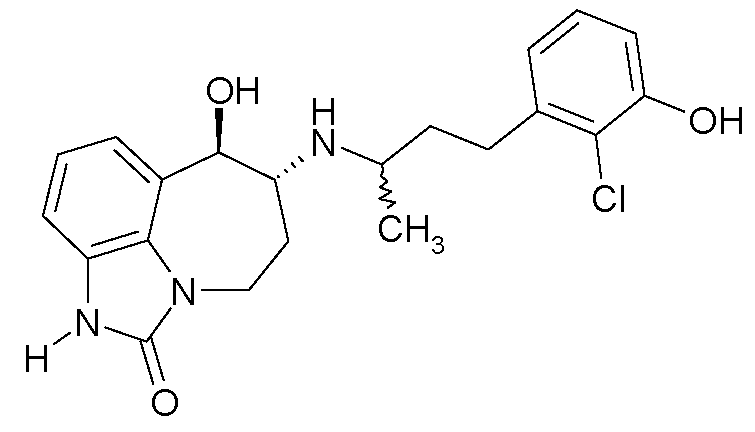
К смеси соединения получения 9 (300 мг, 1,2 ммоль) и соединения получения 49 (280 мг, 1,4 ммоль) в метаноле (5 мл) в атмосфере азота добавляют триэтиламин (0,05 мл, 0,4 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (111 мг, 1,8 ммоль) и реакционную смесь нагревают при 60°C в атмосфере азота в течение 18 часов. После охлаждения добавляют лимонную кислоту (500 мг) и смесь нагревают при 60°C в течение 3 часов. К смеси добавляют воду (0,2 мл), а затем избыток гидрокарбоната натрия и смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют в вакууме и остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40+M c диоксидом кремния) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 89:11]. Подходящие фракции объединяют, концентрируют и дополнительно очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 90:10 до 78:22 (2-8 мин), до 50:50 (15-20 мин), до 5:95 (21-22 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 50 (61 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 11,51 мин.
EC50, нМ
Пример 50
1H-ЯМР (CD3OD): 1,26-1,28 (3H), 1,78-1,85 (2H), 4,65-4,67 (1H), 6,73-6,76 (2H), 6,98-7,03 (2H), 7,04-7,07 (1H), 7,19-7,21 (1H).
Пример 51
2,2,2-трифтор-N-{2-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}ацетамид
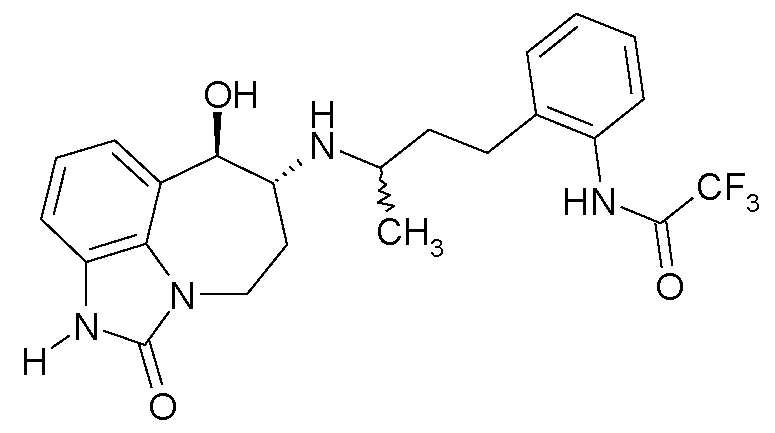
К смеси соединения получения 9 (247 мг, 1,0 ммоль) и соединение получения 71 (250 мг, 1,0 ммоль) в метаноле (8 мл) в атмосфере азота добавляют триэтиламин (0,04 мл, 0,4 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (91 мг, 1,5 ммоль) и реакционную смесь нагревают при 60°C в атмосфере азота в течение 18 часов. После охлаждения добавляют лимонную кислоту (500 мг) и смесь нагревают при 60°C в течение 3 часов. К смеси добавляют воду (0,2 мл), а затем избыток гидрокарбоната натрия и смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют в вакууме и остаток предварительно абсорбируют на диоксиде кремния (10 г) и пропускают через подложку из диоксида кремния (10 г), элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и остаток растворяют в смеси ацетонитрил:вода (9:1, 4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 90:10 до 80:20 (2-15 мин), до 50:50 (24-26 мин), до 5:95 (26-28 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 51 (61 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 12,72 мин.
EC50, нМ
Пример 51
1H-ЯМР (CD3OD): 1,15-1,17 (3H), 2,57-2,60 (2H), 4,64-4,66 (1H), 6,59-6,61 (1H), 6,67-6,69 (1H), 6,91-6,97 (2H), 6,99-7,01 (1H), 7,05-7,07 (1H), 7,20-7,22 (1H).
Пример 52
4-[-3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]-N-(2,2,2-трифторэтил)бензамид
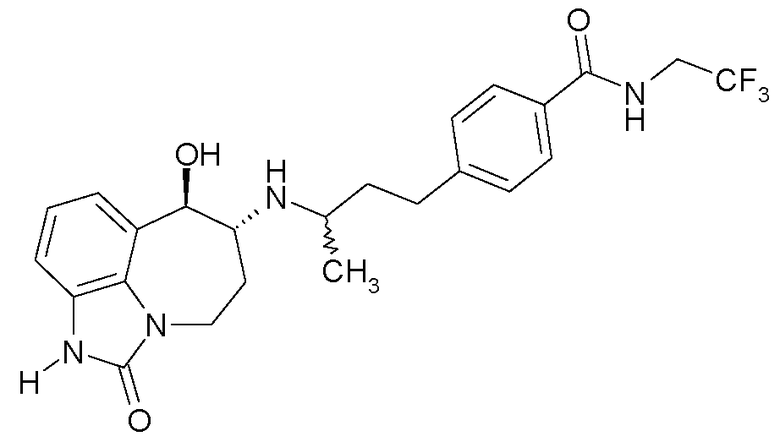
К смеси соединения получения 9 (293 мг, 1,1 ммоль) и триэтиламина (0,05 мл, 0,4 ммоль) в метаноле (15 мл) добавляют соединение получения 89 (172 мг, 0,6 ммоль), а затем цианборгидрид натрия (108 мг, 1,6 ммоль) и реакционную смесь нагревают при 50°C в течение 18 часов. После охлаждения смесь гасят, добавляя воду (3 мл), и добавляют лимонную кислоту, а затем избыток гидрокарбоната натрия. Смесь перемешивают при комнатной температуре в течение 30 минут и затем пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [3:1]. Фильтрат концентрируют в вакууме и остаток растворяют в смеси ацетонитрил:вода (9:1, 6 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 250×50 мм Gemini C18 10 мкм, 120 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 90:10 до 65:35 (2-5 мин), до 50:50 (11-12 мин), до 5:95 (14-15 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 52 (120 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 13,47 мин.
Пример 52
1H-ЯМР (CD3OD): 1,16-1,19 (3H), 2,75-2,79 (2H), 4,04-4,10 (2H), 4,63-4,65 (1H), 6,98-7,00 (1H), 7,01-7,03 (1H), 7,19-7,21 (1H), 7,30-7,33 (2H), 7,75-7,77 (2H).
Пример 53
3-[[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]бензойная кислота
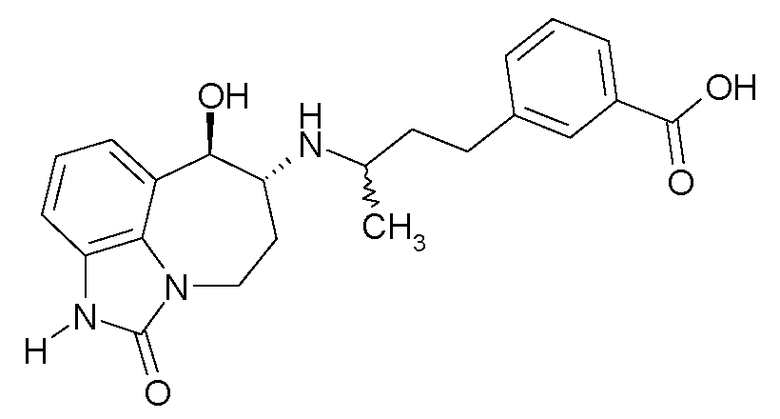
К смеси соединения получения 9 (277 мг, 1,1 ммоль) и триэтиламина (0,05 мл, 0,3 ммоль) в метаноле (15 мл) добавляют соединение получения 51 (250 мг, 1,3 ммоль), а затем цианборгидрид натрия (102 мг, 1,6 ммоль) и реакционную смесь нагревают при 50°C в течение 18 часов. После охлаждения смесь гасят, добавляя воду (3 мл), и добавляют лимонную кислоту, а затем избыток гидрокарбоната натрия. Смесь перемешивают при комнатной температуре в течение 30 минут и затем пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [3:1]. Фильтрат концентрируют в вакууме и остаток растворяют в смеси ацетонитрил:вода (9:1, 6 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21 мм Gemini C18 5 мкм, 25 мл/мин), используя градиентное элюирование смесью 0,1% водный аммиак:ацетонитрил [от 5:95 до 20:80 (0-6 мин), до 98:2 (8-8,5 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 53 (72 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 8,11 мин.
EC50, нМ
Пример 53
1H-ЯМР (CD3OD): 1,38-1,40 (3H), 4,90-4,92 (2H), 7,00-7,02 (1H), 7,08-7,11 (1H), 7,27-7,33 (3H), 7,78-7,80 (1H), 7,84-7,86 (1H).
Пример 54
6-{[3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
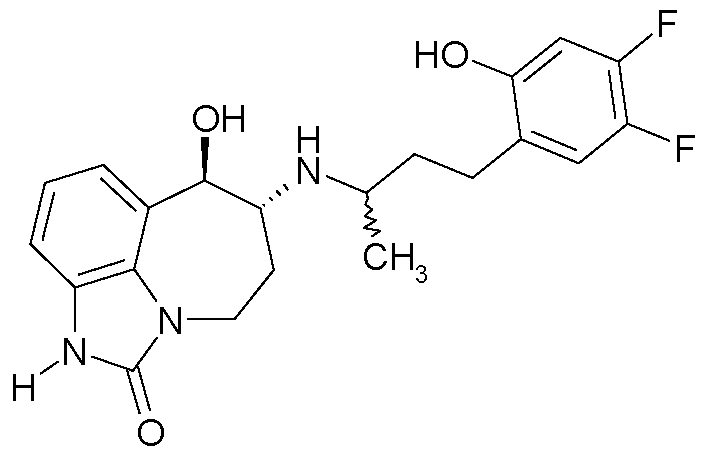
К смеси соединения получения 9 (445 мг, 1,7 ммоль) и соединения получения 52 (418 мг, 2,1 ммоль) в метаноле (5 мл) в атмосфере азота добавляют триэтиламин (0,07 мл, 0,5 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (164 мг, 2,6 ммоль) и реакционную смесь нагревают при 60°C в атмосфере азота в течение 18 часов. После охлаждения добавляют лимонную кислоту (500 мг) и смесь нагревают при 60°C в течение 3 часов. К смеси добавляют воду (0,2 мл), а затем избыток гидрокарбоната натрия и смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют в вакууме и остаток предварительно абсорбируют на диоксиде кремния (10 г) и пропускают через подложку из диоксида кремния (10 г), элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40+M c диоксидом кремния) с градиентным элюированием смесью дихлорметан:2,5% аммиак в метаноле [от 96:4 до 89:11]. Подходящие фракции объединяют и концентрируют, получая соединение примера 54 (69 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 14,49 мин.
EC50, нМ
Пример 54
1H-ЯМР (CD3OD): 1,15-1,17 (3H), 1,70-1,76 (2H), 4,65-4,67 (1H), 6,58-6,60 (1H), 6,93-6,99 (2H), 7,02-7,04 (1H), 7,22-7,24 (1H).
Следующие вещества получают способами, аналогичными способам примеров 48-54:
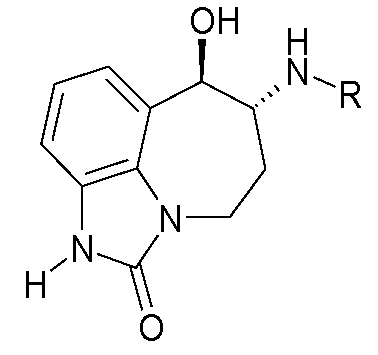
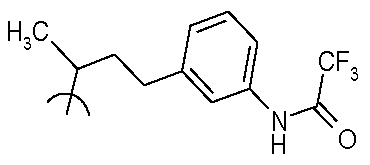
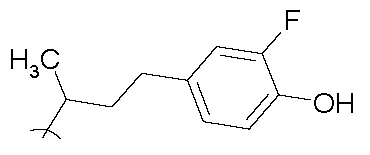
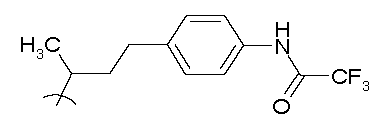
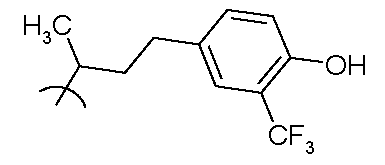
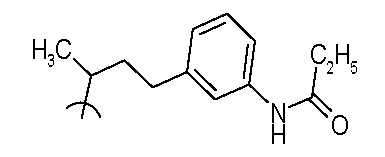
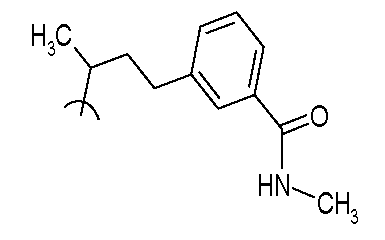
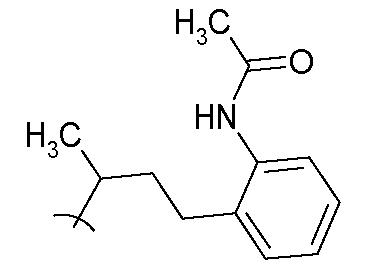
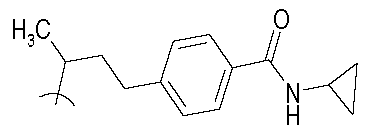
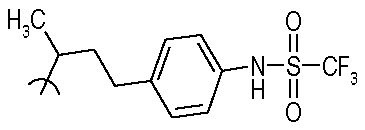
Пример 55
6-{[3-(2,6-дихлор-3-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,18-1,20 (3H), 4,67-4,69 (1H), 6,74-6,76 (1H), 6,99-7,01 (1H), 7,03-7,05 (1H), 7,08-7,10 (1H), 7,20-7,22 (1H).
ВЭЖХ метод A - время удерживания 11,28 мин.
Пример 56
N-{2-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}этансульфонамид
Экспериментальное значение MH+ 459,2; ожидаемое значение 459,2.
1H-ЯМР (CD3OD): 1,10-1,12 (3H), 1,28-1,31 (3H), 3,05-3,11 (2H), 4,15-4,19 (1H), 6,98-7,00 (1H), 7,06-7,08 (1H), 7,12-7,18 (2H), 7,24-7,26 (1H), 7,30-7,32 (1H), 7,38-7,40 (1H).
ВЭЖХ метод A - время удерживания 12,77 мин.
Пример 57
2,2,2-трифтор-N-{3-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}ацетамид
ВЭЖХ метод A - время удерживания 12,19 мин.
Пример 58
6-{[3-(3-фтор-4-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,40-1,42 (3H), 2,05-2,11 (2H), 4,95-4,97 (1H), 6,83-6,87 (2H), 6,97-7,00 (1H), 7,03-7,05 (1H), 7,10-7,13 (1H), 7,30-7,32 (1H).
Пример 59
2,2,2-трифтор-N-{4-[(3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}ацетамид
1H-ЯМР (CD3OD): 1,09-1,12 (3H), 1,70-1,80 (2H), 4,61-4,63 (1H), 6,61-6,64 (2H), 6,88-6,91 (2H), 6,99-7,01 (1H), 7,03-7,05 (1H), 7,18-7,20 (1H).
ВЭЖХ метод A - время удерживания 11,90 мин.
Пример 60
7-гидрокси-6-({3-[4-гидрокси-3-(трифторметил)фенил]-1-метилпропил}амино)-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
1H-ЯМР (CD3OD): 1,14-1,16 (3H), 1,76-1,84 (2H), 4,64-4,66 (1H), 6,80-6,82 (1H), 6,99-7,01 (1H), 7,02-7,04 (1H), 7,20-7,23 (2H), 7,29-7,31 (1H).
ВЭЖХ метод A - время удерживания 12,50 мин.
Пример 61
N-{3-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}пропанамид
1H-ЯМР (CD3OD): 1,10-1,12 (3H), 1,17-1,20 (3H), 2,36-2,40 (2H), 4,62-4,64 (1H), 6,89-6,91 (1H), 6,99-7,01 (1H), 7,02-7,05 (1H), 7,17-7,20 (2H), 7,30-7,32 (1H), 7,40-7,42 (1H).
ВЭЖХ метод A - время удерживания 12,67 мин.
Пример 62
3-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]-N-метилбензамид
1H-ЯМР (CD3OD): 1,16-1,18 (3H), 2,90-2,91 (3H), 4,63-4,65 (1H), 6,98-7,01 (1H), 7,03-7,06 (1H), 7,18-7,20 (1H), 7,32-7,37 (2H), 7,38-7,40 (1H), 7,65-7,67 (1H).
ВЭЖХ метод A - время удерживания 11,40 мин.
Пример 63
N-{2-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}ацетамид
1H-ЯМР (CD3OD): 1,11-1,14 (3H), 2,07-2,09 (3H), 4,62-4,64 (1H), 6,99-7,01 (1H), 7,04-7,07 (1H), 7,15-7,22 (3H), 7,22-7,27 (2H).
ВЭЖХ метод A - время удерживания 11,46 мин.
Пример 64
N-циклопропил-4-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]бензамид
1H-ЯМР (d6-ДМСО): 0,54-0,59 (2H), 0,62-0,66 (2H), 0,98-1,02 (3H), 3,00-3,03 (1H), 4,47-4,50 (1H), 6,81-6,83 (1H), 6,89-6,92 (1H), 7,01-7,04 (1H), 7,20-7,23 (2H), 7,67-7,70 (2H).
ВЭЖХ метод A - время удерживания 12,01 мин.
Пример 65
N-{3-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}метансульфонамид
1H-ЯМР (CD3OD): 1,14-1,16 (3H), 2,90-2,92 (3H), 4,62-4,64 (1H), 6,97-7,01 (2H), 7,02-7,07 (2H), 7,09-7,11 (1H), 7,19-7,22 (2H).
ВЭЖХ метод A - время удерживания 10,00 мин.
Пример 66
3-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]бензамид
1H-ЯМР (CD3OD): 1,37-1,39 (3H), 4,86-4,88 (1H), 7,00-7,02 (1H), 7,07-7,10 (1H), 7,26-7,31 (3H), 7,78-7,80 (1H), 7,85-7,86 (1H).
ВЭЖХ метод A - время удерживания 8,02 мин.
Пример 67
N-{4-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}бензолсульфонамид
1H-ЯМР (CD3OD): 1,06-1,09 (3H), 4,60-4,62 (1H), 6,96-7,00 (2H), 7,00-7,06 (4H), 7,18-7,20 (1H), 7,41-7,45 (2H), 7,49-7,51 (1H), 7,70-7,72 (2H).
ВЭЖХ метод A - время удерживания 11,41 мин.
Пример 68
4-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]бензойная кислота
1H-ЯМР (CD3OD): 1,25-1,27 (3H), 1,90-2,00 (2H), 4,78-4,80 (1H), 7,00-7,02 (1H), 7,06-7,09 (1H), 7,20-7,24 (3H), 7,84-7,86 (2H).
ВЭЖХ метод A - время удерживания 8,02 мин.
Пример 69
1,1,1-трифтор-N-{4-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]фенил}метансульфонамид
1H-ЯМР (CD3OD): 1,36-1,38 (3H), 1,96-2,05 (2H), 4,80-4,82 (1H), 7,02-7,09 (5H), 7,09-7,12 (1H), 7,25-7,27 (1H).
ВЭЖХ метод A - время удерживания 9,92 мин.
Пример 70
Метил 4-[3-{[7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]амино}бутил]бензоат
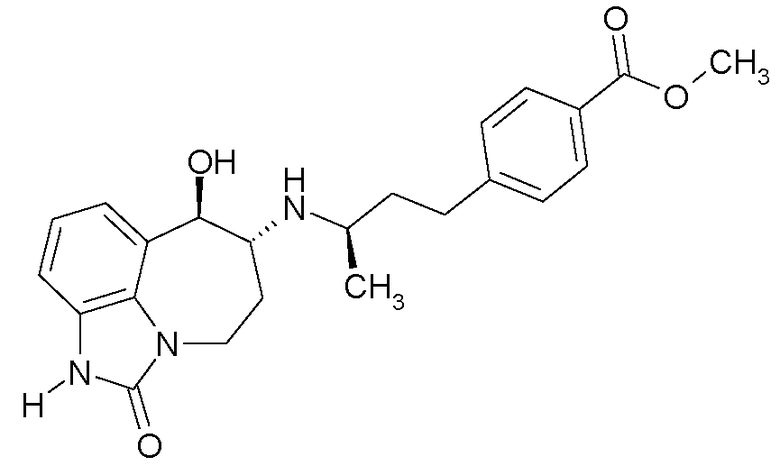
К смеси соединения получения 9 (207 мг, 0,8 ммоль) и триэтиламина (0,03 мл, 0,2 ммоль) в метаноле (5 мл) добавляют соединение получения 97 (186 мг, 1,0 ммоль), а затем цианборгидрид натрия (76 мг, 1,2 ммоль) и реакционную смесь нагревают при 50°C в течение 18 часов. Добавляют еще цианборгидрид натрия (76 мг, 1,2 ммоль) и реакционную смесь перемешивают при 50°C еще 18 дней. После охлаждения смесь гасят, добавляя воду (3 мл), и добавляют лимонную кислоту, а затем избыток гидрокарбоната натрия. Смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют в вакууме. К остатку добавляют метанол (250 мл) и диоксид кремния и смесь концентрируют в вакууме. Смесь продукт/диоксид кремния пропускают через подложку из диоксида кремния, элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и остаток растворяют в смеси ацетонитрил:вода (9:1, 4 мл) и очищают методом автоматизированной препаративной жидкостной хроматографии (система Gilson, колонка 150×21,4 мм Gemini C18 5 мкм, 20 мл/мин), используя градиентное элюирование смесью ацетонитрил:0,1% водный аммиак (5:95):ацетонитрил:0,1% водный аммиак (95:5) [от 90:10 до 78:22 (2-5 мин), до 70:30 (16-18 мин), до 5:95 (30-31 мин)]. Подходящие фракции объединяют и концентрируют, получая соединение примера 70 (6 мг) в виде единственного энантиомера. ВЭЖХ метод A - время удерживания 14,01 мин.
EC50, нМ
Пример 70
1H-ЯМР (d6-ДМСО): 1,00-1,03 (3H), 3,79-3,82 (3H), 4,48-4,50 (1H), 6,83-6,85 (1H), 6,88-6,91 (1H), 7,02-7,05 (1H), 7,30-7,33 (2H), 7,91-7,94 (2H).
Получение 1
Соль гидрохлорид 6-амино-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-она
К раствору соединения получения 2 (53,5 г, 211 ммоль) в метаноле (2600 мл) при 0°C добавляют боргидрид натрия (8,8 г, 232 ммоль) за 30 минут. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов перед добавлением соляной кислоты (2 н., 120 мл). Смесь концентрируют в вакууме и остаток перекристаллизовывают из смеси изопропанол:вода (3:1, 700 мл). Твердое вещество промывают диэтиловым эфиром и сушат в вакуумной печи в течение ночи, получая указанное в заголовке соединение (33,8 г).
1H-ЯМР (d6-ДМСО): 2,00-2,10 (1H), 2,30-2,40 (1H), 3,60-3,70 (1H), 4,10-4,20 (1H), 4,85-4,95 (1H), 6,45-6,50 (1H), 6,90-6,95 (1H), 6,95-7,00 (1H), 7,15-7,20 (1H).
Получение 2
Соль гидрохлорид 6-амино-5,6-дигидроимидазо[4,5,1-jk][1]бензазепин-2,7(1H,4H)-диона
Смесь соединения получения 3 (35,3 г, 153 ммоль), палладия (10% на угле, 11 г) и концентрированной соляной кислоты (25,5 мл) в метаноле (300 мл) перемешивают при комнатной температуре в атмосфере водорода (1,55 кг/см2, 22 фунт/дюйм2) в течение 3 часов. Реакционную смесь фильтруют через Arbocel®, промывая метанолом и водой, и обеспечивая невысыхание катализатора. Фильтрат концентрируют в вакууме и остаток растирают в ацетоне, получая указанное в заголовке соединение (30,0 г).
1H-ЯМР (d6-ДМСО): 2,20-2,30 (1H), 2,40-2,50 (1H), 3,70-3,80 (1H), 4,30-4,40 (1H), 4,60-4,70 (1H), 7,10-7,15 (1H), 7,25-7,30 (1H), 7,60-7,65 (1H).
Получение 3
4,5-дигидроимидазо[4,5,1-jk][1]бензазепин-2,6,7(1H)-трион 6-оксим
К раствору соединения получения 4 (10,3 г, 51 ммоль) в уксусной кислоте (150 мл) добавляют трет-бутилнитрит (16 мл, 135 ммоль), а затем соляную кислоту (4 н. в диоксане, 33,4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем фильтруют. Твердое вещество сушат в вакуумной печи, получая указанное в заголовке соединение (10,0 г).
Экспериментальное значение MH+ 232,1; ожидаемое значение 232,1.
Получение 4
5,6-дигидроимидазо[4,5,1-jk][1]бензазепин-2,7(1H,4H)-дион
К раствору соединения получения 5 (45,0 г, 0,2 моль) в дихлорметане (150 мл) добавляют тионилхлорид (30 мл, 0,4 моль) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь концентрируют в вакууме и к остатку добавляют дихлорметан (1000 мл) и частями добавляют хлорид алюминия (84,0 г, 0,6 моль). После перемешивания при комнатной температуре в течение ночи реакционную смесь нагревают при кипении с обратным холодильником в течение 2 часов и затем концентрируют в вакууме. К остатку добавляют ледяную воду (2000 мл) и концентрированную соляную кислоту (50 мл), а затем еще ледяную воду (2000 мл). Полученный осадок собирают фильтрованием, промывают водой (4×250 мл) и растворяют в растворе гидроксида натрия (1 н., 600 мл). Раствор промывают дихлорметаном (2×150 мл) и циклогексаном (150 мл) и доводят pH до 10, добавляя сухой лед. Твердое вещество собирают фильтрованием, промывают водой (3×50 мл) и сушат в течение ночи при 40°C, получая указанное в заголовке соединение (30,0 г).
1H-ЯМР (d6-ДМСО): 2,03-2,11 (2H), 2,90-3,00 (2H), 3,85-3,95 (2H), 7,02-7,10 (1H), 7,17-7,24 (1H), 7,50-7,58 (1H).
Получение 5
4-(2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)масляная кислота
К раствору соединения получения 6 (152,0 г, 0,6 моль) в тетрагидрофуране (600 мл) добавляют концентрированную соляную кислоту (75 мл). Реакционную смесь перемешивают в течение 2 часов и затем выливают в воду (700 мл). Смесь фильтруют, промывая водой (750 мл), и твердое вещество сушат в течение ночи при 40°C, получая указанное в заголовке соединение (155,5 г).
1H-ЯМР (d6-ДМСО): 1,80-1,89 (2H), 2,20-2,25 (2H), 3,74-3,82 (2H), 6,96-7,01 (3H), 7,05-7,10 (1H).
Получение 6
4-(3-изопропенил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)масляная кислота
К раствору соединения получения 7 (223,8 г, 0,7 моль) в тетрагидрофуране (500 мл) добавляют водный раствор гидроксида натрия (15% мас./мас., 500 мл). Реакционную смесь нагревают при кипении с обратным холодильником в течение 4 часов, охлаждают до комнатной температуры и перемешивают в течение ночи. Тетрагидрофуран удаляют вакуумной перегонкой (38°C) и водный слой экстрагируют дихлорметаном (2×400 мл) и циклогексаном (2×300 мл). К водному слою добавляют ледяную уксусную кислоту (250 мл) и раствор охлаждают до 2°C. После перемешивания в течение 30 минут продукт собирают фильтрованием, промывая водой (3×250 мл) при 2°C. Твердое вещество сушат в течение ночи при 40°C, получая указанное в заголовке соединение (307,5 г).
Экспериментальное значение MH+ 261,2; ожидаемое значение 261,1.
Получение 7
Этил 4-(3-изопропенил-2-оксо-2,3-дигидро-1H-бензимидазол-1-ил)бутаноат
Смесь соединения получения 8 (114,0 г, 0,7 моль), карбоната калия (136 мг, 1 моль) и соединения получения 166 (167,4 г, 0,9 моль) в ацетоне (500 мл) нагревают при кипении с обратным холодильником в течение 18 часов. Затем реакционную смесь охлаждают до комнатной температуры и фильтруют, промывая ацетоном (250 мл). Фильтрат концентрируют в вакууме и остаток сушат в течение ночи при 40°C, получая указанное в заголовке соединение (223,8 г).
1H-ЯМР (d6-ДМСО): 1,10-1,20 (3H), 2,10-2,15 (3H), 3,95-4,07 (2H), 5,10-5,12 (1H), 5,35-5,39 (1H), 7,00-7,10 (3H), 7,20-7,26 (1H).
Получение 8
1-изопропенил-1,3-дигидро-2H-бензимидазол-2-он
К раствору соединения получения 140 (98,0 г, 0,9 моль) в ксилоле (420 мл) при 120°C добавляют 1,8-диазобицикло[5,4,0]ундец-7-ен (1,5 мл), а затем добавляют соединение получения 141 (130,0 г, 1,0 моль) за 30 минут. Реакционную смесь нагревают при 150°C, используя аппарат Дина-Старка, в течение 60 часов и затем охлаждают до комнатной температуры. Твердое вещество выделяют фильтрованием, промывая холодным ксилолом (250 мл), и сушат в вакуумной печи, получая указанное в заголовке соединение (208,4 г).
1H-ЯМР (d6-ДМСО): 2,08-2,11 (3H), 5,05-5,11 (1H), 5,34-5,37 (1H), 6,98-7,01 (3H), 7,01-7,06 (1H), 10,90-11,00 (1H).
Получение 9
Соль гидрохлорид (6R,7R)-6-амино-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-она
К соединению получения 10 (160 мг, 0,5 ммоль) добавляют хлористый водород (4 н. в диоксане, 1,25 мл) и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют в вакууме и к остатку добавляют диоксан (10 мл). Раствор повторно концентрируют в вакууме, получая указанное в заголовке соединение в виде соли гидрохлорида (135 мг).
1H-ЯМР (CD3OD): 2,07-2,13 (1H), 2,41-2,44 (1H), 3,50-3,54 (1H), 3,78-3,82 (1H), 4,20-4,26 (1H), 7,01-7,04 (1H), 7,10-7,14 (1H), 7,35-7,37 (1H).
Альтернативный синтез
Смесь соединения получения 3 (11,0 г, 48 ммоль), димера хлор(норборнадиен)родия (55 мг, 0,1 ммоль) и 1-[(S)-ферроценил-2-(R)-этил-1-диметиламино)фенил]-(S)-фосфино-1'-дициклогексилфосфино-ферроцена (Solvias AG) (187 мг, 0,3 ммоль) в метаноле (165 мл) и воде (11 мл) продувают азотом (×3) и нагревают при 80°C в атмосфере водорода (20 бар) в течение 16 часов. Смесь фильтруют, промывая метанолом, и фильтрат концентрируют в вакууме. К остатку добавляют хлористый водород (4 M в диоксане, 14 мл). Раствор концентрируют в вакууме и остаток очищают азеотропной перегонкой с изопропанолом (2×50 мл). Остаток перекристаллизовывают из смеси изопропанол:вода (6:1, 150 мл) и еще раз из смеси изопропанол:вода (6:1, 80 мл), получая указанное в заголовке соединение (6,5 г) в виде соли гидрохлорида.
1H-ЯМР (d6-ДМСО): 1,96-2,05 (1H), 2,30-2,38 (1H), 3,60-3,68 (1H), 4,08-4,15 (1H), 4,82-4,88 (1H), 6,45-6,50 (1H), 6,90-6,93 (1H), 6,97-7,01 (1H), 7,15-7,18 (1H).
Получение 10
Трет-бутил [(6R,7R)-7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]карбамат
Соединение получения 11 (500 мг, 1,6 ммоль) растворяют в изопропаноле, содержащем 0,1% диэтиламин (100 мл), при нагревании и воздействии ультразвука. Раствор очищают методом хроматографии со сверхкритической подвижной фазой (колонка Berger Multigram III, 250×30 мм Chiralcel OJ-H, 5 мкм, 35°C, 180 мл/мин), используя в качестве подвижной фазы сверхкритическую смесь диоксид углерода/изопропанол, содержащую 0,1% диэтиламин [85:15]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение в виде желаемого энантиомера, который используют немедленно.
Получение 11
Трет-бутил [7-гидрокси-2-оксо-1,2,4,5,6,7-гексагидроимидазо[4,5,1-jk][1]бензазепин-6-ил]карбамат
К раствору соединения получения 1 (1,0 г, 3,9 ммоль) в метаноле (20 мл) добавляют триэтиламин (1,1 мл, 7,8 ммоль), а затем соединение получения 142 (1,71 г, 7,8 ммоль). Реакционную смесь перемешивают в течение 1 часа, концентрируют в вакууме и к остатку добавляют дихлорметан (50 мл). Раствор промывают водой (50 мл) и осадок собирают фильтрованием и сушат в вакуумной печи, получая указанное в заголовке соединение (500 мг), которое используют немедленно.
Получение 12
4-[4-(циклопропилметокси)фенил]бутан-2-он
К раствору соединения получения 106 (5,0 г, 31 ммоль) в ацетоне (75 мл) добавляют карбонат цезия (20,0 г, 61,0 ммоль), а затем соединение получения 107 (5,9 мл, 61 ммоль) и йодид натрия (0,46 г, 31,0 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 24 часов, концентрируют в вакууме и остаток распределяют между этилацетатом (75 мл) и водой (100 мл). Два слоя разделяют и экстрагируют водный слой этилацетатом (75 мл). Объединенные органические фазы промывают насыщенным раствором соли (100 мл), сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (5,7 г), которое используют немедленно для восстановительного аминирования соединением получения 1.
Получение 13
4-(2-гидроксифенил)-4-метилпентан-2-он
К раствору соединения получения 14 (222 мг, 0,8 ммоль) в тетрагидрофуране (2 мл) при -60°C и в атмосфере азота добавляют по капле метиллитий (1,6 M в диэтиловом эфире, 1,8 мл, 2,8 ммоль) за 5 минут. Реакционную смесь перемешивают при -60°C в течение 30 минут, гасят этанолом (0,2 мл) и дают нагреться до комнатной температуры в течение ночи. Смесь распределяют между водой и диэтиловым эфиром и органическую фазу отделяют, промывают насыщенным раствором соли, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (130 мг).
Экспериментальное значение (M-H+)- 191,3; ожидаемое значение 191,1.
Получение 14
2-(1,1-диметил-3-морфолин-4-ил-3-оксопропил)фенол
Раствор соединения получения 15 (950 мг, 5,4 ммоль) в морфолине (30 мл) нагревают при 85°C в течение 18 часов. К реакционной смеси добавляют воду (5 мл) и осадок собирают фильтрованием, промывают водой и сушат в вакуумной печи, получая указанное в заголовке соединение (1,22 г).
Экспериментальное значение MH+ 264,0; ожидаемое значение 264,2.
Получение 15
4,4-диметилхроман-2-он
К раствору соединения получения 105 (2,0 г, 11,5 ммоль) в 1,2-дихлорэтане (20 мл) добавляют за 5 минут хлорид алюминия (2,3 г, 17,2 ммоль) и реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 60 часов. К реакционной смеси добавляют дихлорметан и раствор концентрируют в вакууме. Остаток распределяют между водой и дихлорметаном и два слоя разделяют. Органический слой еще раз промывают водой, сушат (MgSO4) и концентрируют в вакууме. Остаток очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M) с градиентным элюированием смесью циклогексан:дихлорметан [от 3:1 до 1:3]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (1,4 г).
Экспериментальное значение MH+ 177,2; ожидаемое значение 177,1.
Получение 16
4-(3-хлор-2-гидроксифенил)бут-3-ен-2-он
К раствору соединения получения 108 (17,5 г, 112,0 ммоль) в ацетоне (49 мл) при 0°C добавляют за 10 минут водный раствор гидроксида натрия (5 M, 33 мл). Реакционную смесь перемешивают при 0°C в течение 60 минут и затем при комнатной температуре в течение 18 часов. К смеси добавляют воду (500 мл) и раствор экстрагируют дихлорметаном (100 мл). Водную фазу подкисляют избытком водного раствора лимонной кислоты и полученный осадок собирают фильтрованием. Твердое вещество промывают водой (100 мл), водным раствором гидрокарбоната натрия (100 мл), водным раствором метабисульфита натрия (100 мл) и еще раз водой (3×100 мл) и сушат на воздухе, получая указанное в заголовке соединение (20 г).
1H-ЯМР (CDCl3): 2,39-2,41 (3H), 6,78-6,93 (2H), 7,34-7,38 (1H), 7,41-7,46 (1H), 7,77-7,83 (1H).
Получение 17
4-(5-фтор-2-гидроксифенил)бут-3-ен-2-он
К раствору соединения получения 110 (900 мг, 6,4 ммоль) в ацетоне (20 мл) при 0°C добавляют водный раствор гидроксида натрия (5 M, 1,9 мл). После перемешивания при 0°C в течение 1 часа добавляют воду (50 мл) и смесь экстрагируют дихлорметаном (50 мл). Водную фазу подкисляют соляной кислотой (4 M) и раствор экстрагируют дихлорметаном (100 мл). Объединенные органические фазы промывают водой (20 мл), насыщенным водным раствором метабисульфита натрия (30 мл) и еще раз водой (3×20 мл), сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (900 мг).
1H-ЯМР (CD3OD): 2,31-2,34 (3H), 6,76-6,83 (2H), 6,92-6,99 (1H), 7,24-7,28 (1H), 7,82-7,88 (1H).
Получение 18
4-(4,5-дифтор-2-гидроксифенил)бут-3-ен-2-он
К раствору соединения получения 60 (3,5 г, 22,0 ммоль) в ацетоне (50 мл) при 0°C добавляют водный раствор гидроксида натрия (5 M, 6,6 мл, 33,2 ммоль). Реакционную смесь перемешивают при 0°C в течение 1 часа и затем при комнатной температуре в течение 18 часов. Смесь разбавляют водой (200 мл) и подкисляют соляной кислотой (4 M). Смесь экстрагируют диэтиловым эфиром (3×300 мл) и объединенные экстракты сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (2,9 г).
1H-ЯМР (CDCl3): 2,39-2,43 (3H), 6,81-6,89 (1H), 7,25-7,31 (2H), 7,67-7,77 (1H).
Аналогично получают следующие соединения:
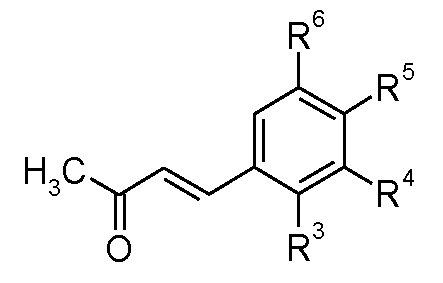
Получение 19
4-[4-гидрокси-3-(трифторметил)фенил]бут-3-ен-2-он
1H-ЯМР (CDCl3): 2,29-2,31 (3H), 6,60-6,64 (1H), 6,99-7,01 (1H), 7,43-7,46 (1H), 7,59-7,61 (1H), 7,70-7,72 (1H).
Получение 22
4-гидрокси-3-[3-оксобут-1-ен-1-ил]бензонитрил
1H-ЯМР (d6-ДМСО): 2,31-2,33 (3H), 6,97-7,10 (2H), 7,60-7,70 (2H), 8,09-8,11 (1H).
Получение 23
4-(2-гидрокси-3-метилфенил)бут-3-ен-2-он
1H-ЯМР (d6-ДМСО): 2,14-2,20 (3H), 2,25-2,32 (3H), 6,69-6,80 (2H), 7,11-7,17 (1H), 7,41-7,47 (1H), 7,88-7,94 (1H).
Получение 24
4-(2-метоксифенил)бут-3-ен-2-он
1H-ЯМР (d6-ДМСО): 2,28-2,30 (3H), 3,83-3,86 (3H), 6,78-6,84 (1H), 6,95-7,00 (1H), 7,05-7,09 (1H), 7,37-7,43 (1H), 7,64-7,69 (1H), 7,74-7,80 (1H).
Получение 25
4-(2-гидрокси-5-метоксифенил)бут-3-ен-2-он
1H-ЯМР (d6-ДМСО): 2,27-2,29 (3H), 3,68-3,71 (3H), 6,80-6,86 (3H), 7,11-7,15 (1H), 7,72-7,78 (1H).
Получение 26
4-(4-фторфенил)бут-3-ен-2-он
1H-ЯМР (CD3OD): 2,33-2,34 (3H), 7,10-7,15 (3H), 7,61-7,68 (3H).
Получение 27
4-(4-фтор-2-гидроксифенил)бут-3-ен-2-он
1H-ЯМР (CD3OD): 2,37-2,39 (3H), 6,56-6,64 (2H), 6,79-6,82 (1H), 7,55-7,60 (1H), 7,82-7,85 (1H).
Получение 32
4-[2-гидрокси-5-(трифторметил)фенил]бут-3-ен-2-он
1H-ЯМР (CDCl3): 2,44-2,47 (3H), 7,02-7,06 (1H), 7,13-7,19 (1H), 7,47-7,52 (1H), 7,70-7,73 (1H), 7,78-7,84 (1H).
Получение 35
4-(4-нитрофенил)бут-3-ен-2-он
К раствору соединения получения 145 (2,0 г, 13,2 ммоль) в тетрагидрофуране (100 мл) добавляют соединение получения 150 (8,4 г, 26,5 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов и затем охлаждают и концентрируют в вакууме. Остаток растирают в диэтиловом эфире и затем загружают на подложку из диоксида кремния и элюируют диэтиловым эфиром. Подходящие фракции объединяют и концентрируют и остаток еще раз очищают, используя подложку из диоксида кремния, элюируя диэтиловым эфиром. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (2,4 г).
1H-ЯМР (CDCl3): 2,39-2,41 (3H), 6,78-6,80 (1H), 7,48-7,50 (1H), 7,65-7,67 (2H), 8,20-8,22.
Аналогично получают следующие соединения:
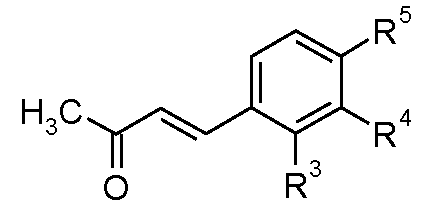
Получение 37
4-(3-нитрофенил)бут-3-ен-2-он
1H-ЯМР (CDCl3): 2,39-2,41 (3H), 6,78-6,82 (1H), 7,56-7,59 (1H), 7,66-7,68 (1H), 7,80-7,82 (1H), 8,18-8,21 (1H), 8,38-8,40 (1H).
Получение 38
4-(2-нитрофенил)бут-3-ен-2-он
1H-ЯМР (CDCl3): 2,40-2,41 (3H), 6,56-6,60 (1H), 7,42-7,46 (1H), 7,57-7,60 (1H), 7,62-7,65 (1H), 7,97-8,00 (1H), 8,02-8,04 (1H).
Получение 39
4-[3-оксобут-1-ен-1-ил]бензойная кислота
1H-ЯМР (d6-ДМСО): 2,17-2,19 (3H), 6,85-6,88 (1H), 7,61-7,64 (1H), 7,79-7,81 (2H), 7,91-7,93 (2H).
Получение 40
3-[3-оксобут-1-ен-1-ил]бензойная кислота
1H-ЯМР (CD3OD): 2,39-2,41 (3H), 6,80-6,83 (1H), 7,51-7,54 (2H), 7,66-7,69 (1H), 7,85-7,87 (1H), 8,06-8,08 (1H), 8,23-8,25 (1H).
Получение 41
4-(2-гидроксифенил)бутан-2-он
Суспензию палладия (5% на оксиде алюминия, 5,0 г, 47,0 ммоль) в этилацетате (500 мл) перемешивают в атмосфере водорода (4,22 кг/см2, 60 фунт/дюйм2) в течение 40 минут. К этой суспензии добавляют соединение получения 100 (50,0 г, 308 ммоль) и реакционную смесь гидрируют при 1,05 кг/см2 (15 фунт/дюйм2) в течение 2 часов. Смесь фильтруют через Celite® и фильтрат концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (диоксид кремния, 1 кг), элюируя дихлорметаном. Подходящие фракции объединяют и концентрируют и остаток растирают в смеси диэтиловый эфир/пентан, получая указанное в заголовке соединение PF-01896702-00 (10,3 г).
1H-ЯМР (CDCl3): 2,18-2,19 (3H), 2,80-2,95 (4H), 6,75-6,85 (2H), 7,00-7,11 (2H).
Получение 42
4-(5-фтор-2-гидроксифенил)бутан-2-он
Смесь соединения получения 17 (2,1 г, 11,4 ммоль) и палладия (2 мас.% на карбонате стронция, 800 мг) в этилацетате (40 мл) перемешивают в атмосфере водорода (1 атм.) при комнатной температуре в течение 18 часов. Смесь фильтруют через Arbocel® и фильтрат концентрируют в вакууме. Остаток растворяют в смеси этилацетат:циклогексан [20:80, 20 мл] и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M) с градиентным элюированием смесью этилацетат:циклогексан [от 20:80 до 30:70]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (1,2 г).
1H-ЯМР (CD3OD): 1,46-1,51 (3H), 1,70-1,80 (1H), 1,90-2,00 (1H), 2,58-2,62 (1H), 2,85-2,95 (1H), 6,72-6,80 (3H).
Получение 43
4-(2-метилфенил)бутан-2-он
Смесь соединения получения 36 (840 мг, 5,2 ммоль) и хлортрис(трифенилфосфин)родия(I) (242 мг, 0,3 ммоль) в этилацетате (25 мл) перемешивают в атмосфере водорода (5 атм) при 40°C в течение 60 часов. Смесь концентрируют в вакууме и к остатку добавляют смесь этилацетат:циклогексан [1:3, 30 мл]. Раствор загружают на подложку из диоксида кремния и элюируют смесью этилацетат:циклогексан [1:3, 300 мл]. Фильтрат концентрируют в вакууме, получая указанное в заголовке соединение (556 мг).
Следующие соединения получают способами, аналогичными способам получений 41-43
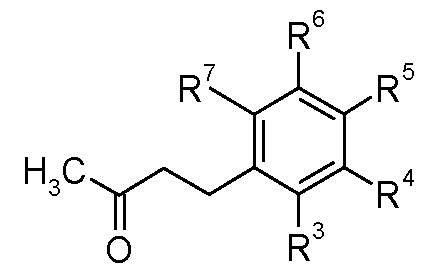
Получение 44
4-[4-(трифторметил)фенил]бутан-2-он
1H-ЯМР (CD3OD): 2,08-2,12 (3H), 2,79-2,84 (2H), 2,87-2,92 (2H), 7,34-7,38 (1H), 7,49-7,54 (1H).
Получение 45
4-(2,4-дихлорфенил)бутан-2-он
1H-ЯМР (CD3OD): 2,10-2,12 (3H), 2,74-2,79 (2H), 2,88-2,93 (2H), 7,18-7,21 (1H), 7,23-7,27 (1H), 7,36-7,38 (1H).
Получение 46
4-[3-(трифторметил)фенил]бутан-2-он
1H-ЯМР (CDCl3): 2,14-2,16 (3H), 2,76-2,82 (2H), 2,92-2,98 (2H), 7,35-7,41 (2H), 7,42-7,48 (2H).
Получение 47
4-(2-хлор-6-фторфенил)бутан-2-он
1H-ЯМР (CD3OD): 2,15-2,17 (3H), 2,70-2,76 (2H), 2,98-3,04 (2H), 7,01-7,07 (1H), 7,19-7,23 (2H).
Получение 49
4-(2-хлор-3-гидроксифенил)бутан-2-он
1H-ЯМР (CDCl3): 2,11-2,13 (3H), 2,70-2,73 (2H), 2,95-2,99 (2H), 6,78-6,80 (1H), 6,87-6,89 (1H), 7,05-7,07 (1H).
Получение 50
4-(3-оксобутил)бензойная кислота
1H-ЯМР (CD3OD): 2,16-2,18 (3H), 2,80-2,83 (2H), 2,89-2,92 (2H), 7,30-7,32 (2H), 7,90-7,93 (2H).
Получение 51
3-(3-оксобутил)бензойная кислота
1H-ЯМР (CDCl3): 2,16-2,18 (3H), 2,79-2,82 (2H), 2,95-2,98 (2H), 7,38-7,40 (1H), 7,41-7,44 (1H), 7,94-7,96 (2H).
Получение 52
4-(4,5-дифтор-2-гидроксифенил)бутан-2-он
1H-ЯМР (CDCl3): 2,20-2,22 (3H), 2,74-2,77 (2H), 2,87-2,89 (2H), 6,70-6,73 (1H), 6,79-6,82 (1H).
Получение 53
4-(2,6-дихлор-3-гидроксифенил)бутан-2-он
Экспериментальное значение MH+ 233,2; ожидаемое значение 233,0.
Получение 54
4-[4-гидрокси-3-(трифторметил)фенил]бутан-2-он
1H-ЯМР (CDCl3): 2,17-2,19 (3H), 2,76-2,79 (2H), 2,81-2,83 (2H), 6,80-6,82 (1H), 7,18-7,21 (1H), 7,29-7,31 (1H).
Получение 55
4-(4-гидрокси-3,5-диметилфенил)бутан-2-он
К смеси соединения получения 117 (442 мг, 3,6 ммоль) и концентрированной серной кислоты (конц., 0,9 мл) в толуоле (4 мл) при 0°C добавляют по капле соединение получения 118 (116 мг, 1,7 ммоль) в толуоле (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов и затем распределяют между водой и диэтиловым эфиром. Органическую фазу отделяют, промывают водой и насыщенным раствором соли, сушат (MgSO4) и концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (картридж Isolute, 5 г) с градиентным элюированием смесью циклогексан:дихлорметан [от 3:1 до 0:1]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (128 мг).
1H-ЯМР (CDCl3): 2,09-2,10 (3H), 2,18-2,20 (6H), 2,61-2,72 (4H), 4,61-4,62 (1H), 6,78-6,79 (2H).
Получение 56
4-(3-фтор-4-гидроксифенил)бутан-2-он
К раствору соединения получения 156 (5,8 г, 51,9 ммоль) в толуоле (25 мл) при 0°C добавляют концентрированную серную кислоту (1,1 мл, 21,6 ммоль). К смеси добавляют по капле соединение получения 118 (3,0 г, 43,2 ммоль) в толуоле (5 мл) за 1,5 часа и реакционную смесь перемешивают еще 2 часа. К смеси добавляют воду (25 мл) и два слоя разделяют. Органическую фазу промывают водой (2×10 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток растворяют в смеси этилацетат:циклогексан [10:90, 5 мл] и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 40M) с градиентным элюированием смесью этилацетат:циклогексан [от 5:95 до 20:80]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (747 мг).
1H-ЯМР (CD3OD): 2,10-2,12 (3H), 2,75-2,78 (4H), 6,77-6,80 (2H), 6,84-6,86 (1H).
Аналогично получают следующие соединения:
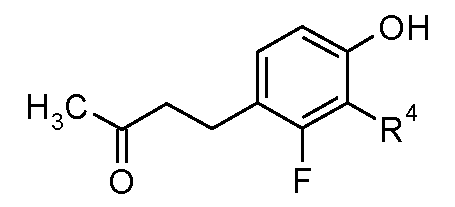
Получение 57
4-(2,3-дифтор-4-гидроксифенил)бутан-2-он
1H-ЯМР (CDCl3): 2,15-2,18 (3H), 2,70-2,73 (2H), 2,82-2,85 (2H), 6,65-6,69 (1H), 6,80-6,84 (1H).
Получение 58
4-(2-фтор-4-гидроксифенил)бутан-2-он
1H-ЯМР (CDCl3): 2,16-2,18 (3H), 2,71-2,75 (2H), 2,80-2,84 (2H), 6,50-6,54 (2H), 6,98-7,01 (1H).
Получение 59
3-формил-4-гидроксибензонитрил
К раствору соединения получения 123 (2,5 г, 13,0 ммоль) в безводном тетрагидрофуране (100 мл) при -78°C и в атмосфере азота медленно добавляют н-бутиллитий (1,6 M, 16,2 мл) при помощи шприца. Реакционную смесь перемешивают при -78°C в течение 30 минут перед добавлением N,N-диметилформамида (2,1 мл). Реакционной смеси дают нагреться до комнатной температуры в течение ночи и затем разбавляют водой (100 мл). Смесь концентрируют в вакууме и остаток подкисляют, добавляя соляную кислоту (2 M). Осадок собирают фильтрованием и сушат в вакууме, получая указанное в заголовке соединение (1,13 г).
1H-ЯМР (CDCl3): 7,02-7,17 (1H), 7,69-7,98 (2H), 9,86-9,97 (1H).
Получение 60
4,5-дифтор-2-гидроксибензальдегид
К раствору соединения получения 132 (5,0 г, 20,0 ммоль) в безводном тетрагидрофуране (100 мл) при -78°C и в атмосфере азота добавляют шприцем н-бутиллитий (1,6 M в гексане, 30,7 мл, 49,0 ммоль). Смесь перемешивают при -78°C в течение 30 минут перед добавлением N,N-диметилформамида (3,9 мл, 50 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 18 часов. К смеси добавляют воду (200 мл) и раствор концентрируют в вакууме. Остаток подкисляют избытком соляной кислоты (2 M) и экстрагируют диэтиловым эфиром (2×300 мл). Объединенные экстракты сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (3,0 г).
1H-ЯМР (CDCl3): 6,77-6,83 (1H), 7,34-7,40 (1H), 9,77-9,79 (1H).
Аналогично получают следующее соединение:
Получение 61
2-гидрокси-5-трифторметилбензальдегид
Из соединения получения 133.
1H-ЯМР (CDCl3): 6,87-6,93 (1H), 7,09-7,13 (1H), 7,48-7,53 (1H), 9,94-9,97 (1H).
Получение 62
N-[2-(3-оксобутил)фенил]метансульфонамид
К смеси соединения получения 64 (200 мг, 0,7 ммоль), ацетата палладия(II) (10 мол.%, 15 мг, 0,07 ммоль) и хлорида лития (28,5 мг, 0,7 ммоль) в атмосфере азота добавляют триэтиламин (0,34 мл, 2,4 ммоль). Реакционный сосуд продувают азотом и дегазируют перед добавлением соединения получения 139 (0,2 мл, 2,4 ммоль). Затем реакционную смесь нагревают в микроволновой печи (300 Вт) при 120°C в течение 20 минут. Смесь концентрируют в вакууме и к остатку добавляют воду (10 мл). Раствор экстрагируют этилацетатом (3×25 мл). Объединенные экстракты промывают соляной кислотой (0,1 M) и водным раствором гидрокарбоната натрия, сушат (MgSO4) и концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (Biotage™, картридж 40S, кондиционированный смесью циклогексан:этилацетат [88:12]) с градиентным элюированием смесью циклогексан:этилацетат [от 88:12 до 0:100]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (160 мг).
1H-ЯМР (CDCl3): 2,12-2,15 (3H), 2,84-2,93 (4H), 3,02-3,06 (3H), 7,12-7,18 (1H), 7,19-7,25 (1H), 7,45-7,49 (1H), 8,24-8,33 (1H).
Аналогично получают следующее соединение:
Получение 63
4-(3-гидроксифенил)бутан-2-он
Из соединения получения 165.
1H-ЯМР (CDCl3): 2,17-2,19 (3H), 2,75-2,79 (2H), 2,81-2,85 (2H), 6,65-6,68 (2H), 6,76-6,78 (1H), 7,13-7,16 (1H).
Получение 64
N-(2-йодфенил)метансульфонамид
К раствору соединения получения 135 (1,0 г, 5,8 ммоль) в пиридине (8 мл) добавляют по капле соединение получения 174 (0,7 мл, 8,7 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют в вакууме и к остатку добавляют воду. Раствор экстрагируют дихлорметаном и органический экстракт подкисляют соляной кислотой (2 M), нейтрализуют гидрокарбонатом натрия, сушат (MgSO4) и концентрируют в вакууме. К остатку добавляют дихлорметан (4 мл) и надосадочную жидкость удаляют и разделяют на слои при помощи циклогексана, из которого в течение ночи кристаллизуется твердое вещество. Кристаллическое твердое вещество фильтруют и сушат, получая указанное в заголовке соединение (1,2 г).
1H-ЯМР (CDCl3): 2,98-3,02 (3H), 6,91-6,96 (1H), 7,35-7,42 (1H), 7,63-7,67 (1H), 7,80-7,85 (1H).
Получение 65
N-{2-[3-оксобут-1-ен-1-ил]фенил}метансульфонамид
К раствору соединения получения 64 (1,2 г, 3,9 ммоль) в N,N-диметилформамиде (24 мл) добавляют ацетат палладия(II) (10 мол.%, 874 мг, 3,9 ммоль), соединение получения 118 (0,5 мл, 5,8 ммоль), хлорид тетрабутиламмония (1,08 г, 3,9 ммоль) и гидрокарбонат натрия (818 мг, 9,7 ммоль). Реакционный сосуд продувают азотом и смесь нагревают при 60°C в течение 2 часов и затем перемешивают при комнатной температуре в течение 18 часов. К смеси добавляют воду (50 мл) и раствор экстрагируют этилацетатом (4×100 мл). Объединенные экстракты концентрируют в вакууме, получая сырой продукт. Остаток очищают методом колоночной хроматографии (диоксид кремния, 20 г, кондиционированный дихлорметаном) с градиентным элюированием смесью циклогексан:этилацетат [от 80:20 до 0:100]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (514 мг).
Экспериментальное значение (M-H+)- 237,9; ожидаемое значение 238,1.
Получение 66
4-(2-изопропоксифенил)бутан-2-он
К раствору соединения получения 41 (31,7 г, 193 ммоль) в ацетоне (750 мл) добавляют карбонат цезия (126,0 г, 386,0 ммоль) и соединение получения 167 (38,5 мл, 386 ммоль). Реакционную смесь нагревают при 55°C в течение 18 часов, охлаждают до комнатной температуры и распределяют между водой (700 мл) и этилацетатом (600 мл). Два слоя разделяют и водный слой экстрагируют этилацетатом (600 мл). Объединенные органические фазы промывают насыщенным раствором соли (500 мл) и концентрируют в вакууме, получая указанное в заголовке соединение (41,0 г).
1H-ЯМР (CDCl3): 1,23-1,30 (6H), 2,09-2,10 (3H), 2,61-2,68 (2H), 2,90-2,98 (2H), 4,50-4,60 (1H), 6,78-6,82 (2H), 7,09-7,15 (2H).
Получение 67
7-гидрокси-6-{[1-метил-3-(4-нитрофенил)пропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он
К смеси соединения получения 9 (300 мг, 1,2 ммоль) и соединения получения 35 (269 мг, 1,4 ммоль) в метаноле (5 мл) в атмосфере азота добавляют триэтиламин (0,05 мл, 0,4 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (111 мг, 1,8 ммоль) и реакционную смесь нагревают при 60°C в атмосфере азота в течение 5 дней. После охлаждения добавляют лимонную кислоту (500 мг) и смесь нагревают при 60°C в течение 3 часов. К смеси добавляют воду (0,2 мл), а затем избыток гидрокарбоната натрия и перемешивают смесь при комнатной температуре в течение 18 часов. Смесь концентрируют в вакууме и остаток предварительно абсорбируют на диоксиде кремния (10 г) и пропускают через подложку из диоксида кремния (10 г), элюируя смесью дихлорметан:2,5% аммиак в метаноле [4:1]. Фильтрат концентрируют в вакууме и остаток промывают толуолом и сушат, получая указанное в заголовке соединение (600 мг), которое используют немедленно.
Аналогично получают следующее соединение:
Получение 68
7-гидрокси-6-{[1-метил-3-(3-нитрофенил)пропил]амино}-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-он
Из соединения получения 37. Указанное в заголовке соединение немедленно используют на следующей стадии реакции.
Получение 69
7-гидрокси-6-{[3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он
К раствору соединения получения 100 (7,1 г, 43,3 ммоль) в метаноле (200 мл) добавляют соединение получения 1 (10,1 г, 39,4 ммоль), а затем триэтиламин (1,7 мл, 11,8 ммоль). После перемешивания в течение 20 минут добавляют цианборгидрид натрия (6,2 г, 98,5 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 60 часов. Смесь гасят водой (10 мл) и концентрируют в вакууме. Остаток подвергают азеотропной перегонке с метанолом и раствор концентрируют в вакууме, получая указанное в заголовке соединение (22,5 г) в виде смеси 4 диастереомеров.
Экспериментальное значение MH+ 368,1; ожидаемое значение 368,2.
Получение 70
4-(3,5-дибром-2-гидроксифенил)бутан-2-он
К раствору соединения получения 41 (2,0 г, 12,2 ммоль) в дихлорметане (70 мл) добавляют по капле соединение получения 148 (4,3 г, 24,4 ммоль) в N,N-диметилформамиде (8 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов перед добавлением дихлорметана (100 мл). Раствор промывают водой (3×100 мл) и концентрируют в потоке азота. Остаток растворяют в смеси этилацетат:циклогексан [5:95] и очищают методом автоматизированной флэш-хроматографии (Biotage™, картридж 65i c диоксидом кремния) с градиентным элюированием смесью этилацетат:циклогексан [от 2:98 до 20:80]. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (3,7 г).
1H-ЯМР (CDCl3): 2,18-2,20 (3H), 2,77-2,80 (2H), 2,88-2,91 (2H), 7,15-7,17 (1H), 7,20-7,22 (1H).
Получение 71
2,2,2-трифтор-N-[2-(3-оксобутил)фенил]ацетамид
К раствору соединения получения 78 (400 мг, 1,3 ммоль) в метаноле (10 мл) добавляют концентрированную соляную кислоту (0,1 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь концентрируют в вакууме и к остатку добавляют дихлорметан (15 мл). Раствор промывают водой (2×5 мл), сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (250 мг).
1H-ЯМР (CDCl3): 2,16-2,19 (3H), 2,78-2,82 (2H), 2,97-3,00 (2H), 7,17-7,20 (2H), 7,60-7,65 (2H).
Аналогично получают следующие соединения:
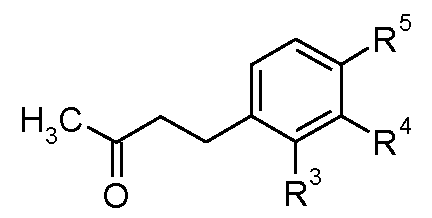
Получение 72
N-[2-(3-оксобутил)фенил]этансульфонамид
1H-ЯМР (CDCl3): 1,40-1,44 (3H), 2,12-2,14 (3H), 2,86-2,89 (4H), 3,17-3,21 (2H), 7,11-7,16 (2H), 7,18-7,21 (1H), 7,41-7,43 (1H).
Получение 73
2,2,2-трифтор-N-[3-(3-оксобутил)фенил]ацетамид
1H-ЯМР (CDCl3): 2,13-2,15 (3H), 2,76-2,80 (2H), 2,87-2,91 (2H), 7,04-7,06 (1H), 7,27-7,30 (1H), 7,39-7,43 (2H).
Получение 74
2,2,2-трифтор-N-[4-(3-оксобутил)фенил]ацетамид
1H-ЯМР (CDCl3): 2,15-2,18 (3H), 2,76-2,80 (2H), 2,84-2,88 (2H), 7,20-7,23 (2H), 7,43-7,46 (2H).
Получение 75
N-[3-(3-оксобутил)фенил]пропанамид
1H-ЯМР (CDCl3): 1,20-1,25 (3H), 2,10-2,13 (3H), 2,37-2,40 (2H), 2,76-2,79 (2H), 2,81-2,84 (2H), 6,90-6,93 (1H), 7,15-7,19 (2H), 7,26-7,28 (1H).
Получение 76
N-[2-(3-оксобутил)фенил]ацетамид
1H-ЯМР (CDCl3): 2,13-2,15 (3H), 2,28-2,30 (3H), 2,80-2,83 (2H), 2,89-2,92 (2H), 7,03-7,07 (1H), 7,19-7,22 (1H), 7,43-7,46 (1H), 7,62-7,64 (1H).
Получение 77
N-[3-(3-оксобутил)фенил]метансульфонамид
1H-ЯМР (CDCl3): 2,16-2,18 (3H), 2,76-2,79 (2H), 2,84-2,87 (2H), 2,99-3,01 (3H), 7,00-7,05 (3H), 7,22-7,25 (1H).
Получение 78
2,2,2-трифтор-N-{2-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}ацетамид
К раствору соединения получения 83 (350 мг, 1,7 ммоль) в дихлорметане (10 мл) добавляют пиридин (534 мг, 6,8 ммоль) и смесь охлаждают на бане ацетонитрил/сухой лед. К смеси добавляют по капле соединение получения 173 (0,3 мл, 1,9 ммоль) в дихлорметане (5 мл) и реакционную смесь перемешивают в течение 10 минут. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 2 часов перед добавлением избытка гидрокарбоната натрия. После перемешивания в течение 18 часов добавляют воду (5 мл) и дихлорметан (10 мл) и разделяют два слоя. Органическую фазу концентрируют в вакууме, получая указанное в заголовке соединение (400 мг).
1H-ЯМР (CDCl3): 1,20-1,23 (3H), 1,94-1,98 (2H), 2,68-2,72 (2H), 3,94-4,00 (4H), 7,20-7,25 (2H), 7,40-7,45 (2H).
Аналогично получают следующие соединения, используя подходящий хлорангидрид кислоты или ангидрид кислоты:
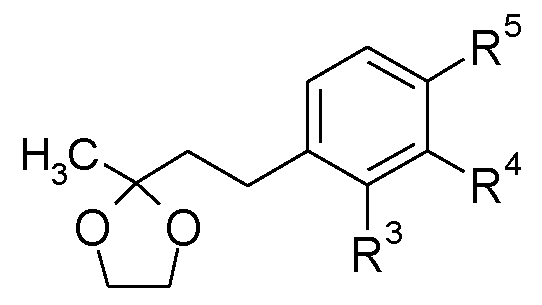
Получение 79
2,2,2-трифтор-N-{3-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}ацетамид
1H-ЯМР (CDCl3): 1,37-1,39 (3H), 1,95-1,99 (2H), 2,69-2,73 (2H), 3,96-4,00 (4H), 7,26-7,29 (1H), 6,38-6,42 (2H), 8,60-8,62 (1H).
Получение 80
2,2,2-трифтор-N-{4-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}ацетамид
1H-ЯМР (CDCl3): 1,37-1,39 (3H), 1,90-1,94 (2H), 2,68-2,73 (2H), 3,96-4,00 (4H), 7,19-7,22 (2H), 7,44-7,47 (2H).
Получение 81
N-{3-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}пропанамид
1H-ЯМР (CDCl3): 1,08-1,12 (3H), 1,38-1,40 (3H), 1,95-1,99 (2H), 2,36-2,40 (2H), 2,65-2,70 (2H), 3,90-3,96 (4H), 6,91-6,94 (1H), 7,10-7,15 (1H), 7,22-7,28 (2H).
Получение 82
N-{2-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}ацетамид
1H-ЯМР (CDCl3): 1,36-1,38 (3H), 1,94-1,98 (2H), 2,09-2,11 (3H), 2,60-2,64 (2H), 3,90-3,94 (2H), 4,00-4,03 (2H), 7,01-7,04 (1H), 7,10-7,13 (1H), 7,42-7,45 (1H), 7,61-7,64 (1H).
Получение 83
2-[2-(2-метил-1,3-диоксолан-2-ил)этил]анилин
Раствор соединения получения 86 (550 мг, 2,3 ммоль) в метаноле (75 мл) пропускают через гидрогенизатор H-Cube (1 мл/мин, 1 атм, комнатная температура), используя палладиевый катализатор (10% на угле). Раствор концентрируют в вакууме, получая указанное в заголовке соединение (500 мг).
1H-ЯМР (CDCl3): 1,38-1,40 (3H), 1,92-1,97 (2H), 2,58-2,62 (2H), 4,00-4,04 (4H), 6,67-6,73 (2H), 7,01-7,04 (2H).
Аналогично получают следующие соединения:
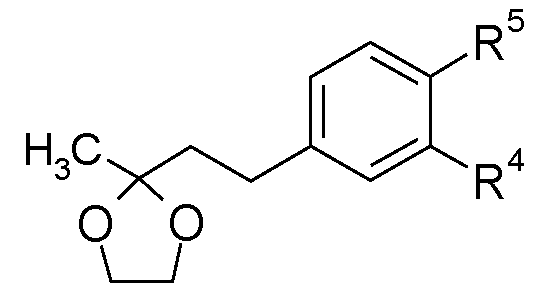
Получение 84
3-[2-(2-метил-1,3-диоксолан-2-ил)этил]анилин
1H-ЯМР (CDCl3): 1,37-1,39 (3H), 1,90-1,94 (2H), 2,60-2,64 (2H), 3,96-4,00 (4H), 6,49-6,52 (2H), 6,60-6,62 (1H), 7,03-7,05 (1H).
Получение 85
4-[2-(2-метил-1,3-диоксолан-2-ил)этил]анилин
1H-ЯМР (CDCl3): 1,37-1,39 (3H), 1,88-1,92 (2H), 2,59-2,63 (2H), 3,97-4,00 (4H), 6,60-6,63 (2H), 6,98-7,00 (2H).
Получение 86
2-метил-2-[2-(2-нитрофенил)винил]-1,3-диоксолан
Смесь соединения получения 38 (2,5 г, 13,1 ммоль), этиленгликоля (1,6 г, 26,2 ммоль) и моногидрата пара-толуолсульфоновой кислоты (25 мг, 0,1 ммоль) в толуоле (50 мл) нагревают при кипении с обратным холодильником в аппарате Дина-Старка в течение 5 часов. После охлаждения смесь промывают насыщенным водным раствором карбоната натрия (2×20 мл) и водой, сушат (K2CO3) и концентрируют в вакууме, получая указанное в заголовке соединение (2,2 г).
1H-ЯМР (CDCl3): 2,58-2,61 (3H), 4,00-4,05 (4H), 6,05-6,09 (1H), 7,14-7,18 (1H), 7,55-7,57 (1H), 7,64-7,68 (2H), 7,95-7,97 (1H).
Аналогично получают следующие соединения:
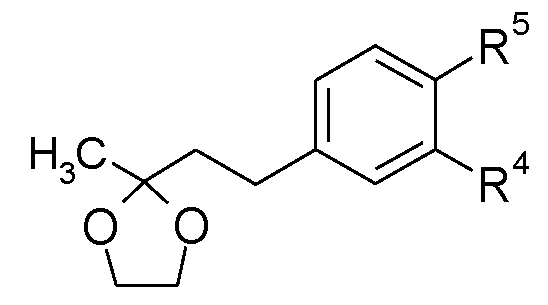
Получение 87
2-метил-2-[2-(3-нитрофенил)винил]-1,3-диоксолан
1H-ЯМР (CDCl3): 1,58-1,60 (3H), 3,92-3,97 (2H), 4,00-4,04 (2H), 6,26-6,30 (1H), 6,76-6,80 (1H), 7,48-7,51 (1H), 7,65-7,68 (1H), 8,08-8,11 (1H), 8,22-8,24 (1H).
Получение 88
2-метил-2-[2-(4-нитрофенил)винил]-1,3-диоксолан
1H-ЯМР (CDCl3): 2,59-2,61 (3H), 3,95-3,99 (2H), 4,00-4,05 (2H), 6,30-6,34 (1H), 6,76-6,80 (1H), 7,52-7,55 (2H), 8,17-8,20 (2H).
Получение 89
4-(3-оксобутил)-N-(2,2,2-трифторэтил)бензамид
К раствору соединения получения 152 (0,6 мл, 7,0 ммоль) в дихлорметане (15 мл) добавляют соединение получения 91 (367 мг, 1,7 ммоль). Реакционную смесь перемешивают в течение 15 минут и затем экстрагируют водой (2×2 мл). Органическую фазу сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (670 мг).
1H-ЯМР (CDCl3): 4,05-4,11 (1H), 7,25-7,30 (2H), 7,69-7,75 (2H).
Аналогично получают следующее соединение:
Получение 90
N-метил-3-(3-оксобутил)бензамид
Из соединения получения 92 и получения 175.
1H-ЯМР (CDCl3): 2,10-2,12 (3H), 2,75-2,79 (2H), 2,85-2,89 (2H), 2,96-2,98 (3H), 7,26-7,29 (2H), 7,54-7,57 (1H), 7,60-7,62 (1H).
Получение 91
4-(3-оксобутил)бензоил хлорид
К раствору соединения получения 50 (1,2 г, 6,2 ммоль) в дихлорметане (15 мл) добавляют N,N-диметилформамид (30 мкл). Смесь охлаждают до 0°C и добавляют соединение получения 147 (0,9 мл). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов. Смесь концентрируют в вакууме, получая указанное в заголовке соединение (1,3 г), которое используют немедленно.
Аналогично получают следующее соединение:
Получение 92
3-(3-оксобутил)бензоил хлорид
Из соединения получения 51 и соединения получения 147.
Получение 93
N-{2-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}этансульфонамид
К раствору соединения получения 83 (350 мг, 1,7 ммоль) в дихлорметане (5 мл) добавляют пиридин (0,4 мл, 5,1 ммоль) и смесь охлаждают на бане со льдом. К смеси добавляют по капле соединение получения 155 (0,2 мл, 1,9 ммоль) в дихлорметане (5 мл). После перемешивания в течение 10 минут реакционной смеси дают нагреться до комнатной температуры и перемешивают еще 2 часа, добавляют избыток гидрокарбоната натрия и смесь перемешивают в течение 18 часов перед добавлением воды (5 мл) и дихлорметана (10 мл). Два слоя разделяют и органическую фазу концентрируют в вакууме, получая указанное в заголовке соединение (400 мг), которое используют немедленно.
Аналогично получают следующее соединение:
Получение 94
N-{3-[2-(2-метил-1,3-диоксолан-2-ил)этил]фенил}метансульфонамид
Из соединения получения 84 и соединения получения 174.
Получение 95
N-циклопропил-4-(3-оксобутил)бензамид
К раствору соединения получения 50 (200 мг, 1,0 ммоль) в ацетонитриле (10 мл) добавляют тионилхлорид (151 мкл, 2,1 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. К смеси добавляют соединение получения 160 (511 мкл, 7,3 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Смесь экстрагируют этилацетатом и объединенные экстракты промывают водным раствором гидрокарбоната натрия и водой, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (65 мг).
1H-ЯМР (CDCl3): 0,59-0,64 (2H), 0,82-0,87 (2H), 2,15-2,17 (3H), 2,70-2,74 (2H), 2,88-2,95 (3H), 7,20-7,23 (2H), 7,61-7,63 (2H).
Получение 96
3-(3-оксобутил)бензамид
Раствор соединения получения 92 (307 мг, 1,5 ммоль) в аммиаке (0,5 M в диоксане, 17,5 мл) перемешивают в течение 15 минут. Смесь экстрагируют водой (2×2 мл) и органическую фазу сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (130 мг).
1H-ЯМР (CDCl3): 2,14-2,16 (3H), 2,78-2,82 (2H), 2,95-2,99 (2H), 7,38-7,40 (1H), 7,41-7,43 (1H), 7,90-7,92 (2H).
Аналогично получают следующее соединение:
Получение 97
4-(3-оксобутил)бензамид
Из соединения получения 91.
1H-ЯМР (CDCl3): 2,16-2,18 (3H), 2,78-2,81 (2H), 2,97-3,00 (2H), 7,30-7,32 (2H), 8,00-8,02 (2H).
Получение 98
4-(2-хлор-3-гидроксифенил)бут-3-ен-2-он
Смесь соединения получения 149 (157 мг, 1,0 ммоль) и соединения получения 150 (637 мг, 2,0 ммоль) в тетрагидрофуране (20 мл) нагревают при кипении с обратным холодильником в течение 12 часов. Смесь концентрируют в вакууме и остаток очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:гексан. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (100 мг).
1H-ЯМР (CDCl3): 2,40-2,42 (3H), 6,61-6,64 (1H), 7,08-7,10 (1H), 7,40-7,45 (2H), 7,80-7,82 (1H).
Аналогично получают следующее соединение:
Получение 99
4-(2,6-дихлор-3-гидроксифенил)бут-3-ен-2-он
Из соединения получения 169.
Экспериментальное значение MH+ 233,2; ожидаемое значение 233,0.
Получение 100
4-(2-гидроксифенил)бут-3-ен-2-он
К раствору соединения получения 109 (150,0 г, 1,2 моль) в ацетоне (700 мл) при 0°C и в атмосфере азота аккуратно добавляют водный раствор гидроксида натрия (1 н., 1350 мл), поддерживая температуру смеси ниже 10°C. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов. К смеси добавляют соляную кислоту (3 н., 600 мл) и полученное твердое вещество собирают фильтрованием в атмосфере азота. Твердое вещество промывают водой (3×300 мл и 1×500 мл), а затем циклогексаном (250 мл) и сушат в вакууме. Остаток суспендируют в циклогексане (750 мл) в течение 2 дней, фильтруют, промывают циклогексаном (2×150 мл) и концентрируют в вакууме, получая указанное в заголовке соединение (155,0 г).
1H-ЯМР (CD3OD): 2,37-2,39 (3H), 6,81-6,83 (1H), 6,83-6,86 (2H), 7,20-7,23 (1H), 7,51-7,53 (1H), 7,93-7,96 (1H).
Получение 101
N-[4-(3-оксобутил)фенил]бензолсульфонамид
К смеси соединения получения 103 (163 мг, 1,0 ммоль) и триэтиламина (35 мкл, 2,5 ммоль) в тетрагидрофуране и дихлорметане (8,5 мл) добавляют соединение получения 161 (194 мг, 1,1 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 часов и затем концентрируют в вакууме. Остаток экстрагируют этилацетатом и объединенные экстракты сушат (MgSO4) и концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:гексан. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (250 мг).
Экспериментальное значение MH+ 304,2; ожидаемое значение 304,1.
Получение 102
1,1,1-трифтор-N-[4-(3-оксобутил)фенил]метансульфонамид
К смеси соединения получения 103 (163 мг, 1,0 ммоль) и триэтиламина (35 мкл, 2,5 ммоль) в дихлорметане (8,5 мл) добавляют соединение получения 162 (185 мг, 1,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов и затем концентрируют в вакууме. К остатку добавляют метанол и водный раствор гидроксида натрия и смесь перемешивают еще 12 часов. Смесь концентрируют в вакууме и остаток экстрагируют этилацетатом. Объединенные экстракты сушат (MgSO4) и концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:гексан. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (103 мг).
1H-ЯМР (d6-ДМСО): 2,08-2,10 (3H), 2,72-2,75 (4H), 7,10-7,13 (2H), 6,40-6,42 (2H).
Получение 103
4-(4-аминофенил)бутан-2-он
Смесь соединения получения 100 (150 мг, 0,8 ммоль) и палладия (10% на угле, 15 мг) в этаноле (5 мл) перемешивают в атмосфере водорода (3,52 кг/см2, 50 фунт/дюйм2) при комнатной температуре в течение 2 часов. Реакционную смесь фильтруют через Celite® и фильтрат концентрируют в вакууме. Остаток очищают методом колоночной хроматографии (диоксид кремния), элюируя смесью этилацетат:гексан. Подходящие фракции объединяют и концентрируют, получая указанное в заголовке соединение (114 мг).
1H-ЯМР (d6-ДМСО): 2,05-2,07 (3H), 2,56-2,60 (2H), 2,60-2,64 (2H), 6,42-6,44 (2H), 6,80-6,82 (2H).
Получение 104
4-изопропоксифенилбутанон
К раствору соединения получения 106 (1,00 г, 6,1 ммоль) в ацетоне (30 мл) добавляют карбонат калия (1,70 г, 12,2 ммоль), соединение получения 143 (1,15 мл, 12,2 ммоль) и йодид калия (2,02 г, 12,2 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 18 часов и затем гасят, добавляя воду. Смесь экстрагируют этилацетатом (3×50 мл) и объединенные экстракты сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (1,25 г), которое используют немедленно.
Получение 105
Фенил 3-метилбут-2-еноат
К раствору соединения получения 176 (6,7 г, 71 ммоль) и соединения получения 144 (8,5 г, 71 ммоль) в диэтиловом эфире (150 мл) при 0°C добавляют по капле триэтиламин (10,0 мл, 71 ммоль). Реакционную смесь перемешивают в течение 30 минут и затем фильтруют через Celite®, промывая диэтиловым эфиром. Фильтрат промывают водой и насыщенным раствором соли, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение (13,5 г).
Экспериментальное значение MH+ 177,3; ожидаемое значение 177,1.
Следующие соединения можно приобрести коммерчески:
Получение 168
4-(5-хлор-2-гидроксифенил)бут-3-ен-2-он
Это соединение получают согласно способу, описанному в WO-9946266 A1, пример 4.
Получение 169
2,6-дихлор-3-гидроксибензальдегид
Это соединение получают согласно способу, описанному в Synthesis (2004), (12), 2062-2065.
Получение 170
4-(2,3-дигидро-1-бензофуран-5-ил)бутан-2-он
Это соединение получают согласно способу, описанному в WO-0279143 A1, получение 140.
Получение 171
4-(3-гидроксифенил)бут-3-ен-2-он
Это соединение получают согласно способу, описанному в WO-0208188 A1, пример 1, стадия 1.
Получение 172
3-(гидроксиметил)бензальдегид
Это соединение получают согласно способу, описанному в Can. J. Chem, 1973, 51, 3756-3764.
Следующие соединения можно приобрести коммерчески
Источник 1 - Sigma-Aldrich, P O Box 14508, St. Louis, MO, 63178, USA.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭНАНТИОСЕЛЕКТИВНЫЙ СИНТЕЗ 6-АМИНО-7-ГИДРОКСИ-4,5,6,7-ТЕТРАГИДРОИМИДАЗО[4,5,1-jk][1]БЕНЗАЗЕПИН-2[1H]-ОНА И ЗИЛПАТЕРОЛА | 2008 |
|
RU2433131C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ПРОИЗВОДНОЕ ПИПЕРИДИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2730508C2 |
| МОДУЛЯТОРЫ SHIP1 И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2014 |
|
RU2679805C2 |
| МОДУЛЯТОРЫ 5HT РЕЦЕПТОРА | 2003 |
|
RU2317982C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ГЛИКОЗИДАЗЫ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2625308C2 |
| БИЦИКЛИЧЕСКИЕ 6-АЛКИЛИДЕНПЕНЕМЫ В КАЧЕСТВЕ ИНГИБИТОРОВ β-ЛАКТАМАЗ | 2003 |
|
RU2339640C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| ПРОИЗВОДНОЕ ФТАЛАЗИНОНКЕТОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2564527C2 |
Настоящее изобретение относится к соединению формулы (I) или его фармацевтически или ветеринарно приемлемым солям, где: А представляет собой -CH2-; и В представляет собой -СН2-, -С(СН3)2-; или -А-В- представляет собой -СН=СН-; один из R1 и R2 представляет собой СН3 и другой представляет собой Н; R3, R4, R5, R6 и R7, каждый независимо выбран из Н, R8 и R9; или R4 и R5 вместе представляют собой -O-СН2-СН2-, -СН2-СН2-O- или -O-СН2-O-, и R3, R6 и R7, каждый представляет собой Н; R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, -СН2OН, -O-(C1-C4 алкил), -O-СН2-(С3-С5)циклоалкил, -СO2Н, -CO2(C1-C4 алкил), -CONH2, -CONH(C1-C4 алкил), -CONH(C1-C4 галогеналкил), -CONH(C3-C6 циклоалкил) или NH2; и R9 представляет собой -ОН, -NHSO2(C1-C3 алкил), -NHCO(C1-C4 алкил), -NHCO(C1-C4 галогеналкил), -NHSO2(С1-С3 галогеналкил) или -NНSO2(фенил). Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), которая обладает агонистической активностью в отношении коровьих и свиных адренергических бета-2-рецепторов. Технический результат: получены новые соединения, обладающие полезными биологическими свойствами. 2 н. и 10 з.п. ф-лы.
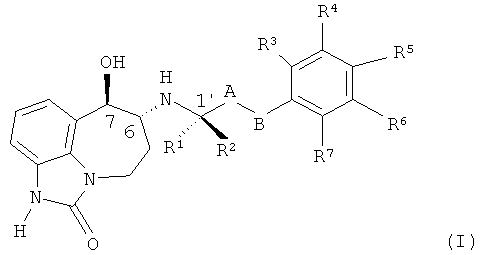
1. Соединение формулы (I)
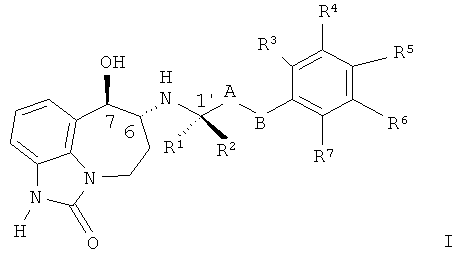
или его фармацевтически или ветеринарно приемлемая соль, где
А представляет собой -СН2-; и
В представляет собой -СН2-, -С(СН3)2-; или
-А-В- представляет собой -СН=СН-;
один из R1 и R2 представляет собой СН3 и другой представляет собой Н;
R3, R4, R5, R6 и R7 каждый независимо выбран из Н, R8 и R9;
или
R4 и R5 вместе представляют собой -O-СН2-СН2-, -СН2-СН2-O- или
-O-СН2-O-, и R3, R6 и R7 каждый представляет собой Н;
R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, СН2OН, -О-(C1-C4 алкил), -О-СН2- (С3-С5) циклоалкил, -СO2Н, -СO2 (C1-C4 алкил), -CONН2, -CONH(C1-C4 алкил), -CONH(C1-C4 галогеналкил), -CONH(С3-С6 циклоалкил) или NН2; и
R9 представляет собой -ОН, -NHSO2(C1-С3 алкил), -NHCO(C1-C4 алкил), -NHCO(C1-C4 галогеналкил), -NHSO2(C1-С3 галогеналкил) или -NHSO2(фенил).
2. Соединение по п.1 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где:
-А- представляет собой -СН2- и -В- представляет собой -С(СН3)2-; или
-А-В- представляет собой -СН=СН-.
3. Соединение по п.1 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где -А- представляет собой -СН2- и -В- представляет собой -СН2-.
4. Соединение по п.1 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где R1 представляет собой Н и R2 представляет собой СН3.
5. Соединение по п.4 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где абсолютная стереохимия по С-1', С-6 и С-7 соответствует R, R, R.
6. Соединение по п.1 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где R3, R4, R5, R6 и R7 каждый независимо выбран из Н, R8 и R9, при условии, что по меньшей мере два из R3, R4, R5, R6 и R7 представляют собой Н; или
R4 и R5 вместе представляют собой -О-СН2-СН2-, -СН2-СН2-О- или -O-СН2-O-, и R3, R6 и R7 представляют собой Н;
R8 представляет собой галоген, -CN, C1-C4 алкил, -СF3, CH2OH,
-O-(C1-C4 алкил) или -О-СН3- (C3-C5) циклоалкил; и
R9 представляет собой -ОН или -NHSO2 (C1-С3 алкил).
7. Соединение по п.6 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где один из R3, R4, R5, R6 и R7 представляют собой R8 или R9, два других из R3, R4, R5, R6 и R7 представляют собой Н или R8, и еще два из R3, R4, R5, R6 и R7 представляют собой Н.
8. Соединение по п.7 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где R3 представляет собой R9.
9. Соединение по п.8 или фармацевтически или ветеринарно приемлемая соль указанного соединения, где R9 представляет собой -ОН.
10. Соединение по п.1, выбранное из следующих соединений:
(6R*,7R*)-7-гидрокси-6-{(1R*)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-7-гидрокси-6-{(1S*)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{(1RS)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{(1S)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{(1R)-[3-(4-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-7-гидрокси-6-{[(1R*)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-7-гидрокси-6-{[(1S*)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{[(1RS)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{[(1R)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-7-гидрокси-6-{[(1S)-3-(2-гидроксифенил)-1-метилпропил]амино}-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-6-{[(1R*)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-6-{[(1S*)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-6-{[(1RS)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-6-{[(1R)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-6-{[(1S)-3-(5-фтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-6-{[(1R*)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R*,7R*)-6-{[(1S*)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-6-{[(1RS)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он,
(6R,7R)-6-{[(1R)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1Н)-он и
(6R,7R)-6-{[(1S)-3-(4,5-дифтор-2-гидроксифенил)-1-метилпропил]амино}-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1] бензазепин-2(1Н)-он,
или фармацевтически или ветеринарно приемлемая соль указанного соединения.
11. Соединение по любому из пп.1-10 или фармацевтически или ветеринарно приемлемая соль указанного соединения для применения в качестве лекарственного средства, обладающего агонистической активностью в отношении коровьих и свиных адренергических бета-2-рецепторов.
12. Фармацевтическая композиция, обладающая агонистической активностью в отношении коровьих и свиных адренергических бета-2-рецепторов, содержащая соединение по любому из пп.1-10 или фармацевтически или ветеринарно приемлемую соль указанного соединения и фармацевтически приемлемый носитель.
| ЕР 0 272 976 А2, 29.06.1988 | |||
| Способ получения тетрагидроимидазо-(1,4)-бензодиазепин-12-онов, или их солей присоединения фармацевтически приемлемых кислот, или их стереохимически изомерных форм | 1989 |
|
SU1748647A3 |
Авторы
Даты
2011-05-27—Публикация
2007-10-03—Подача