Изобретение относится к использованию химических соединений в области медицины и может быть использовано в предклинических исследованиях в опытах на грызунах лекарственных препаратов, содержащих сложноэфирные и/или амидные группы, модулируя их фармакологические и/или токсические эффекты. Соединения также могут представлять интерес как ингибиторы карбоксилэстераз насекомых. Кроме того, изобретение может быть использовано в фармацевтических смесях и рецептурах пестицидов для повышения их эффективности за счет ингибирования карбоксилэстеразы и снижения, таким образом, количества пестицида, необходимого для ингибирования мишени - ацетилхолинэстеразы в случае фосфорорганических и карбаматных пестицидов, и за счет снижения скорости гидролиза действующего вещества в случае пиретроидов.
Карбоксилэстеразы (КЭ) являются детерминантой в фармакокинетике большинства терапевтических средств, содержащих сложноэфирную или амидную группировку, причем конструирование многих новых лекарств идет с учетом их метаболической активации или инактивации за счет карбоксилэстеразного гидролиза (Prokai L, Prokai-Tatrai K. Metabolism-based drug design and drug targeting. Pharm Sci Technolo Today. 1999; 2(11):457-462). В связи с этим ингибиторы КЭ, влияющие на скорость гидролиза таких лекарственных препаратов и таким образом определяющие, например, скорость превращения пролекарства в действующее лекарство или увеличивающие полупериод жизни активного препарата, гидролизующегося КЭ, имеют важное терапевтическое значение (Potter PM, Wadkins RM. Carboxylesterases-detoxifying enzymes and targets for drug therapy. Curr Med Chem. 2006, 13(9):1045-1054).
Кроме того, принимая во внимание, что предклинические исследования механизма действия и метаболизма лекарственных препаратов проводятся прежде всего на грызунах, которые, в отличие от человека, имеют высокий уровень КЭ плазмы, возникает проблема экстраполяции результатов с животных на человека. Применение эффективных необратимых ингибиторов карбоксилэстеразы, обладающих низкой острой токсичностью для теплокровных, позволяет при использовании уже в малых дозах необратимо ингибировать КЭ плазмы и создать адекватную, эффективную модель на грызунах, типичным представителем которых являются мыши, для исследования метаболизма и фармакокинетики препаратов, гидролизующихся под действием КЭ.
Ингибирование карбоксилэстераз насекомых потенцирует действие инсектицидов, гидролизующихся под действием КЭ, таких как пиретроиды, а также антихолинэстеразных инсектицидов за счет снижения их связывания с КЭ. (Шипов А.Э., Генкина Г.К., Махаева Г.Ф., Малыгин В.В., Волкова Р.И., Рославцева С.А., Еремина О.Ю., Баканова Е.И., Мастрюкова Т.А., Кабачник М.И. Исследование механизма действия пестицидов ряда 2-арилокси-2-тио-1,3,2-оксазафосфоринана. Биоорган. химия. 1999, 25 (1):14-19). Использование ингибиторов карбоксилэстераз является одним из путей преодоления резистентности насекомых к действию инсектицидов. (Yan S, Cui F, Qiao С. Structure, function and applications of carboxylesterases from insects for insecticide resistance. Protein Pept Lett. 2009; 16(10):1181-1188). Кроме того, ингибирование КЭ само может приводить к гибели насекомых.
Решением проблемы создания селективных и малотоксичных ингибиторов карбоксилэстераз в мире занимаются уже достаточное количество лет, однако в связи с большим структурным сходством сериновых эстераз имеется лишь ограниченное число сообщений о селективных ингибиторах КЭ. Это серия аналогов трифторметилкетонов (весьма гигроскопичные соединения, которые легко гидролизуются, см. Wheelock СЕ, Severson TF, Hammock BD. Synthesis of new carboxylesterase inhibitors and evaluation of potency and water solubility. Chem Res Toxicol. 2001, 14(12):1563-1572), недавно предложенные аналоги бензила (дифенилэтан-1,2-диона) (Wadkins KM, Hyatt JL, Wei X, Yoon KJ, Wierdl M, Edwards CC, Morton CL, Obenauer JC, Damodaran K, Beroza P, Danks MK, Potter PM. Identification and characterization of novel benzil (diphenylethane-1,2-dione) analogues as inhibitors of mammalian carboxylesterases. J.Med.Chem. 2005, 48(8):2906-2915; патент US 20050054691, МПК А61К 31/44, опуб. 10.03.2005; патент US 2008146548, МПК А61К 31/44, опуб. 19.06.2008 года) и замещенные фенилсульфонамиды и фенилмочевины (те же патенты).
Однако перечисленные соединения являются обратимыми ингибиторами КЭ.
Известны необратимые ингибиторы КЭ, эффект которых нарастает во времени и является более продолжительным. Представителем таких ингибиторов являются фосфорорганичесие соединения (ФОИ) - эфиры кислот пятивалентного фосфора, общей формулы R1R2P(O)X, где одна из групп - Х является обычно хорошей уходящей группой. R1 и R2 обычно представляют собой простые алкильные или арильные группы, из которых обе связаны непосредственно с атомом фосфора (фосфинаты), одна связана непосредственно, а вторая через атом кислорода или серы (фосфонаты), обе группы связаны через атомы кислорода или серы (фосфаты). Х может быть -F, -C≡N, алифатической или ароматической группой, связанной с фосфором посредством лабильной P-O или P-S связи (M. Eto, Organophosphorus Pesticides: Organic and Biological Chemistry, CRC Press, Cleveland, 1974).
Однако, поскольку большинство ФОИ также ингибируют ацетилхолинэстеразу, они обладают высокой острой токсичностью.
Для всех вышеперечисленных соединений информация о применении для ингибирования КЭ in vivo для исследования фармакокинетики и модуляции фармакологического эффекта лекарственных средств, содержащих сложноэфирные группы, отсутствует. Опубликованные данные относятся только к экспериментам на ферментных препаратах, плазме или культуре клеток (Hyatt JL, Tsurkan L, Wierdl M, Edwards CC, Danks MK, Potter PM. Intracellular inhibition of carboxylesterases by benzil: modulation of CPT-11 cytotoxicity. Mol Cancer Ther. 2006, 5(9):2281-2288).
Известно единственное на настоящий момент соединение, используемое в предклинических испытаниях для селективного необратимого ингибирования КЭ в экспериментах in vitro, - бис(пара-нитрофенил)фосфат (Heymann E, Krisch K. Phosphoric acid-bis-(p-nitro-phenylester), a new inhibitor of microsomal carboxylesterases. Hoppe-Seyler's Z Physiol Chem 1967, 348:609-619).
Он также был использован в ряде случаев для исследований на грызунах в опытах in vivo (White KN, Eggermont J, Hope DB. Effect of the carboxylesterase inhibitor bis-(4-nitrophenyl)phosphate in vivo on aspirin hydrolase and carboxylesterase activities at first-pass sites of metabolism in the guinea pig. Biochem Pharmacol 1987, 36(16):2687-2688).
Однако его острая токсичность (которая может быть связана с высвобождающимся при ингибировании пара-нитрофенолом) ограничивает его использование на современном уровне медицины. Величина острой токсичности соединений - LD50 бис(пара-нитрофенил)фосфата для мышей составляет 410 мг/кг (Brandt E, Hyemann E, Mentlein R. Selective inhibition of rat liver carboxylesterases by various organophosphorus diesters in vivo and in vitro. Biochem Pharmacol 1980, 29:1927-1931). При этом для полного ингибирования КЭ крысам обычно вводят 100 мг/кг BPNP однократно или 50 мг/кг многократно.
Задачей, на решение которой направлено предлагаемое изобретение, является расширение арсенала средств, которые могут быть использованы в качестве новых эффективных необратимых ингибиторов карбоксилэстеразы in vivo, т.е. на уровне целого организма, обладающих низкой острой токсичностью для теплокровных, и разработка конкретного способа использования этих соединений.
Поставленная задача решается применением фосфорилированных 1-гидроперфторизопропанолов формулы (1),
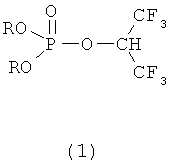
где R=Alkyl,
в качестве эффективного средства для необратимого ингибирования карбоксилэстеразы in vivo, обладающего низкой острой токсичностью для теплокровных.
В данном изобретении под термином Alkyl подразумевается любой радикал, включая все изомеры, из гомологического ряда CnH2n+1, например СН3-, С2Н5-, С3Н7-, i-С3Н7-, С4Н9-, i-С4Н9-, С5Н11-, i-C5H11-, С6Н13- и т.д.
Наиболее предпочтительными ингибиторами являются O,O-диэтил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат формулы 1а и O,O-дибутил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат формулы 1б:
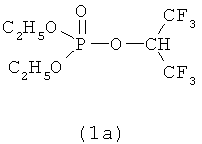
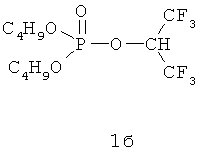
Соединения формулы (1) являются известными соединениями. Их получение описано в работах (Махаева Г.Ф., Серебрякова О.Г., Болтнева Н.П., Галенко Т.Г., Аксиненко А.Ю., Соколов В.Б., Мартынов И.В. Эстеразный профиль и анализ связи структура-ингибиторная селективность гомологичных фосфорилированных 1-гидроперфторизопропанолов. ДАН, 2008, 423 (6), 826-831; Makhaeva G.F., Aksinenko A.Y., Sokolov V.B., Serebryakova O.G., Richardson R.J. Synthesis of organophosphates with fluorine-containing leaving groups as serine esterase inhibitors with potential for Alzheimer disease therapeutics. Bioorg. Med. Chem. Lett. 2009, v.19, 5528-5530; Аксиненко А.Ю., Соколов В.Б., Горева Т.В., Махаева Г.Ф. Синтез О-фосфорилированных 1-замещенных 2,2,2-трифторэтанолов - ингибиторов сериновых гидролаз. Известия АН, сер. хим., 2010, №1, 103-106).
Там же указано, что соединения формулы 1 в опытах in vitro проявляют свойства необратимых ингибиторов эстераз, ингибируя, хоть и в разной степени, но одновременно, карбоксилэстеразу, бутирилхолинэстеразу (БХЭ) и ацетилхолинэстеразу (АХЭ), при этом, в соответствиии с теорией, можно было предположить, что за счет ингибирования последней они должны проявлять повышенную острую токсичность.
Авторами неожиданно было обнаружено, что при испытаниях in vivo фосфорилированные 1-гидроперфторизопропанолы формулы (1) эффективно ингибируют КЭ, менее эффективно ингибируют БХЭ и вообще не ингибируют АХЭ. При этом они проявляют очень низкую острую токсичность (например, для diBu-PFP ЛД50>2500 мг/кг, в/бр), что позволяет использовать их in vivo в качестве новых высокоэффективных необратимых ингибиторов карбоксилэстеразы, обладающих низкой острой токсичностью для теплокровных.
Еще одним аспектом изобретения является способ применения соединений формулы 1 для ингибирования in vivo карбоксилэстеразы плазмы грызунов введением его эффективного количества.
Ингибирование при наименьшей острой токсичности проводят с использованием соединения (О,О-дибутил)-О-1-трифторметил-2,2,2-трифторэтилфосфата (1б) в дозе не менее 3 мг/кг.
При этом для селективного ингибирования только карбоксилэстеразы (О,О-дибутил)-О-1-трифторметил-2,2,2-трифторэтилфосфат вводят в дозе от 3 до 10 мг/кг.
Для селективного ингибирования карбоксилэстеразы и бутирилхолинэстеразы (О,О-дибутил)-О-1-трифторметил-2,2,2-трифторэтилфосфат вводят в дозе выше 10 мг/кг.
Активность БХЭ в плазме мышей существенно ниже по сравнению с КЭ (соотношение активностей БХЭ/КЭ у мышей составляет 1/10; Sigolaeva L.V., Makhaeva G.F., Rudakova E.V., Boltneva N.P., Porus M., Dubacheva G.V., Eremenko A.V., Kurochkin I.N. and Richardson R.J. (2010) Biosensor analysis of blood esterases for organophosphates exposure assessment: Approaches to simultaneous determination of several esterases, Chem. Biol. Interact. 10.1016/j.cbi.2010.01.028), в связи с чем БХЭ плазмы мышей вносит значительно меньший вклад в гидролитический метаболизм лекарств по сравнению с КЭ и ее ингибирование, происходящее при возрастании дозы соединений формулы 1, лишь несущественно ухудшает предлагаемую модель. Изменений АХЭ крови при увеличении дозы (diBu-PFP) до 2500 мг/кг не обнаружено. Т.е. высокая эффективность ингибирования данным соединением КЭ (ED50) и низкая острая токсичность (LD50) обусловливают его высокий терапевтический индекс: для ингибирования КЭ плазмы он составляет более 800. (Терапевтический индекс - показатель широты терапевтического действия лекарственных веществ, представляющий собой отношение средней смертельной дозы, характеризуемой LD50, к средней эффективной дозе ED50 средства, которая в данном случае характеризует ингибиторную активность соединения in vivo).
Техническим результатом, который может быть получен при осуществлении изобретения, является обнаружение ингибиторов КЭ с высоким терапевтическим индексом. Благодаря этому свойству достигается значительное расширение области применения таких ингибиторов.
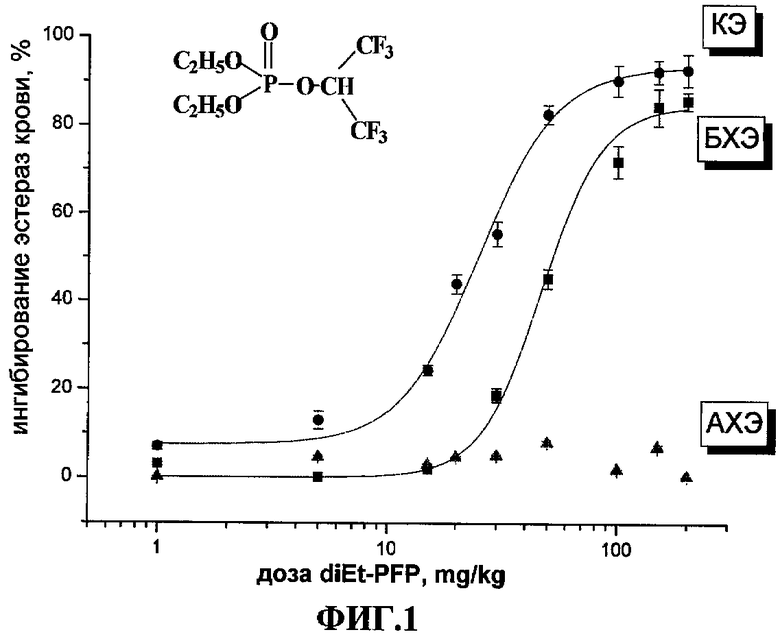
На ФИГ.1 представлена зависимость активности КЭ, БХЭ и АХЭ крови мышей (в виде % ингибирования активностей каждой из эстераз в сравнении с активностью эстераз у контрольных животных) от дозы diEt-PFP (мг/кг) через 1 час после внутрибрюшинного (в/бр) введения. Активности эстераз крови у контрольных животных составляли (µmol/min/ml крови, Mean ± SEM): АХЭ - 0.829±0.035 (N=18), БХЭ - 0.625±0.034 (N=20), КЭ - 6.02±0.27 (N=20).
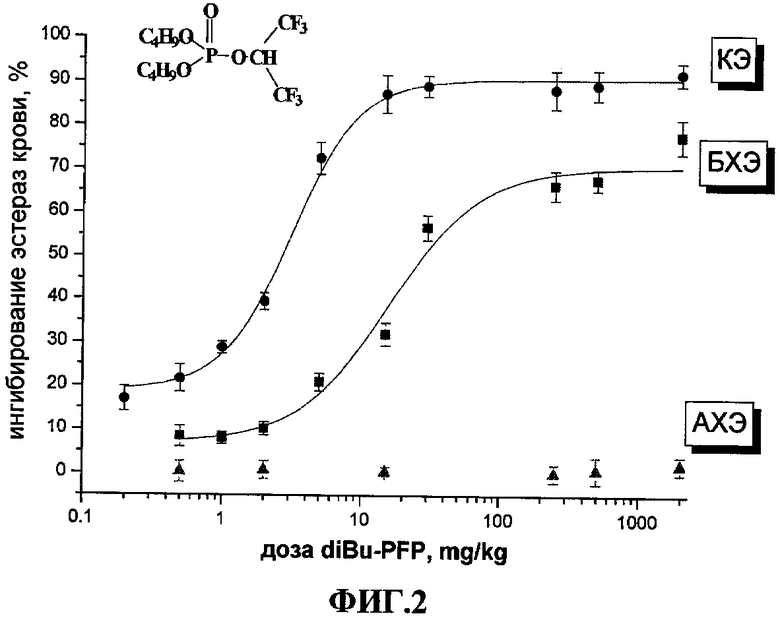
На ФИГ. 2 представлена зависимость активности КЭ, БХЭ и АХЭ крови мышей (в виде % ингибирования активностей каждой из эстераз в сравнении с активностью эстераз у контрольных животных) от дозы diBu-PFP (мг/кг) через 1 час после внутрибрюшинного (в/бр) введения. Активности эстераз крови у контрольных животных составляли (µmol/min/ml крови, Mean ± SEM): АХЭ - 0.829±0.035 (N=18), БХЭ - 0.625±0.034 (N=20), КЭ - 6.02±0.27 (N=20).
В таблице 1 приведены данные по изменению активности эстераз крови мышей через 1 час после внутрибрюшинного (в/бр) введения соединений (RO)2P(O)OCH(CF3)2, представленной в % от активности эстераз у контрольных животных, и острая токсичность соединений для мышей при в/бр введении.
В таблице 2 приведены данные по ингибиторной активности in vivo соединений формулы 1 (RО)2Р(O)ОСН(СF3)2 через 1 час после их в/бр введения в отношении КЭ, БХЭ крови мышей (ED50, мг/кг), острая токсичность соединений (LD50, мг/кг) и их терапевтический индекс как ингибиторов карбоксилэстеразы плазмы (LD50/ED50).
Приведенные примеры подтверждают, но не ограничивают предлагаемое изобретение.
Фосфорилированные 1-гидроперфторизопропанолы формулы (1) были получены в соответствии с методикой, описанной в (Махаева Г.Ф., Серебрякова О.Г., Болтнева Н.П., Галенко Т.Г., Аксиненко А.Ю., Соколов В.Б., Мартынов И.В. Эстеразный профиль и анализ связи структура-ингибиторная селективность гомологичных фосфорилированных 1-гидроперфторизопропанолов. ДАН, 2008, 423 (6), 826-831; Makhaeva G.F., Aksinenko A.Y., Sokolov V.B., Serebryakova O.G., Richardson R.J. Synthesis of organophosphates with fluorine-containing leaving groups as serine esterase inhibitors with potential for Alzheimer disease therapeutics. Bioorg. Med. Chem. Lett. 2009, v.19, 5528-5530; Аксиненко А.Ю., Соколов В.Б., Горева Т.В., Махаева Г.Ф. Синтез O-фосфорилированных 1-замещенных 2,2,2-трифторэтанолов - ингибиторов сериновых гидролаз. Известия АН, сер. хим., 2010, №1, 103-106).
O,O-Диэтил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат (1a). Раствор 3.0 г (21.7 ммоля) диэтилфосфита, 5.5 г (33.1 ммоля) гексафторацетона и 0.2 г Et3N в 10 мл ТГФ выдержали в запаянной ампуле при комнатной температуре 1 сутки. Ампулу вскрывали, ТГФ упаривали, остаток фракционировали, получили 6.0 г (91%) фосфата 1а. Т. кип. 63-65°С (5 Торр). Спектр ЯМР 1H(CDCl3, δ, м.д., J/Гц): 1.40 (т, 6Н, Me, JHH=7.2); 4.22 (м, 4Н, СН2O); 5.20 (д.септ., 1Н, ОН, JHP=JHF=6.0). Спектр ЯМР 19F (CDCl3, δF, м.д., J/Гц): 3.70 (д, JFH=6.0). Спектр ЯМР 31P(CDCl3, δр, м.д.): -1.23 с.
O,O-Дибутил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат (1б) получен аналогично 1а. Выход 69%. Т. кип. 90-91°С (5 Торр). Спектр ЯМР 1H(CDCl3, δ, м.д., J/Гц): 0.99 т (6Н, JHH=7.0); 1.45 секстет (4Н, JHH=7.0); 1.70 м (4Н); 4.09 м (4Н); 5.74 д септетов (1Н, JHP=JHF=6.0). Спектр ЯМР 19F (СDСl3, δF, м.д., J/Гц): 3.72 д JFH=6.0. Спектр ЯМР 31P(CDCl3, δр, м.д.): -0.82 с.
Методы исследования.
Эксперименты проводили на аутбредных белых мышах весом 18-25 г. Исследуемые соединения, diEt-PFP и diBu-PFP, растворяли в диметилсульфоксиде (DMSO) и вводили однократно внутрибрюшинно (в/бр) в возрастающих дозах в объеме около 0.1 мл. Для каждой дозы использовали минимум 6 животных. Контрольные животные получали только DMSO. Предварительные эксперименты показали, что при в/бр введении максимальное ингибирование эстераз крови достигается через 0.5-1 час после введения. Основываясь на этих данных, мышей забивали через 1 час после введения исследуемого соединения (декапитация под действием CO2-анестезии), кровь собирали в маленькие стеклянные стаканы, которые предварительно ополаскивали 3.8% цитратом натрия. В качестве антикоагулянта добавляли гепарин (20 µl раствора 500 E/ml). Затем кровь переносили в пластиковые пробирки (Эппендорфы), замораживали в жидком азоте и хранили при -70oC до проведения измерений.
Получение гемолизата. Замороженную кровь оттаивали на водяной бане со льдом. Затем получали гемолизат (1:100) путем быстрого разбавления 1 объема крови в 100 объемах охлажденного на водяной бане со льдом фосфатного буфера. После тщательного перемешивания аликвотированные гемолизаты немедленно замораживали в жидком азоте для ускорения гемолиза и обеспечения его полноты и хранили при -20°C до проведения анализов. Перед началом анализа образцы оттаивали и держали на льду. (Количество крови для анализа каждой из эстераз выбирали по линейному участку зависимости активности данной эстеразы от концентрации крови (определяли в отдельном эксперименте)).
Определение активности эстераз. Активность АХЭ в цельной крови определяли по скорости гидролиза ацетилтиохолина (1mM) колориметрическим методом Эллмана в K-Na-фосфатном буфере pH 7.5 при 25oC в присутствии селективного ингибитора БХЭ этопропазина (0,02 mM) (Worek F., Mast U., Kiderlen D., Diepold C., Eyer P. Improved determination of acetylcholinesterase activity in human whole blood. Clin. Chim. Acta 1999, 288: 73-90).
Активность БХЭ в цельной крови определяли в тех же условиях с использованием в качестве субстрата бутирилтиохолина (1 mM). Для снижения влияния абсорбции гемоглобина при 412 нм, длина волны при измерениях была изменена на 436 нм (ε436=10600 M-1cm-1).
Спектрофотометрическое измерение активности КЭ в цельной крови проводили с 1 mM 1-нафтилацетатом в качестве стандартного субстрата в буфере pH 8.0 при 25oC. Измерения проводились при длине волны 322 нм (ε322 = 2200 M-1cm-1 (Huang T.L, Shiotsuki T., Uematsu T., Borhan B., Li Q.X., Hammock B.D. Structure-activity relationships for substrates and inhibitors of mammalian liver microsomal carboxylesterases. Pharm Res. 1996, 10:1495-1500)). Для элиминирования PON1 и холинэстеразного гидролиза использовали дифференциальный ингибиторный анализ со специфическими ингибиторами PON1/арилэстераз (2 mM EDTA) и холинэстераз (40 µM эзерина) (Chanda S.M., Mortensen S.R., Moser V.C., Padilla S. Tissue-specific effects of chlorpyrifos on carboxylesterase and cholinesterase activity in adult rats: an in vitro and in vivo comparison. Fundam. Appl. Toxicol. 1997, 38(2):148-157). Спектрофотометрические измерения проводили на спектрофотометре Gilford-250 (Англия).
Определяли активности АХЭ, БХЭ и КЭ в крови при введении возрастающих доз исследуемых соединений. Результаты представляли в виде зависимости % ингибирования активности каждой из эстераз у контрольных животных от дозы введенного вещества.
Определение острой токсичности соединений. Эксперименты проводили на аутбредных белых мышах весом 18-25 г. Исследуемые соединения, diEt-PFP и diBu-PFP, растворяли в DMSO и вводили однократно внутрибрюшинно (в/бр) в возрастающих дозах в объеме около 0.1 мл. Для каждой дозы использовали минимум 6 животных. Контрольные животные получали только DMSO. Срок наблюдения - 24 часа. Величину LD50 вычисляли методом пробит-анализа (метод Финнея) с использованием программы BioStat 2006 Professional.
Пример 1.
Оценка способности фосфорилированных 1-гидроперфторизопропанолов ингибировать in vivo карбоксилэстеразы в крови мышей и острая токсичность соединений.
Исследуемые соединения - О,О-диметил-О-(1-трифторметил-2,2,2-трифторэтил)фосфат (diMe-PFP); diEt-PFP; О,О-дипропил-О-(1-трифторметил-2,2,2-трифторэтил)фосфат (diPr-PFP) и diBu-PFP (раствор в DMSO) вводили однократно в/бр аутбредным белым мышам (N=6) в дозе 20 мг/кг. Контрольные животные получали только DMSO. Мышей забивали через 1 час после введения исследуемого соединения, собирали кровь и определяли в ней активность АХЭ, БХЭ и КЭ. Результаты представляли в % от активности эстераз у контрольных животных.
Активности эстераз крови у контрольных животных составляли (µmol/min/ml крови, Mean ± SEM): АХЭ - 0.829±0.035 (N=18), БХЭ - 0.625±0.034 (N=20), КЭ - 6.02±0.27 (N=20).
Острую токсичность соединений определяли при в/бр введении. Срок наблюдения - 24 часа.
Острая токсичность соединения diEt-PFP составляла 200 мг/кг, тогда как введение соединения diBu-PFP даже в дозе 2500 мг/кг не приводило к гибели животных.
Как видно из таблицы 1, при испытаниях in vivo фосфорилированные 1-гидроперфторизопропанолы формулы (1) эффективно ингибируют КЭ, менее эффективно ингибируют БХЭ и не ингибируют АХЭ. При этом они проявляют очень низкую острую токсичность (например, для diBu-PFP LD50> 2500 мг/кг, в/бр), что позволяет использовать их in vivo в качестве новых высокоэффективных необратимых ингибиторов карбоксилэстеразы, обладающих низкой острой токсичностью для теплокровных.
Пример 2.
Определение изменения активности КЭ в крови грызунов при введении возрастающих доз О,О-диэтил-О-(1-трифторметил-2,2,2-трифторэтил)фосфата формулы 1а (diEt-PFP).
В качестве представителей грызунов были взяты аутбредные белые мыши (N=6). Возрастающие дозы diEt-PFP (раствор в DMSO) вводили однократно в/бр. Контрольные животные получали только DMSO. Мышей забивали через 1 час после введения исследуемого соединения, собирали кровь и определяли в ней активность АХЭ, БХЭ и КЭ. Результаты представляли в виде зависимости % ингибирования активности каждой из эстераз у контрольных животных от дозы diEt-PFP (Фиг.1). Из полученных зависимостей вычисляли величину ED50, мг/кг, характеризующую ингибиторную активность соединения в отношении каждой эстеразы in vivo. Поскольку КЭ и БХЭ локализованы в плазме, приведенная зависимость изменения активностей эстераз в крови соответствует изменению активности КЭ и БХЭ плазмы с увеличением дозы.
Как видно из приведенной на Фиг.1 зависимости, через 1 час после в/бр введения мышам diEt-PFP наблюдается дозозависимое торможение активности КЭ и БХЭ крови. При этом ингибиторного эффекта в отношении АХЭ не обнаружено.
Т.о. при испытаниях in vivo diEt-PFP эффективно ингибировал КЭ уже в малых дозах, в более высоких дозах ингибировал также БХЭ и вообще не ингибировал АХЭ - даже в дозах, приближающихся к ЛД50.
Пример 3.
Определение изменения активности КЭ в крови мышей при введении возрастающих доз (О,О-дибутил)-О-1-трифторметил-2,2,2-трифторэтилфосфата формулы 1б ( diBu-PFP).
В качестве представителей грызунов были взяты аутбредные белые мыши (N=6). Возрастающие дозы diBu-PFP (раствор в DMSO) вводили однократно в/бр. Контрольные животные получали только DMSO. Мышей забивали через 1 час после введения исследуемого соединения, собирали кровь и определяли в ней активность АХЭ, БХЭ и КЭ. Результаты представляли в виде зависимости % ингибирования активности каждой из эстераз у контрольных животных от дозы diBu-PFP (Фиг.2). Из полученной зависимости вычисляли величину ED50, мг/кг, характеризующую ингибиторную активность соединения в отношении исследуемой эстеразы in vivo.
Как видно из приведенной на Фиг.2 зависимости, через 1 час после в/бр введения мышам diBu-PFP наблюдается дозозависимое торможение активности КЭ и БХЭ крови. Ингибиторного эффекта в отношении АХЭ не обнаружено.
При этом 50% ингибирование in vivo КЭ плазмы мышей соединением 1б (diBu-PFP) происходит уже при дозе менее 0.0012 ЛД50. В интервале доз от 0.0012 до 0.004 LD50 (3-10 мг/кг) происходит селективное ингибирование в плазме крови только КЭ (на 50-90%), а при дозах выше 10 мг/кг (0.004 LD50) начинается также ингибирование БХЭ плазмы. Изменений АХЭ крови при увеличении дозы diBu-PFP до 2500 мг/кг не обнаружено.
Из анализа зависимостей, приведенных на Фиг.1 и Фиг.2, были рассчитаны величины ингибиторной активности in vivo (средней эффективной дозы) ED50 заявляемых соединений как ингибиторов КЭ и БХЭ плазмы грызунов, и на их основе рассчитаны терапевтические индексы этих соединений (см. таблицу 2).
Как видно из таблицы, предлагаемые соединения имеют низкую острую токсичность (особенно diBu-PFP), высокую эффективность ингибирования КЭ и проявляют выраженную селективность в отношении КЭ и БХЭ по сравнению с АХЭ. Сравнение величин ED50 (50% ингибирование КЭ и БХЭ в крови мышей) и LD 50 (острая токсичность соединения) показывает, что эффект ингибирования проявляется в дозах, значительно меньших LD50 (особенно для diBu-PFP), т.е. заявляемые соединения обладают высоким терапевтическим индексом.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,2,2-ТРИФТОР-1-ТРИФТОРМЕТИЛЭТИЛОВЫЙ ЭФИР ЦИКЛОГЕКСИЛКАРБАМИНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ ЭФФЕКТИВНОГО СРЕДСТВА ДЛЯ СЕЛЕКТИВНОГО НЕОБРАТИМОГО ИНГИБИРОВАНИЯ КАРБОКСИЛЭСТЕРАЗЫ | 2011 |
|
RU2449988C1 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ АЛКИЛ-2-АРИЛГИДРАЗИНИЛИДЕН-3-ОКСО-3-ПОЛИФТОРАЛКИЛПРОПИОНАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2014 |
|
RU2574291C1 |
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ NMDA-РЕЦЕПТОРОВ | 2016 |
|
RU2621348C1 |
| Мультифункциональные конъюгаты такрина и его аналогов с производными 1,2,4-тиадиазола, способ их синтеза и применение для лечения нейродегенеративных заболеваний | 2017 |
|
RU2675794C1 |
| 1-(1,1,1,3,3,3-ГЕКСАФТОР-2-ФЕРРОЦЕНИЛПРОП-2-ИЛ)-ИМИДАЗОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2013 |
|
RU2533823C1 |
| УСТРОЙСТВО ДЛЯ ВЗЯТИЯ КРОВИ, СОДЕРЖАЩЕЕ ИНГИБИТОР ЛИЗОФОСФОЛИПАЗЫ | 2012 |
|
RU2623049C2 |
| Мультифункциональные конъюгаты ипидакрина с 2-замещенными фенолами, способ их получения и применение для лечения нейродегенеративных заболеваний | 2023 |
|
RU2836319C1 |
| ГИДРОХЛОРИДЫ ЗАМЕЩЕННЫХ 2-[(ДИМЕТИЛАМИНО)МЕТИЛ]АРИЛДИМЕТИЛКАРБАМАТОВ, ОБЛАДАЮЩИЕ АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2754133C1 |
| ГЕПАТОПРОТЕКТОР | 1996 |
|
RU2156130C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНЫМ, КАРДИОПРОТЕКТОРНЫМ, ПРОТИВОДИАБЕТИЧЕСКИМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ, ГЕПАТОПРОТЕКТОРНЫМ, ПРОТИВООПУХОЛЕВЫМ И ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2432959C1 |
Изобретение относится к области медицины. Фосфорилированные 1-гидроперфторизопропанолы формулы 1 применяют в качестве эффективного средства для необратимого ингибирования in vivo карбоксилэстеразы. Указанные соединения представляют собой (O,O-диэтил)-O-1-трифторметил-2,2,2-трифторэтилфосфат или (O,O-дибутил)-O-1-трифторметил-2,2,2-трифторэтилфосфат. Для ингибирования in vivo карбоксилэстеразы в плазме грызунов животным вводят эффективное количество данных соединений. Соединения имеют низкую острую токсичность и обладают высоким терапевтическим индексом. 2 н. и 5 з.п. ф-лы, 2 ил., 2 табл.
1. Применение фосфорилированных 1-гидроперфторизопропанолов формулы 1 в качестве эффективного средства для необратимого ингибирования in vivo карбоксилэстеразы
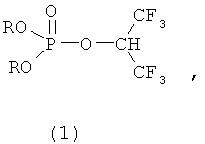
где R=Alkyl.
2. Применение по п.1, где указанное соединение представляет собой (O,O-диэтил)-O-1-трифторметил-2,2,2-трифторэтилфосфат.
3. Применение по п.1, где указанное соединение представляет собой (O,O-дибутил)-O-1-трифторметил-2,2,2-трифторэтилфосфат.
4. Способ ингибирования in vivo карбоксилэстеразы в плазме грызунов, заключающийся во введении животным эффективного количества фосфорилированных 1-гидроперфторизопропанолов общей формулы 1
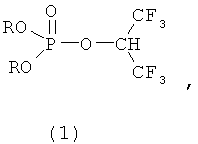
где R=Alkyl.
5. Способ по п.4, отличающийся тем, что для ингибирования при наименьшей острой токсичности животным вводят (O,O-дибутил)-O-1-трифторметил-2,2,2-трифторэтилфосфат в дозе не менее 3 мг/кг.
6. Способ по п.5, отличающийся тем, что для ингибирования карбоксилэстеразы (O,O-дибутил)-O-1-трифторметил-2,2,2-трифторэтилфосфат вводят в дозе от 3 до 10 мг/кг.
| DRANDT Е | |||
| et al | |||
| Selective inhibition of rat liver carboxylesterases by various organophosphorus diesters in vivo and in vitro, Biohem | |||
| Pharmacol., 1980, 29, 1927-1931 | |||
| WADKINS R.M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 20050054691 A1, 10.03.2005. | |||
Авторы
Даты
2011-07-10—Публикация
2010-04-15—Подача