Изобретение относится к применению химических соединений в области медицины и может быть использовано в предклинических исследованиях на грызунах лекарственных препаратов, содержащих сложноэфирные и/или амидные группы, для снижения скорости их карбоксилэстеразного гидролиза, модулируя таким образом их фармакологические и/или токсические эффекты. Кроме того, изобретение может быть использовано в фармацевтических смесях и рецептурах пестицидов для повышения их эффективности за счет ингибирования карбоксилэстеразы и снижения таким образом количества пестицида, необходимого для ингибирования мишени - ацетилхолинэстеразы в случае фосфорорганических и карбаматных пестицидов.
Карбоксилэстеразы (КЭ) являются детерминантой в фармакокинетике большинства терапевтических средств, содержащих сложноэфирную или амидную группировку, причем конструирование многих новых лекарств идет с учетом их метаболической активации или инактивации за счет карбоксилэстеразного гидролиза [Prokai L, Prokai-Tatrai K. Metabolism-based drug design and drug targeting. Pharm Sci Technolo Today. 1999; 2(11):457-462]. В связи с этим ингибиторы КЭ, влияющие на скорость гидролиза таких лекарственных препаратов и таким образом определяющие, например, скорость превращения пролекарства в действующее лекарство или увеличивающие полупериод жизни активного препарата, гидролизующегося КЭ, имеют важное терапевтическое значение [Potter PM, Wadkins RM. Carboxylesterases-detoxifying enzymes and targets for drug therapy. Curr Med Chem. 2006, 13(9):1045-1054].
Кроме того, принимая во внимание, что предклинические исследования лекарственных препаратов проводятся прежде всего на грызунах, которые в отличие от человека имеют высокий уровень КЭ плазмы, возникает проблема экстраполяции результатов с животных на человека. Применение эффективных необратимых ингибиторов карбоксилэстеразы, обладающих низкой острой токсичностью для теплокровных, позволяет ингибировать КЭ плазмы и создать таким образом адекватную, эффективную модель на грызунах для исследования фармакологически важных препаратов, гидролизующихся под действием КЭ.
Ингибирование карбоксилэстераз насекомых потенцирует действие инсектицидов, гидролизующихся под действием КЭ, таких как пиретроиды, а также антихолинэстеразных инсектицидов за счет снижения их связывания с КЭ [Шипов А.Э., Генкина Г.К., Махаева Г.Ф., Малыгин В.В., Волкова Р.И., Рославцева С.А., Еремина О.Ю., Баканова Е.И., Мастрюкова Т.А., Кабачник М.И. Исследование механизма действия пестицидов ряда 2-арилокси-2-тио-1,3,2-оксазафосфоринана. Биоорган. химия. 1999, 25 (1):14-19]. Использование ингибиторов карбоксилэстераз является одним из путей преодоления резистентности насекомых к действию инсектицидов [Yan S, Cui F, Qiao C. Structure, function and applications of carboxylesterases from insects for insecticide resistance. Protein Pept Lett. 2009; 16(10):1181-1188]. Кроме того, ингибирование КЭ само может приводить к гибели насекомых.
Решением проблемы создания селективных и малотоксичных ингибиторов карбоксилэстераз в мире занимаются уже достаточное количество лет, однако в связи с большим структурным сходством сериновых эстераз имеется лишь ограниченное число сообщений о селективных ингибиторах КЭ. Это серия аналогов трифторметилкетонов (весьма гигроскопичные соединения, которые легко гидролизуются, см. Wheelock CE, Severson TF, Hammock BD. Synthesis of new carboxylesterase inhibitors and evaluation of potency and water solubility. Chem Res Toxicol. 2001, 14(12):1563-1572), недавно предложенные аналоги бензила (дифенилэтан-1,2-диона) [Wadkins RM, Hyatt JL, Wei X, Yoon KJ, Wierdl M, Edwards CC, Morton CL, Obenauer JC, Damodaran K, Beroza P, Danks MK, Potter PM. Identification and characterization of novel benzil (diphenylethane-1,2-dione) analogues as inhibitors of mammalian carboxylesterases. J.Med.Chem. 2005, 48(8): 2906-2915] и замещенные арилсульфонамиды и арилмочевины [Potter PM, Hyatt JL, Morton CL, Beroza PP, Damoradan KV. Amide, aryl sulfonamide, aryl urea, and a,b-diketone derived carboxylesterase inhibitors, and their methods of use. US Appl. 2008146548, МПК А61К 31/44].
Однако перечисленные соединения являются обратимыми ингибиторами КЭ.
Известны необратимые ингибиторы КЭ, эффект которых нарастает во времени и является более продолжительным. Представителем таких ингибиторов являются фосфорорганичесие соединения (ФОИ) - эфиры и тиоэфиры кислот пятивалентного фосфора, общей формулы R1R2P(O)X, где одна из групп - Х является обычно хорошей уходящей группой (M. Eto, Organophosphorus Pesticides: Organic and Biological Chemistry, CRC Press, Cleveland, 1974).
Наиболее близкими аналогами к предлагаемому техническому решению являются соединения общей формулы (II)
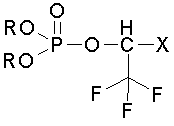
(II)
где R = Alkyl, X = CF3, Aryl, C(O)OCH3
Ингибиторная активность этих соединений по отношению к сериновым гидролазам ацетилхолинэстеразе (АХЭ), бутирилхолинэстеразе и карбоксилэстеразе (КЭ) и их синтез подробно изучены [Махаева Г.Ф., Фетисов В.И., В.Б.Соколов, Янковская В.Л., Горева Т.В., Малыгин В.В., Безноско Б.К., Галенко Т.Г., Коломиец А.Ф., Мартынов И.В. - Взаимодействие диалкил(α-карбометокси-β,β,β-трифторэтил)фосфатов с эстеразами млекопитающих. - Биоорганическая химия, 1987, том 13, вып. 1, с. 33-37; Махаева Г.Ф., Серебрякова О.Г., Болтнева Н.П., Галенко Т.Г., Аксиненко А.Ю., Соколов В.Б., Мартынов И.В. Эстеразный профиль и анализ связи структура-ингибиторная селективность гомологичных фосфорилированных 1-гидроперфторизопропанолов. ДАН, 2008, том 423, вып.6, с. 826-831; Makhaeva G.F., Aksinenko A.Y., Sokolov V.B., Serebryakova O.G., Richardson R.J. Synthesis of organophosphates with fluorine-containing leaving groups as serine esterase inhibitors with potential for Alzheimer disease therapeutics. Bioorg. Med. Chem. Let. 2009, V.19, P.5528-5530; Аксиненко А.Ю., Соколов В.Б., Горева Т.В., Махаева Г.Ф. Синтез О-фосфорилированных 1-замещенных 2,2,2-трифторэтанолов - ингибиторов сериновых гидролаз. Известия АН, сер. хим., 2010, №1, c.103-106].
Однако практическое применение фосфорорганических ингибиторов карбоксилэстераз вызывает известную настороженность в связи с их возможным отставленным нейротоксическим эффектом.
Целью изобретения является расширение арсенала средств, которые могут быть использованы в качестве новых эффективных и селективных необратимых ингибиторов карбоксилэстеразы, обладающих низкой острой токсичностью для теплокровных.
Поставленная задача решается синтезом и применением обладающего низкой острой токсичностью для теплокровных нового соединения - 2,2,2-трифтор-1-трифторметилэтилового эфира циклогексилкарбаминовой кислоты формулы (I) в качестве эффективного средства для селективного необратимого ингибирования карбоксилэстеразы.
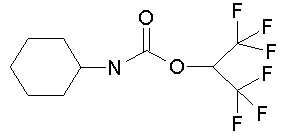
(I)
Соединение формулы (I) - 2,2,2-трифтор-1-трифторметилэтиловй эфир циклогексилкарбаминовой кислоты синтезируют исходя из циклогексилизоцианата и 1-гидрогексафторизопропанола. Взаимодействие реагентов осуществляют при 20оС в бензоле в присутствии каталитических количеств триэтиламина, в результате чего образуется целевое соединение (I) (схема 1).
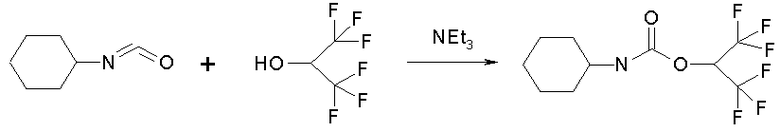
Схема 1
Синтез соединения формулы (I)
2,2,2-Трифтор-1-трифторметилэтиловй эфир циклогексилкарбаминовой кислоты (I)
К раствору 25.0 ммоль циклогексилизоцианата в 10 мл бензола прибавляют 25.5 ммоль 1-гидрогексафторизопропанола и 0.05 г триэтиламина. Реакционную массу перемешивают 2 ч при 20°С. Бензол упаривают и остаток перекристаллизовывают из гексана. Выход 91%. Т. пл. 94-96°C. 1H ЯМР спектр (200 MHz, CDCl3, δ, м.д.): 1.03-1.45 м (5 Н, с-С6Н11); 1.54-1.83 м (3 Н, с-С6Н11); 1.90-2.05 м (2 Н, с-С6Н11); 3.53 м (1 Н, с-С6Н11); 4.99 д (1 Н, NH, J HH = 5.1 Гц); 5.68 (м, 1 H, CHO). 19F ЯМР спектр (188 MHz, CDCl3, δ, м.д.): 4.03 (д, J FH = 5.2 Hz).
Методика биологических испытаний
Для кинетических исследований использовали коммерческие препараты («Sigma», США) ацетилхолинэстеразы эритроцитов человека (АХЭ, КФ 3.1.1.7), бутирилхолинэстеразы сыворотки лошади (БХЭ, КФ 3.1.1.8) и карбоксилэстеразы печени свиньи (КЭ, КФ 3.1.1.1).
Определение активности ферментов
Активность АХЭ и БХЭ определяли методом Эллмана (λ 412 нм) с использованием в качестве субстрата ацетилтиохолина (1mM) и бутирилтиохолина (1mM) соответственно; условия определения: 0.1 М фосфатный буфер рН 7.5, 25оС. Активность КЭ определяли спектрофотометрически по выделению 4-нитрофенола (λ 405 нм), субстрат - 4-нитрофенилацетат (1mM); условия определения: 0.1 М фосфатный буфер рН 8.0, 25оС. Измерения проводили на микропланшетном спектрофотометре BioRad Benchmark Plus.
Определение величин IC 50 для ингибирования АХЭ, БХЭ и КЭ
Первичную оценку ингибиторной активности соединения проводили путем определения величин IC50 - концентрации ингибитора, которая требуется для снижения активности фермента на 50%. Для определения IC50 ингибирования АХЭ, БХЭ и КЭ соединением (I) образец соответствующего фермента инкубировали с исследуемым соединением (концентрация ДМСО 2 об.%) в течение 8 минут в условиях [I]0>>[E]0 (I - ингибитор, E - фермент), затем определяли остаточную активность фермента. Диапазон концентраций исследуемого соединения составлял 1·10-12 - 4·10-4 М. Каждый эксперимент проводили в трипликате. Измерения проводили на микропланшетном спектрофотометре BioRad Benchmark Plus. Вычисление IC50 проводили с использованием программы Origin 6.1.
Определение бимолекулярной константы ингибирования КЭ
Для исследования кинетики ингибирования КЭ образец фермента инкубировали с исследуемым соединением (концентрация ДМСО 2 об.%) при условии [I]0>>[E]0, затем определяли остаточную активность фермента. При проведении исследования использовали 3-4 концентрации ингибитора и для каждой концентрации 4-5 различных интервалов времени инкубации. Измерения проводили на микропланшетном спектрофотометре BioRad Benchmark Plus. Тангенсы углов наклона (k') каждой первичной зависимости log (% ингибирования) от времени определяли методом линейной регрессии. Затем строили зависимость полученных величин k' от концентрации ингибитора [I] и методом линейной регрессии определяли тангенс угла наклона (k") вторичной зависимости. Бимолекулярную константу ингибирования (k i) как меру ингибиторной активности соединения вычисляли из уравнения k i = 2.303k' / [I] = 2.303k". Анализ данных и все вычисления проводили с использованием программы Origin 6.1.
Определение острой токсичности соединения
Эксперименты проводили на аутбредных белых мышах весом 25-30 г. Исследуемое соединение растворяли в DMSO и вводили однократно внутрибрюшинно (в/бр) в возрастающих дозах в объеме около 0.1 мл. Для каждой дозы использовали минимум 6 животных. Контрольные животные получали только DMSO. Срок наблюдения - 24 часа. Величину LD50 вычисляли методом пробит-анализа (метод Финнея) с использованием программы BioStat 2006 Professional.
Результаты биологических испытаний соединения (I), иллюстрирующие настоящее изобретение
Определена ингибиторная активность соединения (I) в отношении трех коммерческих препаратов сериновых эстераз: ацетилхолинэстеразы эритроцитов человека (КФ 3.1.1.7, АХЭ), бутирилхолинэстеразы сыворотки лошади (КФ 3.1.1.8, БХЭ) и карбоксилэстеразы печени свиньи (КФ 3.1.1.1, КЭ). Первичную оценку ингибиторной активности проводили путем определения величин IC50 - концентрации ингибитора, которая требуется для снижения активности фермента на 50%. Исследование показало, что предлагаемое соединение (I) не ингибирует АХЭ, слабо ингибирует БХЭ: IC50 = (1.70 ± 0.07)·10-4 М и проявляет высокую ингибиторную активность в отношении КЭ: IC50 = (5.23±0.96)·10-7 М.
Ингибиторная селективность соединения (I) в отношении КЭ по сравнению с БХЭ охарактеризована отношением величин IC50 и равна 325.
Исследование кинетики ингибирования КЭ карбаматом (I) показало необратимый характер процесса с зависимой от времени инкубации степенью ингибирования фермента и линейной зависимостью константы скорости псевдопервого порядка от концентрации ингибитора. Бимолекулярная константа ингибирования КЭ k i=(1.42±0.20)·105 M-1мин-1, т.е. соединение (I) является эффективным необратимым ингибитором КЭ.
Определение острой токсичности в опытах на аутбредных белых мышах при в/бр введении показало, что предлагаемое соединение (I) имеет низкую острую токсичность для теплокровных: ЛД50 > 2000 мг/кг.
Таким образом, соединение (I) является эффективным и селективным необратимым ингибитором карбоксилэстеразы с низкой острой токсичностью для теплокровных и может быть использовано в предклинических исследованиях на грызунах для снижения скорости карбоксилэстеразного гидролиза лекарственных препаратов, содержащих сложноэфирные и/или амидные группы, а также в качестве ингибиторов карбоксилэстераз насекомых в фармацевтических смесях и рецептурах пестицидов для повышения их эффективности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ НЕОБРАТИМОГО ИНГИБИРОВАНИЯ IN VIVO КАРБОКСИЛЭСТЕРАЗЫ НА ОСНОВЕ ФОСФОРИЛИРОВАННЫХ 1-ГИДРОПЕРФТОРИЗОПРОПАНОЛОВ, ОБЛАДАЮЩЕЕ НИЗКОЙ ОСТРОЙ ТОКСИЧНОСТЬЮ ДЛЯ ТЕПЛОКРОВНЫХ, И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КАРБОКСИЛЭСТЕРАЗЫ В ПЛАЗМЕ ГРЫЗУНОВ | 2010 |
|
RU2423132C1 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ АЛКИЛ-2-АРИЛГИДРАЗИНИЛИДЕН-3-ОКСО-3-ПОЛИФТОРАЛКИЛПРОПИОНАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2014 |
|
RU2574291C1 |
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ NMDA-РЕЦЕПТОРОВ | 2016 |
|
RU2621348C1 |
| Мультифункциональные конъюгаты такрина и его аналогов с производными 1,2,4-тиадиазола, способ их синтеза и применение для лечения нейродегенеративных заболеваний | 2017 |
|
RU2675794C1 |
| Мультифункциональные конъюгаты ипидакрина с 2-замещенными фенолами, способ их получения и применение для лечения нейродегенеративных заболеваний | 2023 |
|
RU2836319C1 |
| Оптический биосенсор необратимых ингибиторов холинэстеразы в воздухе | 2016 |
|
RU2654294C2 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| N-(2-ДИИЗОПРОПИЛОКСИФОСФОРИЛТИОЭТИЛ)-N-(ЗАМЕЩЕННЫЕ БЕНЗИЛ)-N,N-ДИАЛКИЛАММОНИЙ, ПИПЕРИДИНИЙ ИЛИ МОРФОЛИНИЙ ГАЛОГЕНИДЫ | 1996 |
|
RU2102398C1 |
| N,N-ДИАЛКИЛАМИДОФТОР-О-(ТРАНС-2-ЗАМЕЩЕННЫЕ ЦИКЛОАЛКИЛ)ФОСФАТЫ | 1993 |
|
RU2041878C1 |
| ИНГИБИРУЮЩЕЕ ДИПЕПТИДИЛПЕПТИДАЗУ IV СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2485952C2 |
Заявленное изобретение относится к химико-фармацевтической промышленности и касается 2,2,2-трифтор-1-трифторметилэтилового эфира циклогексилкарбаминовой кислоты (I), который получают исходя из циклогексилизоцианата и 1-гидрогексафторизопропанола при 20°С в бензоле в присутствии каталитических количеств триэтиламина. Соединение (I) является эффективным и селективным необратимым ингибитором карбоксилэстеразы с низкой острой токсичностью для теплокровных и может быть использовано в предклинических исследованиях на грызунах для снижения скорости карбоксилэстеразного гидролиза лекарственных препаратов, содержащих сложноэфирные и/или амидные группы, а также в качестве ингибиторов карбоксилэстераз насекомых в фармацевтических смесях и рецептурах пестицидов для повышения их эффективности. 2 н.п. ф-лы.
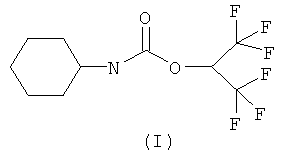
1. 2,2,2-Трифтор-1-трифторметилэтиловый эфир циклогексилкарбаминовой кислоты (I)

обладающий необратимой селективной ингибирующей активностью в отношении карбоксилэстеразы.
2. Применение соединения (I) по п.1 в качестве средства для селективного необратимого ингибирования карбоксилэстеразы.
| СРЕДСТВО ДЛЯ НЕОБРАТИМОГО ИНГИБИРОВАНИЯ IN VIVO КАРБОКСИЛЭСТЕРАЗЫ НА ОСНОВЕ ФОСФОРИЛИРОВАННЫХ 1-ГИДРОПЕРФТОРИЗОПРОПАНОЛОВ, ОБЛАДАЮЩЕЕ НИЗКОЙ ОСТРОЙ ТОКСИЧНОСТЬЮ ДЛЯ ТЕПЛОКРОВНЫХ, И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ КАРБОКСИЛЭСТЕРАЗЫ В ПЛАЗМЕ ГРЫЗУНОВ | 2010 |
|
RU2423132C1 |
| ЕР 1877383 В1, 16.01.2008 | |||
| Пастеризатор для молока | 1928 |
|
SU14960A1 |
| EP 1311475 B1, 06.08.2008. | |||
Авторы
Даты
2012-05-10—Публикация
2011-04-29—Подача