Изобретение относится к области биотехнологии, а именно к технологии получения биологически активных веществ (БАВ) методами генной инженерии, точнее к методам получения тканевого фактора человека.
Тканевой фактор (ТФ) человека (синонимы: фактор свертываемости крови III, тромбопластин, CD 142, неактивная тканевая протромбиназа, апопротеин С-термостабильный липопротеид) преимущественно локализован в клетках субэндотелиальных тканей и фибробластах, на мембране моноцитов, в легких, тканях мозга, сердца, кишечника, матки. Основная биологическая функция ТФ состоит в обеспечении локального гемостаза, реализующемся посредством его способности непосредственно инициировать каскад свертывания крови. При повреждении выстилки стенки сосуда ТФ вступает в контакт с кровью, что в конечном итоге способствует генерации тромбина и запуску механизма свертывания крови.
ТФ, находящийся на поверхности «кислых» липидных мембран, обладает высоким сродством к циркулирующему в крови фактору свертываемости крови фVII. В присутствии ионов Са++ апопротеин ТФ образует стехиометрический комплекс с фVII, вызывая его конформационные изменения и превращая последний в сериновую протеиназу фVIIа путем расщепления Arg-152-Ile пептидной связи. Реакция стимулируется следовыми количествами протеиназ, циркулирующих в крови (фХа, тромбин, фVIIа, фIХа). Возникающий активный комплекс (фVIIа-ТФ) путем сайт-специфического протеолиза конвертирует фХ в сериновую протеиназу фХа, которая, в свою очередь, конвертирует протромбин в тромбин. Комплекс ТФ-фVIIа способен активировать как фактор X, так и фактор IX, что в конечном итоге способствует генерации тромбина [Boyle, E.M., Verrier, E.D., et al., 1996].
По своей структуре ТФ - гликопротеин с молекулярной массой около 47 кДа. Полипептидная часть ТФ человека состоит из 263 аминокислот и содержит 5 остатков цистеина, образующих 2 внутримолекулярных дисульфидных мостика во внеклеточном домене ТФ.
В образовании комплекса ТФ с фVIIа принимает участие только внеклеточный домен ТФ, содержащий 219 аминокислотных остатков Ser-1-Glu-219, и поверхность липидной мембраны. 23-членный трансмембранный домен ТФ обеспечивает корректную ориентацию внеклеточного домена относительно мембраны; короткий внтриклеточный домен ТФ обеспечивает «заякоривание» ТФ в мембране за счет гидрофобного взаимодействия радикалов алифатических аминокислот и образования единственным остатком Cys этого домена тиоэфирной связи с липидами мембраны - пальмитатом или стеаратом, а также участвует в сигнальной функции ТФ как рецептора, активируемого протеазой, и не влияет на образование комплекса с фVIIа.
Внеклеточный домен ТФ гликозилирован по трем остаткам - Asn11, Asn124, Asn137 (Boys et al., 1993). Он содержит 4 остатка Cys, которые образуют две дисульфидные связи, одну в N-концевой, другую - в С-концевой области домена Cys49-Cys57 и Cys186-Cys-209 (Bach "Initiation of Coagulation by Tissue Factor", CRc Critical Rewiews in Biochemistry, 23(4):339-368 (1988)). Эти связи стабилизируют соответствующие пептидные петли. Показано, что расположенная в С-концевой области дисульфидная связь Cys186-Cys-209 является функционально значимой, именно ее участие необходимо для проявления кофакторных функций тканевого фактора по отношению к факторам VII и VIIa. (Rehemtulla, et al., 1991). Вариации в составе N-связанных олиго-сахаридов ТФ, оказывающие влияние на суммарный заряд молекул ТФ, не сказываясь на его прокоагулянтной активности (Verstreeg, Ruf, 2006).
На основе анализа первичной структуры, расположения дисульфидных связей и изучения функциональных особенностей внеклеточного домена ТФ, выявлена гомология его с рецепторами интерферонов альфа и бета семейства цитокиновых рецепторов класса II. В системе свертывания крови взаимодействие факторов VII/VIIa с рецептором - кофактором - ТФ ускоряет в несколько тысяч раз активацию внешнего механизма гемокоагуляции. Это достигается, прежде всего, за счет протеолитического механизма, инициирующегося при образовании комплекса тканевого фактора с фактором VII/VIIa свертывания крови, в котором ТФ работает как кофактор и модулятор фактора VII/VIIa (прокоагулянтная функция ТФ). Связывание фактора VIIa с ТФ вызывает повышение внутриклеточного Са2+ фосфорилирования активируемых митогеном протеинкиназ (МАР-киназ) - Erk-1, Erk-2, p38, Jnk и ведет к транскрипции гена Egr-1 (early growth response), индуцируемого обычно цитокинами и факторами роста. В настоящее время известно, что так называемый внешний путь свертывания крови, индуцируемый тканевым фактором, - основной механизм тромбиногенеза в сосудистом русле [Mann, et al., 1999, Roberts, et al., 1998, Mann, еt al., 1990].
Рецепторная функция ТФ, также опосредованно вносящая свой вклад в ускорение активации внешнего механизма гемокоагуляции in vivo, реализуется непротеолитическим механизмом, при котором цитоплазматический домен ТФ сам участвует во внутриклеточной сигнализации, приводящей к адгезии клеток и миграции [Banner, еt аl., 1996, Ruf, еt аl., 1999, Prydz, et al., 1999].
Первоначальные варианты биотехнологических систем для получения рекомбинантного ТФ человека включали транзиентную трансфекцию культивируемой линии клеток человека А-293 плазмидной ДНК, кодирующей ТФ (US 5589363), либо получение штамма продуцента E. coli, несущего плазмиду, кодирующую ТФ и лидерный пептид одного из белков Bordetella pertussis (US 6261803); либо получение штамма-продуцента Е. coli, несущего плазмиду, кодирующую лидерный пептид pel В, направляющий синтезируемый полипептид в периплазматическое пространство бактерии, слитый с ним в рамке короткий пептид, включающий эпитоп моноклонального антитела и сайт узнавания протеиназы фактор Ха, и слитый с ним в рамке внеклеточный домен ТФ (US 5298599).
Уровень продукции ТФ во всех указанных случаях не превышал 1% от тотального белка. Кроме того, существовала вероятность значительного протеолитического распада рекомбинантного ТФ в процессе культивирования, выделения и очистки.
Более совершенным способом экспрессии рекомбинантного ТФ является система, приведенная в (US 5858724). Для экспрессии рекомбинантного ТФ кролика, высокогомологичного ТФ человека, использовали вектор, содержащий ген тиоредоксина, слитого в рамке с геном ТФ, и специальный штамм Е. coli AD494[DE3].
Данная технология позволяет получать ТФ в растворимой форме в существенных количествах, однако требует специальных, точно подобранных условий ферментации, включающих принудительное охлаждение ферментера до температуры +16°С и непродолжительной индукции культуры на очень низкой плотности (1,5 О.Е.), что существенно ограничивает экономическую привлекательность такой системы экспрессии, а также требует проводить сложную многостадийную хроматографическую очистку. Кроме того, ТФ кролика и ТФ человека не полностью идентичны, что вносит определенные ограничения в область их применения.
Наиболее близким по технической сущности аналогом настоящего изобретения является плазмида pHIL-S1-rRTF и штамм продуцент дрожжей Р. pastoris GS115/ pHIL-S1-rRTF (US 6100072). Данная система экспрессии позволяет получать рекомбинантный ТФ, имеющий небольшой дополнительный С-концевой пептид, включающий гексагистидиновый кластер. Применение такого варианта белка дает возможность проводить его очистку в одну стадию при помощи металлохелатной хроматографии.
Недостатком этой системы экспрессии также является низкий уровень биосинтеза ТФ (не более 1-2% общего белка), что обусловлено необходимостью включения рекомбинантного ТФ в мембрану дрожжевой клетки в процессе биосинтеза белка.
Технической задачей, решаемой авторами, являлось создание технологии получения ТФ с более высоким выходом.
Технический результат достигался путем создания технологии, включающей в себя новую экспрессионную плазмидную ДНК р6Е-tTF, кодирующую фрагмент тканевого фактора человека, создание штамма продуцента E. coli на ее основе и технологию выделения ТФ.
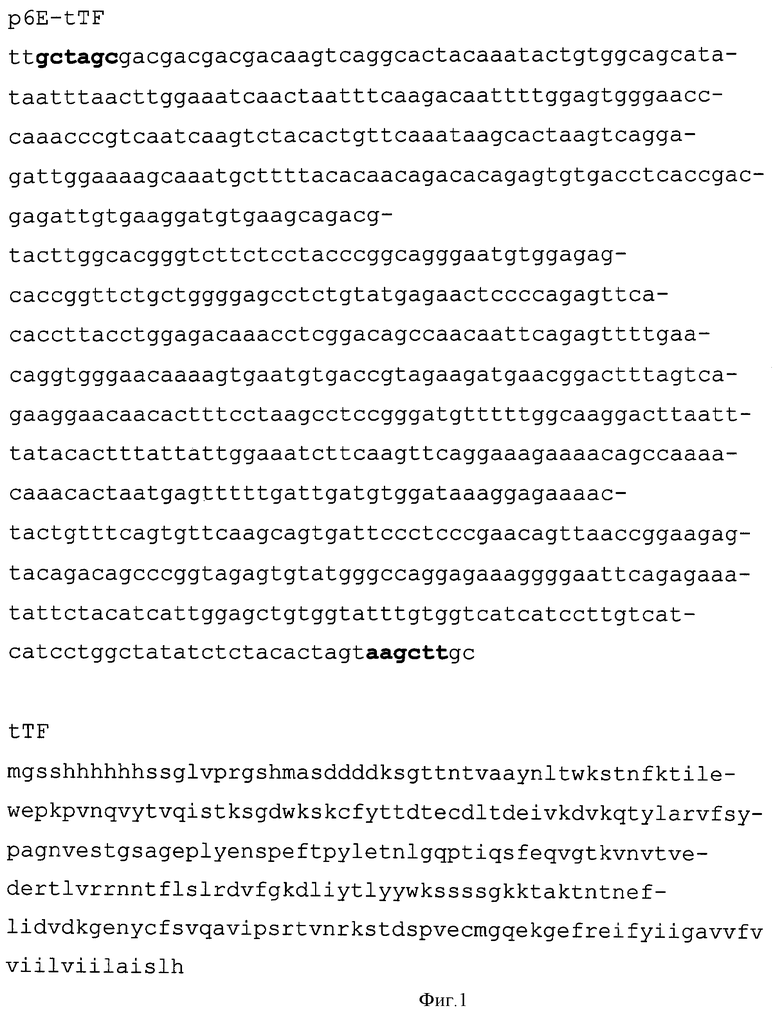
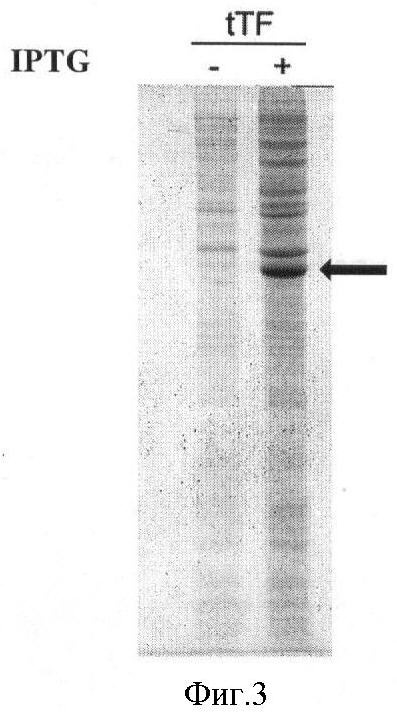
В основе данного решения лежит разработанная авторами плазмидная ДНК р6Е-tTF длиной 6065 п.о., кодирующая синтетический N-концевой пептид длиной 28 а.к. и слитые с ним в рамке внеклеточный и трансмембранный домены ТФ. Данная плазмидная ДНК состоит из фрагмента 5311 п.о. плазмиды рЕТ28а(+) и фрагмента ДНК длиной 754 п.о, амплифицированного при помощи адапторных олигонуклеотидов и матрицы кДНК ТФ. Плазмидная ДНК также содержит промотор и терминатор транскрипции Т7 РНК-полимеразы, усилитель трансляции гена 10 фага Т7 и генетический маркер устойчивости к антибиотику канамицин. Плазмида содержит уникальные (то есть единственные) сайты узнавания эндонуклеазами рестрикции: HindIII (174), SpeI (180), NheI (928), ApaI (2031), PciI (3921).
Плазмидная ДНК р6Е-tTF, состоящая из 6065 п.о., обладает следующими отличительными признаками:
- имеет молекулярную массу 3,75 МДа;
- содержит последовательность, кодирующую трансмембранный и внеклеточный домены тканевого фактора человека;
- включает NheI/HindIII фрагмент плазмиды рЕТ28а(+), содержащий ген Kan(R), обеспечивающий устойчивость трансформированных клеток к канамицину, а также участки узнавания следующих рестриктаз: HindIII (174), SpeI (180), NheI (928), ApaI (2031), PciI (3921).
Плазмида была введена по стандартной технологии (Jac A. Nickoloff, Electroporation Protocols for Microorganisms (Methods in Molecular Biology) // Humana Press; 1st edition (August 15, 1995) в клетки Е. coli, при этом был получен штамм-продуцент BL21[DE3]/p6E-tTF, который обеспечивал синтез в рекомбинантном ТФ количестве 15-40% от суммарного содержания белка клеток.
Штамм Escherichia coli BL21[DE3]/p6E-tTF депонирован в коллекции ГНУ ВНИИ сельскохозяйственной микробиологии 23.12.08 под № 516.
Родовое и видовое название штамма-хозяина (реципиента): Esherichia coli.
Номер или наименование штамма ГИММ: BL21[DE3]/p6E-tTF. Родословная ГИММ: производное E.coli В. Штамм получен трансформацией штамма BL21 [DE3] плазмидной ДНК р6Е-tTF в ООО "ИЦ Новтехмат", 115093 г.Москва, ул. Большая Серпуховская, д.44, офис 33.
Культурально-морфологические особенности штамма ГИММ: грам-отрицательные палочки, образуют нити; на агаризованной среде - беловатые крупные колонии с неровным краем.
Область применения штамма ГИММ: получение рекомбинантного тканевого фактора человека для производства тромбопластиновых реагентов, а именно получение делеционного варианта тканевого фактора человека с выходом целевого продукта после индукции не менее 20% от общего белка. Активность штамма определяется методом денситометрии электрофореграммы.
Штамм хранится в следующих условиях: среда Лурье-Бертрана, 1% глюкозы, 10% глицерина.
Штамм размножается в следующих условиях: среда Лурье-Бертрана, 1% глюкозы, канамицина сульфат 30 мкг/мл.
Генетические особенности штамма.
Генотип штамма - F- ompT gal dcm lon hsdSB(rB -mB -) λ(DE3 [lacI lacUV5-T7 gene 1 indl sam7 nin5]).
Рекомбинантная плазмида: р6Е-tTF; 6065 п.о., уникальные рестриктные сайты для HindIII (174), SpeI (180), NheI (928), ApaI (2031), PciI (3921).
Штамм Escherichia coli BL21[DE3]/p6E-tTF кодирует внеклеточный и трансмембранный домены рекомбинантного тканевого фактора человека, слитые в рамке с N-концевым пептидом, содержащим шестигистидиновый кластер и сайт расщепления энтерокиназой, находящийся непосредственно перед первой аминокислотой внеклеточного домена тканевого фактора.
Особенности конструкции и результаты практического применения изобретения приведены на следующих чертежах.
Фиг.1 - последовательность ДНК в области вставки, последовательность кодируемого полипептида.
Фиг.2 - схема плазмиды р6Е-tTF, где используются следующие обозначения: pBR322 ori - участок инициации репликации плазмиды, f1 ori - участок инициации репликации бактериофага f1, T7 prom - промотор РНК-полимеразы бактериофага T7, ORF - область, кодирующая tTF, 6-His - гексагистидиновый кластер, EK-PRO - сайт процессинга энтерокиназы, ECD - область, кодирующая внеклеточный домен ТФ, ТМ - область, кодирующая трансмембранный домен ТФ, STOP - блок стоп-кодонов, T7term - участок терминации транскрипции, lacI - ген репрессора лактозного оперона, KanR2 - ген устойчивости к канамицину.
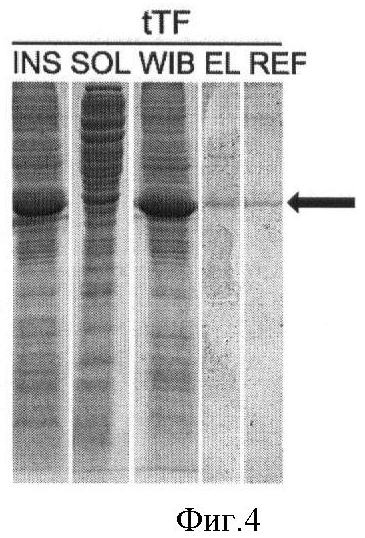
Фиг.3 - электрофореграмма тотального белка штаммов Е. coli.
BL21[DE3]/p6E-tTF до (-) и после (+) индукции ИПТГ в течение часов при +37°С.
Фиг.4 - электрофореграмма фракций нерастворимого белка (INS), растворимого белка (SOL), обогащенных телец включения (WIB), очищенного денатурированного рекомбинантного ТФ (EL) и очищенного рекомбинантного ТФ после ренатурации и концентрирования (REF). Дорожки INS, SOL, WIB - восстанавливающие условия электрофореза, дорожки EL, REF - невосстанавливающие.
Практическая применимость заявляемого изобретения иллюстрируется следующими примерами
Пример 1. Получение плазмидной ДНК р6Е-tTF.
Проводили полимеразную цепную реакцию с использованием специфических праймерных синтетических олигонуклеотидов F3for, sF3rev, tF3rev, f1F3rev на приборе Терцик МС2 («ДНК-технология», Россия).
Первичные нуклеотидные последовательности праймеров:
F3for - TTGCTAGCGACGACGACGACAAGTCAGGCACTACAAATAC,
tF3rev - GGAAGCTTACTACTTGTGTAGAGATATAG
Препаративные реакции проводили в объеме 50 мкл, аналитические в объеме 25 мкл. Готовили инкубационную смесь следующего состава: 1х буфер для термостабильной ДНК-полимеразы; 10 пМ каждого праймерного олигонуклеотида; 2 мМ каждого дезоксирибонуклеотидтрифосфата; 1-2 ед. термостабильной ДНК-полимеразы 0,1-0,2 мкг ДНК. Поверх этой смеси наслаивали 50 мкл легкого минерального масла и вели амплификацию по схеме: 1 цикл - денатурация - 94°С, 3 мин; 25 циклов - денатурация 94°С, 30 сек, отжиг Х°С 30 сек, достройка 72°С, 45-60 сек; 1 цикл - достройка 72°С, 7 мин, где расчет температуры отжига (X) производили по формуле: Х=2°С×n (А/Т)+4°С×n (Г/Ц) - 5°С, где n - число соответствующих нуклеотидов.
В качестве матрицы использовали кДНК гена ТФ человека, депонированной в публичной базе данных данных GeneBank NM_001993.2, распространяемую компанией Origene в виде плазмиды, каталожный номер SC110888.
Продукты ПЦР с пар праймеров F3for и sF3rev; F3for и tF3rev, F3for и f1F3rev, вариантов полипептидов ТФ смешивали с 1 мкл буфера для нанесения и проводили разделение в 1% агарозном геле с добавлением бромистого этидия (0,4 мкг/мл). Для выделения ДНК, полосу, соответствующую продукту амплификации, визуализированную при помощи УФ, вырезали из агарозного геля, помещали в пробирку объемом 1,5 мл и проводили выделение ДНК, используя набор реактивов "Wizard SV Gel and PCR Clean-Up System" («Promega», США) согласно протоколу фирмы-производителя.
Очищенные продукты лигировли в векторную плазмиду PAL-TA (ЗАО «Евроген», Россия) с использованием ДНК-лигазы фага Т4 и стандартного буферного раствора (Fermentas, Литва). Лигирование вели в объеме 10 или 20 мкл, при молярном соотношении вектора и вставки 1:10, в течение 2-20 часов при комнатной температуре. Для лигирования использовали ДНК-лигазу фага Т4 и стандартный буферный раствор (Fermentas, Литва). Лигирование вели в объеме 10 или 20 мкл, при молярном соотношении вектора и вставки 1:10, в течение 2-20 часов при комнатной температуре. Полученными лигазными смесями трансформировали клетки Е. coli штамма DH5α, с генотипом F-φ80lacZΔM15 Δ(lacZYA-argF) U169 recA1 endA1 hsdR17 (rk-, mk+) phoA supE44 λ-thi-1 gyrA96 relA1. Для этого к 200 мкл замороженной суспензии клеток E. coli добавляли 5 мкл лигазной смеси, инкубировали на льду 30 минут для сорбции плазмидной ДНК, нагревали до 42°С 60 секунд и инкубировали на льду 5 минут. После чего добавляли 800 мкл питательного бульона LB и инкубировали при 37°С 60 минут. После инкубации переносили суспензию на чашку Петри с твердой агаризованной средой, содержащей ампициллин в концентрации 100 мкг/1 мл агара и помещали в термостат на 37°С 18 часов.
Колонии Е. coli, отобранные в результате бело-голубого скрининга, анализировали методом ПЦР с клонов, с использованием праймерных олигонуклеотидов к последовательностям реципиентной плазмиды M13rev и M13for (первичные нуклеотидные последовательности праймеров:
М13 rev 5'GAGCGGATAACAATTTCACACACAGG3',
M13 for 5'GCCAGGGTTTTCCCAGTCACGA3') и специфических олигонук-леотидов F3for, sF3rev, tF3rev, flF3rev (первичные нуклеотидные последовательности праймеров
F3for - TTGCTAGCGACGACGACGACAAGTCAGGCACTACAAATAC,
tF3rev - GGAAGCTTACTACTTGTGTAGAGATATAG,
Отобранные клоны наращивали в 5 мл питательного бульона LB и проводили выделение плазмидной ДНК с использованием набора реактивов "Wizard Plus SV Minipreps" («Promega», США) по стандартному протоколу фирмы-производителя. Полученные генетические конструкции PAL-tTF анализировали методом ПЦР-секвенирования с использованием праймерных олигонуклеотидов к последовательностям реципиентной плазмиды M13rev и M13for (первичные нуклеотидные последовательности праймеров: М13 rev 5'GAGCGGATAACAATTTCACACACAGG3', M13for 5'GCCAGGGTTTTCCCAGTCACGA3') и проводили верификацию соответствия кодирующих фрагменты ТФ последовательностей последовательности референсной кДНК гена ТФ человека, опубликованной в публичной базе данных GeneBank NM_001993.2. После этого проводили препаративную рестрикцию плазмиды PAL-tTF эндонуклеазами рестрикции NheI и HindIII. Продукты реакции разделяли в 1% агарозном геле и выделяли с помощью набора реактивов Wizard SV Gel&PCR Clean-Up System no стандартной методике производителя.
Реципиентную плазмиду рЕТ28а (+) рестрицировали последовательно каждой из эндонуклеаз NheI и HindIII. Сначала аликвоты плазмиды инкубировали 2 часа в водном термостате при 37°С с каждой из рестриктаз, контролировали электрофорезом в агарозном геле полную линеаризацию плазмид (в пределах чувствительности метода), после чего добавляли вторую рестриктазу и инкубировали еще 2 часа. Затем пробы объединяли, рестриктазы инактивировали прогреванием при 65°С в течение 20 минут и проводили дефосфорилирование вектора щелочной фосфатазой (Fermentas, Литва) согласно рекомендациям производителя. Щелочную фосфатазу инактивировали прогреванием до 85°С в течение 20 минут. Рестрицированную и дефосфорилированную плазмиду обрабатывали равным объемом смеси фенол-хлороформ 1:1 и переосаждали водную фазу 3 объемами этанола. Центрифугировали 10 минут на скорости 13200 об/мин при комнатной температуре, промывали осадок 70% спиртом, растворяли в воде и использовали для постановки реакции лигирования в рабочей концентрации 10-2 мкг/мкл.
Реакцию лигирования очищенного фрагмента, соответствующего минигену tTF и реципиентной плазмиды проводили, как описано выше. После этого проводили трансформацию клеток Е. coli штамма DH5α, как описано выше.
Колонии Е. coli анализировали методом ПЦР с клонов, с использованием праймерного олигонуклеотида к последовательности векторов T7t-5TGCTAGTTATTGCTCAGCGG3' и специфических олигонуклеотидов F3for, tF3rev (первичные нуклеотидные последовательности праймеров F3for - TTGCTAGCGACGACGACGACAAGTCAGGCACTACAAATAC, tF3rev - GGAAGCTTACTACTTGTGTAGAGATATAG).
Отобранные клоны наращивали в 5 мл питательного бульона LB и проводили выделение плазмидной ДНК с использованием набора реактивов "Wizard Plus SV Minipreps" («Promega», США) по стандартному протоколу фирмы-производителя.
При помощи ПЦР-секвенирования для конструкции р6Е-tTF определяли нуклеотидную последовательность обоих комплементарных цепей ДНК для области вставки. В результате секвенирования установили, что в полученном препарате плазмиды не содержатся мутации в области вставки, то есть кодируется корректная последовательность фрагмента кДНК ТФ.
Пример 2. Получение штамма-продуцента, оценка продуктивности штамма-продуцента и локализация целевого белка.
Для получения штамма-продуцента рекомбинантного ТФ плазмидную ДНК р6Е-tTF использовали для трансформации компетентных клеток Escherichia coli BL21(DE3) (с генотипом F - ompT hsdSB (r-m-) gal dcm (DE3)) и проводили отбор клонов, сохраняющих уровень биосинтеза рекомбинантного полипептида не ниже 10-12% от суммарного клеточного белка в течение по крайней мере шести последовательных пассирований.
Для этого клетки Е. coli BL21(DE3) трансформировали плазмидой р6Е-tTF и высевали на агаризованную среду с добавлением канамицина до 30 мкг/мл, проводили отбор клонов методом ПЦР-анализа с использованием праймерных олигонуклеотидов к последовательностям векторов T7t и специфических олигонуклеотидов F3for, tF3rev. Отобранные клоны наращивали в 5 мл питательного бульона с добавлением канамицина до 30 мкг/мл, проводили выделение плазмидной ДНК, ее рестриктный анализ эндонуклеазами NheI и HindIII и верификацию нуклеотидной последовательности методом ПЦР-секвенирования с использованием праймерных олигонуклеотидов к последовательностям вектора р6Е, как описано выше. После этого проводили аналитическую экспрессию целевых белков.
Для этого клоны клеток Е. coli BL21(DE3), трансформированных плазмидой р6Е-tTF выращивали в питательном бульоне с добавлением канамицина до 30 мкг/мл и раствора глюкозы до 1% в течение 12-14 часов, инокулировали новую порцию питательной среды в соотношении 1:100, растили культуру до достижения оптической плотности 2 О.Е., индуцировали изопропилтио-p-D-галактозидом и культивировали еще 3-6 часов. После окончания культивации осадок клеток отделяли центрифугированием, ресуспендировали клетки в растворе 10 мМ Трис-HCl, 2 мМ ЭДТА-Na, 0,1% Тритона-Х100, 10 мкг/мл лизоцима в соотношении 10 мл раствора на 1 г клеточной пасты, выдерживали суспензию 30 мин на льду и проводили разрушение клеток ультразвуковым диспергатором. Отбирали образцы для электрофоретического анализа, разделяли в них растворимую и нерастворимую фракцию белков центрифугированием, дополнительно ресуспендировали осадок в том же растворе и осаждали центрифугированием. Результаты анализа приведены на фиг.3, целевой белок практически полностью был локализован в нерастворимой фракции белков, т.е. находился в форме «телец включения».
Пример 3. Выделение, очистка и ренатурация рекомбинантного ТФ.
Штамм-продуцент BL21[DE3]/p6E-tTF высевали из музея петлей истощающим штрихом на чашку Петри с агаризованной средой LB, содержащей 30 мкг/мл канамицина и 1% глюкозы, растили 14 часов при +37°С. Одну отдельную колонию штамма переносили в 5 мл жидкой среды LB, содержащей 30 мкг/мл канамицина и 1% глюкозы и растили на качалке 14 часов при +37°С. Содержимым инокулировали 250 мл среды 2xYT, содержащей 30 мкг/мл канамицина и 0,1% глюкозы, растили на качалке 3,5 часа при +37°С, отбирали образцы бактериальной суспензии для анализа, добавляли ИПТГ до конечной концентрации 1 мМ и растили еще 4 часа.
Осадок клеток ресуспендировали в 20 мл раствора А (50 мМ Трис, рН 7,4, 2 мМ ЭДТА), добавили лизоцим до 0,1 мг/мл и Тритон X100 до 0,1%, инкубировали 30 мин на льду. Проводили разрушение клеток и геномной ДНК при помощи ультразвукового диспергатора пульсами по 10 с до исчезновения повышенной вязкости суспензии. Отделяли осадок центрифугированием 10 мин при 20000 об/мин. Осадок ресуспендировали в растворе А, добавляли детергент NP-40 до 1%, суспензию обрабатывали ультразвуковым диспергатором до исчезновения частиц осадка крупнее 1 мм, отделяли осадок центрифугированием 10 мин при 20000 об/мин. Полученный осадок ресуспендировали в растворе А, добавляли NaCl до 500 мМ, суспензию обрабатывали ультразвуковым диспергатором до исчезновения частиц осадка крупнее 1 мм, отделяли осадок центрифугированием 10 мин при 20000 об/мин. Полученный осадок обогащенных телец включения хранили при -70°С.
Для проведения солюбилизации целевого белка к осадку телец включения добавляли раствор Б (6 М гуанидинхлорида, 50 мМ фосфата натрия, 50 мМ бета-меркаптоэтанола, рН 8,0) в соотношении 10 мл раствора на 1 г осадка.
Суспензию инкубировали при перемешивании 2 часа при +37°С, отделяли нерастворившийся клеточный дебрис центрифугированием 10 мин при 20000 об/мин. Супернатант разбавляли в 5 раз раствором В (6 М мочевины, 50 мМ фосфата натрия, 300 мМ хлорида натрия, рН 8,0) для уменьшения конечной концентрации бета-меркаптоэтанола, отделяли выпавший осадок центрифугированием 10 мин при 20000 об/мин и наносили супернатант на колонку с сорбентом Chelating Sepharose Fast Flow (GE Healthcare, США), содержащим хелатированные ионы никеля и уравновешенным раствором В. Последовательно промывали колонку раствором Г (6 М мочевины, 50 мМ фосфата натрия, 300 мМ хлорида натрия, рН 7,0) и раствором Д (6 М мочевины, 50 мМ фосфата натрия, 300 мМ хлорида натрия, 50 мМ имидазола рН 7,0). Элюировали очищенный белок раствором Е (6 М мочевины, 50 мМ фосфата натрия, 300 мМ хлорида натрия, 250 мМ имидазола, рН 7,0). Элюат концентрировали ультрафильтрацией до конечной концентрации белка 20 мг/мл и обессоливали диафильтрацией.
К концентрированному обессоленному раствору целевого белка добавляли дитиотреитол до конечной концентрации 10 мМ, инкубировали 2 часа при +37°С для восстановления дисульфидных связей и добавляли октилглюкозид до конечной концентрации 0,1 М. Раствор денатурированного белка по каплям вносили в перемешиваемый раствор для рефолдинга, содержащий 20 мМ Трис-HCl, рН 8,0, 1 мМ ЭДТА-Na, 150 мМ NaCl, 0,1 М октилглюкозида, 0,3 мМ цистеамина и 1 мМ цистамина. После внесения раствора денатурированного белка продолжали перемешивание в течение 14 часов при температуре +4°С, отделяли образовавшийся осадок денатурированного белка центрифугированием, супернатант концентрировали ультрафильтрацией до конечной концентрации белка 1 мг/мл и при помощи диафильтрации переводили белок в раствор для хранения, содержащий 20 мМ Трис-HCl, рН 8,0, 1 мМ ЭДТА-Na, 150 мМ NaCl, 0,1 М октилглюкозида, 1 мМ бета-меркаптоэтанола. Полученный готовый раствор хранили при -20°С.
Анализ ТФ проводили при помощи ДСН-ПААГ в невосстанавливающих условиях (фиг.4). Чистота целевого белка после очистки составила >90% по денситометрии электрофореграмм, доля ковалентных мультимеров <5%. Выход целевого белка от тотального белка по денситометрии ДСН - ПААГ 100 мг/л культуры (10% от тотального белка). Выход денатурированного белка после очистки 75 мг/л культуры (75%).
Выход продукта после рефолдинга 30 мг/л культуры (общий выход 40%). Белок после рефолдинга пригоден для прямого приготовления тромбопластинового реагента.
Приведенные результаты показали, что включение в последовательность синтезируемого белка короткого дополнительного N-концевого пептида, кодируемого оптимальными для Е. coli кодонами, позволяет увеличить уровень экспрессии гетерологичного белка за счет эффективной трансляции первых 28 аминокислот полипептида. Данный пептид также позволяет проводить хроматографическую очистку экспрессируемого белка в денатурирующих условиях методом металлохелатной хроматографии, что, в свою очередь, позволяет получать полностью очищенный продукт при помощи одной хроматографической стадии. При необходимости данный пептид может быть удален обработкой энтерокиназой и последующей повторной металлохелатной хроматографией.
Преимущества предлагаемого штамма Е. coli BL21[DE3] заключаются в использовании бактерий с фенотипом Lon OmpT, что исключает возможность протеолитического расщепления синтезируемого de novo рекомбинантного ТФ и контаминации выделяемого белка наиболее активными протеазами Е. coli. Встроенный в ее геном ген РНК полимеразы бактериофага Т7 под контролем lac промотора, что при использовании Т7-lac промотора и Т7 терминатора в плазмидах приводит к быстрой и эффективной продукции белка.
Еще одним общим преимуществом использованного штамма, экспрессионного вектора и стратегии биосинтеза является возможность проводить индукцию без изменения температуры культивирования.


Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и может быть использовано для получения делеционного варианта рекомбинантного тканевого фактора человека. Данный полипептид содержит внеклеточный и трансмембранный домены тканевого фактора человека. На основе фрагмента ДНК, кодирующего этот полипептид и плазмиды рЕТ28а(+) была получена генетическая конструкция, обеспечивающая биосинтез рекомбинантного тканевого фактора человека. Также предложен штамм Е. coli BL21[DE3]/p6E-tTF, продуцент рекомбинантного тканевого фактора человека. Использование предложенной генетической конструкции или штамма продуцента Е. coli BL21[DE3]/p6E-tTF позволяет увеличить выход рекомбинантного белка и упростить его выделение и очистку. 2 н.п. ф-лы, 4 ил.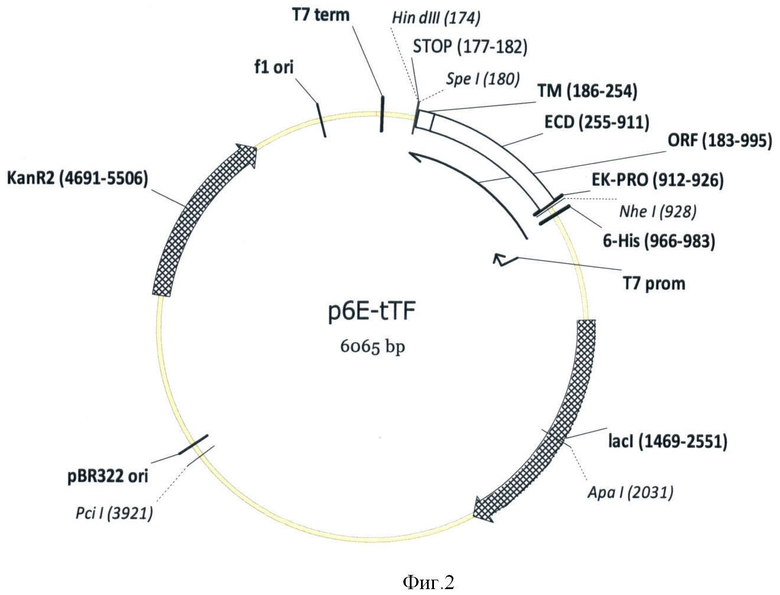
1. Экспрессионная плазмидная ДНК р6Е-tTF, включающая область ДНК, соответствующую SEQ ID NO: 1 и кодирующая полипептид с последовательностью SEQ ID NO: 2, содержащий внеклеточный и трансмембранный домены тканевого фактора человека, а также NheI/HindIII фрагмент плазмиды рЕТ28а(+), содержащий ген Kan(R).
2. Рекомбинантный штамм E.coli BL21[DE3]/p6E-tTF, стабильно трансформированный плазмидной ДНК р6Е-tTF по п.1 - продуцент делеционного варианта рекомбинантного тканевого фактора человека, содержащего трансмембранный и тканевый домены.
| GUAN М | |||
| еt al | |||
| Production of extracellular domain of human tissue factor using maltose-binding protein system | |||
| Protein expression and purification, 2002, v.226, p.229-234 | |||
| STONE M.J | |||
| еt al | |||
| Recombinant soluble human tissue factor secreted by Saccharomyces cerevisae and refolded from Escherichia coli inclusion bodies: glycosylation of mutants, |
Авторы
Даты
2011-08-20—Публикация
2008-11-05—Подача