Изобретение относится к области медицинских исследований, фармацевтической промышленности и биотехнологии и конкретно касается определения активности тромбина с использованием оптических методов.
Тромбин - это белок, относящийся к классу сериновых протеаз. Согласно Второму международному стандарту для тромбина, принятому Всемирной Организацией Здравоохранения, активность белка измеряется в IU (international units). Непосредственное определение активности тромбина не практикуется в лабораториях, более надежным представляется измерение относительно коммерчески доступного стандартного препарата [1].
Биохимические методы определения активности тромбина можно разбить на две группы. Во-первых, применяются низкомолекулярные аналоги субстрата, которые расщепляются активным центром фермента с образованием окрашенного продукта. Примерами таких субстратов служат H-D-Phe-Pro-Arg-п-нитроанилид (FPR) [2], H-D-Phe-Pro-Phe-п-нитроанилид (FPF) [3]. Полученные данные характеризуют активность только каталитического центра тромбина, поэтому корректнее использовать методы второй группы.
Ко второй группе относятся методы, учитывающие эффективность как работы каталитической триады, так и связывания природных субстратов с распознающим участком протеазы. Активность тромбина можно вычислить исходя из кривых накопления продуктов расщепления PAR1, PAR4, протеина C или фибриногена [3-6]. Отщепляемые пептиды определяются хроматографическими методами. Однако специализированное оборудование ВЭЖХ обычно недоступно для повседневного использования в лаборатории, что вынуждает обратиться к определению модифицированных тромбином белков, а не отщепленных пептидов. В этой области разработаны методики для определения фибрина, продукта протеолиза фибриногена тромбином. Фибрин самопроизвольно и обратимо агрегирует с образованием фибриновых нитей. Несмотря на то, что для клинического применения разработаны методы измерения количества фибрин-мономера (на основе ELISA) [7], для лабораторных исследований степень превращения фибриногена удобнее оценивать оптикомеханическим и спектрофотометрическим методом по образованию фибриновых нитей.
Суть оптико-механического метода состоит в перемешивании реакционной смеси магнитной мешалкой, что приводит к наматыванию на нее фибриновых нитей, которые тормозят вращение мешалки вплоть до полной остановки. Время остановки мешалки фиксируется как время сворачивания. Несмотря на некоторую условность получаемой величины и отсутствие корреляции с кинетическими параметрами, стандартизация реагентов и условий реакции делает время сворачивания хорошо воспроизводимым параметром. Оптико-механический метод, в основном, находит применение в клинических лабораториях, что объясняется небольшим диапазоном определяемой активности тромбина (0,3-0,6 IU на 300 мкл пробы), значительной погрешностью результатов (до 50%) и потребностью в узкоспециализированном оборудовании - т.н. коагулометре [8, 9]. Результаты оптико-механического метода недостоверно отражают степень агрегации фибрина в случае некоторых мутаций, поэтому более предпочтительно использование спектрофотометрических методов исследования агрегированного фибрина [9].
В спектрофотометрических методах определения активности тромбина не используется перемешивание раствора во время реакции. На начальных этапах протеолиза раствор агрегирующегося фибрина ведет себя подобно коллоидному раствору, который с течением реакции переходит в гель, образованный трехмерным каркасом агрегированного фибрина и раствора низкомолекулярных соединений, удерживаемого им. Протекание реакции сопровождается помутнением и увеличением вязкости, соответственно для наблюдения можно использовать нефелометрию, турбидиметрию и вискозиметрию.
Из RU 2007137972 A, 10.06.2009 известен способ измерения активности тромбина в цельной крови (в образце), а измерение выработки тромбина включает следующие стадии:
- приведение слоя указанного образца в контакт с флюорогенным субстратом тромбина, при этом толщина указанного слоя составляет от 0.05 до 5 мм, а площадь поверхности составляет от 10 до 500 мм2;
- обеспечение для условий выработки тромбина в указанном образце;
- измерение флюоресценции, испускаемой с поверхности указанного слоя флюоресцентной группой, которую высвобождает флюорогенный субстрат в результате ферментативного воздействия вырабатываемого тромбина на указанный флюорогенный субстрат.
Концентрацию тромбина, выработанного в ходе анализа, определяют как функцию измеренной флюоресценции от высвобождаемой флюоресцентной группы. Указанный образец цельной крови разбавляют в пределах до 10 максимум раз. Толщина слоя указанного образца составляет примерно 2 мм или меньше. При проведении анализа указанный образец крови помещают в лунку планшета, которая содержит решетку с размером отверстий от 50 до 500 мкм.
В настоящее время в медицинской практике широко применяют оптический турбидиметрический метод (G.V.Born, V.J.Cross. The aggregation of platelet. // J Physiol, 1963, V.16, P.178-195), основанный на регистрации светопропускания суспензии тромбоцитов (обогащенная тромбоцитами плазма, получаемая путем центрифугирования крови). Мерой агрегационного процесса здесь является графически регистрируемое увеличение светопропускания плазмы, обусловленное уменьшением рассеяния света на тромбоцитах в результате их поглощения агрегатами, образующимися под воздействием индукторов агрегации.
Турбидиметрия - метод количественного химического анализа, основанный на измерении интенсивности света, прошедшего через исследуемую дисперсную систему.
К настоящему моменту наиболее разработаны методики на основе турбидиметрии, являющейся ближайшим аналогом изобретения.
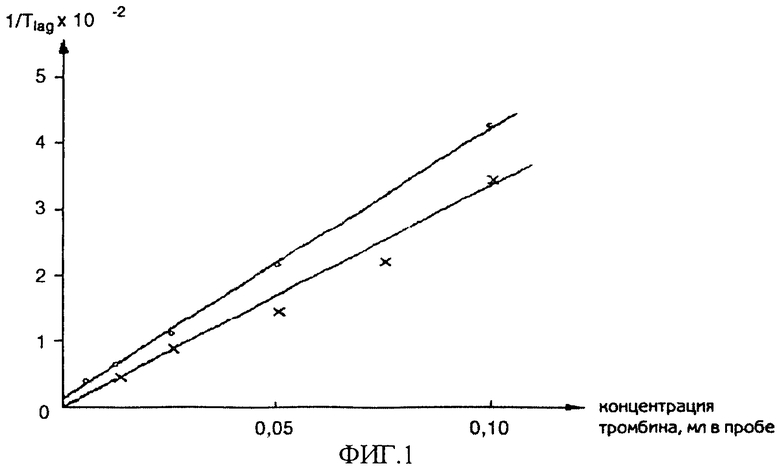
Ближайшим аналогом изобретения является традиционный турбидиметрический способ определения фибриновых нитей, представленный в работе [10], фиг.1. В качестве источника фибриногена использовали пул бестромбоцитарной цитратной плазмы здоровых доноров. Для активации свертывания применяли бычий тромбин. Регистрацию светопоглощения инкубационной среды проводили с помощью фотоэлектрокалориметра МКМФ-02М со светофильтром 340 нм в кювете толщиной 1 см, термостатируемой при 37°C. Графическую регистрацию процесса осуществляли с использованием самописца ЛКД-4-003. Стандартная процедура исследования состояла в следующем. В кювету с толщиной оптического слоя 1 см вносили 1,79 мл 0,02 М вероналового буфера, содержащего 0,13 NaCl и 1 мМ CaCl2; 0,1 мл плазмы крови и 0,1 мл рабочего раствора тромбина, быстро перемешивали и регистрировали динамику изменений светопоглощения во времени. Скрытый период, когда не происходит изменений мутности среды, оценивается временем Tlag. Эта величина характеризует время образования растворимого фибрин-полимера и двунитчатых протофибрилл. В этот период среда остается жидкой. Наиболее четкие и простые закономерности выявляются для Tlag: на фиг.1 представлено, как в исследованном нами диапазоне величина, обратная Tlag, линейно зависела от количества тромбина, добавленного в пробу, а полученная прямая проходит через начало координат (активность пропорциональна концентрации, определяется относительно стандартного препарата тромбина).
Несомненным достоинством таких методик является использование для детектирования спектрофотометров - приборов, компактных и доступных для лабораторного использования. Рассеяние света образцом агрегирующегося фибрина фиксируется спектрофотометром как поглощение излучения. Получаемая величина является сложной функцией формы, размера и концентрации частиц агрегированного фибрина, однако получаемые зависимости поглощения от времени реакции позволяют выделить несколько параметров с установленной зависимостью от концентрации фермента, фибриногена и температуры. Традиционно длину волны падающего излучения выбирают 330-660 нм, т.е. в области прозрачности неокрашенных белков. В качестве параметра, линейно зависящего от концентрации тромбина в диапазоне 0,03-0,3 IU/пробу (погрешность около 10%), выбирают т.н. «лаговое» время Tlag, т.е. время, в течение которого отсутствует поглощение образца [10].
Технической задачей заявленного изобретения является повышение точности и чувствительности метода, т.е. возможность определять тысячные доли IU активности тромбина, а также упрощение процесса.
Поставленная техническая задача достигается способом определения активности тромбина с использованием турбидиметрического метода, включающего наблюдение за образованием фибринового сгустка по гидролизу фибриногена и регистрацию светопропускания инкубационной среды с помощью ультрафиолетового диапазона излучения посредством УФ-спектрофотометра в качестве детектора фибрин-полимера.
Сущность изобретения состоит в использовании УФ-диапазона для турбидиметрических измерений. Огранические молекулы интенсивно поглощают УФ-излучение, однако уменьшение длины волны дает выигрыш в чувствительности турбидиметрического метода.
Предпочтительно при осуществлении способа по изобретению используют температуру 27°C. Все растворы подогреваются при рабочей температуре в течение 15 мин. Состав растворов предпочтительно следующий:
0,1±0,005% человеческий фибриноген;
10-кратная буферная смесь (pH 7,4±0,1, 200±10 мМ Tris-ацетат, 1,4±0,05 М NaCl, 50±5 мМ KCl, 10±1 мМ MgCl2, 10±1 мМ CaCl2);
тромбин человеческий (0,2-50 мкМ).
Момент добавления раствора тромбина фиксируют секундомером и проводят измерения оптической плотности образца при рабочей длине волны 200-300 нм (в работе обычно использовалось излучение 230 нм). Измерения прекращают при достижении плато кривой оптической плотности - приблизительно через 40-100 секунд после добавления раствора тромбина (в зависимости от качества белков и удельной активности тромбина). Качество белка - удельная активность для ферментов (тромбин), способность выполнять свою специфическую функцию для фибриногена, гирудина. Качество белка зависит от технологии получения белка, условий хранения, срока хранения, количества циклов замораживание/размораживание и т.п.
В качестве параметра полученной кривой оптической плотности, пропорционального активности тромбина, можно использовать тангенс угла наклона касательной в точке перегиба кривой. Этот параметр можно интерпретировать как максимальную скорость накопления фибрин-полимера Wmax. Использование препаратов тромбина со стандартизованной активностью позволяет получить калибровочную кривую, линейную для сравнительно широкого диапазона активности протеазы.
Способ иллюстрируется следующими примерами.
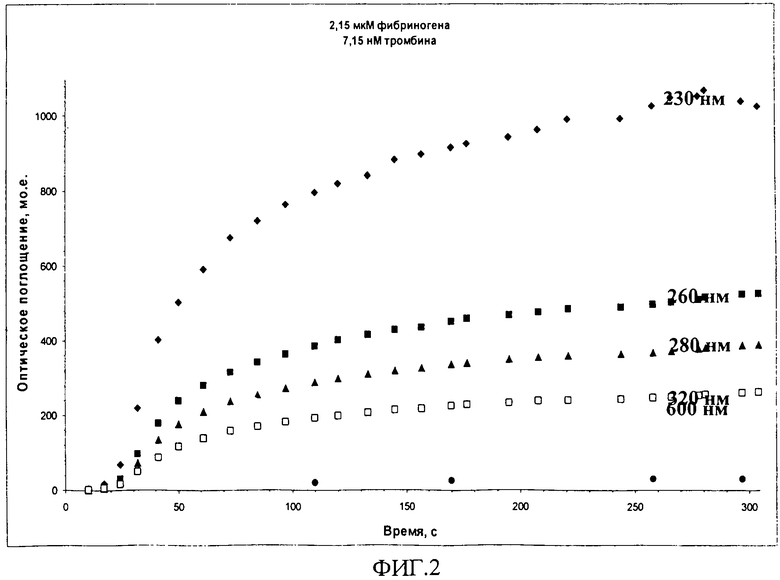
Пример 1. Определение оптимальной рабочей длины волны (фиг.2)
Данные на фиг.2 согласуются с тем фактом, что рассеяние света увеличивается с уменьшением длины волны излучения. При экспериментальном определении длины волны использовался раствор в составе фибриногена 2,15 (мкМ) и тромбина 7,15 (нМ). Наибольший отклик и наименьшие погрешности точек наблюдались при 230 нм, поэтому именно эта длина волны использовалась в последующих экспериментах. В то же время белки поглощают в данной области спектра, это ограничение удалось обойти путем измерения поглощения рабочего раствора относительно такого же раствора фибриногена, но без добавления тромбина (фибриноген всегда присутствовал в 103-104-кратном избытке по массе).
Пример 2. Построение калибровочной кривой
В качестве стандарта активности протеазы использован тромбин человека с активностью 110 IU/ампула (NIBSC, Великобритания). В качестве параметра кривой, пропорционального активности тромбина, можно выбрать тангенс угла наклона участка кривой. Тангенс угла α далее обозначается как Wmax (м.о.е./с, мили оптических единиц в секунду), отображая соответствие этого параметра максимальной скорости изменения поглощения образца во времени.
На фиг.3 представлена калибровочная кривая ферментативной активности тромбина. Т.о. продемонстрирована линейная корреляция между активностью препарата тромбина в пробе и параметром Wmax. Полученная калибровочная кривая аппроксимирована уравнением Wmax=524*A+0.5, где A - активность тромбина, IU.
Вышеприведенное уравнение калибровочной кривой получено в программе Excel (Microsoft Office) путем линейной аппроксимации зависимости Wmax от количества единиц активности тромбина, внесенных в реакционную смесь, у соответствует Wmax (м.о.е./с), x - активности тромбина (IU), R2 - величина достоверности аппроксимации.
Пример 3. Определение активности неизвестного препарата тромбина
Определение активности неизвестного препарата тромбина
В микрощелевую УФ-проницаемую кювету для спектрофотометра помещают предварительно прогретые 15 минут при 27°C растворы:
0,1±0,005% человеческий фибриноген (50 мкл);
10-кратная буферная смесь (pH 7,4±0,1, 200±10 мМ Tris-ацетат, 1,4±0,05 М NaCl, 50±5 мМ KCl, 10±1 мМ MgCl2, 10±1 мМ CaCl2) (7 мкл);
Вода (бидистиллят) (до общего объема реакционной смеси 70 мкл);
тромбин человеческий (0,01-50 мкМ) (от 1 до 13 мкл).
Момент добавления тромбина фиксируют секундомером и проводят измерения оптической плотности образца при рабочей длине волны (230 нм).
Измерения прекращают при достижении плато кривой оптической плотности - приблизительно 40-100 сек.
Далее добавляют количество препарата тромбина с неизвестной активностью так, чтобы получаемое значение Wmax находилось в пределах градуировочной кривой, построенной в примере 2. Для достоверности опыт повторяем, экспериментально подбирая количество препарата тромбина так, чтобы Wmax получался в пределах диапазона значений калибровочной кривой (см. фиг.3). Активность внесенного тромбина вычисляем исходя из уравнения калибровочной кривой, в данном случае A=(Wmax-0.5)/524, IU. Результат можно выразить как объемную активность aThr=A/V (IU/мкл), где V - объем внесенного препарата (в микролитрах).
Например, в кювету спектрофотометра внесли 2 мкл препарата тромбина с неизвестной активностью, Wmax составил 8 м.о.е./с. Тогда активность внесенного количества тромбина составила:
A=(8-0.5)/524=0,014 IU, а объемная активность αThr=0,014/2-0,007 IU/мкл.
Пример 4. Определение активности ингибиторов тромбина на примере гирудина.
Гирудин - специфический ингибитор тромбина является полипептидом (65 аминокислот). В микрощелевую УФ-проницаемую кювету для спектрофотометра помещают предварительно прогретые 15 минут при 27°C растворы:
0,1±0,005% человеческий фибриноген (50 мкл);
10-кратная буферная смесь (pH 7,4±0,1, 200±10 мМ Tris-ацетат, 1,4±0,05 М NaCl, 50±5 мМ KCl, 10±1 мМ MgCl2, 10±1 мМ CaCl2) (7 мкл);
Гирудин (100±10нМ) (1-5 мкл);
Вода (бидистиллят) (до общего объема реакционной смеси 70 мкл);
Тромбин человеческий (0,1 мкМ) (от 1 до 8 мкл).
Каждый раз вносим известное количество единиц активности тромбина, а объем препарата гирудина с каждым опытом повышаем вплоть до достижения минимальной величины Wmax градуированной кривой примера 2.
Момент добавления тромбина фиксируют секундомером и проводят измерение оптической плотности образца при рабочей длине волны (230 нм).
Измерения прекращают при достижении плато кривой оптической плотности - приблизительно 40-300 сек.
На фиг.4 приведена зависимость параметра Wmax от количества добавленного гирудина. Экстраполируя зависимость к Wmax=0, получаем количество гирудина, обладающего активностью, равной активности внесенного тромбина, которую он полностью ингибирует (т.е. 10 mIU в данном случае). Результат можно представить в виде αHir=A/m (IU/пмоль), где m - количество вещества гирудина (пмоль). Ahir=0.01/0.2=0.05 (IU/пмоль).
Измерения оптической плотности прекращают при достижении плато кривой оптической плотности. В приведенных экспериментах за плато принимали изменение оптической плотности при 230 нм менее чем 1 м.о.е. в секунду.
Состав буферного раствора и количество фибриногена можно варьировать в широком диапазоне концентраций. В описании приведен лишь оптимальный вариант соотношения реагентов. Изменение соотношения реагентов влияет на чувствительность метода.
Таким образом, использование УФ-диапазона позволило на порядок увеличить чувствительность метода, т.е. определять тысячные доли IU активности тромбина. Воспроизводимость результатов, низкие затраты реактивов и простота технического оснащения делают способ удобным для лабораторного определения активности препаратов тромбина, степени его ингибирования, автолиза и прочих процессов, сопровождающихся изменением активности протеазы.
Литература
1. Whitton, С., Sands, D., Lee, Т., Chang, A. and Longstaff, C. (2005). Thromb Haemost., 93, 261-266.
2. Papaconstantinou, M.E., Bah, A. and Di Cera, E. (2008). Cell. Mol Life Sci., 65, 1943-1947.
3. Bush, LA., Nelson, R.W. and Di Cera, E. (2006). J. Biol. Chem., 281, 7183-7188.
4. Nieman, M.T. and Schmaier, A.H. (2007). Biochemistry, 46, 8603-8610.
5. Mullin, J.L., Gorkun, O.V., Binnie, C.G. and Lord, S.T. (2000). J. Biol. Chem., 275, 25239-25246.
6. Pineda, A.O., Cantwell, A.M., Bush, L.A., Rose, Т. and Di Cera, E. (2002). J. Biol. Chem., 277, 32015-32019.
7. Schutgens, R.E., Haas, F.J., Agterof, M.J., Vos, M. and Biesma, D.H. (2007). Thromb Haemost., 97, 807-813.
8. Спиридонова В.А., Рог Е.В., Баранов Ю.В., Дугина Т.Н., Струкова С.М., Копылов А.М. (2003). Биоорг. Хим., 29, 1-4.
9. Lefkowitz, J.B., DeBoom, Т., Weller, A., Clarke, S. and Lavrinets, D. (2000). Am J Hematol., 63, 149-155.
10. Щербак И.Г, Субботина Т.Ф., Фаенкова В.П., Рюмина Е.В. (2001). Вопр. мед. хим., 47, 80-89.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИИ ПЛАЗМЫ КРОВИ - АКТИВНОСТИ ТРОМБИНА, ВРЕМЕНИ РЕКАЛЬЦИФИКАЦИИ ПЛАЗМЫ И ТОЛЕРАНТНОСТИ ПЛАЗМЫ К ГЕПАРИНУ | 2020 |
|
RU2786591C2 |
| Способ определения тромбинового пути активации системы комплемента | 2019 |
|
RU2717946C1 |
| Определение циркулирующего тромбина в тесте активации системы комплемента | 2019 |
|
RU2709341C1 |
| Способ определения фибриногена при рекальцификации цитратной плазмы и оценка его функциональности | 2019 |
|
RU2703541C1 |
| Определение чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути | 2019 |
|
RU2696981C1 |
| Способ определения фибриногена и оценка его функциональности | 2020 |
|
RU2732388C1 |
| СПОСОБ ИНГИБИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ И УСКОРЕНИЯ ФИБРИНОЛИЗА С ПОМОЩЬЮ ДНК АПТАМЕРОВ, ИНГИБИРУЮЩИХ АКТИВНОСТЬ ТРОМБИНА, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2559545C1 |
| Способ определения плазминогена в эуглобулиновой фракции крови | 1986 |
|
SU1436073A1 |
| Способ определения фибриногена и оценка его функциональности | 2019 |
|
RU2712643C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА КОЛЛАГЕНАЗ С АНТИКОАГУЛЯНТНЫМ ДЕЙСТВИЕМ ИЗ ГЕПАТОПАНКРЕАСА КАМЧАТСКОГО КРАБА | 2009 |
|
RU2403284C1 |


Изобретение относится к области медицины, а именно к лабораторным методам исследования. Сущность способа определения активности тромбина заключается в том, что он основан на методе турбидиметрического наблюдения за образованием фибринового сгустка, при этом регистрацию светопропускания инкубационной среды проводят с помощью ультрафиолетового диапазона излучения от 230 до 320 нм посредством УФ-спектрофотометра в качестве детектора фибрин-полимера. Изобретение позволяет повысить точность и чувствительность метода. 4 ил.
Способ определения активности тромбина, характеризующийся тем, что используют турбидиметрический метод, включающий наблюдение за образованием фибринового сгустка и регистрацию светопропускания инкубационной среды с помощью ультрафиолетового диапазона излучения от 230 до 320 нм посредством УФ-спектрофотометра в качестве детектора фибрин-полимера.
| ЩЕРБАК И.Г | |||
| и др | |||
| Турбидиметрический анализ полимеризации фибрина в плазме крови | |||
| - Вопросы медицинской химии | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
| Способ исследования свертывания крови | 1990 |
|
SU1777089A1 |
| Способ диагностики тромбинемии | 1988 |
|
SU1672372A1 |
| Способ определения антикоагулянтной активности низко- и среднемолекулярной фракции плазмы крови | 1990 |
|
SU1758560A1 |
| Способ определения активности антитромбина Ш в плазме крови | 1988 |
|
SU1608585A1 |
| УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ | 2005 |
|
RU2278381C1 |
| US 5071247 A, 10.12.1991 | |||
| ШИБЕНКО A.M | |||
| Моделирование формирования | |||
Авторы
Даты
2011-09-20—Публикация
2010-05-18—Подача