Область техники, к которой относится изобретение
Настоящее изобретение относится к способу присоединения алкина, обладающего концевой тройной связью, к сложному α-иминоэфиру.
Уровень техники
Энантиомерные α-аминокислоты, в частности непротеиногенные аминокислоты, приобретают исключительную и все более значительную популярность в качестве важных средств в белковой инженерии и разработке лекарственных средств на основе пептидов. Обширные исследования направлены на получение энантиомерно обогащенных не встречающихся в природе α-аминокислот. Показано, что перспективными являются схемы биологического разделения, а также катализируемое родием асимметрическое гидрирование енамидов. Однако все еще необходим эффективный и технически реализуемый способ обычного синтеза производных не встречающихся в природе аминокислот разных типов.
Привлекательной стратегией проведения таких синтезов является энантиоселективное нуклеофильное присоединение к сложным α-иминоэфирам. Это является полезным, поскольку за одну стадию можно образовать новый хиральный центр и новую связь углерод-углерод. Предшествующие исследования в данной области техники в основном были посвящены каталитическому асимметрическому алкилированию сложного α-иминоэфира. Применявшиеся нуклеофилы включали енол силана, металлаллилы, тетраметилсиланнитронат, кетоны и нитроалканы.
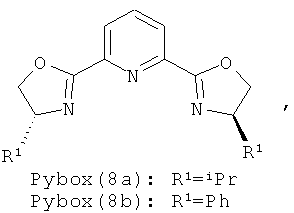
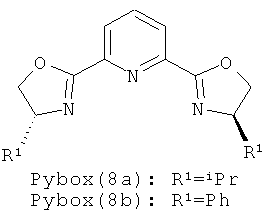
Недавно описано алкинилирование сложных α-иминоэфиров путем прямого присоединения алкинов, обладающих концевой тройной связью, к сложному α-иминоэфиру в присутствии солей Ag(I) в мягких условиях. См. публикацию Ji et al., "Efficient Synthesis of β,γ-alkynyl α-amino acid derivatives by Ag(I) catalyzed alkynylation α-iminoesters", 346 ADV. SYNTH. CATAL. 42-44 (2004). Однако эта описанная катализируемая Ag(I) реакция не является энантиоселективной даже при использовании хирального лиганда, например аминофосфанов, дифосфанов и pybox (2,6-бис[(4R)-(+)-4-изопропил-4,5-дигидро-1,3-оксазол-2-ил]пиридин).
Таким образом, необходим способ асимметрического концевого алкинилирования сложных α-аминоэфиров, который можно использовать для синтеза оптически активных не встречающихся в природе α-аминокислот. Настоящее изобретение решает эту задачу.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу получения асимметрически алкинилированных сложных α-аминоэфиров формулы
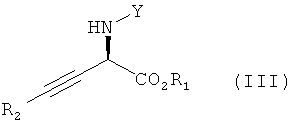
в которой R1 и R2 независимо обозначают необязательно замещенный алкил, циклоалкил, арил или гетероарил и Y обозначает водород или защитную группу атома азота; способ включает взаимодействие сложного α-иминоэфира формулы
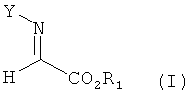
в которой R1 и Y обладают значениями, указанными для формулы III с алкином, обладающим концевой тройной связью, формулы
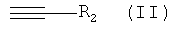
в которой R2 обладает значением, указанным для формулы III.
Подробное описание изобретения
Настоящее изобретение относится к способу каталитического асимметрического алкинилирования сложных α-иминоэфиров.
При использовании в настоящем изобретении термин "сложный α-иминоэфир" означает соединение, обладающее формулой (I)

в которой
R1 обозначает необязательно замещенный алкил, циклоалкил, арил или гетероарил; и
Y обозначает водород или защитную группу атома азота.
При использовании в настоящем изобретении термин "необязательно замещенный алкил" означает незамещенные или замещенные обладающие линейной или разветвленной цепью углеводородные группы, содержащие 1-20 атомов углерода, например 1-7 атомов углерода. Примеры незамещенных алкильных групп включают, но не ограничиваются только ими, метил, этил, пропил, изопропил (ipr), н-бутил, трет-бутил, изобутил, пентил, неопентил, гексил, изогексил, гептил, октил и т.п. Замещенные алкильные группы, включают, но не ограничиваются только ими, алкильные группы, замещенные одной или большим количеством следующих групп: гидроксигруппа, алкиламиногруппа, диалкиламиногруппа, циклоалкил, алкенил или алкоксигруппа.
При использовании в настоящем изобретении термин "низш. алкил" означает необязательно замещенные алкильные группы, описанные выше, содержащие 1-6 атомов углерода.
При использовании в настоящем изобретении термин "алкенил" означает любую из указанных выше алкильных групп, содержащую не менее двух атомов углерода и дополнительно содержащую двойную углерод-углеродную связь в положении присоединения. Применимыми являются группы, содержащие 2-4 атома углерода.
При использовании в настоящем изобретении термины "галоген", "галогенид" означают фтор, хлор, бром или йод.
При использовании в настоящем изобретении термин "алкоксигруппа" означает алкил-O-.
При использовании в настоящем изобретении термин "циклоалкил" означает необязательно замещенные моноциклические алифатические углеводородные группы, которые могут содержать один или большее количество заместителей, таких как алкил или алкоксигруппа.
Примеры моноциклических углеводородных групп включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, циклогексил и т.п.
При использовании в настоящем изобретении термин "арил" означает моноциклические или бициклические ароматические углеводородные группы, содержащие 6-12 атомов углерода в кольцевом фрагменте, такие как фенил, бифенил, нафтил и тетрагидронафтил, каждая из которых необязательно может содержать 1-4 заместителя, таких как необязательно замещенный алкил, циклоалкил или алкоксигруппа.
При использовании в настоящем изобретении термин "моноциклический арил" означает необязательно замещенный фенил, описанный в качестве арила.
При использовании в настоящем изобретении термин "гетероарил" означает ароматический гетероцикл, например моноциклический или бициклический арил, такой как пирролил, пиразолил, имидазолил, триазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, фурил, тиенил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, бензотиазолил, бензоксазолил, бензотиенил, хинолинил, изохинолинил, бензимидазолил, бензофурил и т.п., необязательно замещенный, например, низш. алкилом или низш. алкоксигруппой.
При использовании в настоящем изобретении термин "защитная группа атома азота" означает заместители, которые можно ввести для защиты атома азота от нежелательных реакций с компонентами реакции при условиях, использующихся для проведения конкретного химического превращения, предлагаемого в настоящем изобретении. Необходимость и методика выбора защитных групп для конкретной реакции известны специалисту в данной области техники и зависят от структуры и стабильности молекулы, частью которой является заместитель, и условий проведения реакции.
Хорошо известные защитные группы, соответствующие этим условиям, и их введение и удаление описаны, например, в публикациях McOmie, Protective Groups in Organic Chemistry, Plenum Press, London, NY (1973); и Greene and Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, Inc., NY (1999).
Примеры защитных групп атома азота, подходящих для Y, включают, но не ограничиваются только ими: п-метоксифенил ("РМР"), бензил, метил и трифенилметил. Особенно подходящими являются РМР и бензил.
При использовании в настоящем изобретении термин "алкин, обладающий концевой тройной связью" означает соединение, обладающее формулой (II)
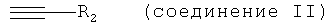
в которой
R2 обозначает необязательно замещенный алкил, циклоалкил, арил или гетероарил.
При использовании в настоящем изобретении термин "асимметрически алкинилированный сложный α-иминоэфир" означает соединение, обладающее формулой (III):
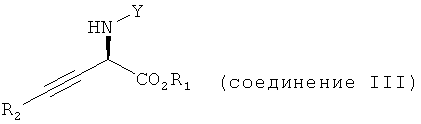
в которой Y, R1 и R2 являются такими, как определено выше.
Катализаторы, применимые в настоящем изобретении, содержат хиральные лиганды, связанные с источником переходного металла, например, представляют собой переходный металл, соль переходного металла или комплекс переходного металла. Такие катализаторы можно образовать in situ или выделить перед использованием.
Переходные металлы, подходящие для каталитической системы, включают, но не ограничиваются только ими, медь (Cu), иридий (Ir), никель (Ni), палладий (Pd), платину (Pt), родий (Rh) и рутений (Ru) и их соли и комплексы. Особенно подходящей является, например, медь и ее комплексы. Другие примеры таких источников переходного металла приведены, например, в публикации Seyden-Penne, Chiral Auxiliaries and Ligands in Asymmetric Synthesis, John Wiley & Sons, Inc., NY (1995), которая включена в настоящее изобретение в качестве ссылки.
Примеры комплексов переходных металлов включают, но не ограничиваются только ими, IrCl·2COD, Zn(OTf)2, ZnCl2, Sc(OTf)3, CuO2, CuOAc, CuCl, CuI, CuBF4, CuBr, CuPF5·4MeCN, CuOTf·0,5С6Н6 и Cu(OTf)2. Однако особенно подходящими в качестве источников переходного металла являются CuPF5·4MeCN и CuOTf·0,5С6Н6.
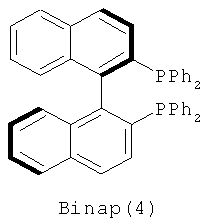
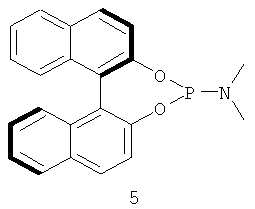
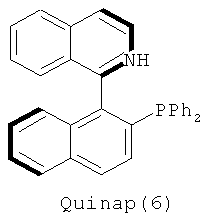
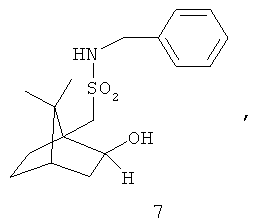
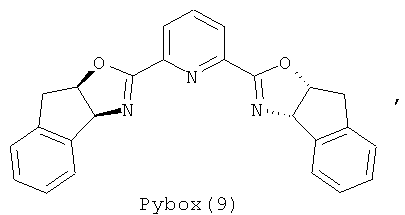
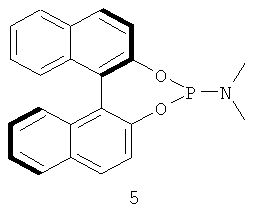
Примеры хиральных лигандов включают, но не ограничиваются только ими, следующие хиральные лиганды, обозначенные, как 4, 5, 6, 7, 8a, 8b и 9 и их энантиомеры и смеси их энантиомеров. Однако особенно подходящими являются хиральные лиганды: 5, 7, 8a и 9 и их энантиомеры и смеси их энантиомеров. Хиральный лиганд 4 представляет собой 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (или "Binap"). Хиральный лиганд 6 представляет собой 1-(2-дифенилфосфино-1-нафтил)изохинолин (или "Quinap"). Хиральный лиганд 9 представляет собой бис(оксазолидин)-пиридин (или "Pybox").
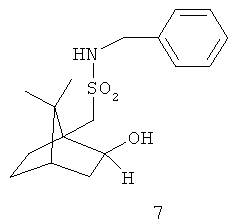
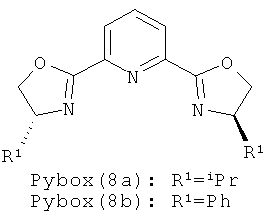
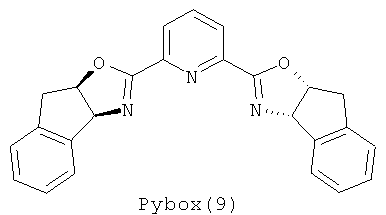
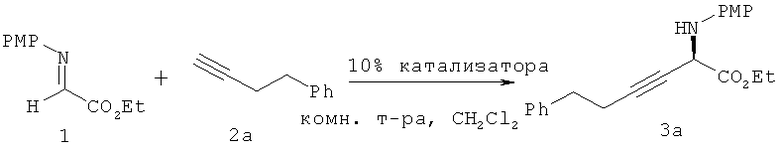
Примеры аминов-оснований включают, но не ограничиваются только ими, РМР-NН2, Et3N, iPr2NH, Pr2EtN, Cy2NMe. Однако особенно подходящим является РМР-NH2.
Все реакции алкинилирования соединения I (рассмотренные ниже) проводят по следующей общей методике:
Все реакции проводят в атмосфере азота. Все химикаты и растворители, например органические растворители, используют в том виде, в котором они приобретены, без дополнительной очистки, если не указано иное. Органический растворитель CH2Cl2 получают перегонкой над СаН2. Соединение I синтезируют по методикам, известным специалистам с общей подготовкой в данной области техники. См., например, публикацию Andrew Taggi et al., "A-imino esters: versatile substrates for the catalytic, asymmetric synthesis of α- and β-amino acids and β-lactams," 36 Acc. Снем. Res. 10-19 (2003).
Pybox (хиральный лиганд 9) (9,7 мг, 0,025 ммоля) и CuOTf·0,5С6Н6 (6,5 мг, 0,025 ммоля) помещают в высушенную круглодонную колбу объемом 10 мл, содержащую стержень для магнитной мешалки. Прибавляют CH2Cl2 (1,0 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Другими органическими растворителями, которые также можно использовать в настоящем изобретении, являются диэтиловый эфир, тетрагидрофуран и диоксан. Раствор охлаждают до температуры, равной примерно -10°С. Температура реакции может меняться от примерно -40 до примерно 30°С; например, примерно от -20 до 0°С. При энергичном перемешивании последовательно прибавляют сложный α-иминоэфир (соединение I) (52,3 мг, 0,25 ммоля) в CH2Cl2 (400 мкл), алкин, обладающий концевой тройной связью (соединение II) (0,25 ммоля) и PMP-NH2 (амин-основание) (3,2 мг, 025 ммоля) в CH2Cl2 (100 мкл). Полученный раствор перемешивают при -10°С и за реакцией следят с помощью ТСХ (тонкослойная хроматография. После завершения реакции смесь фильтруют через слой силикагеля 1×1 см, который затем промывают с помощью EtOAc (10 мл). Раствор выливают в делительную воронку и энергично перемешивают с EtOAc (25 мл) и Н2О (5 мл). Водный слой отбрасывают и органический слой промывают насыщенным рассолом (5 мл). Полученный органический слой сушат над безводным Na2SO4, фильтруют и затем концентрируют в вакууме. Очистка остатка с помощью колоночной флэш-хроматографии (9:1 гексан-EtOAc в качестве элюента) дает искомый продукт алкинилирования в виде светло-желтого масла.
Для анализа спектры 1Н ЯМР и 13С ЯМР снимают в CDCl3 на спектрометре Varian AS 500 (500 и 125 МГц соответственно) при комнатной температуре. Химические сдвиги (δ) выражают в част./млн и значения J приводят в герцах. МСВР (масс-спектры высокого разрешения) получают по методике ИЭР (ионизация электрораспылением) на приборе Fisons VG или спектрометре Finnigan Model MAT-95. Анализы с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) проводят на приборе Waters Model 600 с использованием УФ-детектора Waters 486. Оптическое вращение исследуют на поляриметре Perkin-Elmer Model 341 с использованием кюветы 10 см. Колоночную флэш-хроматографию проводят на силикагеле (230-400 меш).
Пример 1: Выявление переходных металлов, подходящих для катализатора
Исследован ряд солей переходных металлов, таких как Zn(II), Cu(I)/(II), Ir(I) и Sc(III), указанных выше в таблице 1. Присоединение 4-фенил-1-бутина 2а к сложному α-иминоэфиру 1 не обнаруживается при использовании IrCl·2COD, Zn(OTf)2, ZnCl2 или Sc(OTf)3 в качестве предшественника катализатора (№1 в таблице 1). Искомый продукт 3а получают с хорошим выходом при использовании предшественников катализатора CuPF6·4MeCN (№3) и CuOTf·0,5С6Н6 (№4). Некоторые другие комплексы меди, например, включающие Cu(OTf)2 (№5), CuCl, CuBr (№2), CuO2 и CuOAc (№1), обладают более низкой или практически не обнаруживаемой каталитической активностью.
Пример 2 - Влияние включения амина-основания
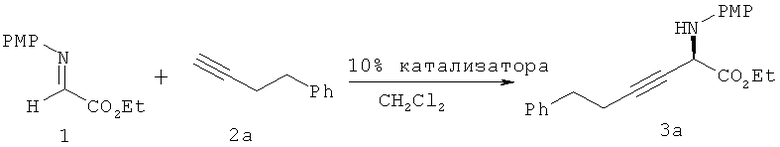
Прибавление аминов-оснований и использование других источников меди и структурно различных лигандов Pybox охарактеризовано выше в таблице 2. Известно, что алкинилиды металлов, использующиеся в реакциях образования связей С-С, генерируются в присутствии амина-основания, такого как Et3N. Неожиданно обнаружено, что в системе алкинилирования, предлагаемой в настоящем изобретении, реакция заметно замедляется при добавлении 0,5 экв. Et3N или iPr2NH (№№6, 7). В отличие от этого использование 0,5 или 0,1 экв. РМР-NH2 в качестве добавки повышает выход соединения 3 от 73 до 86% и 90% соответственно без ухудшения энантиоселективности (№№5, 8, 9). Последующая тщательная оптимизация привела к следующим условиям проведения реакции: использование CuOTf·0,5С6Н6 в качестве источника переходного металла и конформационно более ограниченного Pybox (9) в качестве хирального лиганда при температуре около -10°С, что дает искомый продукт 3 с выходом 90% и энантиомерным избытком 85% ("ее").
Пример 3 - Алкинилирование сложных α-иминоэфиров, катализируемое с помощью CuOTf·0,5С6Н6/pybox (9).
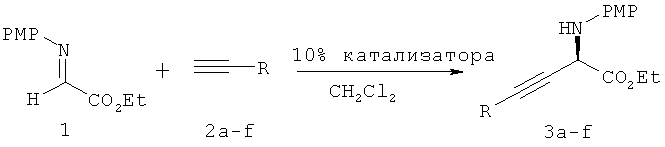


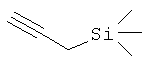
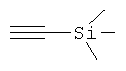
Проводят прямое алкинилирование сложного α-иминоэфира 1 с использованием набора алкинов, обладающих концевой тройной связью, и типичные результаты приведены выше в таблице 3. Проведенные по методике, аналогичной использованной для присоединения 4-фенил-1-бутина (№1), реакции присоединения 3-фенил пропина (№2), 1-октина (№3) и циклопропилацетилена (№4) дают соответствующие продукты алкинилирования с хорошими выходами и энантиомерными избытками. В то же время использование алкинов с объемными заместителями, расположенными близко к тройной связи, таких как триметилсилилацетилен (№6), приводит к меньшим скорости реакции и энантиоселективности. Примечательно, что указанное присоединение циклопропилацетилена к сложному иминоэфиру 1 (№4) представляет собой новый прямой и удобный путь получения производных α-аминокислот, содержащих конформационно заторможенные циклопропановые кольца.
Ниже описаны условия анализа продуктов, приведенных в таблице 3 и относящихся к примеру 3, т.е. 3a-3f.
Этил-2-(п-метоксифениламино)-6-фенил-3-гексиноат. Соединение 3а получают с выходом 90% путем использования общей методики. Значение ее (85%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 90:10 гексан: i-PrOH, 1,0 мл/мин: tR (главный)=11,48 мин, tR (второстепенный)=16,75 мин]. [α]D 20 -64,7° (с 0,5, CHCl3); 1Н ЯМР (500 МГц, CDCl3): δ=7,28-7,25 (m, 2H), 7,20-7,16 (m, 3H), 6,80-6,78 (m, 2H), 6,67-6,65 (m, 2H), 4,69 (t, 1H, J=2,3 Гц), 4,27-4,24 (q, 2H, J=7,5 Гц), 3,76 (s, 3H), 2,80-2,77 (t, 2H, J=7,3 Гц), 2,49-2,46 (dt, 2H, J=7,3, 2,0 Гц), 1,31-1,28 (t, 3H, J=7,5 Гц); 13С ЯМР (125 МГц, CDCl3): δ=169,5, 153,7, 140,6, 137,6, 128,7, 128,6, 126,6, 116,5, 114,9, 84,8, 75,4, 62,5, 55,9, 50,5, 34,9, 21,1, 14,3; MCBP (ИЭР) рассчитано для C21H24NO3 [М+1]+: 338,1756, найдено: 338,1782.
Этил-2-(п-метоксифениламино)-5-фенил-3-пентиноат. Соединение 3b получают с выходом 92% путем использования общей методики. Значение ее (83%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 90:10 гексан: i-PrOH, 1,0 мл/мин: tR (второстепенный)=21,49 мин, tR (главный)=35,00 мин]. [α]D 20 -38,1° (с 0,4, CHCl3); 1Н ЯМР (500 МГц, CDCl3): δ=7,31-7,24 (m, 5H), 6,83-6,81 (m, 2H), 6,74-6,72 (m, 2H), 4,83 (t, 1H, J=2,2 Гц), 4,32-4,28 (q, 2H, J=7,2 Гц), 3,76 (s, 3H), 3,62 (d, 1H, 2,0 Гц), 1,27 (t, 3H, J=7,3 Гц); 13С ЯМР (125 МГц, CDCl3): δ=169,5, 153,6, 139,7, 136,3, 128,7, 128,1, 126,9, 116,4, 115,0, 82,9, 72,8, 62,5, 55,8, 50,5, 25,2, 14,3; МСВР (ИЭР): Рассчитано для C20H22NO3 (M++1): 324,1600, найдено: (M++1): 324,1596.
Этил-2-(п-метоксифениламино)-3-дециноат. Соединение 3с получают с выходом 89% путем использования общей методики. Значение ее (91%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 90:10 гексан: i-PrOH, 1,0 мл/мин: tR (главный)=9,96 мин, tR (второстепенный)=12,63 мин]. [α]D 20 -62,3° (с 0,4, CHCl3); 1Н ЯМР (500 МГц, CDCl2): δ=6,79-6,77 (m, 2H), 6,70-6,68 (m, 2H), 4,70 (t, 1H, J=2,3 Гц 1Н), 4,29-4,24 (q, 2H, 7,3 Гц), 3,75 (s, 3H), 2,19-2,15 (dt, 2H, J=7,0, 2,3 Гц), 1,47-1,44 (m, 2H), 1,34-1,20 (m, 13H), 0,89-0,86 (t, 3H, J=7,0 Гц); 13С ЯМР (125 МГц, CDCl3): 5=169,6, 153,7, 139,3, 116,6, 114,9, 86,0, 75,0, 62,4, 55,8, 50,6, 31,5, 28,6, 28,5, 22,8, 18,9, 14,3, 14,2; МСВР (ИЭР) рассчитано для C19H28NO3 [M+1]+: 318,2069, найдено: 318,2091.
Этил-2-(п-метоксифениламино)-4-циклопропил-3-бутиноат. Соединение 3d получают с выходом 92% путем использования общей методики. Значение ее (79%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 95:15 гексан: i-PrOH, 1,0 мл/мин: tR (главный)=11,08 мин, tR (второстепенный)=19,46 мин]. [α]D 20 -47,4° (с 0,7, CHCl3); 1Н ЯМР (500 МГц, CDCl3): δ=6,78-6,74 (m, 2H), 6,66-6,62 (m, 2H), 4,64 (d, 1H, J=2,3 Гц), 4,26-4,21 (q, 2H, J=7,0), 3,17 (s, 3H), 1,26 (t, 3H, J=7,0 Гц), 1,12-1,08 (m, 1H), 0,67-0,64 (m, 2H), 0,63-0,60 (m, 2H); 13С ЯМР (125 МГц, CDCl3): δ=169,9, 153,7, 140,1, 116,4, 115,2, 88,8, 70,6, 62,6, 56,1, 50,7, 14,5, 8,8, 8,7; МСВР (ИЭР) рассчитано для C16H20NO3 [M+1]+: 274,1443 найдено: 274,1453.
Этил-2-(п-метоксифениламино)-5-(триметилсилил)-3-пентиноат. Соединение 3е получают с выходом 63% путем использования общей методики. Значение ее (77%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 90:10 гексан: i-PrOH, 0,7 мл/мин: tR (главный)=18,03 мин, tR (второстепенный)=27,63 мин]. [α]D 20 -36,3° (с 0,5, CHCl3); 1Н ЯМР (500 МГц, CDCl3): δ=6,79-6,72 (m, 2H), 6,68-6,66 (m, 2H), 4,71 (t, 1H, 2,5 Гц), 4,28-4,24 (q, 2H, J=7,2 Гц), 3,74 (s, 3H), 1,46-1,45 (d, 2H, J=3,0 Гц), 1,32-1,29 (t, 3H, J=7,3 Гц), 0,04 (s, 9H); δ=169,8, 153,5, 139,6, 116,3, 114,9, 83,7, 73,9, 62,2, 55,9, 50,5, 14,3, 7,3, -1,9; МСВР (ИЭР) рассчитано для C17H26NO3Si [М+1]+: 320,1682, найдено: 320,1711.
Этил-2-(п-метоксифениламино)-4-(триметилсилил)-3-бутиноат. Соединение 3f получают с выходом 55% путем использования общей методики. Значение ее (48%) определяют путем анализа с помощью ВЭЖХ с использованием хиральной колонки [Chiralcel AD, 90:10 гексан: i-PrOH, 1,0 мл/мин: tR (главный)=6,97 мин, tR (второстепенный)=9,15 мин]. [α]D 20 -98,5° (с 0,3, CHCl3); 1Н ЯМР (500 МГц, CDCl3): δ=6,65-6,63 (m, 2H), 6,55-6,53 (m, 2H), 4,58 (s, 1H), 4,15-4,11 (q, 2H, J=7,0), 3,60 (s, 3H), 1,15 (t, 3H, J=7,0 Гц); 13С ЯМР (125 МГц, CDCl3): δ=169,0, 153,6, 139,5, 116,4, 114,9, 100,1, 90,0, 62,5, 55,8, 51,2, 14,2, -0,1; МСВР (ИЭР) рассчитано для C16H24NO3Si [M+1]+: 306,1525, найдено: 306,1529.
Пример 4 - Применение асимметрически алкинилированных сложных α-иминоэфиров
Продукты, полученные способами, предлагаемыми в настоящем изобретении, т.е. асимметрически алкинилированные сложные α-иминоэфиры можно использовать для синтеза оптически активных производных не встречающихся в природе α-аминокислот. Пример приведен ниже на схеме 1, на которой продукт, являющийся модификацией продукта 3b примера 3 дает производное бисмонофенилаланина, или (R)-12 на схеме 1, который является ключевым промежуточным продуктом для получения представляющих интерес для фармацевтики пептидов, использующихся для получения гормонов роста.
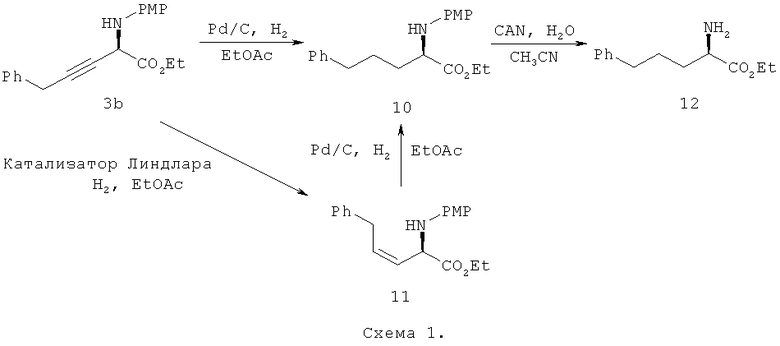
Продукт алкинилирования 3b гидрируют в 10 с количественным выходом. Последующая обработка 10 нитратом церия-аммония (CAN) дает искомую молекулу с выходом 76%. Для этого превращения установлено, что абсолютной конфигурацией 3b является R {[α]D 20 -11,7° (с 0,4, CHCl3) для (R)-12; ссылка 47,
[α]D 20 +14,5° (с 0,4, CHCl3) для его S-энантиомера}. Кроме того, частичное восстановление 3b в присутствии катализатора Линдлара дает производное (Z)-виниламинокислоты 11, производное β,γ-виниламинокислоты. Каталитическое асимметрическое алкинилирование сложного α-иминоэфира 1 совместно с частичным восстановлением впервые приводит к каталитическому введению винильной группы в производные аминокислот. Гидрирование 11 с использованием Pd/C также дает промежуточный продукт 10 с количественным выходом.
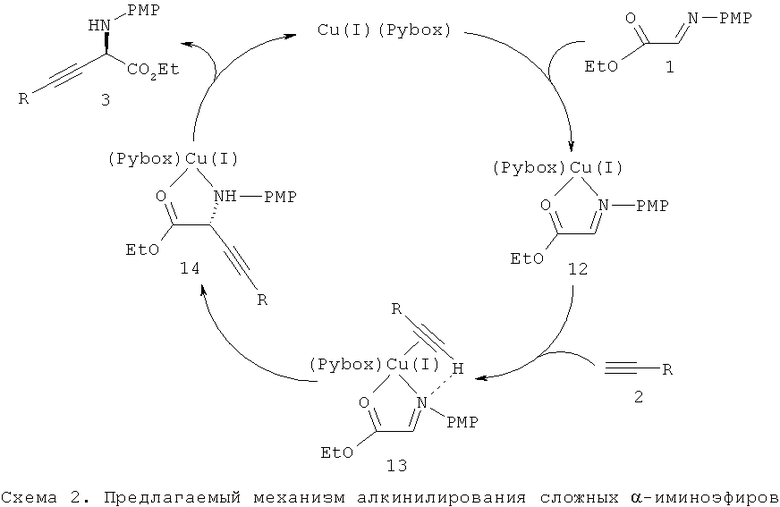
Если не ограничиваться конкретной теорией, то можно предложить механизм каталитического алкинилирования сложного α-иминоэфира, представленный на схеме 2. Последующее образование комплекса субстрата 1 и алкина 2 с каталитическим центром дает промежуточный продукт 13, в котором происходит внутримолекулярный перенос алкина с образованием промежуточного продукта 14. Последующее отщепление продукта 3 от 14 одновременно приводит к регенерации катализатора.
Таким образом, настоящее изобретение относится к способу асимметрического присоединения алкина, обладающего концевой тройной связью, к сложному α-иминоэфиру, который характеризуется хорошими выходом и значением ее.
Следует понимать, что, хотя настоящее изобретение представлено с помощью подробного описания, приведенное выше описание предназначено для иллюстрации, а не для ограничения объема настоящего изобретения, которое определяется объемом приведенной ниже формулы изобретения. Другие особенности, преимущества и изменения входят в объем формулы изобретения.
Изобретение относится к способу получения энантиомерного избытка асимметрически алкинилированных сложных α-аминоэфиров формулы 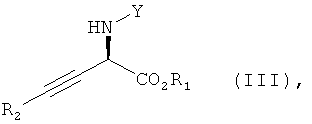
в которой R1 и R2 независимо обозначают C1-7-алкил, необязательно замещенный фенилом или триметилсилилом, или С3-5-циклоалкил; Y обозначает Н или защитную группу атома азота. Способ включает взаимодействие в присутствии катализатора сложного α-иминоэфира формулы 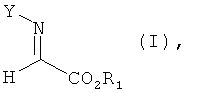 в которой R1 и Y имеют значения, указанные для формулы III, с алкином, содержащим концевую тройную связь, формулы
в которой R1 и Y имеют значения, указанные для формулы III, с алкином, содержащим концевую тройную связь, формулы 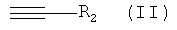 , в которой R2 имеет значения, указанные для формулы III. Используемый катализатор включает комплекс переходного металла CuPF6·4MeCN или CuOTf·0,5С6Н6 и хирального лиганда, выбранного из группы, включающей
, в которой R2 имеет значения, указанные для формулы III. Используемый катализатор включает комплекс переходного металла CuPF6·4MeCN или CuOTf·0,5С6Н6 и хирального лиганда, выбранного из группы, включающей
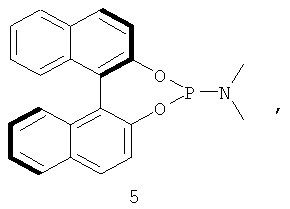
их энантиомеров и смеси их энантиомеров. Способ позволяет с хорошими выходами и значениями ее получать асимметрически алкинилированные сложные α-аминоэфиры формулы (III), которые могут использоваться в синтезе оптически активных производных не встречающихся в природе аминокислот. 2 з.п. ф-лы, 3 табл.
1. Способ получения энантиомерного избытка асимметрически алкинилированных сложных α-аминоэфиров формулы
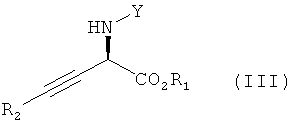 ,
,
в которой R1 и R2 независимо обозначают C1-7-алкил, необязательно замещенный фенилом или триметилсилилом, или С3-5-циклоалкил, и Y обозначает водород или защитную группу атома азота;
включающий взаимодействие в присутствии катализатора сложного α-иминоэфира формулы
 ,
,
в которой R1 и Y имеют значения, указанные для формулы III,
с алкином, содержащим концевую тройную связь формулы
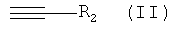 ,
,
в которой R2 имеет значения, указанные для формулы III,
где указанный катализатор включает комплекс переходного металла CuPF6·4MeCN или CuOTf·0,5С6Н6 и хирального лиганда, выбранного из группы, включающей
 ,
, 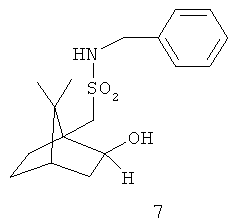 ,
,  ,
, 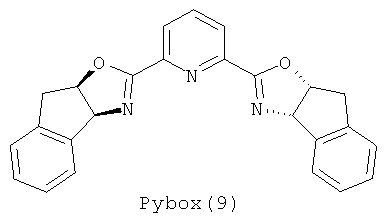 ,
,
их энантиомеров и смеси их энантиомеров.
2. Способ по п.1, в котором указанное взаимодействие проводят в присутствии каталитического количества п-метоксифениламина (PMP-NH2).
3. Способ по п.1, в котором R1 обозначает C1-7-алкил.
| JIAN-XIN JI et al | |||
| Efficient Synthesis of β,γ-Alkynyl α-Amino Acid Derivatives by Ag(I)-Catalyzed Alkynylation of α-Imino Esters, ADV | |||
| SYNTH | |||
| CATAL., 2004, 346, 42-44 | |||
| ANDREW E | |||
| TAGGI et al, α-Imino Esters: Versatile Substrates for the Catalytic, Asymmetric Synthesis of α- and β-Amino Acids and β-Lactams, |
Авторы
Даты
2011-11-27—Публикация
2006-05-17—Подача