Изобретение относится к химической промышленности, к продуктам малотоннажной химии, а именно 2(3Н)-бензотиазолону и некоторым производным на его основе.
Известен ряд методов получения 2(3H)-бензотиазолононов: (1) циклизацией 2-аминотиофенолов фосгеном, хлоркарбонатами [1, 2] и мочевиной [3]; (2) восстановительным карбонилированием замещенных нитробензолов с использованием серы, монооксида углерода и воды в присутствии оснований [Патент Великобритании №966496], (3) циклизацией тиокарбаматов с последующим расщеплением образующихся 2-алкоксибензотиазолов [3], (4) окислением 2-меркаптобензотиазолов или бензотиазолилалкилтиоэфиров с получением 2-сульфонил- или 2-алкилсульфонилбензотиазолов и последующим их гидролизом [4, 5]; (5) реакцией о-нитрохлорбензолов с тиогликолевой кислотой и последующей циклоконденсацией о-нитрофенилтиоуксусной кислоты уксусным ангидридом, а затем деацилированием [1]; (6) реакцией 2-аминобензотиазолов с гидроксидами щелочных металлов в безводной среде и циклизацией образующихся о-меркаптофенилмочевин [Патенты США №5594145, №4429134]; (7) реакцией тиосалициловой кислоты с азидом аммония и тремя эквивалентами комплекса ДМФА-POCl3 [6].
Способы получения (1-7) имеют существенный недостаток, так как основаны на использовании меркаптосоединений, применение которых вызывает ряд экологических проблем.
Описано получение 3-замещенных 2(3Н)-бензотиазолонов нитрозированием 3-замещенных 2(3Н)-иминобензотиазолов в системе ксилол - хлороводородная кислота (Патент EP №0622361 А). Недостатками последнего способа получения 3-замещенных 2(3Н)-бензотиазолонов является образование токсичных N-нитрозосоединений, а также осуществление процесса в ксилоле, что делает этот процесс с точки зрения «зеленой» химии менее привлекательным и более энергозатратным.
Разнообразные 2- и 3-замещенные производные 2(3H)-бензотиазолонов обладают широким спектром биологической активности. Среди них найдены соединения с высокой гербицидной [Патент Великобритании №966496, Патенты США №4971619, №4824465], антимикробной [7], анальгетической [8], противовоспалительной [9], антиаллергической [Патент Японии №92952], антифунгицидной [Патент Германии №2924712, Патент США №4293702], росторегулирующей [10] и другими видами активности. Они также служат в качестве ценных прекурсоров в синтезе новых функционально замещенных соединений.
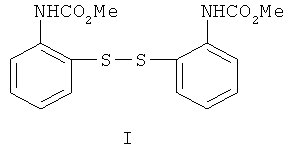
Предложен новый способ получения 2(3Н)-бензотиазолона, отличающийся тем, что в качестве исходного соединения используется бис-(2,2'-диметоксикарбоксамидо)фенилдисульфид (I), который, в свою очередь, получают по реакции ацилирования 2-аминотиофенола метилхлорформиатом в безводном пиридине (пример 1). Выход дисульфида I - 79%.
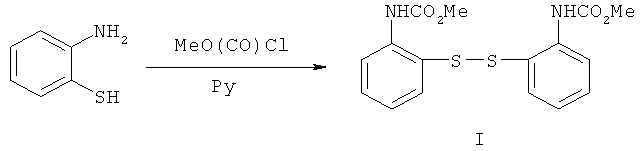
Структура дисульфида (I) подтверждена методами ИК, ЯМР 1H спектроскопии, масс-спектрометрии и элементным анализом.
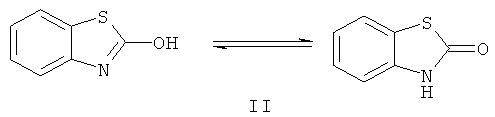
Превращение дисульфида (I) в 2(3Н)-бензотиазолон (II) достигается кипячением бис-(2,2'-диметоксикарбоксамидо)фенилдисульфида (I) в ледяной уксусной кислоте в присутствии цинковой пыли в течение 7,5 часов, отделением осадка солей цинка посредством фильтрования и выливанием фильтрата в ледяную воду (пример 2).
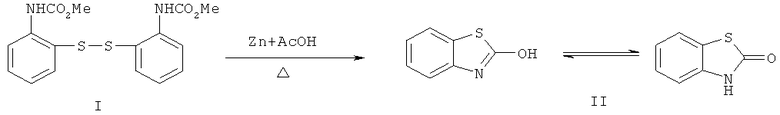
После промывки раствором соляной кислоты (1:1), водой и сушки на воздухе получают практически чистый продукт II, который может быть дополнительно очищен перекристаллизацией из этанола. Выход 2(3Н)-бензотиазолона (II) - 94%.
Образование 2(3H)-бензотиазолонона в этой реакции, вероятно, происходит в результате циклизации первоначально образующегося метил N-(2-тиофенил)карбамата и последующего отщепления алкоксигруппы при содействии кислоты Льюиса, роль которой выполняет ацетат цинка.
Структура соединения (II) подтверждается методами ИК и ЯМР 1Н спектроскопии, масс-спектрометрии, а также согласуется с дальнейшими его химическими превращениями.
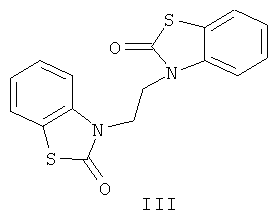
На основе соединения (II) получены новые N-замещенные алкил- и ацил-производные (III, IV).
3-2-[2-Оксо-1,3-бензотиазол-3(2H)-ил]этил-1,3-бензотиазол-2(3H)-он (III) получен алкилированием 2(3H)-бензотиазолона (II) 1,2-дибромэтаном в ацетоне в присутствии карбоната калия (пример 3).
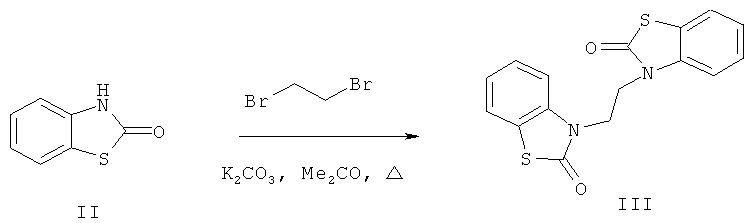
Протекание реакции по атому азота 2(3H)-бензотиазолона (II) подтверждено данными ИК, ЯМР 1Н спектроскопии, масс-спектрометрии и элементного анализа.
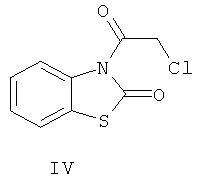
Ацилирование 2(3H)-бензотиазола (II) хлорангидридом монохлоруксусной кислоты при кипячении в бензоле в течение 10 ч приводит к образованию 3-(2-хлорацетил)-1,3-бензотиазол-2(3H)-она(IV) (пример 4).
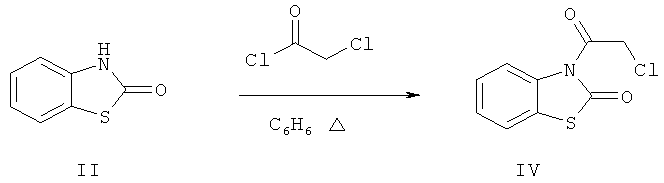
В ИК-спектрах продуктов алкилирования (III) и ацилирования (IV) присутствуют полосы поглощения в области 1662-1672 см-1, обусловленные валентными колебаниями карбонильной группы, что свидетельствует в пользу протекания реакций по атому азота соединения (II).
Пример 1.
Бис-(2,2'-диметоксикарбоксамидо)фенилдисульфид (I). К раствору 10.7 мл (0.1 моль) 2-аминотиофенола в 46 мл безводного пиридина добавляли по каплям при перемешивании и наружном охлаждении льдом 7.7 мл (0.1 моль) метилхлорформиата, защищая реакционную массу от влаги воздуха. Реакционную смесь после добавления всего количества метилхлорформиата перемешивали при охлаждении 0.5 ч, оставляли при комнатной температуре на 13 ч, выливали на лед и осторожно подкисляли концентрированной соляной кислотой до кислой реакции среды (по конго). Раствор обрабатывали (4×25 мл) этилацетатом, органический слой промывали насыщенным водным раствором хлорида натрия (100 мл), водой (2×50 мл), сушили сульфатом магния, растворитель удаляли в вакууме, к остатку добавляли 50 мл эфира и помещали в холодильный шкаф на 24 ч. Выпавший кристаллический продукт отфильтровывали и перекристаллизовывали из метанола. Получили 28.8 г (79%) соединения (I), бесцветные кристаллы, т.пл. 105-108°С (из метанола). ИК-спектр, ν, см-1: 3380 (NH), 2836-3108 (С-Н), 1740 (С=О), 1620, 1580 (С=С, 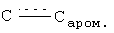 ). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 3.680 с (6Н, 2NHCO2
Me), 7.210 т (2Н, Наром., J 8.0 Гц), 7.287 т (2Н, Наром., J 8.0 Гц), 7.332 д (2Н, Наром., J 8.0 Гц), 7.540 д (2Н, Наром., J 8.0 Гц), 9.150 уш. с (2Н, 2NH). m/z (I,%): 364 [М]+ (55), 332 (11), 306 (4), 182 (57), 166 (2), 150 (100), 136 (2.5), 124 (22), 106 (6), 96 (18), 77 (7). Найдено, %: С 52.57; Н 4.38; N 7.39. C16H16N2O4S2. Вычислено, %: С 52.75; Н 4.40; N 7.69.
). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 3.680 с (6Н, 2NHCO2
Me), 7.210 т (2Н, Наром., J 8.0 Гц), 7.287 т (2Н, Наром., J 8.0 Гц), 7.332 д (2Н, Наром., J 8.0 Гц), 7.540 д (2Н, Наром., J 8.0 Гц), 9.150 уш. с (2Н, 2NH). m/z (I,%): 364 [М]+ (55), 332 (11), 306 (4), 182 (57), 166 (2), 150 (100), 136 (2.5), 124 (22), 106 (6), 96 (18), 77 (7). Найдено, %: С 52.57; Н 4.38; N 7.39. C16H16N2O4S2. Вычислено, %: С 52.75; Н 4.40; N 7.69.
Пример 2.
2(3Н)-Бензотиазолон (II). Кипятили в течение 7 ч смесь 4 г (0.011 моль) бис-(2,2'-диметоксикарбоксамидо)фенилдисульфида (I), 10 г (0.16 моль) цинковой пыли в 10 мл ледяной уксусной кислоте при перемешивании, добавляли 2 мл концентрированной соляной кислоты и кипятили еще 0.5 ч, отфильтровывали от солей и фильтрат выливали в 100 мл воды. Выпавший осадок отфильтровывали, промывали на фильтре разбавленной (1:1) соляной кислотой (50 мл), водой (100 мл), сушили на воздухе и перекристаллизовывали из этанола. Получили 1.56 г (94%) соединения (II), бесцветные кристаллы, т.пл. 138-140°С (из этанола). ИК-спектр, ν, см-1: 3400-3500 (NH, ОН), 1662 (С=О), 1592, 1460 (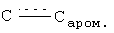 ). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 7.127 т (2Н, Наром., J 8.0 Гц), 7.257-7.298, 7.547-7.574 м (2Н, Наром.), 11.851 уш. с (1Н, NH). m/z (I, %): 151 (100), 123 (64), 109 (1.4), 96 (60). Найдено, %: С 55.58; Н 3.27; N 9.13. C7H5NOS. Вычислено, %: С 55.63; Н 3.31; N 9.27.
). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 7.127 т (2Н, Наром., J 8.0 Гц), 7.257-7.298, 7.547-7.574 м (2Н, Наром.), 11.851 уш. с (1Н, NH). m/z (I, %): 151 (100), 123 (64), 109 (1.4), 96 (60). Найдено, %: С 55.58; Н 3.27; N 9.13. C7H5NOS. Вычислено, %: С 55.63; Н 3.31; N 9.27.
Пример 3.
3-2-[2-Оксо-1,3-бензотиазол-3(2Н)-ил]этил-1,3-бензотиазол-2(3Н)-он (III). Смесь 1.51 г (10 ммоль) 2(3Н)-бензотиазолона (II) 0.43 мл (5 ммоль) свежеперегнанного 1,2-дибромэтана, 1.38 г (10 ммоль) безводного карбоната калия и 7 мл ацетона нагревали 6 ч при 70°С, охлаждали, разбавляли водой (25 мл) и обрабатывали диэтиловым эфиром (3×25 мл). Экстракт промывали 10%-ным водным раствором гидроксида натрия (100 мл), водой (50 мл) и сушили карбонатом калия. Растворитель удаляли, остаток кристаллизовался. Перекристаллизацией из метанола получали 1.44 г (88%) бесцветного кристаллического соединения (III), т.пл. 242-243°С. ИК-спектр, ν, см-1: 1672 (С=O), 1584, 1467 (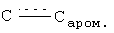 ). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 4.282 с (4Н, 2СН2), 7.158 т (4Н, Наром., J 7.5 Гц), 7.277 т (2Н, Наром., J 7.5 Гц). 7.589 д (2Н, Наром., J 7.5 Гц), m/z (I, %): 328 (51), 177 (100), 164 (20), 149 (45.7), 109 (90), 77 (15.7). Найдено, %: С 58.43; Н 3.58; N 8.50. C16H12N2O2S2. Вычислено, %: С 58.54; Н 3.66; N 8.54.
). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 4.282 с (4Н, 2СН2), 7.158 т (4Н, Наром., J 7.5 Гц), 7.277 т (2Н, Наром., J 7.5 Гц). 7.589 д (2Н, Наром., J 7.5 Гц), m/z (I, %): 328 (51), 177 (100), 164 (20), 149 (45.7), 109 (90), 77 (15.7). Найдено, %: С 58.43; Н 3.58; N 8.50. C16H12N2O2S2. Вычислено, %: С 58.54; Н 3.66; N 8.54.
Пример 4.
3-(2-Хлорацетил)-1,3-бензотиазол-2(3H)-он (IV). Смесь 1.51 г (10 ммоль) 2(3H)-бензотиазолона (II), 0.8 мл (10.5 ммоль) хлорацетилхлорида и 5 мл безводного бензола кипятили 10 ч. Продукт промывали 2%-ным водным раствором гидроксида натрия, экстрагировали бензолом (2×15 мл). Объединенные экстракты промывали водой, сушили безводным хлоридом кальция. Получили 1.8 г (79%) соединения (IV), бесцветные кристаллы, т.пл. 111-114°С (из хлороформа). ИК-спектр, ν, см-1: 1665 (С=О), 1595, 1580, 1465 (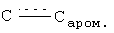 ), 835 (С-Сl). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 4.252 с (2Н, СН2), 7.122 т (1Н, Наром., J 8.0 Гц), 7.371 д (1Н, Наром., J 8.0 Гц), 7.410 д. т (1Н, Наром., J 8.0, 35.0 Гц), 8.283 д (1Н, Наром., J 8.0 Гц), m/z (I, %): 229 (15.7), 227 (48.6), 152 (30.3), 151 (100), 123 (68.6), 77 (41.4). Найдено, %: С 47.37; Н 2.55; N 6.08. C9H6ClNO2S. Вычислено, %: С 47.47; Н 2.64; N 6.15.
), 835 (С-Сl). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 4.252 с (2Н, СН2), 7.122 т (1Н, Наром., J 8.0 Гц), 7.371 д (1Н, Наром., J 8.0 Гц), 7.410 д. т (1Н, Наром., J 8.0, 35.0 Гц), 8.283 д (1Н, Наром., J 8.0 Гц), m/z (I, %): 229 (15.7), 227 (48.6), 152 (30.3), 151 (100), 123 (68.6), 77 (41.4). Найдено, %: С 47.37; Н 2.55; N 6.08. C9H6ClNO2S. Вычислено, %: С 47.47; Н 2.64; N 6.15.
Цитируемая литература
1. Elderfield R.C., Short F.W, J. Org. Chem., 1952, 17, 758-763.
2. Erlenmeyer Н., Buchmann P., Schenkel Н., Helv. Chim. Acta, 1944, 27, 1432.
3. Fife H.T., Hutchins J.E.C, Wang M.S., J. Am. Chem. Soc., 1975, 97, 5878.
4. Tanabe Yo., Okabe Т., Kakimuzu A., Ohno N., Yoshioka Н., Bull. Chem. Soc. Jpn., 1983, 53, 1255.
5. Рамазанова П.А., Вагабов М.В., Тараканова А.В., Ахмедов Н.Г, Анисимов А.В., Вести. Моск. ун-та, 2000, 41, 119.
6. Sridhar R., Perumal P.T., Synth. Comm., 2004, 34, 735.
7. El-Hamouly W.S., Amine K.M., Abbas E.M.H., Abdel-Maguid E.A., Taibah Int. Chem. Conf. - 2009, March 23-25, 2009 Al-Madinah Al-Munawwarach, Saudi Arabia, p.568.
8. Şafak C., Erdoğan Н., Palaska E., Sunal R., Duru S., J. Med. Chem., 1992, 35, 1296.
9. Doğruer S.D., Ünlü S., Şahin M.F., Yeşilada E., I1 Farmaco, 1998, 53, 80.
10. Loos D., Sidoova E., Sutoris V., Molecules, 1999, 4, 81.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2(3Н)-БЕНЗОТИАЗОЛОНОВ С КАРБАМАТНОЙ ФУНКЦИЕЙ ПРИ C | 2011 |
|
RU2461552C1 |
| 4-ЗАМЕЩЕННЫЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФЛУОРЕСЦЕНТНЫХ СЕНСОРОВ НА КАТИОНЫ МЕТАЛЛОВ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2515195C1 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, СОЕДИНЕНИЯ, КОМПЛЕКСНЫЙ МЕТАЛЛООРГАНИЧЕСКИЙ КАТАЛИЗАТОР | 2012 |
|
RU2652807C2 |
| ПРОИЗВОДНЫЕ ТЕТРАЗОЛА | 1992 |
|
RU2091376C1 |
| Производные 2,3-дигидро-1Н-индола, обладающие свойствами лигандов мелатониновых рецепторов, способ получения и применение | 2017 |
|
RU2692239C2 |
| ДУШИСТЫЕ 3,6-ДИАЗАГОМОАДАМАНТАН-9-ОНЫ | 2014 |
|
RU2559051C1 |
| СОЕДИНЕНИЯ БЕНЗОТИАЗОЛОНА, СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ, А ТАКЖЕ СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2172313C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛЕНОВЫХ ПРОИЗВОДНЫХ ХРОМАНА ИЛИ ТИОХРОМАНА | 1990 |
|
RU2015969C1 |
Изобретение относится к способу получения 2(3H)-бензотиазолона. Способ осуществляют путем кипячения бис-(2,2'-диметоксикарбоксамидо)-фенилдисульфида с цинковой пылью в течение 7,5 часов в ледяной уксусной кислоте с последующим отделением солей цинка, разбавления фильтрата ледяной водой, фильтрования кристаллического продукта и его промывания разбавленной НСl (1:1), водой и последующей сушки на воздухе и перекристаллизации из этанола. Также изобретение относится к способу получения 3-2-[2-оксо-1,3-бензотиазол-3(2H)-ил]этил-1,3-бензотиазол-2(3H)-она. Способ осуществляют путем кипячения 2(3H)-бензотиазолона с 1,2-дибромэтаном в ацетоне в присутствии К2СО3. Затем добавляют воду и обрабатывают смесь диэтиловым эфиром с последующим промыванием органической фазы 10%-ным водным раствором NaOH, водой, сушкой безводным карбонатом калия, удалением растворителя и перекристаллизацией из метанола. Изобретение относится к способу получения 3-(2-хлорацетил)-1,3-бензотиазол-2(3H)-она. Способ осуществляют путем кипячения 2(3H)-бензотиазолона в безводном бензоле с хлорацетилхлоридом в течение 10 ч, затем промывают охлажденную реакционную массу 2%-ным водным раствором NaOH, экстрагируют бензолом, промывают объединенные экстракты водой, осушают безводным хлоридом кальция и удаляют растворитель, с последующей перекристаллизацией из хлороформа. Технический результат - усовершенствованные способы получения производных 2(3H)-бензотиазолона. 3 н.п. ф-лы.
1. Способ получения 2(3H)-бензотиазолона (II), заключающийся в кипячении исходного бис-(2,2'-диметоксикарбоксамидо)фенилдисульфида (I) с цинковой пылью в течение 7,5 ч в ледяной уксусной кислоте, отделении солей цинка, разбавлении фильтрата ледяной водой, фильтровании кристаллического продукта и его промывании разбавленной HCl (1:1), водой и последующей сушке на воздухе и перекристаллизации из этанола.
2. Способ получения 3-2-[2-оксо-1,3-бензотиазол-3(2H)-ил]этил-1,3-бензотиазол-2(3H)-она (III), заключающийся в кипячении 2(3H)-бензотиазолона (II) с 1,2-дибромэтаном в ацетоне в присутствии К2СО3, добавлении воды, обработке смеси диэтиловым эфиром, промывании органической фазы 10%-ным водным раствором NaOH, водой, сушке безводным карбонатом калия, удалении растворителя и перекристаллизации из метанола.
3. Способ получения 3-(2-хлорацетил)-1,3-бензотиазол-2(3H)-она (IV), заключающийся в кипячении 2(3H)-бензотиазолона (II) в безводном бензоле с хлорацетилхлоридом в течение 10 ч, промывании охлажденной реакционной массы 2%-ным водным раствором NaOH, экстрагировании бензолом, промывке объединенных экстрактов водой, сушке безводным хлоридом кальция, удалении растворителя и перекристаллизации из хлороформа.
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| ZINNER H., NIMMICH W | |||
| Benzazoles | |||
| XIV | |||
| Alkylation, acylation and hydroxymethylation of benzothiazolone | |||
| JOURNAL FUER PRAKTISHE CHEMIE, vol.14, 1961, p.139-149 | |||
| ОЛИМОВА М.И | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| УЗБЕКСКИЙ ХИМИЧЕСКИЙ | |||
Авторы
Даты
2011-12-10—Публикация
2010-04-09—Подача