Изобретение относится к химической промышленности, к продуктам малотоннажной химии, а именно 2(3H)-бензотиазолону с карбаматной функцией при С6 и некоторым его производным.
Замещенные производные 2(3H)-бензотиазолонов обладают широким спектром биологической активности. Среди них найдены соединения с высокой гербицидной [Патент Великобритании №966,496, Патенты США №4,971,619, №4,824,465], антимикробной [El-Hamouly W.S., Amine K.M., Abbas E.M.H., Abdel-Maguid E.A., Taibah Int. Chem. Conf. - 2009, March 23-25, 2009 Al-Madinah Al-Munawwarach, Saudi Arabia, p.568-569], анальгетической [Şafak C., Erdoğan H., Palaska E., Sunal R., Duru S., J. Med. Chem., 1992, 35, 1296-1299], противовоспалительной [Doğruer S.D., Ünlü S., Şahin M.F., Yeşilada E., Il Farmaco, 1998, 53, 80-84], антифунгицидной [Патент Германии №2,924,712, Патент США №4,293,702], росторегулирующей [Loos D., Sidoova E., Sutoris V., Molecules, 1999, 4, 81-93] и другими видами активности. Они также служат в качестве ценных прекурсоров в синтезе новых функционально замещенных соединений.
Известен ряд методов получения 2(3H)-бензотиазолононов: (1) циклизацией 2-аминотиофенолов фосгеном, хлоркарбонатами [Elderfield R.C., Short F.W., J. Org. Chem., 1952, 17, 758-763, Erlenmeyer H., Buchmann P., Schenkel H., Helv. Chim. Acta, 1944, 27, 1432] и мочевиной [Fife Н.Т., Hutchins J.E.C., Wang M.S., J. Am. Chem. Soc., 1975, 97, 5878-5882]; (2) восстановительным карбонилированием замещенных нитробензолов с использованием серы, монооксида углерода и воды в присутствии оснований [Патент Великобритании №966496], (3) циклизацией тиокарбаматов с последующим расщеплением образующихся 2-алкоксибензотиазолов [Fife Т.Н., Hutchins J.E.C., Wang M.S., J. Am. Chem. Soc., 1975, 97, 5878-5882], (4) окислением 2-меркаптобензотиазолов или бензотиазолилалкилтиоэфиров с получением 2-сульфонил- или 2-алкилсульфонилбензотиазолов и последующим их гидролизом [Tanabe Yo., Okabe Т., Kakimuzu A., Ohno N., Yoshioka H., Bull. Chem. Soc. Jpn., 1983, 53, 1255-1256, Рамазанова П.А., Вагабов М.В., Тараканова А.В., Ахмедов Н.Г., Анисимов А.В., Вестн. Моск. ун-та, 2000, 41, 119-120]; (5) реакцией о-нитрохлорбензолов с тиогликолевой кислотой и последующей циклоконденсацией о-нитрофенилтиоуксусной кислоты уксусным ангидридом, а затем деацилированием [Elderfield R.C., Short F.W., J. Org. Chem., 1952, 17, 758-763]; (6) реакцией 2-аминобензотиазолов с гидроксидами щелочных металлов в безводной среде и циклизацией образующихся о-меркаптофенилмочевин [Патенты США №5,594,145, №4,429,134]; (7) реакцией тиосалициловой кислоты с азидом аммония и тремя эквивалентами комплекса ДМФА-POCl3 [Sridhar R., Perumal Р.Т., Synth. Comm., 2004, 34, 735].
Описано получение 3-замещенных 2(3H)-бензотиазолонов нитрозированием 3-замещенных 2(3H)-иминобензотиазолов в системе ксилол-хлороводородная кислота (Патент EP №0622361 A1).
Предлагается способ получения 2(3H)-бензотиазолона с карбаматной функцией при С6 (I) и его 5-хлорпроизводного (II), заключающийся в выдержке эквимолярных количеств N,N'-диметоксикарбонил-1,4-бензохинондиимина (или 2-хлоро-N,N'-диметоксикарбонил-1,4-бензохинондиимина) (Максимова Т.Н., Великородов А.В. ЖОрХ. 1986, 22, 1092) и тиоуксусной кислоты в метиленхлориде 3 ч при комнатной температуре, фильтровании кристаллического продукта, промывке его диэтиловым эфиром и в последующем кипячении 5 ч в этаноле в присутствии концентрированной HCl, выливании массы в ледяную воду, фильтровании кристаллического продукта, промывке его водой, сушке на воздухе и перекристаллизации из диоксана.
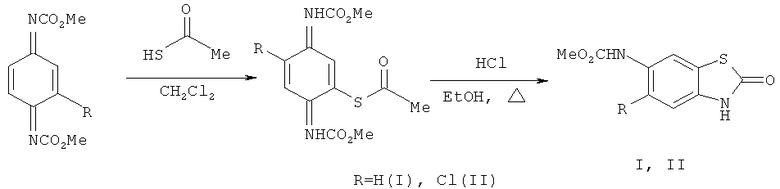
Взаимодействие N,N'-диметоксикарбонил-1,4-бензохинондиимина (или 2-хлор-N,N'-диметоксикарбонил-1,4-бензохинондиимина) с тиоуксусной кислотой в метиленхлориде при комнатной температуре протекает как реакция 1,4-присоединения по системе сопряженных связей N=C-C=C с образованием продуктов ароматической структуры, которые при кипячении в этаноле в присутствии HCl подвергаются гетероциклизации с образованием соединений (I, II).
Гетероциклизация вероятно происходит посредством нуклеофильной атаки атомом азота карбаматной группы по карбонильному атому углерода с элиминированием метилацетата.
Структура соединений (I, II) подтверждена ИК, ЯМР 1H спектрами.
Пример 1.
Метил-N-(2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамат (I). К раствору 1.1 г (5 ммоль) N,N'-диметоксикарбонил-1,4-бензохинондиимина в 10 мл метиленхлорида добавляли 0.36 мл (5 ммоль) тиоуксусной кислоты и смесь выдерживали при комнатной температуре 3 ч. Выпавший кристаллический продукт отфильтровывали, промывали на фильтре диэтиловым эфиром (5 мл). Смесь 0.8 г (2.7 ммоль) вышеполученного аддукта 1,4-присоединения, 1 мл концентрированной соляной кислоты в 10 мл этанола кипятили 5 ч, выливали в 50 мл ледяной воды, выпавший осадок отфильтровывали, промывали водой, сушили на воздухе и перекристаллизовывали из диоксана. Выход 0.54 г (90%), бесцветные кристаллы, т.пл. 256-258°C. ИК спектр, ν, см-1: 3300-3340 (NH), 2845-3120 (CH), 1725, 1710 (C=O), 1615, 1565, 1535 ( аром.). Спектр ЯМР 1H, δ, м.д.: 3.68 с (3H, NHCO2
Me), 7.03 д (1H, Наром., J 8.7 Гц), 7.27 д (1H, Hаром., J 8.7 Гц), 7.68 с (1H, Hаром.), 9.65 уш. с (1H, NH), 11.73 уш. с (1H, NH). Масс-спектр, m/z (I, %): 226 (5) [М+2], 225 (10) [M+1], 224 (100) [M]+, 192 (73.8), 164 (40), 137 (92.5), 125 (20), 119 (12.5), 110 (23.8), 93 (15), 83 (21.3), 79 (47.5), 69 (23.8), 59 (86.3), 52 (78.8). Найдено, %: C 47.98; H 3.55; N 12.28. C9H8N2O3S. Вычислено, %: C 48.21; H 3.57; N 12.50.
аром.). Спектр ЯМР 1H, δ, м.д.: 3.68 с (3H, NHCO2
Me), 7.03 д (1H, Наром., J 8.7 Гц), 7.27 д (1H, Hаром., J 8.7 Гц), 7.68 с (1H, Hаром.), 9.65 уш. с (1H, NH), 11.73 уш. с (1H, NH). Масс-спектр, m/z (I, %): 226 (5) [М+2], 225 (10) [M+1], 224 (100) [M]+, 192 (73.8), 164 (40), 137 (92.5), 125 (20), 119 (12.5), 110 (23.8), 93 (15), 83 (21.3), 79 (47.5), 69 (23.8), 59 (86.3), 52 (78.8). Найдено, %: C 47.98; H 3.55; N 12.28. C9H8N2O3S. Вычислено, %: C 48.21; H 3.57; N 12.50.
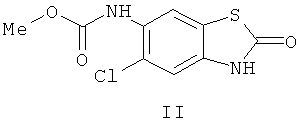
Пример 2. Метил - N-(5-хлоро-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамат (II). К раствору 1.28 г (5 ммоль) 2-хлор-N,N'-диметоксикарбонил-1,4-бензохинондиимина в 10 мл метиленхлорида добавляли 0.36 мл (5 ммоль) тиоуксусной кислоты и смесь выдерживали при комнатной температуре 3 ч. Выпавший кристаллический продукт отфильтровывали, промывали на фильтре диэтиловым эфиром (5 мл). Смесь 0.9 г (2.7 ммоль) вышеполученного аддукта 1,4-присоединения, 1 мл концентрированной соляной кислоты в 10 мл этанола кипятили 5 ч, выливали в 50 мл ледяной воды, выпавший осадок отфильтровывали, промывали водой, сушили на воздухе и перекристаллизовывали из диоксана. Выход 0.6 г (87%), бесцветные кристаллы, т.пл. 242-245°C. Спектр ЯМР 1H, δ, м.д.: 3.73 с (3H, NHCO2 Me), 7.51 с (1H, Наром.), 7.62 с (1H, Hаром.), 9.13 с (1H, NHCO2Me), 12.01 с (1H, NH). Найдено, %: C 41.55; H 2.57; N 10.67. C9H7ClN2O3S. Вычислено, %: C 41.70; H 2.70; N 10.81.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2(3Н)-БЕНЗОТИАЗОЛОНА И НЕКОТОРЫХ ПРОИЗВОДНЫХ НА ЕГО ОСНОВЕ | 2010 |
|
RU2435765C1 |
| СОЕДИНЕНИЯ БЕНЗОТИАЗОЛОНА, СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ, А ТАКЖЕ СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2172313C2 |
| ПРОЛЕКАРСТВА 3-АЦИЛ-2-ОКСИНДОЛ-1-КАРБОКСАМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124514C1 |
| АМИНОСОЕДИНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ НОВЫХ ПРОИЗВОДНЫХ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СОЛЕЙ | 1996 |
|
RU2171252C2 |
| ПРОИЗВОДНЫЕ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СОЛИ И АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО | 1996 |
|
RU2167873C2 |
| ТРИЦИКЛИЧЕСКИЕ ДИКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1995 |
|
RU2145606C1 |
| СПИРОСОЕДИНЕНИЕ ИЛИ ЕГО СОЛИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2094432C1 |
| НОВОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ И ЕГО ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 2007 |
|
RU2434868C2 |
| ПРОИЗВОДНЫЕ ПИРАЗИНА ИЛИ ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЕ СОЕДИНЕНИЯ, И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2297414C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИН- ИЛИ НАФТИРИДИНКАРБОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2120940C1 |
Изобретение относится к способу получения метил-N-(2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамата формулы (I) и метил-N-(5-хлоро-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамата формулы (II). Способ осуществляют путем выдерживания эквимолярных количеств N,N'-диметоксикарбонил-1,4-бензохинондиимина (или 2-хлоро-N,N'-диметоксикарбонил-1,4-бензохинондиимина для получения метил-N-(5-хлоро-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамата) и тиоуксусной кислоты в метиленхлориде в течение 3 ч при комнатной температуре, фильтрования полученного кристаллического продукта, промывки его диэтиловым эфиром и дальнейшего его кипячения в течение 5 ч в этаноле в присутствии концентрированной HCl. Полученную массу выливают в ледяную воду, кристаллический продукт фильтруют, промывают водой, сушат на воздухе и перекристаллизовывают из диоксана. 2 н.п. ф-лы, 2 пр.
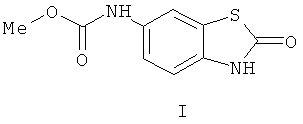
1. Способ получения метил-N-(2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамата (I), заключающийся в выдержке эквимолярных количеств N,N'-диметоксикарбонил-1,4-бензохинондиимина и тиоуксусной кислоты в метиленхлориде 3 ч при комнатной температуре, фильтровании кристаллического продукта, промывке его диэтиловым эфиром и в последующем кипячении 5 ч в этаноле в присутствии концентрированной HCl, выливании массы в ледяную воду, фильтровании кристаллического продукта, промывке его водой, сушке на воздухе и перекристаллизации из диоксана

2. Способ получения метил-N-(5-хлоро-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбамата (II), заключающийся в выдержке эквимолярных количеств 2-хлоро-N,N'-диметоксикарбонил-1,4-бензохинондиимина и тиоуксусной кислоты в метиленхлориде 3 ч при комнатной температуре, фильтровании кристаллического продукта, промывке его диэтиловым эфиром и в последующем кипячении 5 ч в этаноле в присутствии концентрированной HCl, выливании массы в ледяную воду, фильтровании кристаллического продукта, промывке его водой, сушке на воздухе и перекристаллизации из диоксана

| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| ПРОИЗВОДНЫЕ УРАЦИЛА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С СОРНЯКАМИ | 1990 |
|
RU2029472C1 |
Авторы
Даты
2012-09-20—Публикация
2011-05-16—Подача