Изобретение относится к органической химии, а именно к способу получения 3β,28-дигидроксилупана формулы (I):
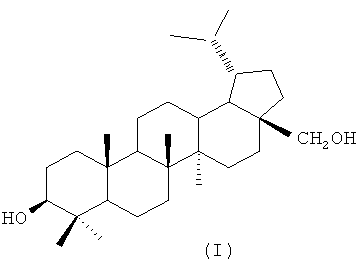
3β,28-Дигидроксилупан (дигидробетулин) и ряд его полусинтетических производных проявляют выраженную противовирусную и противоопухолевую активность [Sun I.-C., Wang H.-K., Kashiwada Y., Shen J.-K., Cosentino L.M., Chen C.-H., Yang L.-M., Lee K.-H. Anti-AIDS agents. 34. Synthesis and structure-activity relationships of betulin derivatives as anti-HIV agents. // J. Med. Chem., 1998, V. 41, p.4648-4657; Koohang A., Majewski N.D., Szotek E.L., Mar A.A., Eiznhamer D.A., Flavin M.Т., Xu Z.-Q. Synthesis and cytotoxicity of 2-cyano-28-hydroxy-lup-1-en-3-ones. // Bioorg. Med. Chem. Lett., 2009, V.19, р.2168-2171]. Отмечается, что в сериях производных 3β,28-дигидроксилупана противовирусная (анти-ВИЧ) и иммуностимулирующая активность соединений превышает таковую у аналогичных производных 3β,28-дигидрокси-20(29)-лупена (бетулина) [Dzhemilev U.M., Tolstikov G.A., Pokrovsky A.G., Salakhutdinov N.F., Tolstikova T.G., Shults E.E. N′-{N[3-Oxo-lupen-28-oyl-9-aminononanoyl]}-3-amino-3-phenylpropeonic acid and the pharmaceutically acceptable derivatives thereof, a method for the production and the use thereof in the form of a medicinal agent. WO 2008/054250, 8.05.2008], то есть они более перспективны для разработки новых лекарственных препаратов.
Известные методы получения 3β,28-дигидроксилупана основаны на восстановлении изопропенильной группы 3β,28-дигидрокси-20(29)-лупена (бетулина) газообразным водородом в присутствии катализаторов или водородом, получаемым in situ. В свою очередь, бетулин широко распространен в природе, легко извлекается из растительного сырья [Cinta Pinzaru S., Leopold N., Kiefer W. Vibrational spectroscopy of betulinic acid HIV inhibitor and of its birch bark natural source. // Talanta, 2002, Vol.57, p.625-631; Hayek E.W.H., Jordis U., Moche W., Sauter F. A bicentennial of betulin. // Phytochemistry, 1989, Vol.28, No.9, p.2229-2242], поэтому служит надежным источником для получения дигидробетулина.
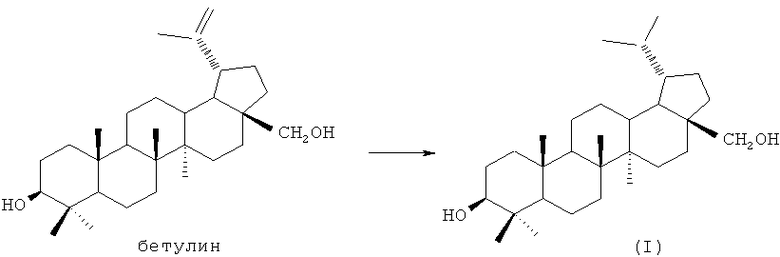
Способы получения 3β,28-дигидроксилупана путем восстановления 3β,28-дигидрокси-20(29)-лупена (бетулина) газообразным водородом отличаются типом применяемого катализатора и условиями реакций. Восстановление 3β,28-дигидрокси-20(29)-лупена газообразным водородом с использованием катализатора никеля Ренея (Ni-Raney) проводили в среде этанола при 80-100°С и 400 атм, выход 60% [Monato S.B., Banerjee S.K., Chakavarti R.N. Reaction of Raney nickel with triterpenoids. // Bull. Calcutta Sch. Trop. Med., 1968, V.16, p.122-125]. Восстановление 3β, 28-дигидрокси-20(29)-лупена газообразным водородом с использованием катализатора палладия на угле (10% Pd/C) проводили в среде метанола при комнатной температуре и при 1 атм, выход 60% [Evers М., Poujade С., Soler F., Ribeill Y., James C., Lelievre Y., Gueguen J.-C., Reisdorf D., Morize I., Pauwels R., De Clercq E., Henin Y., Bousseau A., Mayaux J.-F., Le Pecq J.-B., Dereu N. Betulinic acid derivatives: a new class of human immunodeficiency virus type 1 specific inhibitors with a new mode of action. // J. Med. Chem., 1996, V.39, p.1056-1068]. Восстановление 3β,28-дигидрокси-20(29)-лупена газообразным водородом с использованием катализатора оксида платины (PtO2) проводили в среде этилацетат-уксусная кислота при комнатной температуре в течение 20 ч, выход 53% [Suokas E.; Hase Т. Triterpenes. The synthesis of novel 18βH,19β-substituted lupane derivatives. // Acta Chem. Scand., Ser. B, 1974, V.28, p.793-796]. К методу получения 3β, 28-дигидроксилупана путем восстановления 3β, 28-дигидрокси-20(29)-лупена водородом, получаемым in situ, относится использование амальгамы цинка в смеси уксусной и соляной кислот при комнатной температуре, выход 60% [Bilham Р., Kon G. A.R., Ross W.C.J. Sapogenins XII. The position of the carboxyl group in certain triterpene acids. // J. Chem. Soc., 1942, V.36, p.35-42].
Недостатками известных методов получения 3β,28-дигидроксилупана являются:
- использование дорогостоящих катализаторов (PtO2, Pd/C, Ni-Raney), газообразного водорода, требование специальной подготовки процессов; в отдельных случаях необходимы высокие температура и давление, длительное время протекания реакции, неудовлетворительные выходы, необходимость специального оснащения (автоклав);
- использование амальгамы цинка неэффективно с точки зрения экологии.
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке способа получения 3β,28-дигидроксилупана более простым и дешевым способом.
В заявленном способе восстановление 3β,28-дигидрокси-20(29)-лупена (бетулина) до 3β,28-дигидроксилупана (дигидробетулина) проводят дибораном В2Н6, получаемым in situ взаимодействием NaBH4 и BF3·Et2O [метод получения диборана приводится в работе Dunkelblum E. The reaction of diphenylcyclopropenone with diborane. // Tetrahedron, 1972, V.28, p.3879-3883], при мольном соотношении 3β,28-дигидрокси-20(29)-лупен:диборан, равном 1:5 в тетрагидрофуране при температуре 65°С в течение 4 ч, выход 78%.
Сущность изобретения состоит в следующем. 3β,28-Дигидрокси-20(29)-лупен, полученный путем экстракции бересты водным изопропанолом в соответствии с [Флехтер О.Б., Карачурина Л.Т., Нигматуллина Л.Р., Сапожникова Т.А., Балтина Л.А., Зарудий Ф.С., Галин Ф.З., Спирихин Л.В., Толстиков Г.А., Плясунова О.А., Покровский А.Г. Синтез и фармакологическая активность диникотината бетулина. // Биоорган. химия, 2002, Т.28, №6, с.543-550], суспендируют в тетрагидрофуране при комнатной температуре, добавляют NaBH4 и прикапывают BF3·Et2O в атмосфере аргона с тем, чтобы мольное соотношение 3β,28-дигидрокси-20(29)-лупен:диборан составляло 1:5, реакционную массу кипятят при 65°С в течение 4 ч (ТСХ-контроль), затем выливают в подщелоченную воду, осадок промывают водой до нейтральной среды. Осадок высушивают на воздухе и перекристаллизовывают из этанола, получают 3β,28-дигидроксилупан с выходом 78%.
Таким образом, предложен способ получения 3β, 28-дигидроксилупана, имеющий следующие преимущества перед известными методами: использование в качестве восстановителя диборана и проведение реакции при атмосферном давлении упрощает процесс получения целевого продукта и исключает необходимость использования специального оборудования. Предлагаемый метод позволяет проводитьэкспериментальную наработку 3β,28-дигидроксилупана в дециграммовых и более количествах, экономит время, сокращает стоимость материальных затрат.
Пример.
К суспензии 1 г (2 ммоль) 3β,28-дигидрокси-20(29)-лупена (бетулина), полученного как приведено выше, в 50 мл тетрагидрофурана в атмосфере аргона добавляют 0.4 г NaBH4 (10.6 ммоль) и при интенсивном перемешивании прикапывают 4 мл BF3·Et2O (32.3 ммоль) в 10 мл тетрагидрофурана, кипятят 4 ч с обратным холодильником. Реакционную массу выливают в 200 мл 2М раствора NaOH, осадок отфильтровывают, промывают водой, сушат на воздухе и перекристаллизовывают из этанола. Выход 3.5 г (78%). Т.пл. 265°С (этанол); [α]D 20 - 3° (с 0.09, СН3ОН). Литер.: 248-250°С; [α]D 20 - 11.6° (с 0.5, CHCl3) [Sun I.-C., Wang H.-K., Kashiwada Y., Shen J.-K., Cosentino L. M., Chen C.-H., Yang L.-M., Lee K.-H. Anti-AIDS agents. 34. Synthesis and structure-activity relationships of betulin derivatives as anti-HIV agents. // J. Med. Chem., 1998, V.41, p.4648-4657]. Спектр ЯМР1 (CD3OD, δ, м.д.): 0.75, 0.78, 0.84, 0.86, 0.88, 0.94, 1.04 (7 с, 21Н, 7СН3), 1.15-1.91 (м, 28Н, CH2, CH), 3.21-3.28 (1Н, м, Н3), 3.32 и 3.78 (оба д, по 1H, Н28, J 11.0 Гц). Спектр ЯМР13С (CDCl3, δ, м.д.): 14.6, 14.9, 16.0, 16.5, 18.2, 20.8, 21.6, 22.9, 23.5, 23.7, 26.8, 26.9, 27.9, 29.4, 29.8, 34.2, 34.6, 36.8, 37.1, 37.8, 38.4, 40.9, 42.8, 44.5, 46.4, 48.1, 50.0, 55.3, 60.7 (С28), 78.9 (С3).
| название | год | авторы | номер документа |
|---|---|---|---|
| Гибридное производное лупанового тритерпеноида и галловой кислоты, содержащее 1,2,3-триазольный линкер, обладающее антиоксидантной и противовоспалительной активностью | 2023 |
|
RU2811236C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОРОНОВОЙ КИСЛОТЫ | 2011 |
|
RU2472803C1 |
| СПОСОБ РАСКРЫТИЯ ТЕТРАГИДРОФУРАНОВОГО КОЛЬЦА АЛЛОБЕТУЛИНА | 2009 |
|
RU2402560C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2686100C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛОБЕТУЛИНА | 2009 |
|
RU2402561C1 |
| АДАПТОГЕННОЕ СРЕДСТВО | 2003 |
|
RU2240799C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ И УРСАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ШИСТОСОМОЗА | 2013 |
|
RU2576658C2 |
| МЕТИЛОВЫЙ ЭФИР 24-ДИБРОМ-4-ОКСО-2-ЦИАНО-3,23-ДИНОРЛУП-28-ОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2022 |
|
RU2784317C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5α,22α-ДИГИДРОКСИ-ГИПСОГЕНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК RHODOCOCCUS RHODOCHROUS | 2023 |
|
RU2810501C1 |
Изобретение относится к органической химии, а именно к улучшенному способу получения 3β,28-дигидроксилупана формулы (I):

Способ получения заключается в восстановлении 3β,28-дигидрокси-20(29)-лупена до 3β,28-дигидроксилупана дибораном, получаемым in situ, при мольном соотношении 3β,28-дигидрокси-20(29)-лупен:диборан, равном 1:5 в тетрагидрофуране при температуре 65°С в течение 4 ч. Выход целевого продукта составляет 78%.
Способ получения 3β,28-дигидроксилупана путем восстановления 3β,28-дигидрокси-20(29)-лупена в среде растворителя, отличающийся тем, что в качестве восстановителя используют получаемый in situ диборан при мольном соотношении 3β,28-дигидрокси-20(29)-лупен:диборан, равном 1:5, в качестве растворителя - тетрагидрофуран, процесс проводят при температуре 65°С в течение 4 ч, реакционную массу выливают в подщелоченную воду, выделившийся осадок промывают водой до нейтральной среды и перекристаллизовывают.
| EVERS M | |||
| et al | |||
| // J | |||
| Med | |||
| Chem | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| BILHAM P | |||
| et al | |||
| // J | |||
| Chem | |||
| Soc | |||
| Водопроводный кран | 1925 |
|
SU1942A1 |
| CTEXOBA С.И | |||
| и др | |||
| // Всесоюзн | |||
| конфер | |||
| «Химия и технология растительных веществ» | |||
| - Казань, 24-27 июня 2002. | |||
Авторы
Даты
2012-01-27—Публикация
2010-05-05—Подача