Изобретение относится к новым химическим соединениям класса А-секотритерпеноидов лупанового и 18αН-олеананового типа, которые проявляют цитотоксическую и противовирусную активности.
Природный тритерпеноид бетулин и его полусинтетических производные - перспективные источники для разработки новых терапевтически активных агентов [ , М. Kielbus, A.
, М. Kielbus, A.  , А. Stepulak. Comprehensive review on betulin as a potent anticancer agent // BioMed Research International. - 2015. - Vol. 2015. - P. 1-11; E.E. Rufino-Palomares, A.
, А. Stepulak. Comprehensive review on betulin as a potent anticancer agent // BioMed Research International. - 2015. - Vol. 2015. - P. 1-11; E.E. Rufino-Palomares, A.  , F.J. Reyes-Zurita, L.
, F.J. Reyes-Zurita, L.  , K. Mokhtari, A.
, K. Mokhtari, A.  , P.P. Medina,
, P.P. Medina,  Anti-cancer and anti-angiogenic properties of various natural pentacyclic triterpenoids and some of their chemical derivatives // Current Organic Chemistry. - 2015. - Vol. 19. - P. 919-947; D.-M. Zhang, H.-G. Xu, L. Wang, Y.-J. Li, P.-H. Sun, X.-M. Wu, G.-J. Wang, W.-M. Chen, W.-C. Ye. Betulinic acid and its derivatives as potential antitumor agents // Medicinal Research Reviews. - 2015. - Vol. 35. - №6. - P. 1127-1155; S. Y. Lee, H. H. Kim, S. U. Park. Recent studies on betulinic acid and its biological and pharmacological activity // EXCLI Journal - 2015. - Vol. 14. - P. 199-203; S.C. Jonnalagadda, P. Suman, D.C. Morgan and J.N. SeayRecent. Developments on the Synthesis and applications of betulin and betulinic acid derivatives as therapeutic agents // Studies in Natural Products Chemistry - 2017 - Vol. 53. - P. 45-84; J.Pokorny,
Anti-cancer and anti-angiogenic properties of various natural pentacyclic triterpenoids and some of their chemical derivatives // Current Organic Chemistry. - 2015. - Vol. 19. - P. 919-947; D.-M. Zhang, H.-G. Xu, L. Wang, Y.-J. Li, P.-H. Sun, X.-M. Wu, G.-J. Wang, W.-M. Chen, W.-C. Ye. Betulinic acid and its derivatives as potential antitumor agents // Medicinal Research Reviews. - 2015. - Vol. 35. - №6. - P. 1127-1155; S. Y. Lee, H. H. Kim, S. U. Park. Recent studies on betulinic acid and its biological and pharmacological activity // EXCLI Journal - 2015. - Vol. 14. - P. 199-203; S.C. Jonnalagadda, P. Suman, D.C. Morgan and J.N. SeayRecent. Developments on the Synthesis and applications of betulin and betulinic acid derivatives as therapeutic agents // Studies in Natural Products Chemistry - 2017 - Vol. 53. - P. 45-84; J.Pokorny,  , M. Urban. Click reactions in chemistry of triterpenes - advances towards development of potential therapeutics // Current Medicinal Chemistry. - 2018. - Vol. 25. - P. 1-23;
, M. Urban. Click reactions in chemistry of triterpenes - advances towards development of potential therapeutics // Current Medicinal Chemistry. - 2018. - Vol. 25. - P. 1-23;  . New pharmacological opportunities for betulinic acid // Planta Medica. - 2018. - Vol. 84. - P. 8-19; S. Xiao, Z. Tian, Yu. Wang, L. Si, L. Zhang, D. Zhou. Recent progress in the antiviral activity and mechanism study of pentacyclic triterpenoids and their derivatives // Medicinal Research Reviews. - 2018. -https://doi.org/10.1002/med.21484]. В частности, химические трансформации по атомам С3 и С28 данных соединений позволяют получить производные (в том числе моно- и дифункционализированные сложноэфирные и амидные производные), эффективно ингибирующие репродукцию вирусов герпеса простого и ВИЧ-1 [Y. Wei, С.-М. Ma, D.-Y. Chen, М. Hattori. Anti-HIV-1 protease triterpenoids from Stauntonia obovatifoliola Hayata subsp.intermedia // Phytochemistry. - 2008. - Vol. 69. - P. 1875-1879; Y. Wei, C.-M. Ma, M. Hattori. Synthesis of dammarane-type triterpene derivatives and their ability to inhibit HIV and HCV proteases // Bioorganic & Medicinal Chemistry. - 2009. - Vol. 17. - P. 3003 - 3010; Y. Wei, C.-M. Ma, M. Hattori. Synthesis and evaluation of A-seco type triterpenoids for anti-HIV-1 protease activity // European Journal of Medicinal Chemistry. - 2009. - Vol. 44. - P. 4112-4120; E.V. Igosheva, I.A. Tolmacheva, Yu. B. Vikharev, V.V. Grishko, O.V. Savinova, E.I. Boreko, V.F. Eremin. Synthesis and biological activity of amides of 28-methoxy-28-oxo-1-cyano-2,3-seco-lup-20(29)-en-3-oic acid // Chemistry of Natural Compounds. - 2012. - Vol. 48. - P. 426-431; I.A. Tolmacheva, E.V. Igosheva, Yu.B. Vikharev, V.V. Grishko, O.V. Savinova, E.I. Boreko, V.F. Eremin Synthesis and biological activity of mono-and diamides of 2, 3-secotriterpene acids // Russian Journal of Bioorganic Chemistry. - 2013. - Vol. 39. - P. 186-193; M.
. New pharmacological opportunities for betulinic acid // Planta Medica. - 2018. - Vol. 84. - P. 8-19; S. Xiao, Z. Tian, Yu. Wang, L. Si, L. Zhang, D. Zhou. Recent progress in the antiviral activity and mechanism study of pentacyclic triterpenoids and their derivatives // Medicinal Research Reviews. - 2018. -https://doi.org/10.1002/med.21484]. В частности, химические трансформации по атомам С3 и С28 данных соединений позволяют получить производные (в том числе моно- и дифункционализированные сложноэфирные и амидные производные), эффективно ингибирующие репродукцию вирусов герпеса простого и ВИЧ-1 [Y. Wei, С.-М. Ma, D.-Y. Chen, М. Hattori. Anti-HIV-1 protease triterpenoids from Stauntonia obovatifoliola Hayata subsp.intermedia // Phytochemistry. - 2008. - Vol. 69. - P. 1875-1879; Y. Wei, C.-M. Ma, M. Hattori. Synthesis of dammarane-type triterpene derivatives and their ability to inhibit HIV and HCV proteases // Bioorganic & Medicinal Chemistry. - 2009. - Vol. 17. - P. 3003 - 3010; Y. Wei, C.-M. Ma, M. Hattori. Synthesis and evaluation of A-seco type triterpenoids for anti-HIV-1 protease activity // European Journal of Medicinal Chemistry. - 2009. - Vol. 44. - P. 4112-4120; E.V. Igosheva, I.A. Tolmacheva, Yu. B. Vikharev, V.V. Grishko, O.V. Savinova, E.I. Boreko, V.F. Eremin. Synthesis and biological activity of amides of 28-methoxy-28-oxo-1-cyano-2,3-seco-lup-20(29)-en-3-oic acid // Chemistry of Natural Compounds. - 2012. - Vol. 48. - P. 426-431; I.A. Tolmacheva, E.V. Igosheva, Yu.B. Vikharev, V.V. Grishko, O.V. Savinova, E.I. Boreko, V.F. Eremin Synthesis and biological activity of mono-and diamides of 2, 3-secotriterpene acids // Russian Journal of Bioorganic Chemistry. - 2013. - Vol. 39. - P. 186-193; M.  , M. Drag, M. Poreba, S. Borska, Ju. Kulbacka, J. Saczko. Anticancer properties of ester derivatives of betulin in human metastatic melanoma cells (Me-45) // Cancer Cell International. - 2017. - Vol. 17. - P. 1-7; A.V. Markov, M.A. Zenkova, E.B. Logashenko. Modulation of tumour-related signaling pathways by natural pentacyclic triterpenoids and their semisynthetic derivatives // Current Medicinal Chemistry. - 2017. - Vol. 24. - P. 1277-1320; M. Medina-O'Donnell, F. Rivas, F. J. Reyes-Zurita, A. Martinez, J.A. Lupianez, A. Parra. Diamine and PEGylated-diamine conjugates of triterpenic acids as potential anticancer agents // European Journal of Medicinal Chemistry. - 2018. - Vol. 148. - P. 325-336].
, M. Drag, M. Poreba, S. Borska, Ju. Kulbacka, J. Saczko. Anticancer properties of ester derivatives of betulin in human metastatic melanoma cells (Me-45) // Cancer Cell International. - 2017. - Vol. 17. - P. 1-7; A.V. Markov, M.A. Zenkova, E.B. Logashenko. Modulation of tumour-related signaling pathways by natural pentacyclic triterpenoids and their semisynthetic derivatives // Current Medicinal Chemistry. - 2017. - Vol. 24. - P. 1277-1320; M. Medina-O'Donnell, F. Rivas, F. J. Reyes-Zurita, A. Martinez, J.A. Lupianez, A. Parra. Diamine and PEGylated-diamine conjugates of triterpenic acids as potential anticancer agents // European Journal of Medicinal Chemistry. - 2018. - Vol. 148. - P. 325-336].
Наиболее близкие аналоги описываемых соединений по структуре - метиловый эфир 3-О-сукцинил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты, метиловый эфир 3-O-3',3'-диметилсукцинил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты, метиловый эфир 3-O-3',3'-диметилглутарил-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты, которые обладают способностью подавлять репродукцию ВГП-1 в диапазонах концентраций от МПК до 1/4 МПК со снижением титра вируса, достигающим более 2,2 lg ТЦИД50/мл [И.А. Толмачева, В.В. Гришко, Е.В. Игошева, Е.И. Бореко, В.Ф. Еремин, И.И. Кучеров, О.В. Савинова. Лупановые А-секотритерпеноиды, проявляющие противовирусную активность // Патент РФ №2470003, опубл. 20.12.2012, бюл. №35] и метиловые эфиры 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой и 3-(бромметилен)-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой кислот, проявляющие цитотоксическую активность в отношении опухолевых клеток линий НЕр-2, НСТ 116, MS, RD ТЕ 32 и А549 [А.В. Конышева, В.О. Небогатиков, И.А. Толмачева, В.В. Гришко, Е.Ю. Рыбалкина, А.Ф. Карамышева. Метиловые эфиры 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой и 3-(бромметилен)-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой кислот, проявляющие цитотоксическую активность // Патент РФ №2632002, опубликован 2.10.2017, бюл. №28].
Задача изобретения - синтез новых тритерпеновых производных для расширения спектра противоопухолевых и противовирусных агентов.
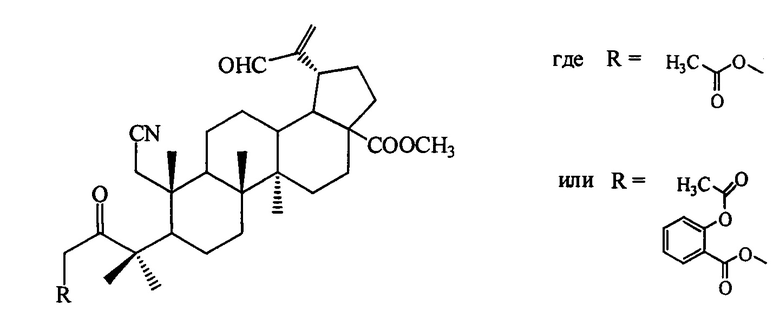
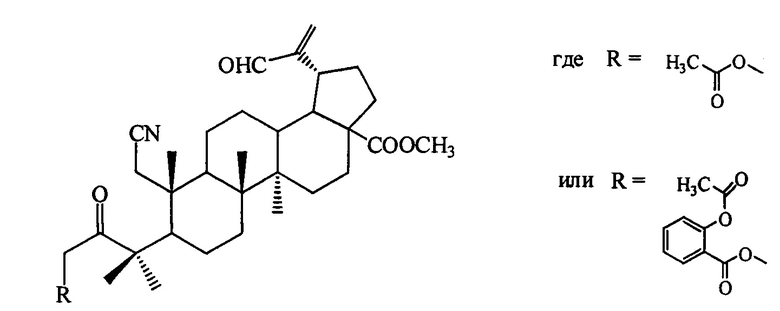
1. Для решения поставленной задачи синтезированы 3-ацилоксиметил-3-оксо-1-циано-2,3-секо-2-нор-тритерпеноиды общей формулы:
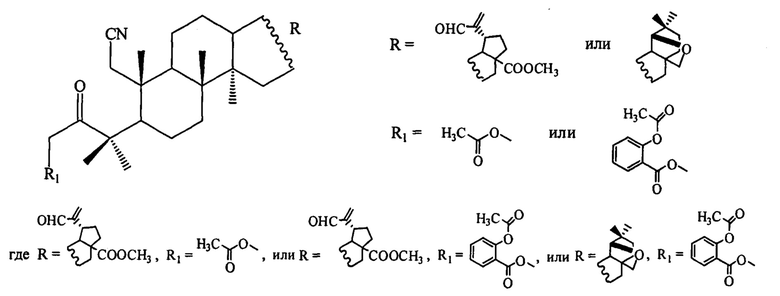
2. Соединение по п. 1, где 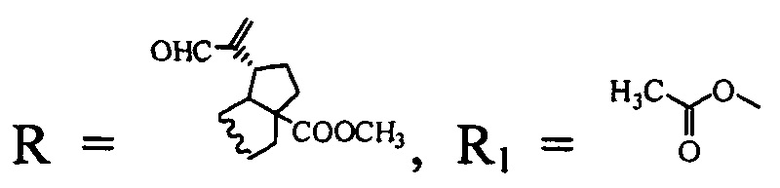 проявляет цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома) и при этом слаботоксично в отношении нераковых клеток почки эмбриона человека линии HEK 293.
проявляет цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома) и при этом слаботоксично в отношении нераковых клеток почки эмбриона человека линии HEK 293.
3. Соединение по п. 1, где 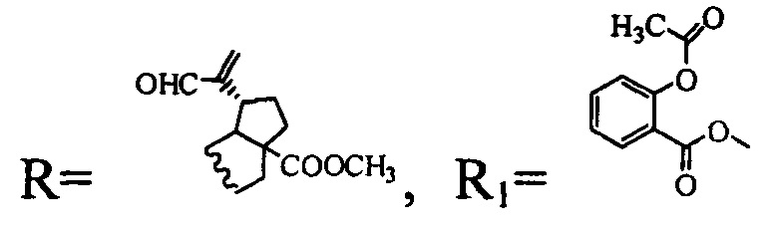 проявляет цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), RD ТЕ32 (рабдомиосаркома) и при этом малотоксично в отношении нераковых клеток почки эмбриона человека линии HEK 293.
проявляет цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), RD ТЕ32 (рабдомиосаркома) и при этом малотоксично в отношении нераковых клеток почки эмбриона человека линии HEK 293.
4. Соединение по п. 1, где 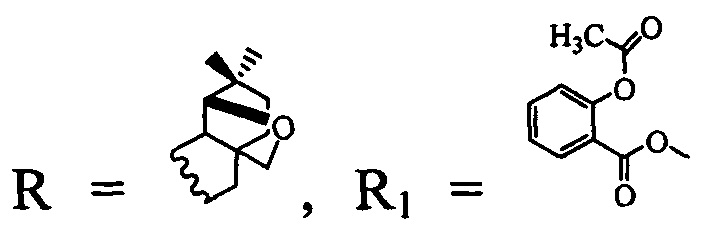 ингибирует репродукцию ВИЧ-1 и вирусов герпеса простого I и II типа и обладает одновременно вирулицидными свойствами.
ингибирует репродукцию ВИЧ-1 и вирусов герпеса простого I и II типа и обладает одновременно вирулицидными свойствами.
Синтезированы соединения общей формулы, где 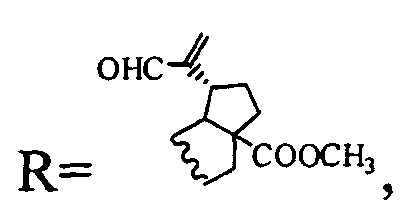
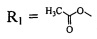 (соединение I), где
(соединение I), где 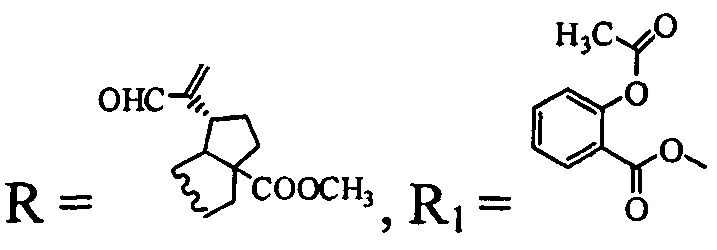 (соединение II)
(соединение II)
и 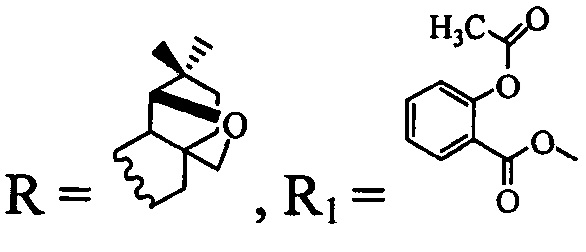 (соединение III).
(соединение III).
Полученные соединения представляют собой бесцветные мелкокристаллические вещества, хорошо растворимые в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, плохо растворимые в гексане и не растворимые в воде.
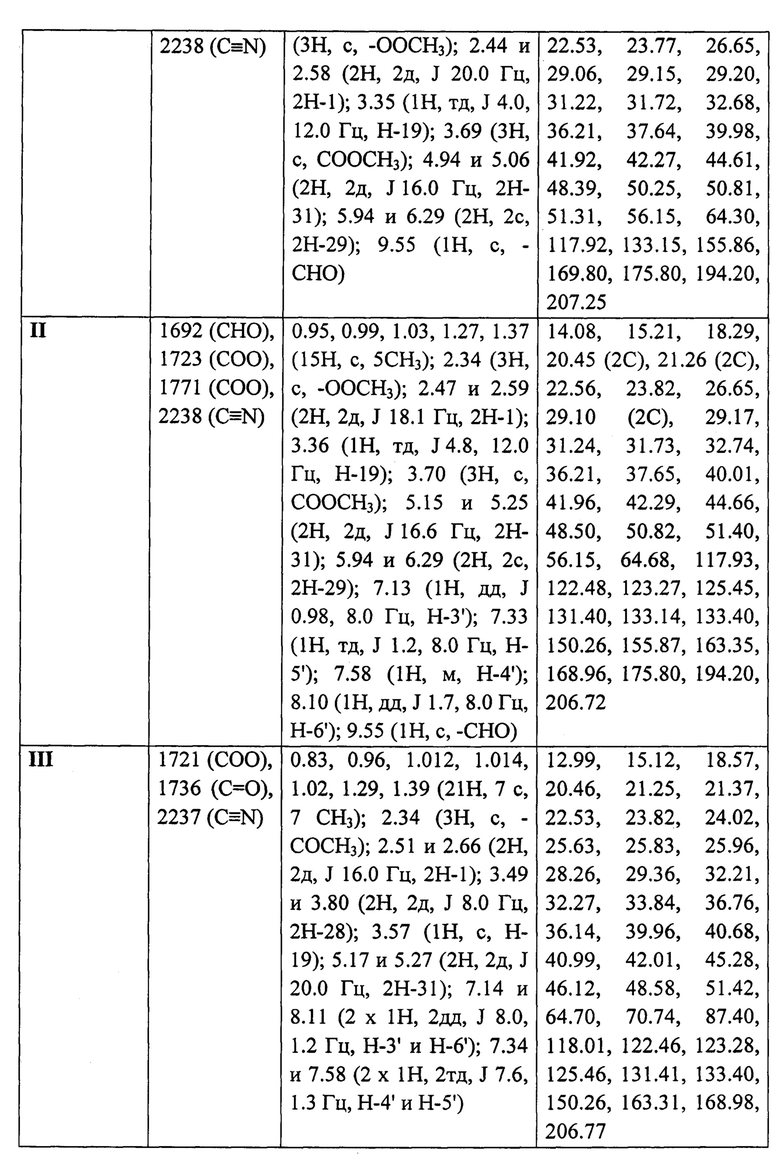
Структура соединений I-III подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I-III приведены в таблице. Спектры ЯМР 1Н и 13С ЯМР (δ, м.д.; J, Гц) для растворов соединений I-III в CDCl3 записывали на спектрометре Bruker AVANCE II (Германия) при рабочей частоте прибора 400 и 100 МГц соответственно. В качестве внутреннего стандарта использовали тетраметилсилан. ИК спектры (ν, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в тонкой пленке, полученной испарением раствора вещества в CHCl3 на поверхности стекла NaCl. Пороговое значение температуры в точке плавления определяли на приборе OptiMelt МРА100 (США) со скоростью 1°С в мин. Величину удельного оптического вращения измеряли для растворов соединений в CHCl3 на поляриметре 341 модели Perkin-Elmer (США) при длине волны 589 нм. Качественный контроль реакции проводили методом ТСХ на пластинах «Sorbfil» (Россия). Обнаружение веществ осуществляли обработкой пластин 5% H2SO4 и последующим прогреванием при 95-100°С в течение 2-3 мин. Для колоночной хроматографии использовали силикагель марки «Macherey-nagel» (60-200 μm), в качестве элюента - смесь петролейный эфир-этилацетат в соотношение 7:1. Величины Rf определяли в системе петролейный эфир-этилацетат 1:1.
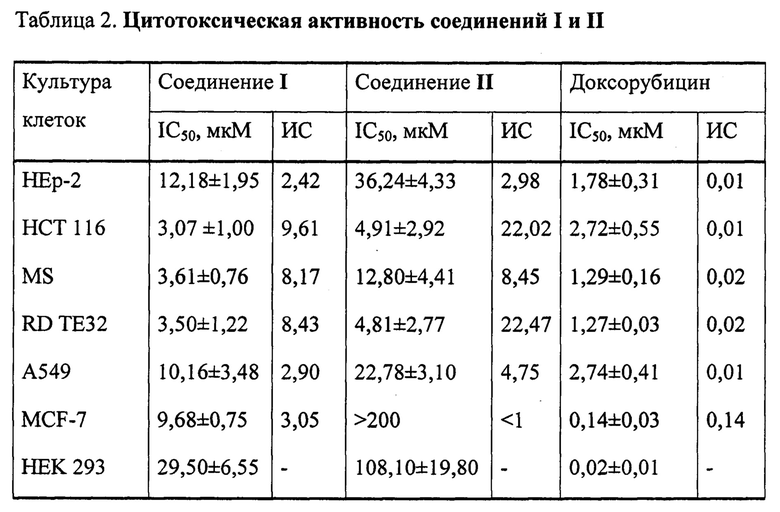
В исследованиях in vitro выявлена цитотоксическая активность соединения I в отношении линий опухолевых клеток НСТ 116, MS и RD ТЕ32.
В исследованиях in vitro выявлена цитотоксическая активность соединения II в отношении линий опухолевых клеток НСТ 116 и RD ТЕ32.
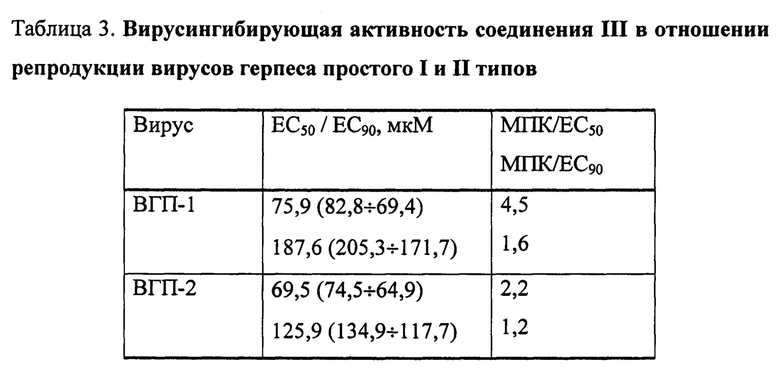
Соединение III in vitro проявляет ингибирующую активность в отношении репродукции ВИЧ-1 и вирусов герпеса простого I и II типа и обладает одновременно вирулицидными свойствами.
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-5 и результатами исследований, приведенными в таблицах 1-3.
Пример 1. Получение метилового эфира 3-(ацетилокси)метил-3-оксо-1-циано-2,3-секо-2-нор-луп-20(29)-ен-30-аль-28-овой кислоты (соединение I). 0.3 г (5.1 ммоль) Метилового эфира 3-бромметил-3-оксо-1-циано-2,3-секо-2-нор-луп-20(29)-ен-30-аль-28-овой кислоты [A.V. Konysheva, V.O. Nebogatikov, I.A. Tolmacheva, M.V. Dmitriev, V.V. Grishko. Synthesis of cytotoxically active derivatives based on alkylated 2,3-seco-triterpenoids // Eur. J. Med. Chem. - 2017. - Vol. 140. - P. 74-83] растворяли в 10 мл абсолютного ацетона, добавляли 0.03 мл (5.1 ммоль) уксусной кислоты, девятикратный избыток триэтиламина и четырехкратный избыток K2CO3. Реакционную смесь кипятили в течение 12 ч. Ход реакции контролировали методом ТСХ. По окончании реакции K2CO3 отделяли фильтрованием, реакционную смесь промывали 10% раствором HCl и затем водой до нейтральной реакции среды. Продукты реакции экстрагировали этилацетатом (3×50 мл). Органический слой сушили над безводным MgSO4, растворитель упаривали, соединение I очищали методом колоночной хроматографии на силикагеле.
Выход 53%; Rf 0.46; т. пл. 141.1°С (гексан-этилацетат), 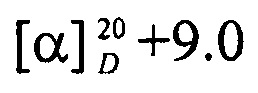 (с 0.5, CHCl3).
(с 0.5, CHCl3).
Пример 2. Получение метилового эфира 3-(2'-ацетилоксибензоилокси)метил-3-оксо-1-циано-2,3-секо-2-нор-луп-20(29)-ен-30-аль-28-овой кислоты (соединение II). 0.3 г (5.1 ммоль) Метилового эфира 3-бромметил-3-оксо-1-циано-2,3-секо-2-нор-луп-20(29)-ен-30-аль-28-овой кислоты [A.V. Konysheva, V.O. Nebogatikov, I.A. Tolmacheva, M.V. Dmitriev, V.V. Grishko. Synthesis of cytotoxically active derivatives based on alkylated 2,3-seco-triterpenoids // Eur. J. Med. Chem. - 2017. - Vol. 140. - P. 74-83] растворяли в 10 мл абсолютного ацетона, добавляли 0.09 г (5.4 ммоль) ацетилсалициловой кислоты, девятикратный избыток триэтиламина и четырехкратный избыток K2CO3. Реакционную смесь кипятили в течение 12 ч. Ход реакции контролировали методом ТСХ. По окончании реакции K2CO3 отделяли фильтрованием, реакционную смесь промывали 10% раствором HCl и затем водой до нейтральной реакции среды. Продукты реакции экстрагировали этилацетатом (3×50 мл). Органический слой сушили над безводным MgSO4, растворитель упаривали, соединение II очищали методом колоночной хроматографии на силикагеле.
Бесцветные кристаллы. Выход 55%; Rf 0.46; т. пл. 108.7°С (гексан-этилацетат), 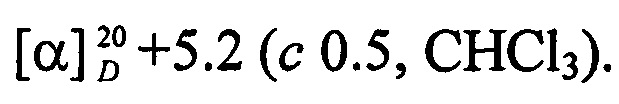
Пример 3. Получение 3-(2'-ацетилоксибензоилокси)метил-3-оксо-1-циано-19β,28-эпокси-2,3-секо-2-нор-18αH-олеан-3-она (соединение III). 0.3 г (5.4 ммоль) 3-бромметил-1-циано-19β,28-эпокси-2,3-секо-2-нор-18αН-олеан-3-она [А.V. Konysheva, V.O. Nebogatikov, I.A. Tolmacheva, M.V. Dmitriev, V.V. Grishko. Synthesis of cytotoxically active derivatives based on alkylated 2,3-seco-triterpenoids // Eur. J. Med. Chem. - 2017. - Vol. 140. - P. 74-83] растворяли в 10 мл абсолютного ацетона, добавляли 0,10 г (5.4 ммоль) ацетилсалициловой кислоты, девятикратный избыток триэтиламина и четырехкратный избыток K2CO3. Реакционную смесь кипятили в течение 12 ч. Ход реакции контролировали методом ТСХ. По окончании реакции K2CO3 отделяли путем фильтрования, реакционную смесь промывали 10% раствором HCl и затем водой до нейтральной реакции среды. Продукты реакции экстрагировали этилацетатом (3×50 мл). Органический слой сушили над безводным MgSO4, растворитель упаривали, соединение III очищали методом колоночной хроматографии на силикагеле.
Выход 58%; Rf 0.44; т. пл. 197.6°С (гексан-этилацетат), 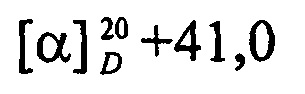 (с 0.5, CHCl3).
(с 0.5, CHCl3).
Пример 4. Исследование цитотоксической активности соединений I и II в отношении опухолевых клеток линий НЕр-2 (карцинома гортани), НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома), А549 (немелкоклеточная карцинома легкого), MCF-7 (рак молочной железы) и линии неопухолевых клеток HEK293.
Клетки выращивали при температуре 37°С во влажной стерильной атмосфере 5% CO2 в CO2-инкубаторе Isotemp Barnstead (США) в соответствующих средах: для НЕр-2, RD ТЕ 32, А549, MCF-7 и HEK 293 использовали DMEM, для MS и НСТ 116 - RPMI 1640. В культуральные среды добавляли 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина и 1% гентамицина. В эксперименте клетки высевали в 96-луночные планшеты в концентрации 1×104 клеток/100 мкл. После 24 ч инкубации к монослою клеток добавляли исследуемые соединения в концентрации от 10-6 до 10-4 М в виде раствора в ДМСО. В качестве контроля использовали лунки с добавлением 0,1% ДМСО. Через 72 ч инкубации в лунки вносили по 20 мкл МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид, Alfa Aesar, UK) в концентрации 5 мг/мл, после чего планшеты инкубировали дополнительно 4 ч. Затем среду сливали, кристаллы формазана растворяли в 100 мкл ДМСО. Оптическую плотность растворов измеряли при 544 нм с помощью планшетного спектрофотометра FLUOstar Optima (BMG Labtech, GmbH).
В качестве количественных показателей цитотоксичности по кривой «доза - эффект» рассчитывали концентрации тестируемого соединения, которые вызывают гибель 50% клеток в культуре (IC50). Индекс селективности соединений рассчитывали по формуле: ИС=IC50 соединения для клеточной линии HEK 293 / IC50 соединения для линии опухолевых клеток. Результаты представлены в виде среднего значения трех независимых экспериментов. В качестве препарата сравнения использовали доксорубицин.
Результаты исследования цитотоксической активности соединений I и II представлены в таблице 2.
Пример 5. Исследование противовирусной активности соединения III. Использовали вирусы герпеса простого 1 и 2 типа (ВГП-1 и ВГП-2), вирусингибирующие свойства соединений изучали в экспериментах на культуре клеток рабдомиосаркомы человека (RD). Монослойную культуру клеток, выращенную во флаконах, отмывали от ростовой среды, инфицировали 0,01-0,001 ТЦИД50/клетка вирусов путем нанесения разведения вируссодержащей суспензии в объеме 0,1 мл на 1 ч при 37°С. Затем жидкость удаляли и клетки покрывали средой поддержки (среда DMEM), содержащей различные концентрации исследуемого вещества. После 72 ч инкубации при 37°С регистрировали морфологические изменения монослоя клеток (цитопатический эффект вируса, увеличение ×80). Титр вируса в присутствии исследуемого вещества и в контроле рассчитывали в lg ТЦИД50 (50% тканевая цитопатогенная инфицирующая доза). Критерием противовирусного действия считали наличие различий титра вируса в сравнении с контролем. На основании полученных данных вычисляли концентрации 50 и 90% подавления размножения вируса в присутствии изучаемого вещества (ЕС50 и ЕС90). Отношения максимальная переносимая концентрация (МПК)/ЕС50 и МПК/ЕС90 использовали в качестве величин, свидетельствующих о широте диапазона активных нетоксичных концентраций вещества. МПК определяли как максимальную концентрацию вещества, не оказывающую влияния на морфологию неокрашенной культуры клеток.
При проведении исследований вирусингибирующей активности в отношении репродукции вируса иммунодефицита человека 1 типа (ВИЧ-1, штамм ВИЧ-1zmb) использовали перевиваемые суспензионные культуры Т-лимфобластоидных линий клеток человека МТ-4 и CEMss. Для поддержки их жизнедеятельности использовали среду RPMI-1640. Исследование выполняли в 96-луночных панелях. Инфицирование культур клеток проводили 106 lg вируса. Инфицированную культуру клеток инкубировали в атмосфере 5% CO2 при 37°С в течение 72 ч. После завершения инкубации учет результатов осуществляли посредством добавления в лунки панели реагента МТТ (3-(4,5-диметил-тиазол-2)-2,5-дифенол-тетразолиум-бромида) в концентрации 7,5 мкг/мл. После выдерживания при 37°С в течение 3 ч надосадок из лунок удаляли, образовавшийся формазановый продукт растворяли в диметилсульфоксиде, затем проводили измерение интенсивности развившегося окрашивания на спектрофотометре при длине волны 550/630 нм. На основе полученных значений определяли процент жизнеспособных клеток, вычисляли ЕС50 вирусингибирующего действия исследуемого вещества и соотношение МПК/ЕС50, характеризующее широту спектра его нетоксических эффективных концентраций.
О вирулицидных свойствах соединения судили по остаточной инфекционности ВГП-1 после контакта. Суспензию исследуемого вещества объединяли с неразведенной суспензией вируса и выдерживали при комнатной температуре в течение заданного времени. После завершения экспозиции готовили последовательные десятикратные разведения смеси на поддерживающей среде и инфицировали ими выращенную монослойную культуру клеток (во флаконах или в лунках планшет). После инкубации регистрировали морфологические изменения монослоя клеток и вычисляли титр вируса. Критерием наличия вирулицидного действия считали различие в титре вируса в сравнении с группой без экспозиции (точка «0»). Вычисляли время достижения 50 и 90% вирулицидного действия (ЕТ50 и ЕТ90 соответственно).
Исследование вирулицидной активности в отношении ВИЧ-1 проводили в 96-луночных панелях с использованием перевиваемых суспензионных Т-лимфобластоидных линий клеток человека МТ-4 и CEMss, поддерживающей среды RPMI-1640 в последовательности, изложенной выше в примере для вируса герпеса простого. После экспозиции вируссодержащей суспензии с разведениями исследуемого соединения готовили ряд серийных разведений этой смеси и инфицировали ими заранее подготовленные культуры однотипных клеток. Определение процента жизнеспособных клеток проводили с помощью формазанового теста в МТТ-варианте.
Полученные данные свидетельствуют о практически одинаковой вирусингибирующей активности соединения III в отношении ВГП-1 и ВГП-2 (таблица 3), несмотря на их неодинаковую чувствительность к действию ацикловира: ВГП-1 чувствителен (ЕС50 ацикловира 2,9 (3,2÷2,7) мкМ); ВГП-2 устойчив (ЕС50 163,0 (174,5÷151,9) мкМ). Ингибирующие свойства в отношении репродукции ВИЧ-1 были слабыми - в пределах концентраций 15,5-154,8 мкМ.
При исследовании вирулицидных свойств соединения III снижение титра ВГП-1 за 60 мин экспозиции достигло 2,18 lg ТЦИД50/мл, значения ЕТ50 и ЕТ90 вирулицидного действия составили 6,4 и 13,7 мин соответственно. Вычисленные значения ЕС50 и ЕС90 вирулицидного действия соединения при 60 мин экспозиции были равны 1,6 и 49,7 мкМ, при 30 мин экспозиции - 264,4 и 587,3 мкМ соответственно. Вирулицидные свойства соединения в отношении ВИЧ-1 были наиболее высокими: показатель жизнеспособности клеток МТ-4 и CEMss при 5-30 мин экспозиции составил ≥60%, ЕТ50=0,03 мин, ЕС50<154,8 мкМ.
Полученные вещества могут быть использованы для разработки противоопухолевых (соединение I, II) и противовирусных (соединение III) средств.

| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| МЕТИЛОВЫЕ ЭФИРЫ 3-МЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ И 3-БРОММЕТИЛЕН-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ КИСЛОТ, ПРОЯВЛЯЮЩИЕ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2016 |
|
RU2632002C1 |
| ТРИТЕРПЕНОВЫЕ АМИДЫ ЛУПАНОВОГО ТИПА С ФРАГМЕНТОМ 2-АМИНОБУТАН-1-ОЛА, ПРОЯВЛЯЮЩИЕ ВИРУСИНГИБИРУЮЩУЮ И ВИРУЛИЦИДНУЮ АКТИВНОСТЬ | 2017 |
|
RU2664804C1 |
| МЕТИЛОВЫЙ ЭФИР 24-ДИБРОМ-4-ОКСО-2-ЦИАНО-3,23-ДИНОРЛУП-28-ОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2022 |
|
RU2784317C1 |
| А-СЕКОТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ МЕТИЛКЕТОНА | 2013 |
|
RU2537840C1 |
| ТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ ЕН-НИТРИЛА В А-ПЕНТАЦИКЛЕ | 2012 |
|
RU2496785C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| АЦЕТИЛГИДРАЗОН 1-ЦИАНО-19β,28-ЭПОКСИ-2,3-СЕКО-18α-ОЛЕАН-3-АЛЯ, ПРОЯВЛЯЮЩИЙ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ВЕЗИКУЛЯРНОГО СТОМАТИТА ШТАММ "ИНДИАНА" | 2010 |
|
RU2429227C1 |
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
Изобретение относится к А-секотритерпеноидам общей формулы I. Технический результат: получены новые А-секотритерпеноиды, проявляющие цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома). 2 з.п. ф-лы, 3 табл., 5 пр.
1. А-секотритерпеноиды общей формулы
2. Соединение по п. 1, где 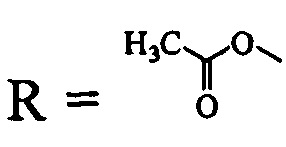 , проявляющее цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома).
, проявляющее цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), MS (меланома), RD ТЕ32 (рабдомиосаркома).
3. Соединение по п. 1, где 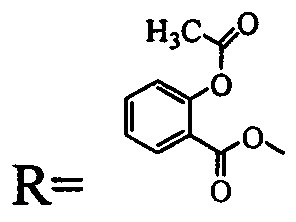 , проявляющее цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), RD ТЕ 32 (рабдомиосаркома).
, проявляющее цитотоксическую активность в отношении опухолевых клеток линий НСТ 116 (колоректальная карцинома), RD ТЕ 32 (рабдомиосаркома).
| Л | |||
| В | |||
| Аникина и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| И | |||
| А | |||
| Толмачева и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| А-СЕКОТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ МЕТИЛКЕТОНА | 2013 |
|
RU2537840C1 |
| МЕТИЛОВЫЕ ЭФИРЫ 3-МЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ И 3-БРОММЕТИЛЕН-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ КИСЛОТ, ПРОЯВЛЯЮЩИЕ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2016 |
|
RU2632002C1 |
Авторы
Даты
2019-04-24—Публикация
2018-12-20—Подача