Изобретение относится к молекулярной медицине и может быть использовано при лечении сосудистых заболеваний и прежде всего при ишемической болезни сердца и кардиомиопатии.
Сосудистые заболевания и прежде всего ишемическая болезнь сердца и кардиомиопатии, сопровождающиеся тяжелой сердечной недостаточностью, являются одной из главных причин смертности взрослого населения промышленно развитых стран [Шумаков В.И., Шевченко О.П., Орлова О.В., Онищенко Н.А., Гуреев С.В. Связь воспаления и апоптоза с эффективностью трансплантации клеток костного мозга больным с хронической сердечной недостаточностью // Вестник Российской АМН. - 2006. - №11, - с.14-21]. Несмотря на достигнутые успехи в лечении этих заболеваний значительная часть пациентов имеет абсолютные противопоказания для реваскуляризации с применением эндоваскулярной баллонной ангиопластики, стентирования или шунтирования [Смолянинов А.Б., Арьев А.Л., Афанасьев Б.В., Кириллов Д.А., Кованько Г.Н. Современные методы в репаративной кардиологии: опыт применения клеточных технологий // Молекулярная медицина. - 2008. - №1, - с.7-14].
Лишь только у каждого четвертого пациента со стенозирующим атеросклерозом коронарных артерий при окклюзиях хорошо развиваются коллатеральные сосуды, что может быть обусловлено генетическими факторами [Wustmann K., Zbinden S., Windecker S., et al. Is there functional collateral flow during vascular occlusion in angiographically normal coronary arteries? // Circulation. - 2003. - vol. 107, - p.2213-2220].
Несмотря на то что в регуляции ангиогенеза участвует большое количество разнообразных факторов, основная доля клинических исследований посвящена применению VEGF и ФР фибробластов (FGF), являющихся представителями больших семейств ФР. Так, в состав ФР эндотелия входит шесть факторов: VEGF-A (VEGF-1), VEGF-B (VEGF-3), VEGF-C (VEGF-2), VEGF-D, VEGF-E и PIGF, которые являются секретируемыми белками и связываются с тремя типами рецепторов: Flt-1 (VEGFR-1), Flk-2 (VEGFR-2), Flt-4 (VEGFR-3). VEGF-A, представленный 5 изоформами (121, 145, 165, 189 и 206), был идентифицирован первым. Изоформы VEGF-121 и VEGF-165 изучены наиболее полно как в экспериментальных, так и в клинических исследованиях [Парфенова Е.В., Ткачук В.А. Перспективы генной терапии сердечно-сосудистых заболеваний // Вопр. мед. хим. - 2000. - №46, - с.293-310; Tabibiazar R., Rockson S.G. Angiogenesis and the ischaemic heart // European Heart Journal. - 2001. - vol. 22, - p.903-918].
Возможность неоваскуляризации ишемизированных тканей с помощью VEGF доказана в многочисленных экспериментальных работах с использованием гистологических, ангиографических, радионуклидных методов на моделях ишемии миокарда и скелетных мышц у грызунов (мыши, крысы, кролики), собак, свиней и овец [Yla-Herttuala S., Rissanen Т.Т., Vajanto I. Vascular endothelial growth factors: biology and current status of clinical application in cardiovascular medicine // JMCC. - 2007. - vol. 49, - p.1015-1026]. Эти ФР обычно используют как в виде рекомбинантных белков, так и конструкций в плазмидном или аденовирусном векторах. Перспективным направлением представляется разработка технологий генотерапии, предусматривающих прямое введение встроенных в векторную систему генов факторов роста сосудов в миокард, скелетные мышцы или непосредственно в сосудистую стенку [Leeuw K.d., Kusumanto Y., Smit A. J., et al. Hospers Skin capillary permeability in the diabetic foot with critical limb ischaemia: the effects of a ph VEGF 165 gene product // Diabet Med. - 2008. - vol. 10. - p.1241-1244; Lewis B.S., Flugelman M.Y., Weisz A. et al. Angiogenesis by gene therapy: a new horizon for myocardial revascularization. // Cardiovascular Res. - 1997. - vol. 35, - p.480-489].
Векторные системы, которые используются для переноса генов в клетки человека и животных, включают невирусные и вирусные векторы. Первые представлены плазмидной или "голой" ДНК, которая вводится в комплексе с липосомами - положительно заряженными липидными пузырьками, обволакивающими отрицательно заряженную ДНК и способствующими лучшему проникновению через отрицательно заряженную клеточную мембрану. Эффективность трансфекции тканей in vivo плазмидной ДНК составляет до 4-5% [Baek S., March K.L. (1998). Circ. Res. 82. 295-305]. Между тем трансфекция даже 2-3% клеток может дать желаемый биологический эффект благодаря экспрессии белка, секретируемого клеткой и способного по паракринному механизму действовать на другие клетки [Takeshita S., Weir L., Chen D. et al. (1996). Biochem Biophys Res Commun. 227. 628-635., Van Belle Т., Tio F.O., Chen D. et al. (1997). J. Am. Cell. Cardiol. 29. 1371-1379], тем более, что плазмидная ДНК не встраивается в геном хозяина и нередко обеспечивает только временную экспрессию гена - 2-4 недели [Iris Baumgartner, Ann Pieczek, Orit Manor, Richard Blair, Marianne Kearney, Kenneth Walsh and Jeffrey M. Isner. Constitutive Expression of phVEGF165 After Intramuscular Gene Transfer Promotes Collateral Vessel Development in Patients With Critical Limb Ischemia Circulation 1998; 97; 1114-1123].
Первоначальные исследования по генной терапии ИБС продемонстрировали два важнейших результата: во-первых, были доказаны хорошая переносимость, возможность выполнения и безопасность введения в миокард и скелетные мышцы генетических конструкций, кодирующих ангиогенные факторы как при использовании плазмидных, так и аденовирусных векторов; во-вторых, удалось разработать и оценить различные техники введения генетических конструкций в сердце:
1) внутримиокардиальное, осуществляемое во время аортокоронарного шунтирования (АКШ) или через малую торакотомию,
2) трансэндокардиальное - с помощью катетера, имеющего специальное устройство для инъекций и датчик, сопряженный с системой электромеханического картирования полости левого желудочка (ЛЖ). Устройство обеспечивает детекцию зоны гибернирующего миокарда и введение препарата непосредственно в исследуемую область,
3) внутрикоронарное.
Наряду с демонстрацией хорошей переносимости процедур генотерапии, в этих работах были получены положительные предварительные результаты их эффективности [Springer M.A. Balansing act: Therapeutic approaches for the modulation of angiogenesis. // Curr. Opin. Invest. Drugs. - 2006. - vol. 7. - p.243-250; Tirziu D., Simons M. Angiogenesis in the human heart: Gene and cell therapy // Angiogenesis. - 2005. - vol. 8, - p.241-251].
Общим недостатком вышеперечисленного является либо низкий уровень трансфекции, либо непродолжительность эффекта VEGF или других ангиогенных факторов роста.
Наиболее близким к заявляемому решению является способ лечения, описанный в статье «Влияние фактора ангиогенеза на морфофункциональное состояние миокарда у крыс при экспериментальном инфаркте миокарда ((1 Сисакян А.С., 2 Оганян В.А., 2 Семерджян А.Б., 1 Петросян М.В., 2 Сисакян С.А., 3 Гуревич M.A. Ереванский государственный медицинский университет - кафедра пропедевтики внутренних болезней1; кафедра медицинской биологии и генетики2, Ереван; Московский областной клинический НИИ им. А.Владимирского3, Москва. - Российский кардиологический журнал, №2, 2008, с.63-67).
Данный препарат VEGF-164 вводили внутривенно перед окклюзией передней нисходящей артерии у крыс, который обеспечил стимуляцию ангиогенеза в миокарде и позволил снизить повреждающее действие ишемии и, как следствие, ограничил очаг некроза и последующую реорганизацию миокарда, однако он недостаточно эффективен. Во-первых, препарат VEGF164, который вводили внутримиокардиально, представлял собой полипептид - белок, продолжительность действия которого не превышает 12 часов. Во-вторых, обеспечивалось лишь увеличение плотности капиллярного русла в периинфарктной зоне. В-третьих, применение VEGF164 возможно только у грызунов.
Задачей изобретения является усиление доставки генного конструкта в миокард, что позволит активировать большее количество клеток, участвующих в ангиогенезе, и, как следствие, восстановить нормальный уровень перфузии в ишемизированной области миокарда.
Технический результат, который будет достигнут от использования изобретения, заключается в повышении эффективности лечения коронарной недостаточности.
Технический результат достигается тем, что лечение коронарной недостаточности при моделируемой ишемии миокарда осуществляют путем прямого введения в миокард гена фактора роста эндотелиоцитов - вектора phVEGF165 из расчета 50-100 мкг на см2 зоны ишемии и шагом по площади 5 мм, с добавлением 2-диметиламиноэтанола.
Сущность изобретения заключается в применении генной терапии для проведения терапевтической реваскуляризации миокарда при наличии исходной коронарной недостаточности, т.е. наличия стенозирующего поражения коронарных артерий с наличием критериев ишемии.
Использование для прямого введения в миокард гена фактора роста эндотелиоцитов phVEGF165 из расчета 50-100 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм обеспечивает даже при невысокой эффективности трансфекции стабильную секрецию трансфектированной клеткой фактора роста в течение времени, достаточного для формирования сосудистой сети как на периферии, так и в очаге поражения, а также высокую избирательность и безопасность терапии при однократном введении в область поражения.
Добавленный в готовый раствор 2-диметиламиноэтанол (ДМАЭ) способен повысить уровень трансфекции миокардиоцитов до 10%. Применение ДМАЭ приводит к обратимому изменению цитоплазмы клеток, обусловленное вакуолизацией (образование внутриклеточных включений, представляющих собой обособленный фрагмент внеклеточной жидкости в цитоплазме клетки, за счет стимуляция протонного насоса обеспечивает стабильность внутриклеточных вакуолей и торможение возврата вакуолей через клеточную мембрану во внеклеточную среду). В процессе исследования на базе лаборатории оказалось, что вакуолизация появляется после двухчасового воздействия ДМАЭ, а к четвертому часу достигает максимального уровня.
ДМАЭ принимает участие в эндоцитозе путем торможения процессов рециклинга рецепторов к факторам роста и регуляции и повышает эффективность трансфекции миокардиоцитов.
Изобретение осуществляется следующим образом.
Пример 1.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%. Опытной группе животных №1 (n=5) сразу после наложения лигатуры интрамиокардиально однократно вводили ген фактора роста phVEGF165 в концентрации 100 мкг/мл физиологического раствора, из расчета 50 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм (расстояние между всеми проколами составляет 5 мм и распределяется равномерно по всей площади зоны ишемии). Для повышения эффективности трансфекции миокардиоцитов в готовый раствор добавляют 2-диметиламиноэтанол в концентрации 2,5 ммоль/л. (Концентрация ДМАЭ от 2,5 до 10 мМоль/л не вызывает гибели клеток и является относительно безопасной. ДМАЭ принимает участие в эндоцитозе путем торможения процессов рециклинга рецепторов к факторам роста и регуляции и повышает эффективность трансфекции миокардиоцитов).
Уровень ангиогенеза оценивали на 30-е сутки после операциии на микроскопических срезах миокарда, окрашенных гематоксилин-эозином, на основании определения числа капилляров, среднего диаметра капилляров (d), измеряемого с помощью окуляр-микрометра, расчета плотности (n) (кап/мм2), обменной поверхности капилляров (ОПК) и емкости капиллярного русла (ЕКП) на 1 мм3 миокардиальной ткани. Изучение pO2 в зоне повреждения на открытом сердце проводили полярографическим методом с использованием генерирующей пары медная амальгама - кадмий.
Радиоактивность фракций клеток ядер и цитоплазмы определяли после дифференциального центрифугирования разрушенных гомогенизацией кардиомиоцитов на жидкостном сцинтилляционном счетчике Бета 2 (эффективность счета по 3Н - 56%).
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 3.04. Результаты считали достоверными при p≤0,05.
Данные исследования приведены в таблице 1.
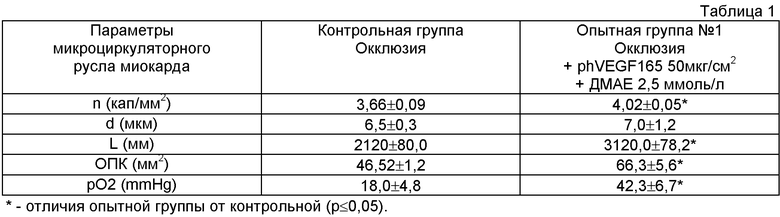
Полученные результаты свидетельствуют о том, что однократное интрамиокардиальное введение phVEGF165 в условиях моделируемой ишемии вызывает усиление неоангиогенеза в виде формирования новых капилляров, ответвляющихся от уже существующих, что свидетельствует об успешной трансфекции клеток миокарда плазмидной ДНК, экспрессии гена фактора роста эндотелиоцитов и продукции VEGF миокардиальными клетками в достаточном количестве для проявления его эффекта.
Раздельная радиометрия клеток, а также ядерной и цитоплазматической фракций биоптата миокарда в опытной группе показала, что основная часть внутриклеточной радиоактивности приходится на цитоплазму (95%), а не на ядерную фракцию (5%). Последнее указывает на эпигенетическое расположение вектора. Вместе с тем внеядерная экспрессия введенного гена обеспечивает синтез VEGF в течение времени, необходимого для ангиогенеза.
Пример 2.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполнялась перевязка ее проксимального сегмента на мандрене, сужающая просвет сосуда на 80%. Опытной группе животных №1 (n=5) сразу после наложения лигатуры интрамиокардиально однократно вводят генный конструкт фактора роста эндотелиоцитов phVEGF165 в концентрации 100 мкг/мл физиологического раствора, из расчета 75 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм. Для повышения эффективности трансфекции миокардиоцитов в готовый раствор добавляют 2-диметиламиноэтанол в концентрации 7,0 ммоль/л. Уровень ангиогенеза оценивали на 30-е сутки после операции на микроскопических срезах миокарда, окрашенных гематоксилин-эозином, на основании определения числа капилляров, среднего диаметра капилляров (d), измеряемого с помощью окуляр-микрометра, расчета плотности (n) (кап/мм2), обменной поверхности капилляров (ОПК) и емкости капиллярного русла (ЕКП) на 1 мм3 миокардиальной ткани. Изучение pO2 в зоне повреждения на открытом сердце проводили полярографическим методом с использованием генерирующей пары медная амальгама - кадмий.
Радиоактивность фракций клеток ядер и цитоплазмы определяли после дифференциального центрифугирования разрушенных гомогенизацией кардиомиоцитов на жидкостном сцинтилляционном счетчике Бета 2 (эффективность счета по 3Н - 56%).
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 3.04. Результаты считали достоверными при p≤0,05.
Данные исследования приведены в таблице 2.
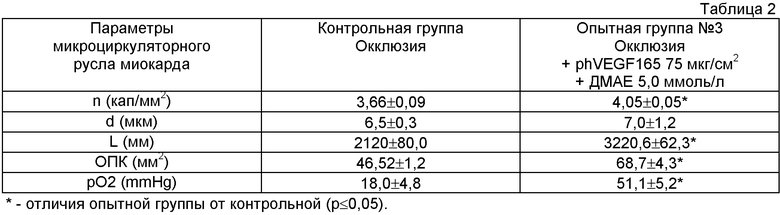
Полученные результаты свидетельствуют о том, что однократное интрамиокардиальное введение phVEGF165 в условиях моделируемой ишемии вызывает усиление неоангиогенеза в виде формирования новых капилляров, ответвляющихся от уже существующих, что свидетельствует об успешной трансфекции клеток миокарда плазмидной ДНК, экспрессии гена фактора роста эндотелиоцитов и продукции VEGF миокардиальными клетками в достаточном количестве для проявления его эффекта.
Раздельная радиометрия клеток, а также ядерной и цитоплазматической фракций биоптата миокарда в опытной группе показала, что основная часть внутриклеточной радиоактивности приходится на цитоплазму (95%), а не на ядерную фракцию (5%). Последнее указывает на эпигенетическое расположение вектора. Вместе с тем внеядерная экспрессия введенного гена обеспечивает синтез VEGF в течение времени, необходимого для ангиогенеза.
Пример 3
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%. Опытной группе животных №3 (n=5) сразу после наложения лигатуры интрамиокардиально однократно вводили генный конструкт фактора роста эндотелиоцитов phVEGF165 в концетрации 100 мкг/мл физиологического раствора, из расчета 100 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм. Для повышения эффективности трансфекции миокардиоцитов в готовый раствор добавляли 2-диметиламиноэтанол в концентрации 10,0 ммоль/л.
Контрольной группе животных вводился физиологический раствор, включающий в себя все компоненты кроме генного конструкта.
Уровень ангиогенеза оценивали на 30-е сутки после операциии на микроскопических срезах миокарда, окрашенных гематоксилин-эозином, на основании определения числа капилляров, среднего диаметра капилляров (d), измеряемого с помощью окуляр-микрометра, расчета плотности (n) (кап/мм2), обменной поверхности капилляров (ОПК) и емкости капиллярного русла (ЕКП) на 1 мм3 миокардиальной ткани. Изучение pO2 в зоне повреждения на открытом сердце проводили полярографическим методом с использованием генерирующей пары медная амальгама - кадмий.
Радиоактивность фракций клеток ядер и цитоплазмы определяли после дифференциального центрифугирования разрушенных гомогенизацией кардиомиоцитов на жидкостном сцинтилляционном счетчике Бета 2 (эффективность счета по 3Н - 56%).
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 3.04. Результаты считали достоверными при p≤0,05.
Данные исследования приведены в таблице 3.

Полученные результаты свидетельствуют о том, что однократное интрамиокардиальное введение phVEGF165 в условиях моделируемой ишемии вызывает усиление неоангиогенеза в виде формирования новых капилляров, ответвляющихся от уже существующих, что свидетельствует об успешной трансфекции клеток миокарда плазмидной ДНК, экспрессии гена фактора роста эндотелиоцитов и продукции VEGF миокардиальными клетками в достаточном количестве для проявления его эффекта.
Раздельная радиометрия клеток, а также ядерной и цитоплазматической фракций биоптата миокарда в опытной группе показала, что основная часть внутриклеточной радиоактивности приходится на цитоплазму (95%), а не на ядерную фракцию (5%). Последнее указывает на эпигенетическое расположение вектора. Вместе с тем внеядерная экспрессия введенного гена обеспечивает синтез VEGF в течение времени, необходимого для ангиогенеза. Группа наилучших показателей.
Использованный в примерах 1-3 генный конструкт фактора роста phVEGF165, производства Sigma, синтезированный компанией по нашему заказу, представляет собой плазмидную ДНК с включением гена, состоящего из 165 кодонов, последовательность которого соответствует универсальной для человека и животных изоформе гена фактора роста эндотелиоцитов VEGF. В состав генного конструкта также входит участок цитомегаловирусного промоутера, регулирующего трансфекцию, гены-регуляторы, сайт полиаденирования и терминирующий кодон.
Контрольной группе животных вводился физиологический раствор, включающий в себя все компоненты кроме генного конструкта.
Результаты сравнительных данных заявляемого решения и прототипа приведены в таблице 4.
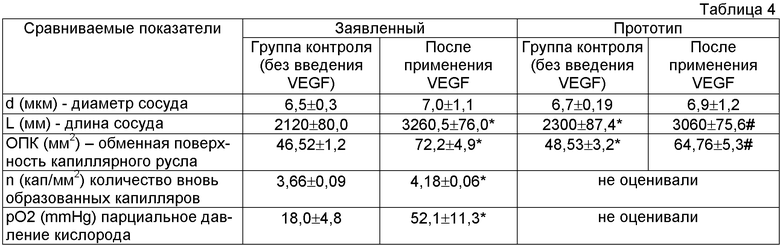
Как видно из сравнительной таблицы, однократное интрамиокардиальное введение phVEGF165 в условиях моделируемой ишемии вызывает усиление неоангиогенеза в виде формирования новых капилляров, ответвляющихся от уже существующих, что свидетельствует об успешной трансфекции клеток миокарда плазмидной ДНК, экспрессии гена фактора роста эндотелиоцитов и продукции VEGF миокардиальными клетками в достаточном количестве для проявления его эффекта. В отличие от прототипа была проведена оценка парциального давления кислорода в группе применения VEGF и контрольной, указывающая на достоверный возврат к практически нормальным показателям перфузионного кровотока в миокарде, что свидетельствует об эффективности применяемой векторной конструкции. Кроме того, улучшились показатели - диаметр сосудов, длина сосудов, обменная поверхность капиллярного русла.
Таким образом, изобретение обладает способностью стимулировать ангиогенез за счет использования генного конструкта на основе плазмидной ДНК, включающей участок цитомегаловирусного промоутера, гены-регуляторы, сайт полиаденирования, терминирующий кодон и ген фактора роста эндотелиоцитов VEGF165, встроенного в векторную систему.
Эпигеномная локализация трансфецированного в миокардиоциты генного конструкта является достаточной для экспрессии гена VEGF165, не превышающей 4 недели, способствует образованию фактора роста и проявлению его ангиостимулирующего эффекта.
В отличие от применения пептидных факторов роста, требующих регулярное их введение, использование генного конструкта с геном фактора роста эндотелиоцитов обеспечивается однократным интрамиокардиальным введением.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ | 2014 |
|
RU2572798C1 |
| Способ терапии атопического дерматита | 2022 |
|
RU2804005C1 |
| СПОСОБ ТЕРАПИИ ПОВРЕЖДЕНИЙ КОЖИ И БИОТРАНСПЛАНТАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2588835C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК | 2019 |
|
RU2712770C1 |
| Способ стимуляции репаративного ангиогенеза и регенерации соединительной ткани, при её повреждении, методом генной терапии с использованием видоспецифичных генов белковых факторов vegf и fgf2, в ветеринарии, и генетическая конструкция для реализации заявленного способа | 2015 |
|
RU2614665C1 |
| Оптимизированная нуклеотидная последовательность и фармацевтическая композиция на ее основе с пролонгированной экспрессией трансгена vegf | 2015 |
|
RU2612497C2 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ВОЗРАСТНЫХ ИЗМЕНЕНИЙ КОЖИ | 2019 |
|
RU2803093C2 |
| СПОСОБ СТИМУЛЯЦИИ АНГИОГЕНЕЗА В ИШЕМИНИЗИРОВАННЫХ ТКАНЯХ И КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 2015 |
|
RU2628706C2 |
| НЕИНФЕКЦИОННЫЙ ДЛЯ ЧЕЛОВЕКА АДЕНОВИРУС КАК ВЕКТОР ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ГЕННОЙ ТЕРАПИИ НАРУШЕНИЙ АНГИОГЕНЕЗА, ОБЕСПЕЧИВАЮЩИЙ ЭФФЕКТИВНЫЙ СИНТЕЗ АНГИОГЕНИНА ЧЕЛОВЕКА В ТРАНСФЕЦИРОВАННЫХ КЛЕТКАХ МЛЕКОПИТАЮЩИХ, СПОСОБ ИНДУКЦИИ АНГИОГЕНЕЗА, СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ, КОМПОЗИЦИЯ ДЛЯ ИНДУКЦИИ АНГИОГЕНЕЗА И ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ | 2005 |
|
RU2321631C2 |
| КЛЕТОЧНАЯ ТЕРАПИЯ ИШЕМИЧЕСКОЙ ТКАНИ | 2009 |
|
RU2535966C2 |
Изобретение относится к экспериментальной медицине и может быть использовано при разработке молекулярных способов лечения коронарной недостаточности. Для этого в эксперименте при моделируемой ишемии миокарда осуществляют прямое введение в миокард гена фактора роста эндотелиоцитов в виде вектора phVEGF165 из расчета 50-100 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм. При этом в раствор препарата вектора добавляют 2-диметиламиноэтанол для повышения эффективности трансфекции миокардиоцитов. В отличие от пептидных факторов роста, требующих регулярного введения, использование генного конструкта с геном фактора роста эндотелиоцитов при однократном введении по разработанному способу обеспечивает усиление доставки конструкта в миокард и активизацию большего числа клеток, участвующих в ангиогенезе, что приводит к восстановлению перфузии в ишемизированной области миокарда. 2 пр., 4 табл.
Способ лечения коронарной недостаточности при моделируемой ишемии миокарда путем прямого введения в миокард гена фактора роста эндотелиоцитов, отличающийся тем, что в качестве гена фактора роста эндотелиоцитов вводят вектор phVEGF 165 из расчета 50-100 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм, с добавлением 2-диметиламиноэтанола.
| TIRZIU D | |||
| et al | |||
| Angiogenesis in the human heart: gene and cell therapy, enesis | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| АКТИВНАЯ ИММУНОТЕРАПИЯ ПРОТИВ АНГИОГЕНЕЗА | 2003 |
|
RU2329824C2 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2001 |
|
RU2311921C2 |
| Аппарат для обработки металлических предметов посредством направленных на них пульверизируемых частиц | 1927 |
|
SU9390A1 |
| US 20070281888 A1, 06.12.2007 | |||
| WO 2004113384 A1, 29.12.2004 | |||
| ПАРФЕНОВА Е.В | |||
| и др | |||
| Перспективы генной терапии сердечно-сосудистых заболеваний // Вопросы мед | |||
| химии | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2012-03-10—Публикация
2010-09-06—Подача