Изобретение относится к медицине, в частности к дерматологии, и может быть использовано для лечения атопического дерматита, а также в научных исследованиях для разработки методов клеточной и генной терапии.
Актуальность разработки обусловлена с одной стороны - распространенностью данной патологии (от 20 до 40% в структуре кожных заболеваний), а с другой - отсутствием одновременно безопасных и эффективных способов терапии.
Для лечения атопического дерматита в настоящее время применяют препараты системной терапии: азатиоприн, циклоспорин, метотрексат и др., которые обладают выраженным иммуносупрессивным и цитостатическим действием и характеризуются побочными осложнениями. Для наружной терапии атопического дерматита до сих пор «золотым стандартом» считаются глюкокортикоиды от так называемой «слабой» активности (гидрокортизон, преднизолон и др.) до высокой степени активности (метилпреднизолонаацепонат, мометазонафуорат, клобетазолапропионат и др.), которые также не лишены многочисленных побочных эффектов.
Одним из перспективных направлений терапии дерматитов считается применение тканеинженерных конструкций на основе жизнеспособных культивированных клеток [NadiaTsao. Advanced WoundCareTechnologies 2020-2030. Opportunities in the diagnosis, treatment, and monitoring of chronic non-healing wounds. IDTechExReports, 2020, p. 682].
Однако, как показывает клинический опыт, эффективность применения таких конструкций в большинстве случаев остается невысокой [http://www.drugs.com/drp/apligraf.html]. Taк, в недавнем мультицентровом плацебо контролируемом клиническом исследовании эффективность терапии дерматитов составила 38.3% [Dearman, В.L., Воусе, S.Т., &Greenwood, J.Е. (2021). Advances in Skin Tissue Bioengineering and the Challenges of Clinical Translation. Frontiers in surgery, 8, 640879. https://doi.org/10.3389/fsurg. 2021.6408791.
Анализ причин невысокой эффективности клеточной терапии дерматитов продемонстрировал ее обусловленность рядом причин:
1. При использовании для терапии аллогенных клеток наблюдается только временный эффект вследствие отторжения и последующего разрушения генетически чужеродного материала.
2. При использовании аутологичных клеток последние ускоренно утрачивают восстановительный потенциал вследствие их интенсивного деления и, тем самым, достижением клетками барьера Хейфлика.
3. Нанесенные клетки не проникают в пораженную кожу, взаимодействуя только с поверхностными и быстро слущиваемыми слоями эпидермиса, что ограничивает эффективность терапии.
4. В условиях раны создаются неблагоприятные условия для жизнедеятельности как аллогенных, так и аутологичных клеток - недостаток кислорода, пластических и энергетических субстратов, воздействие токсичных веществ, факторов воспаления и пр., вследствие чего часть нанесенных на рану клеток гибнет уже в первые сутки.
Известны исследования, направленные на повышение жизнеспособности клеток в раневом окружении путем дополнительной стимуляции их пролиферации, применения антиоксидантов, метаболитов, создания барьера между трансплантированными клетками и агрессивным раневым содержимым [Akinfenwa А.О., Abdul N.S., Marnewick J L. & Hussein A.A.(2021). Protective Effects of Linearthin and Other Chalcone Derivatives from Aspalathuslinearis (Rooibos) against UVB Induced Oxidative Stress and Toxicity in Human Skin Cells.lants (Basel, Switzerland), 10(9), 1936. https://doi.Org/00.3390/plants 10091936].
Однако данные способы химической протекции, как правило, оказывают кратковременный эффект или, в случае применения факторов роста, приводят к ускоренному истощению регенераторного потенциала трансплантированных клеток.
Известны исследования, направленные на повышение регенераторного потенциала клеток путем их генетической модификации.
Наиболее близким решением является патент ЕР 3262159 В1, предусматривающий предварительное трансфицирование мультипотентных мезенхимальных стромальных клеток (ММСК) с целью повышения их регенераторного потенциала вирусным вектором с геном, кодирующим секреторную форму белка Klotho, с целью их терапевтического применения.
Задачей изобретения является снижение сроков и повышение качества лечения атопического дерматита.
Задача решается путем применения экзосом, содержащих полноразмерную форму белка Klotho, получаемых из генномодифицированных ММСК путем индукции в последних гиперэкспрессии трансмембранного гена Klotho.
Ген Klotho расположен на 13 хромосоме (13ql2). В результате альтернативного сплайсинга образуются две мРНК, кодирующих две формы белка Klotho:
- полноразмерную (трансмембранную) форму, молекулярной массой порядка 130 к Да. Эта форма белка Klotho состоит из двух внеклеточных доменов - надмембранной части и короткого внутриклеточного;
- укороченную (секреторную) форму молекулярной массой около 70 кДа.
Кроме двух основных форм, имеется еще так называемая растворимая изоформа, образующаяся в результате отщепления протеолитическими ферментами надмембранной части трансмембранной формы белка Klotho. Эта изоформа может отделяться от мембраны и циркулировать в крови как гормон.
Трансмембранная форма белка Klotho, в отличие от секретируемой, формирует комплексы с рецепторами многих факторов роста с образованием корецепторов, например для FGF23, что позволяет ей участвовать в опосредованной FGF23 передаче сигналов в ядро клетки и регуляции трансмембранного транспорта Са++ и фосфатов. Более того, трансмембранной форме белка Klotho отводится центральная роль в поддержании гомеостаза ионов Са++ в организме. В свою очередь, ионы Са++ считается инициатором клеточной активности, активируя митохондриальное дыхание, внутриклеточную передачу сигналов, перенос аминокислот, а также выполняют функцию вторичного мессенджера. Трансмембранный белок реализует множество других функций, в том числе отвечает за транслокацию Na/K АТФаз и передачу сигналов фактора роста. При этом растворимая форма белка, образующаяся из трансмембранной, также участвует в регуляции концентрации ионов кальция [Dalton G.D, Xie J, An S.W, Huang C.L.New Insights into the Mechanism of Action of Soluble Klotho. Front Endocrinol (Lausanne). 2017 Nov 17;8: 323. doi:10.3389/fendo.2017.00323. PMID: 29250031; PMCID: PMC5715364; Prud'homme J., Kurt M., & Wang Q. (2022). Pathobiology of the Klotho Antiaging Protein and Therapeutic Considerations. Frontiers in aging, 3, 931331. https://doi.org/10.3389/fragi.2022.931331].
Все эти механизмы могут иметь решающее значение для возникновения и развития генетически детерминированного нарушения функций эпидермиального барьера, выступающего в качестве основного звена патогенеза атопического дерматита. Именно нарушение проницаемости эпидермального барьера кожи приводит к избыточной транеэпидермальной потере воды, а уменьшение гидратации кожи генерирует хроническое воспаление и, с одной стороны, усиливает зуд и экскориации, а с другой - образует дополнительные входные ворота для патогенов. В свою очередь, трансмембранная форма белка Klotho также активирует кальциевые каналы и препятствует их интернализации (закрытию), что обеспечивает гидратацию эпидермиса и тем самым разрывает порочный круг патогенеза атопического дерматита.
Однако принципиально важной задачей заявляемого способа с позиции терапии атопического дерматита является доставка трансмембранной формы белка Klotho непосредственно в жизнеспособные клетки в очаге поражения, особенно если принять во внимание размеры этого белка (1014 аминокислот).
Экзосомы являются важными посредниками физиологической межклеточной коммуникации, что обеспечивается их наноразмерностью. Применение экзосом, в отличие от клеток, предоставляет возможность организации таргетной доставки лекарственных средств в клетки-мишени, что многократно повышает эффективность терапии.
Последнее может быть значительно усилено за счет возможности экзосом включать в свое внутреннее содержимое биологически активную полезную нагрузку, например белки, образующиеся вследствие искусственно индуцированной избыточной экспрессии генов в клетках-донорах экзосом и благодаря этому приобретать способность целевым образом влиять на критические звенья патогенеза конкретного заболевания.
В настоящем изобретении с целью повышения восстановительного потенциала мультипотентные мезенхимальные стромальные клетки в процессе культивирования трансфицируют плазмидными векторами, обеспечивающими эктопическую (внедряемую) экспрессию гена Klotho (membrane, Addgene plasmid 17712), с использованием Lipofectamine™ 2000 (Invitrogen) для трансфекции согласно протоколу производителя. Об эффективности трансфекции судят по количеству живых клеток в среде, содержащей 1 мкг/мл пуромицина (Sigma).
Спустя три - четыре пассажа после получения резистентной к пуромицину клеточной культуры, последнюю продолжают культивировать уже в бессывороточной среде. При этом клетки в ходе культивирования, секретируют в среду экзосомы, содержащие трансмембранную форму белка Klotho и иные биологически активные вещества.
С целью получения экзосом применяли метод ступенчатого центрифугирования (патент WO 2019191444 А1). На начальном этапе кондиционную среду центрифугируют (600g, 60 минут) для отделения клеточной фракции. В свою очередь, для предварительного сбора супернатанта центрифугируют при 15000-17000g в течение 220 минут, а для сбора полученного супернатанта - при 100000g в течение 300 минут.
Затем полученный осадок повторно ресуспендируется до 1/10 от его исходного объема в PEG буфере с дополнительным концентрированием раствора экзосом путем центрифугирования при 100000g в течение 120 минут. Полученный супернатант стерилизуют фильтрованием на нитроцеллюлозных фильтрах с диаметром пор 220 нм. Фильтрат в дальнейшем используют с терапевтическими целями.
При этом первичную культуру клеток получают из эксплантата, взятого под местной анестезией с ягодичной области самого пациента.
Пример 1.
В ходе работы использовали плазмиды, несущие в качестве полезного ген Klotho (Addgene plasmid 17712: Klotho (membrane)). Плазмиды хранили и наращивали в составе трансгенного штамма бактерии E.coli (Dh5a). Для выделения и очистки плазмидного генетического материала бактерии размораживали и наращивали на жидкой LB-среде с добавлением используемого для селекции антибиотика ампициллина (75 мкг/мл), поскольку в качестве репортерного гена плазмиды содержат ген устойчивости к данному антибиотику, что приводит к гибели бактерий E.coli, лишенных данных плазмид.
После получения высокой плотности бактерий культуры центрифугировали при 1000g в течение 10 минут, супернатант удаляли, а осадок использовали для выделения плазмидной ДНК с помощью коммерческого набора реагентов MiniprepKit (ZymoResearch, США) в соответствии с протоколом производителя.
Количественный подсчет плазмидной ДНК (пДНК) проводили на спектрофотометре (BIO-RAD) при длине волны 260 нм. Качественный анализ проводили по соотношению OD260/OD280. Образцы считали пригодными при OD260/OD280=1.8±0.1. Копийность полученных растворов пДНК определяли по формуле: (количество ДНК (нг) × 6,022 × 1023) / (длина плазмиды (п.о.) × 1 × 109 × 650).
Пример 2.
Повышение экспрессии гена Klotho (membrane)
Для получения клеточных культур были использованы эксплантаты кожи ягодичной области здоровых пациентов 32-46 лет с их информированного согласия эксплантаты получали из косметологических клиник г. Екатеринбурга. Материал (10-30 мм) в виде образцов, взятых методом панч-биопсии, забирали в асептических условиях. К критериям включения пациентов в исследование было отнесено подтвержденное заключение «клинического здоровья». Критериями исключения являлось наличие таких хронических инфекционных заболеваний, как ВИЧ-инфекция и вирусные гепатиты В и С, а также любые иные заболевания, сопровождающиеся острой воспалительной реакцией на момент проведения исследования.
После забора образцы помещали в стерильные одноразовые полипропиленовые пробирки или стаканчики, содержащие от 5 до 50 мл смесевой питательной среды DMEM/F-12, в соотношении 1:1, с добавлением культуральных антибиотиков пенициллина, стрептомицина и амфоторицинаВ (SigmaAldrich, США). При температуре +4°С пробы доставляли в лабораторию не более чем в течение 4 часов. Далее образцы ткани препарировали на чашках Петри в ламинарных боксах, удаляли некротические ткани и механически измельчали стерильным лезвием до размеров, не превышающих 4 мм3. Полученные кусочки ткани промывали в фосфатном буферном растворе PBS (Биолот, Россия) для удаления форменных элементов крови и помещали в свежую питательную среду DMEM/F-12 с 10% фетальной бычьей сыворотки (ФБС) в культуральные флаконы с площадью посевной поверхности 25 см (Orange, Бельгия).
Клетки культивировали в течение 48 часов при 37°С, 95% влажности и 5% содержании углекислого газа. По истечении двухсуточного срока наблюдения, флаконы подвергали тщательной оценке признаков возможной микроорганизменной контаминации. При отсутствии макро- и микроскопических признаков тех или иных инфекционных агентов, в первичную культуру добавляли коллагеназу (Биолот, Россия) в концентрации 200 ед/мл. После достижения полной химической деструкции ткани (в течение 24-48 часов), первичные культуры клеток отмывали от фермента путем центрифугирования при 200g с последующим ресуспендированием клеточного осадка в свежей культуральной среде. Гомогенизированную клеточную суспензию переносили в новые малые культуральные флаконы.
Общепризнанным критерием идентификации ММСК является экспрессия набора определенных поверхностных маркеров. Так, ММСК должны экспрессировать маркеры CD73, CD 90, CD 105 и не экспрессировать CD34, CD45, CD14, CD19.
Исследования полученных клеток методом флуоресцентной микроскопии продемонстрировали наличие необходимого набора маркеров (CD73, CD90, CD105), тогда как определение маркеров CD34 и CD45 дало отрицательный результат.
Количественный анализ маркеров методом проточной цитофлуориметрии подтвердил данные флуоресцентной микроскопии. Средний уровень экспрессии маркеров CD73, CD90 и CD105 составил 96%. При изучении показателей CD34, CD45 и CD14 полученные результаты не отличались от показателей отрицательного контроля (экспрессия всех маркеров была ниже 1%), что соответствует требованиям для чистых культур ММСК (требование - экспрессия не более 2%).
Стандартный метод анализа рассеяния пучка показал, что в образце содержится количество неповрежденных клеток, достаточное для получения достоверных результатов. Расчеты проводились только по сигналам, полученным от целых неповрежденных клеток, что существенно повышает достоверность полученных данных.
После подтверждения чистоты получаемой клеточной популяции трансфекцию ММСК выполняли липосомальным методом с использованием комплекса поликатионных липидов Lipofectamin 2000 (Sigma Aldrich, США), согласно протоколу производителя.
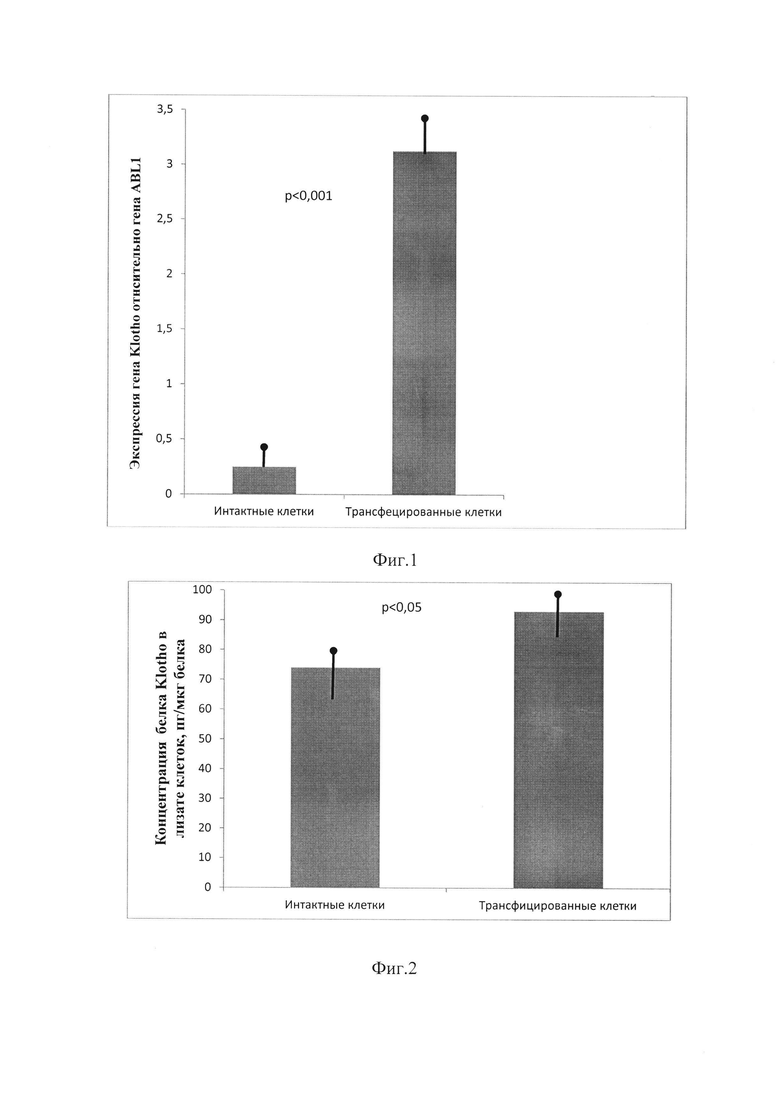
Принципиально важным вопросом заявляемого технического решения можно считать подтверждение эффективности экспрессии гена Klotho, то есть достижимость поставленной задачи по созданию популяции клеток-доноров, способных накапливать эффекторный белок в цитоплазме, которые служат источником экзосом. В качестве контрольной группы использовали так называемый ген «домашнего хозяйства» - ABL 1 (abelson murine leukemia viral oncogene homolog 1). На Фиг. 1 представлена диограмма - Относительная экспрессия гена Klotho. Концентрация белка Klotho в культуральной среде (Klotho, пг среднее значение ± стандартное отклонение).
Исследование продемонстрировало, что эффективность амплификации фрагментов mKL и ABL1 была соизмеримой и составила 91 и 99% соответственно.
В соответствии с критериями MIQE [Bustin S.A, Benes V, Garson J.А, Hellemans J, Huggett J, Kubista M et al. (2009) The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chem 55(4):611-622. https:// doi. org/ 10.1373/ clinc hem. 2008.112797 Published March 2009] информация, касающаяся метода количественной ПЦР, и данные количественного определения позволяют предположить, что технологию анализа экспрессии можно считать подходящей для решения поставленных задач. Так, согласно данным RTqPCR, показанным на Фиг. 1, относительная экспрессия в контрольной группе составила в среднем в 13,55 раза меньшее значение, чем в опытной группе (р<0,001).
Концентрация белка Klotho в клеточных лизатах контрольной группы клеток составила 74,22±6,73 в и 93,03±6,65 в экспериментальной группе (пг белка Klotho/мкг общего белка). Выявленные различия также являются статистически достоверными, р<0,05. На Фиг. 2 представлены - Концентрации белка Klotho в клеточных лизатах (Klotho, пг/общий белок, мкг).
Аналогичным образом, в культуральной среде были обнаружены более значительные различия, из-за высвобождения белка наружу (Фиг. 3 - Концентрация белка Klotho в культуральной среде, пг/мл). Так, концентрация белка Klotho в контроле составила 7,82±2,11 пг/мл по сравнению с опытом: 115,1±13,24 пг/мл. Следовательно, трансфекция клеток плазмидой, несущей ген Klotho сама по себе способствовала увеличению количества белка Klotho в культуральной среде генномодифицированных ММСК более чем в 14 раз (р<0,001). Последнее имеет почти ту же величину, что и данные сверхэкспрессии RT-qPCR (14,72 против 13,55), указывающие на то, что общая мРНК транслировалась в белок.
Пример 3
Получение и определение экзосом
С целью получения экзосом, на начальном этапе кондиционную среду центрифугируют (600g, 60 минут), для отделения клеточной фракции. Для сбора супернатанта центрифугируют дважды при 15000-17000g в течение 220 минут, а для повторного сбора полученного супернатанта (при 100000g) в течение 300 минут. Затем полученный осадок повторно ресуспендируется до 1/10 от его исходного объема в PEG буфере с дополнительным концентрированием раствора экзосом путем центрифугирования при 100000g в течение 120 минут. Полученный супернатант фильтруют на нитроцеллюлозных фильтрах с диаметром пор 220 нм. Фильтрат в дальнейшем используют с терапевтическими целями. Фильтрат, полученный на предыдущем этапе, помещали на предметное стекло и немедленно микроскопировали, избегая высушивания и разрушения экзосом. На Фиг. 4 представлена Экзосома. Трансмиссионная электронная микроскопия, негативное контрастирование 2% водным раствором уранилацетата.
Таким образом, полученные экзосомы находятся в пределах от 50 до 150 нм и характеризуются округлой формой с мелкозернистыми включениями, что соответствует «правилам» международного общества по изучению внеклеточных везикул (ISEV, International Society for Extacellular Vesicles), регламентирующего основные методические вопросы работы с внеклеточными везикулами.
Пример 4.
Клиническое применение
Клиническое применение препарата осуществлено на основании решения ЛЭК ФГБОУ ВО «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации и на основании письменного информированного согласия пациента.
Женщина и мужчина 23 и 27 лет соответственно с детства страдают атопическим дерматитом. Диагноз атопического дерматита установлен в 2-4 летнем возрасте. Так, пациентка Я. характеризуется обострениями осенью и весной, иногда зимой. Продолжительность клинических проявлений на фоне терапии не менее 30 дней. Отдельные проявления на конечностях (экскориации, зуд, неровности кожи) сохраняются более длительное время (до полугода и более). Пациент М. отмечает обострения мокнущего дерматита на тыльной стороне рук. Обычная продолжительность клинических проявлений 2-3 недели. Традиционная терапия к исчезновению признаков заболевания не привела.
Материал (10-30 мм3) в виде образцов, полученных методом панч-биопсии, был взят у пациентов в асептических условиях.
После забора образцы помещали в стерильные одноразовые полипропиленовые пробирки содержащие от 5 до 50 мл смесевой питательной среды DMEM/F-12, в соотношении 1:1, с добавлением культуральных антибиотиков пенициллина, стрептомицина и амфотерицина В (Sigma Aldrich, США). При температуре +4°С пробы доставляли в лабораторию в течение не более чем в течение 4 часов. Далее образцы ткани препарировали на чашках Петри в ламинарных боксах, удаляя некротические ткани, и механически измельчили стерильным лезвием до размеров, не превышающих 4 мм. Полученные кусочки ткани промывали в фосфатном буферном растворе PBS (Биолот, Россия) для удаления форменных элементов крови и помещали в свежую питательную среду DMEM/F-12 с 10% фетальной бычьей сыворотки (ФБС) в культуральные флаконы с площадью посевной поверхности 25 см (Orange, Бельгия).
Клетки культивировали в течение 48 часов при 37°С, 95% влажности и 5% содержании углекислого газа. По истечении двухсуточного срока наблюдения, флаконы подвергали тщательной оценке признаков возможной микроорганизменной контаминации. При отсутствии макро- и микроскопических признаков тех или иных инфекционных агентов, в первичную культуру добавляли лиофилизированную коллагеназу (Биолот, Россия) в рабочей концентрации 200 ед/мл. После достижения полной химической деструкции ткани (в течение 24-48 часов), первичные культуры клеток отмывали от фермента путем центрифугирования при 200g с последующим ресуспендированием клеточного осадка в свежей культуральной среде. Гомогенизированную клеточную суспензию переносили в новые малые культуральные флаконы.
Трансфекцию ММСК выполняли методом липосомальной трансфекции с использованием комплекса поликатионных липидов Lipofectamin 2000 (Sigma Aldrich, США), согласно протоколу производителя. Клетки выращивали на бессывороточной среде StemPro-MSC исходя из двух условий:
1. Применение бессывороточной среды повышает эффективность трансфекции с использованием липосом.
2. Стандартное применение эмбриональных сывороток, в том числе КРС, обычно используемых в качестве добавки к средам при культивировании клеток, в данном случае неприемлемо, поскольку последние несут в своем составе посторонние экзосомы.
В процессе культивирования, при смене среды, 1/3 среды забирали и заменяли на новую. Забранную среду сразу после получения центрифугировали на охлаждаемой центрифуге при 2000g в течение 90 минут при -4°С для ее хранения.
С целью получения экзосом, на начальном этапе кондиционную среду центрифугируют (600g, 60 минут) для отделения клеточной фракции, для предварительного сбора супернатанта центрифугировали дважды при 15000-17000g в течение 220 минут, а для сбора полученного супернатанта при 100000g в течение 300 минут.
В дальнейшем супернатант фильтровали через нитроцеллюлозные фильтры (Sarsthted) с диаметром пор 220 нм. Для концентрирования раствора экзосом осадок повторно ресуспендировали до 1/10 его исходного объема и центрифугировали при 100000g в течение 120 минут. Перед применением готовили взвесь экзосом в физрастворе, который помещали в стерильный шприц.
Полученные экзосомы в виде взвеси в физиологическом растворе наносили на поврежденную поверхность кожи пациентов из расчета 1,0 мкг белка на см при перевязках и влажном ведении два раза в сутки. Спустя 9 суток наблюдалась нормализация структуры кожи, которая соответствовала неповрежденной у обоих пациентов. На Фиг. 5 представлена структура кожи до и после экзосомальной терапии пациентки. (А - проявление атопического дерматита в правой кубитальной ямке. Б – то же, спустя 9 суток начала терапии зкзосомами генно-модифицированных ММСК) Последующие наблюдение не выявило обострения заболевания в течение 5-6 месяцев у обоих пациентов.
Таким образом, использование экзосом, полученных из кондиционной среды генно-модифицированных плазмидой с трансмембранным геном Klotho культивируемых мультипотентных мезинхимальных стромальных клеток позволяет снизить сроки лечения атопического дерматита с 3-4 недель до 8-9 суток и повысить качество терапии в сравнении с существующими способами.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения и концентрирования микроРНК-содержащих экзосом мультипотентных мезенхимально-стромальных клеток для применения в косметических и лекарственных средствах для стимуляции регенеративных процессов и замедления процессов старения | 2018 |
|
RU2710368C2 |
| СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК | 2019 |
|
RU2712770C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СОДЕРЖАЩЕГО ФРАКЦИЮ ЭКЗОСОМ | 2023 |
|
RU2827355C1 |
| ЭКЗОСОМА, ВЫДЕЛЕННАЯ ИЗ СЕПТАЛЬНОГО ХРЯЩА, ИСПОЛЬЗОВАННАЯ ДЛЯ ПОЛУЧЕНИЯ ХРЯЩЕВОЙ ТКАНИ | 2019 |
|
RU2833888C2 |
| КОДОН-ОПТИМИЗИРОВАННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ВОССТАНОВЛЕНИЯ КРОВЕНОСНЫХ СОСУДОВ | 2014 |
|
RU2557385C1 |
| ЭКЗОСОМЫ, СОДЕРЖАЩИЕ ТЕРАПЕВТИЧЕСКИЕ ПОЛИПЕПТИДЫ | 2017 |
|
RU2737732C2 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ИНГАЛЯЦИИ | 2019 |
|
RU2799315C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ, ПРОИСХОДЯЩИХ ИЗ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК, И КУЛЬТУРАЛЬНОГО РАСТВОРА, ПРОДУЦИРОВАННОГО ИЗ НИХ | 2020 |
|
RU2799432C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |


Изобретение относится к биотехнологии и может быть использовано для лечения атопического дерматита. Представлен способ, в котором для лечения атопического дерматита используются экзосомы, полученные из кондиционной культуры мультипотентных мезенхимальных стромальных клеток, предварительно трансфицированных плазмидным вектором, несущим в качестве полезного ген Klotho membrane. Выделяемые в процессе культивирования трансфицированными клетками экзосомы, включающие трансмембранную форму белка Klotho, наносят на область кожного дефекта в количестве 1,0 мкг на см кожного дефекта два раза в сутки. Таким образом, использование изобретения позволяет снизить сроки лечения атопического дерматита с 3-4 недель до 8-9 суток и повысить качество терапии в сравнении с существующими способами. 2 з.п. ф-лы, 5 ил., 4 пр.
1. Способ терапии атопического дерматита с применением аутологичных мультипотентных мезенхимальных стромальных клеток, предварительно трансфицированных встроенным в векторы геном Klotho с последующим нанесением клеток на область повреждения, отличающийся тем, что клетки генетически модифицируют с помощью трансфекции вектором, несущим в качестве полезного трансмембранный ген Klotho, кодирующий соответствующую форму белка Klotho, при этом на область дефекта наносят экзосомы, выделенные в процессе культивирования из кондиционной среды генно-модифицированных мультипотентных мезенхимальных стромальных клеток в количестве 1,0 мкг белка на см кожного дефекта в виде взвеси в физиологическом растворе два раза в сутки.
2. Способ терапии атопического дерматита по п. 1, отличающийся тем, что в качестве вектора, несущего трансмембранный ген Klotho, применяют плазмиду, которая не интегрируется в геном и не изменяет его последовательность.
3. Способ терапии атопического дерматита по п. 1, отличающийся тем, что первичную культуру клеток получают из эксплантата, взятого под местной анестезией с ягодичной области самого пациента.
| DALTON G.D, XIE J, AN S.W, HUANG C.L., New Insights into the Mechanism of Action of Soluble Klotho | |||
| Front Endocrinol, Lausanne 17.11.2017 | |||
| PRUD'HOMME J, KURT M., & WANG Q., Pathobiology of the Klotho Antiaging Protein and Therapeutic Considerations | |||
| Frontiers in aging, 3, 07.2022 | |||
| DEARMAN В.L., ВOYCE S.Т., GREENWOOD J.Е., Advances in Skin Tissue |
Авторы
Даты
2023-09-25—Публикация
2022-12-15—Подача