Область техники, к которой относится изобретение
Настоящее изобретение относится к производному циклогексилбензола, такому как 4-(4-алкилциклогексил)бензальдегид, и к способу его получения. Более конкретно, настоящее изобретение относится к способам получения 4-(4-алкилциклогексил)бензальдегида,
4-(циклогексил)бензальдегида,
4-(транс-4-алкилциклогексил)бензальдегида и
(транс-4-алкилциклогексил)бензола, которые могут быть использованы в составе химических продуктов, таких как продукты, используемые в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения.
Уровень техники
Производные циклогексилбензола известны в качестве жидкокристаллических соединений (см. непатентный документ 1). Например, описан способ получения 4-(транс-4-гептилциклогексил)бензойной кислоты (см. патентный документ 1), а также описан 4'-(4-пропилгексил)бифенил-4-илацетат (см. патентный документ 2). Кроме того, используются 4-(транс-4-пентилциклогексил)бензальдегид (см. непатентный документ 2), 4-(транс-4-пропилциклогексил)бензальдегид (см. патентный документ 3) и т.д. С другой стороны, в качестве инициатора фотополимеризации описан 1,2-бис(4-(4-пропилциклогексил)фенил)этан-1,2-дион (см. патентный документ 4). Производные циклогексилбензола также используют в фармацевтических применениях и считается, что они могут использоваться в качестве функциональных материалов в различных областях (см. патентный документ 5).
Таким образом, производные циклогексилбензола разрабатывают, в основном, для применения в качестве жидкокристаллических соединений, и, кроме того, существует возможность их применения и развития в различных областях, таких как лекарственные препараты и функциональные материалы. В данных обстоятельствах, определенно предпринимаются попытки разработок новых соединений.
В области таких технологий известен способ получения 4-(транс-4-пентилциклогексил)бензальдегида окислением 4-(транс-4-пентилциклогексил)бензилового спирта хромовой кислотой (см. непатентный документ 2). Известный способ, однако, не является предпочтительным в качестве промышленного способа, так как 4-(транс-4-пентилциклогексил)бензиловый спирт не является легкодоступным исходным веществом, и поэтому необходимо использовать хромовую кислоту, обладающую высокой токсичностью. Также известен способ получения 4-(транс-4-пропилциклогексил)бензальдегида восстановлением 4-(транс-4-пропилциклогексил)бензонитрила с помощью NaAlH2(OC2H4ОCH3)2 (см. патентный документ 3). Применение данного способа в промышленном масштабе также проблематично, потому что 4-(транс-4-пропилциклогексил)бензонитрил не является легкодоступным исходным веществом, необходимо использовать большое количество дорогого NaAlH2(OC2H4ОCH3)2 в качестве восстановителя, и в большом количестве образуются побочные продукты, такие как Al(OH)3.
4-(4-Алкилциклогексил)бензальдегид можно также получить из (4-алкилциклогексил)бензола, как указано ниже. (4-Алкилциклогексил)бензол сначала подвергают взаимодействию с бромом в присутствии восстановленного железного катализатора, с получением 4-(4-алкилциклогексил)бромбензола. Затем эфирный раствор очищенного 4-(4-алкилциклогексил)бромбензола добавляют по каплям к эфирному раствору, содержащему металлический магний. Полученную смесь подвергают взаимодействию с этилортоформиатом, получая диэтилацеталь 4-(4-алкилциклогексил)бензальдегида, который, в конечном итоге, гидролизуют водным раствором хлористоводородной кислоты, с получением целевого 4-(4-алкилциклогексил)бензальдегида.
Однако помимо желаемого транс-изомера, полученный таким образом альдегидный продукт обычно содержит цис-изомер в количестве, соответствующем количеству в исходном материале. Так как температуры кипения данных изомеров очень близки, их невозможно разделить и очистить перегонкой. Можно рассмотреть возможность выделения транс-изомера методом кристаллизации. Однако такой способ неэффективен и требует больших затрат. Таким образом, существует потребность в эффективном способе селективного синтеза транс-изомера путем регулирования условий реакции.
Как правило, производное циклогексилбензола получают в виде смеси его цис- и транс-изомеров. Поэтому необходимо внедрить способ выделения транс-изомера из смеси. В качестве способа выделения транс-изомера из смеси изомеров обычно используют метод кристаллизации, как указано выше. Такой способ, однако, неэффективен и требует больших затрат.
Также исследовался способ эффективного получения транс-изомера изомеризацией цис-изомера в транс-изомер. Например, в патентном документе 6 и патентном документе 7 описан способ получения транс-изомера изомеризацией цис-изомера в транс-изомер с использованием трет-бутоксида калия. В данном способе, однако, необходимо использовать большое количество трет-бутоксида калия и, поэтому, требуются большие усилия для решения задачи обработки отработанного щелочного раствора, остающегося после реакции.
Также описан способ, где цис-изомер изомеризуют в транс-изомер в присутствии кислоты Льюиса, такой как хлорид алюминия, и алкилгалогенидного соединения (см. патентный документ 8). Данный способ, однако, сопряжен с проблемой обработки хлорида алюминия после реакции и, кроме того, необходимостью использования растворителя, такого как метиленхлорид, который неблагоприятен для окружающей среды.
Кроме того, описан способ изомеризации цис-изомера в транс-изомер с использованием гетерополикислоты (см. патентный документ 9). Данный способ, однако, требует длительного времени реакции и не всегда обеспечивает высокую эффективность реакции.
Кроме того, описан способ изомеризации цис-изомера в транс-изомер с использованием трифторметансульфоновой кислоты (см. патентный документ 10). Однако данный способ неэкономичен ввиду необходимости использования большого количества дорогой трифторметансульфоновой кислоты и, кроме того, сопряжен с проблемой использования в качестве растворителя для экстракции метиленхлорида, который неблагоприятен для окружающей среды.
Непатентный документ 1: Quarterly Chemical Review 22, "Chemistry of Liquid Crystals", Yasuyuki GOTO, published by Academy Publication Center, April 25, 1994, p. 40-59.
Непатентный документ 2: HELVETICA CHIMICA ACTA, Vol. 68 (1985), p. 1444-1452.
Патентный документ l: Japanese Patent Application Laid-Open No. S56-077231.
Патентный документ 2: Japanese Patent Application Laid-Open No. S62-067049.
Патентный документ 3: Japanese Patent Application Laid-Open No. H03-141274.
Патентный документ 4: Japanese Patent Application Laid-Open No. H11-171816.
Патентный документ 5: Japanese Patent Application Laid-Open No. H06-293741.
Патентный документ 6: Japanese Patent Application Laid-Open No. H07-278548.
Патентный документ 7: Japanese Patent Application Laid-Open No. H09-278687.
Патентный документ 8: Japanese Patent Application Laid-Open No. H09-100286.
Патентный документ 9: Japanese Patent Application Laid-Open No. H07-41435.
Патентный документ 10: Japanese Patent Application Laid-Open (KOKAI) No. 2004-256490.
Подробное описание изобретения
Задачи, на решение которых направлено настоящее изобретение
Ввиду описанных обстоятельств, первой задачей настоящего изобретения является предоставление способа получения 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, которые пригодны для использования в составе химических продуктов, таких как продукты, используемые в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения, и нового 4-(4-алкилциклогексил)бензальдегида. Второй задачей настоящего изобретения является предоставление промышленного способа получения, который способен обеспечить селективный синтез 4-(транс-4-алкилциклогексил)бензальдегида и дать возможность легкого получения продуктов высокой чистоты. Третьей задачей настоящего изобретения является предоставление промышленного способа получения, который способен обеспечить селективный синтез (транс-4-алкилциклогексил)бензола, пригодного для использования в составе химических продуктов, таких как продукты, используемые в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения, и дать возможность легкого получения продуктов высокой чистоты.
Средства решения указанных задач
В результате серьезного исследования, направленного на решение вышеуказанных задач, авторы настоящего изобретения обнаружили, что указанную первую задачу настоящего изобретения можно решить формилированием (4-алкилциклогексил)бензола или циклогексилбензола монооксидом углерода в присутствии фтороводорода (в дальнейшем иногда обозначается HF) и трифторида бора (в дальнейшем иногда обозначается BF3) и что вторую задачу настоящего изобретения можно решить формилированием (4-алкилциклогексил)бензола, обладающего цис/транс соотношением, не превышающим определенного значения, монооксидом углерода в присутствии HF-BF3. Кроме того, было обнаружено, что третью задачу настоящего изобретения можно решить изомеризацией смеси цис- и транс-изомеров (4-алкилциклогексил)бензола в присутствии HF-BF3. Настоящее изобретение было создано на основе указанных открытий.
То есть, настоящее изобретение предоставляет следующее:
[l] Способ получения 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, включающий формилирование производного бензола, представленного следующей формулой (1a), монооксидом углерода в присутствии фтороводорода и трифторида бора, с получением 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного следующей формулой (2).

В формуле (1a), R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода.
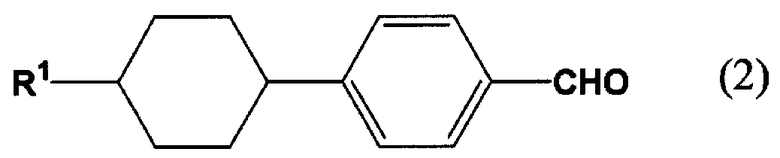
В формуле (2) R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода.
[2] 4-(4-н-Бутилциклогексил)бензальдегид, представленный следующей формулой (3).

[3] Способ получения 4-(транс-4-алкилциклогексил)бензальдегида, включающий формилирование (4-алкилциклогексил)бензола, представленного следующей формулой (1b) и имеющего молярное соотношение цис/транс 0,3 или менее, монооксидом углерода в присутствии фтороводорода и трифторида бора, с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного следующей формулой (4).
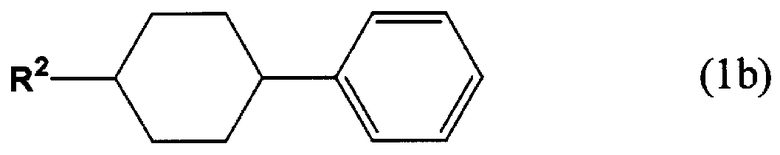
В формуле (1b), R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.

В формуле (4) R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
[4] 4-(Транс-4-алкилциклогексил)бензальдегид, имеющий чистоту 4-(4-алкилциклогексил)бензальдегида 98% или более и чистоту транс-изомера 99% или более.
[5] Способ получения (транс-4-алкилциклогексил)бензола, представленного следующей формулой (5), включающий изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), в присутствии фтороводорода и трифторида бора.

В формуле (5) R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
[6] Способ получения 4-(транс-4-алкилциклогексил)бензальдегида, включающий изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), в присутствии фтороводорода и трифторида бора, с получением (транс-4-алкилциклогексил)бензола, представленного вышеуказанной формулой (5), и затем последовательное формилирование (транс-4-алкилциклогексил)бензола монооксидом углерода, с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного вышеуказанной формулой (4).
Осуществление изобретения
Согласно способу по настоящему изобретению 4-(4-алкилциклогексил)бензальдегид или 4-(циклогексил)бензальдегид, которые пригодны для использования в составе химических продуктов, таких как продукты, используемые в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения, могут быть получены с хорошим выходом формилированием (4-алкилциклогексил)бензола или циклогексилбензола монооксидом углерода в присутствии HF-BF3. 4-(4-н-Бутилциклогексил)бензальдегид, полученный вышеуказанным способом, является новым соединением и представляет собой соединение, пригодное для использования в материалах для электронного оборудования, таких как жидкие кристаллы, и для фармацевтического и агрохимического применения.
Кроме того, согласно способу по настоящему изобретению, 4-(транс-4-алкилциклогексил)бензальдегид может быть легко селективно получен путем взаимодействия (4-алкилциклогексил)бензола с монооксидом углерода в присутствии HF-BF3.
Кроме того, согласно способу по настоящему изобретению, (транс-4-алкилциклогексил)бензол высокой чистоты может быть селективно легко получен изомеризацией смеси цис- и транс-изомеров (4-алкилциклогексил)бензола в присутствии HF-BF3. Данное соединение представляет собой соединение, пригодное, например, для использования в материалах для электронного оборудования, таких как жидкие кристаллы, и для фармацевтического и агрохимического применения.
Предпочтительные варианты осуществления изобретения
Способ получения 4-(4-алкилциклогексил)бензальдегида по настоящему изобретению отличается тем, что производное бензола, представленное следующей формулой (1a), формилируют монооксидом углерода в присутствии HF и BF3, с получением 4-(4-алкилциклогексил)бензальдегида, представленного следующей формулой (2).

В формуле (1a) R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода.

В формуле (2) R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода.
Способ получения 4-(транс-4-алкилциклогексил)бензальдегида по настоящему изобретению отличается тем, что (4-алкилциклогексил)бензол, представленный следующей формулой (1b), имеющий молярное соотношение цис/транс 0,3 или менее, формилируют монооксидом углерода в присутствии HF и BF3, с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного следующей формулой (4).

В формуле (1b), R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.

В формуле (4) R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
Примеры алкильной группы, содержащей 1-10 атомов углерода, которая представлена заместителем R1 в формуле (1a) или R2 в формуле (1b), включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, н-гексильную группу, н-гептильную группу, н-октильную группу, н-нонильную группу и н-децильную группу. Из данных групп предпочтительными являются метильная группа, этильная группа, н-пропильная группа, н-бутильная группа, н-пентильная группа, н-гексильная группа и н-гептильная группа, и более предпочтительными являются н-пропильная группа, н-бутильная группа и н-пентильная группа.
Производное бензола, представленное формулой (1a) или (1b), можно получить в соответствии со способом, описанным в Журнале Органической Химии СССР, том 19, стр. 1479-1483, 1983. А именно, исходные вещества, включающие циклогексен, хлорангидрид жирной кислоты и бензол, подвергают взаимодействию в присутствии AlCl3 и полученный 4-алканоил-1-фенилциклогексан затем подвергают восстановлению по Вольфу-Кижнеру. Альтернативно, производное бензола можно получить способом, описанным в Japanese Patent Application Laid-Open No. H09-100286, в котором реактив Гриньяра, полученный из бромбензола и магния, подвергают взаимодействию с 4-алкилциклогексаноном, с последующей дегидратацией и гидрированием.
(4-Алкилциклогексил)бензол формулы (1b) имеет два вида изомеров, т.е. транс- и цис-изомеры. В получении 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4), (4-алкилциклогексил)бензол предпочтительно имеет молярное соотношение цис/транс 0,3 или менее, более предпочтительно 0,1 или менее. Молярное соотношение цис/транс 0,3 или менее является предпочтительным, так как чистота полученного 4-(транс-4-алкилциклогексил)бензальдегида (далее иногда называемая "чистотой транс-изомера") составляет 99% или более, в то время как чистота полученного 4-(цис-4-алкилциклогексил)бензальдегида (далее обычно называемая "чистотой цис-изомера") составляет 1% или менее. Когда необходимо дополнительно повысить чистоту транс-изомера, предпочтительно молярное соотношение цис/транс составляет 0,08 или менее, более предпочтительно 0,05 или менее, по тем же причинам, как описано выше. Как использовано в данном описании, термин "чистота транс-изомера" означает содержание (%) транс-изомера по отношению к общему количеству транс и цис-изомеров, в то время как термин "чистота цис-изомера " означает содержание (%) цис-изомера по отношению к общему количеству транс и цис-изомеров.
Соотношение цис/транс можно проанализировать с помощью газовой хроматографии. В качестве способа получения (4-алкилциклогексил)бензола, имеющего молярное соотношение цис/транс 0,3 или менее, можно использовать, например, способ, где 4-алканоил-1-фенилциклогексан, полученный вышеуказанным способом, или (4-алкилциклогексил)бензол кристаллизуют с использованием подходящего растворителя.
В настоящем изобретении особенно важно, что производное бензола, представленное формулой (1a) или (1b), подвергают взаимодействию с монооксидом углерода при использовании HF и BF3 в качестве катализатора, с получением 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4). При использовании такого способа получения можно селективно формилировать п-положение бензольного кольца по отношению к циклогексильной группе и получать желаемый 4-(4-алкилциклогексил)бензальдегид или 4-(циклогексил)бензальдегид, представленный формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегид, представленный формулой (4). Так как HF и BF3, используемые в качестве катализатора, являются легколетучими, они могут быть выделены и рециркулированы. Таким образом, отсутствует необходимость утилизации использованного катализатора. Соответственно, данный способ превосходен в экономическом аспекте и может снизить неблагоприятное воздействие на окружающую среду.
Предпочтительно, чтобы используемый в способе по настоящему изобретению HF был в значительной степени безводным. Количество используемого HF по отношению к производному бензола формулы (1a) или (1b) предпочтительно составляет интервал от 2 до 30 моль, более предпочтительно от 3 до 20 моль на 1 моль производного бензола формулы (1a) или (1b). Когда количество используемого HF меньше указанных значений, невозможно эффективно осуществить формилирование. Чрезмерно большое количество HF свыше указанных значений не является предпочтительным с точки зрения эффективности производства, так как возникает необходимость в крупном реакторе и увеличивается объем работ по выделению HF обратно из реакционной смеси. Количество используемого BF3 по отношению к производному бензола формулы (1a) или (1b) предпочтительно составляет интервал от 1 до 10 моль, более предпочтительно от 1,1 до 5 моль на 1 моль производного бензола формулы (1a) или (1b). Когда количество используемого BF3 меньше указанных значений, скорость формилирования обычно становится крайне низкой и снижается селективность атаки в п-положение. Когда количество используемого BF3 превышает указанные значения, парциальное давление BF3 обычно повышается, а парциальное давление оксида углерода обычно снижается, что приводит к низкому выходу.
Формилирование по настоящему изобретению предпочтительно осуществляют при температуре от -50°C до 30°C, более предпочтительно от -30°C до 20°C. При температуре реакции, превышающей вышеуказанные значения, обычно происходят заметные побочные реакции, такие как разложение и полимеризация, производного бензола, представленного формулой (1a) или (1b), 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4). Температура реакции ниже приведенных выше значений не является предпочтительной, так как обычно снижается скорость формилирования.
С точки зрения выхода, предпочтительно давление монооксида углерода при формилировании составляет от 0,5 до 3 МПа, более предпочтительно от 0,7 до 3 МПа. Давление более 3 МПа является экономически невыгодным и ненужным.
Формилирование производного бензола, представленного формулой (1a) или (1b), монооксидом углерода в присутствии HF и BF3 можно осуществлять с растворителем или без него. Используемый растворитель предпочтительно инертен в условиях реакции и представляет собой, например, алифатический углеводород, такой как н-гексан или н-гептан. Когда используют растворитель, его количество предпочтительно составляет от 0,5 до 20 частей по массе на одну часть по массе производного бензола, представленного формулой (1a) или (1b).
Тип реакции для осуществления формилирования по настоящему изобретению конкретно не ограничивается каким-либо образом, при условии, что он допускает перемешивание для достаточного смешивания жидкой фазы и газообразной фазы. Так, можно использовать любой периодический способ, полупериодический способ, непрерывный способ и т.д.
В случае периодического способа, например, производное бензола, представленное формулой (1a) или (1b), безводный HF и BF3 загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое выдерживают при температуре жидкой фазы от около -50°C до 30°C при перемешивании. Давление повышают до значения от около 0,5 до 3 МПа, используя монооксид углерода. Затем добавляют монооксид углерода при сохранении в автоклаве такого же давления и температуры жидкой фазы. Смесь выдерживают в таких условиях до прекращения поглощения монооксида углерода. Содержимое автоклава выливают на лед, с получением масляного слоя. Образование 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4), может быть подтверждено анализом масляного слоя методом газовой хроматографии.
В случае полупериодического способа, например, безводный HF и BF3 загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое доводят до температуры жидкой фазы от около -50°C до 30°C при перемешивании. Автоклав регулируют таким образом, чтобы температура жидкой фазы оставалась постоянной. Давление повышают до значения от около 0,5 до 3 МПа, используя монооксид углерода. Автоклав регулируют таким образом, чтобы было возможно добавлять монооксид углерода при сохранении давления в автоклаве. Затем в автоклав добавляют производное бензола формулы (1a) или (1b), растворенное в растворителе. После завершения добавления исходного вещества автоклав выдерживают в таких условиях в течение заданного периода времени. Содержимое автоклава выливают на лед, с получением масляного слоя. Образование 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4), можно быть подтверждено анализом масляного слоя методом газовой хроматографии.
В случае непрерывного способа, например, безводный HF и BF3 сначала загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое доводят до температуры жидкой фазы от около -50°C до 30°C при перемешивании. Автоклав регулируют таким образом, чтобы температура жидкой фазы оставалась постоянной. Давление повышают до значения от около 0,5 до 3 МПа, используя монооксид углерода. Автоклав регулируют таким образом, чтобы было возможно добавлять монооксид углерода при сохранении давления в автоклаве. Затем в автоклав добавляют производное бензола формулы (1a) или (1b), растворенное в растворителе, для проведения реакции полупериодическим способом. Последовательно начинают добавление безводного HF и BF3, при непрерывном сливании жидкой реакционной массы в ледяную воду. Время нахождения жидкой реакционной массы в автоклаве предпочтительно составляет от 1 до 5 ч. Когда время нахождения меньше вышеуказанного значения, успешно осуществить реакцию обычно не удается. Избыточное время нахождения, превышающее указанные пределы, приводит к недостаточной эффективности из-за необходимости использования большой установки. Образование 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, представленного формулой (2), или 4-(транс-4-алкилциклогексил)бензальдегида, представленного формулой (4), может быть подтверждено анализом полученного масляного слоя методом газовой хроматографии.
Конечная точка реакции конкретно не определена, но ею может служить, например, момент времени, в который прекращается поглощение монооксида углерода.
Полученный формилированием жидкий продукт реакции представляет собой HF раствор комплекса 4-(4-алкилциклогексил)бензальдегид·HF-BF3, HF раствор комплекса 4-(циклогексил)бензальдегид·HF-BF3 или HF раствор комплекса 4-(транс-4-алкилциклогексил)бензальдегид·HF-BF3. При нагревании комплекса разрывается связь между HF-BF3 и 4-(4-алкилциклогексил)бензальдегидом, 4-(циклогексил)бензальдегидом или 4-(транс-4-алкилциклогексил)бензальдегидом. Таким образом, HF и BF3 отделяют выпариванием из раствора и, следовательно, они могут быть выделены и рециркулированы. В данном случае необходимо разложить комплекс как можно скорее и избежать термического разложения и изомеризации продукта. Для быстрого разложения комплекса желательно осуществить разложение при кипячении растворителя с обратным холодильником, инертного по отношению к HF-BF3 (например, насыщенного углеводорода, такого как гептан, или ароматического углеводорода, такого как бензол).
Настоящее изобретение также предоставляет 4-(4-н-бутилциклогексил)бензальдегид, представленный следующей формулой (3).

4-(4-н-Бутилциклогексил)бензальдегид формулы (3), который является новым соединением, можно получить, подвергая взаимодействию (4-н-бутилциклогексил)бензол, используемого в качестве (4-алкилциклогексил)бензола, с монооксидом углерода в присутствии HF и BF3 таким же образом, как описано выше.
Настоящее изобретение, кроме того, предоставляет 4-(транс-4-алкилциклогексил)бензальдегид, имеющий чистоту 4-(4-алкилциклогексил)бензальдегида 98% или более и чистоту транс-изомера 99% или более.
Данное вещество может быть легко получено очисткой путем перегонки неочищенного продукта, полученного термическим разложением HF раствора комплекса 4-(транс-4-алкилциклогексил)бензальдегид·HF-BF3.
Циклическое полифенольное соединение можно синтезировать при использовании в качестве исходных веществ 4-(4-алкилциклогексил)бензальдегида, полученного способом по настоящему изобретению, и фенольного соединения методом дегидратирующей конденсации данных соединений в присутствии кислотного катализатора. Циклическое полифенольное соединение можно использовать в составе формирующей подслой композиции, которую можно применять на стадии нанесения покрытия на многослойный резист в процессе формирования микроструктуры при производстве полупроводниковых устройств и подобного.
Способ получения (транс-4-алкилциклогексил)бензола по настоящему изобретению включает изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), в присутствии HF и BF3, с получением (транс-4-алкилциклогексил)бензола, представленного следующей формулой (5).

В формуле (5) R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
В настоящем изобретении особенно важно то, что цис-изомер, содержащийся в (транс-4-алкилциклогексил)бензоле, представленном формулой (1b), подвергают изомеризации в транс-изомер, при использовании в качестве катализатора HF и BF3, с получением (транс-4-алкилциклогексил)бензола, представленного формулой (5). При применении данного способа можно получить целевой (транс-4-алкилциклогексил)бензол, представленный формулой (5). Поскольку HF и BF3, используемые в качестве катализаторов, являются легколетучими, их можно выделить из реакционной смеси и рециркулировать. Таким образом, отсутствует необходимость утилизации использованного катализатора. Соответственно, данный способ превосходен в экономическом аспекте и может снизить неблагоприятное воздействие на окружающую среду.
Смесь цис- и транс-изомеров (4-алкилциклогексил)бензола, используемую в настоящем изобретении, можно получить способом, описанным в Журнале Органической Химии СССР, том 19, стр. 1479-1483, 1983, способом, описанным в Japanese Patent Application Laid-Open No. H09-100286, или способом, описанным в Japanese Patent Application Laid-Open No. H07-278548. Молярное соотношение цис/транс (4-алкилциклогексил)бензола составляет 0,3 или более.
Предпочтительно, чтобы используемый в способе по настоящему изобретению HF был в значительной степени безводным. Количество используемого HF относительно смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b) предпочтительно находится в диапазоне от 2 до 30 моль, более предпочтительно от 2 до 20 моль, на 1 моль смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b). Когда количество используемого HF меньше указанных значений, обычно невозможно эффективно осуществить изомеризацию. Слишком большое количество HF свыше указанных значений не является предпочтительным с точки зрения эффективности производства, так как обычно возникает необходимость в крупном реакторе и увеличивается объем работ по выделению HF обратно из реакционной смеси. Количество используемого BF3 относительно смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b) предпочтительно находится в диапазоне от 0,1 до 2 моль, более предпочтительно от 0,1 до 1 моль, на 1 моль смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b). Когда количество используемого BF3 меньше указанных значений, скорость изомеризации обычно становится крайне низкой. Отсутствует необходимость использования избыточного количества BF3, превышающего указанные значения.
Реакцию изомеризации по настоящему изобретению предпочтительно осуществляют при температуре от -50°C до 30°C, более предпочтительно от -30°C до 20°C. При температуре реакции, превышающей указанные значения, обычно начинают протекать побочные реакции, такие как разложение смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b) или (транс-4-алкилциклогексил)бензола, представленного формулой (5). Температура реакции ниже вышеуказанных значений не является предпочтительной, так как снижается скорость изомеризации.
Изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b) в присутствии HF и BF3 можно осуществлять с растворителем или без него. Предпочтительно использовать растворитель, который инертен к реакции и представляет собой, например, алифатический углеводород, такой как н-гексан или н-гептан. Когда используется растворитель, его количество предпочтительно составляет от 0,5 до 20 частей по массе на одну часть по массе смеси цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b).
Тип реакции для проведения изомеризации согласно способу по настоящему изобретению конкретно не ограничивается каким-либо образом, при условии, что он допускает перемешивание для достаточного смешивания жидкой фазы и газообразной фазы. Таким образом, можно использовать любой периодический способ, полупериодический способ, непрерывный способ и т.д.
В случае периодического способа, например, смесь цис- и транс-изомеров (4-алкилциклогексил)бензола формулы (1b), безводного HF и BF3 загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое выдерживают при температуре жидкой фазы от около -50°C до 30°C при перемешивании и затем выливают на лед, с получением масляного слоя. Образование (транс-4-алкилциклогексил)бензола, представленного формулой (5), может быть подтверждено анализом масляного слоя методом газовой хроматографии.
В случае полупериодического способа, например, безводный HF и BF3 загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое доводят до температуры жидкой фазы от около -50°C до 30°C при перемешивании. Автоклав регулируют таким образом, чтобы температура жидкой фазы оставалась постоянной. Затем в автоклав добавляют производное бензола формулы (1a) или (1b), растворенное в растворителе. После завершения добавления исходного вещества автоклав выдерживают в таких условиях в течение заданного периода времени. Содержимое автоклава выливают на лед, с получением масляного слоя. Образование (транс-4-алкилциклогексил)бензола, представленного формулой (5), может быть подтверждено анализом полученного масляного слоя методом газовой хроматографии.
В случае непрерывного способа, например, безводный HF и BF3 сначала загружают в автоклав, снабженный электромагнитной мешалкой. Содержимое доводят до температуры жидкой фазы от около -50°C до 30°C при перемешивании. Автоклав регулируют таким образом, чтобы температура жидкой фазы оставалась постоянной. Затем в автоклав добавляют смесь цис- и транс-изомеров (4-алкилциклогексил)бензола для осуществления реакции полупериодическим способом. После этого начинают добавление безводного HF и BF3, при непрерывном сливании жидкой реакционной массы в ледяную воду. Время нахождения жидкой реакционной массы в автоклаве предпочтительно составляет от 0,3 до 5 ч. Когда время нахождения меньше вышеуказанного значения, успешно осуществить реакцию обычно не удается. Избыточное время нахождения, превышающее указанные пределы, приводит к недостаточной эффективности из-за необходимости использования большой установки. Образование (транс-4-алкилциклогексил)бензола, представленного формулой (5), может быть подтверждено анализом полученного масляного слоя методом газовой хроматографии.
Полученный изомеризацией жидкий продукт реакции представляет собой HF раствор комплекса (транс-4-алкилциклогексил)бензол·HF-BF3. При нагревании комплекса разрывается связь между (транс-4-алкилциклогексил)бензолом и HF-BF3. Таким образом, HF и BF3 отделяют выпариванием из раствора, и, следовательно, их можно выделить из реакционной смеси и использовать повторно. В данном случае необходимо разложить комплекс как можно скорее и избежать термического разложения и изомеризации продукта. Для быстрого разложения комплекса желательно осуществить разложение при кипячении растворителя с обратным холодильником, инертного по отношению к HF-BF3 (например, насыщенного углеводорода, такого как гептан, или ароматического углеводорода, такого как бензол). Неочищенный продукт, полученный термическим разложением, можно легко очистить перегонкой, с получением (транс-4-алкилциклогексил)бензола, имеющего молярное соотношение цис/транс менее 0,1.
Полученный таким образом (транс-4-алкилциклогексил)бензол можно использовать в качестве исходного вещества для получения 4-(транс-4-алкилциклогексил)бензальдегида вышеуказанной формулы (4).
Настоящее изобретение также предоставляет способ получения 4-(транс-4-алкилциклогексил)бензальдегида, включающий изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), в присутствии HF и BF3, с получением (транс-4-алкилциклогексил)бензола, представленного вышеуказанной формулой (5), и последовательное формилирование (транс-4-алкилциклогексил)бензола монооксидом углерода, с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного вышеуказанной формулой (4).
В данном способе получения изомеризацию и последовательное формилирование можно проводить в присутствии тех же HF и BF3.
При изомеризации количества используемых HF и BF3 относительно смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), может быть таким, как в описанной выше изомеризации.
Реакцию формилирования осуществляют добавлением монооксида углерода и дополнительного количества BF3, для компенсации его недостатка, к жидкой реакционной смеси от реакции изомеризации. Общее количество BF3, включая его дополнительное количество, относительно смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного вышеуказанной формулой (1b), может быть таким, как при описанном выше формилировании.
Примеры
Настоящее изобретение далее будет подробно описано с помощью приведенных ниже примеров. Следует отметить, однако, что приведенные ниже примеры являются исключительно иллюстративными и не предназначены для ограничения настоящего изобретения только ими.
Пример синтеза 1
Синтез (4-н-пропилциклогексил)бензола (молярное соотношение цис/транс: 1,36)
В трехгорлой колбе объемом 2000 мл (внутренний объем), снабженной обратным холодильником, смешивали 600 мл гексана и 160 г безводного AlCl3 и охлаждали до -60°C, затем добавляли 110 г пропионилхлорида и 82,2 г циклогексена. Температуру смеси повышали до -40°C при перемешивании смеси в течение 3,5 ч. Растворитель затем удаляли декантированием и осадок промывали холодным гексаном. К полученному таким образом 1-пропионил-2-хлорциклогексану добавляли 500 мл бензола и дополнительное количество (60 г) AlCl3. Затем смесь перемешивали при 45°C в течение 3,5 ч. Жидкую реакционную смесь охлаждали до комнатной температуры и затем выливали на лед. Масляный слой отделяли и концентрировали, с получением 130 г (4-пропионилциклогексил)бензола. Полученное вещество смешивали с 1200 мл диэтиленгликоля, 225 г гидроксида калия и 310 г 80%-ного (по массе) гидразингидрата. После кипячения с обратным холодильником полученной смеси в течение 1 ч содержимое колбы нагревали до 220°C для отгонки из нее летучих веществ. Затем смесь кипятили с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и затем выливали в воду. Масляный слой затем экстрагировали гексаном, промывали водой, 5%-ной (по массе) серной кислотой и 80%-ной (по массе) серной кислотой и затем сушили. Полученный масляный слой очищали перегонкой, с получением 85 г (4-н-пропилциклогексил)бензола. Результаты анализа методом газовой хроматографии подтвердили, что чистота (4-н-пропилциклогексил)бензола составляла 98,0%, и молярное соотношение цис/транс составляло 1,36.
Пример синтеза 2
Синтез (4-н-пропилциклогексил)бензола (молярное соотношение цис/транс: 0,05)
В 50 г гексана при 50°C растворяли 100 г (4-н-пропилциклогексил)бензола, полученного в примере синтеза 1. Полученный раствор охлаждали до -30°C. Выпавшие с осадок кристаллы отделяли фильтрованием в количестве 35 г. Кристаллы смешивали с 300 мл диэтиленгликоля, 60 г гидроксида калия и 80 г 80%-ного (по массе) гидразингидрата. После кипячения с обратным холодильником полученной смеси в течение 1 ч содержимое колбы нагревали до 220°C для отгонки из нее летучих веществ. Затем смесь кипятили в течение 1 ч, охлаждали до комнатной температуры и затем выливали в воду. Масляный слой затем экстрагировали гексаном, промывали водой, 5%-ной (по массе) серной кислотой и 80%-ной (по массе) серной кислотой и затем сушили. Полученный масляный слой очищали перегонкой, с получением 26 г (4-н-пропилциклогексил)бензола. Результаты анализа методом газовой хроматографии подтвердили, что чистота (4-н-пропилциклогексил)бензола составляла 98,0%, и молярное соотношение цис/транс составляло 0,05.
Пример синтеза 3
Синтез (4-н-пентилциклогексил)бензола (молярное соотношение цис/транс: 0,02)
В трехгорлую колбу объемом 2000 мл (внутренний объем), снабженную обратным холодильником, загружали 700 мл безводного тетрагидрофурана (ТГФ) и 27 г магниевых стружек, добавляли по каплям 160 г бромбензола со скоростью, обеспечивающей постоянное умеренное кипячение. После завершения прикапывания смесь дополнительно перемешивали в течение 1 ч. К данной смеси добавляли раствор 170 г 4-н-пентилциклогексанона (доступно от Tokyo Chemical Industry Co., Ltd.) в 100 мл ТГФ при 50°C. Затем смесь кипятили с обратным холодильником в течение 2 ч. Полученный жидкий продукт реакции охлаждали до комнатной температуры, выливали в водный раствор хлорида аммония и затем экстрагировали бензолом. К бензольному раствору добавляли 1 г п-толуолсульфоновой кислоты и кипятили с обратным холодильником с удалением образующейся воды. По окончании отгонки воды реакционную смесь охлаждали до комнатной температуры, промывали водным раствором бикарбоната натрия и затем насыщенным раствором соли, сушили и затем концентрировали. Остаток очищали колоночной хроматографией на силикагеле, с получением (4-н-пентилциклогексенил)бензола. Полученный таким образом продукт растворяли в 1000 мл этилацетата и гидрировали при 0,5 МПа с использованием 2 г Pd/C (5% по массе) в качестве катализатора. После поглощения теоретически необходимого количества водорода катализатор отделяли фильтрованием. Полученный фильтрат концентрировали, с получением 220 г (4-н-пентилциклогексил)бензола. Результаты анализа методом газовой хроматографии подтвердили, что чистота (4-н-пентилциклогексил)бензола составляла 97,8%, и молярное соотношение цис/транс составляло 0,67. В 100 г гексана растворяли 220 г (4-н-пентилциклогексил)бензола. Полученный раствор охлаждали до -30°C. Выпавшие в осадок кристаллы отделяли фильтрованием в количестве 100 г. Результаты анализа полученных кристаллов методом газовой хроматографии подтвердили, что чистота (4-н-пентилциклогексил)бензола составляла 98,0%, и молярное соотношение цис/транс составляло 0,02.
Пример синтеза 4
Синтез (транс-4-н-пентилциклогексил)бензола
В 50 г гексана растворяли 100 г (4-н-пентилциклогексил)бензола, полученного в примере синтеза 3. Полученный раствор охлаждали до -30°C. Выпавшие в осадок кристаллы отделяли фильтрованием в количестве 85 г. Результаты анализа полученных кристаллов методом газовой хроматографии подтвердили, что продукт представлял собой высокочистый (транс-4-н-пентилциклогексил)бензол, имеющий содержание цис-изомера 0,8 % (молярное соотношение цис/транс: 0,008).
Пример синтеза 5
Синтез (4-н-пентилциклогексил)бензола (молярное соотношение цис/транс: 0,67)
В трехгорлую колбу объемом 2000 мл (внутренний объем), снабженную обратным холодильником, загружали 700 мл безводного ТГФ и 27 г магниевых стружек, добавляли по каплям 160 г бромбензола со скоростью, обеспечивающей постоянное умеренное кипячение. После завершения прикапывания смесь дополнительно перемешивали в течение 1 ч. К смеси добавляли раствор 170 г 4-н-пентилциклогексанона (доступно от Tokyo Chemical Industry Co., Ltd.) в 100 мл ТГФ при 50°C. Смесь затем кипятили в течение 2 ч. Полученный жидкий продукт реакции охлаждали до комнатной температуры, выливали в водный раствор хлорида аммония и затем экстрагировали бензолом. К бензольному раствору добавляли 1 г п-толуолсульфоновой кислоты и кипятили с обратным холодильником с удалением образующейся воды. По окончании отгонки воды реакционную смесь охлаждали до комнатной температуры, промывали водным раствором бикарбоната натрия и затем водным раствором хлорида натрия, сушили и затем концентрировали. Остаток очищали колоночной хроматографией на силикагеле, получая (4-н-пентилциклогексенил)бензол. Полученный таким образом продукт растворяли в 1000 мл этилацетата и гидрировали при 0,5 МПа с использованием 2 г Pd/C (5% по массе) в качестве катализатора. После поглощения теоретически необходимого количества водорода катализатор отделяли фильтрованием. Полученный фильтрат концентрировали, с получением 220 г (4-н-пентилциклогексил)бензола. Результаты анализа методом газовой хроматографии подтвердили, что чистота (4-н-пентилциклогексил)бензола составляла 99,2% и молярное соотношение цис/транс составляло 0,67.
Пример 1
В снабженный электромагнитной мешалкой автоклав объемом 500 мл (внутренний объем) (изготовленный из SUS316L), с возможностью регулировки температуры, загружали 74,3 г (3,71 моль) безводного HF и 50,5 г (0,744 моль) BF3. При перемешивании содержимого и поддержании температуры жидкой фазы, равной -30°C, давление повышали до 2 МПа, используя монооксид углерода. Затем, поддерживая давление 2 МПа и температуру -30°C, в автоклав добавляли исходные вещества, состоящие из смеси 50,0 г (0,248 моль) (транс-4-н-пропилциклогексил)бензола (доступно от Kanto Chemical Co., Inc., чистота: 98% или выше) и 50,0 г н-гептана, и выдерживали в таких условиях в течение 1 ч. Затем содержимое автоклава выливали на лед, разбавляли бензолом и подвергали нейтрализующей обработке, с получением масляного слоя. Масляный слой анализировали методом газовой хроматографии для определения результатов. Было подтверждено, что конверсия (транс-4-н-пропилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-пропилциклогексил)бензальдегида составила 95,2%. Конечный продукт выделяли простой перегонкой и анализировали методом ГХ-МС. В результате было подтверждено, что конечный продукт имел молекулярную массу 230, как и целевой 4-(транс-4-н-пропилциклогексил)бензальдегид. Химические сдвиги (δ, м.д., стандарт TMS) в спектре 1H-NMR в дейтерированном хлороформе: 0,9 (т, 3H), 1,0-1,6 (м, 9H), 1,9 (м, 4H), 2,55 (м, 1H), 7,36 (д, 2H), 7,8 (д, 2H) и 10 (с, 1H). Чистота 4-(4-н-пропилциклогексил)бензальдегида составляла 98,3%, и чистота транс-изомера составляла 99,0%.
Пример 2
Реакцию формилирования и обработку жидкой реакционной смеси осуществляли по аналогичной методике примера 1, за исключением того, что в качестве исходных веществ загружали смесь 53,6 г (0,248 моль) (транс-4-н-бутилциклогексил)бензола (доступно от Kanto Chemical Co., Inc.; чистота: 98% или выше) и 53,6 г н-гептана. Полученный масляный слой анализировали методом газовой хроматографии для определения результатов. В результате было подтверждено, что конверсия (транс-4-н-бутилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-бутилциклогексил)бензальдегида составила 94,5%. Конечный продукт выделяли простой перегонкой и анализировали методом ГХ-МС. В результате было подтверждено, что конечный продукт имел молекулярную массу 244, как и целевой 4-(транс-4-н-бутилциклогексил)бензальдегид. Химические сдвиги (δ, м.д., стандарт TMS) в спектре 1H-NMR в дейтерированном хлороформе: 0,91 (т, 3H), 1,03 (кв, 2H), 1,2-1,3 (м, 7H), 1,47 (кв, 2H), 1,89 (д, 4H), 2,55 (т, 1H), 7,36 (д, 2H), 7,80 (д, 2H) и 9,96 (с, 1H). Чистота 4-(транс-4-н-бутилциклогексил)бензальдегида составляла 98,5%, и чистота транс-изомера составляла 99,2%.
Пример 3
Реакцию формилирования и обработку жидкой реакционной смеси осуществляли по аналогичной методике примера 1, за исключением того, что в качестве исходных веществ загружали смесь 57,0 г (0,248 моль) (транс-4-н-пентилциклогексил)бензола, полученного в примере синтеза 4, и 57,0 г н-гептана. Полученный масляный слой анализировали газовой хроматографией для определения результатов. Было подтверждено, что конверсия (транс-4-н-пентилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-пентилциклогексил)бензальдегида составила 95,2%. Чистота транс-изомера составляла 99,999%, и чистота цис-изомера составляла 10 м.д.
Пример 4
В снабженный электромагнитной мешалкой автоклав объемом 500 мл (внутренний объем) (изготовленный из SUS316L), с возможностью регулировки температуры, загружали 74,3 г (3,71 моль) безводного HF и 50,5 г (0,744 моль) BF3. При перемешивании содержимого автоклава и поддержании температуры жидкой фазы -30°C, давление повышали до 2 МПа, используя монооксид углерода. Затем, при поддержании давления 2 МПа и температуры -30°C, в автоклав добавляли исходные вещества, состоящие из смеси 50,0 г (0,248 моль; молярное соотношение цис/транс: 0,05) (4-н-пропилциклогексил)бензола, полученного в примере синтеза 2, и 50,0 г н-гептана, и выдерживали в таких условиях в течение 1 ч. Затем содержимое автоклава выливали на лед, разбавляли бензолом и подвергали нейтрализующей обработке, с получением масляного слоя. Масляный слой анализировали методом газовой хроматографии для определения результатов. Было подтверждено, что конверсия (4-н-пропилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-пропилциклогексил)бензальдегида составила 95,2%. Чистота транс-изомера составляла 99,997%, и чистота цис-изомера составляла 26 м.д.
Пример 5
Формилирование
Использовали автоклав объемом 10 л (внутренний объем) (изготовленный из нержавеющей стали), снабженный мешалкой с магнитным приводом, тремя верхними впускными отверстиями, одним нижним выпускным отверстием и рубашкой для регулирования внутренней температуры. Атмосферный воздух в автоклаве заменяли монооксидом углерода. Затем в автоклав загружали 1793 г (89,6 моль) HF и 1215 г (17,9 моль) BF3. При перемешивании содержимого автоклава и поддержании температуры жидкой фазы -30°C давление повышали до 2 МПа, используя монооксид углерода. Затем, при поддержании давления 2 МПа и температуры -30°C, исходные вещества, состоящие из смеси 1209 г (5,0 моль; молярное соотношение цис/транс: 0,05) (4-н-пропилциклогексил)бензола, полученного в примере синтеза 2, и 1209 г н-гептана, добавляли в автоклав через его верхнюю часть в течение около 90 мин для осуществления формилирования. Затем продолжали перемешивание в течение около 20 мин до прекращения поглощения монооксида углерода. В данном случае количество поглощенного монооксида углерода составило 5,9 моль.
Часть полученной жидкой реакционной смеси отбирали в ледяную воду, разбавляли бензолом и затем подвергали нейтрализующей обработке, с получением масляного слоя. Масляный слой анализировали методом газовой хроматографии для определения результатов. Было подтверждено, что конверсия (4-н-пропилциклогексил)бензола составила 95,8%, и селективность в отношении образования 4-(транс-4-н-пропилциклогексил)бензальдегида составила 90,0%.
Термическое разложение комплекса
Для разложения комплекса HF/BF3/4-(транс-4-н-пропилциклогексил)бензальдегид использовали дистилляционную колонну, имеющую внутренний диаметр 76 см и длину 176 см и заполненную кольцами Рашига, изготовленными из тефлона (зарегистрированная торговая марка). Раствор комплекса загружали в среднюю часть дистилляционной колонны со скоростью 410 г/ч, в то время как в нижнюю часть дистилляционной колонны загружали бензол в качестве разлагающей добавки со скоростью 500 г/ч. Внутреннее давление в колонне составляло 0,4 МПа, температура в нижней части колонны составляла 140°C, и жидкость из нижней части колонны удаляли со скоростью 544 г/ч. Из верхней части колонны отводили HF и BF3, используемые в качестве катализатора, в то время как из нижней части колонны отводили 4-(транс-4-н-пропилциклогексил)бензальдегид с большим количеством бензола. Было подтверждено, что содержание неорганического фтора относительно 4-(транс-4-н-пропилциклогексил)бензальдегида в нижней части колонны составляло 221 м.д., и эффективность разложения комплекса составляла 99,9%. Чистота 4-(транс-4-н-пропилциклогексил)бензальдегида составляла 90,5%.
Очистка перегонкой
Жидкость из нижней части колонны, полученную из комплекса, нейтрализовали 2%-ным по массе водным раствором NaOH, промывали водой и затем перегоняли с использованием ректификационной колонны мощностью 20 теоретических тарелок, получая в качестве основной фракции 1218,7 г 4-(транс-4-н-пропилциклогексил)бензальдегида, имеющего чистоту 98,7%. Чистота транс-изомера составляла 99,993%, и чистота цис-изомера составляла 73 ч/млн.
Пример 6
Реакцию формилирования и обработку жидкой реакционной смеси осуществляли по аналогичной методике примера 1, за исключением того, что в качестве исходных веществ загружали смесь 57,0 г (0,248 моль, молярное соотношение цис/транс: 0,02) (4-н-пентилциклогексил)бензола, полученного в примере синтеза 3, и 57,0 г н-гептана. Полученный масляный слой анализировали методом газовой хроматографией для определения результатов. Было подтверждено, что конверсия (4-н-пентилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-пентилциклогексил)бензальдегида составила 95,2%. Чистота транс-изомера составляла 99,997%, и чистота цис-изомера составляла 25 ч/млн.
Пример 7
Реакцию формилирования и обработку жидкой реакционной смеси осуществляли по аналогичной методике примера 1, за исключением того, что в качестве исходных веществ загружали смесь 50,0 г (0,248 моль, молярное соотношение цис/транс: 0,10) (4-н-пропилциклогексил)бензола и 50,0 г н-гептана. Полученный масляный слой анализировали методом газовой хроматографии для определения результатов. Было подтверждено, что конверсия (4-н-пропилциклогексил)бензола составила 100%, и селективность в отношении образования 4-(транс-4-н-пропилциклогексил)бензальдегида составила 89,7%. Чистота транс-изомера составляла 99,98%, и чистота цис-изомера составляла 197 ч/млн.
Пример 8
В снабженный электромагнитной мешалкой автоклав объемом 500 мл (внутренний объем) (изготовленный из SUS316L), с возможностью регулировки температуры, загружали 74,3 г (3,71 моль) безводного HF и 5,05 г (0,074 моль) BF3. При перемешивании содержимого автоклава и поддержании температуры жидкой фазы -30°C в автоклав загружали исходные вещества, состоящие из смеси 50,0 г (0,248 моль; молярное соотношение цис/транс 1,36) (4-н-пропилциклогексил)бензола, полученного в примере синтеза 1, и 50,0 г н-гептана, и выдерживали в таких условиях в течение 0,5 ч. Содержимое автоклава выливали на лед и подвергали нейтрализующей обработке, с получением масляного слоя. Результаты анализа масляного слоя методом газовой хроматографии показали, что чистота (транс-4-н-пропилциклогексил)бензола составляла 91,0%, и молярное соотношение транс цис/транс составляло 0,05.
Пример 9
Изомеризация
Использовали автоклав объемом 10 л (внутренний объем) (изготовленный из нержавеющей стали), снабженный мешалкой с магнитным приводом, тремя верхними впускными отверстиями, одним нижним выпускным отверстием и рубашкой для регулирования внутренней температуры. В автоклав загружали 1793 г (89,6 моль) HF и 122,0 г (1,8 моль) BF3. При перемешивании содержимого автоклава и поддержании температуры жидкой фазы -30°C, исходные вещества, состоящие из смеси 1209 г (5,0 моль; молярное соотношение цис/транс 1,36) (4-н-пропилциклогексил)бензола, полученного в примере синтеза 1, и 1209 г н-гептана, загружали в автоклав через его верхнюю часть в течение около 90 минут для осуществления изомеризации. Часть полученной жидкой реакционной смеси отбирали в ледяную воду и подвергали нейтрализующей обработке, с получением масляного слоя. Масляный слой анализировали методом газовой хроматографией для определения результатов. Было установлено, что чистота (транс-4-н-пропилциклогексил)бензола составляла 92,5%, и молярное соотношение цис/транс составляло 0,05.
Термическое разложение комплекса
Для разложения комплекса HF/BF3/(транс-4-н-пропилциклогексил)бензол использовали дистилляционную колонну, имеющую внутренний диаметр 76 см и длину 176 см и заполненную кольцами Рашига, изготовленными из тефлона (зарегистрированная торговая марка). Раствор комплекса загружали в среднюю часть дистилляционной колонны со скоростью 410 г/ч, в то время как в нижнюю часть дистилляционной колонны загружали бензол в качестве разлагающей добавки со скоростью 500 г/ч. Давление внутри колонны составляло 0,4 МПа, температура в нижней части колонны составляла 140°C, и жидкость из нижней части колонны удаляли со скоростью 544 г/ч. Из верхней части колонны отводили HF и BF3, используемые в качестве катализатора, в то время как из нижней части колонны отводили (транс-4-н-пропилциклогексил)бензол вместе с большим количеством бензола. Было подтверждено, что содержание неорганического фтора относительно (транс-4-н-пропилциклогексил)бензола в нижней части колонны составляло 221 ч/млн, и эффективность разложения комплекса составляла 99,9%. Чистота (транс-4-н-пропилциклогексил)бензола составляла 95,5%.
Очистка перегонкой
Жидкость из нижней части колонны, полученную из комплекса, нейтрализовали 2%-ным по массе водным раствором NaOH, промывали водой и затем перегоняли с использованием ректификационной колонны мощностью 20 теоретических тарелок, получая в качестве основной фракции 1150 г (транс-4-н-пропилциклогексил)бензола, имеющего чистоту 99,2%.
Пример 10
Реакцию изомеризации и обработку жидкой реакционной смеси осуществляли по аналогичной методике примера 8, за исключением того, что в качестве исходных веществ загружали смесь 57,0 г (0,248 моль, молярное соотношение цис/транс: 0,67) (4-н-пентилциклогексил)бензола, полученного в примере синтеза 5, и 57,0 г н-гептана. Полученный масляный слой анализировали методом газовой хроматографии. Результаты показали, что чистота (транс-4-н-пентилциклогексил)бензола составляла 90,5%, и молярное соотношение цис/транс составляло 0,05.
В данном случае, газовую хроматографию в примерах синтеза 1-4 и примерах 1-7 осуществляли в следующих условиях.
Использовали газовый хроматограф (GС-17A, доступен от Shimadzu Corporation) и капиллярную колонку (HR-1, доступна от Shinwa Chemical Industries, Ltd., 0,32 ммø × 25 м). Температурные условия включали скорость повышения температуры 5°C/мин между 100°C и 300°C.
В примере синтеза 5 и примерах 8-10 газовую хроматографию осуществляли в следующих условиях.
Использовали газовый хроматограф (GC-17A, доступен от Shimadzu Corporation) и капиллярную колонку (DB-WAX, доступна от Agilent Technologies, 0,32 ммø × 30 м). Температуру поддерживали равной 100°C в течение 60 мин, затем повышали с 100°C до 220°C со скоростью 5°C/мин и поддерживали такую температуру в течение 6 мин.
Промышленная применимость
Согласно настоящему изобретению возможно эффективное получение 4-(4-алкилциклогексил)бензальдегида,
4-(циклогексил)бензальдегида,
4-(транс-4-алкилциклогексил)бензальдегида и
(транс-4-алкилциклогексил)бензола, полезных в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 4,4'-ДИФОРМИЛДИФЕНИЛАЛКАНА | 2012 |
|
RU2575126C2 |
| 2-[4-(4-Транс-Алкилциклогексил)-фенил]-5-(4-транс-алкилциклогексил)-пиридины в качестве компонентов жидкокристаллического материала для электрооптических устройств и жидкокристаллический материал для электрооптических устройств | 1987 |
|
SU1710556A1 |
| СПОСОБ ПОЛУЧЕНИЯ М-ДИАЛКИЛБЕНЗАЛЬДЕГИДА | 2020 |
|
RU2814018C2 |
| НОВЫЙ АЛИЦИКЛИЧЕСКИЙ СПИРТ | 2011 |
|
RU2564416C2 |
| АРОМАТИЧЕСКИЙ АЛЬДЕГИД, ОТВЕРЖДАЮЩИЙ АГЕНТ ДЛЯ ЭПОКСИДНОЙ СМОЛЫ И КОМПОЗИЦИЯ НА ОСНОВЕ ЭПОКСИДНОЙ СМОЛЫ, СОДЕРЖАЩАЯ АРОМАТИЧЕСКИЙ АЛЬДЕГИД | 2013 |
|
RU2636937C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛИЦИКЛИЧЕСКОГО СПИРТА | 2010 |
|
RU2530880C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИМЕТИЛ-1-НАФТАЛЬДЕГИДА | 2007 |
|
RU2440967C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИАЛКИЛБЕНЗАЛЬДЕГИДА | 2020 |
|
RU2824597C1 |
| Жидкокристаллический материал для устройств изображения информации | 1984 |
|
SU1376949A3 |
| СОЕДИНЕНИЕ КЛАССА АЛЬДЕГИДОВ, СПОСОБ ЕГО ПРОИЗВОДСТВА И ПАРФЮМЕРНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2834899C1 |
Настоящее изобретение относится к способу получения 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, которые могут быть использованы в составе химических продуктов, используемых в материалах для электронного оборудования, включая жидкие кристаллы, и для фармацевтического и агрохимического применения. Также изобретение относится к вариантам способа получения 4-(транс-4-алкилциклогексил)бензальдегида и к способу получения (транс-4-алкилциклогексил)бензола. Способ получения 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида включает формилирование производного бензола, представленного следующей формулой (1а), монооксидом углерода в присутствии фтороводорода и трифторида бора
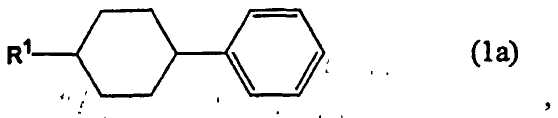
где R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода. При этом фтороводород используют в количестве не менее 3 моль, но не более 20 моль, а трифторид бора в количестве не менее 1,1 моль, но не более 5 моль, на 1 моль производного бензола, представленного формулой (1а), и где формилирование осуществляют при температуре от -50°С до 30°С. Предлагаемое изобретение позволяет селективно получить целевые продукты высокой чистоты. 4 н. и 6 з.п. ф-лы, 15 пр.
1. Способ получения 4-(4-алкилциклогексил)бензальдегида или 4-(циклогексил)бензальдегида, имеющего чистоту 98% или более, включающий формилирование производного бензола, представленного следующей формулой (1а), монооксидом углерода в присутствии фтороводорода и трифторида бора с получением 4-(4-алкилциклогексил)бензальдегида, представленного следующей формулой (2), или 4-(циклогексил)бензальдегида
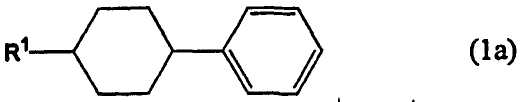
где R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода,

где R1 представляет собой алкильную группу, содержащую 1-10 атомов углерода, или атом водорода,
где фтороводород используют в количестве не менее 3 моль, но не более 20 моль на 1 моль производного бензола, представленного формулой (1а),
где трифторид бора используют в количестве не менее 1,1 моль, но не более 5 моль на 1 моль производного бензола, представленного формулой (1а), и
где формилирование осуществляют при температуре от -50°С до 30°С.
2. Способ получения 4-(транс-4-алкилциклогексил)бензальдегида, включающий формилирование (4-алкилциклогексил)бензола, представленного следующей формулой (1b) и имеющего молярное соотношение цис/транс 0,3 или менее, монооксидом углерода в присутствии фтороводорода и трифторида бора с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного следующей формулой (4),

где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода,
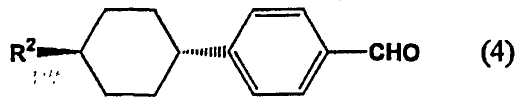
где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
3. Способ получения 4-(транс-4-алкилциклогексил)бензальдегида по п.2, где фтороводород используют в количестве не менее 2 моль, но не более 30 моль на 1 моль (4-алкилциклогексил)бензола.
4. Способ получения 4-(транс-4-алкилциклогексил)бензальдегида по п.2, где трифторид бора используют в количестве не менее 1 моль, но не более 10 моль на 1 моль (4-алкилциклогексил)бензола.
5. Способ получения 4-(транс-4-алкилциклогексил)бензальдегида по п.2, где формилирование осуществляют при температуре от -50°С до 30°С.
6. Способ получения (транс-4-алкилциклогексил)бензола, представленного следующей формулой (5),
включающий изомеризацию смеси цис- и транс-изомеров (4-алкилциклогексил)бензола, представленного следующей формулой (1b), в присутствии фтороводорода и трифторида бора,

где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода,
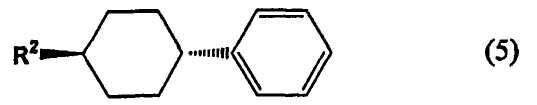
где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
7. Способ получения (транс-4-алкилциклогексил)бензола по п.6, где фтороводород используют в количестве не менее 2 моль, но не более 30 моль на 1 моль (4-алкилциклогексил)бензола.
8. Способ получения (транс-4-алкилциклогексил)бензола по п.6, где трифторид бора используют в количестве не менее 0,1 моль, но не более 2 моль на 1 моль (4-алкилциклогексил)бензола.
9. Способ получения (транс-4-алкилциклогексил)бензола по п.6, где изомеризацию осуществляют при температуре от -50°С до 30°С.
10. Способ получения 4-(транс-4-алкилциклогексил)бензальдегида, включающий изомеризацию смеси цис- и транс-изомеров (4- алкилциклогексил)бензола, представленного следующей формулой (1b), в присутствии фтороводорода и трифторида бора с получением (транс-4- алкилциклогексил)бензола, представленного следующей формулой (5), и затем, в непрерывном режиме, формилирование (транс-4- алкилциклогексил)бензола монооксидом углерода с получением 4-(транс-4-алкилциклогексил)бензальдегида, представленного следующей формулой (4),

где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода,

где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода,

где R2 представляет собой алкильную группу, содержащую 1-10 атомов углерода.
| B.L.Booth et al | |||
| Formylation and Acylation Reactions Catalysed by Trifluoromethanesulphonic Acid | |||
| Journal of the Chemical Society | |||
| Perkin Transactions I, 1980, (1), стр.181-186 | |||
| US 4460794A (MITSUBISHI GAS CHEMICAL COMPANY, INC), 17.07.1984 | |||
| Химическая энциклопедия, т.5 | |||
| / Под ред | |||
| Н.С.Зефирова и др | |||
| - М.: Большая Российская энцикл., 1998, с.364, |
Авторы
Даты
2012-03-27—Публикация
2007-05-08—Подача