Родственные заявки
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США, серийный номер 60/833,479, озаглавленной ПРОЦЕСС ПЕРИОДИЧЕСКОЙ ФЕРМЕНТАЦИИ С ПОДПИТКОЙ ПРИ ВЫСОКОЙ ПЛОТНОСТИ КЛЕТОК ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА, поданной 27 июля 2006 г., описание которой полностью включено в данную заявку посредством ссылки.
Область изобретения
[0002] Настоящая заявка относится в целом к новым способам периодической ферментации с подпиткой, которые обеспечивают улучшенную экспрессию белка в бактериальных системах, а также к композициям с высокой плотностью белков и к композициям, которые применяют в новых способах периодической ферментации с подпиткой.
Уровень техники
[0003] Различные стратегии ферментации применяют для получения белков в достаточных количествах для лабораторного, клинического или коммерческого применения. Периодическую ферментацию с подпиткой применяют, чтобы обеспечить повышенный выход белков по сравнению с таковым, который обеспечивают простые способы периодической ферментации. Периодическая ферментация с подпиткой представляет собой процесс, в котором за первоначальной периодической фазой следует фаза, в которой одно или более питательных веществ подаются в культуру путем подпитки.
[0004] Обычно, во время периодической фазы, клетки сначала выращивают до требуемой концентрации. В этой фазе рост клеток увеличивается, и, обычно, целевой белок не продуцируется до тех пор, пока не добавят индуктор, такой как арабиноза, лактоза или изопропил-бета-D-тиогалактозид (ИПТГ), в зависимости от промотора, или продуцируется, если присутствует некоторое неполное блокирование промотора. Во время фазы с подпиткой, источник углерода и другие требуемые питательные вещества обычно подают в ферментер в относительно концентрированном потоке жидкости при определенной скорости подачи. Как только достигается целевая плотность клеток, в подпитку добавляют индуктор или индуктор и другие питательные вещества. В этой фазе основное внимание уделяется продукции белка выращенными клетками. Субстрат (а именно питательные вещества и индуктор), который подается в ферментер на этой стадии, применяют, как правило, для роста клеток и синтеза продукта. Рост клеток контролируется скоростью подачи для получения оптимального роста клеток и продукции белка. Во время стадии продукции белка нужно добавлять индуктор к рекомбинантным организмам.
[0005] Экспрессия белка в среде, включающей общепринятый источник углерода, такой как глюкоза, или другой источник углерода на основе сахаров и индуктор, удовлетворительна до возникновения ограничивающих условий в конце фазы с подпиткой. Примеры ограничивающих условий включают пониженную концентрацию кислорода, уменьшение питательных веществ, таких как витамины, углерод, азот, и накопление токсичных соединений в ростовой среде.
[0006] Стратегии периодической ферментации с подпиткой часто включают различные формы регуляции с обратной связью, включая непрямую и прямую обратную связь для контроля подачи питательных веществ. Один такой способ периодической ферментации с подпиткой включает применение алгоритма регуляции с обратной связью с помощью подачи питательных веществ, чтобы поддерживать параметр процесса на определенной заданной величине. Например, прямой контроль подачи может быть основан на измерении концентрации питательных веществ. Регуляция с обратной связью тогда непосредственно связана с активностью клеток во время ферментации. Контрольные параметры, которые применялись для регуляции ферментации с обратной связью, включают значение pH, измеренную в реальном времени плотность клеток или давление растворенного кислорода (DOT).
[0007] Тем не менее, применение алгоритмов обратной связи сопровождается рядом недостатков. Одним из таких недостатков является зависимость скорости подачи от текущих параметров процесса. Любое нарушение процесса может повлиять на указанный параметр, изменяя тем самым скорость подачи и конечный выход белка. Подобные недостатки увеличиваются при масштабировании процесса для получения повышенных количеств белка.
[0008] Другим недостатком ранее применяемой стратегии с подпиткой является то, что при использовании регуляции с обратной связью конкретную скорость роста невозможно точно предопределить или контролировать, что приводит к субоптимальному выходу процессов, в которых образование продукта зависит от роста.
[0009] Дополнительно, когда приток углерода (например, при высокой концентрации глюкозы) в основной метаболический путь превышает максимальную мощность цикла трикарбоновых кислот (ЦТК), могут накапливаться побочные продукты. Накопление побочных продуктов может ингибировать рост клеток и продукцию белка в процессе ферментации.
[0010] Дополнительно, различные недостатки способов периодической ферментации с подпиткой часто приводят к неэффективному использованию компонентов питательных веществ. По этой причине указанные способы могут быть экономически невыгодными, в частности для широкомасштабной коммерческой продукции белка.
[0011] Используемые ранее подходы к рекомбинантной экспрессии белка посредством периодической ферментации с подпиткой, как описано выше, имеют различные недостатки. Учитывая важность экономически эффективного получения достаточных количеств белка для различных целей, существует потребность в эффективном способе периодической ферментации с подпиткой, который приводил бы к более высокому росту клеток, повышенному образованию продукта (то есть более высокому выходу белка) и пониженному накоплению побочного продукта.
Краткое описание изобретения
[0012] Настоящее изобретение относится к новым способам периодической ферментации с подпиткой для получения неожиданно высокого выхода рекомбинантного белка.
[0013] Некоторый вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка, включающий непрерывное добавление источника углерода в культуру, содержащую указанную рекомбинантную бактериальную клетку, и непрерывное добавление индуктора в указанную культуру после того, как в культуре достигнут пороговый параметр, и выделение указанного рекомбинантного белка из культуры клеток.
[0014] Некоторый дополнительный вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий: (а) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный белок под контролем индуцируемого промотора, для получения рекомбинантной бактериальной клетки; (b) введение указанной рекомбинантной бактериальной клетки в культуральную среду для получения культуры клеток; (с) добавление источника углерода в указанную культуру клеток в виде непрерывной подачи; (а) слежение за достижением ростом клеток в указанной культуре клеток пороговой оптической плотности (OD600); (e) добавление индуктора указанного индуцируемого промотора в указанную культуру клеток в виде непрерывной подачи, как только достигнута указанная пороговая оптическая плотность (OD600); и (f) получение рекомбинантного белка из культуры клеток.
[0015] Еще дополнительный вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка путем непрерывного добавления индуктора в культуру, включающую указанную бактериальную клетку, после того, как указанная культура достигла порогового параметра, отличающийся тем, что указанная бактериальная клетка включает последовательность нуклеиновых кислот, соответствующую гену из N. meningitidis серологической группы В.
[0016] Согласно сходному дополнительному варианту реализации, настоящее изобретение обеспечивает способ получения рекомбинантного белка 2086 (rP2086), включающий: (а) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный менингококковый белок 2086 под контролем индуцируемого промотора для получения рекомбинантной бактериальной клетки; (b) введение указанной рекомбинантной бактериальной клетки в культуральную среду для получения культуры; (с) добавление источника углерода в культуру; (d) слежение за достижением ростом клеток в указанной культуре пороговой оптической плотности (OD); (е) непрерывное добавление индуктора указанного индуцируемого промотора в указанную культуру, как только плотность клеток в указанной культуре достигла оптической плотности, равной приблизительно от 70 до 110; и (f) получение указанного рекомбинантного менингококкового белка 2086 из указанной культуры через промежуток времени от приблизительно 3 часов до приблизительно 6 часов после начала непрерывного добавления индуктора.
[0017] Согласно другому варианту реализации, настоящее изобретение обеспечивает композицию, включающую бактериальную культуру, включающую рекомбинантный белок 2086 (rP2086) при плотности, равной по меньшей мере приблизительно 1.5 г/л, в общем объеме указанной бактериальной культуры.
[0018] Согласно еще другому варианту реализации, настоящее изобретение обеспечивает композицию, включающую бактериальную культуральную среду, включающую рекомбинантный менингококковый белок 2086 (rP2086), полученный согласно способам настоящего изобретения.
Краткое описание чертежей
[0019] Фигура 1 - периодическая ферментация с подпиткой при различных постоянных скоростях подачи без индукции.
[0020] Фигура 2 - периодическая ферментация с подпиткой при различных постоянных скоростях подачи без индукции.
[0021] Фигура 3 - индукция при различных оптических плотностях.
[0022] Фигура 4 - индукция различными уровнями арабинозы.
[0023] Фигура 5 - влияние способа добавления арабинозы на выход rLP2086.
[0024]. Фигура 6 - влияние скорости подачи арабинозы на продукцию rLP2086.
[0025] Фигура 7 - влияние времени индукции на экспрессию.
[0026] Фигура 8 - периодическая ферментация с подпиткой для получения rLP2086 подсемейства В.
[0027] Фигуры 9А и 9B - анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (ПААГ/ДСН) и анализ методом вестерн-блот индукции rLP2086 подсемейства В соответственно.
[0028] Фигура 10 - периодическая ферментация с подпиткой для получения rLP2086 подсемейства А.
[0029] Фигуры 11А и 11B - ПААГ/ДСН и анализ методом вестерн-блот индукции rLP2086 подсемейства А соответственно.
[0030] Фигура 12А, 12B и 12С - одновременная подача глюкозы и арабинозы в процессе индукции.
[0031] Фигура 13А - периодическая ферментация E. coli с подпиткой для получения rLP2086 подсемейства В в масштабе 100 л.
[0032] Фигура 13B - периодическая ферментация Е. coli с подпиткой для получения rLP2086 подсемейства А в масштабе 100 л.
[0033] Фигура 14А - периодическая ферментация Е. coli с подпиткой для получения rIP2086 подсемейства В с одновременной подачей глюкозы и арабинозы в масштабе 100 л.
[0034] Фигура 14B - периодическая ферментация Е. coli с подпиткой для получения rIP2086 подсемейства А с одновременной подачей глюкозы и арабинозы в масштабе 100 л.
Подробное описание изобретения
[0035] Указанные способы настоящего изобретения основаны на неожиданном открытии, что неожиданно был получен высокий выход белка с помощью периодической ферментации с подпиткой при непрерывной подаче индуктора в процессе индукции культуральной среды. Возможно, источник углерода непрерывно подается перед и/или в процессе непрерывной подачи индуктора. При индукции арабинозой получали приблизительно 2-3 г/л рекомбинантного 2086 липопротеина (rLP2086) (который экспрессируется микроорганизмом и имеет последовательность, соответствующую 2086 гену N. meningitidis серологической группы В) в соответствии с некоторым вариантом реализации настоящего изобретения. Это представляет приблизительно 2-3-кратное повышение выхода rLP2086 с помощью периодической ферментации с подпиткой для обоих подсемейств А и В указанного белка 2086 по сравнению со сравнительным процессом периодической ферментации. Более того, указанные способы настоящего изобретения можно легко приспособить к получению в коммерческом масштабе этих и других белков.
[0036] С целью повышения понимания указанных вариантов реализации, описанных в данной заявке, будут сделаны ссылки на различные варианты реализации и будет использован конкретный язык для описания этого. Терминология, которая используется в данной заявке, используется исключительно с целью описания конкретных вариантов реализации и не предназначена для ограничения объема настоящего изобретения. Как используется по всему данному описанию, все единичные формы включают ссылку на множественную форму, если только контекст не указывает четко на противоположное. Подобным образом, единичные формы терминов, таких как "среда", включают ссылку на множественную форму "среды", и наоборот. Таким образом, например, ссылка на "некоторую культуральную среду" включает множество таких сред, а также одну среду; и ссылка на "культуральную среду" включает множество сред, а также одну среду.
[0037] Термин "индуктор", как используется в данной заявке, относится к любому агенту, который индуцирует, усиливает или вызывает экспрессию некоторого рекомбинантного белка, в результате чего экспрессию генов под контролем индуцируемого промотора можно непосредственно регулировать с помощью концентрации этого агента.
[0038] Термин "источник углерода", как используется в данной заявке, относится к источнику углерода и энергии для клеток.
[0039] Термины "подача", "подается", "подпитка" или "непрерывное добавление", как используется взаимозаменяемо в данной заявке, относятся к добавлению вещества непрерывно в течение некоторого промежутка времени, в отличие от добавления всего количества за один раз. Указанные термины предполагают единичное начало и/или окончание или множество точек пуска и/или остановки для непрерывного добавления указанного вещества в процессе ферментации.
[0040] Термин "рекомбинантный белок", как используется в данной заявке, относится к любому белку или биологически активной его части (например, части, которая сохраняет биологическую активность целого белка), которая не является репортерным или маркерным геном (например, зеленый флуоресцентный белок), экспрессируемым с рекомбинантного генетического материала, кодирующего аминокислоты, включая пептиды, полипептиды, белки, олигопротеины и/или слитые белки. Рекомбинантный белковый продукт может включать терапевтический, профилактический или диагностический продукт.
Способы настоящего изобретения
[0041] Указанные способы настоящего изобретения обеспечивают неожиданно высокий выход белка посредством нового процесса ферментации с подпиткой, включающего непрерывное добавление индуктора, такого как арабиноза, в культуральную среду после того, как указанная культура достигла порогового параметра. Источник углерода, такой как глюкоза, обычно добавляют в культуру, включающую рекомбинантную бактериальную клетку, перед фазой индукции. Указанный источник углерода можно подавать вместе с индуктором. Указанный индуктор может также служить вторичным источником углерода.
[0042] Источник углерода, такой как глюкоза, непрерывно добавляют в указанную культуральную среду, перед и/или в процессе непрерывной подачи указанного индуктора в культуральную среду, в соответствии с некоторым вариантом реализации настоящего изобретения. Таким образом, непрерывная подача источника углерода перекрывается с непрерывной подачей индуктора, согласно некоторому варианту реализации. Непрерывная подача источника углерода может продолжаться во время всего процесса непрерывной подачи индуктора или только во время части (частей) этого процесса. В другом варианте реализации, непрерывная подача источника углерода не перекрывается с непрерывной подачей индуктора. Согласно некоторому варианту реализации настоящего изобретения, указанный индуктор и/или источник углерода могут подаваться в культуру при постоянной скорости.
[0043] Указанный процесс ферментации с подпиткой включает несколько этапов, в результате которых происходит продукция необходимого белка в соответствии с некоторым вариантом реализации настоящего изобретения. На начальном этапе получают вектор экспрессии, который кодирует рекомбинантный белковый продукт под контролем индуцируемого промотора, и затем вводят в бактериальную клетку-хозяина. Указанную бактериальную клетку-хозяина вводят в культуральную среду. Индуктор индуцируемого промотора подают в культуру (а именно индуктор добавляют в культуру непрерывно в течение некоторого промежутка времени). Указанный индуктор можно подавать в культуру при постоянной скорости. Затем указанный рекомбинантный белковый продукт собирают из указанной культуры. Рекомбинантный белок, полученный таким способом, можно затем очистить как необходимо и/или использовать любым подходящим образом, таким как в профилактической, терапевтической или диагностической лекарственной форме.
[0044] Высокая плотность клеток и повышенный выход белка были неожиданно достигнуты с помощью периодической ферментации с подпиткой при постоянной скорости подачи индуктора, которая обеспечивает выход рекомбинантного белкового продукта приблизительно в 2-3 раза выше по сравнению с периодической ферментацией, как проиллюстрировано в примерах, приведенных ниже. Способы настоящего изобретения применимы к широкомасштабной ферментации, а также к маломасштабной ферментации. "Широкомасштабная" ферментация, как используется в данной заявке, относится к ферментации в ферментере, который имеет по меньшей мере приблизительно 1000 л объемной вместимости, а именно рабочий объем, оставляющий достаточно места для наличия свободного пространства над продуктом. "Маломасштабная" ферментация относится обычно к ферментации в ферментере, который обычно имеет не более, чем приблизительно 100 л объемной вместимости, таком как 5 л, 10 л, 50 л или 100 л. Доказанным преимуществом настоящего процесса ферментации с подпиткой является то, что его можно применять для получения рекомбинантного белкового продукта в масштабе ферментера 5-10 л и можно масштабировать до любого объема, например, 100 л, 150 л, 250 л, 500 л, 1000 л или более, без ограничения.
Индукторы
[0045] Способы, описанные в данной заявке, относятся к продукции рекомбинантного белка, отличающегося тем, что экспрессия указанного рекомбинантного белка находится под транскрипционным контролем индуцируемого промотора, в результате чего экспрессия генов под контролем указанного индуцируемого промотора может непосредственно регулироваться концентрацией индуктора, присутствующего в культуральной среде. Указанный индуктор непрерывно подается в культуральную среду, возможно при постоянной скорости. Указанный индуктор добавляют в культуральную среду, как только был достигнут пороговый параметр. Например, рекомбинантный белок может быть под контролем araB промотора (например, ParaB), который можно непосредственно регулировать концентрацией арабинозы, которую добавляют при постоянной скорости в культуральную среду. Подходящие индукторы для применения в соответствии с настоящим изобретением хорошо известны специалистам в данной области. Примеры индукторов согласно настоящему изобретению приведены ниже, без ограничения.
Источник углерода
[0046] Любой подходящий источник углерода, например глицерин, сукцинат, лактат или источник углерода на основе сахаров, например глюкоза, лактоза, сахароза и фруктоза, предусматривается для применения в настоящем изобретении, что должно быть очевидно для среднего специалиста в данной области. Например, источники углерода на основе сахаров, которые можно применять в настоящем изобретении, включают, без ограничения, разветвленные или неразветвленные полисахариды, которые включают мономеры сахаридов D-маннозу, D- и L-галактозу, фукозу, фруктозу, D-ксилозу, L-арабинозу, D-глюкуроновую кислоту, сиаловую кислоту, D-галактуроновую кислоту, D-маннуроновую кислоту (например, полиманнуроновую кислоту, или альгиновую кислоту), D-глюкозамин, D-галактозамин, D-глюкозу и нейраминовую кислоту, включая гомополисахариды и гетерополисахариды, например лактозу, амилопектин, крахмал, гидроксиэтиловый крахмал, амилозу, сульфат декстрана, декстран, декстрины, гликоген или полисахаридную субъединицу кислых мукополисахаридов, например гиалуроновой кислоты; полимеры сахарных спиртов, такие как полисорбит и полиманнит; гепарин или гепаран; или любую их комбинацию, без ограничения. Глюкоза представляет собой первичный источник углерода согласно некоторому варианту реализации настоящего изобретения. Арабиноза, если используется в качестве индуктора, может также служить вторичным источником углерода, хотя она также может быть первичным источником углерода. Согласно некоторому варианту реализации, указанные источники углерода включают любой из D-глюкозы, L-арабинозы, сахарозы, I-инозита, D-маннита, β-D-фруктозы, α-L рамнозы, D-ксилозы, целлюлозы, или любую их комбинацию. Один или более чем один источник углерода можно применять в настоящем изобретении.
Бактериальные экспрессионные системы и плазмиды
[0047] Настоящее изобретение также обеспечивает рекомбинантные бактериальные клетки, включающие вектор экспрессии, такой как плазмиду, включающую последовательность, контролирующую экспрессию, имеющую промоторные последовательности и инициаторные последовательности и последовательность нуклеотидов, которая кодирует необходимый полипептид, указанная последовательность нуклеотидов расположена с 3′ стороны от промоторных и инициаторных последовательностей. Предусмотрены любая подходящая последовательность, контролирующая экспрессию, и клетка-хозяин/переносчик генетического материала, что должно быть очевидно для специалиста в данной области на основании описания, приведенного в данной заявке.
[0048] Подходящие последовательности, контролирующие экспрессию, и комбинации клеток-хозяев/переносчиков генетического материала хорошо известны в данной области и описаны в качестве примера в Sambrook, J., E.F.Fritsch, и Т.Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, Нью-Йорк. Как правило, методики рекомбинантной ДНК включают получение посредством синтеза или выделения последовательности ДНК, которая кодирует интересующий рекомбинантный белок, и ее введение в подходящую экспрессионную систему вектор/клетка-хозяин, где она экспрессируется, предпочтительно под контролем индуцируемого арабинозой промотора. Любой из указанных способов, описанных для вставки ДНК в вектор экспрессии, можно применять для лигирования промотора и других регуляторных элементов в определенные сайты внутри выбранного рекомбинантного вектора. Подходящие клетки-хозяева затем трансформируют, инфицируют, трансдуцируют или трансфецируют такими векторами или плазмидами с помощью традиционных методик.
[0049] Множество систем клетка-хозяин-вектор (плазмида) можно применять для экспрессии интересующего рекомбинантного белка. Указанная векторная система, такая как, например, система, включающая промотор, индуцируемый арабинозой, совместима с используемой клеткой-хозяином. ДНК, кодирующую интересующий рекомбинантный белковый продукт, вставляли в экспрессионную систему, и промотор (предпочтительно, промотор, индуцируемый арабинозой) и другие регуляторные элементы лигировали в специфичные сайты внутри указанного вектора таким образом, что когда вектор вводится в клетку-хозяина (путем трансформации, трансдукции или трансфекции, в зависимости от используемой системы клетка - хозяин - вектор), ДНК, кодирующая интересующий рекомбинантный белковый продукт, экспрессируется клеткой-хозяином.
[0050] Вектор может быть выбран из одного из вирусных векторов или невирусных векторов, описанных выше, но он должен быть совместим с используемой клеткой-хозяином. Рекомбинантный ДНК вектор можно вводить в подходящие клетки-хозяева (бактерию, вирус, дрожжи, клетки млекопитающего или тому подобные) путем трансформации, трансдукции или трансфекции и т.д. (в зависимости от системы вектор/клетка - хозяин). Системы хозяин-вектор включают, но не ограничены перечисленными, бактерию, трансформированную ДНК бактериофага, плазмидной ДНК или космидной ДНК.
[0051] Экспрессию в прокариотах интересующего рекомбинантного белкового продукта можно вести в любом подходящем виде или штамме бактерии, таком как E. coli, применяя векторы, включающие конститутивные или индуцируемые промоторы, направляющие экспрессию либо слитых, либо неслитых белков.
[0052] Гибридные векторы (для получения слитых белков) добавляют некоторое количество аминокислот к закодированному на них белку, к амино- или карбоксильному концу рекомбинантного белка. Такие гибридные векторы, как правило, служат трем целям: 1) повышению экспрессии рекомбинантного белка; 2) повышению растворимости рекомбинантного белка; и 3) способствованию очистки рекомбинантного белка путем действия в качестве лиганда при аффинной очистке. Часто, в гибридные векторы экспрессии вводят сайт протеолитического расщепления в месте соединения рекомбинантного белка и слитой с ним молекулы, чтобы облегчить отделение рекомбинантного белка от слитой с ним молекулы после очистки слитого белка. Такие ферменты и их последовательности когнатного распознавания включают фактора Ха, тромбин и энтерокиназу.
[0053] Типичные гибридные векторы экспрессии включают Pgex (Pharmacia Biotech Inc; Smith и Johnson, 1988), Pmal (New England Biolabs, Беверли, Массачусетс) и Prit5 (Pharmacia, Пискатавей, Нью-Джерси), которые присоединяют глутатион-6-трансферазу (GST), мальтоза-Е-связывающий белок или белок А соответственно к целевому рекомбинантному белку.
[0054] Примеры подходящих индуцируемых негибридных векторов экспрессии в Е. coli включают pTrc (Amann и др. (1988) Tightly regulated tac promoter vectors useful for the expression of unfused and fused proteins in Escherichia coli, Gene, 69, 301-315), и Pet lid (Studier и др. (1990) Use of T7 RNA polymerase to direct expression of cloned genes, Methods in Enzymology, 185, 60-89). Экспрессия целевого гена с pTrc вектора полагается на транскрипцию РНК-полимеразой хозяина с гибридного trp-lac слитого промотора. Экспрессия целевого гена с вектора Pet lid полагается на транскрипцию с T7 gn1 0-lac слитого промотора, опосредуемую совместно экспрессируемой вирусной РНК-полимеразой J7 gnl. Эта вирусная полимераза обеспечивается штаммами хозяина BL21 (DE3) или HMS I 74(DE3) из присутствующего в них профага, несущего ген T7 gnl под транскрипционным контролем lacUV 5 промотора.
[0055] Регуляторной последовательностью векторной конструкции является индуцируемый промотор, согласно некоторому варианту реализации. Применение индуцируемого промотора позволит клетке продуцировать активированный белок на низком основном уровне в процессе обычного культивирования и размножения. Впоследствии, клетки можно индуцировать для экспрессии больших количеств требуемого белка в процессе продукции или скрининга. Индуцируемый промотор можно выделить из генома клетки или вируса.
[0056] Индуцируемые промоторы, которые регулируются с помощью экзогенно вносимых соединений, включают, без ограничения, арабинозный промотор, цинк-индуцируемый промотор металлотионина овцы (МТ), дексаметазон (Dex)-индуцируемый промотор вируса опухоли молочной железы мыши (MMTV), промоторную систему Т7-полимеразы (WO 98/10088); промотор экдизона насекомых (No и др., 1996 Proc. Natl. Acad. Sci. USA, 93:3346-3351), тетрациклин-репрессируемую систему (Gossen и др., 1992 Proc. Natl. Acad. Sci. USA, 89:5547-5551), тетрациклин-индуцируемую систему (Gossen и др., 1995 Science, 268:1766-1769, см. также Harvey и др., 1998 Curr. Opin. Chem Biol, 2:512-518), RU486-индуцируемую систему (Wang и др., 1997 Nat. Biotech., 15:239-243 и Wang и др., 1997 Gene Ther., 4:432-441) и рапамицин-индуцируемую систему (Magari и др., 1997 J. Clin. Invest., 100:2865-2872). Согласно некоторому варианту реализации настоящего изобретения, указанным промотором является промотор, индуцируемый арабинозой.
[0057] Любая подходящая бактериальная клетка-хозяин предусмотрена для применения в рамках настоящего изобретения, что должно быть очевидно для специалиста в данной области на основании описания, приведенного в данной заявке. Например, подходящие бактерии для этих целей включают Escherichia, Enterobacter, Azotobacter, Erwinia, Bacillus, Pseudomonas, Klebsiella, Proteus, Salmonella, Serratia, Shigella, Rhizobia, Vitreoscilla, Paracoccus, или их комбинацию, без ограничения. Любой подходящий штамм любой такой подходящей бактерии также предполагается настоящим изобретением. Дополнительно, применение подходящих мутированных клеток, что должно быть очевидно для специалиста в данной области, также предполагается настоящим изобретением. Специалист в данной области с легкостью сможет выбрать подходящую клетку-хозяина для использования при конкретных обстоятельствах, на основании руководства, приведенного в данной заявке.
[0058] Примеры подходящих индуцируемых векторов экспрессии в Е. coli включают, без ограничения, pTrc (Amann и др., 1988 Gene, 69:301-315), арабинозные векторы экспрессии (например, Pbad18, Guzman и др., 1995 J. Bacteriol., 177:4121-4130) и pETIId (Studier и др., 1990 Methods in Enzymology, 185:60-89). Экспрессия целевого гена с указанного pTrc вектора полагается на транскрипцию РНК-полимеразой хозяина с гибридного trp-lac слитого промотора. Экспрессия целевого гена с указанного pETIId вектора полагается на транскрипцию с Т7 gn10-lac слитого промотора, опосредуемую совместно экспрессируемой вирусной РНК-полимеразой Т7 gn1. Эта вирусная полимераза обеспечивается штаммами хозяина BL21 (DE3) или HMS I 74(DE3) из присутствующего в них профага, несущего ген Т7 gn1 под транскрипционным контролем lacUV5 промотора. PBAD система полагается на индуцируемый арабинозный промотор, который регулируется araC геном. Указанный промотор индуцируется в присутствии арабинозы.
[0059] В других вариантах реализации настоящего изобретения используются регулируемые арабинозой векторы экспрессии или векторы, в которых экспрессия интересующего рекомбинантного белка находится под контролем арабинозного промотора, например промотора для арабинозного оперона Е. coli, PBAD или PARA, без ограничения.
[0060] Последовательность нуклеиновых кислот (нуклеотидов), кодирующая любой требуемый белок, предусмотрена настоящим изобретением. Указанная последовательность нуклеотидов может быть полностью или частично встречающейся в природе последовательностью нуклеотидов или полностью или частично измененной последовательностью нуклеотидов, или любой последовательностью, которая гибридизируется с ней при строгих условиях. Ссылки в данной заявке на последовательности нуклеиновых кислот, которые соответствуют гену, относятся к любой последовательности нуклеиновых кислот, экспрессируемой в виде необходимого белка.
[0061] Например, такие измененные последовательности нуклеиновых кислот включают делецию, замену, включая транзицию и трансверсию, или вставку одного нуклеотида, и отличающиеся тем, что указанные изменения могут встречаться в 5′- или 3′-концевых положениях эталонной последовательности нуклеотидов или в любом месте между этими концевыми положениями, рассеянные либо отдельно среди нуклеотидов эталонной последовательности, либо в виде одной или более непрерывных групп внутри эталонной последовательности. Количество измененных нуклеотидов определяют путем умножения общего количества нуклеотидов в любой последовательности на числовой процент соответствующего процента идентичности (деленный на 100) и вычитания этого произведения из указанного общего количества нуклеотидов в указанной последовательности.
[0062] Например, в настоящем изобретении предполагается применение последовательности нуклеотидов, которая по меньшей мере на 70% идентична некоторой последовательности нуклеиновых кислот, вырожденному ее варианту или ее фрагменту, отличающейся тем, что указанная последовательность может включать вплоть до nn изменений нуклеиновых кислот по всему полинуклеотидному участку указанной последовательности нуклеиновых кислот, при этом nn представляет собой максимальное количество изменений и рассчитывается по формуле:
nn=xn-(xn·y),
в которой xn представляет собой общее количество нуклеиновых кислот любой последовательности и у имеет значение 0.70, отличающейся тем, что любое нецелочисленное произведение xn и y округляется до ближайшего целого значения перед вычитанием этого произведения из xn. Конечно, у может также иметь значение 0.80 для 80%, 0.85 для 85%, 0.90 для 90%, 0.94 для 94%, 0.95 для 95%, 0.96 для 96%, 0.97 для 97%, 0.98 для 98% или 0.99 для 99%, и т.д. Изменения в последовательности могут приводить к нонсенс-, миссенс-мутациям или мутациям со сдвигом рамки считывания в этой кодирующей последовательности и, тем самым, к изменению полипептида, кодируемого указанным полинуклеотидом, после таких изменений.
[0063] В настоящем изобретении предполагается применение вырожденных вариантов, или их фрагментов. Как определено в данной заявке, "вырожденный вариант" представляет собой полинуклеотид, который отличается от указанной последовательности нуклеотидов (и ее фрагментов) вследствии вырожденности генетического кода, но еще кодирует тот же белок.
[0064] Указанная нуклеиновая кислота может включать ДНК, хромосомную ДНК, кДНК и РНК, и может дополнительно включать гетерологичные нуклеотиды. В соответствии с различными вариантами реализации, указанная нуклеиновая кислота гибридизируется с некоторой нуклеиновой кислотой, с комплементарной ей, с вырожденным ее вариантом, или ее фрагментом, при высоко строгих условиях гибридизации. В еще других вариантах реализации, указанный полинуклеотид гибридизируется при средне строгих условия гибридизации.
[0065] Должно быть очевидно, что указанные нуклеиновые кислоты можно получить из природных, синтетических или полусинтетических источников; более того, указанная последовательность нуклеотидов может быть встречающейся в природе последовательностью, или она может быть родственной вследствии мутации, включая единичные или множественные замены, делеции, вставки и инверсии оснований, по отношению к такой встречающейся в природе последовательности. Указанная молекула нуклеиновой кислоты может быть РНК, ДНК, однонитевой или двунитевой, линейной или ковалентно замкнутой циркулярной формы.
[0066] Примеры условий строгости приведены в Таблице Условий строгости, ниже: высоко строгими условиями являются такие условия, которые по меньшей мере настолько строгие, как, например, условия A-F; строгие условия по меньшей мере настолько строгие, как, например, условия G-L; и условия пониженной строгости по меньшей мере настолько строгие, как, например, условия M-R.
УСЛОВИЯ СТРОГОСТИ
[0067] п.о.I: Длиной гибрида является ожидаемая длина гибридизованного участка(ов) гибридизующихся полинуклеотидов. При гибридизации полинуклеотида с целевым полинуклеотидом с неизвестной последовательностью длиной гибрида предполагается длина гибридизующегося полинуклеотида. При гибридизации полинуклеотидов с известной последовательностью длину гибрида можно определить путем выравнивания последовательностей указанных полинуклеотидов и определения участка или участков с оптимальной комплементарностью последовательностей.
[0068] БуферH: SSPE (1×SSPE представляет собой 0.15 М NaCl, 10 мМ NaH2PO4 и 1.25 мМ EDTA, pH 7.4) можно заменить на SSC (1×SSC представляет собой 0.15 М NaCl и 15 мМ цитрат натрия) в буферах для гибридизации и промывки; промывки выполняли в течение 15 минут после того, как гибридизация была завершена.
[0069] От ТВ до TR: температура гибридизации для гибридов ожидаемой длины менее чем 50 пар оснований должна быть на 5-10°С меньше, чем температура плавления (Tm) гибрида, где Tm определяют согласно следующим уравнениям. Для гибридов менее чем 18 пар оснований в длину, Tm(°С) = 2 (количество А+Т оснований) + 4 (количество G+С оснований). Для гибридов между 18 и 49 парами оснований в длину, Tm(°С)=81.5+16.6(log10[Na+])+0.41 (%G+C)-(600/N), где N представляет собой количество оснований в гибриде, и [Na+] представляет собой концентрацию ионов натрия в гибридизационном буфере ([Na+] для 1×SSC=0.165 М).
[0070] Дополнительные примеры условий строгости для гибридизации полинуклеотидов приведены в Sambrook, J., E.F.Fritsch, и T.Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, Нью-Йорк, главы 9 и 11, и Current Protocols in Molecular Biology, 1995, F.M.Ausubel и др., ред., John Wiley & Sons, Inc., разделы 2.10 и 6.3-6.4, включенном в данную заявку посредством ссылки.
[0071] В настоящем изобретении предполагается применение полинуклеотидов, которые полностью комплементарны этим полинуклеотидам, а также антисмысловых последовательностей. Указанные антисмысловые последовательности, также называемые антисмысловыми олигонуклеотидами, включают как имеющие внутреннее происхождение, так и вводимые извне последовательности, которые блокируют экспрессию полинуклеотидов, кодирующих полипептиды согласно настоящему изобретению. Антисмысловые последовательности согласно настоящему изобретению включают, например, приблизительно 15-20 пар оснований, без ограничения. Антисмысловые последовательности можно разработать, например, так, чтобы они ингибировали транскрипцию путем предотвращения связывания промотора факторами транскрипции, гибридизуясь с расположенной перед промотором нетранслируемой последовательностью, или путем предотвращения трансляции транскрипта, кодирующего полипептид согласно настоящему изобретению, посредством предотвращения связывания рибосом.
[0072] Указанные полинуклеотиды могут быть приготовлены или получены любым подходящим способом (например, путем химического синтеза, из ДНК-библиотек, из самого организма) и могут принимать различные формы (такие как однонитевые, двунитевые, векторы, зонды, праймеры), что должно быть очевидно для специалиста в данной области. Термин "полинуклеотид" включает ДНК и РНК, а также их аналоги, включая такие, которые имеют модифицированный остов. Согласно дополнительной реализации настоящего изобретения указанные полинуклеотиды включают ДНК-библиотеку, такую как библиотека кДНК.
Системы экспрессии белка 2086
[0073] Предусмотрен рекомбинантный микроорганизм, способный экспрессировать полипептид 2086 из Neisseria meningitidis серологической группы В, в соответствии с некоторым вариантом реализации настоящего изобретения. Указанный рекомбинантный микроорганизм включает последовательность, контролирующую экспрессию, имеющую промоторные последовательности и инициаторные последовательности, и последовательность нуклеотидов, которая кодирует полипептид 2086, указанная последовательность нуклеотидов расположена с 3′ стороны от промоторной и инициаторной последовательностей. В дополнительном аспекте, предусмотрена клетка-хозяин, включающая рекомбинантный полинуклеотид 2086, как описано в данной заявке, и в WO 03/063766, и WO 04/094596, которые полностью включены в данную заявку посредством ссылки. По этой причине, настоящее изобретение обеспечивает способ получения рекомбинантного белка 2086, как описано, например, в WO 03/063766 и WO 04/094596, без ограничения.
[0074] Как только сконструированы клетки-хозяева, экспрессирующие необходимый белок или полипептид согласно настоящему изобретению, путем трансформирования, трансфецирования или инфецирования клеток-хозяев плазмидами, содержащими соответствующий полинуклеотид 2086, указанных клеток-хозяев культивировали при таких условиях, что полипептиды экспрессировались в соответствии со способами настоящего изобретения. Указанный полипептид можно затем выделить, чтобы он был по существу свободным от контаминирующих компонентов клетки-хозяина, с помощью методик, хорошо известных специалистам в данной области.
Пороговые параметры
[0075] Некоторые параметры можно применять для отслеживания и контролирования развития культуры в контексте роста клеток и экспрессии рекомбинантного белка. Такие параметры включают, но не ограничены перечисленными, оптическую плотность (OD), растворенный кислород (DO), pH, потребление питательных веществ/энергии (таких как источник углерода), накопление побочных продуктов метаболизма (например, уксусной кислоты), время сбора клеток и температуру. Любой подходящий параметр или комбинация параметров предусмотрены для применения в настоящем изобретении, что должно быть очевидно для среднего специалиста в данной области, на основании руководства, приведенного в данной заявке.
[0076] Пороговый параметр устанавливают, чтобы определить точку, в которой нужно непрерывно добавлять индуктор в указанную культуру (а именно подавать в культуру в течение времени). Пороговый параметр представляет собой заранее определенный параметр. Некоторый подходящий пороговый параметр, такой как заранее определенная оптическая плотность, легко определит специалист в данной области на основании руководства, приведенного в данной заявке, в соответствии с различными вариантами реализации настоящего изобретения. Можно использовать один пороговый параметр или комбинацию пороговых параметров.
[0077] Параметр или комбинацию параметров можно отслеживать с любыми подходящими интервалами времени в указанной культуре. Например, OD600 и концентрации глюкозы можно отслеживать с интервалами в один час, полчаса или четверть часа, без ограничения.
[0078] Оптическую плотность используют в качестве порогового параметра для начала непрерывной подачи индуктора, в соответствии с некоторым вариантом реализации настоящего изобретения. Когда плотность клеток в указанной культуре достигает заранее определенного порогового параметра, такого как оптическая плотность, равная от приблизительно 70 до приблизительно 110, индуктор начинают подавать в культуру, как описано в данной заявке. Можно установить более узкий диапазон для указанного порогового параметра. Например, в настоящем изобретении предполагается, что можно начинать непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигла оптической плотности от приблизительно 70 до приблизительно 105, от приблизительно 75 до приблизительно 100, от приблизительно 75 до приблизительно 95, от приблизительно 75 до приблизительно 85, от приблизительно 76 до приблизительно 84, от приблизительно 78 до приблизительно 82, или приблизительно 80, в соответствии с вариантами реализации настоящего изобретения.
[0079] Настоящее изобретение также предполагает использование пороговых параметров для подачи сигнала о начале и/или окончании подачи источника углерода.
[0080] Любой подходящий прибор или комбинация приборов предусмотрены для слежения за пороговым параметром(ами), что должно быть очевидно для специалиста в данной области. Например, датчик или комбинацию датчиков для измерения порогового параметра можно прикрепить на прибор для ферментации ("ферментер") любым подходящим способом, без ограничения.
Постоянная скорость подачи
[0081] Постоянная скорость подачи относится к скорости, при которой индуктор(ы) и/или источник(и) углерода добавляют в культуру. Индуктор добавляли в культуру после того, как пороговый параметр был достигнут. Источник углерода можно также добавлять в культуру после того, как пороговый параметр был достигнут (и подобным образом, добавление источника углерода может быть завершено при достижении порогового параметра). Эти пороговые параметры включают, без ограничения, оптическую плотность (OD), растворенный кислород (DO), pH, концентрацию питательных веществ в культуральной среде, суммарную концентрацию первого источника углерода, добавленного в культуральную среду, или любую их комбинацию.
[0082] Используют любую подходящую постоянную скорость для непрерывного добавления индуктора и/или источника углерода в культуру, что должно быть очевидно для специалиста в данной области на основании руководства, приведенного в данной заявке. В соответствии с различными вариантами реализации настоящего изобретения, подходящая постоянная скорость определяется по системе DO-stat, как описано в примерах ниже. Например, скорость подачи, эквивалентная DO-stat контроллеру, может быть выбрана путем добавления достаточного количества глюкозы, чтобы достичь концентрации вплоть до 15 и 24 г/л каждый час, без ограничения.
[0083] Например, указанный индуктор и/или источник углерода можно добавлять в указанную культуру при постоянной скорости до тех пор, пока некоторое количество индуктора и/или источника углерода, такое как от приблизительно 4 г/л до приблизительно 40 г/л, такое как, 4 г/л, 5 г/л, 6 г/л, 7 г/л, 8 г/л, 9 г/л, 9.5 г/л, 9.75 г/л, 10 г/л, 10.25 г/л, 10.5 г/л, 11 г/л, 12 г/л, 13 г/л, 14 г/л, 15 г/л, 16 г/л, 17 г/л, 18 г/л, 19 г/л, 20 г/л, 21 г/л, 22 г/л, 23 г/л, 24 г/л, 25 г/л, 26 г/л, 27 г/л, 28 г/л, 29 г/л, 30 г/л, 31 г/л, 32 г/л, 33 г/л, 34 г/л, 35 г/л, 36 г/л, 37 г/л, 38 г/л, 39 г/л, 40 г/л, на основании общего объема культуры, не было добавлено в указанную культуру, без ограничения. Согласно различным вариантам реализации, суммарное количество индуктора и/или источника углерода, которое подавали в указанную культуру, равно от приблизительно 5 г/л до приблизительно 20 г/л, от 7 г/л до приблизительно 15 г/л, от 8 г/л до приблизительно 14 г/л, от 9 г/л до приблизительно 11 г/л, или приблизительно 10 г/л.
[0084] Суммарное количество индуктора, которое необходимо добавить в указанную культуру, может быть смещено на суммарное количество источника углерода, добавленного в культуру. Например, когда источником углерода является глюкоза и индуктором является арабиноза, количество добавляемого индуктора может быть снижено путем добавления глюкозы. Например, в некотором варианте реализации, в общей сложности 10 г/л индуктора (а именно, такого как арабиноза) добавляли в культуру и добавляли 11 г/л источника углерода, такого как глюкоза. Выход белка, полученного таким образом, аппроксимирует выход, когда используется суммарное количество 20 г/л арабинозы (а именно всего 20000 г или 20 кг арабинозы в 1000 л культуры) и нет глюкозы. Таким образом, это смещение, предусмотренное настоящими способами, является выгодным, принимая во внимание высокую цену арабинозы по отношению к глюкозе.
[0085] Согласно различным вариантам реализации настоящего изобретения, постоянную скорость, при которой индуктор и/или источник углерода добавляют в указанную культуру, можно установить в диапазоне от приблизительно 1.5 г/л до приблизительно 24 г/л каждый час. Например, когда источником углерода является глюкоза, постоянная скорость добавления глюкозы может включать, без ограничения, 1.8 г глюкозы/л/ч, 3.3 г глюкозы/л/ч, 6.7 г глюкозы/л/ч, 15 г глюкозы/л/ч, 16.4 г глюкозы/л/ч, 18 г глюкозы/л/ч, 24 г глюкозы/л/ч, и т.д. Согласно различным вариантам реализации, некоторый индуктор, такой как арабиноза, добавляют при постоянной скорости, равной от приблизительно 1.5 г/л/ч до приблизительно 16 г/л/ч.
[0086] Согласно различным вариантам реализации, как только был достигнут пороговый параметр, подачу источника углерода можно продолжить, остановить или временно прервать. Подачу источника углерода можно прервать, в этом случае подача начнется заново при постоянной скорости, как только будет достигнут порог для начала подачи. Таким образом, согласно некоторому варианту реализации, начальный порог и остановочный порог можно использовать, чтобы регулировать подачу источника углерода в указанную культуру. Согласно другому варианту реализации, как глюкозу, так и арабинозу подавали при постоянной скорости, на основании порогового параметра, без остановки или начала подпитки заново.
[0087] Подходящее суммарное количество источника углерода, которое нужно добавить в любую конкретную культуру, может легко определить специалист в данной области на основании руководства, приведенного в данной заявке. Суммарное количество источника углерода, которое добавляли в указанную культуру, может варьироваться от приблизительно 1 г/л до приблизительно 100 г/л (на основании общего объема культуры в литрах), согласно некоторому варианту реализации настоящего изобретения. Например, согласно некоторому варианту реализации, 50 г/л глюкозы добавляли во время фазы роста, начиная с 10 г/л в среде, начиная подачу глюкозы с постоянной скоростью, когда уровень глюкозы достигает нуля, и продолжая подачу глюкозы с постоянной скоростью до тех пор, пока OD не достигла 80, в это время приблизительно 40 г/л глюкозы будет подано вдобавок к первоначальным 10 г/л глюкозы. Согласно некоторому варианту реализации, суммарное количество источника углерода доставляется в концентрированной форме для облегчения масштабируемости. Это количество легко конвертируется в общую массу источника углерода, которую необходимо использовать при определенных обстоятельствах. Например, когда необходимо добавить 10 г/л источника углерода в 1000 л культуры, суммарное количество источника углерода, которое нужно добавить, легко определить как 10 г/л × 1000 л = 10000 грамм (или 10 кг) всего источника углерода. Суммарное добавленное количество источника углерода может служить пороговым параметром, в соответствии с различными вариантами реализации, как описано в данной заявке.
[0088] Подходящее суммарное количество индуктора, которое нужно добавить в любую конкретную культуру, может легко определить специалист в данной области на основании руководства, приведенного в данной заявке. Суммарное количество индуктора, добавленного в указанную культуру, может варьироваться от приблизительно 4 г/л до приблизительно 40 г/л (на основании общего объема культуры в литрах) в соответствии с различными вариантами реализации. Согласно различным вариантам реализации, суммарное количество источника углерода, которое добавляли в указанную культуру, равно от приблизительно 5 г/л до приблизительно 20 г/л, от 7 г/л до приблизительно 15 г/л, от 8 г/л до приблизительно 14 г/л, от 9 г/л до приблизительно 11 г/л, или приблизительно 10 г/л, на основании общего объема указанной культуры. Согласно некоторому варианту реализации, суммарное количество индуктора подается в концентрированной форме для облегчения масштабируемости. Это количество легко конвертируется в суммарную массу индуктора, которую нужно использовать при определенном обстоятельстве. Например, когда 10 г/л индуктора нужно добавить в 1000 л культуры, суммарное количество индуктора, которое нужно добавить, легко определить как всего 10 г/л × 1000 л = 10,000 грамм (или 10 кг) индуктора.
[0089] Свежая культуральная среда будет, как правило, содержать начальное количество первого источника углерода во время инокуляции клеткой-хозяином, таким образом создается культура. Эту начальную концентрацию можно отслеживать и концентрацию первого источника углерода использовать в качестве порогового параметра.
[0090] Любую подходящую добавку или питательные вещества, помимо источника углерода, можно также подавать в указанную культуру в подходящих количествах. Можно следить за другими питательными веществами или добавками и устанавливать подходящие пороговые значения. Добавки, такие как источники азота или неорганического фосфата, предполагаются для применения в настоящем изобретении. Неограничивающие примеры соединений, которые предполагаются для применения в способах настоящего изобретения, включают KH2PO4, K2HPO4, цитрат натрия, дигидрат, (NH4)2SO4, MgSO4, (Na)2SO4, CaCl2, FeSO4, хлорамфеникол или любую их комбинацию. Применение дополнительного источника или источников углерода также предполагается.
Оптическая плотность и логарифмическая фаза роста
[0091] Введение бактериальной клетки-хозяина в свежие культуральные среды позволяет создать культуру, которая, как правило, проходит через четыре в той или иной степени различные фазы роста: (i) латентная фаза, (ii) log (логарифмическая или экспоненциальная) фаза, (iii) стационарная фаза и (iv) фаза спада (смерти). Саму логарифмическую фазу можно дополнительно разделить на различные фазы, такие как ранняя логарифмическая фаза роста, средняя логарифмическая фаза роста и поздняя логарифмическая фаза роста. Оптическая плотность связана с фазой логарифмического роста. Логарифмическую фазу роста и оптическую плотность можно также использовать в качестве пороговых параметров для подачи сигнала начала и/или остановки непрерывной подачи источника углерода и/или индуктора.
[0092] Например, индуцирование, или непрерывное добавление индуктора, можно начать в ранней логарифмической фазе роста, средней логарифмической фазе роста и поздней логарифмической фазе роста. Поздняя логарифмическая фаза роста может идти при OD, равной от приблизительно 70 до приблизительно 110. В некотором варианте реализации настоящего изобретения, постоянная скорость подачи индуктора начнется в поздней логарифмической фазе роста указанной культуральной среды или при OD, равной от приблизительно 70 до приблизительно 110, от приблизительно 70 до приблизительно 105, от приблизительно 75 до приблизительно 85, или приблизительно 80, в соответствии с различными вариантами реализации.
[0093] OD можно измерить при различных длинах волн, которые как правило используют специалисты в данной области. Как правило, OD600 используют в качестве меры роста клеток и плотности клеток в культуре. Если не указано иначе, "OD", как используется в данной заявке, относится к OD600.
Растворенный кислород
[0094] Другим параметром, который может служить переключателем для начала и/или остановки контроллера подачи, является растворенный кислород (DO) (а именно периодическая ферментация с подпиткой с DO-stat контролем). DO можно контролировать путем регулировки встряхивания, потока воздуха, добавления кислорода и давления в сосуде для удерживания культуральной среды. Порог DO можно установить в диапазоне от 5% до 80% DO, такой как 20%, 40% или 80%. Как только порог был достигнут, контроллер подачи источника углерода или индуктора может быть включен до тех пор, пока не будет достигнут порог, который сигнализирует об окончании подачи. Порогом для остановки может быть другой порог DO или другой параметр, такой как количество источника углерода или индуктора. Например, во всех случаях, когда DO поднимается выше 30% или 40% в культуральной среде, контроллер подачи может запуститься до тех пор, пока DO не упадет до 20%, или, в качестве альтернативы, до тех пор, пока 0.5 г/л или 1 г/л источника углерода или индуктора не будет вновь добавлено, в соответствии с различными вариантами реализации настоящего изобретения.
pH
[0095] Другим параметром, который может служить переключателем для начала и/или остановки контроллера подачи, является pH (а именно периодическая ферментация с подпиткой с pH-stat контролем). pH можно контролировать с помощью добавления основания или кислоты в культуральную среду. Порог pH можно установить в диапазоне от 6.8 до 7.2, такой как 7.0. Как только порог был достигнут, контроллер подачи источника углерода или индуктора может быть включен до тех пор, пока не будет достигнут порог, который сигнализирует об окончании подачи. Порогом для остановки может быть другой порог pH или другой параметр, такой как количество источника углерода или индуктора. Например, во всех случаях, когда pH поднимается до 6.97 в культуральной среде, контроллер подачи может запуститься до тех пор, пока pH не упадет до 6.95, или, в качестве альтернативы, до тех пор, пока 1 г/л источника углерода или индуктора не будет вновь добавлено, в соответствии с различными вариантами реализации настоящего изобретения.
Время сбора клеток
[0096] Время сбора клеток представляет собой количество времени, которое проходит после первоначальной индукции или добавления индуктора. Любое подходящее время сбора клеток предусмотрено настоящим изобретением. Время сбора клеток может варьироваться от приблизительно 2 часов до приблизительно 10 часов, от приблизительно 2 часов до приблизительно 8 часов, от приблизительно 2.5 часов до приблизительно 7 часов, от приблизительно 3 часов до приблизительно 6 часов, и т.д., в соответствии с различными вариантами реализации настоящего изобретения. Используя постоянные скорость подачи, время сбора клеток и суммарное количество индуктора, средние специалисты в данной области поймут, как можно регулировать каждый параметр, чтобы достичь желаемых результатов. Специалисты в данной области поймут, когда нужно собирать клетки, на основании поданного количества арабинозы, потому что они могут легко определить поданное количество на основании скорости и времени подачи. Таким образом, можно достичь конечных концентраций указанного индуктора, равных 5, 10, 20, 30 и 40 г/л, который подавали в течение 3 часов, в качестве примера, без ограничения.
Концентрация индуктора
[0097] Некоторый индуктор в любой подходящей концентрации предусмотрен настоящим изобретением. Концентрации индуктора, применимые для индукции клеток-хозяев, могут варьироваться от приблизительно 0.00001% до приблизительно 20% (в объемном отношении, v/v), без ограничений.
Температура
[0098] Культуру, согласно настоящим вариантам реализации, можно инкубировать при любой температуре, которая позволяет рост клеток. Различные температуры, при которых следует инкубировать обильно растущую культуру, включают, без ограничения, 22°С, 28°С, 37°С, или любую их комбинацию.
Прибор для ферментации
[0099] Любой подходящий прибор для ферментации (а именно "ферментер") предусмотрен для применения в настоящем изобретении, что должно быть очевидно для специалиста в данной области. Например, ферментер может содержать любое количество импеллеров (таких как импеллеры Раштона), заборников и/или измерительных зондов. В соответствии с некоторым вариантом реализации, указанный ферментер сконфигурирован включающим три импеллера Раштона и кольцевой или лучевой барботер для введения воздуха в ферментер. В настоящем изобретении предполагается использование ручных и/или основанных на применении компьютера систем. По этой причине, система ферментации может быть связана с компьютеризированной системой для слежения и контролирования ферментации. Таким образом, указанная система может быть полностью или частично автоматизирована, в соответствии с вариантами реализации настоящего изобретения.
Композиции согласно настоящему изобретению
[0100] Композиции, включающие рекомбинантные белки, такие как те, которые получены в соответствии со способами настоящего изобретения, предусмотрены в данной заявке, в соответствии с вариантами реализации настоящего изобретения. Композиции согласно настоящему изобретению включают рекомбинантный белок при высокой плотности в культуре, такой как рекомбинантные белки, полученные в соответствии со способами настоящего изобретения, не предназначенными для его ограничения.
[0101] Указанная композиция включает некоторую культуру, имеющую рекомбинантный белок при плотности, равной по меньшей мере приблизительно 1.5 г/л, на основании общего объема указанной культуры. Плотность указанного рекомбинантного белка равна по меньшей мере приблизительно 1.7 г/л, на основании общего объема культуры, согласно дополнительному варианту реализации настоящего изобретения. Плотность указанного рекомбинантного белка равна по меньшей мере приблизительно 2.0 г/л, на основании общего объема культуры, согласно другому варианту реализации настоящего изобретения. Плотность указанного рекомбинантного белка равна по меньшей мере приблизительно 3.0 г/л, на основании общего объема культуры, согласно другому варианту реализации настоящего изобретения.
[0102] Некоторая композиция, включающая рекомбинантный белок 2086, предусмотрена в некотором варианте реализации настоящего изобретения. Указанный белок 2086, как используется в данной заявке, представляет собой белок, экспрессируемый с полинуклеотида, который соответствует 2086 гену в N. meningitidis серологической группы В, включая любой его фрагмент, производные или мутации. Неограничивающие примеры белков и полинуклеотидов 2086 описаны в WO 03/063766 и WO 04/094596.
[0103] Композиция с рекомбинантным белком 2086 включает рекомбинантный белок 2086 в культуре, отличающейся тем, что указанный рекомбинантный белок 2086 содержится при плотности, равной по меньшей мере приблизительно 1.5 г/л, на основании общего объема культуры. Плотность рекомбинантного белка 2086 равна по меньшей мере приблизительно 1.7 г/л, на основании общего объема культуры, согласно дополнительному варианту реализации настоящего изобретения. Плотность рекомбинантного белка 2086 равна по меньшей мере приблизительно 2.0 г/л, на основании общего объема культуры, согласно другому варианту реализации настоящего изобретения. Плотность рекомбинантного белка 2086 равна по меньшей мере приблизительно 3.0 г/л, на основании общего объема культуры, согласно другому варианту реализации настоящего изобретения.
[0104] Композиции согласно настоящему изобретению могут включать любой белок, такой как белок, полученный в соответствии со способом настоящего изобретения. Рекомбинантные белки могут быть липидированными или нелипидированными белками. В некотором варианте реализации настоящего изобретения, указанный рекомбинантный белок представляет собой рекомбинантный белок 2086, либо липидированный, либо нелипидированный. Рекомбинантный белок 2086 может быть белком 2086 подсемейства А или подсемейства В, или их комбинацией. Композиции согласно настоящему изобретению могут включать один белок или более чем один белок. Указанные белки могут быть родственными или неродственными белками. Например, некоторая композиция согласно настоящему изобретению может включать белок 2086, соответствующий одному или более штаммам подсемейства А и/или одному или более штаммам подсемейства В.
[0105] Композиции, включающие вещество для применения при осуществлении способов настоящего изобретения, также предусмотрены в данной заявке. Такие композиции включают необходимые компоненты для культивирования, включая рекомбинантные клетки и питательные вещества, в соответствии с вариантами реализации настоящего изобретения. Различные композиции могут быть предусмотрены совместно в наборе, в соответствии с некоторым вариантом реализации настоящего изобретения. Например, компоненты для ведения культуры могут быть заранее удобно упакованы в требуемых количествах, чтобы облегчить лабораторное или промышленное применение, без ограничения. Подобный набор может также включать этикетки, индикаторы и инструкции, чтобы облегчить применение каждого компонента и способ комбинирования компонентов, в соответствии с различными вариантами реализации настоящего изобретения.
[0106] Следующие примеры включены, чтобы продемонстрировать различные варианты реализации настоящего изобретения. Для специалистов в данной области должно быть очевидно, что методики, описанные в последующих примерах, представляют собой методики, которые авторы настоящего изобретения сочли хорошо работающими при реализации настоящего изобретения, и таким образом, их можно рассматривать составляющими различные модели для его реализации. Тем не менее, для специалистов в данной области, ввиду настоящего описания, должно быть очевидно, что можно совершить множество изменений в конкретных вариантах реализации, которые описаны, и все же получить подобный или сходный результат, не выходя за пределы сущности и объема настоящего изобретения.
ПРИМЕРЫ
Пример 1: Периодическая ферментация с подпиткой при постоянной скорости подачи
[0107] Е. coli (pPW62) подсемейства В использовали в качестве модельного штамма для процесса ферментации с подпиткой. На основании результатов, указанный процесс будет также применен к подсемейству А Е. coli (pPW102).
[0108] Среду и раствор для подпитки для периодической ферментации с подпиткой получали, используя компоненты, которые перечислены в следующих таблицах.
Среда и раствор для подпитки:
Методы
[0109] Периодическую ферментацию с подпиткой при постоянной скорости подачи применяли для достижения высокой плотности клеток при ферментации Е. coli. Первоначальная концентрация глюкозы была 10 г/л в среде. Концентрация (NH4)2SO4 была повышена до 3 г/л в среде для ферментации, но держалась на уровне 1 г/л в посевной культуральной среде. Чтобы определить скорость подачи, сначала выполняли периодическую ферментацию с подпиткой в системе DO-stat. Уровень DO поддерживали на 20% с помощью каскадного контроллера, который повышал скорость встряхивания до максимальной и затем добавлял кислород. Когда глюкоза была исчерпана, DO резко возрастал (выше 40%), и добавляли концентрат глюкозы до конечной концентрации 1 г/л в ферментере. После каждого добавления глюкозы, помпа оставалась выключенной в течение установленного времени перед тем, как позволяли сделать следующее добавление. Максимальная OD, равная приблизительно 160, была достигнута, когда выполняли периодическую ферментацию с подпиткой в системе DO-stat. Постоянную скорость затем выбирали эквивалентной DO-stat контроллеру, добавляя достаточное количество глюкозы, чтобы достичь концентрации вплоть до 18 г/л или 24 г/л каждый час. В процессе периодической ферментации с подпиткой при подпитке с постоянной скоростью, подача глюкозы включалась при необходимой постоянной скорости, когда был резкий подъем DO до 40%.
[0110] Посевные культуры инициировали, используя одну виалу E. coli (pPW62) на литр основной среды +15 мкг/мл хлорамфеникола в 2800 мл колбе Фернбаха. Колбы инкубировали при 32°С, 150 об/мин в течение ночи (~16 часов). Конечная OD600 была обычно ~3. 10% от размера инокулята, который использовали для инокуляции каждого ферментера. Каждый ферментер имел 3 импеллера Раштона и кольцевой барботер. Первоначальные заданные значения: температура: 36°С, рН: 7.00±0.05 (контролировали с помощью 7.4 N NH4OH), поток воздуха: ~1 л воздуха на 1 л среды в минуту (~1 vvm), DO: 20%. DO контролировался каскадом встряхиваний (мин.: 150 об/мин, макс.: 1000 об/мин) и добавлением О2 посредством газосмесительного устройства. Пенообразование контролировали, при необходимости, путем добавления вручную PPG-2000. 0.35 мл/л AF добавляли в среду перед стерилизацией. В процессе ферментации, пробы брали ежечасно для отслеживания глюкозы, pH и OD600 вне системы. Супернатанты получали из 1 мл пробы и хранили для дальнейшего анализа на органические кислоты посредством жидкостной хроматографии высокого разрешения (HPLC).
Результаты
Периодическая ферментация с подпиткой при подпитке с постоянной скоростью
[0111] На Фигуре 1 показана динамика OD, потребления глюкозы и накопления уксусной кислоты при постоянной скорости подачи. Максимальные OD, равные 158 и 150, получали при постоянной скорости подачи, равной 24 г глюкозы/л/ч и 18 г глюкозы/л/ч соответственно. Большое количество глюкозы, такое как 28 г/л, накапливалось во время работы, когда использовалась скорость подачи, равная 24 г/л/ч. Глюкоза накапливалась до 12 г/л, когда использовалась скорость подачи 18 г/л/ч. Небольшое количество уксусной кислоты (а именно менее чем 1.5 г/л) образовывалось в обоих случаях. Экспоненциальная фаза роста заканчивалась близко к OD 100. Характерная скорость роста была приблизительно равна 0.60 (ч-1) в обоих случаях.
[0112] Для снижения накопления глюкозы были исследованы низкие постоянные скорости подачи, равные 16.4 г/л/ч и 15 г/л/ч. На Фигуре 2 показана динамика OD, потребления глюкозы и накопление уксусной кислоты при постоянных скоростях подачи, упомянутых выше. Максимальные OD были равны 142 и 147 соответственно. Как и в предыдущих запусках, культура с наиболее быстрой скоростью подачи накапливала больше глюкозы, хотя количество накопленной глюкозы было гораздо меньше, чем в предыдущих экспериментах. Приблизительно 8 г/л глюкозы накапливалось при ферментации со скоростью подачи 16.4 г/л/ч и 5.4 г/л глюкозы при ферментации со скоростью подачи 15 г/л/ч. Небольшое количество уксусной кислоты (такое как меньше 1.5 г/л) образовывалось в обоих случаях (см. Фигуру 2). Характерная скорость роста была приблизительно равна 0.60 (ч-1) в обоих случаях. Таким образом, на характерную скорость роста не влияла скорость подачи между 15 г/л/ч и 24 г/л/ч.
Индукция при различных OD роста
[0113] Постоянную скорость подачи, равную 15 г глюкозы/л/ч, использовали для исследования индукции арабинозой, потому что она приводила к высокой плотности клеток и небольшому накоплению глюкозы и уксусной кислоты. В этом эксперименте, индуцирование при средней логарифмической фазе роста, OD ~55, и поздней логарифмической фазе роста, OD ~80, было сравнимо. Культуру индуцировали путем простой замены подачи глюкозы на подачу арабинозы, и подавали арабинозу при постоянной скорости, равной 13.4 г/л/ч. Всего 40 г/л арабинозы добавляли в каждую культуру в течение 3 часов. После индуцирования, пробы брали каждый час для проведения анализа на rLP2086 посредством ПААГ/ДСН, анализа на органические кислоты и арабинозу посредством HPLC.
[0114] На Фигуре 3 показана динамика OD и продукция rLP2086, когда индукция производится при OD ~55 и ~80. Как максимальная OD, так и выход rLP2086 были более высокими, когда клетки индуцировали при OD ~80 (максимальная OD: 101 против 84; максимальный выход: 1.8 г/л против 1.2 г/л).
Индукция при различных уровнях арабинозы
[0115] Целью следующих экспериментов было оценить суммарное количество арабинозы, поданной в культуру, и исследовать, будет ли еще приводить снижение суммарного количества арабинозы, поданной в культуру, к высокой экспрессии rLP2086. Концентрат арабинозы подавали в 4 различные культуры, в каждую при различных скоростях подачи, в течение 3 часов, что приводило к конечным концентрациям арабинозы, равным 10, 20, 30 и 40 г/л. Все культуры индуцировали при OD600 ~80. На Фигуре 4 показана динамика OD и продукции rLP2086. В Таблице 5 суммированы OD и выход rLP2086 для каждого из четырех условий. В ней показан максимальный выход rLP2086, равный: 1.2 г/л для 10 г/л суммарного количества добавленной арабинозы; 1.6 г/л для 20 г/л суммарного количества добавленной арабинозы; 1.7 г/л для 30 г/л суммарного количества добавленной арабинозы; 2.0 г/л для 40 г/л суммарного количества добавленной арабинозы. Подача арабинозы в количестве между 20 г/л и 40 г/л приводила к сходному выходу rLP2086, тем не менее, 10 г/л арабинозы приводили к продукции гораздо меньшего количества rLP2086 (а именно 1.2 г/л). Эти результаты позволяют предположить, что суммарное количество арабинозы, добавленное для индукции, можно снизить от 40 г/л до 20 г/л без снижения производительности rLP2086. Таким образом, снижение использования арабинозы будет наиболее экономически целесообразным, особенно учитывая высокую цену арабинозы (приблизительно 500 долларов США за кг).
Сравнение способов добавления арабинозы
[0116] Следующий эксперимент был проведен, чтобы изучить, является ли стратегия непрерывной подачи лучшей, чем простая стратегия периодического добавления при индуцировании арабинозой. При запуске X-BRN05-039, 20 г/л арабинозы единовременно добавляли в ферментер, вместо подачи в течение времени, когда OD была равна приблизительно 80. На Фигуре 5 показана динамика OD, потребления глюкозы, и арабинозы, и продукции rLP2086. Было получено максимальное количество rLP2086, равное 1.3 г/л. Периодическое добавление арабинозы, хотя операционно проще, позволяло получить меньшее количество rLP2086, чем при непрерывной подаче. Таким образом, стратегия непрерывной подачи арабинозы лучше, чем простое периодическое добавление.
[0117] Чтобы изучить, можно ли более эффективно использовать арабинозу путем снижения скорости подачи арабинозы, сравнивали скорости подачи, равные 3.3 г. арабинозы/л/ч и 6.7 г. арабинозы/л/ч. На Фигуре 6 показана динамика OD и продукции rLP2086. Концентрат арабинозы подавали в одну культуру при скорости подачи, равной 6.7 г/л/ч в течение 3 часов, и во вторую культуру подавали при скорости, равной 3.3 г/л/ч в течение 6 часов. Для обеих культур суммарное количество добавленной арабинозы было равно 20 г/л. Как показано на Фигуре 6, при обоих условиях продуцировалось одно и то же максимальное количество rLP2086 (а именно 2.2 г/л), но были различия в кинетике продукции. Более высокая скорость подачи приводила к более высокой скорости продукции. Максимальный уровень rLP2086 был достигнут через 3 часа и 6 часов после индукция при скорости подачи, равной 6.7 г/л/ч и 3.3 г/л/ч соответственно. Преимущество использования более высокой скорости подачи (а именно 6.7 г/л/ч) состоит в том, что цена продукции (например, стоимость энергии) будет ниже при использовании более высокой скорости подачи, чем при использовании более низкой скорости подачи.
Влияние времени индукции на выход экспрессии rLP2086
[0118] Чтобы определить оптимальное время сбора клеток, нормальный профиль подачи (20 г/л арабинозы подавали в течение 3 часов) продливали до 40 г/л, поданные в течение 6 часов. При запусках X-BRN05-028 и X-BRN05-029 клетки индуцировали при OD ~55 и OD ~80 соответственно. На Фигуре 7 показана динамика OD и продукции rLP2086. Хотя подачу арабинозы продлили с 3 часов до 6 часов, примечательно, что пиковый титр был также получен приблизительно через 3 часа после индуцирования. Титр продукта был немного более высоким в культуре, которую индуцировали при более высокой OD. Максимальный выход rLP2086 при индукции при OD ~55 был равен 2.0 г/л (X-BRN05-028), тогда как он был равен 2.4 г/л при индукции при OD ~80 (X-BRN05-029). Этот результат позволяет предположить, что клетки следует собирать через 3 часа после индуцирования.
Сравнение растворов для подпитки с добавлением и без солей
[0119] Для исследования, являются ли добавленные соли необходимыми в растворах глюкозы и арабинозы для подпитки, подпитки глюкозой и арабинозой без добавок сравнивали со стандартными подпитками глюкоза + соли (а именно K2HPO4/KH2PO4+(NH4)2SO4) и арабиноза + соли. Для обеих культур, 20 г/л арабинозы подавали в течение 3 часов. Профили роста и продукции rLP2086 были очень похожими. Максимальный выход rLP2086 был равен 1.8 г/л, когда соли были добавлены к подпиткам, и 2.0 г/л, когда подпитки из глюкозы и арабинозы были приготовлены без солей. Эти результаты позволяют предположить, что нет необходимости в добавлении солей в раствор глюкозы и арабинозы для подпитки.
Периодическая ферментация с подпиткой при постоянной скорости подачи для штамма подсемейства В
[0120] Посевные культуры начинали вести путем инокуляции 1 л основной среды, содержащей 15 мкг/мл хлорамфеникола, 1 мл размороженной работающей затравки. Культуру растили в 2.8-л колбе Фернбаха и инкубировали в течение приблизительно 16 часов при 32°С и 150 об/мин. Конечная OD600 была равна ~3.0. 350 мл посевных культур асептически переносили в 3.15 л основной среды, содержащей 3 г/л (NH4)2SO4 без хлорамфеникола. Ферментацию вели при контролируемом рН 7.0±0.05 посредством 7.4 N NH4OH, при температуре 36°С, при DO 20% и при потоке воздуха 1 vvm. DO контролировался посредством каскада встряхиваний (мин.: 150 об/мин, макс.: 1000 об/мин) и добавления кислорода. Пеногаситель PPG-2000 автоматически добавляли, чтобы контролировать пенообразование. В процессе ферментации, пробы брали ежечасно для отслеживания глюкозы и OD вне системы. После инокуляции, DO падал от ~100% до 20% и затем поддерживался при 20%. Когда был резкий подъем уровня DO от 20% до более чем 40% (обычно, через 6 часов фактической продолжительности ферментации (EFT)), включалась помпа подачи глюкозы (без солей) при скорости 15 г/л/ч. Как показано на Фигуре 8, глюкоза полностью исчерпывалась через 6 часов EFT, что приводило к резкому подъему DO. Пробы брали каждые полчаса, когда OD достигала ~40. Подача глюкозы выключалась при OD 90 и подача арабинозы включалась при скорости 13.4 г/л/ч. После 3 часов подачи арабинозы (без солей) (а именно суммарного добавления 20 г/л арабинозы) подача арабинозы выключалась, и позволяли продолжаться ферментации в течение еще одного часа. Как показано на Фигуре 8, была получена OD, равная 102, и экспрессировалось 2.0 г/л MnB rLP2086, на основании ПААГ/ДСН (см. Фигуру 9). Пик был через 3 часа после индукции (а именно через ~12 часов EFT). ПААГ/ДСН и анализ методом вестерн-блот показал, что экспрессированный белок был, без сомнения, белком подсемейства В rLP2086.
Применение процесса ферментации с подпиткой для MnB rLP2086 штамма подсемейства А
[0121] Чтобы проверить, является ли процесс ферментации с подпиткой, использованный для rLP2086 подсемейства В, применимым к rLP2086 подсемейства А, указанный процесс проводили, применяя процедуру, установленную для штамма подсемейства В. На Фигуре 10 показана динамика OD, потребления глюкозы и арабинозы и продукции rLP2086. Профили роста и продукции rLP2086 для подсемейства А были сходны с таковыми, полученными для подсемейства В (по сравнению с Фигурой 8). ПААГ/ДСН и анализ методом вестерн-блот показали, что экспрессированный белок был, без сомнения, rLP2086 подсемейства А (см. Фигуру 11). В Таблице 6 перечислены максимальные OD и выход экспрессии rLP2086 для шести различных запусков для подсемейства А. Диапазон максимального выхода экспрессии rLP2086 был 1.5-2.1 г/л (средний максимальный выход: 1.8±0.2 г/л), что было сходно с результатами для периодической ферментации с подпиткой, примененной для получения rLP2086 подсемейства В. Таким образом, периодическая ферментация с подпиткой, разработанная для штамма подсемейства В, также подходит для штамма подсемейства А.
Совместная подача глюкозы и арабинозы в процессе индуцирования арабинозой
[0122] Для снижения необходимого количества арабинозы без снижения продукции rLP2086 была исследована одновременная подача глюкозы и арабинозы во время индукции. В рамках этой стратегии было осуществление подачи 10 г/л арабинозы в течение 3 часов (половина от обычного количества), продолжая подачу глюкозы во время фазы индукции на уровне 25% (3.75 г/л/ч), 50% (7.5 г/л/ч), и 100% (15 г/л/ч) от стандартной скорости подачи глюкозы. Все из подпиток, глюкоза и арабиноза, были приготовлены без добавок.
[0123] На Фигурах 12А, 12B и 12С показана динамика роста клеток подсемейства В, концентрации глюкозы, арабинозы, уксусной кислоты и продукция rLP2086. Все три запуска были индуцированы при OD ~80. Как показано на Фигуре 12А, OD при запуске со 100% подачей глюкозы продолжала подниматься после индуцирования, имея пик при 117, тогда как при запуске с 50% подачей пик был при 106 (Фигура 12B) и при запуске с 25% держался около 100 (Фигура 12С) после индуцирования. При подаче 100% глюкозы началось накопление глюкозы и арабинозы через 3 часа после индуцирования. При запуске с подачей 50% глюкозы было лишь небольшое количество глюкозы в последней пробе (показание = 0.21 г/л). Накопления глюкозы не было вообще при запуске с подачей 25% глюкозы. Ни в одном из трех запусков не накапливалась арабиноза. При запусках с подачей 100% (Фигура 12А) и 50% (Фигура 12B) глюкозы продуцировалось ~1.5 и 1.7 г/л rLP2086 соответственно, тогда как при запуске с подачей 25% (Фигура 12С) продуцировалось более 2.1 г/л. Пик продукции при запуске с подачей 100% глюкозы был перед тем, как арабиноза кончалась, позволяя предположить, что экспрессия rLP2086 может подавляться при накоплении глюкозы и уксусной кислоты. Пик продукции при запуске с подачей 50% глюкозы был приблизительно одновременно с исчерпыванием арабинозы, и пик продукции при запуске с подачей 25% был после того, как арабиноза закончилась, позволяя предположить, что экспрессия 2086, возможно, не подавляется до тех пор, пока концентрация глюкозы поддерживается на минимальном уровне (глюкоза не накапливалась, что видно на Фигурах 12B и 12С). Хотя всего лишь 10 г/л арабинозы подавали в эти культуры, их продукция rLP2086 была сходна с таковой, полученной при подаче 20 г/л. Одновременная подпитка глюкозой и арабинозой может снизить потребление арабинозы на 50% и все еще достичь того же выхода rLP2086, когда концентрация глюкозы поддерживается на низком уровне в процессе индукции. Таким образом, цену химических веществ можно значительно уменьшить.
[0124] Чтобы изучить, можно ли дополнительно уменьшить потребление арабинозы и увеличить выход rLP2086, были исследованы различные скорости подачи глюкозы, суммарные количества поданной арабинозы и OD индукции. В Таблице 7 перечислены различные комбинации этих условий. Похоже, что скорость подачи глюкозы между 2.25 и 7.5 г/л/ч и скорость подачи арабинозы между 1.7 и 6.7 г/л/ч не будет значительно влиять на выход rLP2086. OD индукции между 80 и 105 приводят к сходному выходу rLP2086.
Пример 3: Периодическая ферментация с подпиткой в масштабе, увеличенном до 100 л
[0125] Посевную культуру начинали вести путем инокуляции 2×1 л основной среды, содержащей 15 мкг/мл хлорамфеникола, 1 мл (а именно, 1 виалой) размороженной работающей затравки. Культуру в 2.8-л колбе Фернбаха инкубировали в течение приблизительно 16 часов при 32°С и 150 об/мин в ротационном шейкере.
[0126] Две ночные посевные культуры в 1-л колбе Фернбаха асептически переносили в 150-л ферментер, содержащий 70 л основной среды без хлорамфеникола. Ферментацию вели в 150 л в основной среде с контролируемыми pH 7.0±0.05 с помощью 7.4 N NH4OH, температурой 36°С, при DO 20% и при потоке воздуха 1 vvm. DO контролировали посредством каскада встряхиваний и добавления кислорода. Пеногаситель PPG-2000 автоматически добавлялся, чтобы контролировать пенообразование. В процессе ферментации DO падал со ~100% до 20% и поддерживался на 20%. Когда был резкий подъем уровня DO от 20% до более чем 40% (обычно, при OD ~20), что указывало на исчерпывание глюкозы, активировалась помпа подачи концентрированной глюкозы (а именно 500 г/л) при скорости 15 г глюкозы/л содержимого ферментера/ч. В процессе ферментации пробы брали ежечасно для отслеживания глюкозы и OD вне системы. Пробы брали каждые полчаса, когда OD достигала ~40. Как только OD достигала ~80, подачу глюкозы прекращали и подачу арабинозы начинали (например, 500 г/л концентрата арабинозы) при скорости 6.7 г.арабинозы/л содержимого ферментера/ч в течение 3 часов.
[0127] На Фигуре 13А показана динамика роста клеток подсемейства В, потребления глюкозы, накопления уксусной кислоты и продукции rLP2086 в масштабе 100 л. Профиль ферментации при масштабе 100 л был схож с таковым для маломасштабной ферментации. Были получены максимальная OD, равная 99, и максимальный выход rLP2086, равный 1.9 г/л. Эти результаты показывают, что периодическая ферментация с подпиткой является масштабируемой.
[0128] На Фигуре 13B показана динамика роста клеток подсемейства А, потребления глюкозы, накопления уксусной кислоты и продукции rLP2086 в масштабе 100 л. Профиль ферментации при масштабе 100 л был схож с таковым для маломасштабной ферментации. Были получены максимальная OD, равная 96, и максимальный выход rLP2086, равный 2.0 г/л. Эти результаты показывают, что периодическая ферментация с подпиткой является масштабируемой и устойчивой.
[0129] На Фигуре 14А показана динамика плотности клеток подсемейства В, концентраций глюкозы, арабинозы, уксусной кислоты и выход rLP2086 при одновременной подаче глюкозы и арабинозы в масштабе 100 л. В процессе индуцирования скорости подачи поддерживались на уровне 3.75 и 1.67 г/л/ч для подачи глюкозы и арабинозы соответственно. Одновременно арабинозу и глюкозу подавали в течение 5 часов. Были получены максимальная OD, равная 90, и максимальный выход rLP2086, равный 1.8 г/л. Максимальный выход rLP2086 был при 4-часовом индуцировании. Средней максимальной OD и средним максимальным выходом rLP2086 для подсемейства В были значения 84.8±6.8 и 1.6±0.3 г/л соответственно. Эти результаты показывают, что периодическая ферментация с подпиткой с одновременной подачей глюкозы и арабинозы во время фазы индукции является масштабируемой.
[0130] На Фигуре 14B показана динамика роста клеток подсемейства А, потребления глюкозы, накопления уксусной кислоты и продукции rLP2086 в масштабе 100 л. Ферментацию вели при тех же условиях, которые указаны в абзаце [0129] и клетки индуцировали в течение 6 часов. Были получены максимальная OD, равная 89, и максимальный выход rLP2086, равный 1.8 г/л. Максимальный выход rLP2086 был при 4-часовом индуцировании. Средней максимальной OD была 87.9±10.5 и средним максимальным выходом rLP2086 был 1.8±0.2 г/л для подсемейства А. Эти результаты показывают, что периодическая ферментация с подпиткой является масштабируемой и устойчивой.
[0131] Хотя настоящее изобретение было описано со ссылками на различные варианты реализации и примеры, для специалистов в данной области должно быть очевидно, что возможны различные модификации настоящего изобретения, не выходящие за пределы его сущности и объема.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСОКИЕ УРОВНИ КОНСТИТУТИВНОГО ПРОДУЦИРОВАНИЯ ЗАЩИТНОГО АНТИГЕНА СИБИРСКОЙ ЯЗВЫ | 2001 |
|
RU2288272C2 |
| НОВАЯ СИСТЕМА СЕЛЕКЦИИ | 2006 |
|
RU2415935C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2005 |
|
RU2433185C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА АЛЬФА5-ИНТЕРФЕРОНА | 2011 |
|
RU2575598C9 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА SAV-RGD, СПЕЦИФИЧЕСКИ УЗНАЮЩЕГО КЛЕТКИ МЕЛАНОМЫ | 2013 |
|
RU2563540C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА SAV-RGD | 2014 |
|
RU2577138C1 |
| ВЫСОКОПРОДУКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ОСЛАБЛЕННЫХ ШТАММОВ SALMONELLA | 2012 |
|
RU2631924C2 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2785901C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕНА | 2008 |
|
RU2545699C2 |
| ФЕРМЕНТАЦИОННАЯ СРЕДА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2009 |
|
RU2556120C2 |

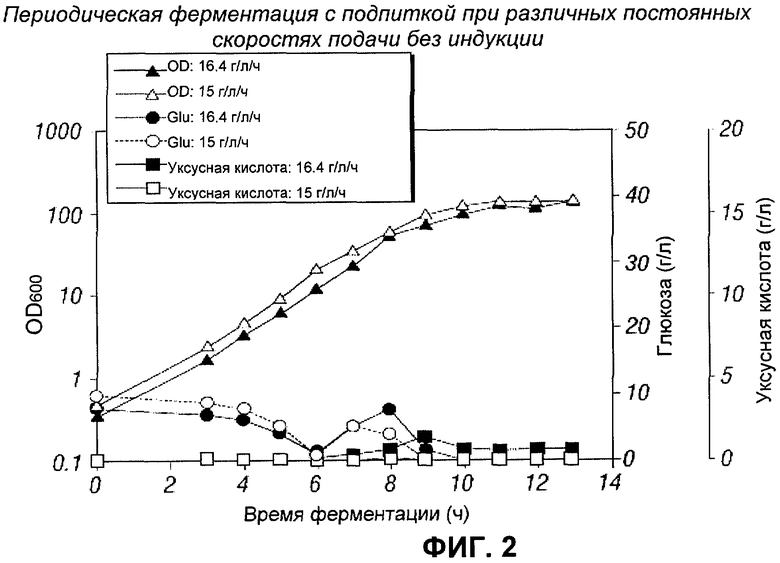

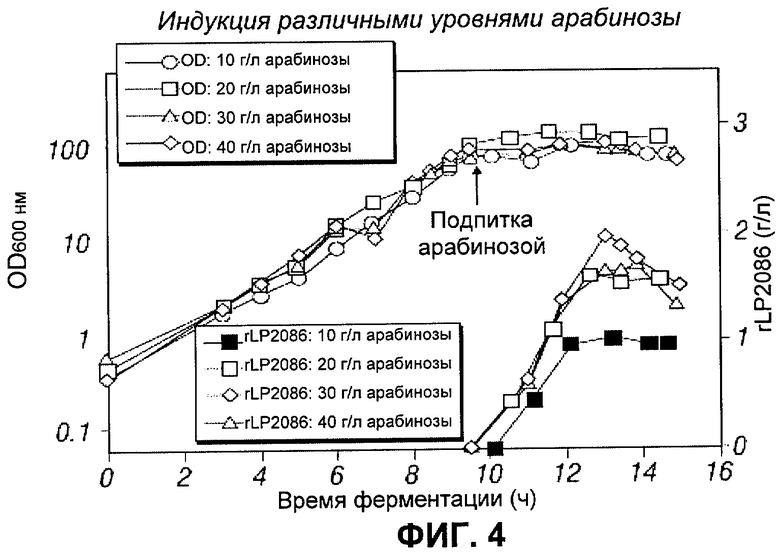
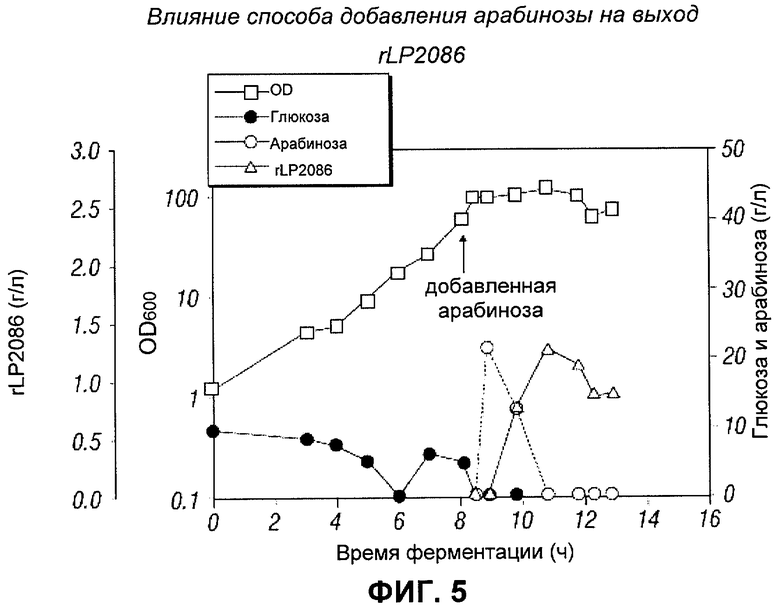
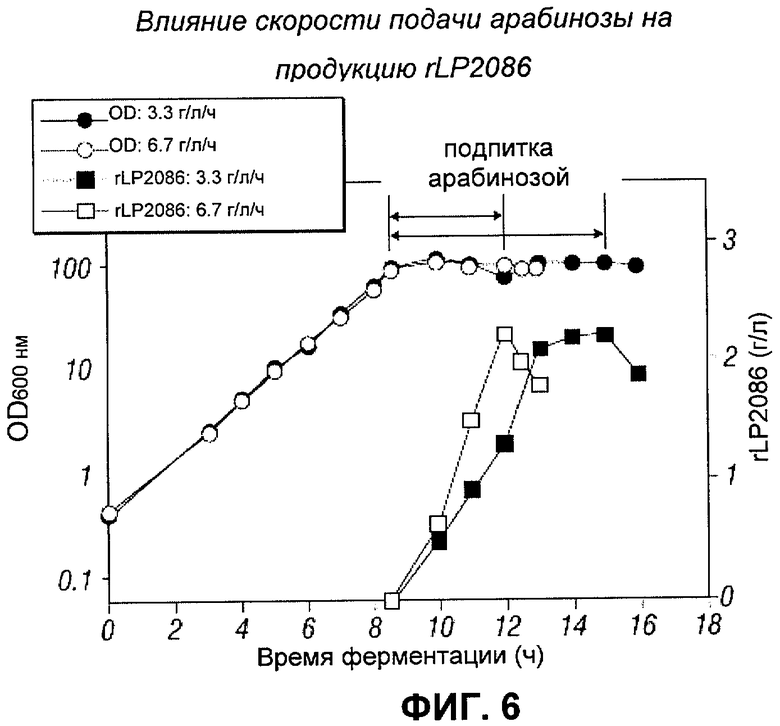



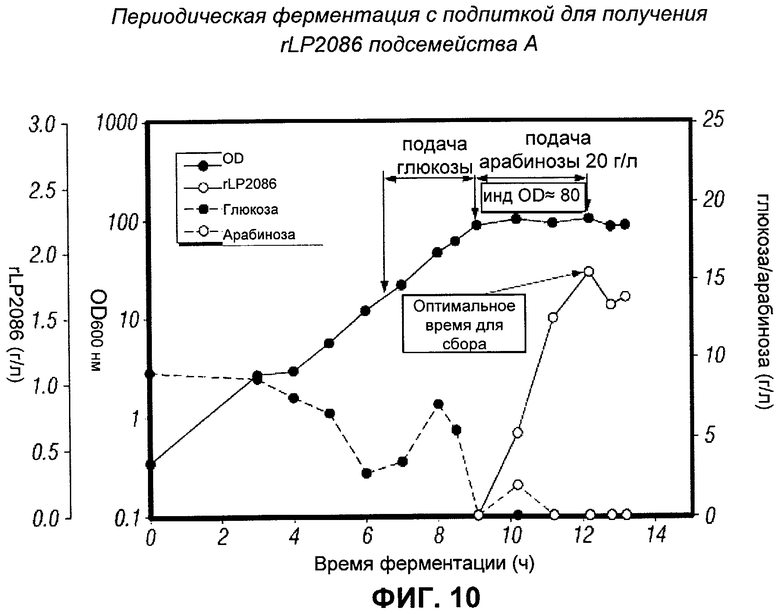
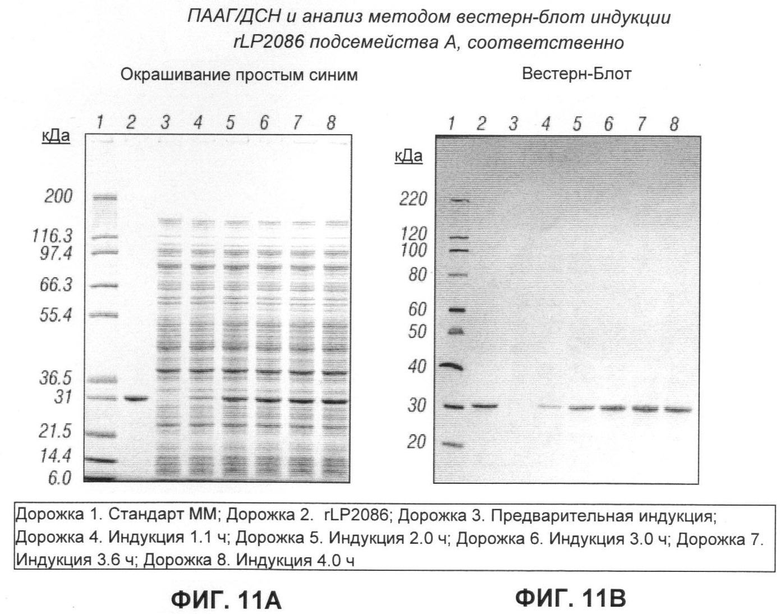
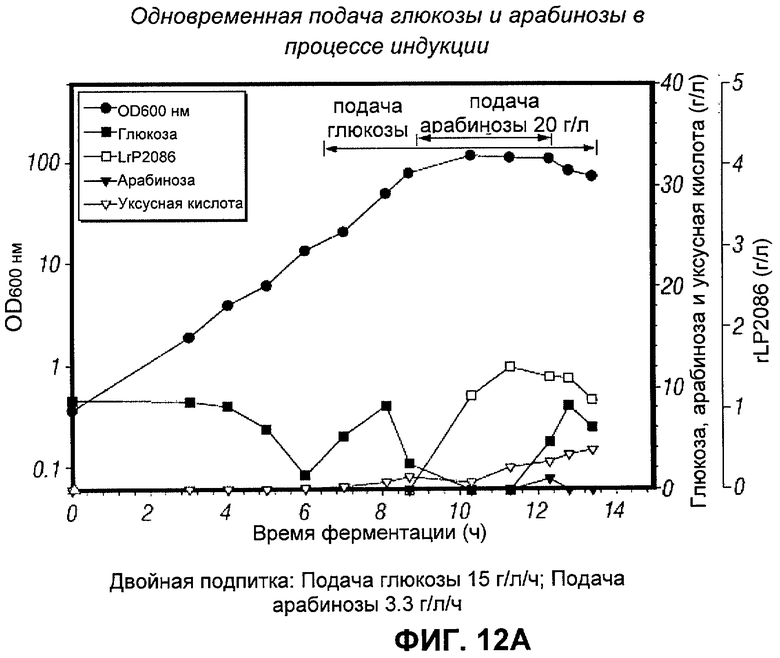
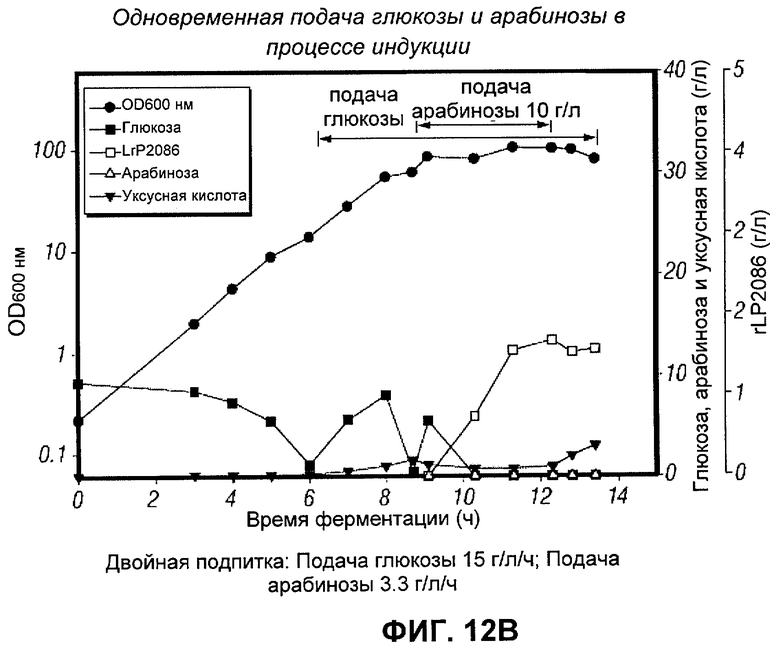
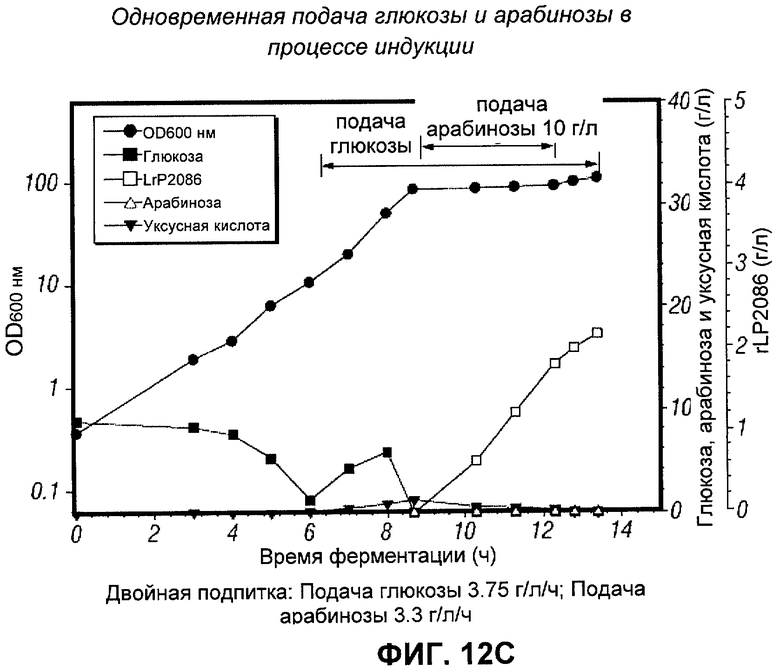



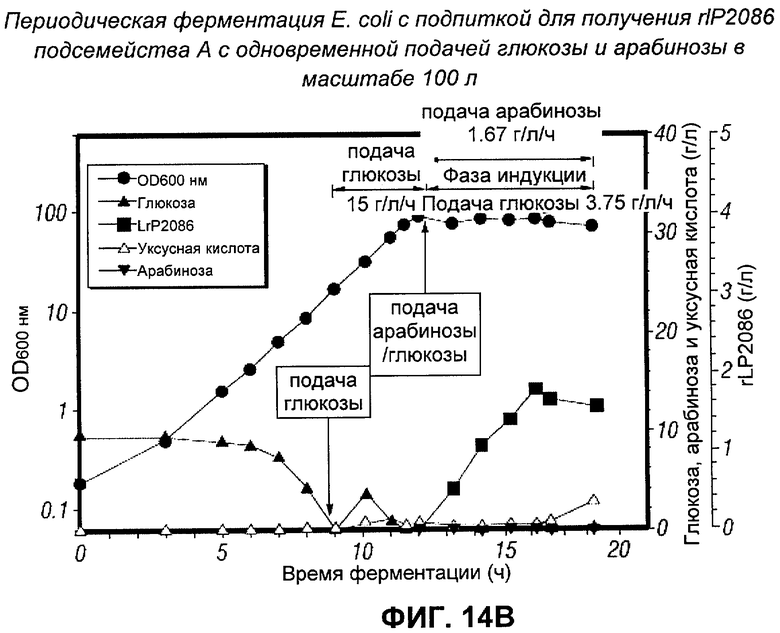
Описаны способы - варианты получения рекомбинантных менингококковых белков 2086 посредством периодической ферментации бактериальной культуры с подпиткой с непрерывной подачей индуктора в суммарном количестве от приблизительно 7 г/л до приблизительно 15 г/л после достижения порогового параметра и с непрерывной подачей источника углерода, например подачей при постоянной скорости с последующим выделением менингококкового белка из бактериальной культуры. Способ культивирования можно осуществлять с использованием бактериальной клетки-хозяина, содержащей вектор экспрессии, кодирующий рекомбинантный белок под контролем индуцируемого промотора, или последовательность нуклеиновых кислот, при непрерывной подаче источника углерода, например глюкозы, и индуктора, например, арабинозы. Описаны композиции для выделения менингококкового белка из бактериальной культуры, полученные указанными способами, с высокой плотностью белка 2086, при этом белок может быть липидированный и нелипидированный. Изобретение обеспечивает улучшение выхода менингококкового белка 2086. 6 н. и 73 з.п. ф-лы, 20 ил., 7 табл., 3 пр.
1. Способ получения рекомбинантного белка, включающий:
культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка, включающее непрерывное добавление источника углерода в культуру, включающую рекомбинантную бактериальную клетку, и непрерывное добавление индуктора в указанную культуру после того, как культура достигла порогового параметра, и выделение указанного рекомбинантного белка из указанной культуры, при этом суммарное количество индуктора, добавленного в культуру в процессе подачи индуктора, равно от приблизительно 7 г/л до приблизительно 15 г/л.
2. Способ по п.1, отличающийся тем, что указанный пороговый параметр представляет собой оптическую плотность (OD), растворенный кислород (DO), концентрацию питательных веществ в культуральной среде, суммарную концентрацию источника углерода, добавленного в культуральную среду, или любую их комбинацию.
3. Способ по п.2, отличающийся тем, что указанный пороговый параметр представляет собой оптическую плотность (OD) указанной культуры.
4. Способ по п.3, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной от приблизительно 70 до приблизительно 110.
5. Способ по п.4, включающий непрерывное добавление индуктора в указанную культуру, когда плотность клеток в указанной культуре достигает OD600, равной от приблизительно 70 до приблизительно 105.
6. Способ по п.5, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной от приблизительно 75 до приблизительно 85.
7. Способ по п.6, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной приблизительно 80.
8. Способ по п.1, включающий добавление индуктора в культуру при постоянной скорости, добавление индуктора в культуру посредством DO-stat подпитки или добавление индуктора в культуру посредством pH-stat подпитки.
9. Способ по п.1, включающий добавление индуктора в культуру при постоянной скорости, равной от приблизительно 3,35 г/л/ч до приблизительно 16 г/л/ч, добавление индуктора в культуру посредством DO-stat подпитки или посредством pH-stat подпитки.
10. Способ по п.1, отличающийся тем, что суммарное количество индуктора, добавленного в культуру, равно от приблизительно 4 г/л до приблизительно 40 г/л.
11. Способ по п.10, отличающийся тем, что суммарное количество индуктора, добавленного в культуру в процессе подачи индуктора, равно приблизительно 10 г/л.
12. Способ по п.1, включающий непрерывное добавление индуктора в культуру в течение от приблизительно 2 до приблизительно 8 ч после начала указанного способа.
13. Способ по п.12, включающий непрерывное добавление индуктора в культуру в течение от приблизительно 3 до приблизительно 6 ч после начала.
14. Способ по п.1, включающий выделение указанного рекомбинантного белка через промежуток времени от приблизительно 2 до приблизительно 8 ч после начала добавления индуктора в культуру.
15. Способ по п.14, включающий выделение указанного рекомбинантного белка через промежуток времени от приблизительно 3 до приблизительно 6 ч после начала добавления индуктора в культуру.
16. Способ по п.1, отличающийся тем, что указанный индуктор представляет собой арабинозу.
17. Способ по п.1, включающий непрерывное добавление источника углерода в культуру перед индуцированием.
18. Способ по п.1, включающий непрерывное добавление источника углерода в культуру перед и в процессе индуцирования.
19. Способ по п.1, включающий непрерывное добавление источника углерода в культуру в то время как указанный индуктор непрерывно добавляют в указанную культуру.
20. Способ по п.1, включающий непрерывное добавление источника углерода в культуру до тех пор, пока плотность клеток в указанной культуре не достигнет OD600, равной от приблизительно 70 до приблизительно 110.
21. Способ по п.1, отличающийся тем, что указанный источник углерода представляет собой источник углерода на основе сахаров.
22. Способ по п.21, отличающийся тем, что указанный источник углерода на основе сахаров представляет собой глюкозу.
23. Способ по п.22, отличающийся тем, что указанный индуктор представляет собой арабинозу.
24. Способ по п.23, включающий непрерывное добавление глюкозы в культуральную среду в то время как арабинозу непрерывно добавляют в культуральную среду.
25. Способ по п.23, включающий непрерывное добавление глюкозы до тех пор, пока плотность клеток в указанной культуре не достигнет OD600, равной приблизительно 80.
26. Способ получения рекомбинантного белка, включающий:
a) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный белок под контролем индуцируемого промотора, чтобы получить рекомбинантную бактериальную клетку;
b) введение указанной рекомбинантной бактериальной клетки в культуральную среду, чтобы получить культуру клеток;
c) добавление источника углерода в указанную культуру клеток в виде непрерывной подачи;
d) слежение за достижением роста клеток в культуре пороговой оптической плотности (OD600);
e) добавление индуктора указанного индуцируемого промотора в указанную культуру клеток в виде непрерывной подачи, как только пороговая оптическая плотность (OD600) будет достигнута, при этом суммарное количество индуктора, добавленного в культуру в процессе подачи индуктора, равно от приблизительно 7 г/л до приблизительно 15 г/л; и
f) выделение указанного рекомбинантного белка из указанной культуры клеток.
27. Способ по п.26, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной от приблизительно 70 до приблизительно 110.
28. Способ по п.27, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной от приблизительно 70 до приблизительно 105.
29. Способ по п.28, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600;
равной от приблизительно 75 до приблизительно 85.
30. Способ по п.29, включающий непрерывное добавление индуктора в культуру, когда плотность клеток в указанной культуре достигает OD600, равной приблизительно 80.
31. Способ по п.26, отличающийся тем, что индуктор добавляют в культуру при постоянной скорости, указанный индуктор добавляют в культуру посредством DO-stat подпитки или указанный индуктор добавляют в культуру посредством pH-stat подпитки.
32. Способ по п.31, отличающийся тем, что индуктор добавляют в культуру при постоянной скорости, равной от приблизительно 3,35 г/л/ч до приблизительно 16 г/л/ч, указанный индуктор добавляют в культуру посредством DO-stat подпитки или указанный индуктор добавляют в культуру посредством pH-stat подпитки.
33. Способ по п.26, отличающийся тем, что суммарное количество индуктора, добавленного в культуру, равно от приблизительно 4 г/л до приблизительно 40 г/л.
34. Способ по п.26, отличающийся тем, что суммарное количество индуктора, добавленного в культуру, равно приблизительно 10 г/л.
35. Способ по п.26, включающий выделение указанного рекомбинантного белка из указанной культуры через промежуток времени от приблизительно 2 ч до приблизительно 8 ч после начала подачи индуктора.
36. Способ по п.35, включающий выделение указанного рекомбинантного белка из указанной культуры через промежуток времени от приблизительно 3 ч до приблизительно 6 ч после начала подачи индуктора.
37. Способ по п.26, отличающийся тем, что указанный источник углерода добавляют в указанную культуру клеток во время подачи с постоянной скоростью как источника углерода, так и индуктора, в процессе DO-stat подпитки как источником углерода, так и индуктором, или в процессе pH-stat подпитки как источником углерода, так и индуктором.
38. Способ по п.26, отличающийся тем, что указанный индуктор представляет собой арабинозу.
39. Способ по п.26, отличающийся тем, что указанный источник углерода представляет собой источник углерода на основе сахаров.
40. Способ по п.39, отличающийся тем, что указанный источник углерода на основе сахаров представляет собой глюкозу.
41. Способ по п.26, отличающийся тем, что указанный источник углерода представляет собой глюкозу и указанный индуктор представляет собой арабинозу.
42. Способ по п.41, включающий непрерывное добавление глюкозы в культуру клеток, в то время как арабинозу непрерывно добавляют в указанную культуру клеток.
43. Способ по п.41, включающий непрерывное добавление глюкозы в культуру клеток до тех пор, пока плотность клеток в указанной культуре не достигнет OD600, равной приблизительно 80.
44. Способ получения рекомбинантного белка, включающий:
культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка с помощью непрерывного добавления индуктора в культуру, включающую указанную бактериальную клетку, после того, как культура достигла порогового параметра, отличающийся тем, что указанная бактериальная клетка включает последовательность нуклеиновых кислот, соответствующую гену из N. meningitidis серологической группы В, при этом суммарное количество индуктора, добавленного в культуру в процессе подачи индуктора, равно от приблизительно 7 г/л до приблизительно 15 г/л.
45. Способ по п.44, отличающийся тем, что указанный пороговый параметр представляет собой оптическую плотность (OD), растворенный кислород (DO), pH, концентрацию питательных веществ в культуральной среде, суммарную концентрацию источника углерода, добавленного в культуральную среду, или любую их комбинацию.
46. Способ по п.45, отличающийся тем, что указанный пороговый параметр представляет собой оптическую плотность (OD) указанной культуры.
47. Способ по п.46, отличающийся тем, что непрерывная подача индуктора начинается, когда плотность клеток в культуре достигает OD600, равной от приблизительно 70 до приблизительно 110.
48. Способ по п.47, отличающийся тем, что непрерывная подача индуктора начинается, когда плотность клеток в культуре достигает OD600, равной от приблизительно 70 до приблизительно 105.
49. Способ по п.48, отличающийся тем, что непрерывная подача индуктора начинается, когда плотность клеток в культуре достигает OD600, равной от приблизительно 75 до приблизительно 85.
50. Способ по п.49, отличающийся тем, что непрерывная подача индуктора начинается, когда плотность клеток в культуре достигает OD600, равной приблизительно 80.
51. Способ по п.44, отличающийся тем, что индуктор добавляют в указанную культуру при постоянной скорости, равной от приблизительно 3,35 г/л/ч до приблизительно 16 г/л/ч, указанный индуктор добавляют посредством DO-stat подпитки или указанный индуктор добавляют посредством pH-stat подпитки.
52. Способ по п.44, отличающийся тем, что суммарное количество индуктора, добавленного в культуру в процессе индукции, равно приблизительно 10 г/л.
53. Способ по п.44, отличающийся тем, что подача индуктора продолжается в течение от приблизительно 2 ч до приблизительно 8 ч после начала указанного способа.
54. Способ по п.53, отличающийся тем, что подача индуктора продолжается в течение от приблизительно 3 ч до приблизительно 6 ч после начала указанного способа.
55. Способ по п.44, отличающийся тем, что указанный рекомбинантный белок собирают через период времени от приблизительно 2 ч до приблизительно 8 ч после начала подачи индуктора.
56. Способ по п.55, отличающийся тем, что указанный рекомбинантный белковый продукт выделяют через период времени от приблизительно 3 ч до приблизительно 6 ч после начала подачи индуктора.
57. Способ по п.44, отличающийся тем, что подача источника углерода в культуральную среду продолжается в процессе подачи индуктора в культуру.
58. Способ по п.44, отличающийся тем, что указанный индуктор представляет собой арабинозу.
59. Способ по п.44, отличающийся тем, что указанный источник углерода представляет собой источник углерода на основе сахаров.
60. Способ по п.59, отличающийся тем, что указанный источник углерода на основе сахаров представляет собой глюкозу.
61. Способ по п.60, отличающийся тем, что указанный индуктор представляет собой арабинозу.
62. Способ по п.61, отличающийся тем, что глюкозу подают в культуру при постоянной скорости подачи во время подачи с постоянной скоростью арабинозы в культуру посредством DO-stat подпитки как глюкозой, так и индуктором, или посредством pH-stat подпитки как глюкозой, так и индуктором.
63. Способ по п.61, отличающийся тем, что глюкозу подают в культуру при постоянной скорости подачи во время подачи с постоянной скоростью арабинозы в культуру посредством DO-stat подпитки как глюкозой, так и индуктором до тех пор, пока плотность клеток в культуре не достигла OD600, равной приблизительно 80, или посредством pH-stat подпитки как глюкозой, так и индуктором до тех пор, пока плотность клеток в культуре не достигла OD600, равной приблизительно 80.
64. Способ по п.61, отличающийся тем, что указанный рекомбинантный менингококковый белок 2086 включает липопротеин (rLP2086).
65. Способ по п.61, отличающийся тем, что указанный белок включает нелипидированный белок.
66. Способ по п.61, отличающийся тем, что указанный белок включает менингококковый белок 2086 подсемейства А.
67. Способ по п.61, отличающийся тем, что указанный белок включает менингококковый белок 2086 подсемейства В.
68. Способ получения рекомбинантного менингококкового белка 2086 (Р2086), включающий:
(a) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный белок 2086 под контролем индуцируемого промотора, для получения рекомбинантной бактериальной клетки;
(b) введение указанной рекомбинантной бактериальной клетки в культуральную среду для получения культуры;
(c) непрерывное добавление источника углерода в указанную культуру;
(d) слежение за достижением роста клеток в указанной культуре пороговой оптической плотности (OD);
(e) непрерывное добавление индуктора указанного индуцируемого промотора в культуру, как только плотность клеток в указанной культуре достигла оптической плотности, равной приблизительно от 70 до 110, при этом суммарное количество индуктора, добавленного в культуру в процессе подачи индуктора, равно от приблизительно 7 г/л до приблизительно 15 г/л; и
(f) выделение указанного рекомбинантного менингококкового белка 2086 из указанной культуры через промежуток времени от приблизительно 3 ч до приблизительно 6 ч после начала непрерывного добавления индуктора.
69. Композиция для выделения рекомбинантного менингококкового белка 2086, включающая: бактериальную культуру, включающую рекомбинантный менингококковый белок 2086 при плотности, равной по меньшей мере приблизительно 1,5 г/л в общем объеме указанной бактериальной культуры.
70. Композиция по п.69, отличающаяся тем, что указанный рекомбинантный менингококковый белок 2086 представляет собой липидированный белок.
71. Композиция по п.69, отличающаяся тем, что указанный рекомбинантный менингококковый белок 2086 представляет собой нелипидированный белок.
72. Композиция по п.69, отличающаяся тем, что указанный рекомбинантный менингококковый белок 2086 представляет собой белок 2086 подсемейства А.
73. Композиция по п.69, отличающаяся тем, что указанный рекомбинантный белок представляет собой белок 2086 подсемейства В.
74. Композиция по п.73, отличающаяся тем, что указанная культура включает второй рекомбинантный менингококковый белок 2086.
75. Композиция по п.74, отличающаяся тем, что указанный второй рекомбинантный менингококковый белок 2086 представляет собой белок 2086 подсемейства А.
76. Композиция по п.69, отличающаяся тем, что плотность указанного рекомбинантного менингококкового белка 2086 равна по меньшей мере приблизительно 1,7 г/л в общем объеме указанной бактериальной культуры.
77. Композиция по п.69, отличающаяся тем, что плотность указанного рекомбинантного менингококкового белка 2086 равна по меньшей мере приблизительно 2,0 г/л в общем объеме указанной бактериальной культуры.
78. Композиция по п.69, отличающаяся тем, что плотность указанного рекомбинантного менингококкового белка 2086 равна по меньшей мере приблизительно 3,0 г/л в общем объеме указанной бактериальной культуры.
79. Композиция для выделения рекомбинантного менингококкового белка 2086, включающая:
бактериальную культуру, включающую рекомбинантный менингококковый белок 2086, полученный согласно способам по любому из пп.1-75.
| US 6998258 B1, 14.02.2006 | |||
| RU 2004103494 A, 27.07.2005 | |||
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ АЭРОБНОРАСТУЩИХ МИКРООРГАНИЗМОВ | 1992 |
|
RU2111246C1 |
| СПОСОБ ПЕРИОДИЧЕСКОГО КУЛЬТИВИРОВАНИЯ КЛЕТОК-ПРОДУЦЕНТОВ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ И БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 1987 |
|
RU2015164C1 |
| RU 2005117338 A, 20.03.2006. | |||
Авторы
Даты
2012-05-20—Публикация
2007-07-21—Подача