Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса спиро{индено[1,2-b]хинолин-6,3'-пирролов} и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем.
Известны структурные аналоги заявленных соединений - этил 1'-бензил-3,3-диметил-1,2'-диоксо-5'-фенил-1',2,2',3,4,10-гексагидро-1H-спиро[акридин-9,3'-пиррол]-4'-карбоксилаты, являющиеся продуктами взаимодействия 5-фенил-4-этоксикарбонил-1H-пиррол-2,3-дионов с 3-(ариламино)-5,5-диметилциклогекс-2-енонами, образующиеся по следующей схеме (А.Н.Масливец, П.С.Силайчев, М.В.Дмитриев, P.P.Махмудов // патент РФ на изобретение №2387651, МПК C07D 417/10, опубл. 27.04.2010, бюл. №12):
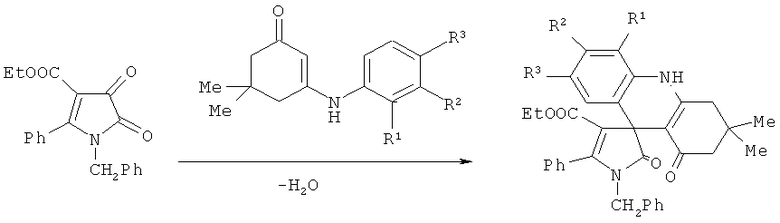
R1=H, Me; R2=H, OMe; R3=H, Me, OMe, Br
К недостаткам данного способа относится невозможность получения этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилатов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилатов и расширения арсенала средств воздействия на живой организм.
Поставленная задача осуществляется путем взаимодействия 5-фенил-4-этоксикарбонил-1H-пиррол-2,3-дионов с 3-ариламино-1H-инден-1-онами в соотношении 1:1 в среде растворителя с последующим выделением целевых продуктов, по следующей схеме:
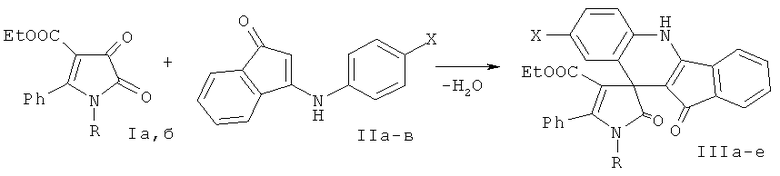
I: R=CH2Ph (a), Ph (б);
II: X=H (a), Me (б), ОМе (в);
III: R-CH2Ph, X=H (a), Me (б), ОМе (в); R=Ph, X=H (г), Me (д), ОМе (е).
Процесс ведут при температуре 110-140°C, а в качестве растворителя используют абсолютный толуол либо другие высококипящие инертные апротонные растворители.
Из патентной и технической литературы не были выявлены способы получения этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилатов, имеющие сходные признаки с заявляемым способом, а именно не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. Этил 1'-бензил-4-метил-3'7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилат (IIIб).
К раствору 1.0 ммоль 1-безил-5-фенил-4-этоксикарбонил-1H-пиррол-2,3-диона (Iа) в 20 мл абсолютного толуола добавляли 1.0 ммоль 3-толиламино-1H-инден-1-она (IIб), кипятили в течение 5 ч, охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из этилацетата. Выход 62%, т.пл. 290-292°C. Соединение (IIIб) C36H28N2O4.
Найдено, %: C 78.17; H 5.15; N 4.93
Вычислено, %: C 78.24; H 5.11; N 5.07.
Соединение (IIIб) - оранжевое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIIб), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH в виде широкого пика при 3200 см-1, лактамной карбонильной группы C2'=O и сложноэфирной карбонильной группы при 1678 см-1, кетонной карбонильной группы C7=О при 1626 см-1.
В спектре ПМР соединения (IIIб), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец, присутствуют синглет протонов метильной группы при 2.24 м.д., два дублета протонов метиленовой группы бензильного заместителя при 4.57 и 4.61 м.д. с характерной константой спин-спинового взаимодействия (J 16.7 Гц), синглет протона группы NH при 10.96 м.д., а также триплет и мультиплет протонов метильной и метиленовой групп этоксикарбонильного заместителя при 0.61 и 3.58 м.д. соответственно.
Пример 2. Этил 4-метил-3',7-диоксо-1',5'-дифенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилат (IIIг).
К раствору 1.0 ммоль 1,5-дифенил-4-этоксикарбонил-1H-пиррол-2,3-диона (Iб) в 20 мл абсолютного толуола добавляли 1.0 ммоль 3-толиламино-1H-инден-1-она (IIб) кипятили в течение 8 ч, охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из этилацетата. Выход 60%, т.пл. 307-308°С. Соединение (IIIг) C35H26N2O4.
Найдено, %: C 78.09; H 4.95; N 5.33.
Вычислено, %: C 78.05; H 4.87; N 5.20.
Соединение (IIIг) - оранжевое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIIг), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний группы NH в виде широкого пика при 3200 см-1, лактамной карбонильной группы C2'=O и сложноэфирной карбонильной группы при 1694 см-1, кетонной карбонильной группы C7=O при 1630 см-1.
В спектре ПМР соединения (IIIг), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец, присутствуют синглет протонов метильной группы при 2.32 м.д., синглет протона группы NH при 11.02 м.д., а также триплет и мультиплет протонов метильной и метиленовой групп этоксикарбонильного заместителя при 0.66 и 3.63 м.д. соответственно.
Пример 3. Фармакологическое исследование этил 1'-бензил-3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилата (IIIа) и этил 1'-бензил-4-метокси-3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилата (IIIв) на наличие анальгетической активности.
Оценку анальгетических свойств соединений (IIIа, в) изучали на беспородных мышах массой 18-22 грамм методом термического раздражения «горячая пластинка» по Эдди и Леймбах (Eddy N.B., Leimbarh D.J. - Pharmacol and Exper. Gher., 1953, 385-393). В качестве препарата сравнения использовали анальгин (М.Д.Машковский, «Лекарственные средства», т.1, стр.184, М., Медицина, 1978).
Проведенные исследования показали (см. таблицу), что соединения (IIIа, в) обладают анальгетической активностью. Данные о фармакологической активности аналогов заявляемых соединений в доступной литературе отсутствуют.
Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить неописанные в литературе этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'H-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилаты (IIIа-е) с хорошими выходами, которые найдут применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Настоящее изобретение относится к области органической химии, а именно к новым производным спиро{индено[1,2-b]хинолин-6,3'-пирролов} формулы 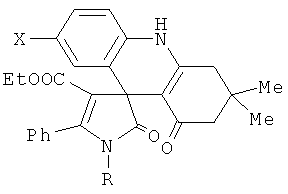
где R=CH2Ph, Ph; X=H, Me, OMe. Также изобретение относится к способу их получения. Технический результат: получены новые соединения, обладающие анальгетической активностью, которые также могут быть использованы для синтеза новых гетероциклических соединений. 2 н. и 2 з.п. ф-лы, 1 табл.
1. Этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'Н-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилаты общей формулы
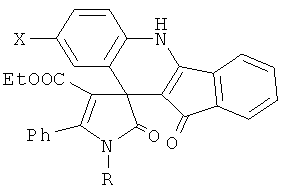
где R=CH2Ph, Ph; X=H, Me, OMe.
2. Способ получения этил 3',7-диоксо-5'-фенил-1,6-дигидро-1'Н-спиро{индено[1,2-b]хинолин-6,3'-пиррол}-4'-карбоксилатов общей формулы
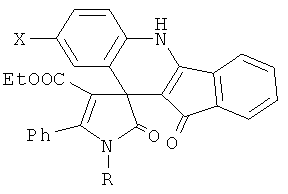
где R=CH2Ph, Ph; X=H, Me, OMe,
отличающийся тем, что 5-фенил-4-этоксикарбонил-1Н-пиррол-2,3-дионы подвергают взаимодействию с 3-ариламино-1Н-инден-1-онами в соотношении 1:1 в среде высококипящего инертного апротонного растворителя с последующим выделением целевых продуктов.
3. Способ по п.2, отличающийся тем, что процесс ведут при температуре 110-140°С.
4. Способ по п.2 или 3, отличающийся тем, что в качестве растворителя используют абсолютный толуол.
| Silaichev, P.S | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 97112188 A, 27.05.1999 | |||
| Abd El-Nabi, H.A | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Reactions of | |||
Авторы
Даты
2012-06-20—Публикация
2010-12-07—Подача