Область техники, которой относится изобретение
Изобретение относится к экологически ориентированным способам борьбы с вредителями. Оно относится к способу получения улучшенных эндофитом растений с увеличенной устойчивостью к вредителям, таким как растительноядные насекомые, посредством инокуляции токсикогенными эндофитными грибками.
Предпосылки изобретения
Известно, что листья различных растений, включая макроводоросли, траву и осоки, обладают бессимптомными инфекциями. Вовлеченные в это грибки обычно обозначают как эндофиты (Carroll, 1988; Clay, 1988). Эндофит представляет собой «организм, обитающий в органах растений, который в какое-то время в его жизни может колонизировать внутреннюю ткань растения, не вызывая очевидного вреда для хозяина» (Petrini 1991). Считают, что грибковые эндофиты являются специфическими для хозяина, так что они инфицируют один или небольшую подгруппу видов растений.
Хорошо понятно, что токсические метаболиты, продуцируемые эндофитами травы, сильно снижают популяции растительноядных насекомых, атакующих растение. Это оказывает большое влияние на приспособленность растений (Clay, 1988; Clay & Holah, 1999). Семена травы из культиваров, содержащих грибковые эндофиты листьев, в течение 10 лет составляли доминирующий способ, применяемый для газонов и полей для игры в гольф в местностях США и Канады. Эти грибки продуцируют внутри листьев травы очень сильные токсины, которые убивают насекомых. Это намного уменьшает количество жестких химических пестицидов, используемых для полученных газонов. Такие газоны обладают увеличенной засухоустойчивостью и обладают увеличенной устойчивостью к грибковым заболеваниям.
Иглы хвойных также являются инфицированными системными грибковыми эндофитами, которые могут исполнять несколько экологических ролей (Carroll 1988; Ganley et al. 2004).
Carroll & Carroll (1978) впервые предположили, что грибковые эндофиты, выделенные из игл хвойных, могут представлять собой мутуалистические симбионты. Это позволяет предполагать уменьшение вкусовой привлекательности для пасущихся насекомых и антагонизм против патогенов игл как возможные преимущества для деревьев-хозяев. В последующей работе эта группа изучала связь между Дугласовой пихтой (Pseudotsuga menziesii) и эндофитом игл Rhabdocline parkeri (Sherwood-Pike et al., 1986; Todd, 1988). Экстракт R. parkeri являлся цитотоксическим для клеток HeLa и приводил к уменьшению скорости роста и к смертности при введении в синтетические рационы Choristoneura fumiferana (гусеницы листовертки-почкоеда елового) при 10 мкг г-1 (Miller, 1986).
Хвойные, подобно другим видам растений, чувствительны к повреждению вредителями. Например, гусеница листовертки-почкоеда восточной ели представляет собой наносящего экономический убыток насекомого-вредителя. Последний раз, когда случилась эпидемия в Восточной Канаде, предпринимали крупномасштабное опрыскивание жесткими химическими пестицидами. Когда это осуществили, леса были уничтожены. Только в 1977 г. стоимость программы опрыскивания в Нью-Брансуик составила приблизительно 47 миллионов $ для неизменяющегося курса доллара. В течение двух промежуточных десятилетий, в течение спада в цикле гусеницы листовертки-почкоеда, для жестких химических пестицидов, применяемых в 1970-е годы, отменили регистрацию в пользу биопестицидов. Вне зависимости от этого в настоящее время менее вероятно, что будет существовать общественное согласие для широко распространенного использования химических инсектицидов, когда популяция гусеницы листовертки-почкоеда елового вернется к эпидемическим соотношениям. Необходимы новые способы борьбы с гусеницей листовертки-почкоеда елового и другими насекомыми-вредителями.
Royama (1984) опубликовал всесторонний анализ динамики популяций гусеницы листовертки-почкоеда елового, сфокусированный на периоде от 1945 до 1983 гг. в Нью-Брансуик (NB), Канада. Один признак этого анализа заключался в том, что он предположил «пятый агент», относящийся к неизвестному фактору, который необходим для построения моделей, лучше всего подходящих к наблюдаемым изменениям популяций. Важнейшей характеристикой этого пятого агента являлось то, что он некоторым образом изменял ответ на популяции насекомых на известные факторы, такие как погода, хищники и заболевания.
С 1984-1994 гг. проведены выделения эндофитов, присутствующих на иглах различных видов хвойных в окрестностях NB. Как обнаружили рабочие по всему миру, иглы всех проверенных зрелых хвойных были колонизированы несколькими видами эндофитов (Johnson & Whitney, 1989; Wilson, 1994). Обнаружили, что из коллекций из окрестностей NB, содержащих 3500 штаммов, низкий процент из Abies balsamea (бальзамическая пихта), Picea rubens (красная ель), Picea glauca (белая ель) и Picea mariana (черная ель) продуцировал токсины против насекомых (Calhoun et al., 1992; Clark et al., 1989 Findlay, 1996; Findlay et al., 1994; Findlay et al., 1995). Один из токсинов, ругулозин, получен из культур, полученных из игл красной ели (Calhoun et al., 1992).
В природе саженцы деревьев могут нуждаться в эндофитах игл с деревьев, окружающих растущее дерево. Однако большинство из этих штаммов, по-видимому, неспособны продуцировать соединения против насекомых. Коммерчески полученные саженцы, покидающие производственные объекты, не являются колонизированными эндофитами игл (Miller et al., 2002). Хвойные, инокулированные эндофитами для увеличения устойчивости к вредителям, были бы очень желательными, учитывая сотни миллионов саженцев, производимых ежегодно в Северной Америке.
Существуют трудности в колонизации хвойных эндофитами. Экономически жизнеспособная крупномасштабная инокуляция хвойных желательными штаммами эндофитов требует способа с увеличенной эффективностью колонизации и простотой инокуляции.
Краткое изложение сущности изобретения
Изобретение относится к новым выделенным штаммам токсикогенных эндофитов и относится к способам для получения сеянцев хвойных с увеличенной устойчивостью к вредителям и для инокуляции сеянцев хвойных композицией инокулята. Авторы изобретения обнаружили, что сеянцы хвойных можно колонизировать токсикогенным эндофитом с использованием способа, который не требует нанесения ран. Инокулят можно вводить, в одном варианте осуществления, распылением. Кроме того, авторы изобретения обнаружили, что эффективность инокуляции является наиболее высокой в период времени, обозначенный здесь как «окно времени чувствительности» или период времени «восприимчивости». Таким образом, изобретение относится к способам, позволяющим увеличенную эффективность колонизации и пригодным к крупномасштабным инокуляциям. Изобретение также относится к сеянцам, деревьям и частям деревьев (таким, как иглы и семена), полученным согласно способам по изобретению.
Соответственно изобретение относится к способу получения сеянцев хвойных (т.е. колонизированных сеянцев хвойных) с увеличенной устойчивостью к вредителям, включающему в себя инокуляцию сеянцев хвойных (т.е. нативных сеянцев хвойных) для получения увеличенной устойчивости к вредителям, включающему в себя инокуляцию сеянцев хвойных выделенным токсикогенным эндофитом, когда сеянцы хвойных являются чувствительными к колонизации эндофитом. Авторы изобретения идентифицировали ряд токсикогенных эндофитов.
Соответственно в другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту.
Выделенные токсикогенные эндофиты являются применимыми для получения сеянцев хвойных с увеличенной устойчивостью к вредителям. Соответственно в другом варианте осуществления изобретение относится к хвойным, колонизированным выделенным токсикогенным эндофитом, продуцирующим токсин, замедляющий рост вредителей.
В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, выбранному из группы, состоящей из 05-37A, 06-486D, 06-485A, 04-052B, 06-011B, 06-011D, 06-012C, 06-013A, 06-014C, 08-040B, 06-264A, 06-332A, 06-268A, 07-013D, 08-011D, 01-002A, 04-002G, 03-020B, 04-012A, 06-063D, 02-002C, 06-073C, 06-094E, 06-255A, 06-097D и 08-018A.
В другом варианте осуществления изобретение относится к композиции инокулята для инокуляции хвойных для получения увеличенной устойчивости к вредителям, содержащей разбавитель и выделенный токсикогенный эндофит, продуцирующий токсин, токсичный для вредителя.
В другом варианте осуществления изобретение относится к антителу, направленному против токсикогенного эндофита, выбранного из группы, состоящей из 5WS22E1, 5WS11/1, 05-37A, 06-486D, 06-485A, 04-052B, 06-011B, 06-011D, 06-012C, 06-013A, 06-014C, 08-040B, 06-264A, 06-332A, 06-268A, 07-013D, 08-011D, 01-002A, 04-002G, 03-020B, 04-012A, 06-063D, 02-002C, 06-073C, 06-094E, 06-255A, 06-097D и 08-018A.
В другом варианте осуществления изобретение относится к способу детекции присутствия намеченного выделенного токсикогенного эндофита в образце хвойных, включающему в себя:
a) приведение в контакт образца хвойных с антителом, направленным против эндофита;
b) детекцию присутствия связавшегося антитела в образе, где присутствие связавшегося антитела является показательным для присутствия токсикогенного эндофита.
Представлены также способы выделения токсикогенных эндофитов, выделенные нуклеиновые кислоты и наборы для практического осуществления описанных здесь способов.
Другие признаки и преимущества по настоящему изобретению станут очевидными из следующего подробного описания. Следует понимать, однако, что подробное описание и конкретные примеры, в то время как показывают предпочтительные варианты осуществления изобретения, приведены только с целью иллюстрации, поскольку различные изменения и модификации в пределах содержания и объема изобретения будут очевидными для специалистов в данной области из этого подробного описания.
Краткое описание рисунков
Варианты осуществления изобретения будут описаны в отношении рисунков, где:
На фигуре 1 показан ответ серийных разведений поликлонального антитела на намеченный эндофит 5WS22E1 [кривая наилучшего соответствия с использованием способа LOWESS] вместе со сравнениями при 60 нг/лунку с клетками некоторых эндофитов белой ели (WS331L1, WS11/1), некоторых грибов, общераспространенных в окружении сеянцев (A. alternata; A. fumigatus, C. cladosporioides, виды Phoma), так же как с контрольными порошкообразными лиофилизированными иглами белой ели.
На фигуре 2 показан ответ поликлонального антитела на 30, 60, 120 и 240 нг клеток 5WS22E1 и на такие же количества, добавленные к 500 нг порошкообразных клеток белой ели [среднее плюс стандартная ошибка].
На фигуре 3 показано распределение концентраций ругулозина в иглах от 113 сеянцев, принимая половину предела детекции за отсутствие детекции [с нормальным сглаживанием].
Фигура 4 представляет собой график линейности и авидности поликлонального антитела для эндофита 5WS11/1.
На фигуре 5 показано применение поликлонального антитела, применяемого для детекции эндофита 5WS11/1 in planta.
На фигуре 6 показан график примера окна времени чувствительности сеянцев для колонизации токсикогенными эндофитами.
На фигуре 7 показана запись самописца для HPLC для ругулозина.
На фигуре 8 показана средняя масса гусеницы листовертки-почкоеда елового, выращенной на рационе с увеличивающейся концентрацией ругулозина.
Фигура 9 представляет собой 3D-гистограмму, показывающую концентрацию ругулозина в иглах в ~300 ветвях с 20 деревьев через 15 месяцев после инокуляции эндофитом 5WS22E1 по отношению к доле образцов; среднее геометрическое концентрации составляло 0,8 мкг г-1.
Фигура 10 представляет собой фотографию деревьев в возрасте четырех лет, показывающую сетчатое покрытие на отдельных ветвях.
Фигура 11 представляет собой график, показывающий распределение массы насекомых между инфицированными эндофитами и неинфицированными деревьями в возрасте трех лет; массы между двумя группами значимо различались по ANOVA, P = 0,018.
Подробное описание изобретения
Авторы изобретения идентифицировали способы инокуляции сеянцев хвойных токсикогенными штаммами грибковых эндофитов и получения инфицированных токсикогенным эндофитом сеянцев хвойных, которые являются более устойчивыми к повреждению вредителями.
Некоторые штаммы эндофитов, естественным образом колонизирующие иглы хвойных, продуцируют соединения или токсины, влияющие на выживаемость вредителей. Иглы колонизированных таким образом сеянцев содержат токсины, и скорость роста вредителей снижена, а чувствительность к паразитам и природным бактериальным патогенам увеличена. Авторы изобретения выделили множество штаммов токсикогенных эндофитов и разработали способы размножения этих штаммов. Кроме того, авторы изобретения показали, что сеянцы хвойных можно инокулировать продуцирующими токсин штаммами эндофитов во время окна времени чувствительности. Инокуляция во время периода времени чувствительности улучшает колонизацию токсикогенным эндофитом. Авторы изобретения показали, что колонизация токсикогенным эндофитом персистирует и распространяется на неинокулированные новые выросшие ветви так, же как на соседние сеянцы. Кроме того, эти способы, как показали авторы изобретения, поддаются крупномасштабной продукции в промышленных посадках. Авторы изобретения также выделили несколько новых штаммов эндофитов и идентифицировали главный токсин, продуцируемый некоторыми из этих штаммов эндофитов.
Представлены способы для инокуляции сеянцев хвойных, для детекции успешно инокулированных растений, для получения эффективной композиции инокулята, так же как способы получения колонизированных токсикогенным эндофитом хвойных растений, которые являются устойчивыми к вредителям, таким как гусеница листовертки-почкоеда елового. Изобретение относится также к новым штаммам токсикогенного эндофита, композициям инокулята и токсикогенным, колонизированным эндофитом хвойным растениям.
Соответственно в одном варианте осуществления изобретение относится к способу инокуляции сеянца хвойного, где способ включает в себя инокуляцию сеянца хвойного эффективным количеством композиции инокулята, содержащей выделенный токсикогенный эндофит, во время окна времени чувствительности, где окно времени чувствительности представляет собой период времени, во время которого сеянец хвойного является чувствительным к колонизации токсикогенным эндофитом.
Термин «сеянец», как применяют здесь, обозначает молодое растение и включает в себя молодое растение, выращенное в промышленном питомнике перед окончательной посадкой, и включает в себя период развития сеянца от семени до 16 недель после прорастания.
Термин «колонизация», как применяют здесь, обозначает персистенцию инокулированного эндофита в хвойном растении, где хвойное является хозяином для эндофита, и эндофит персистирует в достаточном количестве для детекции каким-либо анализом, например анализом детекции антителом с использованием антитела, направленного против эндофита и/или анализом для детекции производного токсина эндофита или модифицированной растением формы, или, альтернативно, персистирует в достаточном количестве для придания хозяину устойчивости к вредителям. Необязательно вегетативно размножаемые обрезки колонизированного растения также являются колонизированными, и сеянцы, приобретшие токсикогенный эндофит посредством вертикальной передачи, также являются колонизированными.
Токсикогенные эндофиты
Термин «токсикогенный», как применяют здесь, обозначает токсичный для вредителей, таких как вредители хвойных. «Токсикогенный» включает в себя токсичность против насекомых и против грибов. Термин «выделенный токсикогенный эндофит», как применяют здесь, обозначает выделенный штамм эндофита, продуцирующий токсин, который является токсичным для вредителя. Выделенный токсикогенный эндофит является способным колонизировать сеянцы хвойных и продуцировать токсин в колонизированном растении. Токсин, продуцированный токсикогенным эндофитом, придает увеличенную устойчивость к вредителям посредством контроля, снижения, уменьшения, предупреждения или отпугивания вредителей, и/или роста вредителей, и/или повреждения вредителей в колонизированном растении по сравнению с неколонизированным растением.
В одном варианте осуществления токсикогенный эндофит по изобретению включает в себя штаммы, описанные в таблицах 1-3, и штаммы, перечисленные в другом месте в этом документе. Другие токсикогенные эндофиты легко использовать в способах по изобретению. Кроме того, необязательно, инокулируют более одного токсикогенного эндофита. Более одного токсикогенного эндофита, необязательно, инокулируют в одно и то же время или последовательно.
Авторы изобретения показали, что различные эндофиты, выделенные из белой ели, являются токсикогенными для вредителей хвойных деревьев. Они включают в себя: продуцирующие ругулозин эндофиты; продуцирующие вермикулин эндофиты; продуцирующие меллеин, включая 5-метоксикарбонилмеллеин, 5-формилмеллеин, 5-метилмеллеин, эндофиты; продуцирующие тирозол, включая 3-бутил-4-метилфуран-2(5H)-он-бутиролактонтирозол, эндофиты; продуцирующие изокумарин, такой как 8-гидрокси-6-метокси-3-пропил-3,4-дигидроизокумарин, эндофиты; и продуцирующие 3-метил-5,7-диметоксифталид эндофиты. Эти метаболиты являются главными компонентами смесей различных метаболитов против насекомых и/или грибов, продуцируемых каждым штаммом, и включают в себя производные, модифицированные растением формы и их метаболиты, которые являются токсичными. Главные метаболиты, их производные, продукты деградации или модифицированные растением формы можно использовать в качестве посредников для токсичности. Грибы продуцируют смеси метаболитов, и токсичность смеси может быть больше, чем у доминирующего соединения, применяемого в качестве посредника. Это может вносить вклад в способность токсикогенного эндофита придавать длительную устойчивость. Термин 5-метоксикарбонилмеллеин, как применяют здесь, необязательно, включает в себя производные, модифицированные растением формы и их метаболиты, токсичные для вредителя.
В одном варианте осуществления выделенный токсикогенный эндофит, присутствующий в композиции инокулята, представляет собой продуцирующий ругулозин эндофит. В более конкретном варианте осуществления продуцирующий ругулозин эндофит представляет собой выделенный эндофит 5WS22E1, содержащий SEQ ID NO: 1. В другом варианте осуществления выделенный токсикогенный эндофит представляет собой продуцирующий вермикулин эндофит. В более конкретном варианте осуществления продуцирующий вермикулин эндофит представляет собой выделенный эндофит 5WS11/1, содержащий SEQ ID NO: 2. В другом варианте осуществления выделенный токсикогенный эндофит представляет собой продуцирующий меллеин, такой как 5-метоксикарбонилмеллеин, эндофит. В более конкретном варианте осуществления продуцирующий 5-метоксикарбонилмеллеин эндофит представляет собой выделенный штамм 05-37A, содержащий SEQ ID NO: 3. В другом варианте осуществления выделенный токсикогенный эндофит представляет собой продуцирующий изокумарин, такой как 8-гидрокси-6-метокси-3-пропил-3,4-дигидроизокумарин, эндофит. В более конкретном варианте осуществления продуцирующий соединение изокумарина эндофит представляет собой 06-485A, содержащий SEQ ID NO:5. В другом варианте осуществления выделенный токсикогенный эндофит представляет собой продуцирующий тирозол эндофит. В более конкретном варианте осуществления продуцирующий тирозол эндофит выбран из группы, состоящей из 05-037A (SEQ ID NO:3), 06-486D (SEQ ID NO:4) и 06-485A (SEQ ID NO:5).
Выделенные токсикогенные эндофиты легко идентифицировать, например, авторы изобретения секвенировали области внутреннего транскрибируемого спейсера (ITS) рибосомальной ДНК (рДНК). Анализ последовательности выявил, что штаммы 5WS22E1 и 5WS11/1 представляют собой виды Phialocephala. Соответственно в другом варианте осуществления штамм токсикогенного эндофита, применяемый в способах по изобретению, представляет собой токсикогенный штамм вида Phialocephala.
Кроме того, авторы изобретения выделили несколько новых токсикогенных эндофитов из игл белой ели, включая штаммы, обозначенные 05-037A, 06-486D, 06-485A, 04-052B, 06-011B, 06-011 D, 06-012C, 06-013A, 06-014C, и 08-040B.
Данные последовательности показывают, что штамм эндофита 05-037A [SEQ ID NO: 3] является родственным Nemania serpens, что штамм 06-486D является родственным инвентарному номеру в Genbank AY971727, и 06-485A является родственным инвентарному номеру в Genbank AY971740, оба выделены из ели в Квебеке (родственные видам Lophodermium). Оба представляют собой виды Lophodermium (94% и 98% сходства ITS, соответственно), где 06-486D является более сходным с Rhytistimataceae.
Соответственно изобретение, кроме того, относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO:3 (05-037A).
В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 4 (06-486D). В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 5 (06-485A). В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 6 (04-052B).
В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 7 (06-011B).
В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 8 (06-011D), и в другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 9 (06-012C).
В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 10 (06-013A). В другом варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 11 (06-014C). В дополнительном варианте осуществления изобретение относится к выделенному токсикогенному эндофиту, содержащему последовательность в SEQ ID NO: 12 (08-040B).
Кроме того, авторы изобретения выделили множество штаммов токсикогенных эндофитов из игл красной ели. Авторы изобретения подобным образом секвенировали области ITS из каждого штамма (см. таблицу 3).
Выделены также токсикогенные эндофиты из бальзамической пихты, такие как 7BF 36H1 (Findlay et al, 1995).
В одном варианте осуществления токсикогенный эндофит содержит все или часть из одного из SEQ ID NO: 1-12, и предпочтительно по меньшей мере: 25-50 или 50-100 последовательных нуклеотидов из одного из SEQ ID NO: 1-12. В другом варианте осуществления токсикогенный эндофит содержит все или часть из одного из SEQ ID NO: 13-28, и предпочтительно по меньшей мере: одно из 25-50 или 50-100 последовательных нуклеотидов из SEQ ID NO: 13-28.
Несколько штаммов токсикогенных эндофитов для использования в способах по изобретению депонированы в международном депонирующем агентстве Centraalbureau voor Schimmelcultures (CBS) в Нидерландах (инвентарные no. в таблице 1). Кроме того, два из штаммов депонированы в National Mycological Herbarium/Herbier National de Mycologie и идентифицированы под аббревиатурой DAOM, как показано в таблице 1. DAOM обозначает Department of Agriculture, Ottawa, Mycology.

b Findlay, Li, Miller, Womiloju. Can J Chem, 2003, 81:284-292.
c среди прочих; новое соединение тригидрокси-4-1'-гидроксиэтил) изокумарин, токсичный также для клеток гусеницы листовертки-почкоеда елового (Can J Chem 81 :284).
d Anderson, Edwards, Whalley. J Chem Soc Perkin Trans I 1983, (2)185-255; Wang, Zhang, Huang, Su, Yang, Zhaob, Ng. Acta Cryst 2003, E59:o1233-1234.

Специалисту в данной области понятно, что другие выделенные штаммы токсикогенных эндофитов можно использовать в способах и композициях по изобретению. Другие штаммы токсикогенных эндофитов можно выделять с использованием способов скрининга токсикогенных эндофитов, представленных здесь.
Токсины эндофитов
Токсикогенные эндофиты продуцируют токсины, которые обеспечивают увеличенную устойчивость к вредителям. Термин «токсин», как применяют здесь, относится к веществу или веществам, которые придают увеличенную устойчивость к вредителям посредством контроля, снижения, уменьшения, предупреждения или отпугивания вредителей, и/или роста вредителей, и/или повреждения вредителей. Токсины нескольких штаммов токсикогенных эндофитов идентифицированы и описаны в таблице 1. Конкретный токсикогенный эндофит может продуцировать более одного токсина. Токсины, идентифицированные в таблице 1, представляют собой доминирующие токсины, продуцируемые перечисленными штаммами. Исследования, цитируемые в таблице 1, иллюстрируют, что каждый штамм может продуцировать множество токсинов. Проиллюстрирован штамм 5WS11/1, продуцирующий, среди прочих, вермикулин, тригидрокси-4-1'-гидроксиэтил и изокумарин.
Способность токсина контролировать, снижать, уменьшать, предупреждать или отпугивать вредителей, и/или уменьшать рост вредителей, и/или повреждать вредителей, можно оценивать in vitro в анализе токсичности для вредителей. Например, авторы изобретения предоставляют способ оценки токсичности токсина-кандидата с использованием способа, оценивающего рост личинок, такой как анализ личинок гусеницы листовертки-почкоеда елового, который измеряет эффекты на рост.
Термин «токсичность», как применяют здесь по отношению к анализу вредителей, такому как анализ личинок гусеницы листовертки-почкоеда елового, обозначает токсины или штаммы эндофитов, обладающие статистически отличающимися от контролей параметрами, для снижения либо массы, либо ширины головной капсулы, либо и того, и другого. Токсичные эндофиты приводят у вредителей, таких как личинки гусеницы листовертки-почкоеда елового, к более низкой массе и/или меньшей головной капсуле, и вышеупомянутые параметры являются статистически сниженными по сравнению с контролем.
Представлены различные анализы токсичности для вредителей. Например, анализ на иглах гусеницы листовертки-почкоеда елового сравнивает активность гусениц листовертки-почкоеда елового на листьях различного возраста и видов деревьев. Система, необязательно, содержит конусовидный контейнер, содержащий перегородку, позволяющую поддерживать отдельную иглу вертикально и подвергать воздействию отдельной гусеницы листовертки-почкоеда елового, причем основание иглы контактирует с увлажнителем. Иглу вставляют в перегородку перед добавлением гусеницы листовертки. Перегородка позволяет собирать несъеденные части иглы.
Личинок гусеницы листовертки-почкоеда елового, как правило, выращивают на искусственном рационе (McMorran, 1965), пока они не достигают стадии, на которой они будут потреблять суккулентные иглы. В каждую пробирку помещают отдельную гусеницу листовертки-почкоеда. Тестируют иглы похожего размера и массы, собранные вокруг точки инокуляции инокулированного токсикогенным эндофитом сеянца (тестируемый сеянец) плюс контрольные иглы. Измеряют данные роста вредителей, которые, необязательно, включают в себя количество несъеденных игл, ширину головной капсулы и массы личинок. Массы гусениц листовертки и оставшихся игл, и ширину головной капсулы гусениц листовертки определяют для тестируемого и контрольного образцов, и сравнивают. Других насекомых и личинок можно легко тестировать в подобных анализах, например пяденицу гемлоковую и листовертку-почкоеда елового.
Токсичность токсина эндофита для вредителя, такого как пяденица гемлоковая, необязательно, тестируют согласно следующему способу. Токсин, подлежащий тестированию, вводят в искусственный рацион, подходящий для роста вредителей. Искусственный рацион получают в отдельных чашках, содержащих концентрации токсина 5 микромолярную, 10 микромолярную, 25 микромолярную, 50 микромолярную и 100 микромолярную. Одну 3-ю насекомых в стадии личинки добавляют в каждую из 75 чашек на разведение и инкубируют в камере для роста в подходящих условиях, таких как 22°C, 55% относительная влажность с 16 час света/сутки. Спустя 4 суток, насекомых замораживают, взвешивают и измеряют их головные капсулы. Уменьшение размера головной капсулы (например, ширины) или массы по сравнению с контрольным образцом является показательным для присутствия токсина. Специалисту в данной области будет понятно, что этот способ можно модифицировать для тестирования различных концентраций токсина, и что условия можно модифицировать для тестирования множества различных вредителей.
Количество токсикогенного эндофита, адекватное для уменьшения роста в хвойном растении, представляет собой количество, для которого показывают статистически значимое уменьшение скорости роста, и/или развития личинки, или снижение прироста массы по сравнению с неинокулированными, но в остальном эквивалентными контрольными сеянцами. Количество будет меняться в зависимости от видов эндофита, концентрации токсина и природы продуцируемого токсина.
В одном варианте осуществления анализ, применяемый для оценки токсичности для вредителей, представляет собой анализ in vitro и включает в себя изоляцию хвойных игл в подходящем контейнере, чтобы убедиться, что иглы остаются увлажненными. Контейнер является подходящим для сбора и оценки массы и ширины головной капсулы подходящего тестируемого насекомого, подразумевая насекомого, которое в норме потребляет иглы во время его роста и развития, так же как для сбора всех оставшихся игл для оценки потребления игл.
В другом варианте осуществления анализ токсичности для вредителя представляет собой анализ in vivo и включает в себя помещение подходящих видов насекомых на ветви колонизированных эндофитом растений и/или деревьев, содержащихся в мешках и/или других контейнерах при плотности, необязательно, не более 10 насекомых/м2 площади ветвей, оставление насекомых на месте в течение подходящего периода времени, сбор насекомых с последующими определениями массы и ширины головной капсулы. Необязательно, можно анализировать другие параметры. Подходящий период времени для оставления вредителя в контакте с ветвями колонизированного эндофитом растения будет меняться с такими факторами, как личиночная стадия развития, погодные условия, виды хвойных и виды насекомых. В одном варианте осуществления период времени, необязательно, составляет между 1-14 сутками, например, 3-7 суток.
В другом варианте осуществления токсичность эндофита оценивают посредством подвергания колонизированного хвойного растения по меньшей мере одному характеристическому тесту, выбранному из группы, состоящей из анализа токсичности для вредителя, и/или анализа присутствия токсина.
Соответственно изобретение относится к способу оценки токсичности для вредителя токсинов токсикогенного эндофита с использованием анализа токсичности для вредителя.
Окно времени чувствительности
Термин «окно времени чувствительности», как применяют здесь, обозначает период времени, во время которого сеянец хвойного является чувствительным или восприимчивым к колонизации при инокуляции композицией инокулята, содержащей токсикогенный эндофит. «Чувствительный» используют здесь взаимозаменяемо с «восприимчивый».
Термин «инокуляция», как применяют здесь, обозначает инокуляцию эндофитом способом, позволяющим колонизацию. Инокулят, необязательно, представляет собой полученную в лаборатории композицию для инокуляции, содержащую токсикогенный эндофит. Инокулят может также представлять собой колонизированное растение, которое инокулирует сеянцы по соседству посредством прямого или вертикального переноса. Вертикальный перенос, необязательно, происходит посредством контакта неинфицированных сеянцев с колонизированными инфицированными иглами, включая опавшие иглы.
Авторы изобретения определили, что эффективная инокуляция сеянцев хвойных токсикогенными эндофитами происходит во время окна времени чувствительности. Окно времени чувствительности, необязательно, включает стадию стратификации семян и/или послевсходовый период непрерывного удлинения верхушки побега, когда кутикула еще не полностью сформирована.
Образование воска происходит внутри кутикулы, и его можно обозначить как кутикулярный воск, так же как на поверхности кутикулы, где его можно обозначить как эпикутикулярный воск. Кутикулярный воск может функционировать для обеспечения водоотталкивающих свойств поверхности игл.
Без желания быть связанными с теорией, считают, что верхний лимит времени, во время которого послевсходовые сеянцы можно инокулировать неинвазивным способом, соответствует образованию воска на и/или в сеянце, что нарушает инокуляцию.
Термин «стратификация семян», как применяют здесь, обозначает процесс искусственного или естественного прерывания покоя зародыша, так что семя может прорастать, и покой зародыша, как правило, включает в себя период времени от взятия семени из охлаждаемого хранилища до высевания семян. «Покой зародыша семени», необязательно, прерывают для белой ели посредством замачивания семени в воде в течение ночи и подвергания высушенного семени воздействию температур приблизительно 3-6° C в течение приблизительно 2 недель. Термин «прорастание», как применяют здесь, обозначает растрескивание оболочки семени и роста сеянца из семени.
Авторы изобретения обнаружили, что семена можно инокулировать во время стратификации семян. В одном варианте осуществления способ включает в себя замачивание семени хвойного в воде, содержащей инокулят, во время стратификации семян. В другом варианте осуществления семя хвойного белой ели замачивают в воде, содержащей инокулят, в течение ночи, высушивают, и еще влажное семя охлаждают при 2-6°C в течение приблизительно двух недель.
Авторы изобретения обнаружили также, что окно времени чувствительности включает период времени непрерывного удлинения верхушки побега до формирования кутикулы иглы. Окно времени чувствительности будет меняться по отношению к высоте сеянца и времени после прорастания с видами хвойных, однако включает период статистически значимой максимальной чувствительности, который, при использовании белой ели в качестве модели, начинается во время периода непрерывного удлинения верхушки побега (>10 мм <100 мм). Минимум определяется биологически периодом после преимущественного завершения процессов прорастания. Это включает в себя время после растрескивания оболочки семени и появления зародышевого корня. Зародышевый корень и гипокотиль, и семядоли быстро удлиняются до момента, где начинает удлиняться основание семядоли. В течение периода, ограниченного высотой сеянца >10, но >40 мм, верхушка побега, примордиальные иглы и противолежащие междоузлия быстро появляются, вытягиваются и развиваются. Рудиментарные иглы и междоузлия становятся полностью дифференцированными, включая формирование кутикулы и мезофилла. Критический период успешной инокуляции связан с процентом игл с промежуточной дифференцировкой по сравнению с полной дифференцировкой, при которой кутикула сформирована полностью. В одном варианте осуществления сеянец инокулируют до полного формирования кутикулы. В другом варианте осуществления сеянец инокулируют в течение периода непрерывного удлинения верхушки побега. В другом варианте осуществления сеянец инокулируют, когда процент игл с промежуточной дифференцировкой кутикулы больше, чем число игл, где кутикула сформирована полностью. Специалист в данной области будет легко способен оценить эти параметры.
Для белой ели авторы изобретения определили, что в окно времени чувствительности входит, пока сеянцы достигают 16 недель после прорастания. В предпочтительном варианте осуществления сеянцы инокулируют между 2-12 неделями, 6-10 неделями или 7-9 неделями после прорастания. В другом варианте осуществления сеянцы инокулируют на 2-3 неделях, 3-4 неделях, 4-5 неделях, 5-6 неделях, 6-7 неделях, 7-8 неделях, 8-9 неделях, 9-10 неделях после всходов. Определили, что особенно успешную инокуляцию сеянцев белой ели получают в варианте осуществления, когда сеянцы инокулируют на приблизительно 8 неделе после всходов (например, 7-9 недели после всходов). По отношению к высоте сеянца период успешности для белой ели включает стадию прорастания вплоть до высоты сеянцев приблизительно 10 см. В другом варианте осуществления сеянцы инокулируют при высоте 1-2 см, при высоте 2-3 см, при высоте 3-4 см, при высоте 4-5 см, при высоте 5-6 см, при высоте 6-7 см, при высоте 7-8 см, при высоте 8-9 см, при высоте 9-10 см. Определили, что особенно успешную инокуляцию получили при варианте осуществления, когда сеянцы инокулируют при высоте приблизительно 3 см (например, при высоте 2-4 см).
Период чувствительности сеянцев ели является таким, как описано для белой ели.
Способы инокуляции
Различные способы можно использовать для инокуляции сеянцев хвойных. В вариантах осуществления способа инокуляция сеянцев хвойных включает в себя приведение в контакт композиции инокулята с сеянцем, таким как интактный сеянец. «Интактный сеянец», как применяют здесь, относится к сеянцу, где сеянец остается без повреждений до или во время контакта с композицией инокулята. Более конкретно, на стебель интактного сеянца не наносят проколов или ранений до или во время контакта с композицией инокулята. Композицию инокулята, необязательно, вводят в интактный сеянец опрыскиванием интактного сеянца композицией инокулята. Использование интактных сеянцев является очень преимущественным, поскольку оно исключает стадию нанесения ранений и облегчает быструю инокуляцию, обеспечивая очень важную экономию времени в обстановке высокопроизводительного хвойного питомника. В другом варианте осуществления способ инокуляции включает в себя приведение в контакт композиции инокулята с областью поверхности сеянца хвойного. Композицию инокулята, необязательно, вводят в сеянец хвойного опрыскиванием области поверхности сеянца хвойного композицией инокулята. Термин «приведение в контакт» используют взаимозаменяемо с «введение».
Термин «опрыскивание», как применяют здесь, включает в себя любой способ доставки жидких частиц композиции инокулята к поверхности растения и включает в себя затуманивание, опрыскивание почвы, воздуходувное опрыскивание, и способы веерообразного распыления. Опрыскивание, необязательно, осуществляют с использованием баллона для опрыскивания или штангового опрыскивателя. В одном варианте осуществления композицию инокулята доставляют с использованием штангового опрыскивателя и инжекторного насоса для инъекции композиции инокулята на линию орошения. Инокуляцию легко проводят в течение времени, когда сеянец будет оставаться влажным в течение наиболее длительного периода времени, и она, необязательно, включает в себя повторное введение в те же самые или в другие сутки. В других вариантах осуществления композиция инокулята, необязательно, содержит добавки, которые улучшают и/или увеличивают поглощение токсикогенного эндофита. В данной области известен ряд химических веществ и/или препаратов, которые будут облегчать поглощение инокулята. Например, добавки могут уменьшать время высушивания после опрыскивания. В одном варианте осуществления добавка представляет собой углевод. В другом варианте осуществления углевод выбран из группы, содержащей сахара. В другом варианте осуществления углевод представляет собой углевод, подобный CMC. Кроме того, можно добавлять флуоресцентные индикаторы к композиции инокулята для определения количества накопленного аэрозоля.
Доставку композиции инокулята можно осуществлять посредством объединения или повторения способов, включая опрыскивание. Необязательно, композицию инокулята можно доставлять посредством повторяющегося опрыскивания.
В другом варианте осуществления способ инокуляции включает в себя введение композиции инокулята на почву.
Инокуляция сеянцев хвойных, в другом варианте осуществления, включает в себя надрезание, прокалывание или проникновение в сеянец другим способом, и доставку композиции инокулята. В одном варианте осуществления участок проникновения представляет собой нелигнифицированную ткань стебля сеянца. В другом варианте осуществления в стебель проникают в 5-15 мм от верхушечного побега. Термин «верхушечный побег», как применяют здесь, обозначает побег, дистальный от самого нижнего листа, оставшегося на главном стебле.
В одном варианте осуществления способ инокуляции включает в себя раневую инокуляцию. «Раневая инокуляция», как применяют здесь, относится к способу, где композицию инокулята вводят в сеянцы хвойных способом, включающим в себя нанесение ранения сеянцу. Инокулят можно вводить способом инъекции иглой. В другом варианте осуществления сеянцы хвойных инокулируют приведением носителя, содержащего токсикогенные эндофиты, в контакт со средой для роста сеянца. В одном варианте осуществления носитель содержит облученные иглы хвойных. В другом варианте осуществления сеянец высевают в среду для роста, и облученные иглы хвойных, колонизированные токсикогенными эндофитами, или другие части хвойных растений, колонизированные токсикогенными эндофитами, добавляют к среде для роста. В другом варианте осуществления среда для роста содержит горшечную смесь, окружающую или поддерживающую сеянцы хвойных, подлежащие инокуляции. В другом варианте осуществления среда для роста содержит компост. В конкретных вариантах осуществления хвойные инокулируют через рану с использованием композиции инокулята, содержащей токсикогенный эндофит, выбранный из группы, включающей 05-37A, 06-486D, 06-485A, 04-052B, 06-011B, 06-011D, 06-012C, 06-013A, 06-014C, 08-040B, 06-264A, 06-332A, 06-268A, 07-013D, 08-011D, 01-002A, 04-002G, 03-020B, 04-012A, 06-063D, 02-002C, 06-073C, 06-094E, 06-255A, 06-097D и 08-018A.
Кроме того, сеянец хвойного можно инокулировать смачиванием семян хвойных инокулятом, содержащим токсикогенный эндофит.
Авторы изобретения показали также, что деревья, посаженные по соседству с инфицированными деревьями (например, где будет опадать хвоя), являются инокулированными через 1 год после посадки. Соответственно в одном варианте осуществления изобретение относится к способу инокуляции или переноса эндофита к сеянцу посредством вертикального переноса, включающего в себя помещение сеянца поблизости от колонизированного хвойного. В одном варианте осуществления колонизированное хвойное является колонизированным токсикогенным эндофитом. В другом варианте осуществления токсикогенный эндофит выбран из таблицы 1-3. В одном варианте осуществления близость включает в себя область или зону, где будут опадать иглы. В одном варианте осуществления область включает в себя радиус 0,25 метров вокруг колонизированного хвойного. Специалисту в данной области будет понятно, что площадь, где будут опадать иглы, зависит от таких факторов, как размер колонизированного дерева. В другом варианте осуществления способ дополнительно включает в себя детекцию перенесенного эндофита в сеянце. Подходящий диапазон радиусов в одном варианте осуществления составляет вплоть до 250 см.
В другом варианте осуществления способ инокуляции включает в себя приведение облученных игл хвойных, инфицированных токсикогенным эндофитом, в контакт с сеянцами хвойных. Иглы в одном варианте осуществления являются облученными. Иглы и эндофит можно приводить в контакт, напрямую или опосредованно, с сеянцами хвойных. Например, иглы можно приводить в непосредственный физический контакт с сеянцем, или можно приводить в опосредованный контакт с сеянцем посредством контактирования игл с горшечной смесью, поддерживающей рост сеянца. В одном варианте осуществления горшечная смесь содержит компост.
Количество инокулированного токсикогенного эндофита составляет предпочтительно в одном варианте осуществления приблизительно 10 пропагул. «Пропагула», как обозначают здесь, означает инфекционную грибковую клетку. Специалисту в данной области будет понятно, что количество инокулированного токсикогенного эндофита может меняться с факторами внешней среды и другими факторами. Например, если инокуляцию сеянцев хвойных проводят при условиях внешней среды, таких как низкая температура, которые не являются благоприятными для инокуляции эндофитами, количество токсикогенного эндофита, необязательно, увеличивают. Подобным образом повторяющиеся инокуляции необязательно используют, если сеянцы подвержены воздействию различных условий внешней среды, таких как высокое количество осадков, когда композиция инокулята разводится или смывается.
Способы инокуляции, описанные выше, можно комбинировать и/или повторять. В одном варианте осуществления комбинированные и/или повторяющиеся способы инокуляции включают в себя один и тот же способ инокуляции. В другом варианте осуществления комбинированные и/или повторяющиеся способы представляют собой различные способы инокуляции. Например, в одном варианте осуществления сеянец сначала инокулируют во время стратификации семян, а затем инокулируют во время непрерывного удлинения верхушки побега.
Композиция инокулята
Авторы изобретения показали, что различные инокуляты можно использовать для инокуляции сеянцев хвойных. Термин «инокулят», как применяют здесь, относится к веществу, содержащему токсикогенный эндофит, которое вводят для придания устойчивости к вредителям и которое представляет собой, необязательно, композицию инокулята, содержащую токсикогенный эндофит, например композицию, содержащую токсикогенный эндофит, выращенный in vitro, или, необязательно, субстрат инокулята, такой как иглы хвойных, содержащий токсикогенный эндофит, или носитель, содержащий токсикогенный эндофит.
Термин «композиция инокулята, содержащая токсикогенный эндофит», как применяют здесь, обозначает композицию для инокуляции, где токсикогенный эндофит присутствует в эффективном количестве, чтобы колонизировать сеянцы хвойных, придавая увеличенную устойчивость к вредителям посредством контроля, снижения, уменьшения, предупреждения или отпугивания вредителей, и/или повреждения вредителей, и/или уменьшения роста вредителей. Композиция инокулята, также альтернативно обозначаемая «инокулят», является эффективной, если уровень продуцируемого токсина является достаточным, чтобы контролировать, снижать, уменьшать, предупреждать или отпугивать вредителей, и/или уменьшать рост вредителей, и/или повреждать вредителей. Примеры подходящих композиций описаны в этой заявке, и их, необязательно, легко идентифицируют с использованием анализов, таких как анализ личинок гусеницы листовертки-почкоеда елового, описанный здесь.
Авторы изобретения идентифицировали новые способы получения композиции инокулята по изобретению. Филаменты токсикогенного эндофита, необязательно, разрезают посредством способов разрезания, уменьшающих число полученных мертвых эндофитов по сравнению с другими способами измельчения, таким образом, увеличивая число живых токсикогенных эндофитов на объем инокулята и облегчая колонизацию инокулированных сеянцев хвойных.
В одном варианте осуществления эндофит выращивают в агрегате для ферментации с перемешиваемым баком, так что клетки присутствуют в не превышающих 5 мм кластерах мицелия или спорах, являются более чем на 80%, и, предпочтительно, более чем на 95% жизнеспособными, и более чем на 80% и, предпочтительно, более чем на 95% инфекционными на восприимчивой ткани, в жидкости, по существу, свободной от бактерий и существенных концентраций оставшихся питательных веществ.
В другом варианте осуществления изобретение относится к композиции инокулята, которую, необязательно, получают способом выращивания выделенного эндофита, включающим в себя:
a) получение культуры эндофита на скошенной питательной среде (например, культуры на скошенном агаре);
b) инокуляцию культурой первой жидкой культуры;
c) подвергание первой жидкой культуры срезающему усилию, разрезающему гифу эндофита;
d) инокуляцию второй жидкой культуры первой жидкой культурой;
e) подвергание второй жидкой культуры второму срезающему усилию для разрезания гифы эндофита.
В другом варианте осуществления, способ включает в себя:
a) выращивание исходной культуры эндофита (например, культуры на скошенном агаре);
b) инокуляцию первой жидкой культуры суспензией, содержащей культуру на скошенном агаре, где первую жидкую культуру выращивают в течение приблизительно 2 недель;
c) измельчение первой жидкой культуры;
d) инокуляцию второй жидкой культуры измельченной первой жидкой культурой в условиях срезающего усилия, достаточного для разрезания гифы эндофита, где вторую культуру выращивают в большом сосуде и с аэрацией.
В одном варианте осуществления композицию инокулята, необязательно, собирают из большого сосуда, который включает в себя ферментер, центрифугируют и ресуспендируют в разбавителе. В одном варианте осуществления разбавитель представляет собой стерильную воду.
В одном варианте осуществления скошенный агар представлял собой скошенный агар с экстрактом солода. В другом варианте осуществления первая жидкая культура представляет собой 2% экстракт солода, и суспензию добавляют при 5% об./об. Срезающее усилие в одном варианте осуществления включает в себя встряхивание или повороты при 200-310 об/мин. В другом необязательном варианте осуществления встряхивание или повороты осуществляют при 220 об/мин. В одном варианте осуществления первую жидкую культуру предпочтительно инкубируют при 25°C. В одном варианте осуществления первая жидкая культура содержит экстракт солода. В другом варианте осуществления измельченную жидкую культуру добавляют в 1-3% среды с экстрактом солода. В одном варианте осуществления концентрация экстракта солода составляет приблизительно 1%. В другом варианте осуществления измельченную жидкую культуру и среду с экстрактом солода перемешивают при 200-310 об/мин, например, перемешивание при 280 об/мин. В другом варианте осуществления температура в большом сосуде, который, необязательно, может представлять собой перемешиваемый ферментер, составляет 20-22°C и, необязательно, составляет 21°C. В другом варианте осуществления присутствует аэрация 0,05-0,15 об./об. в минуту и, необязательно, составляет 0,1 об./об. в минуту. В другом варианте осуществления расщепленную жидкую культуру и экстракт солода инкубируют в течение 6-10 суток и предпочтительно 7 суток. Специалисту в данной области будет понятно, что потребуются общепринятые адаптации для выращивания новых идентифицированных штаммов токсикогенного эндофита. Кроме того, специалисту в данной области будет понятно, что изменения концентрации сахара, температуры и давления кислорода могут требовать компенсирующих изменений других переменных. Специалисту в данной области будут также понятны общепринятые эксперименты для дальнейшего масштабирования продукции композиции инокулята.
Композиция инокулята может являться разведенной или концентрированной. В одном варианте осуществления композицию инокулята разводят водой перед инокуляцией.
Авторы изобретения детектировали ругулозин в деревьях через 3,5 года и 4,5 года после инокуляции. Средняя концентрация, с поправкой на восстановление структуры, составляла 0,7 мкг/г, и это было приблизительно таким же для различных классов возраста игл. В течение двух лет после инокуляции деревьев авторы изобретения детектировали ругулозин, концентрированный от 0,15 мкг/г до 24,8 мкг/мл. Авторы изобретения показали также, что иглы через 15 месяцев после последней инокуляции обладают средней арифметической концентрацией ругулозина 1 мкг/г. Эти концентрации являлись достаточными для уменьшения роста гусеницы листовертки-почкоеда елового.
Авторы изобретения показали, что концентрация ругулозина в иглах, инфицированных продуцирующими ругулозин грибковыми штаммами, которая уменьшает рост вредителей, составляет в среднем 1 микрограмм/грамм массы игл. Концентрация, влияющая на рост вредителей, необязательно, является настолько низкой, как 0,15 микрограмм/грамм массы игл. Присутствие токсина или эндофита детектируют в колонизированном образце хвойного. Образец хвойного включает в себя ткань хвойного из растения, предварительно инокулированного эффективной концентрацией инокулята, содержащего токсикогенный эндофит. Соответственно в одном варианте осуществления эффективная композиция инокулята представляет собой композицию, продуцирующую в среднем приблизительно 10 микромолярную концентрацию токсина ругулозина в колонизированном сеянце хвойного. В другом варианте осуществления концентрация токсина достигает в среднем, необязательно, 10-25 микромолярной, или необязательно 25-50 микромолярной.
Эффективность инокулята меняется с длительностью времени хранения инокулята. Предпочтительно инокулят собирают, разводят и/или получают в те же сутки, что и для инокуляции.
В другом варианте осуществления изобретение относится к композиции инокулята, содержащей токсикогенный эндофит, которую можно использовать в способах по изобретению для получения сеянца хвойного, инфицированного грибковым токсикогенным эндофитом.
В одном варианте осуществления способ инокуляции сеянцев хвойных дополнительно включает в себя детекцию, является ли сеянец колонизированным токсикогенным эндофитом.
Способ детекции токсикогенного эндофита
Различные способы можно применять для детекции присутствия токсикогенных эндофитов. Анализы с использованием способов на основе антител для детекции эндофитов травы разработаны для нескольких видов эндофитов с использованием, например, анализов в микропланшетах и способов иммуноблоттинга тканей (Gwinn et al., 1991; Johnson et al., 1982; Reddick & Collins, 1998). По сравнению с конкурирующими способами, такими как ПЦР, они обладают большим потенциалом для использования в полевых условиях на основе простых протоколов.
Авторы изобретения разработали анализ с использованием детектирующего средства для анализа намеченных эндофитов. В одном варианте осуществления анализ нацелен на эндофиты, такие как 5WS22E1, с использованием детектирующего средства, такого как антитело. Разработанное антитело обладает сравнимой чувствительностью к анализам с антителами эндофитов травы (Gwinn et al., 1991; Johnson et al., 1982; Reddick & Collins, 1998). Это достигнуто, несмотря на большие трудности с матриксом игл хвойных по сравнению с листьями травы. Авторы изобретения получили также антитела к 5WS22E1, 5WS11/1, 05-37A, 06-486D, 06-485A.
Детекцию токсикогенного эндофита можно осуществлять посредством детекции штамма токсикогенного эндофита или продукта эндофита, такого как токсин. Соответственно изобретение относится к анализу с использованием детектирующего средства, которое связывает токсин или узнает токсикогенный штамм эндофита для детекции присутствия намеченных эндофитов в образце хвойного, где анализ включает в себя:
a) приведение в контакт образца хвойного со средством, узнающим токсикогенный штамм эндофита;
b) детекцию присутствия связанного средства в образце хвойного, где присутствие связанного средства является показательным для присутствия токсикогенного штамма эндофита, распознаваемого антителом.
В одном варианте осуществления средство, которое связывает токсин или узнает токсикогенный штамм эндофита, представляет собой антитело. Соответственно в одном варианте осуществления анализ представляет собой анализ с антителом.
В другом варианте осуществлении анализ с антителом представляет собой анализ ELISA. В другом варианте осуществления анализ с антителом представляет собой портативный анализ на основе иммуноблоттинга. В другом варианте осуществления анализ с антителом заключен в наборе, содержащем антитело, которое узнает токсикогенный штамм эндофита и детектирующие средства для детекции присутствия штамма, узнаваемого антителом. В другом варианте осуществления набор содержит антитело, узнающее токсикогенный штамм эндофита, и инструкции для применения.
Авторы изобретения показали, что присутствие токсикогенного штамма эндофита может не поддаваться детекции в успешно колонизированных сеянцах, пока сеянец растет в течение периода времени. Таким образом, в одном варианте осуществления образец хвойного получают, когда растение старше чем 3 месяца, старше чем 4 месяца, старше чем 5 месяцев, старше чем 6 месяцев, старше чем 7 месяцев, старше чем 8 месяцев, старше чем 9 месяцев, старше чем 10 месяцев или старше чем 11 месяцев после прорастания. В другом варианте осуществления образец хвойного получают, когда растение старше чем 1 год после прорастания. В другом варианте осуществления образец хвойного получают, когда растению 12-18 месяцев после прорастания. В другом варианте осуществления образец хвойного получают, когда возраст растения больше чем 18 месяцев после прорастания.
Авторы изобретения показали, что инокулированные токсикогенные эндофиты персистируют в течение по меньшей мере пяти лет. Кроме того, токсикогенные эндофиты распространяются по ветвям и распространяются на другие сеянцы поблизости от колонизированного дерева. Специалисту в данной области будет понятно, что образец можно получать через много месяцев или лет после инокуляции, и его можно получать из ткани, проксимальной или дистальной от участка инокуляции. Например, специалисту в данной области будет понятно, что ветви, близкие к участку инокуляции, по-видимому, будут положительными в более ранних временных точках, чем ветви дальше от участка инокуляции. Подобным образом можно тестировать несколько ветвей при анализе хвойного по колонизации. Детекции токсикогенного эндофита или токсина в 9 образцах хвойного достаточно, чтобы показать, что хвойное является колонизированным.
Образец хвойного, необязательно, содержит ткани хвойного, включая иглы. Образец хвойного, как правило, размалывают в порошок перед контактом с узнающим токсикогенный эндофит антителом и/или суспендируют в соответствующем буфере, таком как забуференный Tris солевой раствор (TBS).
Кроме того, присутствие токсикогенного эндофита можно детектировать посредством аналитической детекции токсина эндофита. Авторы изобретения представляют аналитический способ детекции основного токсина, связанного с токсикогенным штаммом эндофита. Аналитический способ включает в себя получение образца хвойного, содержащего токсин-кандидат токсикогенного эндофита, для переработки посредством разделения, такого как HPLC (высокоэффективная жидкостная хроматография), где способ получения образца хвойного, необязательно, включает в себя:
a) первую экстракцию с использованием петролейного эфира в условиях низкой освещенности;
b) вторую экстракцию хлороформом;
c) промывку экстракта NaHCO3;
d) подкисление экстракта;
e) третью экстракцию хлороформом; высушивание экстракта;
f) растворение высушенного экстракта в ацетонитриле.
Полученный образец, необязательно, анализируют на аппарате для HPLC и анализируют полученный спектр по присутствию токсина. В одном варианте осуществления образец, подлежащий подготовке для анализа HPLC, содержит продуцирующий ругулозин токсикогенный эндофит.
Соответственно изобретение относится к способу детекции токсина, связанного с токсикогенным штаммом эндофита, включающему в себя получение образца хвойного для анализа HPLC, разделяющего экстракт эндофита жидкостной хроматографией высокого давления с получением спектра на выходе, детекцию присутствия или отсутствия значения для токсина в спектре на выходе, где присутствие значения для токсина является показательным для присутствия токсина.
В другом варианте осуществления способ включает в себя:
a) разделение экстракта эндофита жидкостной хроматографией высокого давления с получением спектра на выходе;
b) детекцию присутствия или отсутствия значения для токсина в спектре на выходе, где присутствие значения для токсина является показательным для присутствия токсина.
Токсин также, необязательно, детектируют с использованием других анализов, включая ЯМР, препаративную тонкослойную хроматографию, препаративную ВЭЖХ, ВЭЖХ с масс-спектроскопией и колоночную хроматографию. Способы использования этих техник известны в данной области.
Виды и генотипы хвойных деревьев, чувствительных к колонизации токсикогенными эндофитами
Изобретение осуществляют на практике для хвойных растений и сеянцев. «Хвойный», как применяют здесь, относится к множеству иглолистных деревьев или кустарников и включает в себя все виды ели (виды Picea), сосны (виды Pinus) и деревья бальзамической пихты (Abies balsamea), и «растение», как применяют здесь, включает в себя сеянец или дерево и включает древесную изгородь для получения укоренившихся побегов или кустарника.
В конкретных вариантах осуществления инокулируемый сеянец хвойного представляет собой сеянец белой ели (Picea glauca). В других вариантах осуществления инокулируемый сеянец хвойного представляет собой сеянец красной ели (Picea rubens). В следующих вариантах осуществления инокулируемый сеянец представляет собой сеянец бальзамической пихты. В другом варианте осуществления инокулируемый сеянец хвойного представляет собой сеянец сосны, например веймутовой сосны (Pinus strobus).
В одном варианте осуществления сеянец белой ели инокулируют композицией инокулята, содержащей токсикогенный эндофит 5WS22E1. В другом варианте осуществления сеянец белой ели инокулируют композицией инокулята, содержащей токсикогенный эндофит 5WS11/1. В другом варианте осуществления сеянец белой ели инокулируют композицией инокулята, содержащей токсикогенный эндофит 05-037A (SEQ ID NO: 3). В другом варианте осуществления сеянец белой ели инокулируют композицией инокулята, содержащей токсикогенный эндофит 06-486D (SEQ ID NO: 4). В другом варианте осуществления сеянец белой ели инокулируют композицией инокулята, содержащей токсикогенный эндофит 06-485A (SEQ ID NO:5).
В другом варианте осуществления сеянец красной ели инокулируют композицией инокулята, содержащей токсикогенный эндофит, выбранный из группы, содержащей 06-264A (SEQ ID NO:13), 06-332A (SEQ ID NO:14), 06-268A (SEQ ID NO:15), 07-013D (SEQ ID NO:16), 08-011 (SEQ ID NO:17), 01-002A (SEQ ID NO:18), 04-002G (SEQ ID NO:19), 03-020B (SEQ ID NO:20), 04-012A (SEQ ID NO:21), 06-063D (SEQ ID NO:22), 02-002C (SEQ ID NO:23), 06-073C (SEQ ID NO:24), 06-094E (SEQ ID NO:25), 06-255A (SEQ ID NO:26), 06-097D (SEQ ID NO:27) и 08-018 (SEQ ID NO:28).
Авторы изобретения обнаружили, что инокуляция сеянцев из выведенной популяции белой ели композицией инокулята по изобретению являлась успешной для ряда генотипов. Из 25 тестируемых семей белой ели шесть обладали индивидуумами, тестированными как положительные по заражению одним из тестируемых штаммов эндофитов. Из этих шести семей были представлены 11 из 31 родителя, и эти 11 родителей перекрывали тот же самый диапазон, что охватывала большая выборка. Это обеспечивает хороший показатель того, что широкий диапазон генотипов будет являться чувствительным к инфекции тестируемыми эндофитами.
Улучшенное эндофитом хвойное растение
Изобретение относится также к хвойному растению, колонизированному штаммом токсикогенного эндофита. В одном варианте осуществления хвойное растение представляет собой растение белой ели с токсикогенным эндофитом 05-037A (SEQ ID NO: 3). В другом варианте осуществления хвойное растение представляет собой растение белой ели, колонизированное токсикогенным эндофитом 06-486D (SEQ ID NO: 4). В другом варианте осуществления хвойное растение представляет собой растение белой ели, колонизированное токсикогенным эндофитом 06-485A (SEQ ID NO: 5).
В другом варианте осуществления хвойное растение представляет собой растение красной ели, колонизированное токсикогенным эндофитом, выбранным из группы, состоящей из 06-264A (SEQ ID NO:13), 06-332A (SEQ ID NO:14), 06-268A (SEQ ID NO:15), 07-013D (SEQ ID NO:16), 08-011 (SEQ ID NO:17), 01-002A (SEQ ID NO:18), 04-002G (SEQ ID NO:19), 03-020B (SEQ ID NO:20), 04-012A (SEQ ID NO:21), 06-063D (SEQ ID NO:22), 02-002C (SEQ ID NO:23), 06-073C (SEQ ID NO:24), 06-094E (SEQ ID NO:25), 06-255A (SEQ ID NO:26), 06-097D (SEQ ID NO:27) и 08-018 (SEQ ID NO:28).
Вредители, чувствительные к токсинам токсикогенного эндофита
Термин «вредитель», как применяют здесь, обозначает любой организм, который может вызывать повреждение хвойного растения, включая любой патоген игл, и включает в себя насекомых, личинок насекомых и грибковые патогены. Вредители-насекомые включают в себя насекомых, которые потребляют листья, таких как гусеница листовертки-почкоеда елового, листовертка-почкоед еловый, пяденицы гемлоковые, пилильщики и гусеница листовертки-почкоеда сосны Банкса. Грибковые вредители включают в себя серянку сосны веймутовой и виды возбудителей фузариоза.
Все токсины или культуры эндофитов, описанные здесь, тестировали на личинках гусениц листовертки-почкоеда елового (Choristoneura fumiferana). В случае токсина ругулозина 5WS22E1 гусеницы листовертки-почкоеда елового (фигура 8) и пяденицы гемлоковые (Lambdina fiscellaria) являлись пораженными при концентрациях ругулозина в рационе между 25 и 50 мкМ. Тесты с собранным диким листоверткой-почкоедом еловым (Zeiraphera canadensis) показали, что эти виды также являлись пораженными ругулозином в том же порядке величины. Тесты на плодовых мушках (Drosophila melanogaster) также показали токсичность ругулозина в рационе в диапазоне 50 мкМ (Dobias et al., 1980). Это соединение является также токсичным для культивируемых клеток из нескольких линий клеток насекомых, включая совку травяную (Spodoptera frugiperda) и личинок комара (Aedes albopictus; Watts et al., 2003).
При тестировании в условиях, описанных выше, полуочищенные экстракты оставшихся перечисленных эндофитов приводили к статистически значимым уменьшениям скорости роста и/или максимальной личиночной стадии гусеницы листовертки-почкоеда елового в пределах функциональных параметров тестов.
Способы скрининга эндофитов
Авторы изобретения идентифицировали множество штаммов токсикогенных эндофитов, которыми можно инокулировать сеянцы хвойных для уменьшения поражения вредителями колонизированных хозяев. При идентификации токсикогенных эндофитов по изобретению авторы изобретения взяли грибковые штаммы из существующей литературы, из общедоступных коллекций и тестировали дополнительные коллекции более 1000 штаммов эндофитов. Культивировали эндофитные штаммы из игл случайным образом выбранных еловых деревьев и разработали антитело, позволяющее детекцию. Анализ с антителом позволил детекцию успешных инокуляций. Один аспект изобретения относится к способу идентификации новых токсикогенных эндофитов, которые можно использовать со способами и композициями по изобретению.
Способ скрининга для выделения токсикогенного эндофита из донорного растения включает в себя:
a) выделение медленно растущего эндофита-кандидата из игл хвойных донорного растения (например, донорного хвойного);
b) анализ токсичности эндофита-кандидата для вредителя в анализе токсичности для роста вредителей для определения, является ли эндофит-кандидат токсикогенным эндофитом.
Если эндофит-кандидат является токсикогенным эндофитом, способ, необязательно, дополнительно включает в себя инокуляцию сеянцев хвойных;
a) инокуляцию реципиентного сеянца хвойного штаммами эндофита-кандидата, определенными как токсикогенный эндофит;
b) получение образца инокулированного сеянца и детекцию присутствия намеченного эндофита (т.е. колонизации эндофитом) и/или токсина эндофита.
Как упомянуто, авторы изобретения секвенировали область ITS идентифицированных токсикогенных эндофитов. Соответственно в одном варианте осуществления изобретение относится к выделенным нуклеиновым кислотам, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 3-28.
В одном варианте осуществления изобретение относится к выделенной последовательности нуклеиновой кислоты, содержащей:
(a) последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:3-28;
(b) последовательность нуклеиновой кислоты, которая является комплементарной последовательности нуклеиновой кислоты из (a);
(c) последовательность нуклеиновой кислоты, обладающую значительной гомологией последовательности с последовательностью нуклеиновой кислоты из (a) или (b);
(d) последовательность нуклеиновой кислоты, которая представляет собой аналог последовательности нуклеиновой кислоты из (a), (b) или (c); или
(e) последовательность нуклеиновой кислоты, которая гибридизуется с последовательностью нуклеиновой кислоты из (a), (b), (c) или (d) в строгих условиях гибридизации.
Термин «последовательность, обладающая значительной гомологией последовательности», обозначает те последовательности нуклеиновой кислоты, которые обладают слабыми или несущественными отличиями последовательности от последовательностей из (a) или (b). Отличия могут относиться к локальным мутациям или структурным модификациям. Последовательности нуклеиновой кислоты, обладающие значительной гомологией, включают в себя последовательности нуклеиновой кислоты, обладающие по меньшей мере 65%, более предпочтительно по меньшей мере 85%, и наиболее предпочтительно 90-95% идентичностью с последовательностями нуклеиновой кислоты из SEQ ID NO:3-28.
Нуклеиновые кислоты, содержащие последовательности, являются применимыми в качестве зондов или для дизайна зондов для идентификации родственных и токсикогенных эндофитов. Соответственно один вариант осуществления относится к способу выделения токсикогенного эндофита-кандидата, включающему в себя приведение в контакт нуклеиновой кислоты эндофита, такой как ДНК, с зондом, где зонд содержит последовательности, соответствующие по меньшей мере 50 нуклеотидам из последовательности, выбранной из группы, содержащей SEQ ID NO 3-28, где эндофиты с идентичностью последовательности по меньшей мере 80%, 85%, 90% или 95% представляют собой токсикогенные эндофиты-кандидаты.
Токсикогенный эндофит-кандидат, необязательно, далее анализируют по его способности ингибировать рост вредителя. Токсикогенный эндофит-кандидат, который при введении в сеянец согласно способу по изобретению, описанному здесь, контролирует, снижает, уменьшает, предупреждает или отпугивает вредителей, и/или уменьшает рост вредителей, и/или повреждает вредителей, представляет собой токсикогенный эндофит.
Термин «зонд», как применяют здесь, относится к последовательности нуклеиновой кислоты, которая будет гибридизоваться с последовательностью-мишенью нуклеиновой кислоты. В одном примере зонд гибридизуется с ДНК токсикогенного эндофита-кандидата. Конкретно в одном варианте осуществления зонд гибридизуется с последовательностью внутреннего транскрибируемого спейсера (ITS) рибосомальной ДНК токсикогенного эндофита-кандидата. Длина зонда зависит от условий гибридизации и последовательностей зонда и нуклеиновой кислоты-мишени. В одном варианте осуществления зонд имеет длину по меньшей мере 8, 10, 15, 20, 25, 50, 75, 100, 150, 200, 250, 400 или более нуклеотидов.
Термин «выделенная последовательность нуклеиновой кислоты», как применяют здесь, относится к нуклеиновой кислоте, по существу свободной от клеточного материала или культуральной среды при получении способами рекомбинантной ДНК, или химических предшественников, или других химических веществ при химическом синтезе. Подразумевают, что термин «нуклеиновая кислота» включает в себя ДНК и РНК и может являться двухцепочечной или одноцепочечной.
Термин «гибридизоваться» относится к специфическому взаимодействию нековалентного связывания последовательности с комплементарной нуклеиновой кислотой. Один аспект изобретения относится к выделенной нуклеотидной последовательности, которая гибридизуется с ДНК токсикогенного эндофита. В предпочтительном варианте осуществления гибридизация происходит в условиях высокой строгости. Подходящие условия строгости, способствующие гибридизации, известны специалистам в данной области или их можно найти в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1 6.3.6. Например, можно использовать 6,0 × хлорид натрия/цитрат натрия (SSC) при приблизительно 45°C, с последующей промывкой 2,0×SSC при 50°C в течение 15 мин.
Строгость можно выбирать на основании условий, используемых на стадии отмывки. Например, концентрацию соли на стадии промывки можно выбирать из высокой строгости приблизительно 0,2×SSC при 50°C в течение 15 мин. Кроме того, температура на стадии отмывки может быть в условиях высокой строгости при приблизительно 65°C.
Под «условиями гибридизации по меньшей мере умеренной строгости» понимают, что выбирают условия, способствующие избирательной гибридизации между двумя комплементарными молекулами нуклеиновой кислоты в растворе. Гибридизация может происходить для всей или для части последовательности молекулы нуклеиновой кислоты. Гибридизующаяся часть, как правило, имеет длину по меньшей мере 15 (например 20, 25, 30, 40 или 50) нуклеотидов. Специалистам в данной области понятно, что стабильность дуплекса, или гибридов нуклеиновой кислоты, определяется Tm, которая в содержащих натрий буферах является функцией от концентрации иона натрия и температуры (Tm = 81,5°C - 16,6 (Log10 [Na+]) + 0,41 (%(G+C)-600/I), или подобное уравнение). Соответственно параметрами условий отмывки, определяющими стабильность гибрида, являются концентрация ионов натрия и температура. Чтобы идентифицировать молекулы, которые являются сходными, но не идентичными, с известной молекулой нуклеиновой кислоты, можно предполагать, что 1% несовпадение приводит к уменьшению Tm приблизительно на 1°C, например, если считают, что молекулы нуклеиновой кислоты обладают >95% идентичностью, температуру конечной отмывки будут понижать приблизительно на 5°C. На основании этих соображений специалисты в данной области будут способны легко выбирать подходящие условия гибридизации. В предпочтительных вариантах осуществления выбирают строгие условия гибридизации. Например, следующие условия можно использовать для достижения строгой гибридизации: гибридизация в 5× хлориде натрия/цитрате натрия (SSC)/5x раствор Денхардта/1,0% SDS при Tm - 5°C на основании указанного выше уравнения, с последующей отмывкой 0,2× SSC/0,1% SDS при 60°C в течение 15 мин. Умеренно строгие условия гибридизации включают в себя стадию промывки в 3× SSC при 42° C в течение 15 мин. Понятно, однако, что эквивалентной строгости можно достигать с использованием альтернативных буферов, солей и температур. Дополнительное руководство относительно условий гибридизации можно найти в: Current Protocols in Molecular Biology, John Wiley & Sons, N.Y., 1989, 6.3.1-6.3.6 и в: Sambrook et al., Molecular Cloning, a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2000, Third Edition.
В другом варианте осуществления токсин токсикогенного эндофита секвенировали и зонд конструировали на основании последовательности. Зонд использовали для идентификации других токсикогенных эндофитов, продуцирующих токсин для применения в способах по изобретению. Специалист в данной области будет способен легко секвенировать гены или продукты генов токсина и конструировать зонды на основании последовательности.
Следующие неограничивающие примеры иллюстрируют настоящее изобретение.
Пример 1
Обнаружили, что иглы, колонизированные продуцирующим ругулозин эндофитом, содержат ругулозин в концентрациях, которые являются эффективными in vitro для задержки роста личинок гусеницы листовертки-почкоеда елового. Личинки, представленные на инфицированных эндофитом иглах, содержащих ругулозин, не набирали так много массы, как личинки, поедавшие неколонизированные иглы. Влияние на гусеницу листовертки-почкоеда являлось намного большим, чем ожидали. Один из штаммов, 5WS22E1, являлся наиболее успешным антагонистом роста личинок. Иглы 17 из 22 сеянцев, колонизированных продуцирующим ругулозин штаммами, являлись токсичными для насекомых. Иглы, инфицированные другим семейством штаммов, продуцирующих вермикулин, также являлись токсичными для насекомых.
Ругулозин однозначно присутствовал на иглах, инфицированных продуцирующими ругулозин штаммами, и не обнаружен ни в контроле, ни в сеянцах, колонизированных продуцирующим вермикулин эндофитом. В иглах, которые значительно влияли на массу гусениц листовертки-почкоеда, концентрации ругулозина составляли в среднем 8 мкг/г. Это составляло >15 раз, чем средняя концентрация, обнаруженная в иглах, которые не влияют на рост гусеницы листовертки-почкоеда. In vitro, ругулозин при 1 мкг/г влияет на рост и развитие гусеницы листовертки-почкоеда, и это значение довольно близко к 8 мкг/г, обнаруженным в иглах.
Пример 2
Анализ с антителом для детекции эндофита
Нижеследующее описывает (1) разработку поликлонального антитела для продуцирующего ругулозин эндофита 5WS22E1; (2) инокуляцию 1235 сеянцев и последующее выращивание на открытом воздухе в условиях коммерческого питомника; (3) анализ этих образов игл с использованием способа культивирования, применяемого ранее, и способа с антителом; и (4) анализ ВЭЖХ на присутствие ругулозина в ~10% положительных образцов.
МАТЕРИАЛЫ И МЕТОДЫ
Инокуляция
Используемый штамм, 5WS22E1 (DAOM 229536; продуцент ругулозина), описан в Miller et al. (2002). Для инокуляции получили семьи белой ели с контролируемым опылением, с полными сибсами. Используемые семьи выбирали для обеспечения разнообразного набора генотипов. Использовали девять семей белой ели, происходящих от неродственных родителей. Родителей выбирали по программе генетического улучшения J. D. Irving Limited, и они происходили из пределов 45 N - 47,5 N широты и 65 W - 70 W долготы в Нью-Брансуике и Мэне. Минимальное расстояние между деревьями, выбранными в лесу, составляло 200 м. Семена получали из замороженного хранилища при -5° C, высаживали в пластиковые контейнеры для сеянцев в среду, содержащую 3:1 торфяного мха/вермикулита, и помещали в теплицу. Подкормку удобрениями посредством воды для орошения начинали через один месяц после посева (10-52-10 в течение двух недель, затем 8-20-30 в течение одной недели, затем 20-8-20 при 100 мкг/л и увеличение до максимума 125 мкг/л).
Культуры 5WS22E1 (DAOM 229536) выращивали на 9 см чашках, содержащих 2% агар с экстрактом солода (Difco) при 25°C в течение 8 недель. После инкубационного периода 5 мл стерильной воды наливали на поверхность агара, которую затем осторожно растирали стерильной палочкой из гнутого стекла. Полученную суспензию забирали в стерильную пипетку, измельчали и разводили стерильной водой для доставки в среднем 3 фрагментов грибковых гиф на каплю (6 мкл) из стерильного 1 мл шприца с иглой 0,45 мм (B-D #309597), как определяли подсчетом на гемоцитометре. Раневую инокуляцию 1235 сеянцев проводили в ламинарном шкафу посредством инъекции 6 мкл в нелигнифицированную ткань стебля, как правило, на 10 мм дальше от верхушечного побега (Miller et al., 2002). Это выполняли в лесном питомнике Суссекса 16 апреля 2001 г. Он расположен 45° 43' N, 65° 31' W; высота 21,30 м. Среднегодовая температура составляет 5,8 C (Январь -8,5, Июль 19,0 C) со средним выпадением осадков 245 см снега и 915 мм дождя.
Деревьям позволяли расти в поддонах в течение 6 месяцев в теплице, в этой точке их высаживали в горшки и оставляли в затененной области с орошением до забора образцов в середине сентября 2002 г.
Разработка ELISA
Клетки 5WS22E1 выращивали на двух типах жидкой среды и на облученных, молодых инокулированных игл белой ели. Иглы облучали 25 кГр (MDS Nordion, Montreal, PQ), и 200 мг образца помещали в стерильную стеклянную чашку Петри, содержащую фильтровальную бумагу, с последующим добавлением 1 мл стерильной воды. Через 24 часа культуру инокулировали небольшой частью культуры, взятой из рабочей стороны чашки с 2% агаром с экстрактом солода. Первая используемая жидкая среда представляла собой среду с глюкозой/сахарозой и минеральными солями (1 г/л KH2PO4, 1 г/л KNO3, 0,5 г/л MgSO4 • 7H2O, 0,5 г/л KCl, 0,2 г/л глюкозы, 0,2 г/л сахарозы), а вторая - 2% экстракт солода. Аликвоту (50 мл) каждой среды разливали в 250 мл колбы Эрленмейера, соответственно, и автоклавировали. Культуру на агаре измельчали в 100 мл стерильной воды в асептических условиях. Аликвоту (2,5 мл) использовали для инокуляции колб. Все культуры инкубировали при 18°C в течение приблизительно трех месяцев. В конце инкубационного периода клетки, растущие на иглах, осторожно соскребали скальпелем и лиофилизировали. Клетки из жидких культур фильтровали и промывали несколько раз стерильной дистиллированной водой и лиофилизировали.
Продукцию поликлонального антитела проводили в козах в Cedarlane® Laboratories Limited Hornby, Ontario. Лиофилизированные клетки из каждой среды измельчали, и каждые разводили в стерильном PBS до концентрации 20 мг/мл для раствора антигена. 0,5 мл этого раствора эмульгировали в 0,5 мл полного адъюванта Фрейнда (Brenntag Biosector, Denmark) для первичной иммунизации. 0,5 мл неполного адъюванта использовали для последующих бустер-иммунизаций. Преиммунный образец получали из яремной вены каждой козы с использованием иглы и вакуумного контейнера перед первичной иммунизацией. Затем каждую козу инъецировали с использованием иглы 21 калибра внутримышечно в заднюю часть в 4 различных участках 0,25 мл эмульгированного раствора антигена на участок инъекции. Через 28 суток козам вводили первую бустер-иммунизацию, как описано выше, вторую бустер-иммунизацию на сутки 53, и тестовый забор крови проводили на сутки 66.
Антитела, полученные от 3 различных коз, тестировали для определения их авидности и перекрестной реактивности с порошкообразными, лиофилизированными клетками неинокулированных молодых игл ели, так же как с клетками наиболее распространенных на поверхности игл грибков филлопланы игл, выделенных из этих игл (Alternaria alternata, Phoma herbarum, Cladosporium cladosporioides и Aspergillus fumigatus; Miller et al., 2002; Miller et al., 1985), и других эндофитов хвойных для белой ели: 5WS11/1 (DAOM 229535; продуцент вермикулина) и 5WS331L1 (продуцент ругулозина). Кроме того, тестировали ряд эндофитов бальзамической пихты. Один выделенный эндофит из бальзамической пихты представляет собой BF 36H1 (Findlay et al., 1995).
В случае эндофитов игл клетки получали на облученных иглах, как выше. Тестируемые виды филлопланы выращивали в культуре с встряхиванием с использованием среды с мальтозой, дрожжевым экстрактом, пептоном (Miller & Mackenzie, 2000), фильтровали, промывали и лиофилизировали, как выше. Показано, что этот способ подходит для продукции антигена такими грибками в неродственных исследованиях. Клетки измельчали в тонкий порошок в маленькой ступке и осторожно взвешивали. Суспензии известной концентрации получали в TBS (0,8 г/л NaCl, 0,2 г/л KCl, 1,89 г/л Tris-HCl, и 1,57 г/л Tris-основания) в пробирках и перемешивали с встряхиванием.
Эксперименты по авидности и перекрестной реактивности проводили на сыворотке от коз, обработанных различными иммуногенами подобным образом, сначала оптимизируя добавления клеток/разведения сыворотки, и затем проводя эксперименты по перекрестной реактивности. Как необходимо, аликвоты клеток разводили в 0,1 M карбонатном буфере pH 9,6 (Sigma) - буфере для покрытия, до определенных концентраций и пипетировали в 96-луночные микропланшеты марки Nunc. Планшет покрывали ацетатной пленкой для герметизации и помещали в ротационный встряхиватель на 4 час при комнатной температуре. Планшет вынимали, поворачивали вверх дном и встряхивали, чтобы удалить весь покрывающий раствор в слив. Затем 200 мкл Blotto (10 г нежирного сухого молока на 1 л TBS) добавляли в каждую лунку, накрывали и помещали в холодильник при 5°C на ночь. Затем планшет вынимали и промывали с использованием Molecular Devices Skan Washer 400 для удаления всего раствора Blotto. Используемый раствор для промывки представлял собой TTBS (0,5 мл tween-20 /л TBS) с программой промывки из 3 циклов смачивания, промывки и ополаскивания. Получали различные разведения сыворотки козы в Blotto, из которых 100 мкл добавляли в лунки микропланшета. Планшет накрывали и помещали в ротационный встряхиватель на 1 час при комнатной температуре, его вынимали и промывали с использованием TTBS, как описано выше. Затем 100 мкл конъюгата антител против IgG козы с пероксидазой хрена (Sigma), разведенного в 5000 раз в Blotto, добавляли в каждую лунку микропланшета. Планшет накрывали и инкубировали при комнатной температуре в течение 1 часа. Планшет промывали последний раз и добавляли субстрат. 100 мкл TMB (тетраметилбензидин, Sigma) добавляли в каждую лунку. Планшет накрывали и инкубировали при комнатной температуре в течение 30 минут. Реакцию останавливали с использованием 50 мкл 0,5 M серной кислоты. Планшет немедленно считывали при 450 нм с вычитанием 630 нм на считывателе Molecular Devices Spectra Max 340PC.
Поликлональное антитело, продуцируемое клетками 5WS22E1, выращенными на определенной среде, обладало низкой авидностью, и его далее не исследовали. Антитело из среды 2% MEA обладало приемлемой авидностью, но неприемлемой перекрестной реактивностью. Поликлональное антитело против клеток, культивированных на облученных иглах, использовали во всех дальнейших исследованиях. 4000-кратное разведение последней сыворотки с 5000-кратным разведением вторичного антитела определили как оптимальное для тестов с клетками 5WS22E1, позволяющее предварительное определение чувствительности подлежащего разработке анализа. Тесты с этим и другими эндофитами хвойных проводили с использованием масс клеток от 15 до 240 нг для 5-кратного диапазона концентрации антитела. С использованием разведения сыворотки 4000 определили ответ на 15, 30, 60, 120 и 240 нг клеток видов филлопланы и на 60, 100 и 500 нг лиофилизированных игл белой ели. Затем добавляли порошкообразные лиофилизированные иглы белой ели (500 нг/лунку) с добавлениями клеток 5WS22E1 во всем вышеуказанном диапазоне.
Анализы игл на 5WS22E1
Способ рассева
На время забора образцов средняя высота дерева составляла 12,9 см. Иглы от каждого дерева осторожно удаляли по радиусам от точки инокуляции, помещали в стерильные пластиковые пакеты и немедленно замораживали для транспортировки в лабораторию. Каждый пакет вынимали из морозильной камеры и вынимали приблизительно 20 игл. Поверхность каждой иглы дезинфицировали погружением в 70% этанол на 1 мин, ополаскивали стерильной дистиллированной водой в течение 1 мин и промокали досуха стерильной салфеткой. Иглу помещали в стерильную чашку Петри и разрезали на 2 фрагмента, половину иглы, которая была присоединена к стеблю, высевали на 2% агар с экстрактом солода. Чашки инкубировали при 18°C в течение 6 недель и регулярно проверяли микроскопией рост 5WS22E1 (Miller et al., 2002).
ELISA
Оставшиеся иглы лиофилизировали. Приблизительно 20 игл из каждого замороженного образца игл отбирали, измельчали в тонкий порошок в пробирке с использованием измельчителя-мешалки Spex-Certiprep (модель 5100) и отвешивали 10 мг. Один мл TBS (0,8 г/л NaCl, 0,2 г/л KCl, 1,89 г/л Tris-HCl и 1,57 г/л Tris-основания) добавляли в каждую пробирку и помещали в встряхиватель до полного перемешивания (приблизительно 1 мин). Образцам назначали коды, независимые от кодов деревьев, и распределяли случайным образом, чтобы обеспечить анализ образцов от отдельных деревьев на многих планшетах. Все разводили в 0,1 M карбонатном буфере pH 9,6 (Sigma) - буфере для покрытия, до концентраций 100 и 500 нг игл на 100 мкл лунку, и пипетировали в двух параллелях в 96-луночный микропланшет. Оставшиеся стадии анализа являлись такими, как описано выше. В каждом испытании 60 нг клеток 5WS22E1 использовали в качестве положительного контроля для оценки производительности анализа; относительное стандартное отклонение чистого значения из 25 репрезентативных экспериментов составляло 8,7%. Если не получали приемлемого результата для положительного контроля, результаты для отдельных планшетов переделывали. Образцы с высокими значениями поглощения в тестах как 100 нг, так и 500 нг, отбрасывали как указывающие на проблемы при разведении. Результаты оценивали как положительные, когда поглощение образца 500 нг превышало самое низкое значение поглощения выше единицы (1,000) плюс среднее значение поглощения 30 нг намеченного эндофита в образце на этом планшете.
Химические анализы
Ругулозин с чистотой >95% использовали для стандартов. Затем следовало определить присутствие ругулозина в сокращенной выборке из 113 случайным образом выбранных деревьев из 330 деревьев, определенных как положительные по эндофиту посредством антитела. 100 мг образца лиофилизированных игл измельчали в тонкий порошок, как описано выше, и экстрагировали 10 мл ледяного петролейного эфира посредством перемешивания в течение 45 мин в условиях низкой освещенности. Колбу сохраняли на льду во время экстракции и накрывали алюминиевой фольгой для предотвращения деградации светом. Суспензию отфильтровывали отсасыванием и выбрасывали. Иглы возвращали в колбу и экстрагировали 10 мл хлороформа в течение 45 мин, как выше в случае петролейного эфира. Затем новую суспензию отфильтровывали отсасыванием и сохраняли, в то время как иглы выбрасывали. Экстракт после хлороформа промывали 10 мл 5% NaHCO3 в делительной воронке. Затем первый слой хлороформа выбрасывали, pH подкисляли до pH 3 с использованием 1 Н HCl, и новую аликвоту 10 мл хлороформа добавляли в делительную воронку и экстрагировали. Хлороформ удаляли и высушивали в желтой пробирке под слабым потоком азота.
Высушенные экстракты перерастворяли в 50 мкл ацетонитрила, 10 мкл отбирали и инъецировали в Agilent Technologies HPLC-DAD серии 1100, с использованием колонки Synergi Max RP 8OA, 250 x 4,6 (Phenomonex) и градиентного способа, адаптированного из Frisvad (1987). Градиент начинали при 90% воды с 0,05% TFA и 10% ацетонитрила и изменяли до 10% воды с 0,05% TFA и 90% ацетонитрила в течение 20 мин прогона. Образцы анализировали при 389 нм, максимальное поглощение UV/VIS для ругулозина и идентичность пика подтверждали данными полного спектра из детектора с диодной матрицей. Предел количественного определения составлял 150 нг/г лиофилизированного порошкообразного материала; выделение из добавленных игл составляло в среднем 75%.
Статистические анализы проводили с использованием SYSTAT в. 10.2 (Point Richmond, CA).
РЕЗУЛЬТАТЫ
Разработка инокуляции и ELISA
В описанных условиях предел количественного определения для намеченного эндофита 5WS22E1 составлял между 30 и 60 нг клеток на лунку; предел детекции составлял 30 нг. На протяжении диапазона концентраций один log для антитела показали линейный ответ на 60 нг намеченного эндофита (фигура 1; представлены результаты экспериментов в трех параллелях). Относительная перекрестная реактивность на 15, 30, 60, 120 и 240 нг клеток видов филлопланы являлась умеренной (8%). В том же самом диапазоне присутствовала немного большая перекрестная реактивность с клетками двух тестированных эндофитов белой ели (~15%), один из которых продуцировал ругулозин.
Даже для 240 нг клеток ответ был ниже используемого порога 1 единица поглощения. Ответ поликлонального антитела на вышеуказанный диапазон не являющихся мишенью грибковых клеток являлся нелинейным в диапазоне концентраций антитела. Ответ на 60, 100 и 500 нг клеток белой ели снова в диапазоне концентраций антитела являлся умеренным (~6%) и также нелинейным. Сравнение ответа на 60 нг не являющихся мишенью клеток с ответом на намеченный эндофит приведено на фигуре 1; среднее относительное стандартное отклонение для параллелей, включенных в эти данные, составляло 6,3%.
На количественное определение намеченного эндофита не влияло присутствие больших количеств порошкообразных лиофилизированных игл (~2-18 x). По ANOVA с тестом LSD Фишера ответ на 500 нг материала игл плюс 30 нг намеченного эндофита значимо превышал ответ на комбинацию с 15 нг (p=0,008). Значения для 30 и 60 нг значимо не отличались (p=0,312), указывая, что предел количественного определения находился между этими значениями в присутствии материала игл. Все оставшиеся значения p между добавлениями клеток эндофита игл составляли >0,003. Значения поглощения для 30, 60, 120 и 240 нг намеченного эндофита плюс материал игл и для одного грибка высоко коррелировали r=0,951 (p >0,000), показывая, что присутствие игл не влияет на линейность анализа (фигура 2; представлены результаты экспериментов в трех параллелях).
Иглы и химические анализы
Из 1235 тестированных деревьев только 40 являлись явно положительными по 5WS22E1 по анализу рассева, т.е. грибки выросли из срезанного конца >15/20 игл. Для большинства из приблизительно 25000 фрагментов игл с дезинфицированной поверхностью показали рост не относящихся к эндофиту грибков, включая описанные ранее (Miller et al., 2002). Как и ранее, колонии этих таксонов, как правило, возникали из сторон игл, а не из срезанных концов.
Когда те же самые образцы анализировали способом с антителом, 330 или 27% являлись положительными. Все образцы, где грибок наблюдали в культуре, являлись положительными по анализу с антителом. Из 113 образцов, тестированных по ругулозину посредством ВЭЖХ из 330 положительных по антителу игл, 101 (90%) являлись положительными на пределе количественного определения. Диапазон обнаруженных концентраций составлял 0,15-24,8 мкг/г игл. Распределение значений (принимая половину предела детекции за отсутствие детекции) показано на фигуре 3. Среднее геометрическое концентрации ругулозина составляло 1,02 мкг/г.
Средняя замороженная масса 100 репрезентативных игл составляла 2,6 мг/иглу. Лиофилизированная масса составляла 1,08 мг/иглу.
Поликлональный анализ, разработанный для намеченного эндофита 5WS22E1, обладал сравнимой чувствительностью с подобными анализами для эндофитов травы (Gwinn et al., 1991; Johnson et al., 1982; Reddick & Collins, 1998. Этого достигали несмотря на большие трудности с матриксом игл хвойных по сравнению с листьями травы. Нарезку последних можно помещать непосредственно в микропланшеты, в то время как жесткие, гидрофобные иглы хвойных необходимо измельчать, чтобы экспонировать грибковые клетки для антитела. Перекрестная реактивность для потенциально конкурирующих грибов являлась приемлемой (фигура 1). Эпифитная биомасса является, как правило, небольшой в молодых иглах (Carroll, 1979) и состоит преимущественно из грибков (Swisher & Carroll, 1980). На основании экстраполяции данных авторов настоящего изобретения на данные других исследователей (Swisher & Carroll, 1980; Таблица 2) грибковая эпифитная биомасса на этих иглах в возрасте 19 месяцев будет составлять <3 мкг/г. Это означает, что присутствие таких грибов на образцах игл авторов настоящего изобретения не оказывает эффект на ответ антитела в этих анализах. Кроме того, относительно большие количества порошкообразных игл белой ели по сравнению с грибковыми клетками не влияют на надежную детекцию 30-60 нг клеток намеченного эндофита (фигура 2).
Большинство (90%) игл, показанных как положительные по эндофиту способом с антителом, содержали концентрации ругулозина выше предела детекции. Это обеспечивает дополнительное доказательство надежности способа с антителом. Среднее (1 мкг/г) диапазон и распределение концентраций ругулозина в этих иглах (фигура 3) являлись сходными с обнаруженными в выращенных в вегетационной камере сеянцах (Miller et al., 2002). Аналитический способ, применяемый в настоящем исследовании, включает в себя проверку полного сканирования УФ-спектра на пик ругулозина. Это обеспечивает дополнительное подтверждение присутствия этого соединения по сравнению с предшествующими анализами HPLC UV и TLC (Miller et al., 2002).
Анализы проводили с использованием дублирующих сокращенных выборок по 500 нг, полученных из образца 20 игл. Осторожное допущение, используемое в оценке 330 положительных сеянцев, заключалось в том, что они содержали предел количественного определения. С использованием этого осторожного допущения, каждая игла будет содержать 60 мкг биомассы эндофита на 1 г иглы или ~6%. Для сравнения, Swisher and Carroll (1980) опубликовали, что иглы Дугласовой пихты в возрасте 1-4 лет обладают ~10 мкг эпифитной биомассы на 1 г игл. Она в основном состоит из грибков, но содержит водоросли и бактерии на более старших иглах. Эти измерения позволяют сделать другое сравнение: количество ругулозина на массу грибковых клеток.
Провели несколько исследований по продукции микотоксинов в живых растениях с использованием культивирования и эргостерола для оценки грибковой биомассы. Репрезентативным примером является исследование дезоксиниваленола в экспериментально инокулированных зернах до жатвы с соответствующими измерениями эргостерола и жизнеспособных грибков среди других данных (Miller et al., 1983). С использованием эргостерол-грибкового переноса биомассы, обсуждаемой в Gessner & Newell (2002), можно определить, что in planta концентрация дезоксиниваленола соответствует ~ 3% грибковой биомассы. С использованием средней концентрации ругулозина соотношение в этом случае составляло ~2%.
Таким образом, поликлональный анализ, разработанный для намеченного эндофита 5WS22E1, надежно детектировал грибок в 500 нг сокращенных выборок колонизированных игл. Через девятнадцать месяцев после инокуляции детектированные скорости колонизации являлись высокими. Анализы показали, что большинство колонизированных игл (90%) содержали поддающиеся детекции концентрации обладающего активностью против насекомых соединения ругулозина 5WS22E1.
Пример 3
Коллекции грибков
Из приблизительно 12 участков в Нью-Брансуик, Новой Шотландии, Квебеке и Мэне собирали ветви старших деревьев белой ели, красной ели и бальзамической пихты в различных древостоях, в первую очередь в относительно нетронутых природных лесных лесостоях, но также на плантациях возраста 20-30 лет. Это проводили с 1985 по 2005 гг. Ветви собирали либо непосредственно в полевых условиях, либо из ветвей деревьев, которые прививали из полевых селекций и выращивали на плантации - банке клонов в Суссексе, Нью-Брансуик. Поверхность игл из ветвей стерилизовали и рассевали для общих процедур, разработанных Carroll и соавторами (например, Carroll and Carroll, 1978). Кратко, как правило, 20 здоровых игл собирали с каждой ветви. Их поверхность стерилизовали погружением в 70% этанол, затем 6% гипохлорит натрия в течение 10 мин с последующим ополаскиванием стерильной деионизированной водой, промокали досуха стерильной салфеткой и высевали на 2% агар с экстрактом солода. Чашки инкубировали при 18°C в течение ~6 недель. Целью этой поверхностной дезинфекции являлось уничтожение грибков филлопланы, перекрывающих медленно растущие эндофиты игл (Carroll and Carroll, 1978; Clark et al., 1989). Все фрагменты игл проверяли с помощью стереомикроскопа. Колонии не очевидные для Cladosporium или Alternaria, проверяли при высокой мощности для диагностики эндофита.
Медленно растущие культуры переносили в косяки 2% агара с экстрактом солода или культуральные флаконы, инкубировали при 16-18°C, заклеивали, инвентаризовали по внешнему виду культуры и подробностям сбора и сохраняли при 5°C. Несколько тысяч штаммов, которые были собраны, сортировали по локализации, участку и морфологии колоний и отбирали случайную выборку для дальнейшего исследования.
Скрининг грибковой коллекции по токсинам против патогенов (например, против насекомых)
Выбранные изоляты выращивали либо во флаконах Glaxo, либо в других сосудах, позволяющих культивирование с большим соотношением площади поверхности к объему с пониженным давлением кислорода. Используемая среда представляла собой 2% экстракт солода в деионизированной воде. Культуры инокулировали посредством измельчения конуса 2% агара с экстрактом солода в стерильной деионизированной воде в асептических условиях и добавления полученной суспензии 5% об./об. либо непосредственно в более мелкие культуральные сосуды (Clark et al., 1989), либо в 250 мл колбы Эрленмейера, содержащие 2% экстракт солода в деионизированной воде, на 2 недели при 25°C. Их в свою очередь измельчали и инокулировали во флаконы Glaxo и Roux и инкубировали в течение 6-8 недель при 16-18°C.
Полученные культуры фильтровали. Мицелий замораживали и лиофилизировали. Фильтраты культур экстрагировали этилацетатом и проверяли для доказательств продукции метаболитов тонкослойной хроматографией, ЯМР и высокоэффективной жидкостной хроматографией с детектором с двойной диодной матрицей. На основании этих доказательств проводили скрининг экстрактов по токсичности в рационе для личинок гусеницы листовертки-почкоеда елового. Принципиальные токсины против насекомых таким образом выделяли и идентифицировали с использованием общепринятых способов органической химии, включая, в качестве неограничивающих примеров, препаративную TLC, колоночную хроматографию, ЯМР и высокоразрешающую масс-спектроскопию.
Идентификация штаммов
Информация о морфологии колоний для 5WS22E1 и SWS11/1, двух хорошо изученных штаммов, является следующей: штаммы выращивали на 2% агаре с экстрактом солода при 25°C в темноте. 5WS22E1 рос 0,5 мм сутки-1. Мицелий являлся в основном погруженным, колонии являлись рыжевато-бурыми с растворимым рыжеватым пигментом; обратная сторона являлась бурой, становясь рыжевато-бурой с возрастом. Мицелий являлся темно-бурым с загрубевшими толстыми стенками диаметром 1-2 мкм, септированным, с редкими ответвлениями, возникающим под прямыми углами от мицелия. 5WS11/1 рос 0,4 мм сутки-1. Колонии и обратная сторона являлись зеленовато-коричневыми без растворимого пигмента, и мицелий являлся как погруженным, так и воздушным. Мицелий являлся зеленовато-коричневым с загрубевшими стенками диаметром 1-2 мкм, септированным, без ответвлений (Miller et al., 2002).
Молекулярную характеризацию пяти интересующих штаммов выполняли с использованием праймеров из Glass & Donaldson (1995), что является признанным общепринятым способом для нитевидных Ascomycetes в настоящее время. Клетки эндофитов выращивали в жидкой культуре, фильтровали и промывали, и затем выделяли ДНК с использованием набора для выделения ДНК микроорганизмов Ultraclean (Mo Bio Laboratories, #12224-250), и для полученных последовательностей проверяли в общедоступных базах данных родственные последовательности. Ни один из штаммов ранее не депонирован в GenBank®. На основании сходства последовательностей штаммы 5WS22E1 и 5WS11/1 предварительно являются видами Phialocephala, который включает виды, являющиеся эндофитами на ели. Штамм 05-037A выделен из игл P. glauca в St. George, NB. Ограниченные последовательности ДНК доступны для родственных грибов, однако, доступные данные показывают, что он принадлежит к порядку Xylariales, семейству Xylariaceae и близок, но не идентичен Hypoxylon/Nemania serpens (98% сходство последовательности ITS) (Vasiliauskas, 2005, Sanchez-Ballesteros, 2000). Другие штаммы белой ели, 06-486D и 06-485A, выделены из игл в Суссекс, NB. Данные секвенирования показывают, что они являются наиболее близко родственными неидентифицированными видами грибков, выделенных из деревьев черной ели в Квебеке, Канада. Оба представляли собой виды Lophodermium (94% и 98% сходства ITS, соответственно), где 06-486D наиболее похож на Rhytistimataceae (Higgins et al., 2007, Ganley & Newcombe, 2006).
Идентификация эффективных штаммов
Эффективные штаммы представляют собой такие, которые (a) продуцируют соединения против насекомых, токсичные для гусениц листовертки-почкоеда елового in vitro, (b) колонизируют сеянцы белой ели, (c) продуцируют их токсин(ы) in planta (d) для насекомых, потребляющих колонизированные эндофитом иглы показали сниженные скорости роста.
a) Тесты на насекомых проводили посредством добавления чистого соединения в синтетический рацион
Личинок гусеницы листовертки-почкоеда елового (Choristoneura fumiferana) получили из колоний в Natural Resources Canada, Canadian Forest Service Laboratory в Sault Ste. Marie, Ontario и сохраняли при 5°C. Для каждого теста личинок на второй личиночной стадии помещали в молочники, содержащие приблизительно 15 мл искусственного рациона, который получали на предыдущие сутки, и оставляли располагаться в течение ночи. Используемый рацион основан на McMorran (1965), как модифицировано Forestry Canada. Молочники помещали в вегетационную камеру при 22°C, 55% RH с 16 час света/сутки пока они не достигали 4-5 личиночной стадии, как определяли визуальной оценкой. Получали партии рациона и отмеряли подходящие части для добавления экстрактов, фракций или чистых соединений. Через 4 суток на тестируемом рационе гусениц листовертки-почкоеда замораживали, взвешивали и измеряли. Данные анализировали по уменьшениям сухой массы по сравнению с контролями и по изменениям в распределении насекомых по различным личиночным стадиям по сравнению с контролями.
Для гусениц листовертки-почкоеда елового предварительный тест показал, что эффективная приблизительная концентрация ругулозина для ограничения роста составляла 10 мкМ (Calhoun et al., 1992). В дополнительных тестах получили сходное значение 25 мкМ ругулозин со значением p 0,027 мкМ для ассоциации с уменьшением массы (см. фигуру 8).
Штаммы 5WS22E1, 5WS11/1, 05-037A, 06-486D, 06-485A являлись активными в подобных тестах экстрактов in vitro.
(b) Колонизация сеянцев белой ели
Колонизацию сеянцев после экспериментальной инокуляции проводили для 5WS22E1 и оценивали по присутствию по морфологии колоний, положительному тесту с антителом и анализу токсина in planta (Miller et al., 2002, Sumarah et al., 2005). Показали персистенцию колонизации с продукцией эффективных концентраций ругулозина в полевых условиях в течение ≥5 лет для 5WS22E1.
Анализы ELISA
Продукцию антитела осуществляли с использованием клеток 5WS22E1, выращенных на облученных, молодых инокулированных иглах белой ели. Иглы облучали 25 кГр (MDS Nordion, Montreal, PQ) и 200 мг помещали в стерильную стеклянную чашку Петри, содержащую фильтровальную бумагу, с последующим добавлением 1 мл стерильной воды. Через 24 часа культуру инокулировали небольшой частью культуры, взятой из рабочей стороны чашки с 2% агаром с экстрактом солода. В конце инкубационного периода клетки, растущие на иглах, осторожно соскребали скальпелем и лиофилизировали.
Продукцию поликлонального антитела проводили в козах в Cedarlane® Laboratories Limited, Hornby, Ontario. Эта лаборатория соответствует требованиям Canadian Council on Animal Care. Лиофилизированные клетки из каждой среды измельчали, и каждые разводили в стерильном PBS до концентрации 20 мг/мл для раствора антигена. 0,5 мл этого раствора эмульгировали в 0,5 мл полного адъюванта Фрейнда (Brenntag Biosector, Denmark) для первичной иммунизации. 0,5 мл неполного адъюванта использовали для последующих бустер-иммунизаций. Преиммунный образец получали из яремной вены каждой козы с использованием иглы и вакуумного контейнера перед первичной иммунизацией. Затем каждую козу инъецировали с использованием иглы 21 калибра внутримышечно в заднюю часть в 4 различных участках с 0,25 мл эмульгированного раствора антигена на участок инъекции. Через 28 суток козам вводили первую бустер-иммунизацию, как описано выше, вторую бустер-иммунизацию на 53 сутки и тестовый забор крови проводили на 66 сутки.
Антитела, полученные от 3 различных коз, тестировали для определения их авидности и перекрестной реактивности с порошкообразными, лиофилизированными клетками неинокулированных молодых игл ели, так же как с клетками наиболее распространенных в филлоплане игл грибков, выделенных из этих игл (Alternaria alternata, Phoma herbarum, Cladosporium cladosporioides и Aspergillus fumigatus), и других эндофитов хвойных для белой ели: 5WS11/1 (DAOM 229535; продуцент вермикулина) и 5WS331 L1 (продуцент ругулозина). Кроме того, тестировали ряд эндофитов бальзамической пихты. В случае эндофитов игл клетки получали на облученных иглах, как выше. Тестируемые виды филлопланы выращивали в культуре с встряхиванием с использованием среды с мальтозой, дрожжевым экстрактом, пептоном, фильтровали, промывали и лиофилизировали, как выше. Показано, что этот способ подходит для продукции антигена такими грибами в неродственных исследованиях. Клетки измельчали в тонкий порошок в маленькой ступке и осторожно взвешивали. Суспензии известной концентрации получали в TBS (0,8 г/л NaCl, 0,2 г/л KCl, 1,89 г/л Tris-HCl, и 1,57 г/л Tris-основания) в пробирках и перемешивали с встряхиванием.
Эксперименты по авидности и перекрестной реактивности проводили на сыворотке от коз, обработанных различными иммуногенами подобным образом, сначала оптимизируя добавления клеток/разведения сыворотки, затем проводя эксперименты по перекрестной реактивности. Как необходимо, аликвоты клеток разводили в 0,1 M карбонатном буфере pH 9,6 (Sigma) - буфере для покрытия, до определенных концентраций и пипетировали в 96-луночные микропланшеты марки Nunc. Планшет покрывали ацетатной пленкой для герметизации и помещали в ротационный встряхиватель на 4 час при комнатной температуре. Планшет вынимали, поворачивали вверх дном и встряхивали, чтобы удалить весь покрывающий раствор в слив. Затем 200 мкл Blotto (10 г нежирного сухого молока на 1 л TBS) добавляли в каждую лунку, накрывали и помещали в холодильник при 5°C на ночь. Затем планшет вынимали и промывали с использованием Molecular Devices Skan Washer 400 для удаления всего раствора Blotto. Используемый раствор для промывки представлял собой TTBS (0,5 мл tween-20 /л TBS) с программой промывки из 3 циклов смачивания, промывки и ополаскивания. Получали различные разведения сыворотки козы в Blotto, из которых 100 мкл добавляли в лунки микропланшета. Планшет накрывали и помещали в ротационный встряхиватель на 1 час при комнатной температуре, затем вынимали и промывали с использованием TTBS, как описано выше. 100 мкл конъюгата антител против IgG козы с пероксидазой хрена (Sigma), разведенного в 5000 раз в Blotto, добавляли в каждую лунку микропланшета. Планшет накрывали и инкубировали при комнатной температуре в течение 1 часа. Планшет промывали последний раз и добавляли субстрат. 100 мкл TMB (тетраметилбензидин, Sigma) добавляли в каждую лунку. Планшет накрывали и инкубировали при комнатной температуре в течение 30 минут. Реакцию останавливали с использованием 50 мкл 0,5 M серной кислоты. Планшет немедленно считывали при 450 нм с вычитанием 630 нм на считывателе Molecular Devices Spectra Max 340PC.
Поликлональное антитело, продуцируемое клетками 5WS22E1, выращенными на определенной среде, обладало низкой авидностью, и его далее не исследовали. Антитело из среды 2% MEA обладало приемлемой авидностью, но неприемлемой перекрестной реактивностью. Поликлональное антитело против клеток, культивированных на облученных иглах, использовали во всех дальнейших исследованиях. 4000-кратное разведение последней сыворотки с 5000-кратным разведением вторичного антитела определили как оптимальное для тестов с клетками 5WS22E1, позволяющее предварительное определение чувствительности подлежащего разработке анализа. Тесты с этим и другими эндофитами хвойных проводили с использованием масс клеток от 15 до 240 нг для 5-кратного диапазона концентрации антитела. С использованием разведения сыворотки 4000 определили ответ на 15, 30, 60, 120 и 240 нг клеток видов филлопланы и на 60, 100 и 500 нг лиофилизированных игл белой ели. Затем добавляли порошкообразные лиофилизированные иглы белой ели (500 нг/лунку) с добавлениями клеток 5WS22E1 во всем вышеуказанном диапазоне.
(c) продуцируют их токсин(ы) in planta
Анализ ругулозина
Как правило, 100 мг образца лиофилизированных игл измельчали в тонкий порошок, как описано выше, и экстрагировали 10 мл ледяного петролейного эфира посредством перемешивания в течение 45 мин в условиях низкой освещенности. Колбу сохраняли на льду во время экстракции и накрывали алюминиевой фольгой для предотвращения деградации светом. Суспензию фильтровали отсасыванием и выбрасывали. Иглы возвращали в колбу и экстрагировали 10 мл хлороформа в течение 45 мин, как выше в случае петролейного эфира. Затем новую суспензию отфильтровывали отсасыванием и сохраняли, в то время как иглы выбрасывали. Экстракт после хлороформа промывали 10 мл 5% NaHCO3 в делительной воронке. Затем первый слой хлороформа выбрасывали, pH подкисляли до pH 3 с использованием 1 Н HCl, новую аликвоту 10 мл хлороформа добавляли в делительную воронку и экстрагировали. Хлороформ удаляли и высушивали в желтой пробирке под слабым потоком азота.
Высушенные экстракты перерастворяли в 50 мкл ацетонитрила, и 10 мкл отбирали и инъецировали в Agilent Technologies HPLC-DAD серии 1100, с использованием колонки Synergi Max RP 8OA, 250 x 4,6 (Phenomonex) и градиентного способа, адаптированного из Frisvad (1987). Градиент начинали при 90% воды с 0,05% TFA и 10% ацетонитрила и изменяли до 10% воды с 0,05% TFA и 90% ацетонитрил в течение 20 мин прогона. Образцы анализировали при 389 нм, максимальное поглощение UV/VIS для ругулозина и идентичность пика подтверждали данными полного спектра из детектора с диодной матрицей (Фигура 7). Предел количественного определения составлял 150 нг/г лиофилизированного порошкообразного материала; выделение из добавленных игл составляло в среднем 75%.
Анализ вермикулина
Колонизацию 5WS11/1 после экспериментальной инокуляции показали по морфологии колоний (Miller et al., 2002), посредством положительного теста с антителом и по присутствию токсина in planta. Разработку антитела проводили так же, как выше.
Принципиальный токсин 5WS11/1, вермикулин, определяли следующим образом. Десять миллилитров ледяного петролейного эфира добавляли к каждому образцу измельченных игл и оставляли для экстракции от 45 мин до часа на льду во время перемешивания на магнитной мешалке. Затем растворы фильтровали с помощью фильтровальной бумаги Whatman #1 и воронки Бюхнера. Десять миллилитров этилацетата добавляли к иглам и фильтровальной бумаге. Растворы оставляли для экстракции в течение от 45 минут до 1 часа во время перемешивания на магнитной мешалке и снова фильтровали через фильтровальную бумагу Whatman #1 на воронке Бюхнера. Фильтрат собирали и высушивали под слабым потоком азота. Приблизительно один миллилитр ацетонитрила добавляли к высушенным экстрактам и полученный в результате раствор встряхивали, фильтровали через фильтр Acrodisk 0,22 мкм или 0,45 мкм, снова высушивали под азотом и перерастворяли в небольшом количестве (100-300 мкл) ацетонитрила. Эти экстракты инъецировали в ВЭЖХ. Пик вермикулина детектировали на УФ-хроматограмме при 224 нм, его максимуме УФ на полном спектре сканограммы.
Тесты для выделенного продуцирующего вермикулин эндофита описаны в Miller et al., 2002.
(d) для насекомых, потребляющих колонизированные эндофитом иглы, показали сниженные скорости роста
Систему тестирования, используемую для оценки 5WS22E1 и 5WS11/1 (Miller et al., 2002), адаптировали из системы Thomas (1983) для сравнения активности гусеницы листовертки-почкоеда елового на листве различных возрастов и видов деревьев. Система состояла из 4 мл конусовидных пластиковых чашек для образцов с крышками, каждая с просверленным через центр 0,5 мм отверстием и куском пены Oasis™, вырезанной по размеру узкого основания пробирок (10 мм диаметр × 15 мм). Непосредственно перед использованием добавляли 0,5 мл стерильной воды. Это позволяло поддерживать индивидуальные иглы вертикально и подвергать воздействию отдельной гусеницы листовертки-почкоеда елового, причем основание иглы контактирует с увлажнителем. Иглу брали из морозильной камеры и вставляли в перегородку непосредственно перед добавлением гусеницы листовертки-почкоеда. Гладкая поверхность перегородки позволяла собирать несъеденные части иглы. Затем пробирки поддерживали вертикально в группах по 30 в деревянных штативах.
Гусениц листовертки-почкоеда елового на второй личиночной стадии помещали в пробирки, содержащие искусственный рацион (McMorran, 1965). Их поддерживали в вегетационных камерах при 22°C, 55% RH с 16 час света/сутки в течение 1-2 суток, пока они не достигали ширины головной капсулы 0,4±0,1 мм (3я личиночная стадия). Это стадия, на которой они будут потреблять иглы суккулентов. Партии по 60-70 личинок объединяли и осторожно перемешивали вручную для случайного распределения животных из их исходных пробирок для роста. Затем отдельную гусеницу листовертки-почкоеда помещали в каждую пробирку. Из хорошо перемешанного пула замороженных игл тестировали 100 сходного размера и массы, собранных вблизи точки инокуляции тестируемого сеянца, плюс 100 контрольных игл на генотип. Как правило, 600 насекомых тестировали за один раз. Один генотип контрольного растения тестировали 4 раза. Каждую пробирку помечали так, чтобы это не указывало на происхождение иглы. Пробирки помещали в камеру с контролируемыми внешними условиями (22°C, 55% RH, 16 час день) на 48 час, до времени, в которое деревянные штативы помещали в морозильную камеру. Измеряли количество несъеденных игл, ширину головной капсулы и массы замороженных личинок. Определяли массы гусениц листовертки-почкоеда и остатков игл, и ширину головных капсул гусениц листовертки-почкоеда.
Для эндофита деревьев 5WS22E1 на деревьях в возрасте как 2, так и 3 года, проводили тесты по росту выращенных на рационе свободных от заболеваний личинок гусеницы листовертки-почкоеда елового на второй личиночной стадии следующим образом. Определенное количество гусениц листовертки-почкоеда помещали вручную на боковые ветви с почками и затем покрывали сеткой как положительные, так и отрицательные по эндофитам деревья. Датчики температуры помещали в зону содержания, и прогресс мониторировали, пока гусеница листовертки-почкоеда не превышала шестой личиночной стадии. По окончании насекомых собирали, замораживали для последующих определений ширины головной капсулы и замороженной массы. Собирали образцы для анализа токсина, чтобы убедиться, что не присутствовало ошибочной классификации деревьев по их эндофитному статусу. Масса гусениц листовертки-почкоеда на инфицированных деревьях являлась значительно сниженной по сравнению с массой на контрольных деревьях.
Пример 4
Детекция эндофита 5WS11/1
Поликлональное антитело, используемое для детекции эндофита 5WS1111, получали, как описано выше для 5WS22E1.
В условиях анализа, описанных выше, предел количественного определения и предел детекции намеченного эндофита 5WS11/1 оба составляли 30 нг клеток на лунку. На протяжении диапазона концентраций один log, для антитела показали линейный ответ на 60 нг намеченного эндофита (фигура 1; представлены результаты экспериментов в трех параллелях). Относительная перекрестная реактивность на 15, 30, 60, 120 и 240 нг клеток видов филлопланы являлась умеренной (>10%). В том же самом диапазоне присутствовала немного большая перекрестная реактивность с клетками двух тестированных эндофитов белой ели (~5%). Даже для 240 нг клеток ответ был ≥ используемого порога 1 единица поглощения. Ответ поликлонального антитела на вышеуказанный диапазон не являющихся мишенью грибковых клеток являлся нелинейным в диапазоне концентраций антитела. Ответ на 60, 100 и 500 нг клеток белой ели снова в диапазоне концентраций антитела являлся умеренным (>10%) и также нелинейным. Сравнение ответа на 60 нг не являющихся мишенью клеток с ответом на намеченный эндофит приведено на фигуре 1; среднее относительное стандартное отклонение для параллелей, включенных в эти данные, составляло 6%.
На фигуре 4 показано, что на количественное определение намеченного эндофита не влияло присутствие больших количеств порошкообразных лиофилизированных игл (~2-18 x). По ANOVA с тестом LSD Фишера ответ на 500 нг материала игл плюс 30 нг намеченного эндофита значимо превышал ответ на комбинацию с 15 нг (p=0,000), так же как все значения выше. Все оставшиеся значения p между добавлениями клеток эндофита игл составляли >0,003. Значения поглощения для 30, 60, 120 и 240 нг намеченного эндофита плюс материал игл и для одного грибка высоко коррелировали r=0,973 (p>0,000), показывая, что присутствие игл не влияет на линейность анализа (фигура 5; представлены результаты экспериментов в трех параллелях).
Пример 5
Получение инокулята эндофита
Культуры инокулировали посредством измельчения конуса 2% агара с экстрактом солода в стерильной деионизированной воде в асептических условиях и добавления полученной суспензии 5% об./об. в 250 мл колбы Эрленмейера, содержащие 2% экстракт солода в деионизированной воде. Их инкубировали в течение 2 недель при 25°C в встряхивателе (проход 3,81 см, 220 об/мин). Их в свою очередь измельчали и добавляли в ферментер с перемешиваемым баком, адаптированный для роста мицелиальных грибов, содержащий среду с 1% экстрактом солода, аэрируемый при 0,1 об./об. в минуту при перемешивании 280 об/мин и 21°C в течение 7 суток. Число клеток рассчитывали для обеспечения того, чтобы каждый сеянец получил 10 пропагул, как вводят в теплице на стадии восприимчивости растения, вводимых в условиях внешней среды, которые поддерживают влажность игл.
При условии, что их вводят во время стадии восприимчивости сеянца - окна времени чувствительности, такие инокуляции являются эффективными, являются ли сеянцы легко пораненными или нетронутыми.
В случае 5WS22E1 и 5WS11/1 добавление малых количеств (мг на сеянец) облученных игл, колонизированных, как описано выше, в почву на делянках, используемых для коммерческого получения сеянцев, является эффективным для создания непрямого контакта между иглами и сеянцами для инокуляции сеянцев, при условии, что инокуляция и сеянцы находятся в стадии восприимчивости.
Пример 6
Способ инокуляции - стратификация семян
Способ инокуляции сеянцев включает в себя добавление клеток к семенам во время процесса стратификации. Это процесс, при котором семена деревьев замачивают в воде до прорастания для впитывания воды и подготовки к прорастанию семян. Способ включает в себя добавление промытых клеток токсикогенного эндофита, полученных при ферментации, как выше, т.е. добавление грибковых клеток, собранных из ферментера, центрифугированных и ресуспендированных в стерильной воде с последующим немедленным добавлением в пакеты для стратификации семян на стадии замачивания в питомнике. В одном варианте осуществления семена замачивают в воде, содержащей инокулят, перед высеванием в теплицу во время стратификации семян.
Пример 7
Инокуляция эндофитом с использованием ограниченного окна времени
Репродукция инфицированных сеянцев
Сеянцы, полученные для всех испытаний в питомнике, выращивали с использованием общепринятых контейнерных способов получения сеянцев. Каждый пластиковый контейнер с твердыми стенками содержал 726 см2 с 67 лунками на контейнер. Отдельные лунки составляли 65 см3 по объему. Поддоны заполняли смесью 3:1 сфагнума и вермикулита, и семена высевали поверх этой среды. Семена покрывали тонким слоем песка из доломитового известняка, и поддоны слегка смачивали до насыщения. Теплицу затуманивали с помощью тонких сопл в поливочной штанге для поддержания поверхности среды влажной. Семена прорастают в течение двух недель. Внесение растворимого сбалансированного удобрения производится, когда начинают формироваться боковые корни (3 недели после посева). Сеянцы ели будут, как правило, составлять 3 см в высоту через 8 недель после посева (см. фигуру 6).
Экспериментальную инокуляцию опрыскиванием (для 50 контейнеров с сеянцами) осуществляли смешиванием 350 мл культур грибов с 175 мл стерильной воды в течение 10 секунд. Полученный раствор добавляли в стерильный аэрозольный баллон со спусковым механизмом. Всю смесь распыляли равномерно над 50 контейнерами. Функциональное введение в пилотном масштабе проводили с использованием общепринятого в теплице передвижного штангового опрыскивателя и инжекторного насоса для инъекции раствора культуры грибков на линию орошения. Штанга была шириной 28 футов и имела 22 сопла T Jet 11004VH. Культуру инъецировали с использованием инжектора Dosatron (Dosatron International Inc. Florida) с производительностью 11 галлонов/минуту. Коэффициент инжекции составлял 1:64 при 35 psi. Введение проводили вечером, так что листва оставалась влажной в течение наиболее длинного периода времени. Введения проводили в два последовательных вечера с 3 проходами, выполненными штангой через всю теплицу каждый вечер. Предпринимали шаги, чтобы убедиться, что влажность игл поддерживается 12 час после инокуляции без смывания инокулята с игл.
С 2000 г. проводили серию тестов среднего масштаба для определения оптимального времени для инокуляции. Инокуляцию осуществляли с использованием сеянцев с ранениями или без с использованием культивированных клеток или клеток на облученных иглах, как выше. Объединенные данные из многих испытаний 5WS22E1 показали, что существует период максимальной восприимчивости, независимо от способа введения инокулята (Фигура 6), который тестировали через 3 месяца после инокуляции, или в случаях, где существует больше данных, через 6 месяцев, когда поддающаяся детекции колонизация приблизительно удваивается (Sumarah et al., 2005).
Пример 8
Инокуляция в массовом масштабе
Сеянцы в масштабе тысяч можно инокулировать вручную. Растения порядка 30 миллионов сеянцев в год нельзя легко инокулировать вручную. Проверенный способ для инфекции игл эндофитом, хотя с низкой степенью успешности, представлял собой раневую инокуляцию молодых сеянцев. Эндофиты травы переносят посредством семян, так что способы, применимые для трав, неприменимы для инокуляции сеянцев хвойных.
Данные анализировали следующим образом. Из сохраняемых образцов игл с 340 деревьев, положительных по культивированию и ELISA, случайную выборку из 113 положительных по ELISA сеянцев анализировали по ругулозину; большинство (90%) содержали поддающиеся детекции концентрации ругулозина. Диапазон и распределение концентраций ругулозина являлось сходным с обнаруженными в более ранних тестах, выполненных в вегетационных камерах (Measurement of a rugulosin-producing endophyte in white spruce seedlings (Sumarah et al., 2005).
Поскольку полный анализ распределения эндофита нельзя провести на деревьях в полевых условиях, 10 инокулированных сеянцев, которые тестировали как положительные в испытании инокуляции 2003 г., и 10 инокулированных сеянцев, которые являлись отрицательными по ELISA через 3 месяца, оставили в горшках в питомнике для роста в течение дополнительного года. Каждую ветвь собирали отдельно для анализа ругулозина посредством ELISA. Присутствовало меняющееся число ветвей (11-20), которые тщательно помечали в соответствии с их положением на каждом из 20 деревьев, и все анализировали по ругулозину (~160 образцов). Все инокулированные деревья, которые являлись отрицательными по ELISA, являлись положительными через приблизительно 1 год. Это показывает, что действительный успех инокуляции значительно занижен при анализе через 3 месяца. Некоторую степень ложноотрицательных результатов из испытаний инокуляции отметили как проблему со времени исходных исследований инокуляции в 1999-2002 гг. Эти данные также придают лучший смысл скорости распространения и, как наблюдали на деревьях в полевых условиях, подтверждают его персистенцию. Показано, что эндофит и его токсин хорошо распределяются между ветвями нового и старого роста.
Анализ показал присутствие ругулозина, так же как производного ругулозина. Это либо продукт деградации ругулозина, либо модифицированная растением форма ругулозина. В подобных ситуациях известно, что растения модифицируют грибковые метаболиты in vivo для защиты их собственных клеток от повреждения без влияния на токсичность соединения.
Проведены испытания 5WS22E1, включающие в себя последовательные инокуляции игл и/или последовательные инокуляции с нарезанием и опрыскиванием, т.е. от 10 мм, 20 мм, 30 мм, 40 мм и 50 мм высоты или подобного прорастания до нескольких недель (см. фигуру 6). В каждом испытании получали свежий инокулят и транспортировали в Суссекс, поскольку существовало доказательство, что сохранение инокулята после получения при 5°C приводило к сниженной жизнеспособности со временем хранения. Образцы игл анализировали (~2500 образцов). Анализ данных подтвердил, что либо инокуляции посредством нарезания и опрыскивания, либо добавление игл, колонизированных намеченным грибком, в контейнеры с сеянцами, либо только опрыскивание приводят к положительным результатам. Скорость колонизации за три месяца являлась наиболее высокой при первых двух обработках, но не намного меньше в тестах одного опрыскивания. В конечном счете в нескольких исследованиях по данному вопросу, возвращаясь к периоду 1999-2002 гг., степень успешности по высоте сеянца падала после пика между >3 см и 4 см. Поскольку присутствовали измерения сеянцев скорее с наиболее высокой исходной инфекцией, чем общая скорость, в настоящее время существуют небольшие сомнения относительно скорости для эндофита 5WS22E1.
Испытания инокуляции второго штамма эндофита 5WS11/1 проведены, но доступны для анализа только с последней четверти 2004 г. Они включали в себя способы нарезания и опрыскивания, и инокуляции колонизированных игл. Их анализировали (700 образцов) и теоретические показатели успеха колонизации являлись сходными с показателями для 5WS22E1 (вид, для которого существовали >6 лет опыта), т.е. ~1/3 положительных. Подобным образом подтвердили эффект возраста (высоты) сеянца.
Пример 9
Распространение инокулированных штаммов
В качестве необходимого условия использования этого способа в полевых условиях необходим тестовый участок, где развитие инокулированных деревьев можно повторно тестировать в течение периода 5 лет.
Считают, что эти эндофиты переносятся в природе при сбрасывании игл с колонизированных деревьев. Чтобы ответить на этот вопрос, молодые сеянцы будут посажены вблизи колонизированных развивающихся деревьев.
Весной 2000 г. ~1200 сеянцев инокулировали 5WS22E1. Из всей этой работы 340 деревьев являлись колонизированными эндофитами. Деревья инокулировали и культивировали в питомнике Суссекса в нормальных условиях. Их пересаживали и сохраняли на запасном участке. В августе 2003 г. 300 деревьев в возрасте четырех лет высаживали с большими промежутками, чем обычно. В июле 2004 г. 5 маленьких сеянцев высаживали вблизи 50 положительных по 5WS22E1 деревьев. Сетки помещали вблизи дополнительных 50 тестируемых деревьев для сбора опадающих игл.
Приблизительно 300 мг (сухая масса) игл удаляли из каждой из ветвей в возрасте одного, двух и трех лет, так же как две дополнительные ветви тестировали на присутствие эндофита 5WS22E1 посредством ELISA и ругулозина посредством ВЭЖХ. Эти образцы игл анализировали в 2005 г. Все деревья являлись положительными для грибов и токсинов в пределах каждого из классов возраста игл на дереве. В соответствующих пределах детекции (30 нг для эндофита; 150 нг/г для токсина), 63% образцов из индивидуальных ветвей являлись положительными для эндофита по ELISA, и 89% являлись положительными либо для ругулозина, либо для продукта его деградации, и только 1 ветвь являлась отрицательной для обоих. Концентрация ругулозина являлась несколько более высокой в деревьях в полевых условиях, чем в предыдущих исследованиях, однако, деревья были старше и более адаптированными. Средняя концентрация была точно на уровне эффекта для гусеницы листовертки-почкоеда елового и варьировала между деревьями, но отклонений по отношению к либо более старым, либо более новым ветвям не обнаружили. Опавшие иглы, собранные в сетки вблизи этих деревьев, тестировали и не обнаружили какого-либо присутствующего токсина.
Пример 10
Инокуляция продуцирующим вермикулин штаммом 5WS11/1
Продуцирующий вермикулин штамм 5WS11/1 выбрали в качестве второго штамма-кандидата (Mycological Research 106:47). Разработали поликлональное антитело для определения грибка. Весной 2004 г. сеянцы инокулировали.
Испытания инокуляции с использованием продуцирующего вермикулин эндофита обладали трехмесячной долей успешных попыток по ELISA, приблизительно на 30% сходной с эндофитом 5WS22E1. Из опыта, вероятно, что 6-8-месячная доля успешных попыток будет намного большей, снова из-за того, что распространение эндофитов является медленным.
Поскольку вермикулин обладает непримечательным УФ-спектром, количественное определение этого химического вещества является более трудным, чем определение для ругулозина. В ходе этой работы являлись необходимыми улучшения аналитического способа, так как естественным образом контаминированные образцы стали доступными в первый раз (эксперименты по развитию предыдущего способа проведены по необходимости с добавлением контрольных игл). Это означает, что некоторое обнаружение действительной концентрации вермикулина в естественным образом контаминированном материале получены впервые. Более ранние эксперименты с добавлением игл проведены по необходимости в диапазоне концентраций, которые имеют смысл по сравнению с концентрациями ругулозина, которые, как оказалось, являлись немного слишком высокими.
Через три месяца после инокуляции являлось невозможным детектировать вермикулин в отрицательных по ELISA образцах. Из положительных по ELISA сеянцев 30% содержали вермикулин. Этим впервые показали, что этот токсин продуцируется in vivo и может представлять собой один из эндофитов, используемых для инокуляции.
По существу все из эндофитов белой ели, выделенных в настоящем проекте в лаборатории Суссекса, культивировали и анализировали посредством ВЭЖХ по продукции метаболита. Из них 30 обладали интересными профилями на основании ответа детектора с диодной матрицей (измеряет УФ-спектр каждого соединения, проходящего через детектор). Экстракты с наиболее высоким общим количеством соединения подвергали скринингу с использованием Оксфордовского анализа для токсичности против дрожжей. Хотя дрожжи не являются насекомыми, Saccharomyces cerevisiae являются эукариотами. Из них пять продуцировали соединения с разумной активностью. Посредством ВЭЖХ, масс-спектроскопии и ЯМР показано, что соединения являются комплексными. Одно из них, 05-037A, являлось наиболее активным в анализе на дрожжах, и показано, что обнаруженные соединения являются комплексными и неродственными другим токсинам эндофитов, обнаруженным до настоящего времени. Их выращивали в крупномасштабной ферментации (5 л), экстрагировали и выделяли метаболиты с использованием различных способов, включая препаративную тонкослойную хроматографию, препаративную ВЭЖХ и колоночную хроматографию. Соединения все, как правило, являлись небольшими по молекулярной массе <350 (233, 237, 309, 221, 154, 218) и лежали в диапазоне от умеренно полярных до неполярных. Последняя необходимая стадия представляла собой дополнительную очистку для получения выделенного метаболита для полного определения структуры. Этот штамм выращивали в культуре в достаточном масштабе, чтобы позволять выделение и характеризацию его метаболитов.
Пример 11
Частота инокуляции и персистенция грибковых эндофитов
Десять инокулированных сеянцев, протестированных как положительные в испытании инокуляции в 2003 г., и 10 инокулированных сеянцев, которые являлись отрицательными по ELISA через 3 месяца, оставляли в горшках в питомнике для роста в течение дополнительного года. Каждую ветвь собирали отдельно для анализа посредством ELISA по ругулозину. Присутствовало вариабельное число ветвей (11-20), которые тщательно помечали в соответствии с их положением на каждом из 20 деревьев, и все анализировали по ругулозину (~160 образцов). Все инокулированные деревья, которые являлись отрицательными по ELISA, являлись положительными спустя приблизительно 1 год. Это показывает, что действительный успех инокуляции значительно занижен при анализе через 3 месяца. Эти данные также придают лучший смысл скорости распространения и, как наблюдали на деревьях в полевых условиях, подтверждают его персистенцию. Это являлось очень полезным, чтобы показать, что эндофит и его токсин хорошо распределяются между ветвями нового и старого роста.
Пример 12
Выделение токсикогенных эндофитов красной ели
Множество токсикогенных эндофитов, которые инфицируют белую ель, идентифицировали и частично секвенировали. Они включают в себя штаммы, идентифицированные в таблице 1. Кроме того, идентифицировали другие эндофиты белой ели и некоторые эндофиты красной ели, которые продуцируют токсины против насекомых. Целью являлось получить сравнительную коллекцию эндофитов красной ели и провести их скрининг по метаболитам против насекомых. Культивировали приблизительно 70 эндофитов и подвергали предварительному скринингу метаболитов. Получали фракции для гусениц листовертки-почкоеда и дополнительных химических анализов.
Экстракты из 70 штаммов эндофитов красной ели, так же как и некоторых штаммов эндофитов белой ели, для которых проводили качественный скрининг по продукции потенциальных метаболитов против насекомых и для которых существовали данные последовательности ДНК, включали в синтетический рацион. Их по отдельности наливали в небольшие контейнеры (молочники) и позволяли затвердеть. Гусениц листовертки-почкоеда елового на второй личиночной стадии добавляли в небольшие контейнеры, содержащие экстракты эндофитов, так же как содержащие контроли, и ругулозин использовали в качестве положительного контроля.
Тестированиями с использованием анализа гусениц листовертки-почкоеда елового обнаружили, что некоторые выделенные штаммы эндофитов являлись токсичными. Выделенные штаммы эндофитов, для которых обнаружили токсичность с использованием этого анализа, включают в себя 06-264A, 06-332A, 08-011D, 06-268A, 07-013D, 01-002A, 06-268A, 03-020B, 04-012A, 06-063D, 06-073C, 02-002C, 06-094E, 06-219A, 06-264A и 06-255A.

Пример 13
Выделение токсикогенных эндофитов
Эндофиты белой ели культивировали и анализировали посредством ВЭЖХ по продукции метаболита. Из них 30 обладали хорошими профилями на основании ответа детектора с диодной матрицей (измеряет УФ-спектр каждого соединения, проходящего через детектор). Экстракты с наиболее высоким общим количеством соединения подвергали скринингу с использованием Оксфордовского анализа для токсичности против дрожжей. Хотя дрожжи не являются насекомыми, Saccharomyces cerevisiae являются эукариотами. Из них пять продуцировали активные соединения. Посредством ВЭЖХ, масс-спектроскопии и ЯМР показано, что соединения являются комплексными. Одно из них, 05-037A, являлось наиболее активным в анализе на дрожжах (Vincent and Vicent, 1944, за исключением использования Saccharomyces cerevisiae) и показано, что обнаруженные соединения являются комплексными и неродственными другим токсинам эндофитов, обнаруженным до настоящего времени. Их выращивали в крупномасштабной ферментации (5 л), экстрагировали и выделяли метаболиты с использованием различных способов, включая препаративную тонкослойную хроматографию, препаративную ВЭЖХ и колоночную хроматографию. Соединения все, как правило, являлись небольшими по молекулярной массе <350 (233, 237, 309, 221, 154, 218) и лежали в диапазоне от умеренно полярных до неполярных. Последняя необходимая стадия представляла собой дополнительную очистку для получения выделенного метаболита для полного определения структуры. Этот штамм выращивали в культуре в достаточном масштабе, чтобы позволять выделение и характеризацию его метаболитов.
Всего 62 экстракта тестировали в анализе на гусеницах листовертки-почкоеда елового плюс большое число контролей для каждого набора. Из них 11 экстрактов для белой ели являлись токсичными для гусениц листовертки-почкоеда елового (т.е. статистически отличались от контролей либо по уменьшению массы (наиболее распространено), по ширине головной капсулы, либо по обоим параметрам). В случае экстрактов красной ели, 21 являлись токсичными для гусениц листовертки-почкоеда елового. Последовательность ДНК для выделенных токсикогенных изолятов красной ели перечислена в SEQ ID NO: 6-28.
Пример 14
Выделение и инокуляция токсикогенных эндофитов сосны
Иглы сосны собирали с сосновых деревьев. Медленно растущие эндофиты культивировали из игл и проводили скрининг по присутствию токсикогенных эндофитов. Получили антитела против токсикогенных эндофитов-кандидатов. Токсикогенные эндофиты-кандидаты тестировали in vitro по их эффекту на вредителей, включая вызывающие заболевание грибки, включая серянку сосны веймутовой. Эндофиты, которые являются токсикогенными in vitro, выбирали для тестов in vivo. Получали инокулят, содержащий токсикогенный эндофит. Сеянцы сосны инокулировали инокулятом в течение окна времени чувствительности. Колонизацию позднее подтверждали с использованием теста со специфическим антителом.
Пример 15
Сеянцы веймутовой сосны инокулировали токсикогенным эндофитом и колонизацию подтверждали, как описано в других местах. Колонизированные и контрольные иглы веймутовой сосны подвергали воздействию серянки сосны веймутовой. Повреждение оценивали и сравнивали с контролем. Колонизированные токсикогенным эндофитом сеянцы веймутовой сосны являлись устойчивыми к росту серянки сосны веймутовой и повреждению ею.
Пример 16
Авторы изобретения показали роль, которую играют эндофитные грибы для ограничения пасущихся на иглах хвойных.
Успешную экспериментальную инокуляцию сеянцев P. glauca продуцирующими токсин против насекомых эндофитами игл показали в предшествующих исследованиях, проводимых в вегетационных камерах и в условиях питомника с использованием раневой инокуляции (Miller et al., 2002; Sumarah et al., 2005). В предшествующих исследованиях присутствие грибка и его токсина на иглах уменьшало скорость роста C. fumiferana. Ряд исследований проведен с тех пор авторами изобретения с продуцирующим ругулозин эндофитом 5WS22E1 (DAOM 229536, CBS 120377), сначала опубликованным как продуцирующий (+) ругулозин Calhoun et al. (1992). На основании информации о последовательности ДНК этот грибок представляет собой вид Phialocephala, родственный штаммам, ранее опубликованным как эндофитные для ели европейской (Gruenig et al., 2002).
Ругулозин выделен из разнообразных грибов, включая штаммы хвойных эндофитов из штаммов, собранных авторами изобретения из Aschersonia samoensis P. Henn. (Watts et al., 2003), так же как из организма, ругулозин из которого опубликован впервые, Penicillium rugulosum Thom (Bouhet et al., 1976; Breen et al., 1955). Он является токсичным для личинок C. fumiferana на искусственном рационе (Calhoun et al., 1992) и в иглах (Miller et al., 2002). Ругулозин опубликован как токсичный для Drosophila melanogaster (Dobias et al., 1980) и для клеток яичника совки травяной, Spodoptera frugiperda (Watts et al., 2003). На основании ограниченных исследований ругулозин обладает очень низкой токсичностью для млекопитающих (LD50 55 мг кг-1 BW ip у мышей и 44 мг кг-1 BW у крыс; Ueno et al., 1971). Ругулозин не являлся цитотоксическим для клеток HepG2 (клетки гепатомы человека; Watts et al., 2003). Он опубликован многими авторами как антибиотик против как грамположительных, так и грамотрицательных бактерий (например, Stark et al., 1978) и является умеренно противогрибковым (Breen et al., 1955).
Авторы изобретения исследовали распространение и персистенцию эндофита и его токсина в деревьях, поддерживаемых в питомнике, так же как в полевых условиях. Кроме того, показаны некоторые данные о токсичности ругулозина для некоторых других видов растительноядных насекомых на P. glauca.
Материалы и методы
Эффекты ругулозина в рационе на личинки различных насекомых
Личинки C. fumiferana (гусеница листовертки-почкоеда елового) получили из Insect Production Services, Forestry Canada (Sault Ste. Marie, ON) и хранили при 5°C. Для каждого теста выводили достаточное число личинок и помещали в молочники, содержащие 15 мл искусственного рациона. Рацион получали собственного производства (McMorran, 1965). Молочники помещали в вегетационную камеру при 22°C, 55% RH с 16 час света/сутки, пока личинки не достигали второй/третьей личиночной стадии (McGugan, 1954). Получали подходящее количество рациона, и 4 аликвоты разливали в колбы. Получали разведения чистого ругулозина в 95% этаноле для получения необходимых концентраций (540 мкл раствора в этаноле плюс контроль - носитель) и добавляли в колбы, соответственно. Рацион перемешивали с помощью мешалки и посредством пипетки, используемой для разливания среды. Две капли горячего жидкого рациона добавляли с помощью 10 мл стерильной пипетки (0,1 г сухой массы) в 4-мл конусовидные пластиковые чашки для образцов (Fisher Scientific #025444, #25444A). Пробирки, содержащие рацион и токсин, лиофилизировали для удаления этанола и регидратировали с помощью 60 мкл стерильной воды. Одну личинку помещали в каждую пробирку, которую возвращали в вегетационную камеру для кормления в течение 4 сут. Спустя 4 суток всех личинок замораживали и взвешивали на аналитических весах Mettler 163 (±0,02 мг). Предыдущие исследования показали, что замороженная масса во влажном состоянии коррелировала с сухой массой (p<0,001). Ширину головных капсул определяли с использованием стереомикроскопа при 40 × с окуляром и многоступенчатым микрометром. C. fumiferana тестировали в двух обработках, первая с концентрациями 5, 10 и 50 мкМ (75 насекомых на тестируемую концентрацию), а вторая с концентрациями ругулозина 25, 50 и 100 мкМ (75 насекомых на тестируемую концентрацию), которые повторяли.
Яйца Lambdina fiscellaria (пяденицы гемлоковой) закупали из Forestry Canada в трех партиях. Яйца инкубировали при комнатной температуре в течение 10 сут до появления личинок. Личинки из каждой партии появлялись в пределах двух суток друг от друга, и их немедленно помещали на рацион в молочниках, как выше. После того, как они вырастали до второй личиночной стадии (~1 неделя), личинки помещали в тестовые пробирки, следуя такому же способу, как для C. fumiferana в диапазоне концентраций 5, 10 и 50 мкМ ругулозина для первого теста и 10, 50, 100 и 150 мкМ для второго теста, которые повторяли (~67 личинок на концентрацию). После 1 недели на тестируемых рационах личинок замораживали, взвешивали и определяли ширину головной капсулы.
Личинки Zeiraphera canadensis (листовертки-почкоеда елового) собирали из дикой природы около Суссекса в середине июня. Их немедленно помещали в тестовые пробирки и тестировали при концентрациях ругулозина 10, 50, 100 и 150 мкМ (75 на концентрацию). Через семь суток выживших личинок замораживали и измеряли.
Подготовка деревьев и испытательного участка
Описание деревьев и способов инокуляции, используемых в этих экспериментах, приведены в Sumarah et al. (2005). Триста (некоторые из исходных 330 положительных погибли) положительных по эндофиту/токсину деревьев от Sumarah et al. (2005) рассевали с большими промежутками, чем обычно, на опытном участке приблизительно 30 км от Суссекс, NB, Канада. Участок обладал отличными характеристиками почвы и однородностью. Исходный тип древостоя представлял собой смешанный лес с красной елью, бальзамической пихтой, березой белой, березой желтой и кленом сахарным. Участок подготавливали для посадки с использованием одного прохода катушечного высевающего аппарата Marden и другого прохода с анкерными цепями и барабанами с лопастями в виде акульих плавников. Половину сеянцев высаживали в часть вспаханного массива, который хорошо просушивали, а другую половину высаживали в более влажную область с некоторым просачиванием воды.
Один год спустя 250 (в возрасте пятнадцати месяцев) неинокулированных сеянцев получали, как описано ранее, из программы генетического улучшения J. D. Irving Ltd. (Sumarah et al., 2005). Их выращивали в теплице и затем перемещали в зону ожидания на открытом воздухе, где они перезимовывали. Пять из этих неинокулированных сеянцев (высотой 20-30 мм) высаживали вблизи каждого из 50 случайно выбранных деревьев из 300 высаженных в этом участке поля. После этого сетки из стекловолокна, содержащие площадь 0,25 м2, помещали вблизи следующих 50 тестируемых деревьев для сбора опадающих игл.
Позже целые ветви, представляющие каждый класс возраста игл, собирали и замораживали от 8 случайно выбранных деревьев из исходных 300, высаженных в участке поля. В листопад следующего года собирали сходные образцы и замораживали из 8 различных деревьев из участка поля, включая ветви из классов игл от одного до трех лет (деревья были больше). Кроме того, два из маленьких сеянцев, высаженных вблизи области деревьев предыдущего года, собирали из окружения трех отобранных тестируемых деревьев. Опадающие иглы из всех доступных сеток собирали в оба года как пулированные образцы, из которых инородные материалы (камни, листья и т.д.) удаляли вручную.
Распределение эндофита внутри дерева
Отдельный набор из 1100 сеянцев (ранее не опубликованный) инокулировали по Sumarah et al. (2005). Через восемь месяцев их тестировали на колонизацию эндофитами по ELISA, как описано ранее. Затем эти деревья переносили в горшки и позволяли расти в питомнике Суссекса. Приблизительно через семь месяцев каждую ветвь из 10 положительных по эндофиту сеянцев и 10 отрицательных по эндофиту деревьев (на основании ранее проведенного теста ELISA) собирали, помещали в стерильные пластиковые пакеты, тщательно помечали в соответствии с высотой и направлением по компасу и замораживали.
ELISA и анализы ругулозина
Иглы удаляли с ветвей, лиофилизировали и использовали как для анализа с антителом, так и для анализа токсина по Sumarah et al. (2005). Относительное стандартное отклонение положительного контроля составляло ~9%. Предел способа детекции (LOD) клеточной массы (например, для детекции антителом) составлял 60 нг г-1, и предел количественного определения (LOQ), т.е., положительный, составлял 120 нг г-1 сухой массы иглы. LOD и LOQ для ругулозина оба составляли 150 нг г-1 (Sumarah et al., 2005).
По окончании большого числа анализов игл обнаружили, что некоторые образцы содержали стехиометрически полученный (1:1) продукт деградации, возникающий как функция от задержки высушивания (100% превращение через одну неделю). В условиях ВЭЖХ, описанных выше, это соединение элюировалось за 30 сек (УФ макс.: 210, 240, 275, 326 нм) до ругулозина (УФ макс.: 210, 254, 389 нм). Материал анализировали масс-спектрометрией с использованием тройного квадрупольного масс-спектрометра с прямой инъекцией и электрораспылением (Micromass), LC/MS с использованием времяпролетного масс-спектрометра LCT (Micromass) и LC/MS на QTOF (Micromass). Не достигли консенсуса относительно молекулярной массы, поскольку молекула не ионизировалась систематически ни на одном из используемых аппаратов. Анализы ЯМР проводили на спектрофотометре Bruker Advance 700 МГц (COSY, HSQC и HMBC). Эти данные показали, что соединение содержало кольцо с 4 соседними атомами водорода и двумя O-метильными группами, что химически согласуется с тем, что ругулозин распадается на два и подвергается перегруппировке. При возникновении продукта деградации значение добавляли к общему значению.
Статистические анализы проводили с помощью SYSTAT в. 10.2 (San Jose, CA). Для статистических целей иглы, которые являлись отрицательными по ругулозину, но положительными по ELISA, вводили как предел детекции. Отрицательные значения вводили как половину предела детекции.
РЕЗУЛЬТАТЫ
Тестирование насекомых
Личинки C. fumiferana, питавшиеся >25 мкМ ругулозином, весили значимо меньше, чем соответствующие контроли по ANOVA (25 мкМ: p=0,027, 50 мкМ: p=0,001 и 100 мкМ: p<0,001). Личинки, питавшиеся 100мкМ ругулозином в рационе, также обладали значимо уменьшенной головной капсулой (p=0,008). Данные уровни значимости приведены для второго испытания и являлись сходными с повторами.
Личинки L. fiscellaria, питавшиеся ≥50 мкМ, весили значимо меньше, чем соответствующие контроли. Во время второго теста массы L. Fiscellaria, питавшихся ругулозином, являлись значимо ниже контрольных (ANOVA, 50 мкМ: p=0,030, 100 мкМ: p=0,081 и 150 мкМ: p=0,001). Для третьего испытания результаты являлись сходными (50 мкМ: p=0,034, 100 мкМ: p=0,046 и 150 мкМ: p=0,001). Личинки, питавшиеся 150 мкМ ругулозина в рационе, также обладали значимо уменьшенной головной капсулой (p=0,028).
Личинки Z. canadensis не представлены систематически, поскольку их собирали в дикой природе. Многие (60%) погибли от грибковых инфекций (Aspergillus fumigatus) и других неизвестных причин в ходе культивирования. Массы личинок между группами контроля и обработки (10, 50, 100 и 150 мкМ ругулозина) не различались значимо по ANOVA (LSD, Тьюки). Однако с использованием теста знакового рангового критерия Уилкоксона для согласованных пар личинки, питавшиеся 100 или 150 мкМ ругулозина в рационе, являлись более легкими, чем личинки, питавшиеся 10 мкМ ругулозином и контрольными рационами (p<0,10). Из-за высокого процента контаминированных A. fumigatus личинок в эксперименте неожиданным результатом являлась противогрибковая активность, наблюдаемая выше 50 мкМ, в немногих пробирках присутствовал рост грибков в тестах при 100 мкМ и 150 мкМ ругулозине. Breen et al. (1955) опубликовали, что ругулозин является умеренно противогрибковым.
Результаты образцов с тестируемых полевых участков
Образцы отбирали приблизительно через 3,5 и 4,5 года после инокуляции, как раз более одного и двух лет в полевых условиях, соответственно. На это время деревья составляли в высоту 1-1,25 м и 1,5-1,75 м. С каждого из восьми деревьев выбирали ветвь с каждым из классов игл в возрасте одного, двух и трех лет (всего 24 ветви). Все образцы игл с 24 ветвей являлись положительными по ELISA, и 96% содержали поддающийся детекции ругулозин через один год в полевых условиях и 3,5 года после инокуляции. Средняя концентрация, с поправкой на восстановление структуры, составляла 1,0 мкг г-1, и концентрации ругулозина из игл каждого класса возраста являлись фактически идентичными. Из 8 различных деревьев, собранных, как выше, через 4,5 года после инокуляции (всего 24 ветви), 40% образцов являлись положительными по ELISA, однако 100% содержали ругулозин. Средняя концентрация с поправкой на восстановление структуры составляла 0,7 мкг г-1, и концентрации ругулозина из игл каждого класса возраста снова являлись фактически идентичными. Все шесть из образцов игл из неинокулированных сеянцев, которые высаживали непосредственно под тремя положительными деревьями в полевых условиях, являлись положительными по ругулозину со средней концентрацией с поправкой на восстановление структуры 1,1 мкг г-1 (5/6 являлись положительными по ELISA).
Не детектировали ругулозин в опавших иглах, собранных в сетях вблизи этих деревьев, отобранных в какой-либо год. Образцы, отобранные от деревьев после первого года, являлись положительными по ELISA, и на второй год, они являлись отрицательными.
Распределение эндофита внутри дерева
От 11 до 20 ветвей извлекали для каждого из 20 деревьев через 15 месяцев после инокуляции. Приблизительно 90% ветвей от 10 положительных по ELISA деревьев протестировали как положительные по грибку и/или токсину. Из сеянцев, которые тестировали как отрицательные за 11 месяцев перед этим, через 4 месяца после инокуляции, 75% ветвей являлись положительными по грибку и/или токсину через 15 месяцев. Существовало различие в доле ложноотрицательных по ELISA по сравнению с присутствием ругулозина по анализу токсина между двумя группами. Доля составляла приблизительно 2x долю в неинокулированных деревьях, которые исходно тестировали по ELISA как отрицательные, по сравнению с теми, которые тестировали как положительные (p>0,036). Поскольку все деревья являлись колонизированными, данные объединяли. Среднее арифметическое концентрации ругулозина (с поправкой на восстановление структуры) составляло 0,6 мкг г-1 и среднее геометрическое составляло 0,8 мкг г-1 (фигура 9).
Обсуждение
Авторы изобретения показали эффекты ругулозина из эндофита видов Phialocephala на растительноядных насекомых, распределение внутри дерева инокулированных эндофитов, персистенцию эндофита и токсина и распределение эндофитов на соседние сеянцы.
Этот анализ подтвердил токсичность ругулозина для C. fumiferana и других насекомых, помещая эффективную концентрацию на 25 мкМ (p=0,027 для уменьшения массы по сравнению с контролями). В используемых условиях L. fiscellaria являлись пораженными при концентрациях ругулозина в рационе между 25 и 50 мкМ. Тесты с собранными в дикой природе Z. canadensis являлись незаконченными, поскольку высокий процент собранных в дикой природе личинок являлся инфицированным A. fumigatus. Однако это насекомое также являлось пораженным ругулозином в таком же порядке диапазона концентраций, как и другие виды насекомых. Как отмечено, токсичность в рационе ругулозина для D. melanogaster лежала в таком же диапазоне (50 мкМ; Dobias et al., 1980). Ругулозин будет также оказывать желательный токсичный эффект на ряд лесных вредителей изнутри колонизированных игл.
Результаты настоящего эксперимента, проведенного в питомнике, показали ряд важных обнаружений. Через 15 месяцев после инокуляции деревья являлись основательно колонизированными, где только 32 ветви из 320 протестировали как отрицательные по пределам детекции двух способов. Однако, оказалось также, что подавляющее большинство (75%) деревьев, протестированных как отрицательные по ELISA через три месяца после инокуляции, также являлись положительными после более длительного периода в питомнике. Кроме того, присутствовали признаки существования различий в производительности ELISA из-за различий поглощающих УФ-соединений в иглах. Цвет игл может меняться из-за внешних условий или по генетическим причинам. Настоящее исследование обеспечивает качественную перспективу. Однако доминирующий эффект относится к чувствительности двух способов, которая тем не менее составляла 100 ppb (60 и 150 нг г-1) по отношению к степени колонизации. Таким образом, показано, что эндофит и его токсин хорошо распространены между ветвями через 15 месяцев после инокуляции.
Деревья, высаженные в полевых условиях, выбирали для высаживания на основании ответа по ругулозину и ELISA. Через три с половиной года никакие иглы не будут образовываться из тканей, присутствующих на время инокуляции. Обнаружено, что фактически все образцы игл из трех классов возраста игл из двух различных групп деревьев содержали ругулозин.
Через один год после высаживания ограниченная выборка из маленьких сеянцев, высаженных непосредственно под деревьями (т.е. в зоне, где будут опадать иглы), вся являлась колонизированной. Изобретение предоставляет первое доказательство, что эндофиты игл хвойных переносятся вертикально.
Во всех трех группах деревьев концентрации ругулозина в иглах составляли приблизительно 1 мкг г-1. Теоретически это концентрация порядка 10 мкМ. По сравнению с данными по эффективным концентрациям in vitro это концентрация приблизительно правильного порядка величины для предсказанного эффекта роста насекомых, сопоставимая с результатами, полученными в вегетационных камерах (Miller et al., 2002). В искусственном рационе присутствует неограниченный запас питательных веществ, который обычно является защитным от токсичных эффектов низкого уровня в любой модели на животных. Трудно узнать распределение токсина in planta. Сканирующие электронные микрофотографии показывают, что мицелий эндофита широко занимает межклеточное пространство игл бальзамической пихты (Johnson & Whitney, 1989). Известно, что концентрации экскретированных токсинов являются наибольшими около мицелия (например, Morita et al., 1984). Это позволяет предполагать, что концентрации, с которыми насекомые сталкиваются в перевариваемом материале, могут являться немного более высокими. Низкие концентрации в иглах могут являться достаточными для уменьшения роста вредителей.
Отсутствие поддающегося детекции токсина в опадающих иглах соответствовало ожиданиям. Поскольку микотоксины представляют собой природные продукты, они быстро деградируют при контакте с почвой (например Binder et al., 1996; Mortensen et al., 2006). Опавшие иглы сохраняют токсикогенных эндофитов в течение достаточного времени, чтобы позволить вертикальную передачу.
Таким образом, авторы изобретения показали, что медленный рост эндофитов хвойных ограничивает раннюю детекцию после колонизации. После инокуляции тестируемый эндофит распространяется по развивающемуся дереву, персистирует в полевых условиях по меньшей мере в течение четырех лет. Кроме того, авторы изобретения показали уменьшение массы тела как для C. fumiferana, так и для L. fiscellaria при 25 и 50 мкМ ругулозина, соответственно, и головные капсулы являлись уменьшенными при 100 и 150 мкМ. Z. canadensis являлись более легкими при тестировании с 100 и 150 мкМ ругулозина по сравнению с контролями.
Пример 17
Токсичные метаболиты, продуцируемые эндофитными грибками (виды Epichloë и Neotyphodium) в овсянице сильно уменьшают популяции связанных растительноядных насекомых. Это оказывает значительный благоприятный эффект на приспособленность растения. Эти грибы продуцируют различные алкалоиды, влияющие на рост травоядных (насекомых, млекопитающих; Clay and Schardl, 2002) и их обнаружили в тканях растений в диапазоне 1-30 мкг г-1 (Rottinghaus et al., 1991; Spiering et al., 2005). Существуют некоторые доказательства для передвижения токсинов, так же как для возможной роли ферментов растений в изменении их структур (Spiering et al., 2005). Существует также одно сообщение, что присутствие эндофита напрямую влияет на рост нематоды, которая повреждает один вид травы, независимо от токсинов (Panaccione et al., 2006).
Авторы изобретения исследовали роль эндофитов в P. glauca (белая ель) для ограничения пасущихся на иглах хвойных C. fumiferana и некоторых других видов насекомых. C. fumerana является главным циклическим вредителем деревьев ели и пихты, особенно на северо-востоке США и Канады (Royama et al., 2005). В течение двух десятилетий авторы изобретения собирали эндофитов листвы хвойных из леса Акадии и исследовали их по способности продуцировать соединения, токсичные для личинок C. fumerana.
Успешную экспериментальную инокуляцию сеянцев P. glauca эндофитом игл 5WS22E1 (DAOM 229536, CBS 120377), который продуцирует ругулозин, авторы изобретения показали в исследованиях, проводимых в вегетационных камерах и в условиях питомника с использованием раневой инокуляции. На основании информации о последовательности ДНК этот гриб представляет собой вид Phialocephala, родственный штаммам, ранее опубликованным как эндофитные для ели европейской (Grunig et al., 2002). Выращенные в условиях питомника, образцы игл от инфицированных деревьев в возрасте двух лет содержали 0,15-24,8 мкг г-1 ругулозина со средней геометрической концентрацией 1 мкг г-1. Авторы изобретения показали, что молодые деревья обладали равномерным распределением токсина, с разницей в концентрации преимущественно между индивидуумами. Со старением деревьев присутствовала разница между ветвями по концентрации ругулозина. После однократной инокуляции в виде сеянцев деревья в тестируемом участке поддерживали сходные концентрации ругулозина в иглах через 5 лет после инокуляции.
При исследованиях в вегетационной камере наличие грибка и его токсина в иглах уменьшало скорость роста C. fumerana. In vitro ругулозин уменьшал массу тела и/или влиял на развитие личиночной стадии у C. fumerana (Calhoun et al., 1992), Lambdina fiscellaria и Zeiraphera canadensis при концентрациях в рационе в диапазоне 50 мкМ. Исследование показало, что сходные концентрации ругулозина в иглах уменьшали рост C. fumerana в выращенных в питомнике деревьях.
Материалы и методы
Эксперименты в питомнике: Тесты проводили в лесном питомнике Суссекса J. D. Irving, Limited в Нью-Брансуик, Канада (45° 43' N, 65° 31' W; высота 21,30 м). В два последовательных года несколько сотен сеянцев, выращенных в контейнерных кассетах в контейнерах блоков горшков для 67 сеянцев, инокулировали продуцирующим ругулозин эндофитом 5WS22E1 (DAOM 229536; CBS 120377). Описание популяций, высаживания и способы инокуляции P. glauca, используемые в этих экспериментах, даны в Sumarah et al. (2005). Все деревья помечали 9-значными кодами, и все измерения проводили со слепыми образцами.
Сеянцы в возрасте трех лет: Первую группу высевали и инокулировали приблизительно два месяца спустя. После четырех месяцев в теплице их тестировали по колонизации эндофитом посредством ELISA (Sumarah et al., 2005) и сегрегировали. Вместе со свободными от 5WS22E1 сеянцами из того же посева положительную по эндофитам группу поддерживали в коммерческих условиях, как известно в данной области. Через один год все сеянцы пересаживали в пластиковые горшки и содержали в участке питомника в течение еще одного года после инокуляции.
Сеянцы в возрасте четырех лет: Вторая группа была из тестового посева и инокулирована приблизительно 12 недель спустя. Их тестировали по инфекции эндофитом через 4 месяца роста посредством ELISA. Сеянцы переносили в горшки через один год и содержали, как выше.
Эксперимент 1 с более молодыми деревьями : Он включал в себя 100 деревьев, 50 из которых инфицировали эндофитом, и сходную контрольную группу. Пять личинок на второй личиночной стадии помещали на боковую ветвь первого года на побегах с почками на каждом дереве с использованием тонкой художественной кисти (нейлон #5). Почки набухали, когда вводили личинок. Насекомых получали в виде личинок на второй личиночной стадии из Insect Production Services, Natural Resources Canada, Canadian Forest Service (Sault Ste. Marie, ON) и сохраняли при 5°C до использования. Все дерево (экспериментальную единицу) покрывали мешком из сетки (нарезанный материал полиэфирных драпировок), полученным по Parsons et al. (2005), как для положительных, так и для отрицательных по эндофиту деревьев.
Эксперимент 2 с более старшими деревьями
Двух гусениц листовертки-почкоеда помещали, как выше, на каждую из ветвей в возрасте 3 или 4 лет на побегах с почками на каждом из 48 деревьев в возрасте четырех лет. Затем каждую ветвь (экспериментальную единицу) покрывали мешком из сетки (фигура 10). Этот эксперимент позволял факторный анализ вариаций концентрации ругулозина между деревьями (различия в химическом составе игл из-за истории освещенности, класса игл и т.д.) и между ветвями.
Двух гусениц листовертки-почкоеда помещали, как выше, на каждую из ветвей в возрасте 3 или 4 лет на побегах с почками на каждом из 48 деревьев в возрасте четырех лет. Затем каждую ветвь (экспериментальную единицу) покрывали мешком из сетки (фигура 10). Этот эксперимент позволял факторный анализ вариаций концентрации ругулозина между деревьями (различия в химическом составе игл из-за истории освещенности, класса игл и т.д.) и между ветвями.
Использование слишком многих насекомых будет приводить к дефолиации деревьев независимо от присутствия токсина, в большинстве, если не во всех обработках. Число гусениц листовертки-почкоеда на деревьях двух размеров в настоящем исследовании основано на данных от Parsons et al. (2005). Они показали, что наименьшее поддающееся детекции повреждение бальзамической пихты личинками пилильщика на ранней личиночной стадии происходило при плотности 50 личинок/м2 ветви.
Датчики температуры (Hobo Dataloggers, Onset Computer Corporation, Pocasset, MA) помещали в область содержания, и мониторировали прогрессирование, пока гусеницы листовертки-почкоеда не становились старше, чем шестая личиночная стадия. При завершении всех насекомых, которых удалось найти, собирали и замораживали индивидуально. Их взвешивали на аналитических весах Mettler PJ360 (±0,02 мг). Предыдущие исследования показали, что замороженная масса во влажном состоянии коррелировала с лиофилизированной массой (n=134 животных, корреляция Пирсона r=0,841, P с коррекцией по Бонферрони <0,0001). Ширину головных капсул определяли с использованием стереомикроскопа при 40 × с окуляром и многоступенчатым микрометром. После сбора гусениц листовертки-почкоеда деревья опрыскивали инсектицидом, чтобы убедиться, что не выжило личинок, способных убежать.
Оба эксперимента останавливали 1 месяц спустя и 5-6 боковых ветвей извлекали из деревьев в возрасте трех лет и замораживали. Ветви, где гусениц листовертки-почкоеда собирали с деревьев в возрасте четыре года, извлекали и замораживали по отдельности. Иглы удаляли со всех ветвей по отдельности, лиофилизировали и использовали для определения инфекции посредством ELISA и ругулозина по Sumarah et al. (2005). Предел детекции способа (LOD) для клеточной массы составлял 60 нг г-1, предел количественного определения (LOQ), т.е. положительный, составлял 120 нг г-1 сухой массы иглы для детектора антитела. The LOD и LOQ для ругулозина оба составляли 150 нг г-1.
ANOVA с тестом Тьюки-Крамера проводили для массы и ширины головной капсулы насекомых с деревьев в возрасте трех лет с использованием программного обеспечения NCSS 2004 (Kaysville, UT). T-тест с равными дисперсиями также проводили для масс с использованием того же программного обеспечения.
Для деревьев в возрасте четырех лет насекомых стратифицировали на собранных с игл с концентрациями токсина ниже уровня эффекта токсичности в рационе, для ругулозина 0,5 мкг г-1, и насекомых с игл с концентрациями >0,5 мкг г-1. Это основано на низком наблюдаемом уровне эффекта ругулозина в рационе для C. fumerana в синтетическом рационе (приблизительно 50 мкМ; Calhoun et al., 1992), скорректированном на среднее соотношение сухая масса : масса во влажном состоянии для игл. Для статистических целей иглы, которые являлись отрицательными по ругулозину, но положительными по ELISA, вводили как предел детекции. Значения ниже предела детекции вводили как половину предела детекции. Общепринятые статистические тесты для оставшихся данных, так же как парные t-тесты, знаковый ранговый критерий Уилкоксона и ANOVA проводили для данных для деревьев в возрасте четырех лет с использованием SYSTAT в. 10.2 (San Jose, CA).
Средняя температура составляла 18,4±2,2°C, начинаясь с 15-17°C и поднимаясь до 23°C в последние несколько суток эксперимента. Не присутствовало значимой разницы между средними температурами с мониторов, помещенных с деревьями в возрасте трех или четырех лет (P=0,05). Минимальные температуры являлись сходными, однако, средние максимальные температуры являлись немного более высокими (P=0,05) для монитора среди деревьев в возрасте трех лет по сравнению с более старшими деревьями. Фактически все собранные насекомые были на 6й личиночной стадии.
Деревья в возрасте трех лет : Анализ ELISA контрольной группы выявил, что 5 из отрицательных по эндофиту деревьев являлись положительными через 36 месяцев, т.е. являлись ложноотрицательными при предварительном тестировании. Эти шесть исключены из анализа. Среднее геометрическое концентрации токсина с поправкой на восстановление структуры в положительной по эндофиту группе составляло 0,85 мкг/г. Число гусениц листовертки-почкоеда, выделенных на дерево, составляло 3,3 для инфицированных (всего 161) и 3,5 для неинфицированных деревьев (всего 152). Анализ переменных показал, что массы обработанных и контрольных гусениц листовертки-почкоеда являлись значимо различными (P=0,018; DF=1; F-отношение 5,64). Распределение масс насекомых между инфицированными и неинфицированными эндофитом деревьями в возрасте трех лет показано на фигуре 11. Средняя масса при завершении составляла для контролей 0,061±0,02 мг и 0,055±0,02 мг для собранных на инфицированных деревьях. Это различие являлось статистически различным (P=0,009, t-тест с равными дисперсиями). Средняя ширина головных капсул для контролей составляла 1,89±0,21 мм и 1,90±0,18 мм. Это значимо не отличалось по ANOVA.
Деревья в возрасте трех лет : Среднее геометрическое концентрации ругулозина с поправкой на восстановление структуры составляло 0,8 мкг г-1 во всех образцах, и среднее для положительных ≥0,5 мкг г-1 составляло 1,3 мкг г-1. По ANOVA не присутствовало значимого взаимодействия между деревом и массой насекомых, или деревом и концентрацией ругулозина. Средняя масса для 166 насекомых, собранных с деревьев в возрасте четырех дет, составляла 0,072±0,02 мг. С учетом ветвей выше и ниже 0,5 мкг г-1 существовала обратная связь между концентрацией ругулозина и массой гусениц листовертки-почкоеда (корреляция Пирсона -0,288; P с коррекцией по Бонферрони = 0,023). Ширина головной капсулы в среднем составляла 1,95±0,15 мг.
В среднем выделяли 1,4 гусеницы листовертки-почкоеда из двух исходных, помещенных на каждую ветвь. Когда ветви стратифицировали на квартили по концентрации ругулозина (40 в каждой), доля ветвей с одной гусеницей листовертки-почкоеда являлась более низкой между нижней и тремя верхними квартилями (знаковый ранговый критерий Уилкоксона, P=0,025).
Если не принимать во внимание несколько деревьев, где гусениц листовертки-почкоеда собирали только с одной ветви, деревья попадали в одно из трех распределений. Наибольший процент (38%) включал ситуацию, где все ветви находились выше порога токсичности ругулозина, и 16% все находились ниже порога. Ни в том, ни в другом случае не присутствовало вариаций внутри дерева для исследования. Остальные обладали отдельными ветвями выше и ниже порога. Типичные данные для деревьев с множеством анализированных ветвей показаны в таблице 4. Все три ветви, анализированные на дереве 1034, обладали концентрациями далеко сверх порога токсичности. Выделили только одну гусеницу листовертки-почкоеда на ветвь, и животное с ветви с самой низкой концентрацией обладало наибольшей массой, выше среднего, указанного выше. Одна ветвь с дерева 1360 находилась далеко сверх порога токсичности. В этом случае масса собранного насекомого являлась средней. С двух оставшихся ветвей собрали двух насекомых со средней массой как среднее. Сходную картину можно было наблюдать для дерева 2022.
Обсуждение
Авторы изобретения исследовали два аспекта эффекта ругулозина на рост C. fumerana на иглах в условиях питомника на открытом воздухе. Первый представлял собой сравнение влияния на рост гусеницы листовертки-почкоеда на инфицированных деревьях и неинфицированных деревьях. Второй представлял собой использование группы более старших деревьев, так что иглы с инфицированного дерева служили контролем. Этот способ, как правило, используют в токсикологии для исключения возможных смешанных переменных, возникающих из-за вариаций внутри индивидуума. Этого можно ожидать в результате потенциальных изменений в химическом составе игл из-за вариаций, включая возраст и затенение игл, и сам грибок. Авторы изобретения показали зависимый от дозы ответ на ругулозин.
Известно, что затенение (Lhotakova et al., 2007) и возраст игл, так же как условия почвы влияют на состав листвы, и это, в свою очередь, может влиять на рост гусениц листовертки-почкоеда (Carisey and Bauce, 1997; Clancy et al., 2004; Nealis and Nault, 2005). Деревья, используемые в настоящих исследованиях, представляют собой разнообразную генетическую популяцию, используемую для возобновления лесонасаждений в восточной Канаде и Мэне. В исследованиях в вегетационной камере присутствие грибка и его токсина на иглах уменьшало рост C. fumerana. Эти последние эксперименты проводили с использованием нетронутых игл с сеянцев в возрасте четырех месяцев с использованием разработанного способа для скрининга изменений в устойчивости листвы (Miller et al., 2002). Настоящие эксперименты проводили посредством помещения гусениц листовертки-почкоеда на деревья, растущие на открытом воздухе.
Хотя предпринята попытка остановить эксперимент, так чтобы приблизительно 20% находилось на 6-й личиночной стадии, чтобы присутствовало распределение личиночных стадий, фактически все находились на 6-й личиночной стадии. Это имело место, возможно, из-за более высоких температур в последние 24 часа экспериментов по сравнению с предыдущей неделей. Средняя ширина головных капсул составляла ~1,94 мм. Это значение находится на верхней границе значения, обнаруженного в природе. McGugan (1954) опубликовал, что средняя ширина головных капсул по эпидемическим данным в природе в северо-западном Онтарио составляла 1,63 мм для самцов и 1,79 мм для самок. Опубликовано, что сборы в полевых условиях из Нью-Брансуика составляли 1,66 мм, без указания пола (Anon. 1981. Data Fact Sheet, Determination of spruce budworm larval stage; CANUSA Spruce Budworm Program). Это различие может являться связанным с фактом, что животные, используемые в этом эксперименте, являлись свободными от паразитов и заболеваний в отличие от ситуации в природе (см. нижеследующее).
Распределение масс животных, собранных на инфицированных иглах, при окончании являлось отличным от соответствующих контролей (фигура 11). Присутствовала также статистически значимая разница в массах гусениц листовертки-почкоеда между двумя группами. Как и в вегетационной камере, присутствие грибка и его токсина снижало рост C. fumerana. Подобные эксперименты для инфицированных и неинфицированных эндофитов травы приводили в результате к сходным обнаружениям, так же как к эффектам на развитие (например, Hardy et al., 1986).
Вторым аспектом настоящих экспериментов являлось использование более старших деревьев, для которых можно наблюдать эффект на рост гусениц листовертки-почкоеда на множестве ветвей с одного и того же одного инфицированного дерева. Это являлось возможным, поскольку как в настоящем, так и в предыдущем экспериментах, наблюдали различия в концентрации ругулозина между индивидуальными ветвями в пределах отдельных деревьев. Как обнаружено ранее, концентрация ругулозина на молярной основе, как правило, превышала концентрацию, влияющую на рост C. fumerana, Lambdina fiscellaria и Zeiraphera canadensis in vitro. Для этого компонента исследования наблюдали два эффекта.
Сравнение этих ветвей с концентрациями выше и ниже порога токсичности ругулозина показало, что присутствовала обратная связь между массой гусениц листовертки-почкоеда и концентрацией ругулозина (-0,288; P=0,023). Дополнительная поддержка этого заключения поступает из факта, что на ветвях с наиболее высокими концентрациями ругулозина выживаемость являлась значительно более низкой, чем на ветвях с более низкими концентрациями. Кроме того, присутствовало небольшое, но значимое увеличение массы в популяции выживших, обнаруженных на ветвях в квартили ветвей с наиболее высокой концентрацией ругулозина. Известно, что когда C. fumerana находятся при ограничениях питательных веществ, они будут прибегать к каннибализму, который предоставляет правдоподобное объяснение последнему наблюдению. Тем не менее, еще существовало доказательство зависимости от дозы ругулозина, где собирали отдельных животных (например, дерево 1034B).
На синтетическом рационе (Calhoun et al., 1992) присутствие ругулозина при приблизительно 50 мкМ приводит к снижению скорости роста C. fumerana. С использованием правила совокупности доказательств в токсикологии эффекты, наблюдаемые в этом исследовании, большей частью объясняются посредством токсина и согласуются с другими взаимодействиями эндофитов, которые изучали.
Таким образом, впервые авторы изобретения показали, что присутствие эндофита листьев хвойных и его токсина, ругулозина, в деревьях, выращенных в условиях продукции, приводят к уменьшенному росту C. fumerana зависимым от дозы образом. Кроме того, эти эксперименты показывают, что эффект в первую очередь объясняется ругулозином.
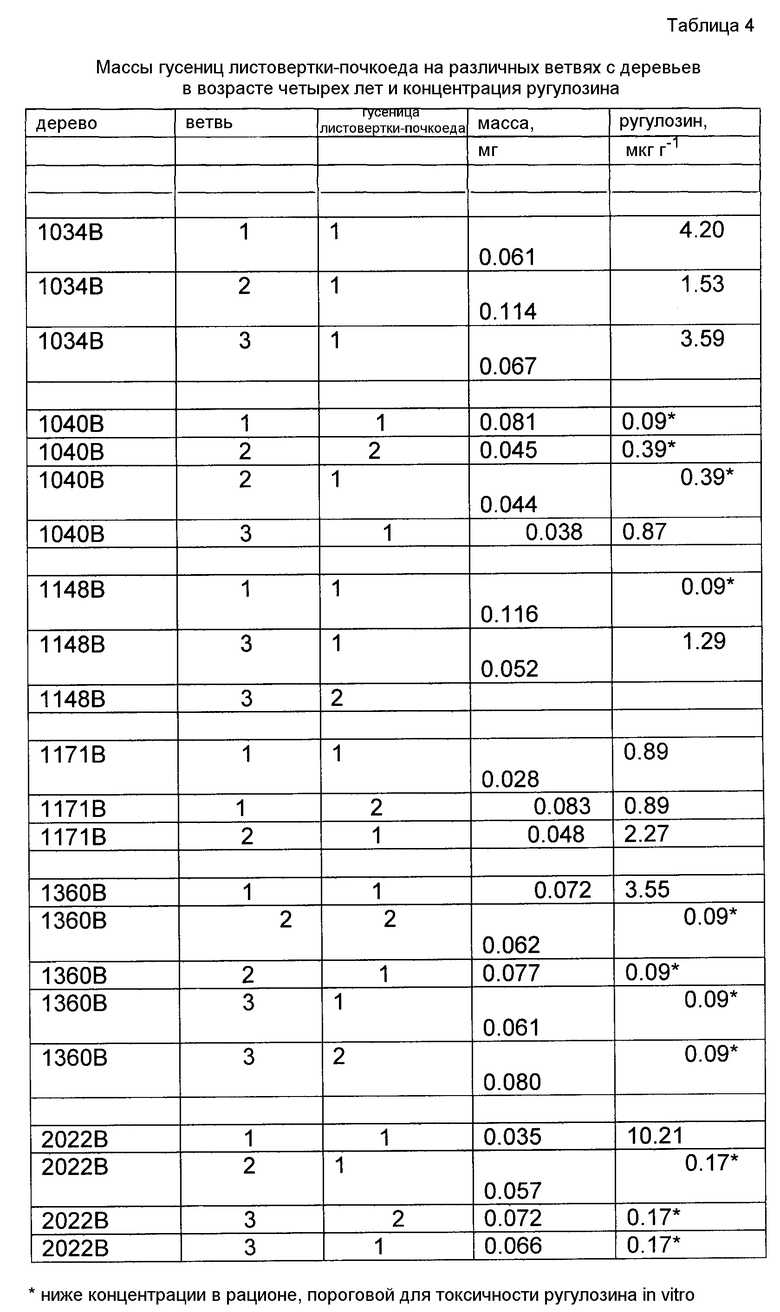
Полное содержание всех публикаций, патентов и патентных заявок приведено здесь в качестве ссылки в той же степени, как если бы полное содержание каждой отдельной публикации, патента или патентной заявки являлось конкретно и индивидуально приведенным здесь в качестве ссылки.






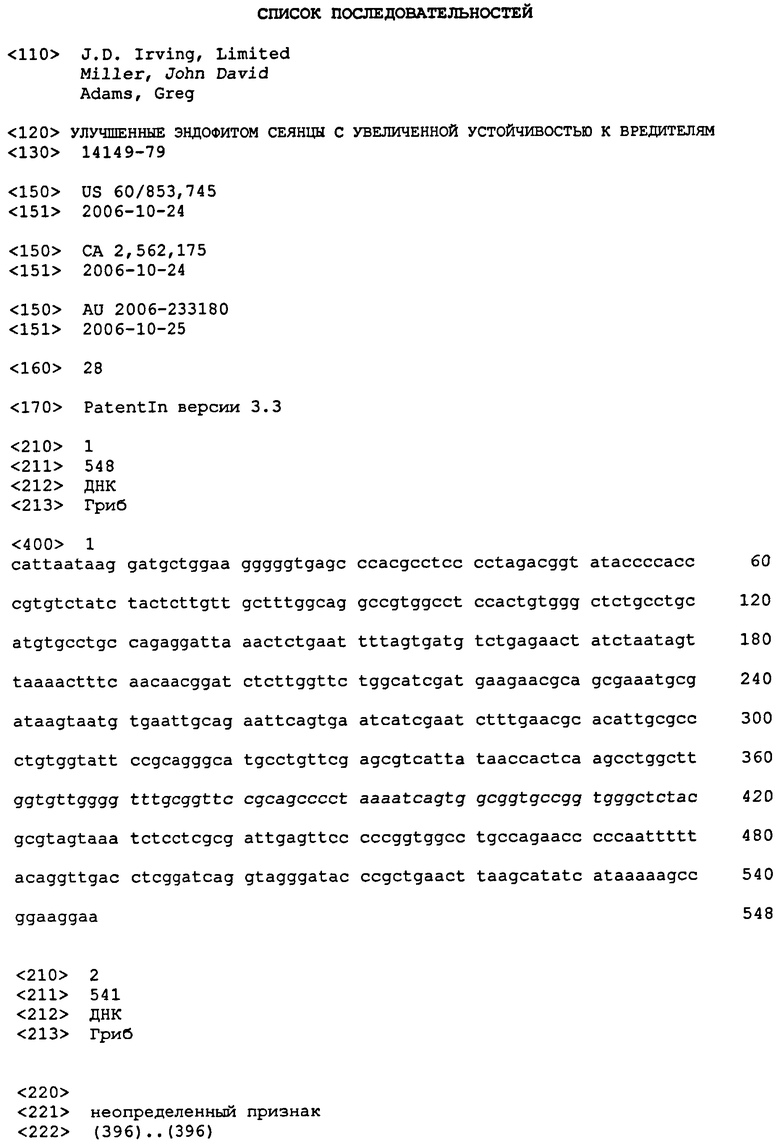

















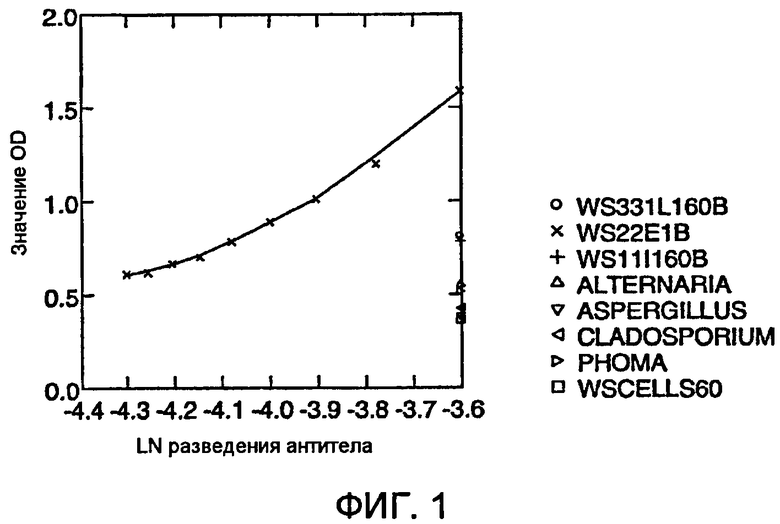


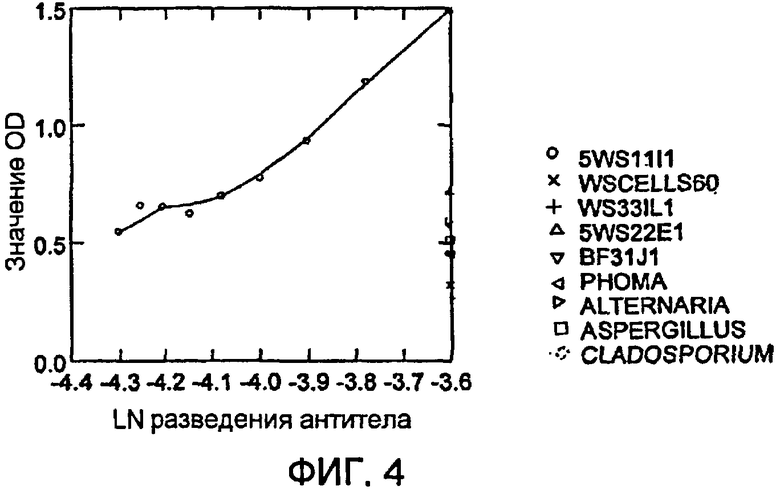
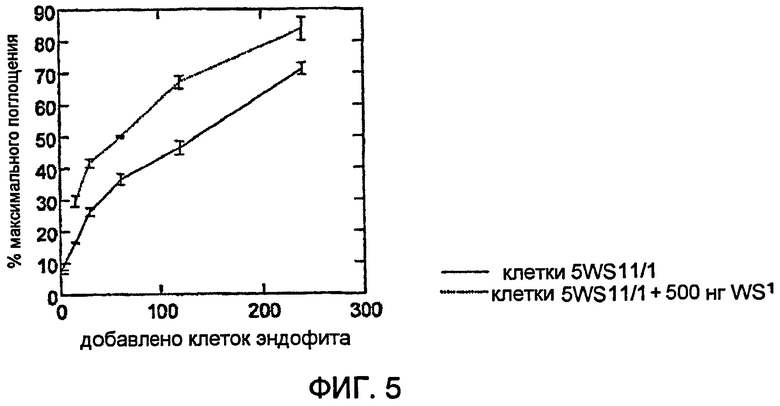

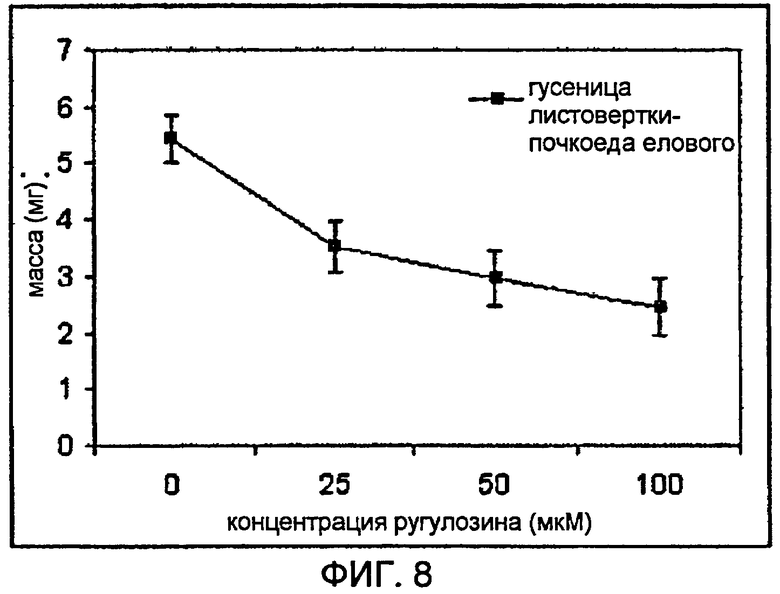
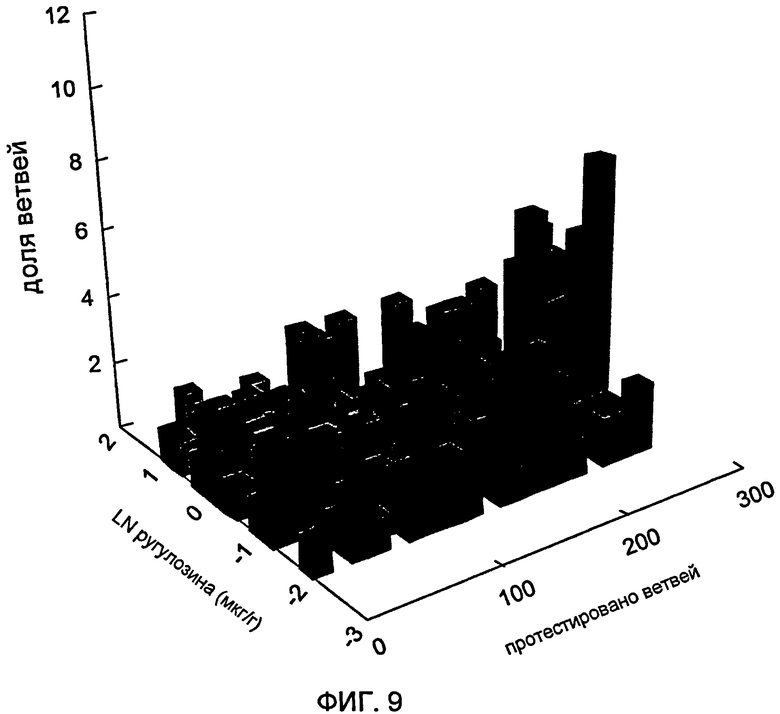

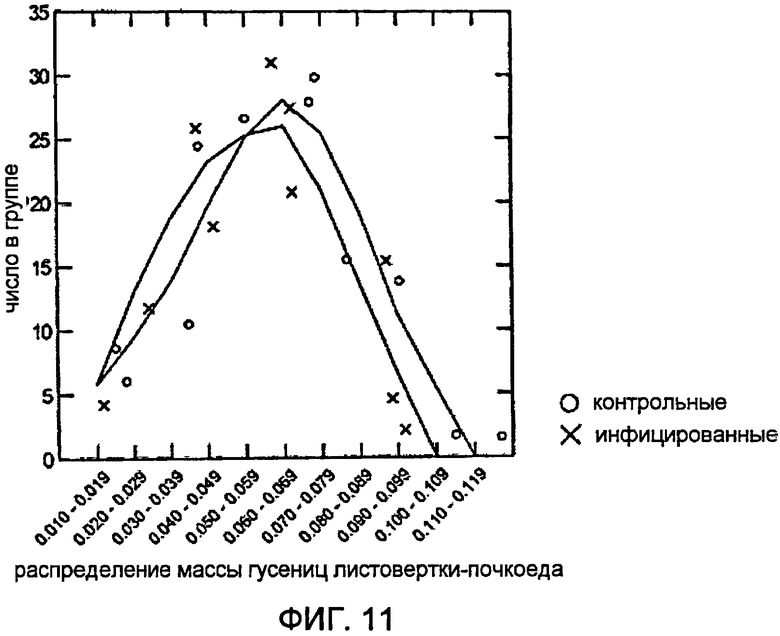
Изобретение относится к биотехнологии. Описан способ получения проростка хвойного растения с повышенной устойчивостью к вредителям, предусматривающий: инокуляцию семени хвойного растения или интактного проростка хвойного выделенным токсикогенным эндофитом в течение временного интервала чувствительности, когда семя хвойного или проросток хвойного чувствителен к колонизации токсикогенным эндофитом, где временной интервал чувствительности для семени во время стратификации семени и для проростка хвойного является интервал от стадии послевсхода до периода полного образования кутикулы, где стадия инокуляции предусматривает приведение семени хвойного или проростка хвойного в контакт с композицией инокулята, содержащей токсикогенный эндофит, и выращивание указанного семени хвойного или проростка хвойного с получением проростка хвойного с повышенной устойчивостью к вредителям. Представлено хвойное растение, колонизированное выделенным токсикогенным эндофитом, где хвойное растение выращено из семени хвойного растения или проростка хвойного, полученного описанным способом, где хвойное растение продуцирует токсин, замедляющий рост вредителей, где токсин включает ругулозин, вермикулин или 5-метокси-карбонилмеллеин. Изобретение позволяет осуществлять крупномасштабную инокуляцию хвойных желательными штаммами эндофитов. 2 н. и 16 з.п. ф-лы, 11 ил., 4 табл., 17 пр.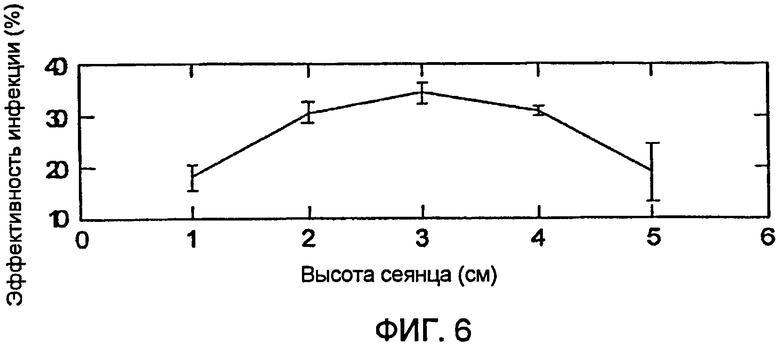
1. Способ получения проростка хвойного растения с повышенной устойчивостью к вредителям, предусматривающий: инокуляцию семени хвойного растения или интактного проростка хвойного выделенным токсикогенным эндофитом в течение временного интервала чувствительности, когда семя хвойного или проросток хвойного чувствителен к колонизации токсикогенным эндофитом, где временной интервал чувствительности для семени во время стратификации семени и для проростка хвойного является интервал от стадии послевсхода до периода полного образования кутикулы, где стадия инокуляции предусматривает приведение семени хвойного или проростка хвойного в контакт с композицией инокулята, содержащей токсикогенный эндофит, где токсикогенный эндофит необязательно находится в форме фрагментов гиф токсикогенного эндофита, и композиция инокулята содержит по меньшей мере 1-25 фрагментов гиф токсикогенного эндофита/6 микролитров, необязательно, по меньшей мере 1-4 фрагмента гиф токсикогенного эндофита/микролитр, и/или, необязательно, по меньшей мере 0,2-4 фрагмента гиф токсикогенного эндофита/микролитр, в частности, где композиция инокулята содержит по меньшей мере 3 фрагмента гиф токсикогенного эндофита на 6 микролитров, необязательно, где композиция инокулята суспендирована в разбавителе; и
выращивание указанного семени хвойного или проростка хвойного с получением проростка хвойного с повышенной устойчивостью к вредителям.
2. Способ по п.1, где стадия инокуляции включает приведение проростка в контакт с токсикогенным эндофитом посредством i) приведения в контакт поверхности проростка с токсикогенным эндофитом и/или композицией инокулята или ii) приведения в контакт среды для роста проростка, обеспечивающей проросток токсикогенным эндофитом и/или композицией инокулята, в частности, где стадия инокуляции включает опрыскивание проростка токсикогенным эндофитом и/или композицией инокулята, например, где опрыскивание включает способ опрыскивания, выбранный из группы, состоящей из затуманивания, опрыскивания почвы, опрыскивания из баллона, штангового опрыскивания, воздуходувного опрыскивания и веерообразного распыления, в частности, где способ опрыскивания включает штанговое опрыскивание или опрыскивание из баллона, например, где штанговое опрыскивание предусматривает наличие штангового опрыскивателя, линии орошения, соединенной со штанговым опрыскивателем, и инжекторного насоса, где инжекторный насос инъецирует выделенный токсикогенный эндофит на линию орошения, и штанговый опрыскиватель распыляет выделенный токсикогенный эндофит на проросток, необязательно, где среда для роста представляет собой горшечную смесь.
3. Способ по п.1 или 2, где инокулируемая композиция содержит токсикогенный эндофит и носитель, и носитель содержит иглу хвойного, где игла хвойного содержит токсикогенный эндофит, необязательно, содержащую токсикогенный эндофит на поверхности иглы хвойного или внутри иглы хвойного.
4. Способ по п.1, где стадия инокуляции предусматривает приведение семени хвойного в контакт с выделенным токсикогенным эндофитом посредством замачивания семени в растворе, содержащем токсикогенный эндофит, необязательно, где семя замачивают в растворе в течение ночи, высушивают и замораживают предпочтительно при 2-6°С.
5. Способ по п.1, включающий повторение стадии инокуляции, необязательно, предусматривающий инокуляцию семени хвойного или проростка с помощью по меньшей мере двух стадий инокуляции, где способ инокуляции выбран из группы, состоящей из опрыскивания, проростка хвойного, замачивания семени хвойного вместе с токсикогенным эндофитом, и/или их сочетания, необязательно, инокуляции семени, когда семя находится на стадии стратификации семени, и снова инокуляции, когда проросток дорастает до стадии послевсхода.
6. Способ по п.1, дополнительно включающий определение, колонизирован ли проросток хвойного эндофитом, посредством приведения образца проростка хвойного в контакт со средством для детекции, направленным против токсикогенного эндофита или токсина, продуцируемого токсикогенным эндофитом, где специфическое связывание средства для детекции в образце указывает на колонизацию, необязательно, где колонизация включает наличие токсикогенного эндофита, присутствующего в количестве, адекватном для уменьшения скорости роста вредителя, развития вредителя и/или уменьшения набора массы вредителя по сравнению с ростом вредителя на неинокулированном проростке хвойного, необязательно, где колонизация включает распространение токсикогенного эндофита на проростке-хозяине в количестве, адекватном для уменьшения скорости роста, развития вредителя и/или уменьшения набора массы вредителя для личинок гусеницы листовертки-почкоеда елового в анализе личинок гусеницы листовертки-почкоеда елового по сравнению с ростом гусеницы листовертки-почкоеда елового на неинокулированном проростке хвойного.
7. Способ по п.1, где эндофит продуцирует по меньшей мере одно соединение токсина, выбранное из группы, состоящей из ругулозина, вермикулина, 5-метоксикарбонилмеллеина, 5-формилмеллеина, 5-метилмеллеина, 3-бутил-4-метилфуран-2(5Н)-он-бутиролактонтирозола, меллеина, 8-гидрокси-6-метокси-3-пропил-3,4-дигидроизокумарина или 3-метил-5,7-диметоксифталида, их вариантов и модифицированных растением форм, в частности, где соединение токсина присутствует в игле хвойного в количестве по меньшей мере 0,15 микрограмм на грамм иглы, например, где соединение токсина представляет собой ругулозин и присутствует в игле хвойного в количестве по меньшей мере 0,15 микрограмм на грамм иглы, предпочтительно, где соединение токсина присутствует в игле хвойного в количестве по меньшей мере 10 микромоль, например, где ругулозин присутствует в игле хвойного в количестве по меньшей мере 10 микромоль или где вермикулин присутствует в игле хвойного в количестве по меньшей мере 10 микромоль.
8. Способ по п.1, где токсикогенный эндофит включает эндофит Phialocephala, эндофит Xylariaceae, эндофит Lophodermium или колонизирующий эндофит Picea, необязательно, где токсикогенный эндофит содержит последовательность нуклеиновой кислоты, обладающую по меньшей мере 50, по меньшей мере 100 или по меньшей мере 200 нуклеотидами из последовательности, выбранной из группы из SEQ ID NO:1-28, или содержащую эту последовательность, например, где токсикогенный эндофит выбран из группы, состоящей из 5WS22E1, 5WS11/1, 05-37A, 06-486D, 06-485А, 04-052В, 06-011В, 06-011D, 06-012C, 06-013А, 06-014С, 08-040В, 06-264А, 06-332A, 06-268A, 07-013D, 08-011D, 01-002A, 04-002G, 03-020B, 04-012A, 06-063D, 02-002C, 06-073C, 06-094E, 06-255A, 06-097D и 08-018A, предпочтительно, где токсикогенный эндофит представляет собой 5WS22E1, или где токсикогенный эндофит представляет собой 5WS11/1, или где токсикогенный эндофит представляет собой 05-37A, или где токсикогенный эндофит представляет собой 06-486D, или где токсикогенный эндофит представляет собой 06-485А.
9. Способ по п.1, где проросток хвойного инокулируют в период непрерывного удлинения верхушки побега, необязательно, когда длина побега составляет более 10 мм и менее 100 мм, или до полного формирования кутикулы игл, или когда присутствующий процент игл с промежуточной дифференцировкой больше, чем процент полностью дифференцированных игл.
10. Способ по п.3, где распыление включает распыление на проросток хвойного каплей жидкости инокулята, содержащих выделенный токсикогенный эндофит хвойных и воду, так, что по меньшей мере порция токсикогенных эндофитов и вода контактируют с проростком хвойного в условиях непрерывной влажности в течение по меньшей мере 12 ч.
11. Способ по п.1, где проросток хвойного представляет собой проросток ели, такой как проросток белой ели или проросток красной ели, проросток пихты или проросток сосны.
12. Способ по п.9, где проросток хвойного инокулируют, если проросток обладает высотой по меньшей мере 1 см и высотой менее 10 см, в частности, где проросток обладает высотой по меньшей мере 1 см и высотой менее 6 см, более конкретно, где проросток обладает высотой по меньшей мере 2 см и высотой менее 5 см, где проросток обладает высотой по меньшей мере 3 см и высотой менее 5 см, необязательно, где проросток обладает высотой по меньшей мере 4 см и высотой менее 5 см, где проросток обладает высотой по меньшей мере 3 см и высотой менее 4 см или где проросток обладает высотой 1-2 см, высотой 2-3 см, высотой 3-4 см, высотой 4-5 см, высотой 5-6 см, высотой 6-7 см, высотой 7-8 см, высотой 8-9 см, высотой 9-10 см; или где проросток насчитывает от 2 недель до 16 недель после прорастания, в частности, где проросток насчитывает от 6 недель до 10 недель после прорастания, более конкретно, где проросток насчитывает 7-9 недель после прорастания, или где проросток насчитывает 8 недель после прорастания.
13. Способ по п.11, где проросток белой ели инокулируют токсикогенным эндофитом белой ели, выбранным из группы, содержащей 5WS22E1, 5WS11/1, 05-037A, 06-486D, 06-485А, 04-052В, 06-011В, 06-011D, 06-012C, 06-013А, 06-014С и 08-040В, или где проросток красной ели инокулируют токсикогенным эндофитом красной ели, выбранным из группы, содержащей 06-264А, 06-332А, 06-268А, 07-013D, 08-011D, 01-002A, 04-002G, 03-020В, 04-012А, 06-063D, 02-002С, 06-073С, 06-094Е, 06-255А, 06-097D и 08-018А, или где проросток пихты инокулируют токсикогенным эндофитом BF36H1.
14. Способ по п.1, где вредитель выбран из группы, состоящей из гусеницы листовертки-почкоеда елового, пяденицы гемлоковой, листовертки-почкоеда елового, пилильщиков, гусеницы листовертки-почкоеда сосны Банкса, в частности, где вредитель представляет собой гусеницу листовертки-почкоеда елового или где вредитель представляет собой пяденицу гемлоковую или листовертку-почкоеда елового, или пилильщиков, и вызывающего заболевание грибкового патогенна, такого как вызывающий заболевание грибок-вредитель, выбранный из группы, содержащей серянку сосны веймутовой и виды возбудителей фузариоза.
15. Способ по п.1, где стадии инокуляции предшествует выделение токсикогенного эндофита из донорного растения и культивирование токсикогенного эндофита, необязательно, где стадия выделения токсикогенного эндофита из донорного растения включает: выделение токсикогенного эндофита-кандидата из игл донорного растения;
необязательно, анализ токсичности эндофита-кандидата для вредителя в анализе токсичности для вредителя, где токсичность эндофита-кандидата является показателем того, что токсикогенный эндофит-кандидат является токсикогенным эндофитом.
16. Способ по п.1, дополнительно включающий детекцию токсикогенного эндофита или токсина токсикогенного эндофита в образце инокулированного проростка посредством приведения образца в контакт со средством для детекции, направленным против токсикогенного эндофита или токсина токсикогенного эндофита, продуцируемого эндофитом, где детекция специфического связывания средства для детекции в образце указывает на колонизацию.
17. Хвойное растение, колонизированное выделенным токсикогенным эндофитом, где хвойное растение выращено из семени хвойного растения или проростка хвойного, полученного способом по любому из пп.1-16, где хвойное растение продуцирует токсин, замедляющий рост вредителей, в частности, где хвойное растение представляет собой хвойное дерево, проросток, куст или живую изгородь, более конкретно, проросток хвойного, необязательно, где токсин включает ругулозин, вермикулин или
5-метокси-карбонилмеллеин, например, где хвойное растение колонизировано токсикогенным эндофитом, выбранным из группы 05-37А, 06-486D, 06-485А, 04-052В, 06-011В, 06-011D, 06-012C, 06-013А, 06-014С, 08-040В, 06-264А, 06-332А, 06-268А, 07-013D, 08-011D, 01-002A, 04-002G, 03-020B, 04-012A, 06-063D, 02-002C, 06-073C, 06-094E, 06-255A, 06-097D и 08-018А, или где хвойное растение колонизировано токсикогенным эндофитом, содержащим по меньшей мере 50, по меньшей мере 100 или по меньшей мере 200 нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO:3-28.
18. Хвойное растение по п.17, где вредитель включает гусеницу листовертки-почкоеда елового, и рост личинок гусеницы листовертки-почкоеда елового замедлен по меньшей мере на 5%, необязательно, на 10%, необязательно, на 10-30%, в анализе токсичности для вредителя, необязательно, в анализе личинок гусеницы листовертки-почкоеда елового.
| MILLER J.D | |||
| et al | |||
| "Needles of white spruce inoculated with rugulosin-producing endophytes contain rugulosin reducing spruce budworm growth rate", Mycol | |||
| Res | |||
| Светоэлектрический измеритель длин и площадей | 1919 |
|
SU106A1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ С КОМПЛЕКСНОЙ УСТОЙЧИВОСТЬЮ К ФИТОСТЕРИНЗАВИСИМЫМ ВРЕДИТЕЛЯМ | 1996 |
|
RU2141196C1 |
Авторы
Даты
2012-06-20—Публикация
2007-10-24—Подача