Изобретение относится к химической технологии, в частности к способу получения фторированного винилового эфира, содержащего сульфонилфторидную группу, а именно 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена, который может быть использован в качестве фторсодержащего мономера для получения фторполимеров, на основе которых изготавливают ионообменные мембраны.
Фторсодержащий мономер, а именно 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктен (далее именуемый ФС141), может быть описан структурной формулой (1)

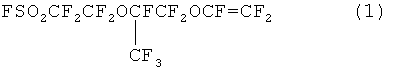
ФС141 применяется для получения различных сополимеров, в частности для получения сополимера с тетрафторэтиленом, который используется для синтеза ионообменных мембран.
Все известные способы получения ФС141 сводятся в основном к следующим стадиям:
а) контактирование 2,5-ди(трифторметил)-3,6-диокса-8-сульфонил-фторидперфтороктаноилфторида (далее - ФС161)
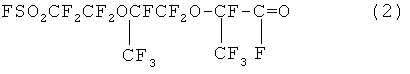
с суспензией карбоната натрия или калия в растворителе (предпочтительно диглим или ацетонитрил), или без растворителя при температуре 40-70°С с образованием натриевой или калиевой соли 2,5-ди(трифторметил)-3,6-диокса-в-сульфонилфторидперфтороктановой кислоты, имеющую структурную формулу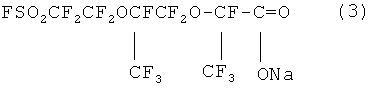 ,
,
углекислого газа и твердой соли фтористого натрия или калия;
б) пиролиз вышеназванной соли в растворителе или без него при температуре от 120 до 250°C с образованием ФС141, который отгоняется из зоны реакции при пониженном давлении, углекислого газа и твердой соли фтористого натрия или калия.
Реакцию получения ФС141 можно представить схемой:
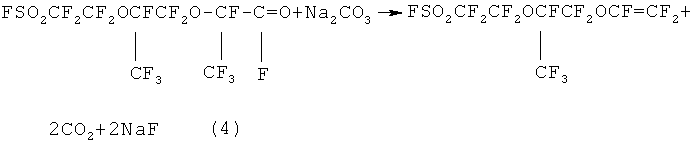
Известен способ получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена, который заключается в пиролизе сухой натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты при температуре 200-600°C [пат. США №3282875, НКИ 260-29.6, опубл. 01.11.1966]. Благодаря отсутствию в реакционной зоне «активной» влаги выход побочных водородсодержащих продуктов значительно ниже, чем в способах получения в присутствии влаги. Недостаток способа - невысокий выход целевого продукта, обусловленный образованием смолообразных продуктов из-за высокой температуры пиролиза.
Известен также [патент РФ 2272806, МПК C07C 309/82; опуб. 27.03.2004] способ, где этот продукт получают путем контактирования 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторида с суспензией карбоната натрия в диглиме с образованием натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты, последующего пиролиза вышеназванной соли при повышенной температуре с получением 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена и выделения последнего из зоны реакции отгонкой, согласно изобретению суспензию карбоната натрия в диглиме предварительно контактируют с перфтор(2-пропоксипропионил)фторидом с получением натриевой соли перфтор-2-пропоксипропионовой кислоты, которую пиролизуют при температуре 140°С с получением перфторпропилвинилового эфира, отгоняемого из зоны реакции.
Пиролиз натриевой соли 2,5-ди-(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты проводят при температуре 120-160°С.
Реагенты расходуют в мольном отношении карбонат натрия: диглим: перфтор(2-пропоксипропионил)фторид: 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторид, равном (1,4-3,0):(1,2-2,0):(0,1 -0,3):1.
В результате получают целевой продукт чистотой 99,6. Выход мономера составляет около 93% от теоретически возможного в расчете на поданный фторангидрид.
Известен способ [WO 03/002506, МКИ С07С 67/32, С07С 69/734, опубл. 09.01.2003] получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена, который наиболее близок к предлагаемому. Этот способ включает контактирование 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторида с суспензией карбоната натрия в диглиме с образованием натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты, отгонку диглима из реакционной зоны, пиролиз сухой натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты при температуре 200°С и более и отгонку целевого продукта из зоны реакции.
Недостатками рассмотренных способов является недостаточно высокий выход продуктов и наличие примесей высококипящих продуктов.
Задачей, стоящей перед авторами изобретения, является разработка способа получения мономера ФС141, позволяющего создать его эффективную технологию и осуществления пиролиза в «мягких» условиях для снижения выхода побочных высококипящих продуктов.
Сущность изобретения состоит в том, что предложен способ получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена взаимодействием 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторида с карбонатом натрия в диглиме, удалением диглима при пониженном давлении с последующим пиролизом образовавшейся натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты при повышенной температуре, отличающийся тем, что пиролиз натриевой соли 2)5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты проводят, повышая температуру, которая первоначально составляет 60°С, и доводят ее до 220-230°С со скоростью (35-40)°С/час при снижении давления от 300 до 30 мм рт.ст.
Способ отличается и тем, что реагенты расходуют в мольном соотношении карбонат натрия: диглим: 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторид, равном (1,1-1,4):(1,9-2):1.
Способ отличается и тем, что удаление диглима проводят при температуре 50-60°С и давлении от 300 до 20 мм рт.ст.
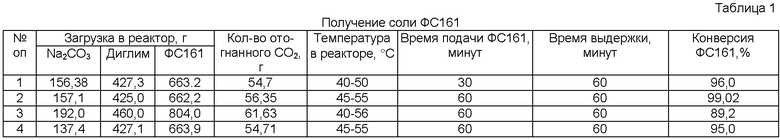
Для повышения выхода натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты(ФС161) до 95-99%, карбонат натрия вводят в избытке, составляющем 5-10 мас.%.
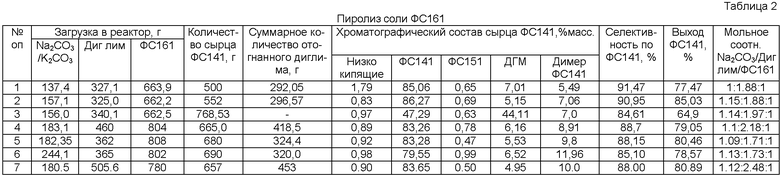
Температура кипения ФС141 составляет 133,5°С, ФС151 - 138°С, ФС61 - 140°С. Разница в температуре кипения ФС141 и ФС151 составляет не более 4,5°С, поэтому необходимо применение высокоэффективной колонны разделения, так как ФС141, который используется в процессе сополимеризации с тетрафторэтиленом, должен быть мономерной чистоты - не менее 99,95 мас.%. Установлено, что при проведении, пиролиза без предварительной отгонки диглима (опыт 3) получается больше ФС151 и димера, чем в опыте 2.
Пиролиз соли ФС161 после отгонки диглима необходимо проводить, постепенно повышая температуру в реакторе ее до 220-230°С со скоростью 35-40°С в час при снижении давлении от 300 до 30 мм рт.ст., чтобы основная часть пиролиза проходила при более низкой температуре, что позволит снизить образование побочных продуктов. Способ позволяет проводить стадию получения соли ФС161 с конверсией 95-99% и ее пиролиз с конверсией 80-85%, селективностью 85-90%.
Образовавшийся сырец ФС141 с чистотой 85-90,0 об.% подвергают ректификации. В результате ректификации сырца выделяют товарный ФС141 с чистотой 99,95 об.%.
Опыты по синтезу ФС141 проводят в реакторе из нержавеющей стали объемом 2.5 л, снабженном рамной мешалкой, обратным холодильником и рубашкой, в которую подают теплоноситель от термостата с температурой от 20°С до 250°С. Образующийся углекислый газ на стадии получения соли ФС161 собирают в барботер с 10% раствором натриевой щелочи и по привесу определяют его количество. Отгонку диглима из реактора после образования натриевой соли ФС161 ведут при пониженном давлении в стеклянный сборник через конденсатор, охлаждаемый теплоносителем холодильной машины до минус 30-40°С. Пиролиз соли ФС161 ведут при пониженном давлении, образовавшийся ФС141 конденсируют при минус 30-40°С и собирали в отдельный сборник.
Подачу ФС161 чистотой 99,0% в реактор осуществляют насосом со скоростью 0,6-0,8 кг/ч. Карбонат натрия высушен при температуре 350°С в течение 3 часов, диглим перегнан и высушен цеолитом марки NaA до содержания влаги не более 0,005 мас.%, загрузку в реактор осуществляют в токе аргона. После каждого опыта проводят хроматографический анализ отогнанного диглима и сырца ФС141.
Ректификацию сырца ФС141 проводят на колонке высотой 6500 мм, диаметром 50 мм (эффективная насадка Zulder-DX), объем куба 25 л, флегмовое число 50. Основные примеси, образующиеся при пиролизе соли ФС161, определяют методом хроматомасс-спектроскопии и ЯМР.
Установлено, что основной примесью является димер, образующийся циклодимеризацией мономера при высоких температурах пиролиза и имеющий температуру кипения около 250°С:
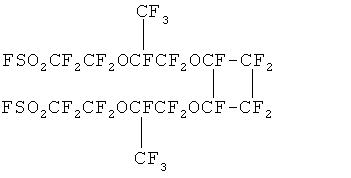
Стадию получения соли ФС161 проводят практически нацело с конверсией ФС161 95-99% с большой скоростью при температуре 40-60°С за 2 часа (1 час прибавления и 1 час выдержки до прекращения выделения CO2).
Результаты опытов приведены в Таблицах 1 и 2.
Для повышения выхода натриевой соли ФС161 с выходом 95 - 99% карбонат натрия вводят в избытке, составляющем 5-10 мас.%. При проведении опыта 1 со стехиометрическим количеством наблюдалось снижение выхода ФС141. Сравнительные опыты 6 и 7 проведены с использованием карбоната натрия и калия, которые показали близкие значения по выходу ФС141, но селективность процесса при использовании карбоната натрия была выше за счет меньшего образования водородсодержащей примеси ФС151 очевидно из-за большей химической активности и влажности карбоната калия и высококипящего димера ФС141. В патенте [WO 03/002506, МКИ С07С 67/32, опубл. 09.01.2003] приведены опыты (примеры 10 и 12) с карбонатом калия и натрия, которые показали худший результат по выходу ФС141 на карбонате натрия (65%), чем на карбонате калия (82%).
Предпочтителен карбонат натрия, так как он менее гигроскопичный, в отличие от карбоната калия выпускается в виде безводной соли и в 2 раза дешевле его. Предпочтительно и проведение пиролиза после отгонки растворителя - диглима с отгонкой не менее чем 80% от количества, загруженного в реактор. Отгонку диглима проводили предпочтительно при температуре 50-60°С при снижении давления от 300 до 20 мм рт.ст. Оставшиеся 20% диглима отгоняются с большим трудом даже при очень низком вакууме, поэтому его отгоняли вместе с ФС141 в начале процесса пиролиза при повышении температуры реактора. При проведении пиролиза без предварительной отгонки диглима (опыт 3) получается больше ФС151 и димера, чем в опыте 2.
Пиролиз соли ФС161 после отгонки диглима проводят, постепенно повышая температуру в реакторе от 60°С до 220-230°С со скоростью 35-40°С в час, при снижении давления от 300 до 130 мм рт.ст. так, чтобы основная часть пиролиза проходила при более низкой температуре, что позволяет снизить образование побочных продуктов.
Результаты опытов, представленные в таблицах 1 и 2, показывают, что достигнута цель изобретения - разработан способ получения мономера ФС141, позволяющий создать его эффективную технологию и позволяющий проводить пиролиз в «мягких» условиях (при температуре не выше 160оС) для снижения образования побочных высококипящих продуктов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-ТРИФТОРМЕТИЛ-3,6-ДИОКСА-8-СУЛЬФОНИЛФТОРИДПЕРФТОРОКТЕНА | 2004 |
|
RU2272806C1 |
| Способ получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена | 2023 |
|
RU2820702C1 |
| Способ получения 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторид)перфтороктаноилфторида | 2023 |
|
RU2820722C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИ(ТРИФТОРМЕТИЛ)-3,6-ДИОКСА-8-СУЛЬФОНИЛФТОРИДПЕРФТОРОКТАНОИЛФТОРИДА | 2004 |
|
RU2269513C1 |
| Способ получения перфтор-4-(фторсульфонил)бутилвинилового эфира | 2022 |
|
RU2800857C1 |
| Способ получения полифтораллилокси-СОЕдиНЕНий | 1977 |
|
SU795452A3 |
| Способ получения десфлурана | 2024 |
|
RU2833270C1 |
| СПОСОБ ПОЛУЧЕНИЯ D-ЭСТРА-1,3,5(10)-ТРИЕН-3-ОЛ-17-ОНА (ЭСТРОНА) | 2000 |
|
RU2170740C1 |
| Способ получения п-диоксанона | 1989 |
|
SU1700001A1 |
| Способ получения виниловых эфиров сульфонилфторидов | 1981 |
|
SU1080742A3 |
Изобретение относится к химической технологии, в частности к способу получения фторированного винилового эфира, содержащего сульфонилфторидную группу, а именно 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена, который может быть использован в качестве фторсодержащего мономера для получения фторполимеров, на основе которых изготавливают ионообменные мембраны. Способ получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена заключается во взаимодействии 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторида с карбонатом натрия в диглиме, удалении диглима при пониженном давлении с последующим пиролизом образовавшейся натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты при повышенной температуре, причем пиролиз натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты проводят, повышая температуру, которая первоначально составляет 60°С, и доводят ее до 220-230°С со скоростью (35-40)°С/час при снижении давления от 300 до 30 мм рт.ст. Техническим результатом является разработка способа получения фторированного мономера, позволяющего создать его эффективную технологию, и осуществление пиролиза в «мягких» условиях для снижения выхода побочных смолообразных продуктов. 2 з.п. ф-лы, 2 табл., 11 пр.
1. Способ получения 5-трифторметил-3,6-диокса-8-сульфонилфторидперфтороктена взаимодействием 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторида с карбонатом натрия в диглиме, удалением диглима при пониженном давлении с последующим пиролизом образовавшейся натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты при повышенной температуре, отличающийся тем, что пиролиз натриевой соли 2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктановой кислоты проводят, повышая температуру, которая первоначально составляет 60°С, и доводят ее до 220-230°С со скоростью (35-40)°С/ч при снижении давления от 300 до 30 мм рт.ст.
2. Способ по п.1, отличающийся тем, что реагенты расходуют в мольном соотношении карбонат натрия:диглим:2,5-ди(трифторметил)-3,6-диокса-8-сульфонилфторидперфтороктаноилфторид, равном (1,1-1,4):(1,9-2):1.
3. Способ по любому из пп.1 и 2, отличающийся тем, что удаление диглима проводят при температуре 50-60°С и снижении давления от 300 до 20 мм рт.ст.
| СПОСОБ ПОЛУЧЕНИЯ 5-ТРИФТОРМЕТИЛ-3,6-ДИОКСА-8-СУЛЬФОНИЛФТОРИДПЕРФТОРОКТЕНА | 2004 |
|
RU2272806C1 |
| CN 101712639 А, 26.05.2010 | |||
| CN 101698654 А, 28.04.2010 | |||
| CN 101696178 А, 21.04.2010 | |||
| WO 2003002506 A1, 09.01.2003 | |||
| Thomas, Brian H | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2012-07-20—Публикация
2010-10-04—Подача