Изобретение относится к области медицины, а точнее к клинической химии, в частности к способам определения уровня содержания эндогенных стероидов в организме, и может быть использовано, например, при допинговом контроле спортсменов и особенно при составлении биологического паспорта спортсмена.
Известен способ определения эндогенных стероидов (ЭС) методами колориметрического анализа [1].
Способ этот относится к методам качественного анализа и соответственно позволяет определить только наличие ЭС, без определения их структурных характеристик и, собственно, природы. К тому же по указанному способу возможно анализировать объекты только с очень высоким содержанием ЭС.
Известны также способы определения ЭС методом газовой хроматографии в сочетании с масс-спектрометрией [2-4].
Общим недостатком таких методов является трудоемкая и продолжительная во времени стадия получения летучих производных, для ЭС, что существенно усложняет ход анализа, увеличивает его продолжительность и удорожает проведение процесса.
Наиболее близким по своей технической сущности и достигаемому результату к заявляемому способу является ГХ-МС способ определения ЭС в моче человека методом газовой хроматографии в сочетании с масс-спектрометрией (ГХ-МС) [5].
По указанному способу в образец мочи добавляют фосфатный буферный раствор, внутренний стандарт, а также фермент (β-глюкуронидаза E.coli). Смесь перемешивают и инкубируют и после гидролиза добавляют карбонатный буферный раствор и диэтиловый эфир, далее органический слой отделяют после центрифугирования, упаривают досуха, дериватизируют и анализируют методом ГХ/МС.
Основным недостатком указанного способа является низкая степень достоверности определения ЭС (в частности, при определении стероидного профиля) и высокий порог чувствительности (например, для эпитестостерона до 10-12 нг/мл), поскольку стероиды выводятся в мочу в виде глюкуронидов и сульфатов, а анализу подвергаются только глюкурониды.
Техническим результатом, на достижение которого направлено создание данного изобретения, является повышение степени достоверности определения ЭС, в частности при определении стероидного профиля за счет снижения порога чувствительности и расширения номенклатуры определяемых ЭС и, соответственно, определения стероидного профиля.
Поставленный технический результат достигается тем, что в процессе пробоподготовки гидролиз анализируемого образца мочи ведут смесью двух ферментов: β-глюкуронидазы E.coli и арилсульфатазы H.pomatia в соотношении от 1:1 до 3:1 и в качестве буферного раствора используют цитратный буферный раствор, при этом у спортсмена определяют ЭС по меньшей мере 10-15 раз с интервалом между анализами не менее 10-12 дней, по результатам анализов устанавливают минимальные и максимальные количественные значения каждого из найденных ЭС, принимают указанные значения за доверительный интервал и выстраивают стероидный профиль спортсмена как совокупность доверительных интервалов всех найденных ЭС.
Известно, что при ГХ/МС анализе ЭС необходимо провести несколько стадий пробоподготовки, поскольку выведение ЭС в мочу происходит после фазы II метаболизма, а именно конъюгирования, во время которого образуются сложные эфиры соединений, причем стероиды выводятся в мочу в виде глюкуронидов и сульфатов. Некоторые стероиды, например, такие как андростерон, этиохоланолон, тестостерон и эпитестостерон, могут выводиться в мочу в виде сульфатов с отношением к глюкуронидам до 1:1. Другие стероиды, например дегидроэпиандростерон, андростендион, эстрон, эстриол, могут выводиться в мочу в основном в виде сульфатов. В свою очередь сульфаты представляют интерес для допинг-контроля не только из-за эндогенных ЭС, а еще и по той причине, что некоторые стероиды образуют наиболее долгоживущие метаболиты именно в сульфатной фракции и поэтому их можно обнаружить в биологической жидкости в течение, например, не 6 часов, а в течение 18 или 24 часов, что должно повысить достоверность подтверждения приема допинга спортсменом. Тем не менее в настоящее время концентрации основных эндогенных ЭС, таких как тестостерон, эпитестостерон, андростерон, этиохоланолон, дегидроэпиандростерон и др., по нормативам WADA рассчитывают, исходя из глюкуронидов соответствующих ЭС [6]. В настоящее время известно около тридцати ЭС человека, однако авторы, основываясь на своих знаниях и опыте, утверждают, что для определения достоверного стероидного профиля аналитическим путем достаточно исследовать 8-12 наиболее характерных ЭС.
При реализации заявляемого изобретения в качестве аппаратурного оформления процесса может быть использован, например, хроматограф Agilent 6890, соединенный с масс-селективным детектором Agilent 5973N с электронной ионизацией (70 эВ), колонка Restek Rxi - 1ms (длина 12 м, внутренний диаметр 0,20 мм, толщина неподвижной фазы 0,33 мкм).
Температурная программа может быть установлена со следующими параметрами: подъем от 188°C до 232°C со скоростью 2°C/мин, далее от 232°C до 300°C по 12°C/мин, изотерма 5,33 мин при объеме вводимой пробы 2 мкл в режиме деления потока (1:20), температура инжектора - 280°С. Газ-носитель - гелий (0,6 мл/мин). Температура источника ионов - 230°С, температура переходной линии - 290°С, квадруполя - 150°С, скорость сканирования - 1,69 циклов/сек, диапазон масс в режиме полного сканирования - 50-600 а.е.м.
В качестве реагентов и материалов могут быть использованы, например, N-метил-N-(триметилсилил)-трифторацетамид (МСТФА), β-глюкуронидаза из H.pomatia, арилсульфатаза из H.pomatia и ацетат натрия (Sigma-Aldrich, США); стандартные образцы тестостерона, эпитестостерона, андростерона, этиохоланолона, дегидроандротестостерона, андростендиона, эстрона, эстриола, 11β-гидроксиандростерона, 11β-гидроксиэтиохолоналона и дегидроэпиандростерона (Steraloids, Newport, США); метанол, соляная кислота и уксусная кислота (Merck, ФРГ); дигидрофосфат калия, гидрофосфат натрия и йодид аммония (Riedel-de-Haën, ФРГ); карбонат калия, гидрокарбонат калия и сульфат натрия (ХимМед, РФ); диэтиловый эфир (МедХимПром, РФ); 1,4-дитио-DL-триэтол (ДТТ), имидазол (Fluka, Швейцария); цитрат калия (Alfa Aesar, США); внутренний стандарт - метилтестостерон, D4-андростерон-глюкуронид и D5-этиохоланолон (LGC Standards, Великобритания); деионизированная вода (MilliQ, ФРГ).
Разумеется, могут быть использованы оборудование, материалы и реактивы других производителей, с тем, однако, условием, что по качественным характеристикам они будут обеспечивать воспроизводимость результатов исследования в объеме заявляемых патентных притязаний.
В качестве вспомогательного оборудования могут быть использованы: автоматический шейкер фирмы Glas-Col®, США - для ЖЖЭ; центрифуга марки Rotina 46R фирмы Hettich (ФРГ) для получения контрастной поверхности раздела между органической и водной фазами;- упариватель фирмы Barnstead Inc. (США), совмещенный с генератором азота марки Mistral-4 фирмы Schmidlin-DBS AG (Чехия) для упаривания органического экстракта. В качестве экстрагента для ЖЖЭ может быть использован метилтретбутиловый эфир (МТБЭ). В качестве регуляторов рН могут быть использованы гидрокарбонат натрия и карбонат калия.
Изобретение может быть осуществлено следующим образом.
Готовят образцы мочи, добавляют в них буферный раствор, внутренний стандарт (метилтестостерон, для конечной концентрации 500 нг/мл мочи), точные количества фермента или смеси ферментов. Смесь далее перемешивают и инкубируют при повышенной температуре в течение 1,0-1,5 час. По окончании гидролиза в смесь добавляют карбонатный буферный раствор (рН 10,4) и диэтиловый эфир, встряхивают в течение 3-10 мин, центрифугируют, отделяют органический слой и упаривают его досуха и дериватизируют раствором МСТФА/NH4I/ДТТ при нагревании в течение 20-40 минут, дериватизат переносят в виалу и анализируют методом ГХ/МС. Снимают и регистрируют хроматографические и масс-спектрометрические характеристики веществ-эталонов, а также всех растворов и проб (детектируют не менее трех характеристических ионов каждого эталонного вещества, определяют время удержания, молекулярную массу, прекурсор-ионы, характеристичные ионы, нижний предел обнаружения) и полученные результаты вводят в программное обеспечение, например ChemStation фирмы Agillent, США.
Для лучшего понимания изобретение может быть проиллюстрировано, но не исчерпано следующими примерами его конкретного осуществления.
Пример 1
Готовят стандартные растворы аналитов (1 мг/мл), в частности тестостерона, эпитестостерона, андростерона, этиохоланолона, дегидроандротестостерона, андростендиона, эстрона, эстриола, 11β-гидроксиандростерона, 11β-гидроксиэтиохолоналона и дегидроэпиандростерона. Рабочие растворы готовят растворением точной навески ЭС - эталонов в метаноле. Далее получают рабочие растворы разбавлением стандартных растворов до содержания 10 мкг/мл. Стандартные растворы каждого из ЭС (1 мг/мл) готовят растворением точной навески в точном объеме метанола. К 3 мл мочи (из приготовленных ранее образцов) добавляют 1 мл буферного раствора, 30 мкл внутреннего стандарта (МТ, для конечной концентрации 500 нг/мл мочи), точные количества смеси ферментов. Смесь перемешивают и инкубируют при 55°С 1 час 10 минут. После гидролиза добавляют 1 мл карбонатного буферного раствора (рН 10,4) и 5 мл диэтилового эфира. Встряхивают в течение пяти минут, центрифугируют при 3000 об/мин в течение 5 мин; органический слой отделяют, упаривают досуха при 70°C в течение 40 минут и проводят дериватизацию - 50 мкл раствора МСТФА/NH4I/ДТТ (1000:3:2) при нагревании до 70°С в течение 30 минут, раствор переносят в виалу и анализируют далее методом ГХ/МС (параметры аналитической процедуры приведены выше).
Содержание отдельных ЭС в пробах мочи определяют в том же порядке и при тех же параметрах, что и в стандартных растворах, с тем исключением, что гидролиз указанных образцов ведут в следующем порядке (см. Таблицу 1).
Таблица 1
Из представленных в Таблице 1 результатов становится очевидным, что использование для гидролиза смеси ферментов E.coli + helix pomatia в цитратном буфере позволяет расширить номенклатуру определяемых ЭС, а также существенно понизить порог определения указанных соединений. В частности, это видно из сопоставления полученных результатов в Таблице 2 (количество определенных в пробе ЭС - нг/мл).
Таблица 2
Пример 2 (сравнительный)
Для сравнения проводят анализы образцов мочи, подвергнутых гидролизу при различных сочетаниях ферментов и буферов (см. Таблицу 3).
Таблица 3
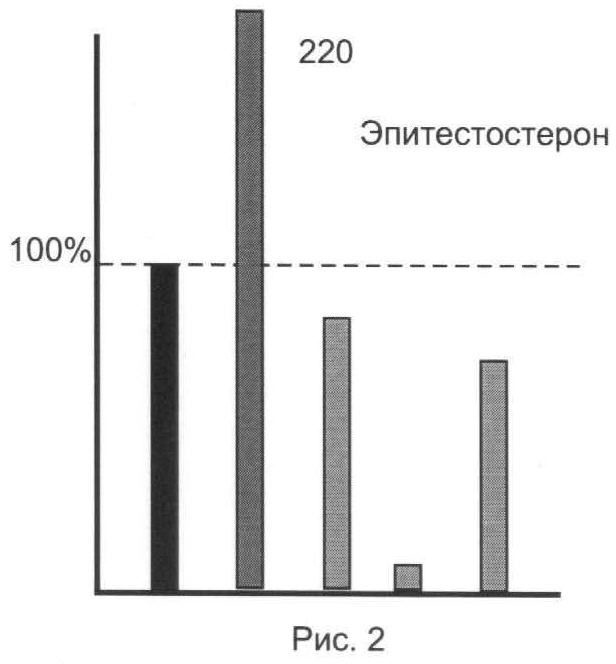
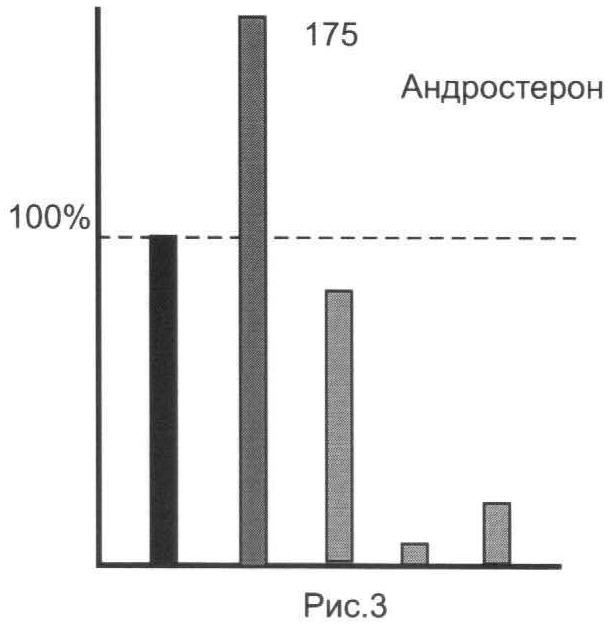
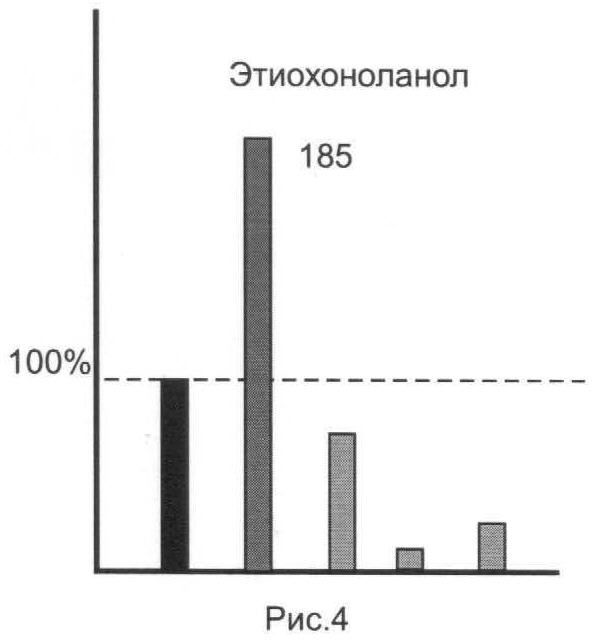
Результаты анализов для исследованной серии ЭС представлены на рис.1-5.
Из представленных иллюстративных материалов вытекает, что при использовании в качестве гидролизующей среды смеси ферментов (E.coli+helix pomatia) в цитратном буфере нижний предел обнаружения исследованных ЭС по сравнению с известным (единица, или 100%) понижается по меньшей мере до 0,8-0,35 (т.е. в 1,2-1,65 раза).
Пример 3
Готовят образец мочи, добавляют в него буферный раствор, внутренний стандарт (МТ, для конечной концентрации 500 нг/мл мочи), точные количества фермента или смеси ферментов. Смесь далее перемешивают и инкубируют при повышенной температуре в течение 1,0 -1,5 час и далее процедуру проводят как в Примере 1, включая технику и условия проведения ГХ/МС анализа за исключением того, что образец мочи разделяют на пять аликвот и каждую аликвоту подвергают гидролизу при следующих условиях (Таблица 4).
Таблица 4
Результаты определения ЭС, в частности этиохолоналона, приведены на рис 6.
Из рис.6 следует, что оптимальное соотношение объемов используемых ферментов составляет 1:2 - 1:3. Выход соотношения за заявленные пределы снижает ожидаемый результат определения ЭС.
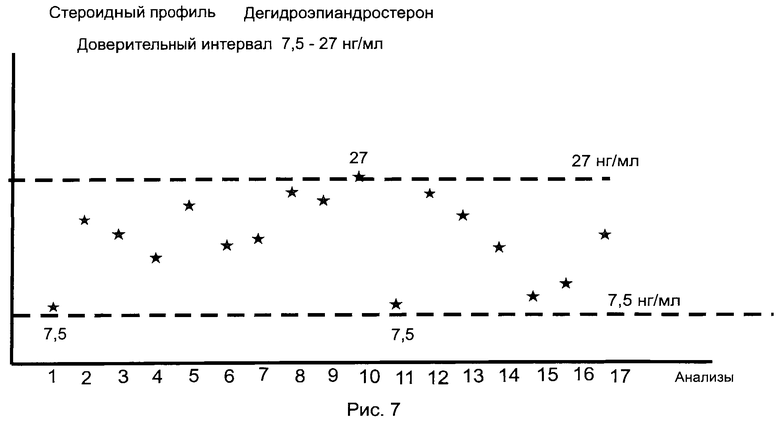
Пример 4 (Определение стероидного профиля)
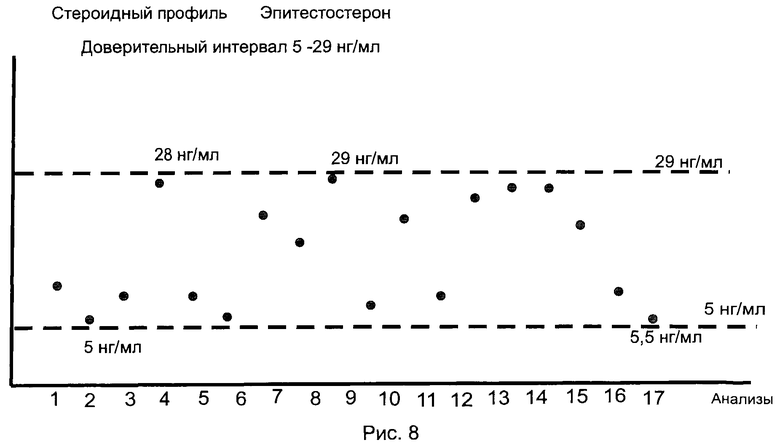
Определяют стероидный профиль добровольца (биатлонист, мужчина, 23 года). Всего взято 17 анализов с интервалом между анализами 10-15 дней. Особо следует отметить, что спортсмен за весь период наблюдения (220 дней) не принимал допинга и не использовал трансфузию крови. Доверительный интервал значений каждого конкретного ЭС устанавливают как разность между минимальным и максимальным значениями содержания указанного ЭС во времени (в данном случае в течение времени наблюдения - 220 дней и по данным 17 анализов). На рис.7-10 представлены стероидные профили спортсмена по дегидроэпиандростерону, эпитестостерону, тестостерону и эстриолу соответственно. По остальным исследуемым ЭС стероидные профили представлены в Таблице 5. Для определения стероидного профиля выбраны по два минимальных и максимальных значения из общего числа 17 значений.
Таблица 5
Пример 5 (контрольный)
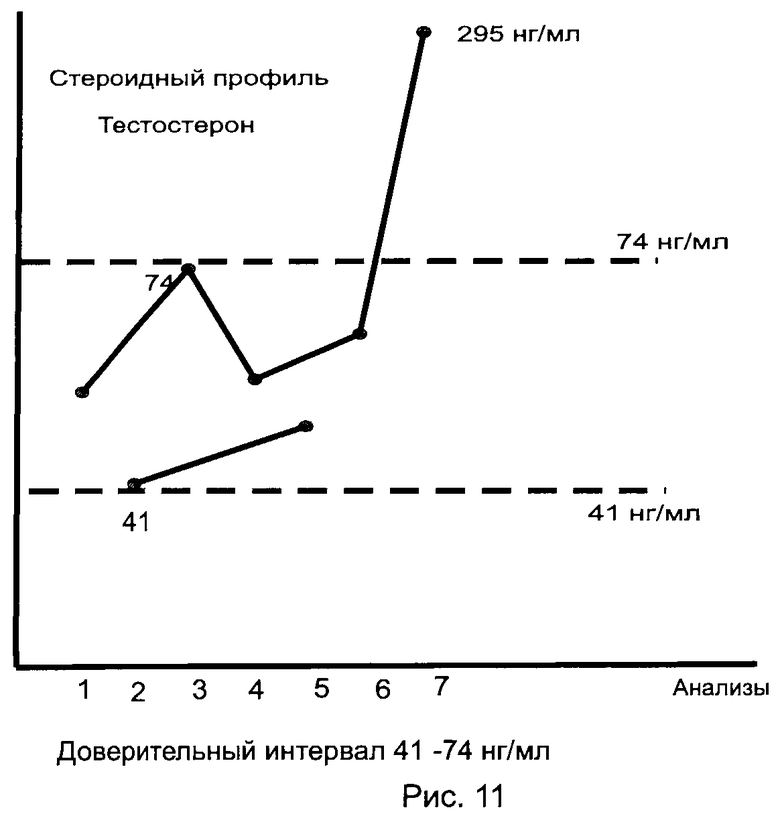
Определяют стероидный профиль добровольца (мужчина, 25 лет). Всего взято 6 анализов с интервалом между анализами 10 дней. Особо следует отметить, что доброволец за весь период наблюдения (60 дней) не принимал допинга и не использовал трансфузию крови. Доверительный интервал значений каждого конкретного ЭС устанавливают как в Примере 4. На 61-й день наблюдения с согласия добровольца ему дали принять капсулу 50 мг тестостерона андеканоата (Андриол) и капсулу ДГЭА 50 мг. Контрольный анализ мочи проводят через 8 часов после приема. На рис.11 и 12 представлены стероидные профили испытуемого по тестостерону и ДГЭА. Следует отметить, что в данном примере одновременно определяют стероидный профиль ЭС по методике, описанной в прототипе (гидролиз Е. coli в фосфатном буфере), при этом нижний предел значения профиля по тестостерону составил 32 нг/мл, а ДГЭА был обнаружен только после приема препарата.
Как видно из описания и приведенных примеров осуществления способа и сравнительных и контрольных примеров, заявляемое изобретение обеспечивает снижение порога чувствительности определения ЭС, расширение номенклатуры определяемых соединений при одновременном повышении достоверности определения стероидного профиля.
Источники информации
1. RU 2190853 C2, G01N 33/74, 2002 г.
2. Хим. фарм. журнал, 1988, т.22, с.622.
3. RU 2313086 C2, G01N 30/72, 2007.
4. J. Anal. toxicol., 2005, v. 29, №4, p.217.
5. WADA Technical Document - TD2004EAAS - прототип.
6. Wada Prohibited List, Version 5.0, 2010.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЪЮГИРОВАННЫХ КСЕНОБИОТИКОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2011 |
|
RU2451936C1 |
| СПОСОБ ВЫБОРА ЛЕЧЕНИЯ АКНЕ У ЖЕНЩИН | 2012 |
|
RU2529789C2 |
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ КЛИНИЧЕСКИ ВАЖНЫХ СТЕРОИДОВ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ЧЕЛОВЕКА | 2007 |
|
RU2380704C2 |
| Способ одновременной диагностики неклассических форм врожденной дисфункции коры надпочечников с недостаточностью 21-гидроксилазы и 11β-гидроксилазы | 2016 |
|
RU2649801C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭНДОГЕННЫХ СТЕРОИДОВ В ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА | 2010 |
|
RU2451292C2 |
| Способ лечения тестикулярной недостаточности у мужчин репродуктивного возраста при гиперэстрогении | 1985 |
|
SU1398870A1 |
| Способ определения 17-кетостероидов в моче | 1985 |
|
SU1328758A1 |
| СПОСОБ РАСПОЗНАВАНИЯ И КЛАССИФИКАЦИИ 3-ОКСОСТЕРОИДОВ И ИХ МЕТАБОЛИТОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2010 |
|
RU2452967C2 |
| ИНГИБИТОРЫ СТЕРОИД-СУЛЬФАТАЗЫ | 1992 |
|
RU2182152C2 |
| Способ получения -галогеноалкил -нитрозокарбаматов или галогеноалкил- -нитрозоаллофанатов стероидных соединений | 1974 |
|
SU512714A3 |






Изобретение относится к области медицины, а именно к спортивной медицине, и может быть использовано для определения стероидного профиля при допинговом контроле спортсменов. Для этого гидролиз пробы мочи осуществляют смесью двух ферментов: β-глюкуронидазы E.coli и арилсульфатазы H.pomatia в объемном соотношении от 1:1 до 1:3 в присутствии цитратного буферного раствора и внутреннего стандарта. Проводят отделение гидролизата, дериватизацию его с последующим хромато/масс-спектральным анализом пробы и регистрацией полученных результатов и определения наличия эндогенных стероидов (ЭС). При этом у спортсмена определяют ЭС по меньшей мере 10-15 раз с интервалом между анализами не менее 10-12 дней. По результатам анализов устанавливают минимальные и максимальные количественные значения каждого из найденных ЭС. Принимают указанные значения за доверительный интервал и выстраивают стероидный профиль спортсмена как совокупность доверительных интервалов всех найденных ЭС. Изобретение обеспечивает определение стероидного профиля, расширение номенклатуры определяемых ЭС и повышение степени достоверности определения ЭС. 12 ил., 5 табл., 5 пр.
Способ определения стероидного профиля при допинговом контроле спортсменов, включающий гидролиз анализируемой пробы мочи ферментом в присутствии буферного раствора и внутреннего стандарта, отделение гидролизата, дериватизацию его, с последующим хромато-масс-спектральным анализом пробы и регистрацией полученных результатов и определения наличия эндогенных стероидов (ЭС), отличающийся тем, что при приготовлении анализируемой пробы гидролиз образца мочи осуществляют смесью двух ферментов: β-глюкуронидазы E.coli и арилсульфатазы H.pomatia в объемном соотношении от 1:1 до 1:3, а в качестве буфера используют цитратный буферный раствор, и при этом у спортсмена определяют ЭС по меньшей мере 10-15 раз с интервалом между анализами не менее 10-12 дней, по результатам анализов устанавливают минимальные и максимальные количественные значения каждого из найденных ЭС, принимают указанные значения за доверительный интервал и выстраивают стероидный профиль спортсмена как совокупность доверительных интервалов всех найденных ЭС.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУММАРНЫХ 17-КЕТОСТЕРОИДОВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 1998 |
|
RU2190853C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФОСФОРОРГАНИЧЕСКИХ ВЕЩЕСТВ | 2006 |
|
RU2313086C2 |
| Способ количественного определения стероидных гормонов в биологических субстратах | 1980 |
|
SU1012138A1 |
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ КЛИНИЧЕСКИ ВАЖНЫХ СТЕРОИДОВ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ЧЕЛОВЕКА | 2007 |
|
RU2380704C2 |
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| КОЧНОВА Е.А | |||
| и др | |||
| Хромато-масс-спектрометрический анализ стероидного профиля спортсмена // Заводская лаборатория, 2010, т.76, №8, с.20-25 | |||
| CATLIN D.H | |||
| et al | |||
| Control of | |||
Авторы
Даты
2012-11-20—Публикация
2011-03-16—Подача