Изобретение относится к области медицины, а точнее к клинической химии, в частности к способам определения уровня содержания эндогенных стероидов в организме.
Известны способы определения органических веществ, в том числе и стероидов, методом газовой хроматографии в сочетании с масс-спектрометрией, например [1-3].
Общим недостатком таких методов является трудоемкая и продолжительная во времени стадия получения летучих производных, для стероидов, что существенно усложняет ход анализа и увеличивает его продолжительность.
Наиболее близким по своей технической сущности и достигаемому результату к заявляемому способу является способ определения стероидов в плазме крови методом высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией (ВЭЖХ-МС) [4].
По указанному способу готовят стандартные растворы веществ-эталонов, снимают и регистрируют хроматографические и масс-спектрометрические характеристики указанных растворов и исследуемой пробы плазмы крови в режиме сканирования в выбранном диапазоне и определяют наличие эндогенных стероидов путем сравнения зарегистрированных времени удержания и соотношений интенсивности характеристичных ионов веществ-эталонов и пробы.
Недостатком указанного способа является высокий порог чувствительности определения стероидов, что требует анализа больших объемов плазмы крови и соответственно забора больших объемов крови, а это естественно травмирует пациента как физически, так и психологически. Кроме того, пробоподготовка требует большого времени (до 1,5 час).
Техническим результатом, на достижение которого направлено создание данного изобретения, является снижение травмируемости пациента при заборе образца крови на исследование за счет снижения количества плазмы крови необходимого для проведения анализа (как результата понижения предела детектирования стероидов) и одновременно сокращение продолжительности проведения анализа.
Поставленный технический результат достигается тем, что в процессе пробоподготовки в образец исследуемой плазмы крови после экстрагирования добавляют внутренний стандарт, делят на две аликвоты, одну из которых химически модифицируют гидроксиламином в кислой среде и вторую ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране, органические слои обоих модифицированных аликвот количественно отделяют, упаривают в токе азота, перерастворяют сухие остатки в мобильной фазе и далее вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией в режиме регистрации положительных ионов с последующей оценкой полученных результатов.
Известно, что стероиды химически достаточно инертны и поэтому они слабо ионизируются в процессе проведения ВЭЖХ-МС/МС анализа с электрораспылительной ионизацией. Указанное обстоятельство приводит к тому, что для получения достоверных результатов анализа приходится исследовать большие объемы плазмы крови (1,5-2,5 мл). Кроме того, пределы детектирования стероидов при проведении вышеуказанного анализа составляют от 10 нг/мл до 2,0 нг/мл. В то же время содержание стероидов у детей пубертального возраста и у женщин постклимактерического возраста составляет <10,0 и до 2,0 пг/мл.
Авторами найдено неожиданное решение: если химически модифицировать стероиды - ввести в молекулу дополнительные, но известные заместители, то такие модифицированные стероиды будут легко ионизироваться и соответственно детектирование их не представит затруднений, при этом существенно снизятся пределы детектирования.
Следует заметить, что в нашем случае стероиды модифицируются по гидроксильной (пиколиновые) и кетогруппам (оксимы), причем одни модифицируются, например тестостерон, обоими системами, другие по одной, как, например, кортизол (оксимы) и эстрадиол (пиколинаты). Для определения эндогенных стероидов в качестве таковых могут быть выбраны, например, андрогены (тестостерон, дегидроэпиандростерон, андростерон и т.п.); эстрогены (эстрон, эстрадиол, эстриол и т.п.); кортикостероиды (кортизол, кортизон, тетрагидро кортизол и т.п.) В том числе могут быть выбраны прегненолон, прегнандиол, прегнантриол, дигидротестостерон, 6β-ОН-кортизол, альдостерон и т.п.
Стандартные растворы аналитов могут быть приготовлены растворением точных навесок в точном объеме растворителя, например метанола. Рабочие растворы могут быть получены разбавлением до соответствующей концентрации.
В качестве химических модификаторов могут быть использованы гидроксиламин и ангидридный реагент - раствор 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране.
В качестве элюента могут быть использованы, например, смеси метанола, ацетата аммония и муравьиной кислоты.
В качестве экстрагента для ЖЖЭ может быть использован метилтретбутиловый эфир (МТБЭ).
В качестве регуляторов рН могут быть использованы гидрокарбонат натрия и карбонат калия.
В качестве системы ВЭЖХ-МС/МС могут быть использованы хромато-масс-спектрометр с тройным квадрупольным анализатором TSQ Quantum фирмы Thermo Finnigan (США), соединенным с высокоэффективным жидкостным хроматографом модели Surveyor, оснащенным автосамплером, насосом высокого давления и дегазатором фирмы Thermo Finnigan (США).
В качестве вспомогательного оборудования могут быть использованы:
- автоматический шейкер фирмы Glas-Col®, США - для ЖЖЭ;
- центрифуга марки Rotina 46R фирмы Hettich, (ФРГ) - для получения контрастной поверхности раздела между органической и водной фазами;
- упариватель фирмы Barnstead Inc.(ClilA), совмещенный с генератором азота марки Mistral-4 фирмы Schmidlin-DBS AG (Чехия) - для упаривания органического экстракта;
- колонка Eclipse XDB-C18, 150×2.1 мм, размер частиц 5 мкм, размер пор 100 Å, фирмы Agilent (США) - для хроматографического разделения.
В качестве мобильной фазы может быть использована система: 0,05% раствор муравьиной кислоты с 20 мМ раствором ацетата аммония (рН 3.0) (А) и метанол (В).
В качестве внутренних стандартов (ISTD) могут быть использованы например D3-тестостерон и метилтестостерон.
Изобретение может быть осуществлено следующим образом.
Растворяют точные навески веществ-эталонов в органических растворителях, разделяют каждый раствор на две аликвоты, одну из которых модифицируют гидроксиламином в кислой среде и вторую ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и
2-метил-6-нитробензойного ангидрида в тетрагидрофуране, органические компоненты каждой модифицированной аликвоты количественно отделяют, упаривают в токе азота, перерастворяют сухие остатки в мобильной фазе и далее вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией в режиме регистрации положительных ионов. Снимают и регистрируют хроматографические и масс-спектрометрические характеристики веществ-эталонов (детектируют не менее трех характеристических ионов каждого эталонного вещества, определяют время удержания, молекулярную массу, прекурсор-ионы, характеристичные ионы, нижний предел обнаружения) и полученные результаты вводят в программное обеспечение, например Xcalibur версии 1.3 фирмы Thermo Finnigan, США.
Далее проводят пробоподготовку, при которой к образцу исследуемой плазмы крови добавляют внутренний стандарт, экстрагируют МТБЭ и делят экстракт на две аликвоты, одну из которых модифицируют гидроксиламином в кислой среде и вторую ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране, органические слои обоих модифицированных аликвот количественно отделяют, упаривают в токе азота, перерастворяют сухой остаток в мобильной фазе и далее каждую аликвоту вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией в режиме регистрации положительных ионов с последующей оценкой полученных результатов путем сравнения зарегистрированных показателей времени удержания и соотношения интенсивности характеристичных ионов во всех растворах и пробах.
Следует отметить, что заявляемый способ определения эндогенных стероидов позволяет сократить продолжительность проведения анализа в 1,5-2,0 раза по сравнению с прототипом.
Для лучшего понимания изобретение может быть проиллюстрировано, но не исчерпано следующими примерами его конкретного осуществления.
Пример 1
А. Получение масс-спектров, определение характеристических ионов, времени удержания и пределов детектирования исследуемых стероидов
Готовят стандартные растворы аналитов (1 мг/мл): кортизола, кортизона, тестостерона, дегидроэпиандростерона, андростерона, эстрона, эстрадиола, эстриола, кортизола, кортизона, тетрагидрокортизола, прегненолона, прегнандиола, прегнантриола, дигидротестостерона, 6β-ОН-кортизола и альдостерона (естественно разумеется, что из имеющегося массива известных стероидов вышеперечисленые стероиды выбраны по случайной схеме). Рабочие растворы готовят растворением точной навески стероидов-эталонов в метаноле. Далее получают рабочие растворы стероидов разбавлением стандартных растворов до содержания 10 мкг/мл. Из каждого рабочего раствора отбирают по две аликвоты объемом 100 мкл, вводят внутренний стандарт (D3-тестостерон и метилтестостерон) и химически модифицируют их. Параметры модификации: гидроксиламином в кислой (HCl) среде - 30-35 мин, 60-70°C; ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране - 35-40 мин, температура комнатная. Органические слои обоих модифицированных аликвот количественно отделяют, упаривают в токе азота, перерастворяют сухой остаток в мобильной фазе состава: 0,05% раствор муравьиной кислоты с 20 мМ раствором ацетата аммония (рН 3.0).
Приготовленные таким образом рабочие растворы вводят в систему ВЭЖХ-МС/МС (хромато-масс-спектрометр с тройным квадрупольным анализатором TSQ Quantum фирмы Thermo Finnigan (США), соединенным с высокоэффективным жидкостным хроматографом модели Surveyor, оснащенным автосамплером, насосом высокого давления и дегазатором фирмы Thermo Finnigan (США). Анализ ведут при скорости потока подвижной фазы 0.2 мл/мин. Определяемые вещества разделяют градиентным элюированием при условиях: 0 мин - 40% В; 8-9 мин - 90% В; 12-18 мин - 40% В; общее время анализа с учетом стабилизации системы перед вводом следующего образца составляет 18 мин. Ионизацию при атмосферном давлении осуществляют электрораспылением в режиме регистрации положительных ионов. Напряжение на капилляре - 3.8 кВ; температура капилляра 245°C; скорость потока осушающего газа (азот) - 0.45 л/мин; скорость потока газа (аргон) в камере соударения - 0.075 л/мин; температура в камере ионизации 200°C; давление на распылителе - 2 атм.
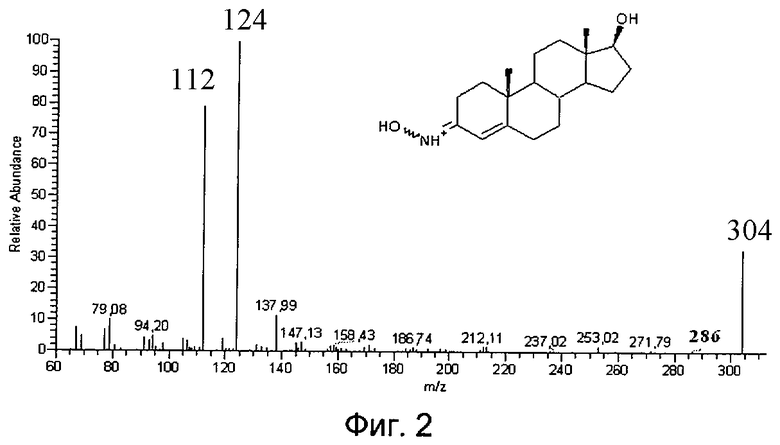
Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Ширина пика для прекурсор-ионов и соответствующих характерных ионов на первом квадруполе (Q1) и третьем квадруполе (Q3) составляет 0.5 а.е.м, (на половине высоты), время задержки - 5 мс. Обработку полученных данных (масс-спектры, характеристические ионы, время удержания и пределы детектирования исследуемых стероидов) проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Результаты анализа стероидов-эталонов (выборочно) представлены в Таблице 1.
На Фиг.1 представлен МС/МС спектр немодифицированного тестостерона.
На Фиг.2 представлен МС/МС спектр оксим-производного тестостерона.
На Фиг.3 представлен МС/МС спектр кето-производного тестостерона.
Результаты анализа немодифицированных стероидов (выборочно) представлены в Таблице 2.
Б. Подготовка пробы и анализ исследуемой плазмы крови.
У пациента (мужчина, 35 лет) получают образец крови забором из вены (6,5 мл), отделяют плазму, разделяют ее на три части: объемом 1,5 мл, объемом 200 мкл и 100 мкл. В первую часть добавляют 50 мкл раствора внутреннего стандарта, содержащего D3-тестостерон (10 нг/мкл) и метилтестостерон (10 нг/мкл), подщелачивают до рН 9.5-10.0 смесью гидрокарбоната натрия и карбоната калия (1:2), добавляют 5 г сульфата аммония и далее экстрагируют с 5 мл МТБЭ в течение 10 мин на автоматическом экстракторе. Центрифугируют при 2000 об/мин в течение 5 мин, органический экстракт упаривают досуха в токе азота. Сухой остаток растворяют в 100 мкл метанола, затем 15 мкл раствора вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации положительных ионов. Анализ ведут при следующих параметрах. Скорость потока подвижной фазы 0,2 мл/мин. Определяемые вещества разделяют градиентным элюированием при условиях: 0 мин - 40% В; 8-9 мин - 90% В; 12-18 мин - 40% В, общее время анализа с учетом стабилизации системы перед вводом следующего образца составляет 18 мин. Ионизацию при атмосферном давлении осуществляют электрораспылением в режиме регистрации положительных ионов. Напряжение на капилляре - 3.8 кВ; температура капилляра - 245°C; скорость потока осушающего газа (азот) - 0.45 л/мин; скорость потока газа (аргон) в камере соударения - 0.075 л/мин; температура в камере ионизации 200°C; давление на распылителе - 2 атм. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Ширина пика для прекурсор-ионов и соответствующих характерных ионов на первом квадруполе (Q1) и третьем квадруполе (Q3) составляет 0.5 а.е.м. (на половине высоты), время задержки 5 мс. В Таблице 3 представлены обнаруженные вещества (стероиды) и найденные пределы детектирования определяемых в плазме крови веществ.
Вторую часть плазмы крови (200 мкл) разделяют на две аликвоты по 100 мкл, вводят в них внутренний стандарт как указано выше и химически модифицируют их. Параметры модификации те же, что и при приготовлении растворов стероидов-эталонов. Органические слои модифицированных аликвот количественно отделяют экстракцией ДМТБЭ, упаривают в токе азота, перерастворяют сухие остатки в 100 мкл мобильной фазы состава: 0,05% раствор муравьиной кислоты с 20 мМ раствором ацетата аммония (рН 3.0), далее 15 мкл раствора вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации положительных ионов. Анализ ведут при тех же параметрах, что и в части «Б» описываемого примера. В Таблице 4 представлены характеристики стероидов, обнаруженных в пробе плазмы.
Установлено, что в исследуемом образце плазмы крови содержатся тестостерон оксим, тестостерон пиколинат, дегидроэпиандростерон пиколинат и андростендион диоксим.
Далее третью часть плазмы крови (100 мкл) подвергают анализу как в первом абзаце части Б Примера 1 (без химической модификации). Результаты анализа отрицательные - ни один стероид не был обнаружен.
Из сопоставления данных Таблиц 1-4 со всей очевидностью вытекает, что, во-первых, двойная химическая модификация стероидов обеспечивает снижение порога детектирования стероидов с 2000-10000 пг для немодифицированных до 2,0-5,0 пг для модифицированных гидроксиламином и до 2-5 пг для карбоксилатных производных; во-вторых, существенно (в 15-20 раз) уменьшается количество плазмы крови, необходимой для проведения анализа.
Примеры 2-4
Забирают по 100 мкл крови из безымянного пальца у трех пациентов: а) женщина постклимактерического возраста (67 лет), б) ребенок пубертального возраста (мальчик 12,5 лет) и в) ребенок пубертального возраста (девочка, 12,5 лет); из каждого образца крови отделяют плазму, разделяют ее на две равные части, добавляют внутренний стандарт, далее обе части химически модифицируют как в Примере 1, далее экстрагируют МТБЭ. Затем оба экстракта упаривают досуха в токе азота, перерастворяют в 50 мкл мобильной фазы состава 40/60 метанол/0,02% р-р муравьиной кислоты с 20 мМ р-ром ацетата аммония и далее каждую аликвоту вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией в режиме регистрации положительных ионов (параметры процесса осуществления анализа такие же, как в Примере 1). Результаты анализа представлены в Таблицах 5, 6 и 7 (по порядку пациентов - женщина 67 лет, мальчик 12,5 лет и девочка 12,5 лет соответственно).
Как видно из описания и приведенных примеров осуществления способа, заявляемое изобретение обеспечивает высокую точность определения стероидов, снижает порог детектирования, позволяет уменьшить количество плазмы крови, необходимое для проведения анализа при одновременном сокращении времени проведения анализа.
Источники информации
1. Хим. фарм. Журнал, 1988, т.22, с.622.
2. RU 2313086 C2, G01N 30/72, 2007.
3. J. Anal. Toxicol., 2005, v.29, №4, p.217.
4. Rapid Communications in Mass Spectroscopy, 20(22), p.3465-3476 - прототип.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАСПОЗНАВАНИЯ И КЛАССИФИКАЦИИ 3-ОКСОСТЕРОИДОВ И ИХ МЕТАБОЛИТОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2010 |
|
RU2452967C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕРОИДНОГО ПРОФИЛЯ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2011 |
|
RU2467331C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ПРОФИЛИРОВАНИЯ СТЕРОИДОВ В СЛЮНЕ ЧЕЛОВЕКА | 2024 |
|
RU2833902C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДОПИНГА У ЛОШАДЕЙ | 2011 |
|
RU2489719C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КСЕНОБИОТИКОВ В МОЧЕ ЧЕЛОВЕКА ПРИ ДОПИНГОВОМ КОНТРОЛЕ | 2008 |
|
RU2390773C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ЭКЗОГЕННЫХ СТЕРОИДОВ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ЧЕЛОВЕКА | 2012 |
|
RU2483309C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРИЕМА КОРТИКОТРОПИНОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2008 |
|
RU2384846C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЪЮГИРОВАННЫХ КСЕНОБИОТИКОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2011 |
|
RU2451936C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРИЕМА ЭРИТРОПОЭТИНА ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2008 |
|
RU2390779C2 |
| Способ определения производных катехоламинов в моче | 2018 |
|
RU2688184C1 |

Изобретение относится к области медицины, а точнее к клинической химии, в частности к способам оценки уровня содержания эндогенных стероидов в организме. Предложенный способ определения эндогенных стеоидов в плазме крови человека включает приготовление растворов веществ-эталонов в органическом растворителе, приготовление анализируемой пробы путем экстракции. Затем осуществляют упаривание экстракта и растворение сухого остатка в мобильной фазе. Далее проводят хроматографическое разделение и масс-спектральный анализ эталонных растворов и анализируемой пробы. Затем регистрируют полученные результаты с последующим определением наличия эндогенных стероидов. При этом в процессе пробоподготовки образец исследуемой плазмы крови экстрагируют. Экстракт делят на две аликвоты, одну из которых модифицируют гидроксиламином в кислой среде и вторую ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране. При этом органические слои обоих модифицированных аликвот количественно отделяют. Затем их упаривают в токе азота, перерастворяют сухие остатки в мобильной фазе и далее осуществляют хроматографическое разделение и масс-спектральный анализ приготовленных проб. Наличие эндогенных стероидов определяют по сравнению показателей времени удержания и соотношения интенсивности характеристичных ионов в пробах и растворах веществ-эталонов.
Техническим результатом изобретения является повышение точности определения стероидов и снижение количества плазмы крови, необходимой для проведения анализа. 7 табл., 3 ил., 4 пр.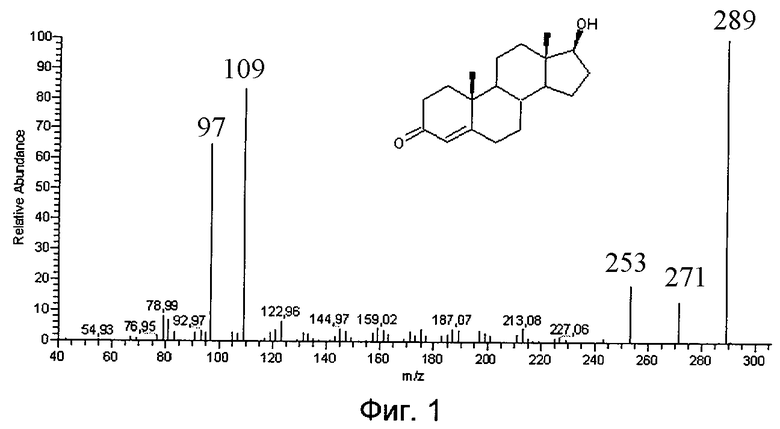
Способ определения эндогенных стероидов в плазме крови человека, включающий приготовление растворов веществ-эталонов в органическом растворителе, приготовление анализируемой пробы путем экстракции, упаривания экстракта и растворения сухого остатка в мобильной фазе с последующим хроматографическим разделением и масс-спектральным анализом эталонных растворов и анализируемой пробы, а также регистрацию полученных результатов и определение наличия стероидов, отличающийся тем, что при проведении пробоподготовки в образец исследуемой плазмы крови добавляют внутренний стандарт, экстрагируют, экстракт делят на две аликвоты, одну из которых модифицируют гидроксиламином в кислой среде и вторую - ангидридным реагентом в виде раствора 4-диметиламинопиридина, триэтиламина и 2-метил-6-нитробензойного ангидрида в тетрагидрофуране, органические слои обоих модифицированных аликвот количественно отделяют, упаривают в токе азота, перерастворяют сухие остатки в мобильной фазе и далее осуществляют хроматографическое разделение и масс-спектральный анализ приготовленной пробы и наличие эндогенных стероидов определяют по сравнению показателей времени удержания и соотношения интенсивности характеристичных ионов в пробе и растворах веществ-эталонов.
| М.MAZZARINO, F.BOTRÈ A fast liquid chromatographic/mass spectrometric screening method for the simultaneous detection of synthetic glucocorticoids, some stimulants, anti-oestrogen drugs and synthetic anabolic steroids, Rapid Commun Mass Spectrom | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Способ количественного определения стероидных гормонов | 1987 |
|
SU1490650A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ИЗ ГИДРОБИОНТОВ, СПОСОБ ПРИГОТОВЛЕНИЯ КИСЛОМОЛОЧНОГО ПРОДУКТА И СПОСОБ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА ТРИТЕРПЕНОВЫХ ГЛИКОЗИДОВ | 1995 |
|
RU2095000C1 |
| ВЫСОКОМЕЧЕННЫЕ ТРИТИЕМ 5α- И 5β-[4,5-H]ПРЕГНАН-3,20-ДИОНЫ И СПОСОБ ИХ ОПРЕДЕЛЕНИЯ В ПЛАЗМЕ КРОВИ | 2001 |
|
RU2183123C1 |
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ КЛИНИЧЕСКИ ВАЖНЫХ СТЕРОИДОВ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ЧЕЛОВЕКА | 2007 |
|
RU2380704C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ПРЕПАРАТОВ ДЛЯ МЫТЬЯ | 1912 |
|
SU4300A1 |
Авторы
Даты
2012-05-20—Публикация
2010-02-09—Подача