Область техники
Настоящее изобретение относится к средству для содействия адгезии роговичных эндотелиальных клеток, которое применяется для адгезии, поддержания или сохранения роговичных эндотелиальных клеток.
Предшествующий уровень техники
Зрительная информация воспринимается когда свет, поступающий от роговицы (прозрачной ткани в самой передней части глазного яблока), достигает сетчатки для возбуждения нервных клеток сетчатки, и возникающие электрические сигналы передаются в зрительную кору головного мозга через зрительный нерв. Для того чтобы иметь хорошее зрение, роговица должна быть прозрачной. Прозрачность роговицы сохраняется, когда содержание воды поддерживается на постоянном уровне насосной функцией и барьерной функцией роговичных эндотелиальных клеток.
У человека при рождении плотность роговичных эндотелиальных клеток составляет примерно 3000 клеток на 1 мм2. После повреждения клетки утрачивают способность к регенерации. При дистрофии роговичного эндотелия и буллезной кератопатии, в результате функционального расстройства роговичного эндотелия, вызванного различными причинами, происходит отек и помутнение роговицы и значительно снижается зрение. В настоящее время буллезная кератопатия лечится проникающей кератопластикой, при которой трансплантируется вся трехслойная структура эпителия, паренхимы и эндотелия роговицы. Однако донорство роговицы в Японии недостаточно и хотя имеется примерно 5500 пациентов, ожидающих трансплантацию роговицы, ежегодно в Японии выполняется примерно 2700 трансплантаций роговицы.
В последние годы внимание офтальмологов привлекала идея «частичной трансплантации», при которой трансплантация производится только на пораженные участки ткани с целью снижения риска реакции отторжения и послеоперационных осложнений, в результате чего может быть достигнуто улучшение зрительной функции. Из роговичных трансплантатов выполнялась эпителиальная трансплантация для трансплантации только роговичного эпителия, эпителиальная трансплантация культивированной слизистой оболочки ротовой полости для трансплантации слизистой оболочки ротовой полости вместо роговичного эпителия, ламеллярная кератопластика глубокой пластины для трансплантации паренхимальной ткани и тому подобная. Рассматривается также способ трансплантации только роговичного эндотелия. Для трансплантации роговичного эндотелия известно использование подобного роговичному эндотелию листка, состоящего из слоя роговичного эндотелия, культивированного на слое коллагена (см. патентные документы 1 и 2). Однако получение культивированных клеток в количествах, требуемых для трансплантации роговичных эндотелиальных клеток, особенно тех которые получены у людей, требует затрат времени и средств, поскольку число доноров роговицы ограничено и культивирование in vitro затруднительно.
Человеческие эмбриональные стволовые (ES) клетки проявляют высокую ауторепликационную способность и мультипотентность и привлекают внимание с точки зрения применения в медицине. Однако использование этих клеток связано с практической проблемой резко сниженного числа клеток, поскольку операция по дисперсии клеток на стадии культивирования легко вызывает гибель клеток. Недавно было обнаружено, что гибель клеток, которая происходит во время культивирования ES клеток, вызвана активацией Rho киназы (ROCK), и ингибирование ROCK заметно подавляет гибель клеток, и сообщается, что использование ингибитора ROCK, такого как Y-27632 и ему подобных, может предоставить возможность массового культивирования человеческих ES клеток и получения церебральных клеток (непатентный документ 1).
Известно, что ингибиторы Rho киназы (ROCK) оказывают различные виды действия. Например, в патентном документе 3 указано, что ингибиторы Rho киназы содействуют образованию роговичных нейритов, и что ингибиторы Rho киназы применяются в качестве средства для восстановления роговичного чувствительного восприятия. Кроме того, в патентном документе 4 указано, что ингибиторы Rho киназы оказывают действие, вызывающее разрастание аксонов на клетках сетчаточных ганглиев, и применяются для лечения нарушения зрительной функции.
Патентный документ 1: JP-A-2004-24852
Патентный документ 2: JP-A-2005-229869
Патентный документ 3: WO2005/118582
Патентный документ 4: WO2002/083175
Непатентный документ 1: Nat Biotechnol. 2007, 25, 681.
Описание изобретения
Проблемы, которые решены изобретением
Задачей настоящего изобретения является предоставление средства, способного эффективно прикреплять роговичные эндотелиальные клетки, и средства для стабильной доставки препарата роговичного эндотелия.
Средства решения проблем
Заявители провели интенсивные исследования в связи с указанными выше проблемами и обнаружили, что адгезии роговичных эндотелиальных клеток к подложке культуры может значительно способствовать культивирование клеток в присутствии ингибитора Rho киназы, что привело к созданию настоящего изобретения. Соответственно, настоящее изобретение предоставляет следующее.
[1] Средство для содействия адгезии роговичных эндотелиальных клеток, содержащее ингибитор Rho киназы.
[2] Средство по [1], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[3] Средство по [1], где роговичные эндотелиальные клетки получены у человека.
[4] Средство по любому из [1]-[3], которое представляет собой препарат для профилактики или лечения дисфункции роговичного эндотелия.
[5] Средство по [4], которое представлено в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
[6] Культуральная среда для роговичных эндотелиальных клеток, содержащая ингибитор Rho киназы.
[7] Культуральная среда по [6], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[8] Культуральная среда по [6], где роговичные эндотелиальные клетки получена у человека.
[9] Раствор для консервации роговицы, содержащий ингибитор Rho киназы.
[10] Раствор для консервации по [9], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[11] Раствор для консервации по [9], где роговица получена у человека.
[12] Способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды по любому из пп. [6]-[8].
[13] Способ по [12], где роговичные эндотелиальные клетки получены у человека.
[14] Применение ингибитора Rho киназы для получения средства для содействия адгезии роговичных эндотелиальных клеток.
[15] Применение по [14], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[16] Применение по [14], где роговичные эндотелиальные клетки получены у человека.
[17] Применение по любому из [14]-[16], где средство для содействия адгезии роговичных эндотелиальных клеток представляет собой препарат для профилактики или лечения дисфункции роговичного эндотелия.
[18] Применение по [17], где средство для содействия адгезии роговичных эндотелиальных клеток представлено в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
[19] Применение ингибитора Rho киназы для получения культуральной среды для роговичных эндотелиальных клеток.
[20] Применение по [19], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[21] Применение по [19], где роговичные эндотелиальные клетки получены у человека.
[22] Применение ингибитора Rho киназы для получения раствора для консервации роговицы.
[23] Применение по [22], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[24] Применение по [22], где роговица получена у человека.
[25] Способ содействия адгезии роговичных эндотелиальных клеток, включающий контакт эффективного количества ингибитора Rho киназы с мишенью или роговичной эндотелиальной клеткой, требующей содействия в адгезии роговичных эндотелиальных клеток.
[26] Способ по [25], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[27] Способ по [25], где роговичные эндотелиальные клетки получена у человека.
[28] Способ по [25], который нацелен на профилактику или лечение дисфункции роговичного эндотелия.
[29] Способ по [25], включающий введение эффективного количества ингибитора Rho киназы в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
[30] Способ культивирования роговичных эндотелиальных клеток, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы.
[31] Способ по [30], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[32] Способ по [30], где роговичные эндотелиальные клетки получены у человека.
[33] Способ защиты роговицы, включающий стадию удерживания роговичного трансплантата или роговичных эндотелиальных клеток в растворе для защиты роговицы, содержащем ингибитор Rho киназы.
[34] Способ по [33], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[35] Способ по [33], где роговица получена у человека.
[36] Способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы.
[37] Способ по [36], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[38] Способ по [36], где роговичные эндотелиальные клетки получены у человека.
[39] Способ лечения буллезной кератопатии, отека роговицы или лейкомы роговицы, включающий
стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы, и
стадию трансплантации препарата роговичного эндотелия, полученного на указанной выше стадии культивирования, индивидууму, нуждающемуся в трансплантации роговичного эндотелия.
[40] Способ по п. [39], где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
[41] Способ по п. [39], где роговичные эндотелиальные клетки получены у человека.
Эффект изобретения
Средство для содействия адгезии роговичных эндотелиальных клеток по настоящему изобретению содержит ингибитор Rho киназы в качестве активного ингредиента. Средство для содействия адгезии роговичных эндотелиальных клеток по настоящему изобретению содействует адгезии роговичных эндотелиальных клеток и обеспечивает возможность образования слоя роговичных эндотелиальных клеток, имеющего хорошую клеточную морфологию и высокую клеточную плотность. Поэтому, его можно применять в качестве терапевтического средства или профилактического средства по поводу заболевания, сопровождающегося дисфункцией роговичного эндотелия, такого как буллезная кератопатия и роговичный эндотелиит. Средство для содействия адгезии роговичных эндотелиальных клеток по настоящему изобретению можно применять в качестве средства для защиты роговичного эндотелия при лечении или профилактике заболевания, сопровождающегося дисфункцией роговичного эндотелия. Кроме того, средство для содействия адгезии роговичных эндотелиальных клеток по настоящему изобретению может использоваться в качестве средства для защиты роговичного эндотелия при лечении или профилактике дисфункции роговичного эндотелия, связанной с внутриглазными операциями, такими как операция по поводу катаракты, операция на стекловидном теле и тому подобные, дисфункции роговичного эндотелия, вызванной повышенным внутриглазным давлением (в частности, глаукоматозным приступом), или дисфункции роговичного эндотелия, вызванной недостаточным поступлением кислорода вследствие ношения контактных линз. Поскольку культуральная среда или раствор для консервации роговицы по настоящему изобретению содержит ингибитор Rho киназы, то роговичные эндотелиальные клетки могут быть хорошо культивированы, поддержаны или сохранены, и обеспечивается стабильная доставка, поддержание или сохранение препарата роговичного эндотелия.
Краткое описание чертежей
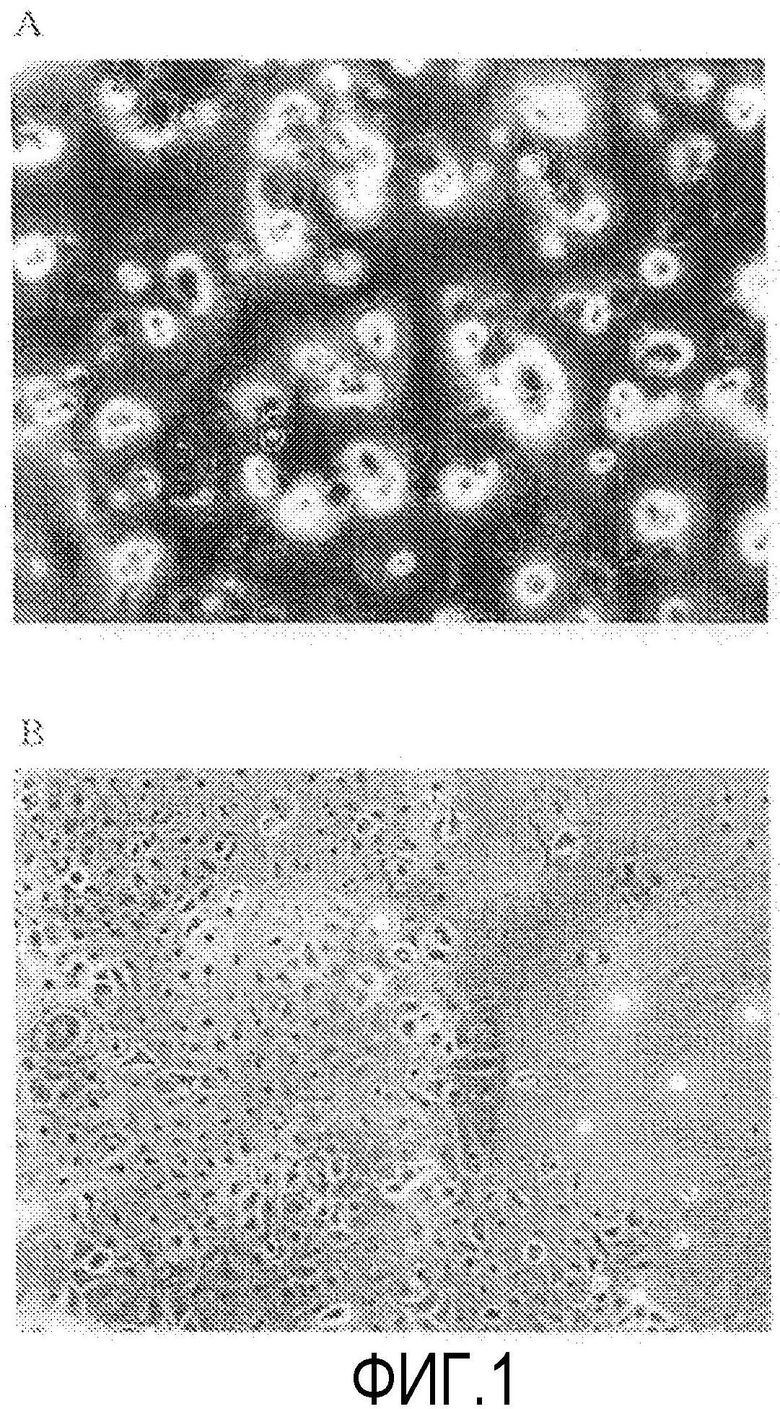
Фиг.1 представляет фазово-контрастную микрофотографию первичной культуры кроличьих роговичных эндотелиальных клеток (через 24 ч от начала культивирования, увеличение в 100 раз).
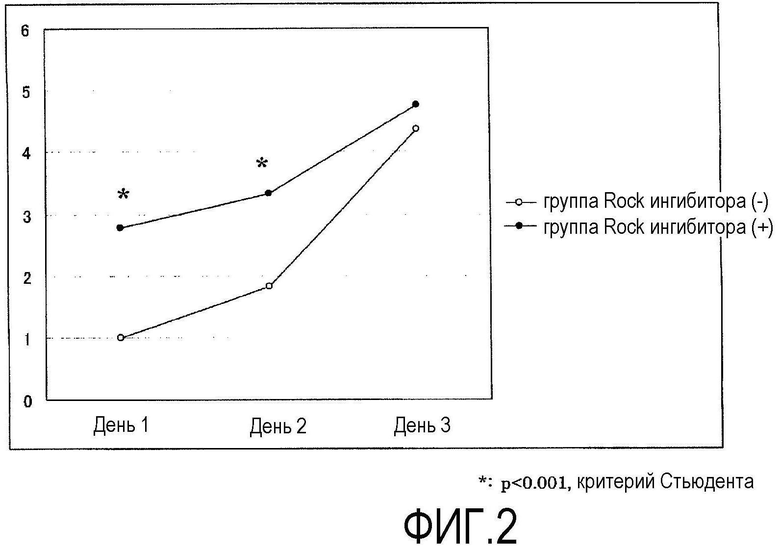
Фиг.2 представляет график, показывающий рост первичной культуры кроличьих роговичных эндотелиальных клеток, исследованных анализом MTS, где по вертикальной оси показана величина спектральной поглощательной способности группы Rock ингибитора (-) в 1-й день.
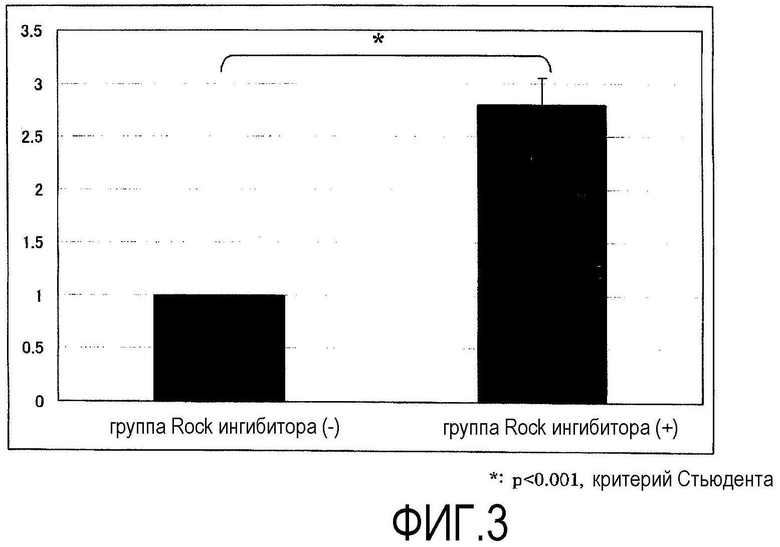
Фиг.3 представляет график, показывающий адгезию первичной культуры кроличьих роговичных эндотелиальных клеток через 24 ч от начала культивирования, где по вертикальной оси показана величина спектральной поглощательной способности группы Rock ингибитора (-) через 24 ч от начала культивирования.
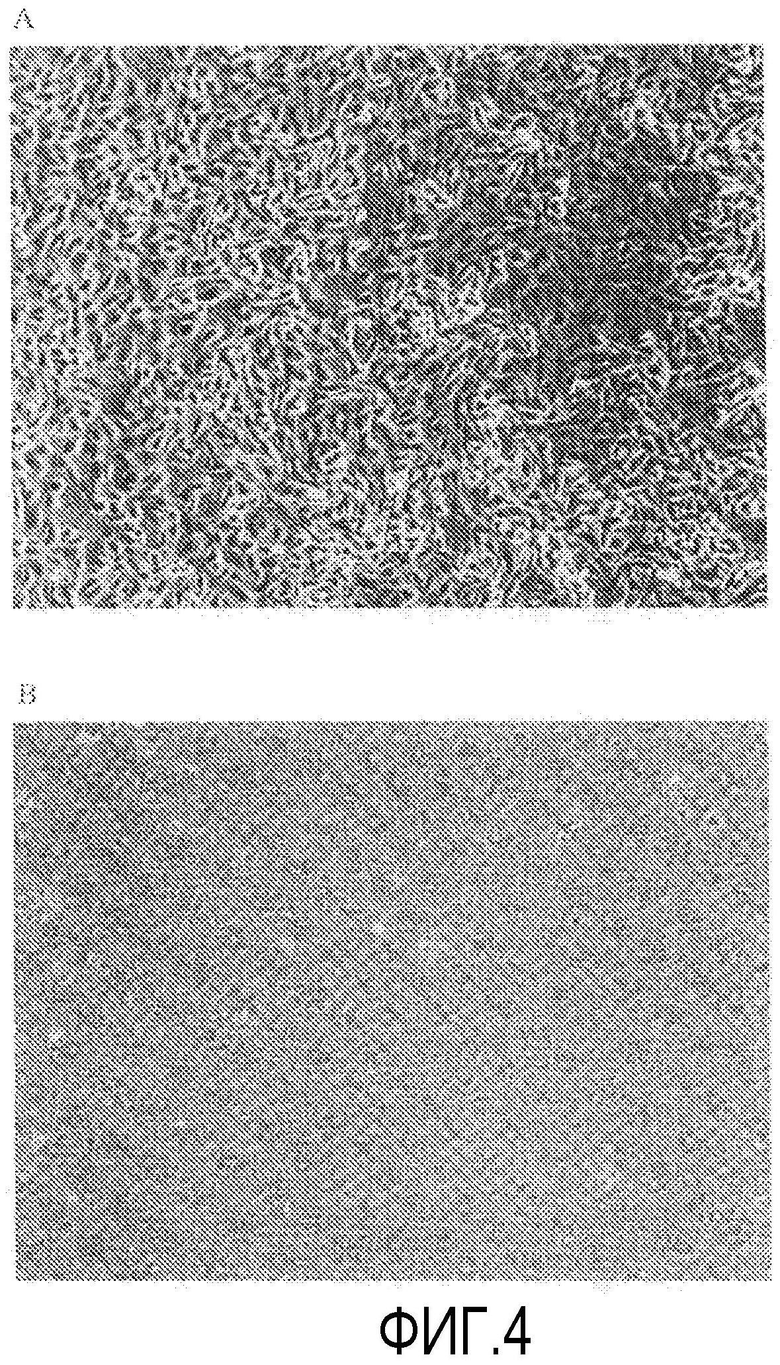
Фиг.4 представляет фазово-контрастную микрофотографию первичной культуры обезьяньих роговичных эндотелиальных клеток на 3-й день от начала культивирования при увеличении в 100 раз.
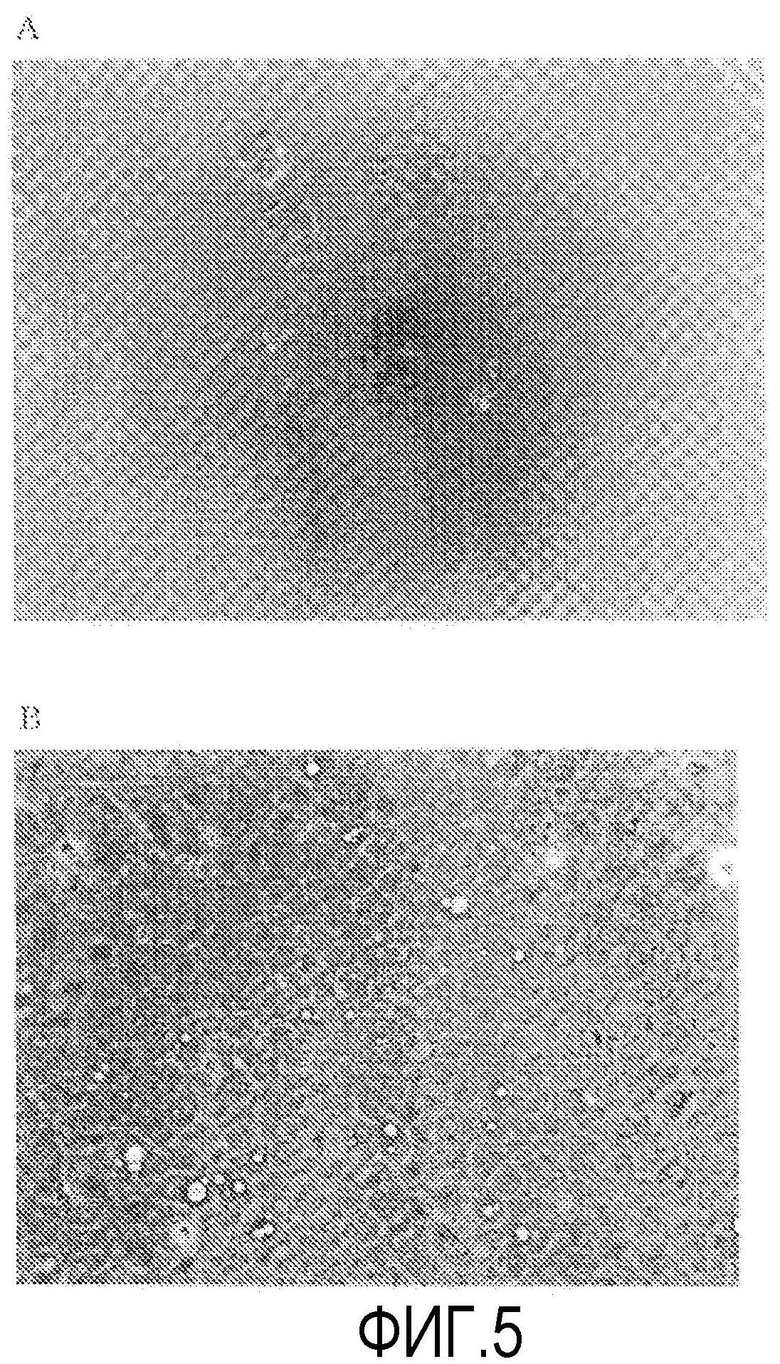
Фиг.5 представляет фазово-контрастную микрофотографию первичной культуры человеческих роговичных эндотелиальных клеток (7-й день, увеличение в 100 раз).
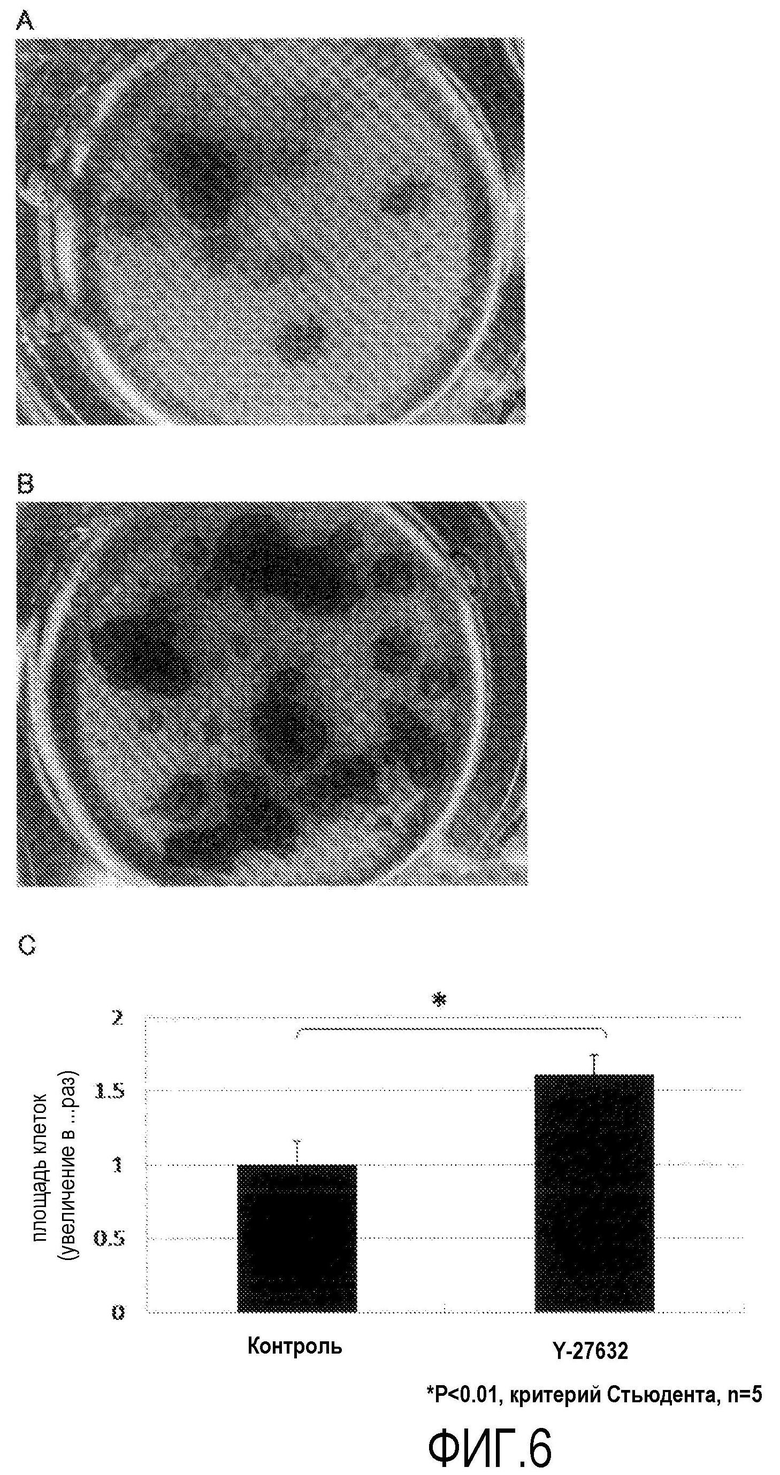
На фиг.6 показана фотография первичной культуры обезьяньих роговичных эндотелиальных клеток (А: ROCK ингибитор (-), В: ROCK ингибитор (+), увеличение в 20 раз) и график (С), показывающий общую площадь культивированных клеток.
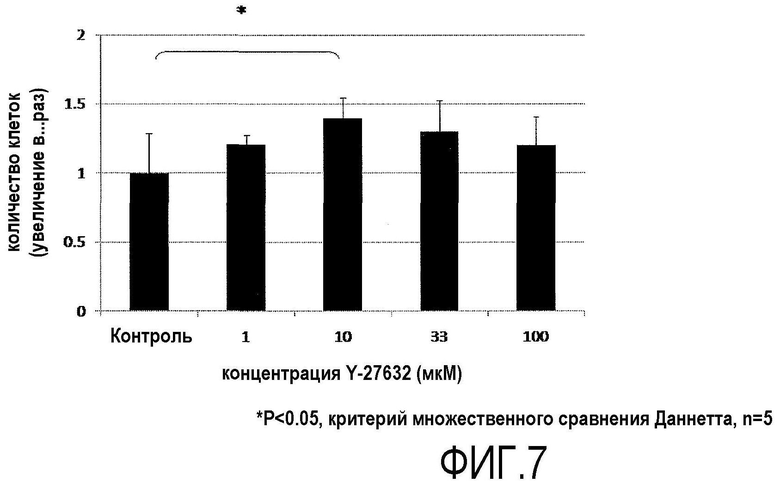
Фиг.7 представляет график, показывающий число жизнеспособных клеток первичной культуры обезьяньих роговичных эндотелиальных клеток.
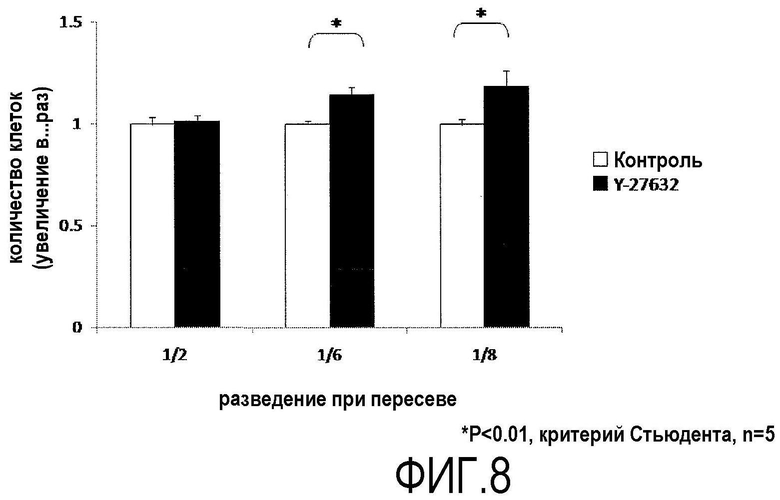
Фиг.8 представляет график, показывающий влияние Y-27632 на пересеваемую культуру обезьяньих роговичных эндотелиальных клеток.
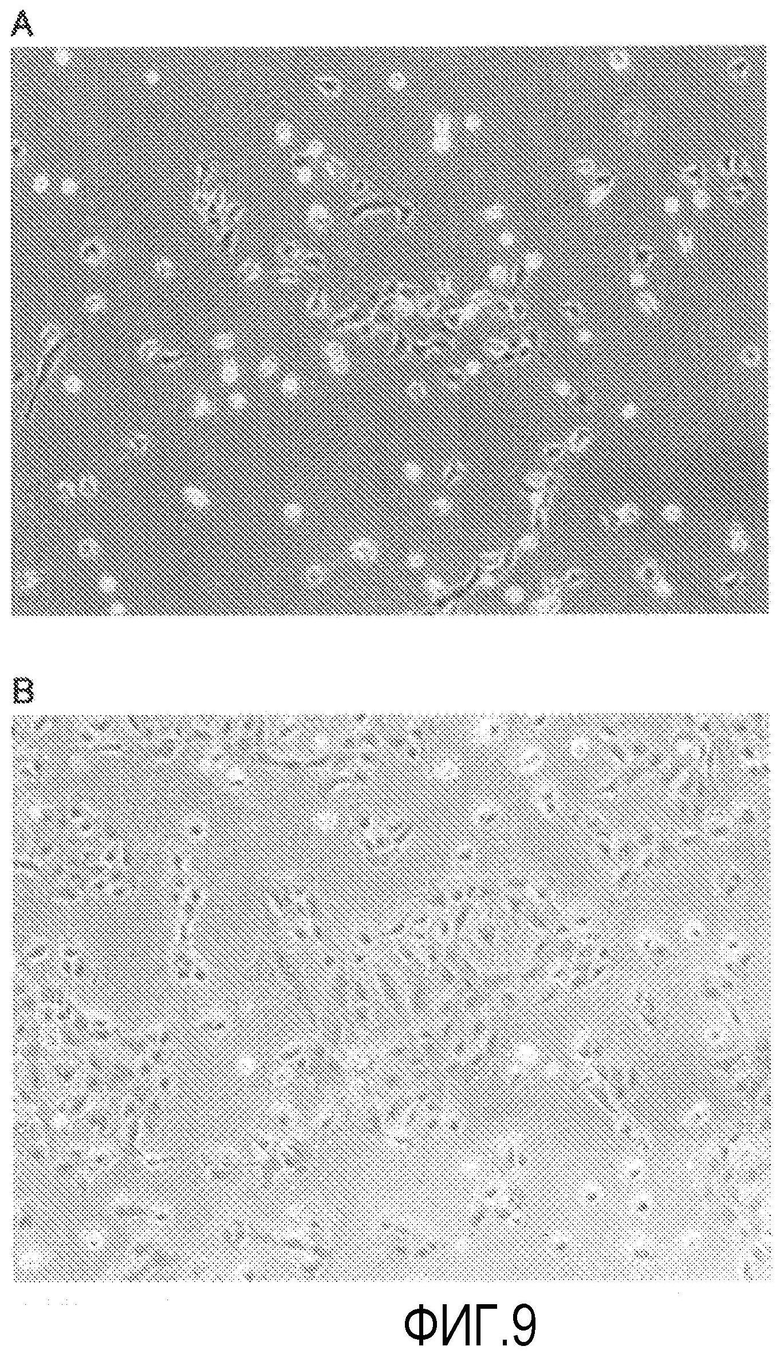
Фиг.9 представляет фазово-контрастную микрофотографию, показывающую влияние Y-27632 на клеточную морфологию во время пересеваемого культивирования обезьяньих роговичных эндотелиальных клеток (100-кратное увеличение).
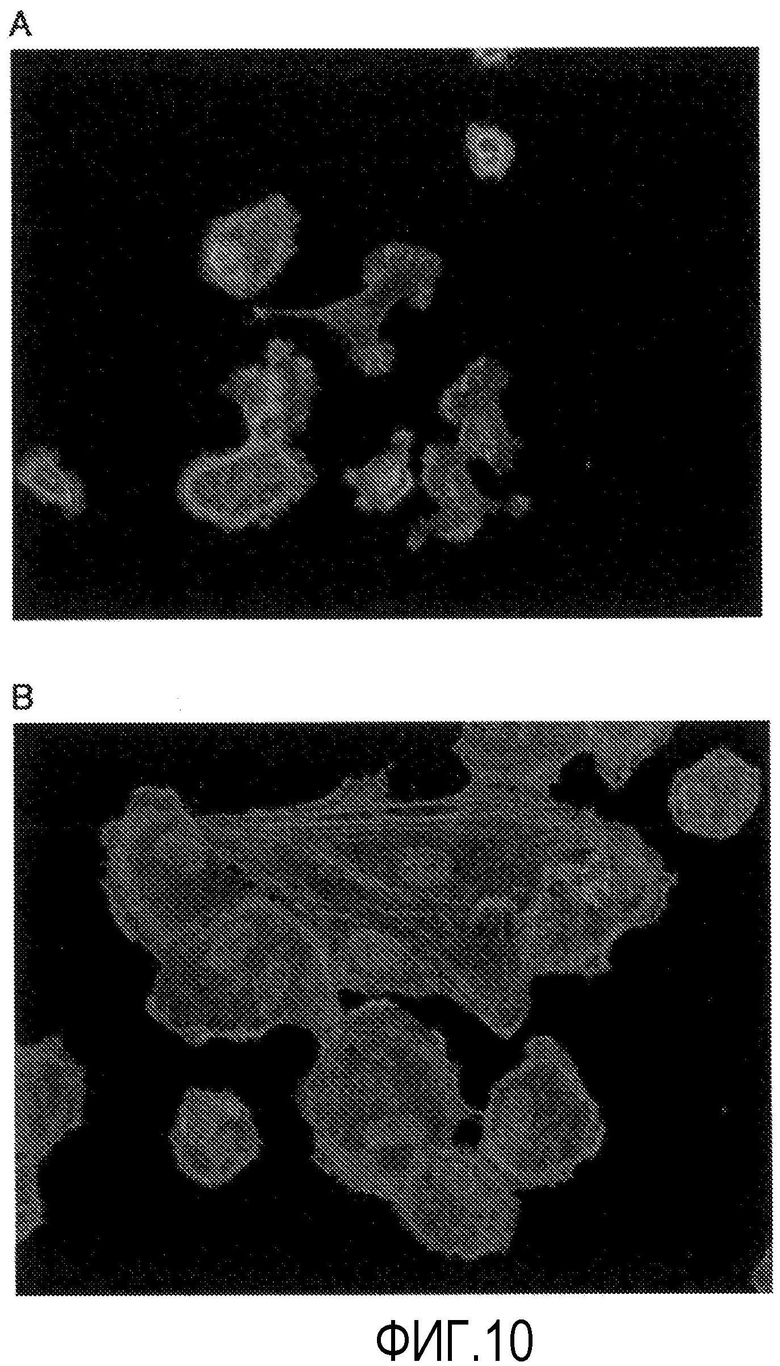
Фиг.10 представляет фазово-контрастную микрофотографию, показывающую влияние Y-27632 на клеточную морфологию во время пересеваемого культивирования обезьяньих роговичных эндотелиальных клеток (флюоресцентное окрашивание фаллоидином, 200-кратное увеличение).
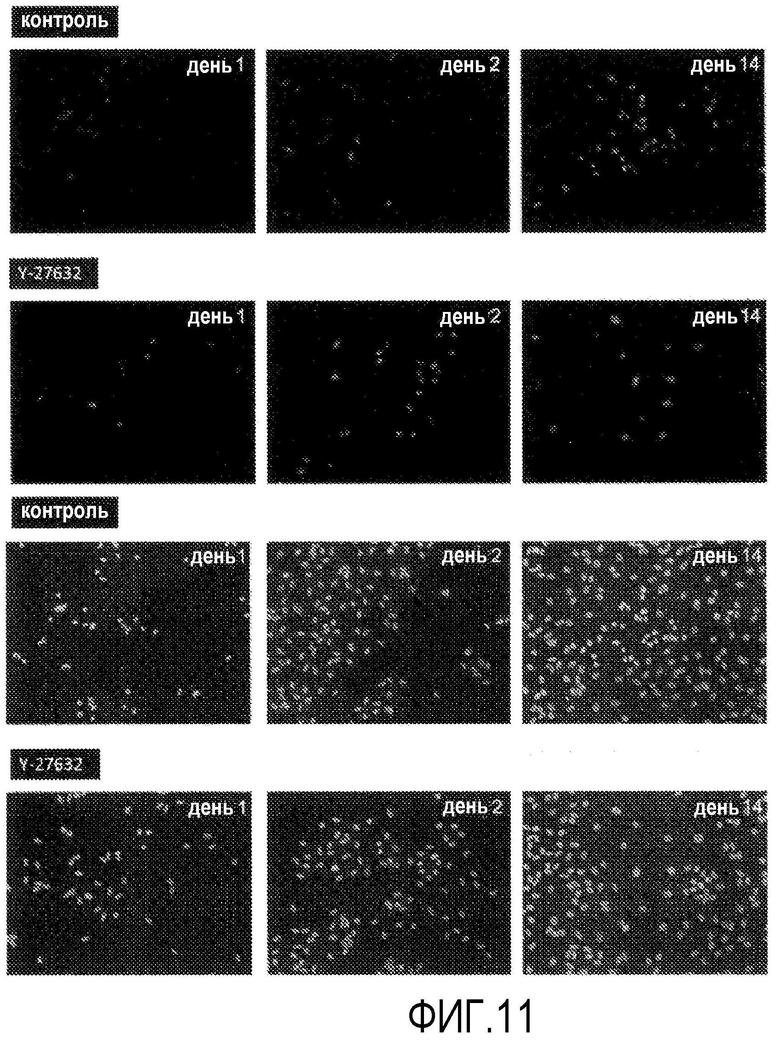
Фиг.11 представляет фазово-контрастную микрофотографию, показывающую влияние Y-27632 на клеточный цикл обезьяньих роговичных эндотелиальных клеток (окрашивание анти-Ki67 антитела, 200-кратное увеличение).
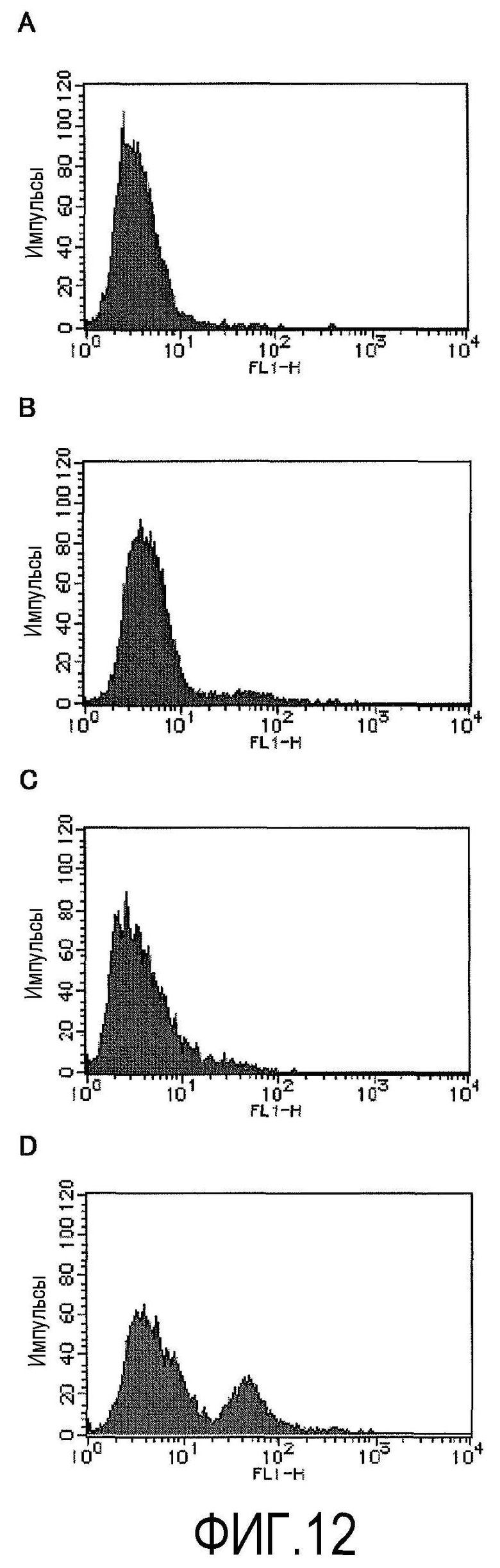
На фиг.12 показаны результаты исследования проточной цитометрией влияния Y-27632 на клеточный цикл обезьяньих роговичных эндотелиальных клеток. На фиг.12А показана пересеваемая культура из группы ROCK ингибитора (-) в 1-й день, на фиг.12В показана пересеваемая культура группы ROCK ингибитора (-) на 2-й день, на фиг.12С показана пересеваемая культура из группы ROCK ингибитора (+) в 1-й день, и на фиг.12D показана пересеваемая культура из группы ROCK ингибитора (+) на 2-й день.
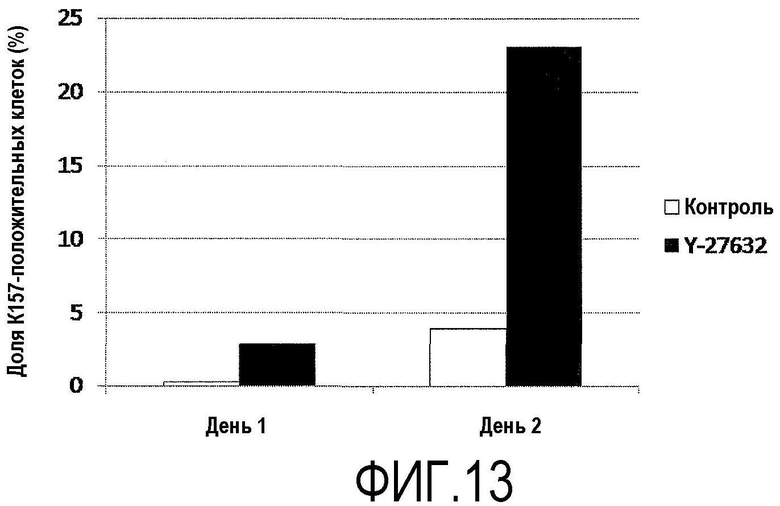
Фиг.13 представляет график, показывающий результаты проточной цитометрии образцов, показанных на фиг.12, по частоте клеток, положительных по анти-Ki67 антителу.
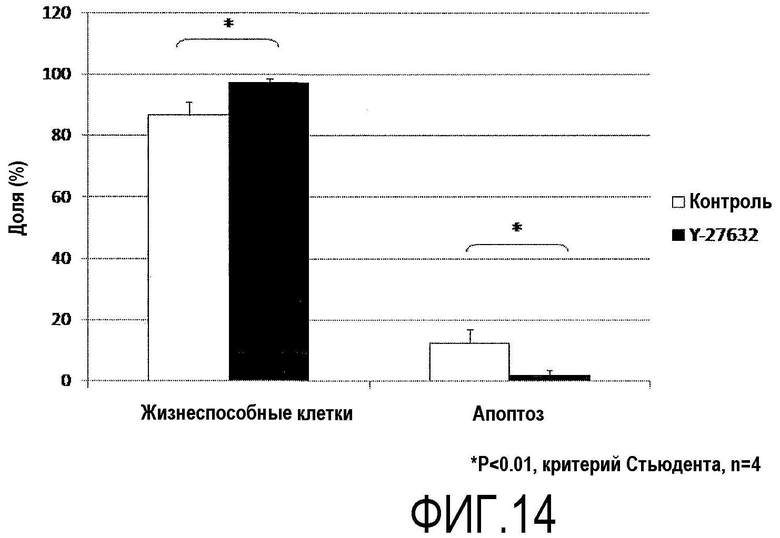
Фиг.14 представляет график, показывающий влияние Y-27632 на апоптоз обезьяньих роговичных эндотелиальных клеток.
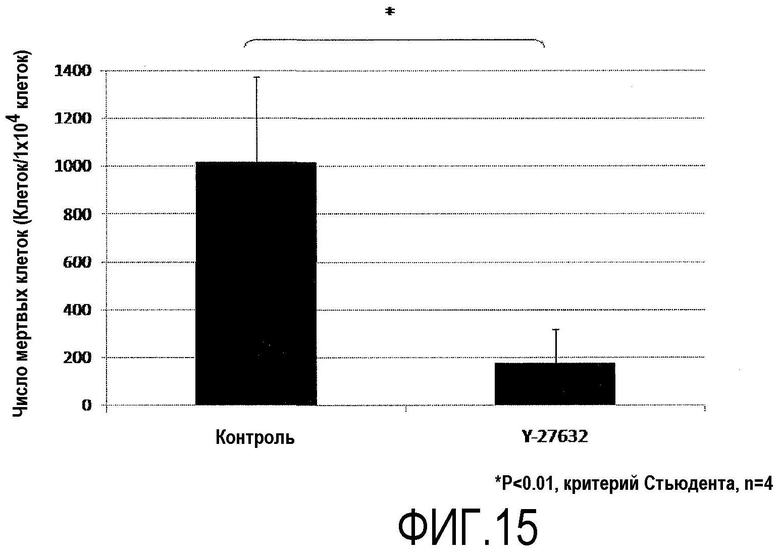
Фиг.15 представляет график, показывающий влияние Y-27632 на апоптоз обезьяньих роговичных эндотелиальных клеток по числу мертвых клеток.
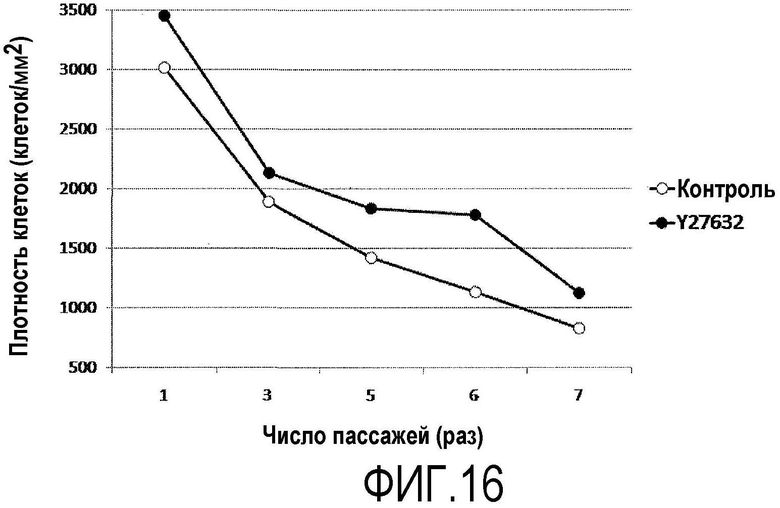
Фиг.16 представляет график, показывающий влияние Y-27632 на плотность культивированных обезьяньих роговичных эндотелиальных клеток.
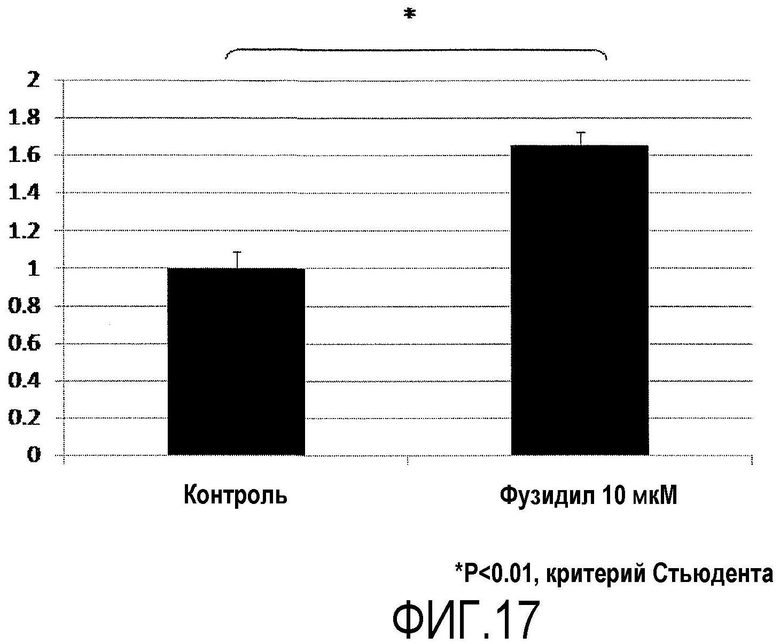
Фиг.17 представляет график, показывающий адгезию культивированных обезьяньих роговичных эндотелиальных клеток через 24 ч от пересева культуры, где по вертикальной оси показана величина в группе фазудила относительно степени люминесценции в контрольной группе через 24 ч от пересева культуры.
Лучший способ осуществления изобретения
Средство для содействия адгезии роговичных эндотелиальных клеток по настоящему изобретению (далее иногда сокращенно называемое «средством для содействия адгезии по настоящему изобретению») содержит ингибитор Rho киназы в качестве активного ингредиента.
В настоящем изобретении Rho киназа означает серин/треонин-киназу, активированную наряду с активацией Rho. Примеры включают ROKα (ROCKII: Leung, T. et al., J. Biol. Chem.,270, 29051-29054, 1995), p160ROCK (ROKβ, ROCK-I: Ishizaki, T. et al., The EMBO J., 15(8), 1885-1893, 1996) и другие белки, обладающие активностью серин/треонин-киназы.
В настоящем изобретении может содержаться отдельно один вид Rho киназы, или при необходимости могут содержаться несколько видов в комбинации.
Примеры ингибитора Rho киназы включают соединения, описанные в следующих ссылках: US4678783, патент 3421217, WO 99/20620, WO 99/61403, WO 02/076976, WO 02/076977, WO 02/100833, WO 03/059913, WO 03/062227, WO 2004/009555, WO 2004/022541, WO 2004/108724, WO 2005/003101, WO 2005/039564, WO 2005/034866, WO 2005/037197, WO 2005/037198, WO 2005/035501, WO 2005/035503, WO 2005/035506, WO 2005/080394, WO 2005/103050, WO 2006/057270, WO 2007/026664 и тому подобных. Такие соединения могут быть получены в соответствии со способом, описанным в каждой из указанных ссылок. Конкретные примеры включают 1-(5-изохинолинсульфонил)гомопиперазин (фасудил), (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексан (Y-27632) и тому подобные. В качестве этих соединений предпочтительно могут применяться коммерчески доступные продукты.
Из них предпочтительно применяется (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексан, 1-(5-изохинолинсульфонил)гомопиперазин и их фармакологически приемлемые соли, поскольку они имеют особое преимущество при содействии адгезии роговичных эндотелиальных клеток. В качестве соли соединения предпочтительна фармацевтически приемлемая кислотно-аддитивная соль. Примеры кислот включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота и тому подобные, органические кислоты, такие как метансульфоновая кислота, фумаровая кислота, малеиновая кислота, миндальная кислота, лимонная кислота, винная кислота, салициловая кислота и тому подобные. Более предпочтительными являются (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексан-2-гидрохлорид и гидрохлорид 1-(5-изохинолинсульфонил)гомопиперазина.
В настоящем изобретении примеры «содействия адгезии роговичных эндотелиальных клеток» включают и содействие адгезии между клетками роговичного эндотелия, и содействие адгезии роговичных эндотелиальных клеток к подложке культуры. Средство для содействия адгезии по настоящему изобретению обеспечивает содействующее адгезии действие на роговичные эндотелиальные клетки, выделенные из роговичной ткани, полученной у млекопитающего (например, человека, мыши, крысы, хомяка, кролика, кошки, собаки, коровы, овцы, обезьяны и т.д.), или роговичные эндотелиальные клетки, выделенные у них и подвергнутые пересеву. Поскольку средство для содействия адгезии по настоящему изобретению оказывает содействующее адгезии действие, превосходящее другие средства, на роговичные эндотелиальные клетки, полученные от человека, которые, как считается, особенно трудно культивировать и пересевать, его предпочтительной мишенью является роговичные эндотелиальные клетки, полученные у человека.
Роговичные эндотелиальные клетки играют роль поддержания прозрачности роговицы. Когда плотность эндотелиальных клеток уменьшается за определенный предел, в роговице развивается отек и она становится неспособной поддерживать прозрачность, в результате чего развивается дисфункция роговичного эндотелия. Средство для содействия адгезии по настоящему изобретению способствует адгезии роговичных эндотелиальных клеток, обеспечивает возможность образования слоя роговичных эндотелиальных клеток, имеющего хорошую клеточную морфологию и высокую плотность клеток, и, кроме того, проявляет подавляющее апоптоз действие на роговичные эндотелиальные клетки. Поэтому его можно применять в качестве терапевтического средства или профилактического средства по поводу заболеваний, сопровождающихся дисфункцией роговичного эндотелия, таких как буллезная кератопатия и роговичный эндотелиит. Кроме того, средство для содействия адгезии по настоящему изобретению может применяться в качестве терапевтического средства или профилактического средства по поводу дисфункции роговичного эндотелия, связанной с внутриглазными операциями, такими как операция по поводу катаракты, операция на стекловидном теле и тому подобные, дисфункции роговичного эндотелия, вызванной повышенным внутриглазным давлением (в частности, глаукоматозным приступом), или дисфункции роговичного эндотелия, вызванной недостаточным поступлением кислорода вследствие ношения контактных линз.
Хотя средство для содействия адгезии по настоящему изобретению конкретно не ограничивается, пока оно имеет лекарственную форму, подходящую для местного введения в глаз, оно предпочтительно составляется в виде раствора для внутрикамерных инъекций или жидкости для внутриглазной перфузии. Их можно получить, используя обычные методики, широко используемые в данной области. При его местном введении в глаз в виде раствора для внутрикамерных инъекций или жидкости для внутриглазной перфузии ингибитор Rho киназы и роговичные эндотелиальные клетки вступают в контакт в организме, и стимулируется адгезия роговичных эндотелиальных клеток.
Например, когда средство для содействия адгезии по настоящему изобретению применяется в виде раствора для внутрикамерных инъекций или жидкости для внутриглазной перфузии, то в них в качестве добавок может добавляться стабилизатор (например, бисульфит натрия, тиосульфат натрия, ацетат натрия, цитрат натрия, аскорбиновая кислота, дибутилгидрокситолуол и т.д.), солюбилизатор (например, глицерин, пропиленгликоль, макрогол, гидрированное касторовое масло полиоксиэтилена и т.д.), суспендирующий агент (например, поливинилпирролидон, гидроксипропилметилцеллюлоза, гидроксиметилцеллюлоза, карбоксиметилцеллюлоза натрия и т.д.), эмульгатор (например, поливинилпирролидон, лецитин соевых бобов, лецитин куриного желтка, гидрированное касторовое масло полиоксиэтилена. Полисорбат 80 и т.д.), буферный агент (например, фосфатный буфер, ацетатный буфер, боратный буфер, карбонатный буфер, цитратный буфер, Tris буфер, глутаминовая кислота, эпсилон-аминокапроновая кислота и т.д.), загуститель (например, растворимое в воде производное целлюлозы, такое как метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза и т.д., хондроитинсульфат натрия, гиалуронат натрия, карбоксивиниловый полимер, поливиниловый спирт, поливинилпирролидон, макрогол и т.д.), консервант (например, бензалконий хлорид, бензетоний хлорид, хлоргексидин глюконат, хлорбутанол, бензиловый спирт, дегидроацетат натрия, сложные п-гидроксибензойные эфиры, эдетат натрия, борная кислота и т.д.), агент изотоничности (например, хлорид натрия, хлорид калия, глицерин, манит, сорбит, борная кислота, глюкоза, пропиленгликоль и т.д.), агент, регулирующий рН (например, хлористоводородная кислота, гидроксид натрия, фосфорная кислота, уксусная кислота и т.д.), освежающий агент (например, 1-ментол, d-камфора, d-борнеол, масло мяты перечной и т.д.). Количество этих добавляемых агентов варьируется в зависимости от вида и использования добавки и тому подобного, и они могут добавляться в концентрации, обеспечивающей достижение цели применения добавки.
Количество активного ингредиента в средстве для содействия адгезии по настоящему изобретению составляет в целом 0,00001-1 мас./об.%, предпочтительно, 0,00001-0,1 мас./об.%, предпочтительнее, 0,0001-0,01 мас./об.%. Поскольку доза и частота введения варьируются в зависимости от симптомов, возраста, массы тела и формы введения, то когда средство применяется в виде раствора для внутрикамерной инъекции взрослому, например, препарата, содержащего 0,0001-0,1 мас./об.%, предпочтительно 0,0001-0,01 мас./об.%, активный ингредиент может, в целом, вводиться несколько раз, предпочтительно 1-2 раза, более предпочтительно 1 раз в день по 0,01-0,1 мл на введение.
Средство для содействия адгезии по настоящему изобретению может также добавляться к культуральной среде, когда роговичные эндотелиальные клетки культивируются в пробирке. Когда культивирование продолжается с добавлением к культуральной среде ингибитора Rho киназы, ингибитор Rho киназы и роговичные эндотелиальные клетки вступают в контакт in vitro, и стимулируется адгезия роговичных эндотелиальных клеток.
Настоящее изобретение предоставляет культуральную среду для роговичных эндотелиальных клеток, которая содержит ингибитор Rho киназы. Ингибитор Rho киназы, содержащийся в культуральной среде по настоящему изобретению, представляет собой, как описано выше.
Культуральная среда по настоящему изобретению может содержать среду, в целом используемую для культивирования эндотелиальных клеток (например, DMEM (GIBCO BRL), сыворотку (например, фетальную телячью сыворотку (FBS)), ростовой фактор (например, b-FGF, основного ростового фактора фибробластов), антибиотик (например, пенициллин, стрептомицин) и тому подобные.
Концентрация ингибитора Rho киназы в культуральной среде по настоящему изобретению составляет в целом 1-100 мкМ, предпочтительно 5-20 мкМ, более предпочтительно 10 мкМ.
Культуральная среда по настоящему изобретению предотвращает сброс клеток увеличением адгезии роговичных эндотелиальных клеток и обеспечивает возможность образования слоя роговичных эндотелиальных клеток, имеющих хорошую клеточную морфологию и высокую клеточную плотность. Поэтому его можно предпочтительно применять для указанного ниже способа получения роговичного эндотелиального препарата по настоящему изобретению. Кроме того, культуральная среда по настоящему изобретению также используется для поддержания роговичных эндотелиальных клеток.
Настоящее изобретение предоставляет раствор для консервации роговицы, содержащий ингибитор Rho киназы. Ингибитор Rho киназы, содержащийся в растворе для консервации роговицы по настоящему изобретению, представляет собой такой, как описано выше. Раствор для консервации роговицы представляет собой жидкость, используемую для сохранения роговичного трансплантата, выделенного у донора, до трансплантации реципиенту.
Примеры раствора для консервации роговицы по настоящему изобретению включают растворы для консервации, в целом используемые для трансплантации роговицы (раствор для роговично-склерального эксплантата (Optisol GS: зарегистрированная торговая марка), раствор для консервации глазного яблока с целью трансплантации роговицы (EPII: зарегистрированная торговая марка), солевой раствор, солевой раствор с фосфатным буфером (PBS) и тому подобные, каждый из которых содержит ингибитор Rho киназы.
Концентрация ингибитора Rho киназы в растворе для консервации роговицы по настоящему изобретению составляет в целом 1-100 мкМ, предпочтительно 5-20 мкМ, более предпочтительно 10 мкМ.
Раствор для консервации роговицы по настоящему изобретению предотвращает сброс клеток увеличением адгезии роговичных эндотелиальных клеток и обеспечивает возможность образования слоя роговичных эндотелиальных клеток, имеющих хорошую клеточную морфологию и высокую клеточную плотность. Поэтому его можно применять в качестве раствора для консервации роговицы, используемого для трансплантации органов, и тому подобного. Кроме того, раствор для консервации по настоящему изобретению также используется в качестве раствора для консервации криоконсервацией роговичных эндотелиальных клеток. Для криоконсервации, кроме того, к раствору для консервации по настоящему изобретению могут добавляться глицерин, диметилсульфоксид, пропиленгликоль, ацетамид и тому подобные.
Настоящее изобретение предоставляет способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды по настоящему изобретению.
Обычно препарат роговичного эндотелия содержит подложку и на подложке слой роговичных эндотелиальных клеток, которые культивировались в пробирке.
В настоящем изобретении подложка конкретно не ограничивается, пока она может поддерживать слой культивируемых роговичных эндотелиальных клеток и может поддерживать его форму в организме в течение, по меньшей мере, 3 дней после трансплантации. Кроме того, подложка может играть роль каркаса, когда культивируемые роговичные эндотелиальные клетки находятся в пробирке, или может только играть роль поддержания слоя культивируемых роговичных эндотелиальных клеток после культивирования. Предпочтительно, подложка используется для культивирования роговичных эндотелиальных клеток и играет роль каркаса, который может непосредственно использоваться для трансплантации после завершения культивирования.
Примеры указанной выше подложки включают полимерные материалы, полученные из естественно встречающихся веществ, таких как коллаген, желатин, целлюлоза и им подобные, синтетических полимерных материалов, таких как полистирол, сложный полиэфир, поликарбонат, поли(N-изопропилакриламид) и тому подобные, биологически разлагаемые полимерные материалы, такие как полимолочная кислота, полигликолевая кислота и тому подобные, гидроксиапатит, амниотическая оболочка и тому подобные.
Хотя форма указанной выше подложки конкретно не ограничивается, пока она поддерживает слой роговичных эндотелиальных клеток и подходит для трансплантации, она предпочтительно представляет собой листок. Когда препарат по настоящему изобретению представляет собой листок, его можно использовать после разрезания до размера, подходящего для участка наложения во время трансплантации. Можно также свернуть небольшой листок и вставить его с края раны. Предпочтительные конкретные примеры включают круговую форму, покрывающую примерно 80% пораженной области роговичного эндотелия. Предпочтительно также сформировать щели в соседней части указанного выше круга с тем, чтобы его можно было плотно прикрепить к участку наложения.
В предпочтительном варианте осуществления указанная выше подложка представляет собой коллаген. В качестве коллагена можно предпочтительно использовать коллагеновый листок, описанный в документе JP-A-2004-24852. Такой коллагеновый листок можно получить в соответствии со способом, описанным в указанном выше документе JP-A-2004-24852, например, из амниотической оболочки.
Указанный выше слой роговичных эндотелиальных клеток предпочтительно проявляет, по меньшей мере, одну из следующих характеристик. Более предпочтительно, он проявляет две или более, более предпочтительно все следующие характеристики:
(1) Клеточный слой имеет однослойную структуру. Это одна из характеристик слоя роговичных эндотелиальных клеток в организме.
(2) Клеточный слой имеет плотность клеток примерно от 1000 до примерно 4000 клеток/мм2. В частности, когда реципиентом (реципиентом трансплантата) является взрослый, плотность предпочтительно составляет от примерно 2000 до примерно 3000 клеток/мм2.
(3) Клетки, составляющие клеточный слой, имеют по существу вид плоского шестиугольника. Это одна из характеристик клеток, составляющих слой роговичных эндотелиальных клеток в организме. Препарат по настоящему изобретению аналогичен слою роговичных эндотелиальных клеток в организме, проявляет функцию, аналогичную функции естественного слоя роговичных эндотелиальных клеток, и может также проявлять пролиферативную способность in vivo.
(4) Клетки упорядоченно расположены в клеточном слое. В слое роговичных эндотелиальных клеток в организме клетки, составляющие слой, расположены упорядоченно, благодаря чему, как считается, поддерживается нормальная функция роговичных эндотелиальных клеток и высокая прозрачность, и считается, что ввиду этого роговица, соответственно, проявляет функцию регуляции водного обмена в ней. Поэтому ожидается, что препарат по настоящему изобретению, имеющий такие морфологические характеристики, проявит функцию, аналогичную функции слоя роговичных эндотелиальных клеток в организме.
Способ получения роговичных эндотелиальных клеток по настоящему изобретению включает стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды по настоящему изобретению, например с использованием следующего способа.
1. Сбор роговичных эндотелиальных клеток и культивирование в пробирке
Роговичные эндотелиальные клетки собирают из роговицы самого реципиента или подходящего донора обычным способом. С учетом условий трансплантации по настоящему изобретению, могут быть получены аллогенные роговичные эндотелиальные клетки. Например, десцеметова оболочка и слой эндотелиальных клеток роговичной ткани отслаиваются от роговичной стромы. Помещаются в культуральную чашку и обрабатываются диспазой или подобным ферментом. С использованием этого способа роговичные эндотелиальные клетки удаляются из десцеметовой оболочки. Роговичные эндотелиальные клетки, остающиеся на десцеметовой оболочке, могут быть удалены пипетированием и тому подобным способом. После удаления десцеметовой оболочки роговичные эндотелиальные клетки культивируются в культуральной среде по настоящему изобретению. Культуральная среда может быть получена, например, соответствующим добавлением FBS (фетальной телячьей сыворотки), b-FGF (основного ростового фактора фибробластов) и антибиотиков, таких как пенициллин, стрептомицин, и тому подобных компонентов, к коммерчески доступной среде DMEM (модифицированной по Дульбекко среде Игла) и затем добавлением к ней Y-27632 или фазудила. Предпочтительно используется контейнер для культуры (культуральная чашка) с покрытием из коллагена I типа, коллагена IV типа, фибронектина, ламинина или внеклеточной матрицы коровьих роговичных эндотелиальных клеток и тому подобных на поверхности. Альтернативно, может использоваться общий культуральный контейнер, обработанный коммерчески доступным покрывающим агентом, таким как покрывающая смесь FNC (зарегистрированная торговая марка) и тому подобные. Путем комбинированного применения такого покрытия и культуральной среды по настоящему изобретению стимулируется адгезия роговичных эндотелиальных клеток к поверхности культурального контейнера и достигается хороший рост клеток.
Хотя температурные условия культивирования роговичных эндотелиальных клеток конкретно не ограничиваются, пока, например, происходит рост роговичных эндотелиальных клеток, с точки зрения эффективности роста температура составляет от примерно 25 до примерно 45ºС, предпочтительно от примерно 30 до примерно 40ºС, и дополнительно предпочтительно примерно 37ºС. Способ культивирования выполняется в обычном инкубаторе для клеточной культуры при увлажнении в среде с концентрацией СО2 примерно 5-10%.
2. Пересеваемая культура
Пересеваемое культивирование может выполняться после роста культуры роговичных эндотелиальных клеток. Пересеваемое культивирование предпочтительно выполняется когда клетки достигли субслияния или слияния. Пересеваемое культивирование может выполняться следующим образом. Клетки отделяются от поверхности культурального контейнера обработкой трипсином-EDTA (этилендиаминтетрауксусной кислотой) и т.д. и извлекаются. Культуральная среда по настоящему изобретению добавляется к извлеченным клеткам для получения клеточной суспензии. Обработка центрифугированием предпочтительно выполняется во время извлечения клеток или после их извлечения. Такая обработка центрифугированием дает клеточную суспензию, имеющую высокую плотность клеток. Предпочтительная плотность клеток составляет примерно 1-2 × 106 клеток/мл. В качестве условий обработки центрифугированием могут быть указаны, например, 500 об/мин (30 г) - 1000 об/мин (70 г) в течение 1-10 мин.
Клеточная суспензия высевается на культуральный контейнер таким же образом, как в указанной выше первоначальной культуре, и культивируется. Хотя соотношение разведения во время пересева варьируется в зависимости от состояния клеток, оно составляет примерно 1:2-1:4, предпочтительно, примерно 1:3. Пересеваемое культивирование может выполняться в условиях культивирования, аналогичных условиям указанной выше первоначальной культуры. Хотя время культивирования варьируется в зависимости от состояния подлежащих использованию клеток, оно составляет, например, 7-10 дней. Указанное выше пересеваемое культивирование может при необходимости выполняться множество раз. При использовании культуральной среды по настоящему изобретению увеличивается адгезия клеток на ранних стадиях культивирования, посредством чего может быть укорочено время культивирования.
3. Получение слоя роговичных эндотелиальных клеток
Клеточная суспензия высевается на подложку, такую как коллагеновый листок и тому подобная, и проводится культивирование. При этом число высеянных клеток регулируется так, что в конечном счете полученный препарат роговичного эндотелия имеет клеточный слой, имеющий желательную плотность клеток. Точнее, клетки высеваются так, что образуется клеточный слой, имеющий плотность клеток от примерно 1000 до примерно 4000 клеток/мм2. Культивирование может выполняться в условиях, аналогичных условиям указанного выше первоначального культивирования и тому подобных. Хотя время культивирования варьируется в зависимости от состояния подлежащих использованию клеток, оно составляет, например от 3 до 30 дней.
Путем культивирования указанным выше образом может быть получен препарат роговичного эндотелия, где слой роговичных эндотелиальных клеток, культивированных в пробирке, образуется на подложке.
В настоящем изобретении препарат роговичного эндотелия может содержать культуральную среду по настоящему изобретению с тем, чтобы поддерживать роговичные эндотелиальные клетки. Кроме того, препарат роговичного эндотелия до его использования для трансплантации может содержать раствор для консервации роговицы по настоящему изобретению. Настоящее изобретение также предоставляет комбинацию препарата роговичного эндотелия и культуральной среды или раствора для консервации по настоящему изобретению.
Препарат роговичного эндотелия, полученный способом получения по настоящему изобретению, может использоваться в качестве трансплантата для лечения заболевания, требующего трансплантации роговичного эндотелия, например буллезной кератопатии, отека роговицы, лейкомы роговицы, в частности буллезной кератопатии, вызванной дисфункцией роговичного эндотелия вследствие роговичной дистрофии, травмы или внутриглазного хирургического вмешательства.
Индивидуум, которому вводится средство для содействия адгезии и препарат роговичного эндотелия по настоящему изобретению, включает, например, млекопитающее (например, человека, мышь, крысу, хомяка, кролика, кошку, собаку, корову, овцу, обезьяну и т.д.).
Примеры
Настоящее изобретение более детально объясняется ниже со ссылкой на примеры, которые не следует рассматривать как ограничивающие. Экспериментальных животных использовали в соответствии с Международными инструкциями по биомедицинским исследованиям с использованием животных, а также Актом по благополучию и ведению животных, и стандартами, относящимися к кормлению, содержанию экспериментальных животных и тому подобными нормами. Этот эксперимент выполняли в соответствии с Инструкциями Ассоциации по исследованиям зрения и в области офтальмологии по использованию животных в исследованиях глаз и зрения.
Пример 1
Исследование влияния ингибитора ROCK на культуру кроличьих роговичных эндотелиальных клеток
Из кроличьей роговичной ткани, выделенной сразу после эвтаназии, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Десцеметову оболочку инкубировали в течение 45 мин вместе с диспазой II (1,2 ЕД/мл, Roche Applied Science) при 37ºС и 5% СО2, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали, клетки из группы ROCK ингибитора (+) перемешивали в среде для роговичного эндотелия с добавлением Y-27632 (10 мкМ), и клетки группы ROCK ингибитора (-) перемешивали в среде для роговичного эндотелия без добавления Y-27632 до одинаковой концентрации, и клетки высевали в 96-луночный планшет при плотности примерно 2000 клеток на лунку. В качестве среды для роговичного эндотелия использовали культуральную среду (DMEM, Gibco Invitrogen) с добавлением 1% фетальной телячьей сыворотки и 2 мг/мл bFGF (Gibco Invitrogen). Планшет предварительно обрабатывали смесью для покрытия FNC (Athena ESS) в течение 10 мин. Через 72 ч от начала культивирования производили замену культуральной среды, и через 72 ч клетки, как из группы ROCK ингибитора (+), так и из группы ROCK ингибитора (-), культивировали в нормальной среде для роговичного эндотелия, не содержащей Y-27632, до 5-го дня. Фазово-контрастная микрофотография первичной культуры кроличьих роговичных эндотелиальных клеток через 24 ч от начала культивирования показана на фиг.1. С 1-го по 3-й день после начала культивирования клетки подсчитывали через каждые 24 ч анализом MTS ([3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий]) с использованием CellTiter 96 (зарегистрированная торговая марка) AQueous One Solution Cell Proliferation (Promega) (фиг.2).
В группе ROCK ингибитора (+) (фиг.1В) адгезия клеток через 24 ч (1-й д) после высевания клеток значительно увеличилась примерно до 2,8 раза (фиг.2 и 3), по сравнению с группой ROCK ингибитора (-) (фиг.1А). Через 3 дня, когда клетки достигли слияния, между группами не было обнаружено значимого различия (фиг.2). На основании этого было выяснено, что Y-27632 оказывает действие, увеличивающее адгезию клеток на ранних стадиях после пересева в первичной культуре кроличьих роговичных эндотелиальных клеток. Кроме того, аналогичные результаты были также получены при исследовании с использованием пересеваемой культуры кроличьих роговичных эндотелиальных клеток и поэтому считалось, что Y-27632 воздействует на адгезию клеток на ранних стадиях после пересева в первичной культуре и пересеваемой культуре.
Пример 2
Исследование влияния Y-27632 на культуру обезьяньих роговичных эндотелиальных клеток
Из роговичной ткани, выделенной у макак Macaca fascicularis, подвергнутых эвтаназии с другой целью, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Для группы ROCK ингибитора (+) десцеметову оболочку помещали в среду для роговичного эндотелия с добавлением Y-27632 (10 мкМ) и инкубировали в течение 10 мин при 37ºС и 5% СО2. Для группы ROCK ингибитора (-) десцеметову оболочку помещали в среду для роговичного эндотелия без добавления Y-27632 и инкубировали в течение 10 мин в таких же условиях. В качестве среды для роговичного эндотелия использовали такую же среду для культивирования клеток, как в примере 1. Десцеметову оболочку после инкубации инкубировали вместе с диспазой II (1,2 ЕД/мл Roche Applied Science) при 37ºС и 5% СО2 в течение 45 мин, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и перемешивали в среде для роговичного эндтелия с Y-27632(+) и Y-27632(-) до такой же концентрации, и клетки высевали на 12-луночный планшет при плотности примерно 20000 клеток на лунку. Лунку предварительно обрабатывали покрывающей смесью FNC (Athena ES) в течение 10 мин. Через 72 ч от начала культивирования производили обмен культуральной среды, и через 72 ч клетки, как из группы ROCK ингибитора (+), так и из группы ROCK ингибитора (-), культивировали в нормальной среде для роговичного эндотелия, не содержащей Y-27632.
Из фиг.4 очевидно, что в первичной культуре роговичных эндотелиальных клеток Macaca fascicularis через 24 ч от начала культивирования больше клеток было прикреплено к планшету в группе ROCK ингибитора (+) (фиг.4В) по сравнению с группой ROCK ингибитора (-) (фиг.4А). Число дней до достижения слияния составило 3 для группы ROCK ингибитора (+), тогда как оно составило 7 для группы ROCK ингибитора (-). На основании этого было показано, что Y-27632 увеличивает адгезию клеток на ранних стадиях после начала культивирования и представляет собой полезное лекарственное средство, которое обеспечивает возможность культивирования клеток даже обезьяньих роговичных эндотелиальных клеток, культивирование которых считалось трудным вне организма, по сравнению с кроличьими.
Пример 3
Исследование влияния Y-27632 на культуру человеческих роговичных эндотелиальных клеток
Из человеческих роговичных тканей, полученных из глазного банка США, центральную часть (диаметром 7 мм) использовали для трансплантации роговицы, а остающуюся окружающую роговичную ткань использовали в данном исследовании. Отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Для группы ROCK ингибитора (+) десцеметову оболочку помещали в среду для роговичного эндотелия с добавлением Y-27632 (10 мкМ) и инкубировали в течение 10 мин при 37ºС и 5% СО2. Для группы ROCK ингибитора (-) десцеметову оболочку помещали в среду для роговичного эндотелия без добавления Y-27632 и инкубировали в течение 10 мин в таких же условиях. В качестве среды для роговичного эндотелия использовали такую же среду для культивирования клеток, как в примере 1. Десцеметову оболочку после инкубации инкубировали вместе с диспазой II (1,2 ЕД/мл Roche Applied Science) при 37ºС и 5% СО2 в течение 45 мин, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и перемешивали в среде для роговичного эндотелия с Y-27632(+) и Y-27632(-) до такой же концентрации, и клетки высевали на 48-луночный планшет, предварительно обработанный покрывающей смесью FNC (Athena ES), при плотности примерно 10000 клеток на лунку. Число человеческих роговичных эндотелиальных клеток, полученных из окружающей роговичной ткани, было крайне мало, и поэтому донорскую роговицу одного глаза культивировали в одной лунке. Донорские роговицы, использованные для исследования, представляли собой: культивирование начинали через 6 дней после смерти донора (в возрасте 69 лет) для группы ROCK ингибитора (+), и культивирование начинали через 7 дней после смерти донора (в возрасте 51 года) для группы ROCK ингибитора (-). Считается, что влияние возраста донора и времени, прошедшего с момента смерти донора, на клеточную культуру, почти одинаковое.
Через 72 ч от начала культивирования производили обмен культуральной среды, и через 72 ч клетки, как из группы ROCK ингибитора (+), так и из группы ROCK ингибитора (-), культивировали в нормальной среде для роговичного эндотелия, не содержащей Y-27632. Для исследования влияния на адгезию клеток на ранних стадиях после начала культивирования и клеточную морфологию клетки наблюдали под фазово-контрастным микроскопом и делали фотографии цифровой камерой после начала культивирования (фиг.5).
На фиг.5 видно, что в группе ROCK ингибитора (+) на 7-й день после начала культивирования образовывался слитый и высокоплотный слой одиночных клеток, состоящий из клеток (однородных многоугольных клеток), аналогичных нормальным роговичным эндотелиальным клеткам (фиг.5В), тогда как в группе ROCK ингибитора (-) выжили только подобные фибробластам удлиненные эндотелиальные клетки с низкой плотностью в форме островков (фиг.5А). На основании этих результатов считается, что в первичной культуре человеческого роговичного эндотелия, которую, как известно, крайне трудно культивировать, добавление к культуральной среде Y-27632, увеличивающего клеточную адгезию на ранних стадиях после начала культивирования, обеспечивает возможность образования слоя роговичных эндотелиальных клеток, имеющих хорошую клеточную морфологию и высокую плотность клеток.
Пример составления 1
Раствор для внутрикамерной инъекции, содержащий ингибитор Rho киназы
Следующий раствор для внутрикамерной инъекции был получен в соответствии с обычным способом:
Использовали Y-27632, изготавливаемый Wako Pure Chemical Industries, Ltd.
Пример составления 2
Жидкость для внутриглазной перфузии, содержащая ингибитор Rho киназы
Следующая жидкость для внутриглазной перфузии была получена в соответствии с обычным способом:
Используются OPEGUARD MA, изготавливаемый Senju Pharmaceutical Co., Ltd., и Y-27632, изготавливаемый Wako Pure Chemical Industries, Ltd.
Пример составления 3
Культуральная среда, содержащая ингибитор Rho киназы, для получения листка роговичного эндотелия
Следующая культуральная среда была получена в соответствии с обычным способом:
Использовали FBS, изготовленный Invitrogen, раствор пенициллина-стрептомицина, изготовленный Nacalai Tesque (содержащий пенициллин 5000 ед/мл и стрептомицин 5000 мкг/мл), основной FGF, изготовленный Invitrogen, Y-27632, изготавливаемый Wako Pure Chemical Industries, Ltd., и DMEM, изготовленную Invitrogen.
Пример составления 4
Раствор для консервации роговицы, содержащий ингибитор Rho киназы
Следующий раствор для консервации был получен в соответствии с обычным способом:
Использовали Optisol-GS, изготавливаемый Bausch & Lomb, Inc., и Y-27632, изготавливаемый Wako Pure Chemical Industries, Ltd.
Пример 4
Исследование влияния Y-27632 на первичную культуру обезьяньих роговичных эндотелиальных клеток
Из роговичной ткани, выделенной у макак Macaca fascicularis, подвергнутых эвтаназии, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Таким же образом, как в примере 2, для группы ROCK ингибитора (+) десцеметову оболочку помещали в среду для роговичного эндотелия с добавлением Y-27632 (10 мкМ) и инкубировали в течение 10 мин при 37ºС и 5% СО2. Для группы ROCK ингибитора (-) десцеметову оболочку помещали в среду для роговичного эндотелия без добавления Y-27632 и инкубировали в течение 10 мин в таких же условиях. В качестве среды для роговичного эндотелия использовали такую же среду для культивирования клеток, как в примере 1. Десцеметову оболочку после инкубации инкубировали вместе с диспазой II (1,2 ЕД/мл Roche Applied Science) при 37ºС и 5% СО2 в течение 45 мин, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и перемешивали в среде для роговичного эндотелия с Y-27632(+) и Y-27632(-) до такой же концентрации, и клетки высевали на 96-луночный планшет при плотности примерно 20000 клеток на лунку. Через 72 ч от начала культивирования производили обмен культуральной среды, и через 72 ч клетки, как из группы ROCK ингибитора (+), так и из группы ROCK ингибитора (-), культивировали в нормальной среде для роговичного эндотелия, не содержащей Y-27632. На 10-й день культивирования клетки фиксировали 4% пара-формальдегидом при комнатной температуре в течение 10 мин и окрашивали толуидином синим (фиг.6А и 6В). Общую площадь клеток измеряли и анализировали с использованием устройства Image J (Национальные Институты Здоровья) (фиг.6С).
В первичной культуре роговичных эндотелиальных клеток Macaca fascicularis через 10 дней после начала культивирования, ROCK ингибитор (+) (фиг.6В) значительно увеличивал общую площадь культивируемых клеток в примерно 1,6 раза (фиг.6С), по сравнению с группой ROCK ингибитора (-) (фиг.6А) путем содействия адгезии на ранних стадиях культивирования. На основании этих данных было показано, что Y-27632 представляет собой лекарственное средство, которое можно применять для первичного культивирования даже обезьяньих роговичных эндотелиальных клеток, культивирование которых вне организма считается трудным.
Пример 5
Исследование оптимальной концентрации Y-27632 для обезьяньих роговичных эндотелиальных клеток
Обезьяньи роговичные эндотелиальные клетки (первичную культуру), собранные таким же образом как в примере 2, помещали в среды для роговичного эндотелия, в каждую из которых добавляли Y-27632 в концентрации 1, 10, 33 и 100 мкМ, и в среду для роговичного эндотелия без добавления Y-27632 и перемешивали до одинаковой концентрации, и клетки высевали на 96-луночный планшет при плотности примерно 2000 клеток на лунку. Через 24 ч от начала культивирования, жизнеспособные клетки подсчитывали, используя устройство CellTiter-Glo (зарегистрированная торговая марка, Promega) (фиг.7).
Когда через 24 ч от начала культивирования собирали роговичные эндотелиальные клетки, культивировавшиеся в среде, содержащей 10 мкМ Y-27632, число клеток, которые прикрепились к планшету, было значительно выше (фиг.7) по сравнению с клеточной культурой в среде для роговичного эндотелия без добавления Y-27632 и в среде для роговичного эндотелия, содержащей различные концентрации Y-27632. На основании полученных результатов было показано, что Y-27632 в концентрации 10 мкМ наиболее эффективен для обезьяньих роговичных эндотелиальных клеток.
Пример 6
Исследование влияния Y-27632 на пересеваемую культуру обезьяньих роговичных эндотелиальных клеток
Из роговичной ткани, выделенной у подвергнутых эвтаназии Macaca fascicularis, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Десцеметову оболочку инкубировали в течение 45 мин вместе с диспазой II (1,2 ЕД/мл, Roche Applied Science) при 37ºС и 5% СО2, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и высевали на среду для роговичного эндотелия. Роговичные эндотелиальные клетки, которые достигли слияния, инкубировали с 0,05% трипсином в течение 10 мин при 37ºС и 5% СО2 и культивировали с пересевом. После 4-6 циклов пересева роговичные эндотелиальные клетки помещали в 96-луночную планшету до разведения 1/2, 1/6 или 1/8. Пересеваемую культуру продолжали с использованием среды для роговичного эндотелия с добавлением Y-27632 (10 мкМ) для группы ROCK ингибитора (+) и среды для роговичного эндотелия без добавления Y-27632 для группы ROCK ингибитора (-). Через 24 ч после пересева клетки подсчитывали таким же образом, как в примере 5, используя CellTiter-Glo (зарегистрированная торговая марка, Promega) (фиг.8).
Когда культивированные роговичные эндотелиальные клетки через 24 ч после пересева культивировались с пересевом в среде, содержащей Y-27632, число клеток, которые прикрепились к планшету, было значительно выше (фиг.8) по сравнению со средой для роговичного эндотелия без добавления Y-27632. На основании этих данных было показано, что Y-27632 был также эффективен при добавлении к первичной культуре, пересеваемой культуре обезьяньих роговичных эндотелиальных клеток.
Пример 7
Исследование влияния Y-27632 на клеточную морфологию в пересеваемой культуре обезьяньих роговичных эндотелиальных клеток
Роговичные эндотелиальные клетки Macaca fascicularis подвергали культивированию пересевом таким же образом, как в примере 6, субкультивировали на предметном стекле до разведения 1/4. Через 24 ч от пересева культуры клеточную морфологию наблюдали под фазово-контрастным микроскопом (фиг.9А и 9В). Кроме того, роговичные эндотелиальные клетки на предметном стекле фиксировали 4% пара-формальдегидом при комнатной температуре в течение 10 мин, и актиновые волокна окрашивали фаллоидиновой флюоресцентной краской (фиг.10А и 10В).
В культивированных роговичных эндотелиальных клетках Macaca fascicularis через 24 ч после пересева, когда пересеваемое культивирование выполнялось в среде, содержащей Y-27632 (фиг.9В), адгезия клеток к предметному стеклу увеличивалась, стимулировалось уплощение клеток, подобных роговичным эндотелиальным клеткам, и агрегация клеток также увеличивалась по сравнению со средой для роговичного эндотелия, не содержащей Y-27632 (фиг.9А). Кроме того, при флюоресцентном окрашивании фаллоидином, когда пересеваемое культивирование выполняли в среде, содержащей Y-27632 (фиг.10В), отчетливо наблюдались напряженные активновые волокна по сравнению со средой для роговичного эндотелия, не содержащей Y-27632 (фиг.10А), и было обнаружено, что Y-27632 содействует образованию цитоскелета.
Пример 8
Исследование влияния Y-27632 на клеточный цикл обезьяньих роговичных эндотелиальных клеток
Роговичные эндотелиальные клетки Macaca fascicularis подвергали культивированию пересевом таким же образом, как в примере 6, субкультивировали на предметном стекле до разведения 1/4. Среду для роговичного эндотелия с добавленным Y-27632 (10 мкМ) использовали для группы ингибитора ROCK (+), и среду для роговичного эндотелия без добавления Y-27632 использовали для группы ингибитора ROCK (-). На 1-, 2- и 14-й дни культивирования с пересевом роговичные эндотелиальные клетки на предметном стекле фиксировали 4% пара-формальдегидом при комнатной температуре в течение 10 мин, и производили иммунное окрашивание анти-Ki67 антителом (фиг.11). Аналогичным образом, кроме того, роговичные эндотелиальные клетки Macaca fascicularis подвергали культивированию пересевом до разведения 1/4 в каждой из группы ингибитора ROCK (+) и группы ингибитора ROCK (-). На 1- и 2-й дни культивирования с пересевом клетки собирали, используя 0,05% трипсин, и подвергали проточной цитометрии с использованием анти-Ki67 антитела, и исследовали клеточный цикл (фиг.12 и 13).
По сравнению с группой ингибитора ROCK (-) группа ингибитора ROCK (+) содержала много Ki67-положительных клеток на 1- и 2-й дни культивирования с пересевом. Однако когда клетки достигали почти слитого состояния на 14-й день, то число положительных клеток группы ингибитора ROCK (+) было меньше, чем в группе ингибитора ROCK (-) (фиг.11). Также при проточной цитометрии группа ингибитора ROCK (+) содержала много Ki67-положительных клеток на 1- и 2-й дни культивирования с пересевом по сравнению с группой ингибитора ROCK (-) (фиг.12 и 13).
Поскольку антиген Ki67 обнаруживается в клеточном ядре в цикле G1 клеточной пролиферации и от S до M фазы, то было показано, что Y-27632 оказывает стимулирующее действие на клеточный цикл на ранних стадиях после пересеваемого культивирования роговичных эндотелиальных клеток Macaca fascicularis, и представляет собой лекарственное средство для эффективного клеточного культивирования.
Пример 9
Исследование влияния Y-27632 на апоптоз обезьяньих роговичных эндотелиальных клеток
Роговичные эндотелиальные клетки Macaca fascicularis подвергали культивированию с пересевом таким же образом, как в примере 6, субкультивировали до разведения 1/4. Среду для роговичного эндотелия с добавленным Y-27632 (10 мкМ) использовали для группы ингибитора ROCK (+), и среду для роговичного эндотелия без добавления Y-27632 использовали для группы ингибитора ROCK (-). На 1-й день культивирования с пересевом все клетки, включая клетки в среде, собирали с использованием 0,05% трипсина и подвергали поточной цитометрии с использованием аннексина V и PI (пропидия йодида), и исследовали апоптоз (фиг.14 и 15).
В группе ингибитора ROCK (+) проявилось значительное уменьшение отношения апоптозных клеток ко всем клеткам на 1-й день культивирования с пересевом (фиг.14) по сравнению с группой ингибитора ROCK (-). Кроме того, сравнение числа апоптозных клеток на 1×104 клеток выявило значительное уменьшение в группе ингибитора ROCK (+) по сравнению с группой ингибитора ROCK (-) (фиг.15).
На основании этих данных было показано, что Н-27632 был активен в подавлении апоптоза во время пересева культуры роговичных эндотелиальных клеток Macaca fascicularis.
Пример 10
Исследование влияния Y-27632 на плотность обезьяньих роговичных эндотелиальных клеток
Из роговичной ткани, выделенной у подвергнутых эвтаназии Macaca fascicularis, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Десцеметову оболочку инкубировали в течение 45 мин вместе с диспазой II (1,2 ЕД/мл, Roche Applied Science) при 37ºС и 5% СО2 и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и высевали на среду роговичного эндотелия. Роговичные эндотелиальные клетки, которые достигли слияния, инкубировали с 0,05% трипсином в течение 10 мин при 37°С и 5% CO2 и культивировали с пересевом. Среду для роговичного эндотелия с добавленным Y-27632 (10 мкМ) использовали для группы ингибитора ROCK (+), и среду для роговичного эндотелия без добавления Y-27632 использовали для группы ингибитора ROCK (-). Через 72 ч от начала культивирования производили замену культуральной среды, и через 72 ч клетки как из группы ROCK ингибитора (+), так и из группы ROCK ингибитора (-) культивировали в нормальной среде для роговичного эндотелия, не содержащей Y-27632. После каждого пересева клетки фотографировали фазово-контрастным микроскопом, измеряли плотность клеток и изучали влияние Y-27632 на плотность культивируемых обезьяньих роговичных эндотелиальных клеток.
Пересев повторяли 7 раз, и группа ROCK ингибитора (+) показала более высокую плотность клеток (фиг.16) в течение всего периода культивирования с пересевом по сравнению с группой ROCK ингибитора (-). На основании этих данных считается, что применение Y-27632 обеспечивает возможность культивирования роговичных эндотелиальных клеток, имеющих высокую плотность, что будет также в будущем использоваться в регенеративной медицине, например, для трансплантации листка культивируемого роговичного эндотелия.
Пример 11
Исследование влияния фазудила на культуру обезьяньих роговичных эндотелиальных клеток
Из роговичной ткани, выделенной у подвергнутых эвтаназии Macaca fascicularis, отделяли десцеметову оболочку с роговичными эндотелиальными клетками, прикрепленными к ней. Десцеметову оболочку инкубировали в течение 45 мин вместе с диспазой II (1,2 ЕД/мл, Roche Applied Science) при 37ºС и 5% СО2, и роговичные эндотелиальные клетки механически отделяли операцией пипетирования. Отделенные роговичные эндотелиальные клетки центрифугировали и подвергали культивированию с пересевом в среде для роговичного эндотелия. В качестве среды для роговичного эндотелия использовали такую же среду, как в примере 1. Культивированные обезьяньи роговичные эндотелиальные клетки, собранные во время пересева культуры, отделяли обработкой 0,05% трипсином и центрифугировали, и перемешивали до такой же концентрации в среде для роговичного эндотелия с добавлением фазудила (10 мкМ, SIGMA-ALDRICH) в группе фазудила, и в среде для роговичного эндотелия без добавления фазудила в контрольной группе, и клетки высевали на 96-луночный планшет при плотности примерно 2000 клеток на лунку. Через 24 ч от начала культивирования подсчитывали прилипшие клетки с использованием устройства CellTiter-Glo (зарегистрированная торговая марка) для люминесцентного анализа жизнеспособности клеток (Promega) (фиг.17). Эффект содействия адгезии роговичных эндотелиальных клеток был также обнаружен при использовании фазудила, ингибитора ROCK.
Пример составления 5
Раствор для внутрикамерной инъекции, содержащий ингибитор Rho киназы
Следующий раствор для внутрикамерной инъекции был получен в соответствии с обычным способом:
Пример составления 6
Содержащая ингибитор Rho киназы культуральная среда для получения листка роговичного эндотелия
Следующую культуральную среду получали в соответствии с обычным способом:
Использовали FBS, изготовленный Invitrogen, раствор пенициллина-стрептомицина, изготовленный Nacalai Tesque (содержащий пенициллин 5000 ед/мл и стрептомицин 5000 мкг/мл), основной FGF, изготовленный Invitrogen, и DMEM, изготовленную Invitrogen.
Эта заявка основана на патентных заявках №№ 2007-223141 (дата подачи: 29 августа 2007 г.) и 2008-016088 (дата подачи 28 января 2008 г.), поданных в Японии, содержание которых полностью включено в настоящую заявку путем данной ссылки.
Группа изобретений относится к области медицины, в частности к офтальмологии. Средство для содействия адгезии роговичных эндотелиальных клеток, содержащее ингибитор Rho киназы, культуральная среда для роговичных эндотелиальных клеток, содержащая ингибитор Rho киназы, раствор для консервации роговицы, содержащий ингибитор Rho киназы, и способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием указанной выше культуральной среды. Группа изобретений обеспечивает способность эффективно выращивать роговичные эндотелиальные клетки и стабильно поставлять препарат роговичного эндотелия. 13 н. и 30 з.п. ф-лы, 17 ил., 19 пр.
1. Средство для содействия адгезии роговичных эндотелиальных клеток, содержащее ингибитор Rho киназы.
2. Средство по п.1, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
3. Средство по п.1, где роговичные эндотелиальные клетки получены у человека.
4. Средство по любому из пп.1-3, которое представляет собой препарат для профилактики или лечения дисфункции роговичного эндотелия.
5. Средство по п.4, которое представлено в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
6. Средство для защиты роговичного эндотелия, содержащее ингибитор Rho киназы.
7. Средство по п.6 в форме, подходящей для местного введения в глаз.
8. Культуральная среда для роговичных эндотелиальных клеток, содержащая ингибитор Rho киназы.
9. Культуральная среда по п.8, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
10. Культуральная среда по п.8, где роговичные эндотелиальные клетки получены у человека.
11. Раствор для консервации роговицы, содержащий ингибитор Rho киназы.
12. Раствор для консервации по п.11, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
13. Раствор для консервации по п.11, где роговица получена у человека.
14. Способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды по любому из пп.8-10.
15. Способ по п.14, где роговичные эндотелиальные клетки получены у человека.
16. Применение ингибитора Rho киназы для получения средства для содействия адгезии роговичных эндотелиальных клеток.
17. Применение по п.16, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
18. Применение по п.16, где роговичные эндотелиальные клетки получены у человека.
19. Применение по любому из пп.16-18, где средство для содействия адгезии роговичных эндотелиальных клеток представляет собой препарат для профилактики или лечения дисфункции роговичного эндотелия.
20. Применение по п.19, где средство для содействия адгезии роговичных эндотелиальных клеток представлено в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
21. Применение ингибитора Rho киназы для получения культуральной среды для роговичных эндотелиальных клеток.
22. Применение по п.21, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1- аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
23. Применение по п.21, где роговичные эндотелиальные клетки получены у человека.
24. Применение ингибитора Rho киназы для получения раствора для консервации роговицы.
25. Применение по п.24, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
26. Применение по п.24, где роговица получена у человека.
27. Способ содействия адгезии роговичных эндотелиальных клеток, включающий контакт эффективного количества ингибитора Rho киназы с мишенью или роговичной эндотелиальной клеткой, требующей содействия в адгезии роговичных эндотелиальных клеток.
28. Способ по п.27, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
29. Способ по п.27, где роговичные эндотелиальные клетки получены у человека.
30. Способ по п.27, который нацелен на профилактику или лечение дисфункции роговичного эндотелия.
31. Способ по п.27, включающий введение эффективного количества ингибитора Rho киназы в виде раствора для внутрикамерной инъекции или внутриглазной перфузионной жидкости.
32. Способ культивирования роговичных эндотелиальных клеток, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы.
33. Способ по п.32, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
34. Способ по п.32, где роговичные эндотелиальные клетки получены у человека.
35. Способ защиты роговицы, включающий стадию удерживания роговичного трансплантата или роговичных эндотелиальных клеток в растворе для защиты роговицы, содержащем ингибитор Rho киназы.
36. Способ по п.35, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
37. Способ по п.35, где роговица получена у человека.
38. Способ получения препарата роговичного эндотелия, включающий стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы.
39. Способ по п.38, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1 -(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
40. Способ по п.38, где роговичные эндотелиальные клетки получены у человека.
41. Способ лечения буллезной кератопатии, отека роговицы или лейкомы роговицы, включающий
стадию культивирования роговичных эндотелиальных клеток с использованием культуральной среды, содержащей ингибитор Rho киназы,
и
стадию трансплантации препарата роговичного эндотелия, полученного на указанной выше стадии культивирования, индивидууму, нуждающемуся в трансплантации роговичного эндотелия.
42. Способ по п.41, где ингибитор Rho киназы представляет собой, по меньшей мере, один, выбранный из группы, состоящей из (+)-транс-4-(1-аминоэтил)-1-(4-пиридилкарбамоил)циклогексана, 1-(5-изохинолинсульфонил)гомопиперазина и их фармакологически приемлемой соли.
43. Способ по п.41, где роговичные эндотелиальные клетки получены у человека.
| LEE JG, KAY EP FGF-2-induced wound healing in comeal endothelial cells requires Cdc-42 activation and Rho inactivation through the phosphatidylinositol 3-kinase pathway | |||
| Invest | |||
| Ophthalmol | |||
| Vis | |||
| Sci | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 6218410 B1, 17.04.2001 | |||
| 3(5)-ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПИРАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ P38 | 1998 |
|
RU2249591C2 |
| WO 2005078071 A1, 25.08.2005 | |||
| WO 2007083685 A1, 26.07.2007 | |||
| US 7141428 A, 28.11.2006 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2013-02-10—Публикация
2008-08-28—Подача