Изобретение относится к области биотехнологии и медицины, в частности к генетической инженерии, и может быть использовано для создания эффективных тест-систем по выявлению антител к вирусу иммунодефицита человека типа I (ВИЧ-1).
В настоящее время имеется большое число работ по экспресии в бактериальных клетках фрагментов гена evn, кодирующего белки оболочки ВИЧ-1 gp 120 и gp 41, а также получению штаммов-продуцентов рекомбинантных белков. Наилучшие результаты получены при использовании для экспресии слитых генов, состоящих из фрагментов гена env и генов Escherichia coli (E. coli).
Известны плазмиды, экспрессирующие следующие фрагменты гена env: Bgl II (7071) -Bgl II (7651) (аминокислоты (ак) 276-466) и Bgl II (7651) - Bam H1 (8505) (ак 467-750). В качестве векторов экспрессии использовали плазмиды pEX 1,2,3, которые содержат слитный cro-Lac Z ген, кодирующий слитый рекомбинантный белок под контролем промотора Pg фага λ , полилинкер на 3I-конце гена Lac Z и сигналы терминации транскрипции и трансляции. Путем трансформации рекомбинантными плазмидами клеток E. coli, были получены штаммы-продуценты искусственных антигенов. С помощью метода иммуноблотинга с сывороткой, содержащей антитела к ВИЧ-1, было установлено, что высокой антигенной активностью обладает рекомбинантный белок, кодируемый плазмидой pAL C17, содержащей Bgl II-Bam H1 фрагмент гена. Клон, содержащий плазмиду с Bgl - Bgl II фрагментом, в условиях иммуноблотинга антигенной активности не проявил. Выход рекомбинантного белка, кодируемого pALC17, составлял около 30 мг белка с одного литра культуры. Рекомбинантный белок использовали в ИФА.
К недостаткам аналога следует отнести недостаточно высокий уровень экспрессии рекомбинантных полипептидов, что делает процедуру очистки антигенов достаточно трудоемкой.
В качестве прототипа была выбрана плазмидная ДНК рЕ 6 и штамм-продуцент рекомбинантного белка. Плазмида рЕ 6 (размер 7339 нуклеотидных пар н. п. ) состоит из Bam H1 фрагмента верктора pUR 290 (5200 н. п. ), Bam H1-KpnI фрагмента плазмиды pUC 19(9) KpnI (6377) - Bam H1 (8505) фрагмента env (2130 н. п. ), взятого из плазмиды рВН 10.
Путем трансформации рекомбинантной плазмидой рЕ 6 клеток E. coli HB 101 [F-, hsdS 20 (rв- , mв- ), rec A13, ara 14, proA2, lacY1, galK2, rpsL20 (Smr ), xyl-5, mtl-1, sUpE44, λ- -] был получен штамм-продуцент полипептидов, обладающих антигенными свойствами поверхностных белков ВИЧ-1. Мажорный гибридный белок представляет собой полипептид, состоящий из 1023 ак β -галактозидазы, 2 ак, кодируемых полилинкером pUR 290, 3 ак, кодируемых полилинкером pUC 19, 708 ак, кодируемых геном env ВИЧ-1, и 16 ак , кодируемых полилинкерной последовательностью вектора pUR 290. Лизаты клеток E. coli, трансформированных плазмидой рЕ 6, содержат полноразмерный химерный белок 174 кДа. Кроме этого белка обнаруживается также присутствие дополнительных полипептидов с мол. массами 151 кДа и 140 кДа, которые, видимо, являются частями белка 174 кДа. Антигенная активность гибридных белков продемонстрирована известным методом иммуноблотинга. Показано, что гибридные белки с мол. м. 174, 151 и 400 кДа обладают антигенной активностью вируса СПИД. Уровень синтеза гибридных белков, по данным авторов, составляет 20% тотального клеточного белка, что позволяет получать 50 мг рекомбинантного антигена с 1 л клеточной суспензии.
Недостатком штамма-продуцента, выбранного в качестве прототипа, является отсутствие суперпродукции lac-репрессора. Это делает синтез мРНК и, следовательно, белкового продукта, направляемый lac-промотором плазмиды pUR-290, нерегулируемым. Полипептид, кодируемый Kpn I-Bam H1 фрагментом env-гена, является токсичным для бактериальных клеток из-за наличия протяженных гидрофобных последовательностей, что в случае конститутивного синтеза приводит к замедлению роста клеточной массы, уменьшению стабильности химерного белка и сказывается на конечном выходе продукта. Недостатком рекомбинантной плазмиды-прототипа рЕ 6 является величина экспрессируемого фрагмента env-гена, который помимо областей, кодирующий иммунодоминантные регионы gp 160, включает в себя участки, кодирующие антигеннонезначимые районы gp 160. Слишком большой размер синтезируемого химерного белка также является причиной его нестабильности, обусловленной протеолизом или неспецифической терминацией трансляции.
Цель изобретения - повышение уровня синтеза и увеличение стабильности рекомбинантного белка, обладающего антигенными свойствами ВИЧ-1.
Цель достигается конструированием плазмиды pUE 41, в которой Bgl II - Hind III фрагмент гена env ВИЧ-1 находится в одной рамке считывания с геном lac Z под контролем лактозного оперона E. coli. Предлагаемый способ конструирования плазмиды предусматривает использование вектора серии pUR 290, сконструированных Мюллер-Хиллом для экспресcии фрагмента вирусного гена и использование химерного белка, состоящего из β -галактозидазы и вирусного полипептида на ее С-конце, для серодиагностики ВИЧ-инфекции. Цель достигается также за счет использования для создания химерного гена ограниченного фрагмента env-гена, кодирующего консервативные иммунодоминантные области белков оболочки ВИЧ-1 gp 120 и gp 41 и не содержащего районов, кодирующих протяженные гидрофобные аминокислотные последовательности. Это позволяет увеличить продукцию химерного антигена в бактериальных клетках в 1,5 раза по сравнению с прототипом, а также избежать его значительной деградации. Цель достигается также получением штамма Escherichia coli, обеспечивающего регулируемый синтез белка, обладающего антигенными свойствами ВИЧ-1. Наличие в клетках штамма-продуцента суперпродукции lac-репрессора, позволяет индуцировать синтез целевого полипептида после достижения культурой значительной плотности и проводить его незначительное время, что способствует повышению выхода продукта и увеличение его стабильности.
С помощью рекомбинантной плазмиды pUE 41 достигается стабильная экспрессия ВИЧ-антигена в E. coli. Фрагмент env-гена находится в одной рамке считывания с геном lac Z, что обеспечивает синтез в E. coli химерного белка с молекулярной массой 130 кДа (фиг. 4), состоящего из β -галактозидазы E. coli и фрагментов белков оболочки ВИЧ-1 gp 120 и gp 41 на ее С-конце.
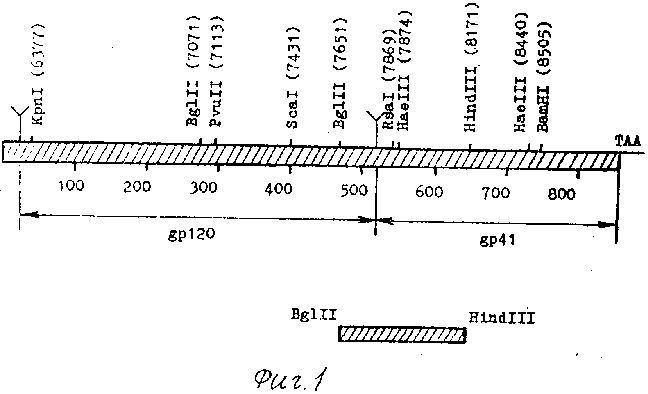
Химерный белок включает в себя аминокислотную последовательность кодируемого Bgl II-Hind III фрагментом гена env ВИЧ-1 (фиг. 1), начинающуюся с изолейцина, номер 1, и заканчивающуюся серином, номер 174. Полипептид, кодируемый Bgl II-Hind III фрагментом, включает в себя следующие важные области (фиг. 2): 1 - гидрофобный трансмембранный пептид (ак 514-524); 2 - додекапептид (ак 500-511), содержащий сайты протеолиза для расщепления белка - предшественника gp 160 на go 120 и gp 41; 3 - высококонсервативную область gp 41 вокруг двух остатков цистеина (иммунодоминантный домен gp 41, ак 598-609; 4 - консервативную последовательность на С-конце; 5 - консервативную последовательность в N-концевой области фрагмента (ак 476-489, предполагаемый сайт С4 gp 120). Кроме того, выбранный фрагмент почти полностью лишен потенциальных сайтов гликозилирования, следовательно, можно предположить, что антигенность рекомбинантного белка будет соответствовать антигенным свойствам белков оболочки ВИЧ-1.
Для получения штамма-продуцента E. coli ВКПМ В-5106 штамм бактерный E. coli JM 103 трансформируют рекомбинантной плазмидой pUE 41.
Штамм продуцента E. coli ВКПМ В-5106 отличается от штамма E. coli JM 103 по признакам, передаваемым плазмидой, т. е. является устойчивым к ампициллину и синтезирует химерный белок, состоящий из β -галактозидазы E. coli и фрагментов белков gp 120 и gp 41 ВИЧ-1, обладающий β -галактозидазной активностью.
Полученный штамм характеризуется следующими признаками:
1. Морфологические признаки.
Клетки прямые, палочковидной формы, 1,2-1,6 х 2,0-6,0 мкм, подвижные с перитрахиальными жгутиками, грам-отрицательные, неспороносные.
2. Культуральные признаки.
Клетки хорошо растут на простых питательных средах, оптимальная температура роста 30-37оС рН 6,8-7,5. При росте на мясопептонном и рыбном агаре развиваются в виде гладких круглых, блестящих, серых мужских колоний с ровными краями. При росте в жидких средах вызывает равномерное помутнение с образованием осадка.
3. Физиолого-биохимические признаки.
Клетки растут в интервале температур 2-45оС, желатин не разжижают, восстанавливают нитраты и нитриты. В качестве источника углерода используют многие углеводы и аминокислоты. В качестве источника азота используют как минеральные соли в аммонийной и нитратной форме, так и органические соединения в виде пептона и аминокислот.
4. Устойчивость к антибиотикам.
Штамм проявляет устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием рекомбинантной плазмиды.
5. Стабильность плазмиды в штамме.
При поддержании штамма в течение двух лет на рыбном агаре при +4оС или в 30% глицерине при -70оС в присутствии ампициллина не наблюдается перестройки или утери плазмиды.
Штамм депонирован во Всесоюзной коллекции промышленных микроорганизмов во ВНИИгенетики и селекции промышленных микроорганизмов Минмедпрома СССР (г. Москва) и имеет коллекционный номер В-5106.
Перечень графических изображений:
Фиг. 1. Графическое изображение гена env ВИЧ-1 с указанием сайтов рестрикции.
Отмечены границы полипептидов кодируемых env-геном, а также выделен использованный в работе фрагмент. Y-сайты протеолиза. В скобках приведены номера соответствующих нуклеотидов плазмиды рВН 10.
Фиг. 2. Нуклеотидная и соответствующая аминокислотная последовательности Bam H1-Hind III фрагмента гена env ВИЧ-1. Обозначены наиболее важные районы фрагмента.
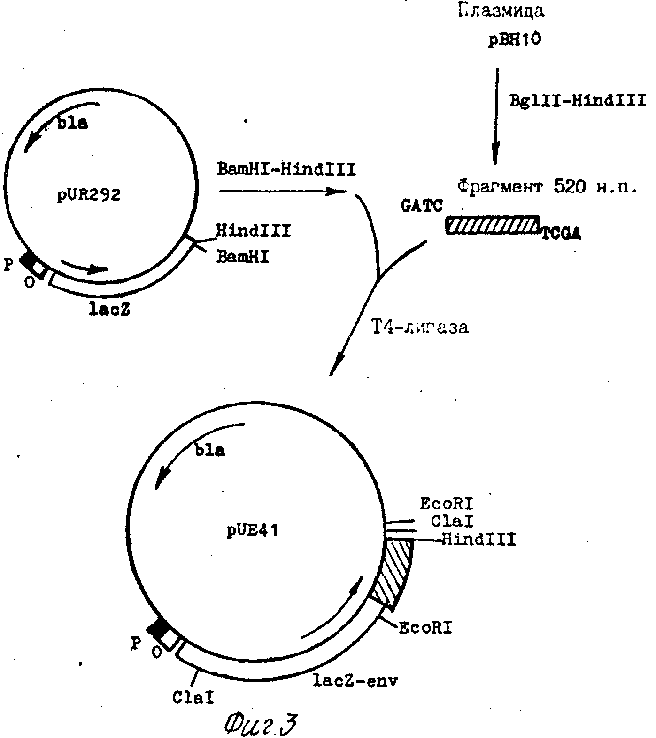
Фиг. 3. Схема конструирования плазмидной ДНК pUE 41, а также генетическая карта плазмиды pUE 41.
Отмечены гены β -лактамазы (bla), промотор (Р), оператор (О) и ген (lac Z) β -галактозидазы.
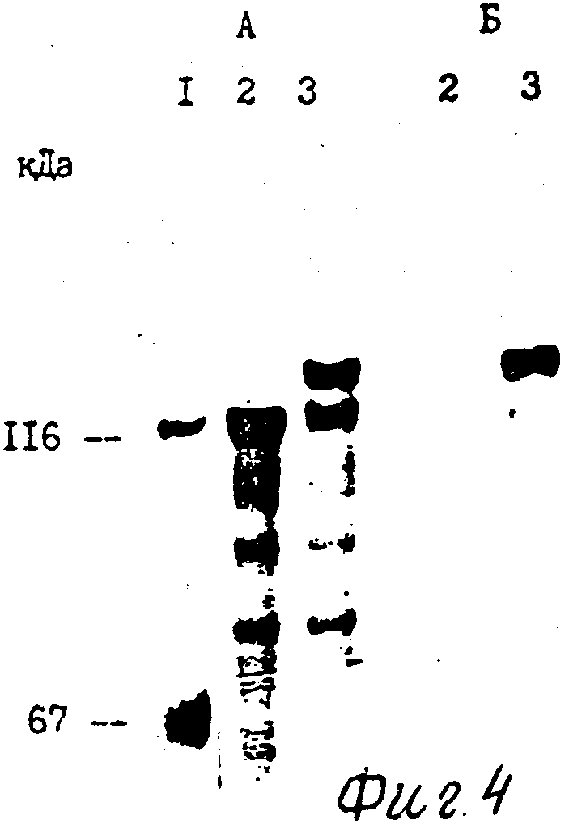
Фиг. 4. Электрофоретический анализ белков трансформированных бактерий E. coli JM 103 в 7,2 додецилсульфате натрия (SDS)-полиакриламидном гене (ПААГ).
А - общие белковые профили индуцированных культур;
Б - иммуноблот с ВИЧ-положительной сывороткой.
1 - М. в. стандарты (сбоку указаны величины молекулярных весов в кДа);
2 - индуцированные клетки E. coli JM 103, несущие плазмиду pUR 292;
3 - индуцированные клетки E. coli JM 103, несущие плазмиду pUE 41.
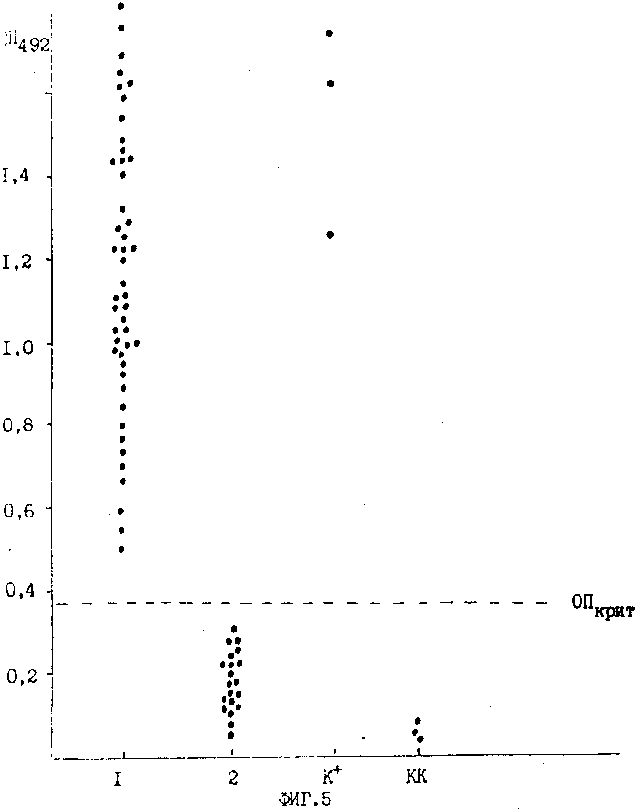
Фиг. 5. Результаты иммуноферментного анализа (ИФА) сыворотки крови вирусоносителей и больных СПИД, а также здоровых доноров.
По оси абсцис отмечены:
1 - панель положительных сывороток;
2 - панель из отрицательных сывороток доноров.
По оси ординат - оптическая плотность ОП492 (о. е. ).
К+ - контрольная положительная сыворотка.
КК - контроль конъюгата.
Изобретение иллюстрируется следующими примерами.
П р и м е р 1. Конструирование рекомбинантной плазмиды pUE 41.
Клетки бактерий E. coli JM 103, содержащие плазмидную ДНК pUR 292, и клетки бактерий E. coli НВ 101, содержащие плазмидную ДНК рВН 10, выращивают в 0,5 л среды YT с ампициллином в концентрации 50 мкг/мл в течение 20 ч. Клетки осаждают центрифугированием (50000 g, 5 мин, 4оС) и выделяют из них плазмидную ДНК.
Полученные препараты ДНК плазмид pUR 292 и pBH 10 используют для конструирования плазмиды pUR 41 (схема на фиг. 3), которое проводят следующим образом. Осуществляют гидролиз 20 мкг ДНК pUR 292 эндонуклеазами рестрикции Bam H1 и Hind III в буфере, содержащем 0,01 М трис-НМ1, рН 8, 0,01 М MgCl2, 0,05 М NaCl, 1 мМ β -меркаптоэтанол. В тех же условиях проводят Bgl II-Hind III гидролиз 50 мкг плазмиды рВН 10. Гидролизаты плазмид подвергают электрофорезу в 4% полиакриламидном геле в трис-боратном буфере, гель прокрашивают бромистым этидием и под длинноволновым ультрафиолетовым облучением (УФО) вырезают полоску, соответствующую линейной ДНК для Bam HI-Hind III гидролизата pUR 292, и полоску, соответствующую фрагменту 520 н. п. , для Bgl II-Hind III - гидролизата рВН 10. Фрагменты ДНК выделяют из кусочков электроэлюцией на бумажные диски ДУ-81 в 0,01 М трис-боратном буфере, рН 8,3, при 350 В в течение 2-3 ч, ДНК с дисков смывают 1,5 М NaCl 10 мМ трис-HCl, рН 7,5 мМ динатриевой соли диэтилендиаминтетрауксусной кислоты (ЭДТА) (4 х 20 мкл) в течение 40 с при 56оС, осаждают этанолом. Осадок промывают спиртом, высушивают, растворяют в 10 мкл Н2О. Выделенный Bgl II-Hind III фрагмент (1 пмоль) смешивают с 0,2 пмолями линейной векторной ДНК в 30 мкл раствора, содержащего 66 мМ трис-HCl, рН 7,5, 5 мМ MgCl2, 5 мМ дитиотреит, 1 мМ рибоаденозитрифосфата (АТР), 20 ед. акт. ДНК-лигазы фага Т4. Реакцию проводят при 10оС в течение 20 ч.
Аликвоты лигазной смеси используют для трансформации компонентных клеток E. coli JM 103. Трансформированные клетки смешивают с 30 мкл 2 % 5-бром-4-хлориндолил-3- β -Д-гелактопиранозида (X-Gal) в диметилформамиде (вес/объем), высевают на чашки с твердым агаром, содержащим ампициллин (25 мкг/мл), и растят 18 ч при 37оС. Выросшие синие колонии скалывают в 10 мл среды YT, содержащей ампициллин (50 мкг/мл), инкубируют при 37оС в течение 18 ч. Клетки отделяют центрифугированием, из них выделяют плазмидную ДНК для последующего рестрикционного анализа. Плазмида, дающая при совместном гидролизе рестриктазами EcoR I и Hind III фрагмент величиной 550 н. п. , получила название pUE 41.
П р и м е 2. Анализ продуктов экспрессии гибридного гена lac Z-env.
Компонентные клетки E. coli JM 103 трансформируют плазмидной ДНК pUE 41, смешивают с 30 мкл 2% X-Gal в диметилформамиде и высевают на чашки с твердым агаром, содержащим ампициллин (25 мкг/мл). Чашки инкубируют ночь при 37оС. Голубую колонию переносят в 5 мл жидкой среды YT, содержащей ампициллин (50 мкг/мл), и инкубируют 16-18 ч при 37оС. Выросшую культуру разбавляют в 100 раз средой YT, содержащей 50 мкг/мл ампициллина и продолжают инкубировать при 37оС, интенсивно перемешивая, до достижения культурой оптической плотности А550 = 1,0 о. е. /мл. Затем в среду вносят 1/100 объема 0,1 М водного изопропил- β -Д-тиогалактопиранозида (ИПТГ) и оставляют на 2-3 ч при умеренном встряхивании (37оС, 100 об/мин). Клетки, выделенные из 1 мл культуры, суспендируют в 100 мкл буфера, содержащего 62,5 мМ трис-HCl, рН 6,8 10% глицерин, 5% SDS, 0,0025% бромфениловый синий, 5% -меркаптоэтанол. Клеточную суспензию прогревают при 100оС в течение 10 мин, полученный лизат осветляют центрифугированием в течение 3 мин при 10000 g, температуре 20оС. Электрофоретический анализ аликвот (5 мкл) в 7,5% SDS-полиакриламидном геле проводят по Лэммли. Проведенный анализ показывает, что бактерии, трансформированные плазмидой pUE 41, при выращивании на среде с ИПТГ синтезируют белок молекулярной массы 130 кДа, количество которого составляет не менее 25-30% суммарного клеточного белка (фиг. 4).
Перенос белка из геля на нитроцеллюлозный фильтр (HAWP, 0,45 мкм, "Millupore", США). После переноса фильтры прединкубируют при комнатной температуре в течение 2-3 ч в растворе А, содержащем 5% обезжиренное молоко, 0,5 М NaCl, 20 мМ трис-HCl, рН 7,5. Далее блот инкубируют в течение 2 ч при 20-23оС с ВИЧ-положительной человеческой сывороткой, разбавленной в 50 раз раствором А, содержащим обработанный ультразвуком лизат клеток E. coli JN 103, несущих плазмиду pUR 290. Концентрация белков E. coli в инкубационной среде составляет 0,3 мг/мл. Неспецифически связанные с нитроцеллюлозой антитела удаляют повторными отмывками фильтром в растворе А и растворе Б, содержащем 0,15 М NaCl, 10 мМ фосфата натрия, рН 7,5, 0,5% Твин-20. Для проявления связанных специфических антител используют конъюгат кроличьих антител против IgG человека с пероксидазой хрена. Инкубацию с конъюгатом осуществляют при комнатной температуре в растворе А в течение 1-2 ч с последующими отмывками в растворах А и Б. Окрашивание проводят в растворе, содержащем 0,6 мг/мл 4-хлор-1 нафтола, 0,05 М Na-фосфат, рН 7,5 0,03% перекись водорода. Через 5 мин раствор красителя сливают и фильтры тщательно промывают дистиллированной водой и высушивают на воздухе. По данным иммуноблотинга с ВИЧ-положительной сывороткой взаимодействует только химерный белок, массой 130 кДа (фиг. 40.
П р и м е 3. Выделение химерного белка -Cal gp 120/gp 41.
Клетки, выделенные из 0,5 л индуцированной ИПТГ культуры клеток E. coli JN 103, несущих плазмиду pUE 41 (примерно 2 г сырых клеток), суспендируют в 15 мл раствора, содержащего 0,2 М трис-HCl, рН 7,6, 0,2 М NaCl, 0,01 М ацетат магния, 5% глицерин, добавляют 30 мкг лизоцима и инкубируют во льду 30 мин. Далее в клеточную суспензию добавляют β -меркаптоэтанол до концентрации 0,01 М. Клетки разрушают ультразвуком (10 х 30 с с интервалом 30 с при 0оС). Озвученную суспензию центрифугируют (12000 g, 10 мин, 2оС). Осадок ресуспендируют в 10 мл раствора, содержащего 0,01 М трис-HCl, рН 7,6, 0,02 М NaCl 2% дезоксихолат натрия ("Fliuka", Швейцария), 0,1 М β -меркаптоэтанол, при комнатной температуре. Суспензию центрифугируют (12000 g, 10 мин, 20оС). Осадок ресуспендируют в 10 мл раствора, содержащего 0,01 М трис-HCl, рН 7,6, 0,2 М NaCl, 1% SDS, 0,1 М -меркаптоэтанол, при 30-40оС. Полученный белковый раствор осветляют центрифугированием (12000 g, 10 мин, 20оС), супернатант диализуют при 20-23оС против 7 М мочевины в течение 20 ч. Концентрацию белка в полученном растворе определяют по Лоури. Использованный метод выделения позволяет получать до 100 мг рекомбинантного антигена с 1 л клеточной суспензии. Полученный белковый продукт может быть использован для тестирования сывороток людей на наличие антител к ВИЧ-1 твердофазным иммуноферментным анализом (ИФА).
П р и м е р 4. Иммуноферментный анализ.
В лунки планшетов для иммунологических реакций вносят по 100 мкл раствора антигена, содержащего 3 мгк/мл рекомбинантного белка, 0,05 М Na-фосфат, рН 7,5 0,075 М NaCl. Планшеты инкубируют при 4оС в течение ночи. Содержимое планшета сливают, лунки промывают трижды буфером ФСБ-Т, содержащем 0,05 М Na-фосфат, рН 7,5, 0,075 М NaCl и 0,05% Твин-20, и один раз дистиллированной водой. Тестируемые, а также контрольные положительную и отрицательную сыворотки разводят 1 : 100 , блокирующим раствором, содержащим белки лизата E. coli в концентрации 2 мг/мл. Разведенные сыворотки наносят по 100 мкл в лунки планшета с сорбированным антигеном и инкубируют в течение 30 мин при 37оС. Планшет промывают трижды буфером ФСБ-Т. Для проявления связавшихся антител используют кроличьи антитела против иммуноглобулинов человека, конъюгированные с пероксидазой хрена. В лунки планшета вносят по 100 мкл конъюгата в рабочем разведении и инкубируют в течение 30 мин при 37оС, промывают 3 раза буфером ФСБ-Т и вносят по 100 мкл раствора О-фенилендиамина в 0,1 М цитратном буфере. Реакцию останавливают через 10-30 мин добавлением в каждую лунку по 100 мкл 1,8 н. H2SO4 и измеряют оптическую плотность (ОП). Оценку результатов проводят следующим образом.
Критическую оптическую плотность (ОПкр) рассчитывают по формуле: ОПкр = х (ОПк + ОПкк ) + ОПкк, где ОПк - оптическая плотность в лунке, содержащей контрольную положительную сыворотку; ОПкк - оптическая плотность в лунке, не содержащей сыворотки; α- поправочный коэффициент, который рассчитывают для каждой серии антигена, используя большой набор отрицательных сывороток. Обычно значение α находится в интервале 0,2-0,3.
Сыворотка считывается положительной, если соответствующие ей значения ОП выше ОПкр. Результаты иммуноферментного анализа приведены на фиг. 5. Из 46 проанализированных положительных сывороток все 46 были идентифицированы как положительные. Из 23 отрицательных сывороток как отрицательны были узнаны все. (56) Суханова Л. Л. и др. Материалы Всесоюзн. конференции. Генная и клеточная инженерия в решении фундаментальных проблем биотехнологии. Тарту - кяэрику 20-22 сент. , 1988 г. , т. 1, Тарту, 1989 г. , с. 113-119.
Авторское свидетельство СССР N 1396604, кл. С 12 N 15/00, 1986.

Использование: биотехнология, медицина, генетическая инженерия. Получена рекомбинантная плазмидная ДНК pue 41, кодирующая белки оболочки gp 120 и gp 41 вируса иммунодефицита человека типа 1. Данной плазмидой трансформирован штамм реципиен E. ColiJM 103 и сконструирован штамм Escherichia coli ВКПМ В - 5106 продуцент рекомбинантного полипептида, обладающего антигенными свойствами белков оболочки иммунодефицита человека типа 1. 2 с. п. ф-лы, 5 ил.
- Bam HI - Hind III - фрагмент плазмидной ДНК pUR292 размером 5180 н. п. ;
- Bgl II - Hind III - фрагмент плазмидной ДНК pBH 10 размером 520 н. п. ;
- уникальный сайт рестрикции Hind III;
- гены и генетические маркеры;
- ген bla - обеспечивающий синтез β -лактамазы;
- ген lacz - обеспечивающий синтез β -галактозидазы;
- фрагмент гена env ВИЧ - 1, обеспечивающий синтез полипептида, обладающего антигенным свойством белков оболочки вируса иммунодефицита человека типа 1.
Авторы
Даты
1994-01-30—Публикация
1990-06-18—Подача