Настоящая заявка является непредварительной заявкой, поданной в соответствии с §1.53 (b) (1) раздела 37 Свода федеральных нормативных документов, и испрашивает приоритет в соответствии с Кодексом законов США, раздел 35, §119 (е) на основании предварительной заявки на патент США №61/682640, поданной 13 августа 2012 года, и предварительной заявки на патент США №61/784332, поданной 14 марта 2013 года, содержание которых полностью включено в настоящую заявку посредством ссылок.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в формате ASCII с помощью системы EFS-Web и тем самым полностью включен в настоящую заявку посредством ссылки. Копия указанного перечня в формате ASCII, созданная 9 августа 2013 года, имеет название P4959R1_WO_SeqList.txt, и размер данного файла составляет 121708 байт.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам к Jagged и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Путь передачи сигналов, в котором задействованы рецепторы Notch, обеспечивает регуляцию широкого спектра клеточных функций (Kopan et al., Cell 137, 216-233 (2009)). У млекопитающих были идентифицированы четыре типа рецепторов Notch, а именно Notch 1-4, которые содержат одинаковые основные структурные элементы, включающие внеклеточный домен, трансмембранный домен и внутриклеточный домен. Аналогичным образом, канонические лиганды рецептора Notch имеют определенное структурное сходство, однако был идентифицирован и ряд неканонических лигандов Notch (Kopan et al., Cell 137, 216-233 (2009)). Пять канонических лигандов у млекопитающих включают Delta-подобный лиганд 1, Delta-подобный лиганд 3, Delta-подобный лиганд 4, Jagged1 и Jagged2. Связывание лиганда Notch с внеклеточным доменом рецептора Notch инициирует запуск сигнального каскада, который начинается с протеолитического расщепления во внеклеточном сайте S2 под действием альфа-секретазы семейства ADAM (дизинтегрин и металлопротеаза). После расщепления в сайте S2 происходит протеолитическое расщепление во внутриклеточном сайте S3 под действием гамма-секретазы, в результате чего происходит высвобождение внутриклеточного домена и последующие события каскада, которые, в конечном итоге, активируют Notch-зависимые факторы транскрипции, такие как Hes1 и Неу.
Поскольку нарушение экспрессии и передачи сигнала Notch связывают с рядом заболеваний, включая рак (Koch et al., Cell. Mol. Life Sci. 64, 2746-2762 (2007)), были проведены исследования модуляторов сигнальных путей, в которых задействованы Notch, как потенциальных терапевтических средств для лечения таких заболеваний. Например, ингибиторы гамма-секретазы изучали в клинических исследованиях для установления их эффективности при лечении различных злокачественных новообразований (Shih et al, Cancer Res. 67, 1879-1882 (2007)). Ингибиторы гамма-секретазы предотвращают расщепление в сайте S3 и тем самым предотвращают передачу сигналов посредством рецепторов Notch. Однако ингибиторы гамма-секретазы не обладают специфичностью в отношении различных членов семейства Notch и, следовательно, ингибируют передачу сигналов через несколько рецепторов одновременно, а также через другие сигнальные пути (Beel et al., Cell. Mol. Life Sci. 65, 1311-1334 (2008)). Следовательно, введение ингибиторов гамма-секретазы связано с токсичностью в отношении кишечника, которая проявляется в виде потери массы тела и метаплазии бокаловидных клеток кишечника, что свидетельствует о роли Notch в определении судьбы клеток путем поддержания пролиферации клеток-предшественников кишечных крипт и подавления дифференциации в секреторные клетки (See van Es et al., Nature 435:959-963 (2005)). Аналогичным образом, ингибирование путей передачи сигналов, опосредованных как Notch 1, так и Notch2, с помощью условного нокаута генов Notch (Riccio et al., EMBO Rep. 9:377-383 (2008)) или путем ингибирования с применением антител-антагонистов (публикация заявки на патент США №2010/0080808) также вызывает метаплазию бокаловидных клеток кишечника.
Ввиду серьезной токсичности, связанной с применением ингибиторов нескольких рецепторов Notch, в данной области техники существует значительная потребность в направленном ингибировании передачи сигналов через конкретные рецепторы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены антитела к Jagged и способы их применения.
Согласно одному из аспектов настоящего изобретения предложено выделенное антитело, которое связывается с Jagged1. Согласно одному из вариантов реализации настоящего изобретения указанное антитело является антагонистом Jagged1-опосредованной передачи сигналов. Согласно одному из вариантов реализации настоящего изобретения антитело содержит по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных областей (HVR), выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 81; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 84; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 87; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 110; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 111; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 114. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 86; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 113. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 83; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112.
Согласно другому аспекту настоящего изобретения предложено выделенное антитело, которое связывается с Jagged2. Согласно одному из вариантов реализации настоящего изобретения антитело является антагонистом Jagged2-опосредованной передачи сигналов. Согласно одному из вариантов реализации настоящего изобретения антитело содержит по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 94; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 115; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 122. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 90; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 117. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 91; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 118. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 90; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 119. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 92; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 120. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 93; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115; (е) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 121.
Согласно другому аспекту настоящего изобретения, предложено выделенное антитело, которое связывается с Jagged1 и Jagged2 (Jagged1/2). Согласно одному из вариантов реализации настоящего изобретения антитело является антагонистом Jagged1/2-опосредованной передачи сигналов. Согласно одному из вариантов реализации настоящего изобретения антитело содержит по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 95; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 96; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 99; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 123; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 127. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 95; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 96; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 97; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 123; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 125. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 95; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 96; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 98; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 123; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 126.
Согласно другому варианту реализации настоящего изобретения антитело содержит по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 105; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 109; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 134. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 100; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 130. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 100; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 108; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 131. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 101; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 102; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 133. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 103; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132. Согласно одному из вариантов реализации настоящего изобретения антитело содержит: (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 104; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128; (е) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132.
Согласно некоторым вариантам реализации настоящего изобретения антитело в соответствии с любым из вышеупомянутых вариантов реализации представляет собой моноклональное антитело. Согласно некоторым вариантам реализации настоящего изобретения антитело в соответствии с любым из вышеупомянутых вариантов реализации представляет собой человеческое, гуманизированное или химерное антитело. Согласно некоторым вариантам реализации настоящего изобретения антитело в соответствии с любым из вышеупомянутых вариантов реализации представляет собой фрагмент антитела.
Согласно другому аспекту настоящего изобретения, предложено выделенное антитело, описанное выше, дополнительно содержащее каркасный участок (FR) вариабельного домена легкой цепи FR1, содержащий аминокислотную последовательность SEQ ID NO: 60; FR2, содержащий аминокислотную последовательность SEQ ID NO: 61; FR3, содержащий аминокислотную последовательность SEQ ID NO: 62; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 135. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит каркасный участок вариабельного домена тяжелой цепи FR1, содержащий аминокислотную последовательность SEQ ID NO: 50; FR2, содержащий аминокислотную последовательность SEQ ID NO: 136; FR3, содержащий аминокислотную последовательность SEQ ID NO: 57; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 35. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит каркасный участок вариабельного домена тяжелой цепи FR1, содержащий аминокислотную последовательность SEQ ID NO: 50; FR2, содержащий аминокислотную последовательность SEQ ID NO: 48; FR3, содержащий аминокислотную последовательность SEQ ID NO: 57; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 35.
Согласно другому аспекту настоящего изобретения, предложено выделенное антитело, которое связывается с Jagged1, содержащее (а) последовательность вариабельной области тяжелой цепи (VH), которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 10; (b) последовательность вариабельной области легкой цепи (VL), которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 19; или (с) последовательность VH, приведенную в (а), и последовательность VL, приведенную в (b). Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 10. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VL, приведенную в SEQ ID NO: 19. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 10, и последовательность VL, приведенную в SEQ ID NO: 19. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит (а) последовательность VH, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 11; (b) последовательность VL, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 20; или (с) последовательность VH, приведенную в (а), и последовательность VL, приведенную в (b). Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 11. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VL, приведенную в SEQ ID NO: 20. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 11, и последовательность VL, приведенную в SEQ ID NO: 20.
Согласно другому аспекту настоящего изобретения, предложено выделенное антитело, которое связывается с Jagged1, содержащее (а) последовательность VH, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 15; (b) последовательность VL, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 24; или (с) последовательность VH, приведенную в (а), и последовательность VL, приведенную в (b). Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 15. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VL, приведенную в SEQ ID NO: 24. Согласно некоторым вариантам реализации настоящего изобретения антитело содержит последовательность VH, приведенную в SEQ ID NO: 15, и последовательность VL, приведенную в SEQ ID NO: 24.
Согласно любому из вышеупомянутых вариантов реализации указанное антитело может представлять собой полноразмерное антитело IgG1.
Согласно другому аспекту настоящего изобретения предложено выделенное антитело, которое конкурирует с любым из антител, описанных в вышеупомянутых вариантах реализации, за специфичное связывание с Jagged1. Согласно другому аспекту настоящего изобретения, предложено выделенное антитело, которое конкурирует с любым из антител, описанных в вышеупомянутых вариантах реализации, за специфичное связывание с Jagged2. Согласно другому аспекту настоящего изобретения предложена выделенная нуклеиновая кислота, кодирующая выделенное антитело согласно вышеупомянутым вариантам реализации. Согласно другому аспекту настоящего изобретения предложена клетка-хозяин, содержащая выделенную нуклеиновую кислоту, кодирующую антитело. Согласно другому аспекту настоящего изобретения предложен способ получения антитела, включающий культивирование клетки-хозяина с получением тем самым антитела.
В другом аспекте настоящего изобретения предложен иммуноконъюгат, содержащий антитело согласно любому из вышеупомянутых вариантов реализации и цитотоксический агент.
В другом аспекте настоящего изобретения предложен фармацевтический состав, содержащий антитело согласно любому из вышеупомянутых вариантов реализации и фармацевтически приемлемый носитель.
В другом аспекте настоящего изобретения предложено антитело согласно любому из вышеупомянутых вариантов реализации для применения в качестве лекарственного средства. В некоторых вариантах реализации настоящего изобретения предложено антитело согласно любому из вышеупомянутых вариантов реализации для применения в лечении рака. В некоторых вариантах реализации настоящего изобретения предложено антитело согласно любому из вышеупомянутых вариантов реализации для применения в уменьшении роста раковых клеток.
Согласно другому аспекту настоящего изобретения предложен способ ингибирования Jagged1-опосредованной передачи сигналов. Согласно одному из вариантов реализации настоящего изобретения, предложен способ ингибирования Jagged1-опосредованной передачи сигналов в условиях in vitro. Согласно одному из вариантов реализации настоящего изобретения, предложен способ ингибирования Jagged1-опосредованной передачи сигналов в условиях in vivo.
Согласно другому аспекту настоящего изобретения предложен способ лечения субъекта, страдающего раком, включающий введение субъекту эффективного количества антитела согласно любому из вышеупомянутых вариантов реализации. Согласно одному из вариантов реализации настоящего изобретения рак выбран из группы, состоящей из: рака молочной железы, рака легких, рака мозга, рака шейки матки, рака толстой кишки, рака печени, рака желчных протоков, рака поджелудочной железы, рака кожи, В-клеточных злокачественных новообразований и Т-клеточных злокачественных новообразований.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 приведены типичные аминокислотные последовательности человеческого и мышиного белка Jagged1.
На ФИГ. 2 приведены типичные аминокислотные последовательности человеческого и мышиного белка Jagged2.
На ФИГ. 3A-D приведены аминокислотные последовательности пептидов, использованных для скрининга и селекции фаговых библиотек антител. Все белки экспрессировали в виде секретируемого белка в клетках BEVS, и их последовательности показаны в направлении от N-конца к С-концу. (А) Аминокислотная последовательность экспрессированного мышиного белка Jagged 1-DSL-EGF1-4 (Q34-D377). Жирный шрифт на N-конце обозначает короткую линкерную последовательность (ADLGS) (SEQ ID NO: 31). Жирный шрифт на С-конце обозначает короткую линкерную последовательность (EFG), сайт расщепления тромбином (LVPRGS) (SEQ ID NO: 137), G-спейсер и 6-His метку (SEQ ID NO: 138). (В) Аминокислотная последовательность экспрессированного человеческого белка Jagl-DSL-EGFl-4. Показана только последовательность Jag1, несмотря на то, что антиген также содержал сайт расщепления протеазой TEV и 6-His метку (SEQ ID NO: 138) на С-конце. (С) Аминокислотная последовательность экспрессированного мышиного белка Jag2-DSL-EGF1-4 (М27-Е388). Жирный шрифт на N-конце обозначает короткую линкерную последовательность (ADLGS) (SEQ ID NO: 31). Жирный шрифт на С-конце обозначает короткую линкерную последовательность (EFG), сайт расщепления тромбином (LVPRGS) (SEQ ID NO: 137), G-спейсер и 6-His метку (SEQ ID NO: 138). (D) Аминокислотная последовательность экспрессированного человеческого белка Jag2-DSL-EGF 1-4 (R2-E388). Жирный шрифт на С-конце обозначает короткую линкерную последовательность (EFG), сайт расщепления тромбином (LVPRGS) (SEQ ID NO: 137), G-спейсер и 6-His метку (SEQ ID NO: 138).
На ФИГ. 4A-1-B-2 приведены результаты сопоставления аминокислотных последовательностей вариабельных доменов тяжелой (ФИГ. 4А-1 и ФИГ. 4А-2) и легкой цепей (ФИГ. 4В-1 и ФИГ. 4В-2) антител к Jagged (пример 1-2). На фигуре указаны положения аминокислотных остатков областей, определяющих комплементарность (CDR).
На ФИГ. 5А-В приведены типичные акцепторные консенсусные последовательности каркаса вариабельного домена тяжелой цепи (VH) человека для применения при реализации настоящего изобретения. Идентификационные номера последовательностей представлены ниже:
- консенсусная последовательность каркаса VH подгруппы I человека «А» минус CDR в соответствии с системой нумерации Кабат (SEQ ID NO: 32, 33, 34, 35).
- консенсусные последовательности каркасов VH подгруппы I человека «В», «С» и «D» минус расширенные гипервариабельные области (SEQ ID NO: 36, 37, 34, 35; SEQ ID NO: 36, 37, 38, 35 и SEQ ID NO: 36, 37, 39, 35).
- консенсусная последовательность каркаса VH подгруппы II человека «А» минус CDR в соответствии с системой нумерации Кабат (SEQ ID NO: 40, 41, 42, 35).
- консенсусные последовательности каркасов VH подгруппы II человека «В», «С» и «D» минус расширенные гипервариабельные области (SEQ ID NO: 43, 44, 42, 35; SEQ ID NO: 43, 44, 45, 35 и SEQ ID NO: 43, 44, 46, и 35).
- консенсусная последовательность каркаса VH подгруппы III человека «А» минус CDR в соответствии с системой нумерации Кабат (SEQ ID NO: 47, 48, 49, 35).
- консенсусные последовательности каркасов VH подгруппы III человека «В», «С» и «D» минус расширенные гипервариабельные области (SEQ ID NO: 50, 51, 49, 35; SEQ ID NO: 50, 51, 52, 35 и SEQ ID NO: 50, 51, 53, 35).
- акцепторная последовательность каркаса VH человека «А» минус CDR в соответствии с системой нумерации Кабат (SEQ ID NO: 54, 48, 55, 35).
- акцепторные последовательности каркасов VH человека «В» и «С» минус расширенные гипервариабельные области (SEQ ID NO: 50, 51, 55, 35 и SEQ ID NO: 50, 51, 56, 35).
- 2 акцепторная последовательность каркаса VH человека «А» минус CDR в соответствии с системой нумерации Кабат (SEQ ID NO: 54, 48, 57, 35).
- 2 акцепторные последовательности каркасов VH человека «В», «С» и «D» минус расширенные гипервариабельные области (SEQ ID NO: 50, 51, 57, 35; SEQ ID NO: 50, 51, 58, 35 и SEQ ID NO: NO: 50, 51, 59, 35).
На ФИГ. 6 приведены типичные акцепторные консенсусные последовательности каркасов вариабельного домена легкой цепи (VL) человека, использованные при реализации настоящего изобретения. Идентификационные номера последовательностей приведены ниже:
- консенсусная последовательность каркаса VL каппа-цепи подгруппы I человека (κv1): SEQ ID NO: 60, 61, 62, 63,
- консенсусная последовательность каркаса VL каппа-цепи подгруппы II человека (κv2): SEQ ID NO: 64, 65, 66, 63,
- консенсусная последовательность каркаса VL каппа-цепи подгруппы III человека (κv3): SEQ ID NO: 67, 68, 69, 63
- консенсусная последовательность каркаса VL каппа-цепи подгруппы IV человека (κv4): SEQ ID NO: 70, 71, 72, 63.
На ФИГ. 7A-F приведены последовательности гипервариабельных областей тяжелой цепи HVR H1, Н2 и Н3 антител к Jagged, описанных в примерах. Положения аминокислот пронумерованы в соответствии с системой нумерации Кабат, описанной ниже.
На ФИГ. 8А-Е приведены последовательности гипервариабельных областей легкой цепи HVR L1, L2 и L3 антител к Jagged, описанных в примерах. Положения аминокислот пронумерованы в соответствии с системой нумерации Кабат, описанной ниже.
На ФИГ. 9 приведены последовательности каркаса легкой и тяжелой цепей антител к Jagged, описанных в примерах. Числа в верхнем индексе указывают на положение аминокислот в соответствии с системой нумерации Кабат.
На ФИГ. 10А-В приведены результаты исследования специфичности связывания антител, полученных в ходе первого (ФИГ. 10А) и второго (ФИГ. 10 В) раунда скрининга. (А) Результаты измерения методом твердофазного иммуноферментного анализа (ИФА) связывания антитела D-1 (левая панель) и С-1 (правая панель) с Jagged1 человека (hJag-1), Jagged2 человека (hJag-2), Jagged2 мыши (mJag-2), Delta-подобным лигандом 1 человека (hDLL-1), Delta-подобным лигандом 1 мыши (mDLL-1), или Delta-подобным лигандом 4 человека (hDLL-4). Концентрации антител указаны на оси X, и величина оптической плотности при длине волны 650 нм (OD650) указана на оси Y. (В) Результаты измерения методом ИФА специфичности связывания антител А и В, оба антитела были идентифицированы в ходе дальнейшего скрининга с использованием Jag1-DSL-EGF1-4 человека (ФИГ. 3В) для антитела А и Jag2-DSL-EGF1-4 мыши и человека (ФИГ. 3С и D) для антитела В. Черные столбики = связывание с человеческим Jagged1; серые столбики = связывание с человеческим Jagged2. С-1 использовали в качестве контроля для связывания как с Jagged1, так и Jagged2.
На ФИГ. 11 приведены величины констант связывания антител А, А-1, А-2, В, В-1, В-2, В-3, С, С-1, D, D-1 и D-2 с очищенным лигандом Jagged1 человека (Jag1 человека), Jagged2 человека (Jag2 человека) и Jagged2 мыши (Jag2 мыши).
На ФИГ. 12 показано дозазависимое ингибирование Jagged1-индуцированной передачи сигналов посредством рецептора Notch 1 под действием антител к Jagged. Результаты были получены в экспериментах с использованием смешанной культуры, в которых проводили измерение Jagged1-индуцированной передачи сигналов посредством рецептора Notch 1, как описано в примере 4. На оси Y показаны уровни экспрессии Notch-зависимого гена-репортера люциферазы светлячка относительно экспрессии контрольного гена (конститутивно активный промотор, инициирующий экспрессию гена люциферазы Renilla). На оси X показаны концентрации антител D и С (0,4-50 мкг/мл). Смешанную культуру без антител (J1-индуцированный положительный контроль) использовали в качестве положительного контроля для оценки Jagged1-индуцированной передачи сигналов. Изотипическое контрольное антитело использовали в качестве контроля при оценке специфичного ингибирования под действием антител. Ингибитор гамма-секретазы (соединение Е+) использовали в качестве контроля при оценке ингибирования Notch-зависимой передачи сигналов.
На ФИГ. 13А-В приведены результаты оценки ингибирования Notch-зависимой передачи сигналов под действием антител к Jagged с созревшей аффинностью. Количественные исследования с использованием смешанной культуры проводили, как описано на ФИГ. 12 и в примере 4. (А) Фаговые антитела и их концентрации (мкг/мл) указаны на оси X (исходные антитела С и D использовали в качестве контроля). Ингибиторы гамма-секретазы (GSIs), соединение Е (CmpE) и N-[N-(3,5-дифторфенилацетил)-L-аланил]-8-фенилглицина трет-бутиловый эфир (DAPT), в указанных концентрациях использовали в качестве положительного контроля при оценке ингибирования Notch-зависимой передачи сигналов; ДМСО использовали в качестве контроля носителя для GSIs; нецелевое антитело, изотип которого соответствовал таковому для антител, исследуемых в панели, использовали в качестве антитела для контроля изотипа. (В) Фаговые антитела в указанных концентрациях показаны на оси X. DAPT в указанных концентрациях использовали в качестве положительного контроля при оценке ингибирования Notch-зависимой передачи сигналов; ДМСО использовали в качестве контроля носителя. Процесс передачи сигналов индуцировали Jagged1 (темно-серые колонки) или Jagged2 (светло-серые колонки). Необработанные = культуры, которые не стимулировали лигандом и не обрабатывали антителом; Нестимулированные или 3Т3Р = культуры, которые не стимулировали лигандом; agD или gD = антитело для контроля изотипа; Stim/no АВ или No Ab = культуры, которые стимулировали лигандом, но не обрабатывали антителом; ингибитором гамма-секретазы DAPT или ДМСО, использованным в качестве контроля носителя для DAPT.
На ФИГ. 14А-В показано, что комбинированное ингибирование Jagged1 и Jagged2 вызывает быструю потерю массы тела. (А) Мышам вводили два раза в неделю антитело к Jagged1/2, С-1 (антитело к J1/2; 5-10 мг/кг), антитело к Jagged1-2, антитело А-2 (антитело к J1; 5-20 мг/кг), антитело к Jagged2, антитело В-3 (антитело к J2; 5-20 мг/кг), комбинацию антител А-2 и В-3 (антитело к J1 и J2; каждое по 5 мг/кг) или изотопическое контрольное антитело (20 мг/кг). Общая концентрация антител при каждом дозировании была доведена до 20 мг/кг с использованием изотопического контрольного антитела, в случае необходимости. Среднее изменение массы тела (ось Y) представлено в графической форме в виде процентного изменения исходной массы тела с течением времени (ось X). (В) Мышам линии Balb/c (по десять животных в группе, индивидуально размещенных) вводили внутрибрюшинно (в/б) два раза в неделю 30 мг/кг изотопического контрольного антитела анти-gD или комбинацию 15 мг/кг антитела А-2 плюс 15 мг/кг антитела В-3 в течение восьми дней. Потребление пищи оценивали с помощью ежедневного взвешивания полученной и оставшейся пищи в каждой клетке. Столбики ошибок обозначают стандартные отклонения (n=10).
На ФИГ. 15А-В приведены результаты стандартных гистологических исследований тканей кишечника после лечения антителами к Jagged. (А) Образцы тканей кишечника мышей, получавших антитела, как описано в примере 6, выделяли и окрашивали гематоксилином и эозином (ФИГ. 15А, Н и Е) или альциановым синим (ФИГ. 15А, альциановый синий). (В) Срезы тканей кишечника окрашивали с использованием первичных антител к лизоциму или Ki-67 (ФИГ. 15В).
На ФИГ. 16А-1-В-2 приведены результаты оценки ингибирования роста клеток рака легких человека под действием антитела-антагониста к Jagged1 в условиях in vivo. Мышам с ксенотрансплантатами клеток рака легких человека вводили внутрибрюшинно (в/б) два раза в неделю 20 мг/кг контрольного изотопического антитела, анти-gD (антитело для контроля изотипа), или антитела к Jagged1, антитела А-2 (анти-Jag1), инъекции начинали после того, как средний объем опухолей (измеренный с помощью циркуля) достигал приблизительно 180 мм3. Объемы опухолей (ось Y) затем оценивали в течение 19 дней. ФИГ. 16А-1 и ФИГ. 16А-2: Средние объемы опухолей для каждой группы (n=10) были графически представлены в виде зависимости от времени (ось X) с использованием линейной модели со смешанными эффектами (ФИГ. 16А-1). Объемы опухолей для каждой мыши в каждой группе показаны на двух панелях на ФИГ. 16А-2. ФИГ. 16В-1 и ФИГ. 16В-2: Общую массу тела каждой мыши измеряли и графически представляли в виде процентного изменения, усредненного для каждой группы (ФИГ. 16В-1) или для каждой мыши в каждой группе (ФИГ. 16В-2).
На ФИГ. 17А-В приведены результаты оценки ингибирования роста клеток рака молочной железы человека под действием антител-антагонистов к Jagged1 и Jagged2 в условиях in vivo. Мышам С.В-17 SCID.bg с ксенотрансплантатами клеток рака молочной железы человека вводили изотипическое контрольное антитело анти-gD (анти-gD), изотипическое контрольное антитело, связывающее агглютинин амброзии (антитело к агглютинину амброзии), антитело к Jagged1A-2, содержащее каркас IgG1 человека (анти-Jag1 А-2 (hIgG1)), антитело к Jagged1 А-2, содержащее каркас IgG2a мыши (анти-Jag1 А-2 (mIgG2a)) или антитело к Jagged2 В-3, содержащее каркас IgG1 человека (анти-Jag2 В-3 (hIgG1)) на 0, 4, 7, 12, 15, 18, 22, 25, 29, 32, 36, 43, 50 и 57 дни. Объемы опухолей (ось Y) в группах, получавших лечение (А), или у отдельных животных (В) графически представляли в виде зависимости от времени (ось X) с использованием линейной модели со смешанными эффектами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Применительно к настоящему изобретению «акцепторный каркас человека» представляет собой каркас, содержащий аминокислотную последовательность каркаса вариабельного домена легкой цепи (VL) или каркаса вариабельного домена тяжелой цепи (VH), полученный из каркаса иммуноглобулина человека или консенсусной последовательности каркаса человека, определенных ниже. Акцепторный каркас человека, «полученный из» каркаса иммуноглобулина человека или консенсусной последовательности каркаса человека, может содержать ту же аминокислотную последовательность, или он может содержать аминокислотную последовательность с заменами остатков. Согласно некоторым вариантам реализации настоящего изобретения количество изменений аминокислотных остатков составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее либо 2 или менее. Согласно некоторым вариантам реализации настоящего изобретения последовательность акцепторного каркаса VL человека идентична последовательности каркаса VL иммуноглобулина человека или консенсусной последовательности каркаса человека.
Термин «аффинность» относится к силе всех нековалентных взаимодействий между отдельным участком связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иное, в настоящей заявке термин «аффинность связывания» относится к природной аффинности связывания, которая отражает взаимодействие в соотношении 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X в отношении ее партнера Y в общем случае может быть описана с помощью константы диссоциации (Kd). Величину аффинности можно измерить с помощью обычных методов, известных в данной области техники, включая те, которые описаны в настоящей заявке. Конкретные иллюстративные и типичные варианты, пригодные для измерения величины аффинности связывания, описаны ниже.
Антитело с «созревшей аффинностью» относится к антителу, содержащему одно или более изменений в одной или более гипервариабельных областей (HVR), по сравнению с исходным антителом, которое не содержит таких изменений, причем такие изменения приводят к улучшению аффинности антитела в отношении антигена.
Термины «антитело к Jagged» и «антитело, которое связывается с Jagged» относятся к антителу, которое способно связывать Jagged1, Jagged2, или Jagged1 и 2 (Jagged1/2) с достаточной аффинностью, в результате чего антитело является пригодным в качестве диагностического и/или терапевтического агента для нацеленного воздействия на Jagged. Согласно одному из вариантов реализации настоящего изобретения, степень связывания антитела к Jagged с нецелевым белком, отличным от Jagged, составляет менее приблизительно 10% от величины связывания антитела с белком Jagged, согласно результатам измерения, например, с помощью радиоиммунологического анализа (РИА). Согласно некоторым вариантам реализации настоящего изобретения антитело, которое связывается с Jagged, имеет константу диссоциации (Kd), величина которой составляет ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). Согласно некоторым вариантам реализации настоящего изобретения антитело к Jagged связывается с эпитопом Jagged, который является консервативным между Jagged различных видов.
В настоящей заявке термин «антитело» используется в самом широком смысле и включает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют желаемую антигенсвязывающую активность.
В настоящей заявке «блокирующее» антитело или «антитело-антагонист» представляет собой антитело, которое существенно ингибирует (как частично, так и полностью) биологическую активность антигена, с которым оно связывается.
Термин «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела и которая связывает антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, фрагменты Fv, Fab, Fab', Fab'-SH, F(ab')2; диантитела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифичные антитела, образованные из фрагментов антител.
Термин «антитело, которое связывается с тем же эпитопом», что и эталонное антитело, относится к антителу, которое блокирует связывание эталонного антитела с его антигеном на 50% или более в исследовании конкурентного связывания, и, наоборот, эталонное антитело блокирует связывание антитела с его антигеном на 50% или более в исследовании конкурентного связывания. Типичный способ исследования конкурентного связывания предложен в настоящей заявке.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как оставшаяся часть тяжелой и/или легкой цепи получена из другого источника или вида.
Термин «класс» антитела относится к типу константного домена или константной области, присущему его тяжелой цепи. Существуют пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
В настоящей заявке термин «цитотоксический агент» относится к веществу, которое ингибирует или предотвращает функцию клеток, и/или вызывает гибель или разрушение клеток. Цитотоксические агенты включают, но не ограничиваются ими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или обладающие ферментативной активностью токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты; и различные противоопухолевые или противораковые агенты, описанные ниже.
«Эффекторные функции» обозначают виды биологической активности, относящиеся к области Fc антитела, которые варьируются в зависимости от изотипа антител. Примеры эффекторных функций антител включают: связывание компонента системы комплемента C1q и комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию поверхностных рецепторов (например, рецепторов В-клеток) и активацию В-клеток.
«Эффективное количество» агента, например, фармацевтического состава, относится к количеству, которое эффективно при необходимых в дозах и в течение необходимых периодов времени для достижения желаемого терапевтического или профилактического результата.
В настоящей заявке термин «область Fc» используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Данный термин включает области Fc с нативными последовательностями и варианты областей Fc. Согласно одному из вариантов реализации настоящего изобретения, область Fc тяжелой цепи IgG человека продолжается от Cys226 или Рго230 до карбоксильного конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) области Fc может либо присутствовать, либо отсутствовать. Если в настоящей заявке не указано иное, нумерация аминокислотных остатков в области Fc или константной области осуществляется в соответствии с системой нумерации ЕС, также называемой индекс ЕС, как описано в работе Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд. Служба общественного здравоохранения, Национальный институт здравоохранения, Бетесда, Мэриленд, США, 1991.
Термин «каркасный участок» или «FR» относится к остаткам вариабельного домена, за исключением остатков гипервариабельной области (HVR). Каркасный участок вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, в VH (или VL) последовательности HVR и FR обычно представлены в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
В настоящей заявке термины «полноразмерное антитело», «интактное антитело» и «целое антитело» используются взаимозаменяемо для обозначения антитела, имеющего структуру по существу аналогичную структуре нативного антитела или антитела, содержащего тяжелые цепи, которые включают область Fc, определенную в настоящей заявке.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичные трансформированные клетки и полученное от них потомство, независимо от числа пассажей. Потомство может быть не полностью идентичным по содержанию нуклеиновых кислот по отношению к исходной клетке, и может содержать мутации. Мутантное потомство, которое имеет аналогичную функцию или биологическую активность, в отношении которой был проведен скрининг или отбор первоначально трансформированной клетки, включено в настоящее описание.
Термин «человеческое антитело» относится к антителу, содержащему аминокислотную последовательность, которая соответствует последовательности антитела, вырабатываемого в организме человека или клеткой человека, или полученного из источника, отличного от человека, который использует репертуар антител человека или другие последовательности, кодирующие антитела человека. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее антигенсвязывающие остатки антител видов, отличных от человека.
«Консенсусная последовательность каркаса человека» представляет собой каркас, который представлен наиболее часто встречающимися аминокислотными остатками в наборе каркасных последовательностей VL или VH иммуноглобулина человека. Обычно набор последовательностей VL или VH иммуноглобулина человека получают из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную в работе Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд., публикация Национального института здоровья, 91-3242, Бетесда, Мэриленд, США (1991), тт. 1-3. Согласно одному из вариантов реализации настоящего изобретения, подгруппа для VL представляет собой подгруппу каппа I, как описано в работе Kabat et al., выше. Согласно одному из вариантов реализации настоящего изобретения, подгруппа для VH представляет собой подгруппу III, как описано в работе Kabat et al., выше.
«Гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из областей HVR видов, не относящихся к человеку, и аминокислотные остатки из FR человека. Согласно некоторым вариантам реализации настоящего изобретения гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно двух вариабельных доменов, в которых все или по существу все из областей HVR (например, CDR) соответствуют таковым в антителе вида, не относящегося к человеку, и все или по существу все FR соответствуют таковым в человеческом антителе. Гуманизированное антитело может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. «Гуманизированная форма» антитела, например, антитела вида, не относящегося к человеку, относится к антителу, которое подверглось гуманизации.
В настоящей заявке термин «гипервариабельная область» или «HVR» относится к каждой из областей вариабельного домена антитела, последовательности которых являются гипервариабельными («области, определяющие комплементарность» или «CDR») и/или образуют структурно обособленные петли («гипервариабельные петли») и/или содержат остатки, вступающие в контакт с антигеном («контактирующие с антигеном»). Как правило, антитела содержат шесть областей HVR: три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). В настоящей заявке типичные HVR включают:
(a) гипервариабельные петли, которые находятся в областях, содержащих аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).
(b) CDR, которые находятся в областях, содержащих аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35 (HI), 50-65 (Н2) и 95-102 (Н3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5-е изд., публикация Национального института здоровья, 91-3242, Бетесда, Мэриленд, США (1991)).
(c) остатки, вступающие в контакт с антигеном, которые находятся в аминокислотных положениях 27-36 (L1), 46-55 (L2), 89-96 (L3), 30-35 (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(d) комбинации (a), (b), и/или (с), включая аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35 (H1), 49-65 (H2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, остатки HVR и другие остатки вариабельного домена (например, остатки FR) нумеруются в настоящей заявке в соответствии с системой, описанной в работе Kabat et al., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичных молекул, включая, но не ограничиваясь указанным, цитотоксический агент.
«Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, человека и приматов, исключая человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). Согласно некоторым вариантам реализации настоящего изобретения индивидуум или субъект представляет собой человека.
«Выделенное антитело» представляет собой антитело, которое было отделено от компонента естественной среды антитела. Согласно некоторым вариантам реализации настоящего изобретения антитело очищают до степени чистоты более чем 95% или 99%, согласно результатам определения, например, электрофоретическими методами (например, методами электрофореза в ДСН-ПААГ, изоэлектрической фокусировки (ИЭФ), капиллярного электрофореза) или хроматографическим методом (например, методом ионообменной хроматографии или обращенно-фазовой ВЭЖХ). Для обзора методов оценки степени чистоты антител, см., например, работу Flatman et al., J. Chromatogr. В 848:79-87 (2007).
Термин «выделенная нуклеиновая кислота» относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее естественной среды. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, однако, такая молекула нуклеиновой кислоты присутствует вне хромосомы или в участке хромосомы, который отличается от ее природного хромосомного расположения.
Термин «выделенная нуклеиновая кислота, кодирующая антитело к Jagged» относится к одной или более молекул нуклеиновой кислоты, кодирующих тяжелые и легкие цепи антитела (или их фрагменты), включая такую молекулу(ы) нуклеиновой кислоты в отдельном векторе или различных векторах, и такую молекулу(ы) нуклеиновой кислоты, которая присутствует в одном или более местах в клетке-хозяине.
В настоящей заявке термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих природные мутации или возникающих в процессе производства препарата, содержащего моноклональные антитела, такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов, содержащих поликлональные антитела, которые обычно включают различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело в препарате моноклональных антител направлено к одной детерминанте на антигене. Таким образом, определение «моноклональное» указывает на характер антитела как полученного по существу из гомогенной популяции антител, и не должно быть истолковано, как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела для применения в соответствии с настоящим изобретением могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, метод гибридом, методы рекомбинантных ДНК, методы фагового дисплея, а также методы с использованием трансгенных животных, содержащих все или часть локусов иммуноглобулинов человека, такие методы и другие типичные методы получения моноклональных антител описываются в настоящей заявке.
Термин «оголенное антитело» относится к антителу, которое не конъюгировано с гетерологичным фрагментом (например, цитотоксическим фрагментом) или радиоактивной меткой. Оголенные антитела могут присутствовать в фармацевтическом составе.
Термин «нативные антитела» относится к природным молекулам иммуноглобулинов с различными структурами. Например, природные антитела IgG являются гетеротетрамерными гликопротеинами с массой приблизительно 150000 дальтон, которые состоят из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидной связью. В направлении от N-конца к С-концу каждая тяжелая цепь содержит вариабельную область (VH), также называемую вариабельный тяжелый домен или вариабельный домен тяжелой цепи, за которой расположены три константных домена (CH1, СН2 и СН3). Аналогичным образом, в направлении от N-конца к С-концу каждая легкая цепь содержит вариабельную область (VL), также называемую вариабельный легкий домен или вариабельный домен легкой цепи, за которой расположен константный домен легкой цепи (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности ее константного домена.
Термин «листок-вкладыш в упаковке» используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических средств, которые содержат информацию о показаниях к применению, способах применения, дозировке, способах введения, возможности применения в комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических средств.
«Процент (%) идентичности аминокислотной последовательности» по отношению к эталонной последовательности полипептида определяется как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной последовательности полипептида, после выравнивания последовательностей и введения пробелов, если это необходимо, для достижения максимальной величины процента идентичности последовательностей, без учета каких-либо консервативных замен как части определения идентичности последовательностей. Выравнивание для определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые известны специалисту в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ALIGN, или программного обеспечения Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения процентные значения величины идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Программа для сравнения последовательностей ALIGN-2 была создана компанией Genentech, Inc., и исходный код был подан совместно с пользовательской документацией в Бюро регистрации авторских прав США, Вашингтон, округ Колумбия, США, 20559, где он зарегистрирован под регистрационным номером Бюро регистрации авторских прав США № TXU510087. Программа ALIGN-2 является общедоступной от компании Genentech, Inc., Южный Сан-Франциско (Калифорния, США), или может быть компилирована из исходного кода. Программа ALIGN-2 должна быть компилирована для использования на базе операционной системы UNIX, включая Digital UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не меняются.
В тех случаях, когда ALIGN-2 используют для сравнения аминокислотных последовательностей, процент идентичности аминокислотных последовательностей для определенной аминокислотной последовательности А по сравнению, с, или по отношению к определенной аминокислотной последовательности В (что, в другом варианте, может быть сформулировано как определенная аминокислотная последовательность А, которая имеет или содержит последовательность с каким-либо процентом идентичности по сравнению, с, или по отношению к определенной аминокислотной последовательности В) рассчитывают следующим образом:
Идентичность (%) = 100*X/Y,
где X представляет собой количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2, при выравнивании с помощью этой программы последовательностей А и В, и где Y представляет собой общее количество аминокислотных остатков в последовательности В. Следует понимать, что в тех случаях, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, процентное значение величины идентичности аминокислотной последовательности А по отношению к последовательности В не будет равно процентному значению величины идентичности аминокислотной последовательности В по отношению к последовательности А. Если специально не указано иное, все процентные значения величин идентичности аминокислотных последовательностей, используемые в настоящей заявке, получены, как описано в предыдущем параграфе, используя компьютерную программу ALIGN-2.
Термин «фармацевтический состав» относится к препарату, который находится в форме, обеспечивающей биологическую активность действующего вещества, содержащегося в нем, для достижения его эффективности, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет введен состав.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом составе, за исключением действующего вещества, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает, но не ограничивается ими, буфер, вспомогательное вещество, стабилизатор или консервант.
В настоящей заявке термин «Jagged» или «Jag» относится к любому нативному Jagged из любого вида позвоночных, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), если не указано иное. Термин включает «полноразмерный», нерасщепленный Jagged, а также любую форму Jagged, полученную в результате расщепления в клетке. Термин также включает природные варианты Jagged, например, варианты сплайсинга или аллельные варианты. Аминокислотная последовательность типичного Jagged1 и Jagged2 человека и мыши приведена на ФИГ. 1 и 2 (SEQ ID NO: 1-4), соответственно.
В настоящей заявке термин «лечение» (и его грамматические варианты, такие как «лечить» или «лечащий») относится к клиническому вмешательству с целью изменения естественного течения заболевания у субъекта, которого лечат, и такое вмешательство может быть выполнено либо для профилактики, либо в ходе клинической лабораторной диагностики. Желательные эффекты лечения включают, но не ограничиваются ими, предотвращение возникновения или рецидивов заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение образования метастазов, уменьшение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, и ремиссию или улучшение прогноза. Согласно некоторым вариантам реализации настоящего изобретения антитела согласно настоящему изобретению применяют, чтобы задержать начало развития заболевания или замедлить прогрессирование заболевания.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельные области (HVR). (См., например, работу Kindt et al. Kuby Immunology, 6-е изд., W.H. Freeman and Co., стр. 91 (2007). Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могут быть выделены с использованием домена VH или VL из антитела, которое связывает антиген, для проведения скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, работы Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
В настоящей заявке термин «вектор» относится к молекуле нуклеиновой кислоты, способной обеспечивать размножение другой нуклеиновой кислоты, с которой она связана. Термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Определенные векторы способны регулировать экспрессию нуклеиновых кислот, с которыми они функционально связаны. В настоящей заявке такие векторы называются «векторы экспрессии».
II. КОМПОЗИЦИИ И СПОСОБЫ
Согласно одному из аспектов, настоящее изобретение частично основано на выявлении антител к Jagged и их фрагментов. Согласно некоторым вариантам реализации настоящего изобретения, предложены антитела, которые связываются по меньшей мере с одним из лигандов Jagged. Антитела согласно настоящему изобретению можно применять, например, для диагностики или лечения рака. Соответственно, в настоящем изобретении предложены способы, композиции, наборы и готовые изделия, относящиеся к антителам к Jagged.
А. Типичные антитела к Jagged
Согласно одному из аспектов настоящего изобретения предложены выделенные антитела, которые связываются с Jagged. Согласно некоторым вариантам реализации настоящего изобретения антитело к Jagged представляет собой антитело к Jagged1.
Согласно одному из аспектов настоящего изобретения предложено антитело к Jagged1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из:
(a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 84;
(c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 87;
(d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 114.
Согласно другому аспекту антитело к Jagged1 содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81 и по меньшей мере одну, две, три, четыре или пять HVR, выбранных из (b), (с), (d), (е) и (f), приведенных выше. Согласно одному из вариантов реализации настоящего изобретения антитело содержит (а), (b), (с), (d), (е) и (f), приведенные выше, в котором по отношению к (b) (с) и (f) предусмотрен любой один или более из следующих вариантов: HVR-H2, содержит аминокислотную последовательность, выбранную из SEQ ID NO: 82-83; HVR-H3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 85-86; и HVR-L3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 112-113.
Согласно другому варианту реализации настоящего изобретения, предложено антитело, которое специфически связывается с Jagged1, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112.
Согласно другому варианту реализации настоящего изобретения, предложено антитело, которое специфически связывается с Jagged1, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 86;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 113.
Согласно другому варианту реализации настоящего изобретения, предложено антитело, которое специфически связывается с Jagged1, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 83;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112.
Согласно некоторым вариантам реализации настоящего изобретения, антитело к Jagged представляет собой антитело к Jagged2.
Согласно одному из аспектов настоящего изобретения, предложено антитело к Jagged2, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из:
(a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 94;
(d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 122.
Согласно другому аспекту настоящего изобретения, предложено антитело к Jagged2, содержащее HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88, и по меньшей мере одну, две, три, четыре или пять HVR, выбранных из (b), (с), (d), (е) и (f), указанных выше. Согласно одному из вариантов реализации настоящего изобретения, антитело содержит (а), (b), (с), (d), (е) и (f), приведенные выше, в котором по отношению к (с) и (f) предусмотрен любой один или более из следующих вариантов реализации: HVR-Н3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 90-93; и HVR-L3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 117-121.
Согласно одному из вариантов реализации настоящего изобретения, предложено антитело, которое специфически связывается с Jagged2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 90;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 117.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 91;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 118.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 90;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 119.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 92;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 120.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 88;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 89;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 93;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 115;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 116; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 121.
Согласно некоторым вариантам реализации настоящего изобретения антитело к Jagged представляет собой антитело к Jagged1/2.
Согласно одному из аспектов настоящего изобретения предложено антитело к Jagged1/2, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 95; HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 96; HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 99; HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 123; HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 124; и HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 127.
Согласно одному из вариантов реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 95;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 96;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 97;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 123;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 124; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 125.
Согласно одному из вариантов реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 95;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 96;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 98;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 123;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 124; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 126.
Согласно другому аспекту настоящего изобретения предложено антитело к Jagged1/2, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 105; HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 106; HVR-Н3, содержащей аминокислотную последовательность SEQ ID NO: 109; HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 128; HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 129; и HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 134.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 100;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 130.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 100;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 108;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 131.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 101;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 102;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 133.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 103;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132.
Согласно другому варианту реализации настоящего изобретения предложено антитело, которое специфически связывается с Jagged1/2, содержащее:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 104;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 106;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 107;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 128;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 129; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 132.
Согласно любому из вышеупомянутых вариантов реализации антитело к Jagged представляет собой гуманизированное антитело. Согласно одному из вариантов реализации настоящего изобретения антитело к Jagged содержит HVR как в любом из вышеупомянутых вариантов реализации, и дополнительно содержит акцепторную последовательность каркаса человека, например, последовательность каркаса иммуноглобулина человека или консенсусную последовательность каркаса человека. Согласно другому варианту реализации антитело к Jagged содержит HVR как в любом из вышеупомянутых вариантов реализации, и дополнительно содержит VH, содержащую по меньшей мере один, два, три или четыре FR, выбранных из FR1, содержащего аминокислотную последовательность SEQ ID NO: 32, 36, 40, 43, 47, 50 или 54; FR2, содержащего аминокислотную последовательность SEQ ID NO: 33, 37, 41, 44, 48, 51 или 136; FR3, содержащего аминокислотную последовательность SEQ ID NO: 34, 38, 39, 42, 45, 46, 49, 52, 53, 55, 56, 57, 58, 59; и FR4, содержащего аминокислотную последовательность SEQ ID NO: 35. Согласно другому варианту реализации антитело к Jagged содержит HVR как в любом из вышеупомянутых вариантов реализации, и дополнительно содержит VL, содержащую по меньшей мере один, два, три или четыре FR, выбранных из FR1, содержащего аминокислотную последовательность SEQ ID NO: 60, 64, 67 или 70; FR2, содержащего аминокислотную последовательность SEQ ID NO: 61, 65, 68 или 71; FR3, содержащего аминокислотную последовательность SEQ ID NO: 62, 66, 69 или 72; и FR4, содержащего аминокислотную последовательность SEQ ID NO: 63 или 135.
Согласно другому аспекту настоящего изобретения антитело к Jagged содержит последовательность вариабельного домена тяжелой цепи (VH), которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 9-17, 29-30 или 73-76. Согласно некоторым вариантам реализации настоящего изобретения последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или удаления по отношению к эталонной последовательности, несмотря на это антитело к Jagged, содержащее такую последовательность, сохраняет способность связываться по меньшей мере с одним лигандом Jagged. Согласно некоторым вариантам реализации настоящего изобретения замены, вставки или удаления происходят в участках за пределами HVR (т.е. в FR). Согласно некоторым вариантам реализации настоящего изобретения антитело к Jagged содержит последовательность вариабельного домена тяжелой цепи (VH), которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 11. Антитело к Jagged возможно содержит последовательность VH, приведенную в SEQ ID NO: 11, включая посттрансляционные модификации этой последовательности. В конкретном варианте реализации настоящего изобретения VH содержит одну, две или три HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 81, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 83, и (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 85.
Согласно другому аспекту настоящего изобретения, предложено антитело к Jagged, содержащее вариабельный домен легкой цепи (VL), который по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичен аминокислотной последовательности SEQ ID NO: 18-28 или 77-80. Согласно некоторым вариантам реализации настоящего изобретения последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или удаления по отношению к эталонной последовательности, несмотря на это антитело к Jagged, содержащее такую последовательность, сохраняет способность связываться с Jagged. Согласно некоторым вариантам реализации настоящего изобретения в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO: 20. Согласно некоторым вариантам реализации настоящего изобретения замены, вставки или удаления происходят в областях за пределами HVR (т.е. в FR). Антитело к Jagged возможно содержит последовательность VL, приведенную в SEQ ID NO: 20, включая посттрансляционные модификации этой последовательности. В конкретном варианте реализации настоящего изобретения VL содержит одну, две или три HVR, выбранных из (a) HVR-L1, содержащей аминокислотную последовательность из SEQ ID NO: ПО; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 111; и (с) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 112.
Согласно другому аспекту настоящего изобретения предложено антитело к Jagged, содержащее VH, как в любом из вариантов реализации, приведенных выше, и VL, как в любом из вариантов реализации, приведенных выше. Согласно одному из вариантов реализации настоящего изобретения антитело содержит последовательности VH и VL, приведенные в SEQ ID NO: 10 и SEQ ID NO: 19, соответственно, включая посттрансляционные модификации этих последовательностей. Согласно одному из вариантов реализации настоящего изобретения антитело содержит последовательности VH и VL, приведенные в SEQ ID NO: 11 и SEQ ID NO: 20, соответственно, включая посттрансляционные модификации этих последовательностей. Согласно одному из вариантов реализации настоящего изобретения антитело содержит последовательности VH и VL, приведенные в SEQ ID NO: 15 и SEQ ID NO: 24, соответственно, включая посттрансляционные модификации этих последовательностей.
Согласно другому аспекту настоящего изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело к Jagged, предложенное в настоящей заявке. Например, согласно некоторым вариантам реализации настоящего изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело к Jagged1, содержащее последовательность VH, приведенную в SEQ ID NO: 10, и последовательность VL, приведенную в SEQ ID NO: 19. Согласно другим вариантам реализации настоящего изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело к Jagged1, содержащее последовательность VH, приведенную в SEQ ID NO: 11, и последовательность VL, приведенную в SEQ ID NO: 20. Согласно другим вариантам реализации настоящего изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело к Jagged2, содержащее последовательность VH, приведенную в SEQ ID NO: 15, и последовательность VL, приведенную в SEQ ID NO: 24.
Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, которое связывается с эпитопом в мышином пептиде Jag1-DSL-EGF1-4, имеющем последовательность SEQ ID NO: 5. Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, которое связывается с эпитопом в человеческом пептиде Jag1-DSL-EGF1-4, имеющем последовательность SEQ ID NO: 6. Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, которое связывается с эпитопом в мышином пептиде Jag2-DSL-EGF1-4, имеющем последовательность SEQ ID NO: 7. Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, которое связывается с эпитопом в человеческом пептиде Jag2-DSL-EGF1-4, имеющем последовательность SEQ ID NO: 8.
Согласно другому аспекту настоящего изобретения предложено антитело, которое конкурирует за связывание с любым из антител, предложенных в настоящей заявке.
Согласно другому аспекту настоящего изобретения антитело к Jagged в соответствии с любым из вышеупомянутых вариантов реализации представляет собой моноклональное антитело, включая химерное, гуманизированное или человеческое антитело. Согласно одному из вариантов реализации настоящего изобретения, антитело к Jagged представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диантитело или фрагмент F(ab')2. Согласно другому варианту реализации настоящего изобретения антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 человека или антитело другого класса или изотипа, определенных в настоящей заявке.
Согласно другому аспекту настоящего изобретения антитело к Jagged в соответствии с любым из вышеупомянутых вариантов реализации может включать любой из признаков, по отдельности или в комбинации, описанных в разделах 1-7 ниже.
1. Аффинность антител
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, имеет константу диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
Согласно одному из вариантов реализации настоящего изобретения KD измеряют с помощью исследования связывания с радиоактивно-меченым антигеном (РИА). Согласно одному из вариантов реализации РИА выполняют, используя фрагменты Fab антитела, представляющего интерес, и его антиген. Например, величину аффинности связывания фрагментов Fab в отношении антигена измеряют в растворе путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии серии титрующих концентраций немеченого антигена, с последующим захватом связанного антигена на планшете, покрытом антителом к фрагментам Fab (см., например, работу Chen et al., J. Mol. Biol. 293:865-881(1999)). Чтобы создать условия для проведения количественного исследования многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи захватывающим антителом к Fab (Cappel Labs) в концентрации 5 мкг/мл, растворенном в 50 мМ карбоната натрия (рН 9,6), и затем блокируют с помощью 2% (масс/об.) бычьего сывороточного альбумина в фосфатно-солевом буфере (ФСБ) в течение от 2 до 5 часов при комнатной температуре (приблизительно 23°С). В лунках неадсорбирующего планшета (Nunc #269620) смешивают по 100 пМ или 26 пМ [125I]-меченого антигена и серийные разведения фрагмента Fab, представляющего интерес (например, в соответствии с методикой оценки антитела к VEGF, Fab-12, описанной в работе Presta et al., Cancer Res. 57:4593-4599 (1997)). Фрагмент Fab, представляющий интерес, затем инкубируют в течение ночи, однако инкубацию можно продолжать в течение более длительного периода времени (например, около 65 часов), чтобы обеспечить достижение равновесного состояния. После этого смеси переносят в планшет с захватывающим антителом для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют, и планшет промывают восемь раз 0,1% полисорбатом 20 (Tween-20®) в ФСБ. После высыхания планшетов в лунки вносят по 150 мкл сцинтилляционного раствора (Microscint-20 ТМ; Packard), и сигнал в лунках планшетов регистрируют с помощью гамма-счетчика TopCount™ (Packard) в течение десяти минут. Концентрации каждого фрагмента Fab, которые обеспечивают связывание, величина которого меньше или равна 20% от величины максимального связывания, выбирают для использования в исследованиях конкурентного связывания.
Согласно другому варианту реализации величину Kd измеряют методом поверхностного плазмонного резонанса, используя систему BIAcore®. Например, исследования с использованием BiAcore®-2000 или BIAcore®-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси, США) проводят при 25°С с антигеном, иммобилизованным на чипах СМ5 в количестве ~10 единиц ответа (RU). Согласно одному из вариантов реализации, биосенсорные чипы из карбоксиметилированного декстрана (СМ5, BIAcore, Inc.) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, рН=4,8, до концентрации 5 мкг/мл (~0,2 мкМ) перед впрыскиванием при скорости потока 5 мкл/мин, чтобы достичь приблизительно 10 единиц ответа (RU) связанного белка. После впрыскивания антигена вносят 1 М этаноламина для блокирования групп, не вступивших в реакцию. Для измерений кинетики двукратные серийные разведения фрагментов Fab (от 0,78 нМ до 500 нМ) в ФСБ с добавлением 0,05% полисорбата 20 (Tween-20TM), поверхностно-активного вещества (ФСБТ), впрыскивают при скорости потока приблизительно 25 мкл/мин и температуре 25°С. Скорость прямой реакции (kon) и скорость обратной реакции (koff) рассчитывают с помощью простой модели Ленгмюра для связывания в соотношении один-к-одному (BIAcore® Evaluation Software, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, работу Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость прямой реакции превышает 106 М-1с-1, согласно результатам исследования методом поверхностного плазмонного резонанса, описанного выше, то скорость прямой реакции может быть определена с помощью методики тушения флуоресценции, которая позволяет измерить увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) 20 нМ раствора антитела к антигену (Fab-форма) в ФСБ, рН=7,2, при 25°С в присутствии возрастающих концентраций антигена, согласно результатам измерения с помощью спектрометра, такого как спектрометр, оборудованный системой для остановки потока (Aviv Instruments), или спектрофотометра SLM-Aminco™ 8000-й серии (ThermoSpectronic) в кювете с перемешиванием.
2. Фрагменты антител
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, представляет собой фрагмент антитела. Фрагменты антител включают, но не ограничиваются ими, фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, а также другие фрагменты, описанные ниже. Для обзора некоторых фрагментов антител см. работу Hudson et al. Nat. Med. 9:129-134 (2003). Для обзора фрагментов scFv, см., например, работу Pluckthiin, in The Pharmacology of Monoclonal Antibodies, vol. 113, под ред. Rosenburg and Moore, (Springer-Verlag, Нью-Йорк), стр. 269-315 (1994); см. также WO 93/16185; и патенты США №№5571894 и 5587458. Для обсуждения фрагментов Fab и F(ab')2, которые содержат остатки эпитопа связывания рецептора реутилизации и имеют повышенный период полувыведения в условиях in vivo, см. патент США №5869046.
Диантитела представляют собой фрагменты антител с двумя антигенсвязывающими участками, которые могут быть двухвалентными или биспецифичными. См., например, патенты ЕР 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триантитела и тетраантитела также описаны в работе Hudson et al., Nat. Med. 9:129-134 (2003).
Однодоменные антитела представляют собой фрагменты антител, содержащих весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. Согласно некоторым вариантам реализации настоящего изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, патент США №6248516 В1).
Фрагменты антител могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, протеолитическое расщепление интактных антител, а также выработку рекомбинантными клетками-хозяевами (например, E.coli, или фагами), как описано в настоящей заявке.
3. Химерные и гуманизированные антитела
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, является химерным антителом. Некоторые химерные антитела, описаны, например, в патенте США №4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). В одном примере химерное антитело содержит вариабельную область вида, отличного от человека (например, вариабельную область, полученную от мыши, крысы, хомяка, кролика или примата, отличного от человека, такого как обезьяна) и человеческую константную область. В другом примере химерное антитело представляет собой антитело с «переключенным классом», в котором класс или подкласс был изменен относительно такового для исходного антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
Согласно некоторым вариантам реализации настоящего изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, антитело вида, отличного от человека, гуманизируют, чтобы уменьшить иммуногенность для человека, сохраняя при этом специфичность и аффинность исходного антитела вида, отличного от человека. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR, (или их части) получены из антитела вида, отличного от человека, и FR (или их части) получены из последовательностей антител человека. Гуманизированное антитело также будет содержать по меньшей мере часть константной области человека. Согласно некоторым вариантам реализации настоящего изобретения некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками из антитела вида, отличного от человека (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения рассматриваются, например, в работе Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и более подробно описаны, например, в работах Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Natl Acad. Sci. USA 86:10029-10033 (1989); патентах США №№5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (описана прививка области, определяющей специфичность (SDR); Padlan, Mol. Immunol. 28:489-498 (1991) (описана «модификация поверхности»); Dall'Acqua et al., Methods 36:43-60 (2005) (описана «перестановка FR»); и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описан подход «направленного отбора» к перестановке FR).
Каркасные участки человека, которые можно применять для гуманизации, включают, но не ограничиваются перечисленными: каркасные участки, выбранные с помощью метода «наилучшего соответствия» (см., например, работу Sims et al. J. Immunol. 151:2296 (1993)); каркасные участки, полученные из консенсусной последовательности конкретной подгруппы вариабельных областей легкой или тяжелой цепей антител человека (см., например, работы Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al. J. Immunol, 151:2623 (1993)); зрелые (соматически мутировавшие) каркасные участки человека или каркасные участки зародышевой линии человека (см., например, работу Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные участки, полученные при скрининге библиотек FR (см., например, работы Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al.,7. Biol. Chem. 271:22611-22618 (1996)).
4. Человеческие антитела
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, является человеческим антителом. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области техники. Человеческие антитела описаны в общих чертах в работах van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для выработки интактных антител человека или интактных антител, содержащих вариабельные области человека, в ответ на антигенную стимуляцию. Такие животные обычно содержат все или часть локусов иммуноглобулинов человека, которые замещают локусы эндогенных иммуноглобулинов, или которые присутствуют вне хромосом или интегрированы в случайном порядке в хромосомы животного. У таких трансгенных мышей локусы эндогенных иммуноглобулинов обычно инактивированы. Для обзора способов получения антител человека из трансгенных животных, см. работу Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №№6075181 и 6150584, в которых раскрыта технология XENOMOUSE™; патент США №5770429, в котором раскрыта технология HUMAB®; патент США №7041870, в котором раскрыта технология K-М MOUSE®, и публикацию патентной заявки США US 2007/0061900, в которой раскрыта технология VELOCIMOUSE®). Вариабельные области человека из интактных антител, вырабатываемых такими животными, могут быть дополнительно модифицированы, например, путем комбинирования с другой константной областью человека.
Человеческие антитела также можно получить, используя методы гибридом. Были описаны линии клеток миеломы человека и гетеромиеломы мыши-человека для получения моноклональных антител человека. (См., например, работы Kozbor J. Immunol, 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., Нью-Йорк, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).) Человеческие антитела, полученные с помощью технологии гибридом В-клеток человека, также описаны в работе Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают те, которые раскрыты, например, в патенте США №7189826 (в котором раскрыто получение моноклональных антител IgM человека из гибридомных клеточных линий) и в работе Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (в которой описаны гибридомы человек-человек). Технология получения гибридом клеток человека (технология триомы) также описана в работах Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Человеческие антитела также могут быть получены путем выделения последовательностей вариабельных доменов клонов Fv, выбранных из библиотек фагового дисплея, которые получены из последовательностей человека. Такие последовательности вариабельных доменов затем можно комбинировать с желаемым константным доменом человека. Способы отбора человеческих антител из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
Антитела согласно настоящему изобретению могут быть выделены путем скрининга комбинаторных библиотек для выявления антител с желаемой активностью или активностями. Например, в данной области техники известны различные способы получения библиотек фагового дисплея и скрининга таких библиотек для отбора антител, обладающих желаемыми характеристиками связывания. Такие способы рассматриваются, например, в работах Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Тотова, Нью-Джерси, 2001) и дополнительно описаны, например, в работах McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Тотова, Нью-Джерси, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
В соответствии с некоторыми методами фагового дисплея репертуары генов VH и VL клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют в случайном порядке в фаговых библиотеках, которые затем могут быть подвергнуты скринингу для отбора антигенсвязывающего фага, как описано в работе Winter et al., Ann. Rev. Immunol, 12: 433-455 (1994). Фаг обычно экспрессирует фрагменты антител в виде либо одноцепочечных фрагментов Fv (scFv), либо фрагментов Fab. Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости получения гибридом. В другом варианте, наивный репертуар может быть клонирован (например, от человека), чтобы обеспечить единый источник антител, направленных к широкому спектру чужеродных, а также собственных антигенов без какой-либо иммунизации, как описано в работе Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также могут быть получены синтетическим путем с помощью клонирования неперестроенных сегментов V-гена из стволовых клеток, а также с использованием ПЦР-праймеров, содержащих случайную последовательность для кодирования областей, определяющих комплементарность, CDR3 и для выполнения перестановки в условиях in vitro, как описано в работе Hoogenboom and Winter, J. Mol. Biol, 227: 381-388 (1992). Патентные публикации, в которых раскрыты фаговые библиотеки человеческих антител, включают, например: патент США №5750373 и публикации патентных заявок США №№2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются в настоящей заявке как человеческие антитела или фрагменты человеческих антител.
6. Мультиспецифичные антитела
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, является мультиспецифичным антителом, например, биспецифичным антителом. Мультиспецифичные антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания в отношении по меньшей мере двух различных участков. Согласно некоторым вариантам реализации настоящего изобретения один из видов специфичности связывания относится к Jagged, а второй к любому другому антигену. Согласно некоторым вариантам реализации настоящего изобретения биспецифичные антитела могут связываться с двумя различными эпитопами Jagged. Биспецифичные антитела также можно применять для перемещения цитотоксических агентов к клеткам, которые экспрессируют Jagged. Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Методики получения мультиспецифичных антител включают, но не ограничиваются ими, рекомбинантную совместную экспрессию двух пар тяжелая цепь/легкая цепь иммуноглобулина, имеющих различные виды специфичности (см. Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10: 3655 (1991)), и способ генетической модификации «выступ-во-впадину» (см., например, патент США №5731168). Мультиспецифичные антитела также могут быть получены путем конструирования белков с использованием эффекта электростатического взаимодействия для получения молекул антител, содержащих гетеродимерные области Fc (WO 2009/089004 А1); путем сшивания двух или более антител или фрагментов (см., например, патент США №4676980 и Brennan et al., Science, 229: 81 (1985)); используя лейциновые молнии для получения биспецифичных антител (см., например, работу Kostelny et al., J. Immunol, 148(5):1547-1553 (1992)); используя технологию «диантител» для получения фрагментов биспецифичных антител (см., например, работу Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и используя димеры одноцепочечных Fv (sFv) (см., например, работу Gruber et al., J. Immunol, 152:5368 (1994)); а также путем получения триспецифичных антител, как описано, например, в работе Tutt et al. J. Immunol. 147: 60 (1991).
Модифицированные антитела, имеющие три и более функциональных антигенсвязывающих сайтов, в том числе «антитела-осьминоги», также включены в область настоящего изобретения (см., например, US 2006/0025576 А1).
Антитело или его фрагмент согласно настоящей заявке также содержит «фрагмент Fab двойного действия» или «DAF», содержащий антигенсвязывающий участок, который связывается с Jagged, а также другим, отличным антигеном (см. US 2008/0069820, например).
7. Варианты антител
Согласно некоторым вариантам реализации в настоящее изобретение включены варианты аминокислотных последовательностей антител, предложенных в настоящей заявке. Например, желательным может быть улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антител могут быть получены путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или с помощью пептидного синтеза. Такие модификации включают, например, удаления и/или вставки, и/или замены остатков в пределах аминокислотных последовательностей антител. Любая комбинация удалений, вставок и замен остатков может быть использована, чтобы получить готовую конструкцию, при условии, что готовая конструкция обладает желаемыми характеристиками, например, антигенсвязывающими свойствами.
а) Варианты, содержащие замены, вставки и удаления
Согласно некоторым вариантам реализации настоящего изобретения, предложены варианты антител, содержащие одну или более аминокислотных замен. Участки, представляющие интерес для заместительного мутагенеза, включают HVR и FR. Консервативные замены приведены в таблице 1 под заголовком «предпочтительные замены». Более значимые замены приведены в таблице 1 под заголовком «типичные замены», и дополнительно описаны ниже со ссылкой на классы боковых цепей аминокислот. Аминокислотные замены могут быть введены в антитело, представляющее интерес, и полученные продукты могут быть подвергнуты скринингу для отбора клонов, имеющих желаемую активность, например, сохраненную/улучшенную способность связывать антиген, сниженную иммуногенность или улучшенную ADCC или CDC.
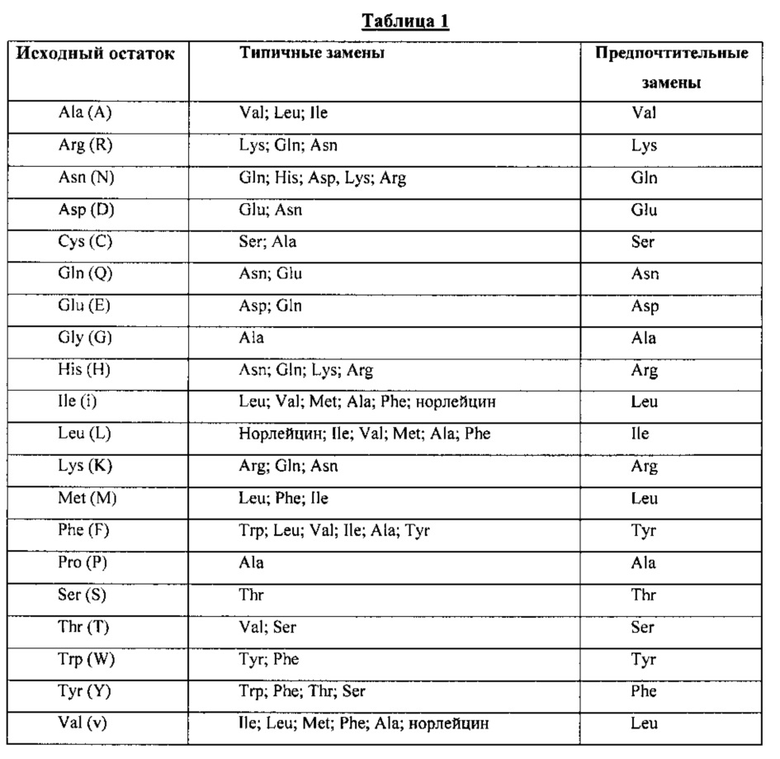
Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные аминокислотные замены приведут к замещению члена одного из этих классов членом другого класса.
Один из типов замещенных вариантов представляет собой замещение одного или более остатков гипервариабельной области исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный в результате вариант(ы), отобранный(е) для дальнейшего исследования, будет содержать модификации (например, улучшения) определенных биологических свойств (например, повышенную аффинность, сниженную иммуногенность) по сравнению с исходным антителом и/или будет иметь по существу сохраненные определенные биологические свойства исходного антитела. Типичный замещенный вариант представляет собой антитело с созревшей аффинностью, которое может быть легко получено, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как те, которые раскрыты в настоящей заявке. В общих чертах, один или более остатков HVR подвергают мутагенезу, и варианты антитела экспрессируют на поверхности фага и подвергают скринингу для отбора клонов с определенной биологической активностью (например, аффинностью связывания).
Изменения (например, замены) могут быть введены в области HVR, например, для улучшения аффинности антитела. Такие изменения могут быть введены в «горячие точки» HVR, т.е. остатки, кодируемые кодонами, которые с высокой частотой подвергаются мутациям в ходе процесса соматического созревания (см., например, работу Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или остатки, вступающие в контакт с антигеном, с последующим исследованием аффинности связывания полученных вариантов VH или VL. Метод получения антител с созревшей аффинностью путем конструирования и повторного отбора из вторичных библиотек был описан, например, в работе Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Тотова, Нью-Джерси, (2001). Согласно некоторым вариантам реализации способа созревания аффинности разнообразие вводят в вариабельные гены, отобранные для процесса созревания аффинности, с помощью любого из множества методов (например, ПЦР с внесением ошибок, перестановки цепей или олигонуклеотид-направленного мутагенеза). После этого получают вторичную библиотеку. Библиотеку затем подвергают скринингу, чтобы идентифицировать любые варианты антител с желаемой аффинностью. Другой метод введения разнообразия включает подходы, основанные на модификации HVR, в которых рандомизируют несколько остатков HVR (например, 4-6 остатков одновременно). Остатки HVR, участвующие в связывании антигена, могут быть точно идентифицированы, например, с помощью мутагенеза со сканированием аланином или моделирования. В частности, мишенями обычно являются области CDR-H3 и CDR-L3.
Согласно некоторым вариантам реализации настоящего изобретения замены, вставки или удаления могут происходить в одной или более областей HVR до тех пор, пока такие изменения существенно не уменьшат способность антитела связывать антиген. Например, консервативные изменения (например, консервативные замены, как это предусмотрено в настоящей заявке), которые не снижают существенно аффинность связывания, могут быть внесены в области HVR. Такие изменения могут, например, находиться вне остатков, вступающих в контакт с антигеном, в HVR. В некоторых вариантах последовательностей VH и VL, предложенных выше, каждая область HVR является либо немодифицированной, либо содержит не более одной, двух или трех аминокислотных замен.
Подходящий метод идентификации остатков или областей антитела, которые могут служить мишенями для мутагенеза, называется «мутагенез со сканированием аланином», как описано в работе Cunningham and Wells (1989) Science, 244:1081-1085. При применении этого метода идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы определить, оказывает ли это влияние на взаимодействие антитела с антигеном. Последующие замены могут быть введены в аминокислотных положениях, которые демонстрируют функциональную чувствительность к первоначальным заменам. Альтернативно или дополнительно для идентификации точек контакта между антителом и антигеном используют данные о кристаллической структуре комплекса антиген-антитело. Такие контактные остатки и соседние остатки можно использовать как мишени или удалять в качестве кандидатов на замещение. Варианты могут быть подвергнуты скринингу, чтобы определить, обладают ли они желаемыми свойствами.
Вставки аминокислотных последовательностей включают амино- и/или карбоксил-концевые гибриды, длина которых варьируется от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или более аминокислотных остатков внутри последовательности. Примеры концевых вставок включают антитело с N-концевым остатком метионина. Другие варианты молекулы антитела, содержащей вставки, включают гибридизацию N- или С-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает период полувыведения антитела из сыворотки.
b) Гликозилированные варианты
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, модифицируют, чтобы увеличить или уменьшить степень гликозилирования антитела. Добавление или удаление участков гликозилирования в молекуле антитела может быть удобно осуществлено путем изменения аминокислотной последовательности таким образом, что создается или удаляется один или более участков гликозилирования.
В том случае, если антитело содержит область Fc, могут быть модифицированы углеводные остатки, присоединенные к антителу. Нативные антитела, которые вырабатываются клетками млекопитающих, обычно содержат разветвленный, двухантеннарный олигосахарид, как правило, прикрепленный с помощью N-связи к Asn297 домена СН2 в области Fc. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может содержать различные углеводные остатки, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, прикрепленную к GlcNAc в «стволе» двухантеннарной структуры олигосахарида. Согласно некоторым вариантам реализации настоящего изобретения модификации олигосахарида в молекуле антитела согласно настоящему изобретению могут быть получены с тем, чтобы создать варианты антител с определенными улучшенными свойствами.
Согласно одному из вариантов реализации, предложены варианты антител, в структуре углеводного остатка которых отсутствует фукоза, присоединенная (непосредственно или косвенно) к области Fc. Например, количество фукозы в таком антителе может быть от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем вычисления среднего количества фукозы в сахарной цепи в положении Asn297 по отношению к суммарному количеству всех гликозильных структур, прикрепленных к остатку Asn297 (например, комплексные и гибридные цепи Сахаров и структуры с высоким содержанием маннозы), согласно результатам измерения методом масс-спектрометрии MALDI-TOF, как раскрыто в патенте WO 2008/077546, например. Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 области Fc (в соответствии с нумерацией ЕС остатков области Fc); однако Asn297 также может быть расположен приблизительно±3 аминокислоты перед или после положения 297, т.е. между положениями 294 и 300, что обусловлено незначительными вариациями последовательностей антител. Такие фукозилированные варианты могут иметь улучшенную функцию индукции ADCC. См., например, публикации патентных заявок США US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к «дефукозилированным» или «фукозо-дефицитным» вариантам антител, включают: патенты US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO 2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных вырабатывать дефукозилированные антитела, включают линию клеток яичника китайского хомяка (СНО) Lecl3, продуцирующих лишенные фукозилирования белки (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); см. публикацию патентной заявки США US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., в частности, в примере 11), и линии клеток с блокированными генами, например, клетки линии СНО, в которых блокирован ген альфа-1,6-фукозилтрансферазы, FUT8 (см., например, работы Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO 2003/085107).
В настоящем изобретении дополнительно предложены варианты антител, содержащих разделенные пополам олигосахариды, например, в которых двухантеннарный олигосахарид, присоединенный к области Fc антитела, разделен пополам остатком GlcNAc. Такие варианты антител могут иметь меньшее количество остатков фукозы и/или улучшенную функцию ADCC. Примеры таких вариантов антител раскрыты, например, в патенте WO 2003/011878 (Jean-Mairet et al.); в патенте США №6602684 (Umana et al.); и патенте США US 2005/0123546 (Umana et al.). В настоящем изобретении также предложены варианты антител, содержащих по меньшей мере один остаток галактозы в структуре олигосахарида, прикрепленного к области Fc. Такие варианты антител могут иметь улучшенную функцию индукции CDC. Такие варианты антител раскрыты, например, в патентах WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
с) Варианты области Fc
Согласно некоторым вариантам реализации настоящего изобретения одна или более модификаций аминокислотных остатков могут быть введены в область Fc антитела, предложенного в настоящей заявке, что обеспечивает вариант области Fc. Вариант области Fc может содержать последовательность области Fc человека (например, область Fc IgG1, IgG2, IgG3 или IgG4 человека), включающую модификацию аминокислотного остатка (например, замену) в одном или более аминокислотных положений.
Согласно некоторым вариантам реализации настоящего изобретения, предложен вариант антитела, обладающего некоторыми, но не всеми эффекторными функциями, которые делают его желательным кандидатом для способов применения, в которых период полувыведения антитела в условиях in vivo является важным, но некоторые эффекторные функции (такие как CDC и ADCC) являются ненужными или вредными. Чтобы подтвердить уменьшение/истощение активности индукции CDC и/или ADCC могут быть проведены количественные исследования цитотоксичности в условиях in vitro или in vivo. Например, могут быть проведены количественные исследования связывания с Fc-рецептором (FcR), чтобы убедиться, что антитело не способно связываться с FcγR (следовательно, возможно, не обладает ADCC-индуцирующей активностью), но сохраняет способность связываться с FcRn. Первичные клетки, которые индуцируют ADCC, природные клетки-киллеры (NK-клетки), экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Результаты исследования экспрессии FcR на поверхности кроветворных клеток представлены в таблице 3 на стр. 464 в работе Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры количественных исследований в условиях in vitro для оценки ADCC-индуцирующей активности молекулы, представляющей интерес, раскрыты в патенте США №5500362 (см., например, работы Hellstrom, I. et al. Proc. Natl Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I et al., Proc. Natl Acad. Sci. USA 82:1499-1502 (1985); патенте США 5821337 (см. Bruggemann, M. et al., J. Exp.Med. 166:1351-1361 (1987)). В другом варианте могут быть использованы нерадиоактивные методы количественных исследований (например, набор для нерадиоактивного исследования цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Маунтин-Вью, Калифорния, США); и набор для нерадиоактивного исследования цитотоксичности CytoTox96® (Promega, Мэдисон, Висконсин, США)). Подходящие эффекторные клетки для таких исследований включают мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK-клетки). Альтернативно или дополнительно, ADCC-индуцирующую активность молекулы, представляющей интерес, можно исследовать в условиях in vivo, например, на животных моделях, как раскрыто в работе Clynes et al. Proc. Natl Acad. Sci. USA 95:652-656 (1998). Исследования связывания компонента системы комплемента C1q также могут быть выполнены, чтобы подтвердить, что антитело не способно связывать C1q и, следовательно, у него отсутствует CDC-индуцирующая активность. См., например, способ исследования связывания C1q и С3с методом ИФА, раскрытый в патентах WO 2006/029879 и WO 2005/100402. Чтобы оценить эффективность активации комплемента может быть выполнено количественное исследование CDC (см., например, работы Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); и Cragg, M.S. and M.J. Glennie, Blood 103:2738-2743 (2004)). Исследование связывания с FcRn, а также определение величины клиренса/периода полувыведения в условиях in vivo также можно проводить с использованием способов, известных в данной области техники (см., например, работу Petkova, S.B. et al., Int'l. Immunol. 18(12): 1759-1769 (2006)).
Антитела со сниженной эффекторной функцией включают антитела, в которых замещен один или более остатков области Fc в положениях 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие мутантные варианты области Fc включают мутантные варианты области Fc с заменами двух или более остатков в аминокислотных положениях 265, 269, 270, 297 и 327, включая так называемый «DANA» мутант Fc, в котором остатки в положениях 265 и 297 замещены аланином (патент США №7332581).
Раскрыты некоторые варианты антител с улучшенной или уменьшенной способностью связываться с FcRs (см., например, патент США №6737056; WO 2004/056312, и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001)).
Согласно некоторым вариантам реализации настоящего изобретения вариант антитела содержит область Fc с одной или более аминокислотными заменами, которые улучшают ADCC-индуцирующую активность, например, с заменами в положениях 298, 333 и/или 334 области Fc (остатки пронумерованы в соответствии с системой ЕС).
Согласно некоторым вариантам реализации настоящего изобретения в область Fc вводят модификации, которые приводят к изменению (т.е. улучшению или ухудшению) ее способности связывать C1q и/или активировать комплемент-зависимую цитотоксичность (CDC), например, как раскрыто в патентах США №6194551, WO 99/51642, и работе Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным периодом полувыведения и улучшенной способностью связываться с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), раскрыты в патенте США US 2005/0014934А1 (Hinton et al.). Такие антитела содержат область Fc с одной или более аминокислотными заменами, которые улучшают связывание области Fc с FcRn. Такие варианты Fc включают области с заменами одного или более аминокислотных остатков области Fc в положениях: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка области Fc в положении 434 (патент США №7371826).
См. также работу Duncan & Winter, Nature 322:738-40 (1988); патент США №5648260; патент США №5624821; и WO 94/29351, в которых раскрыты другие примеры вариантов области Fc.
d) Варианты антител, модифицированных путем введения остатка цистеина
Согласно некоторым вариантам реализации настоящего изобретения желательным может быть создание антител, модифицированных путем введения остатка цистеина, например, «тиоМАт», в которых один или более аминокислотных остатков антитела замещены остатками цистеина. В конкретных вариантах реализации замещенные остатки находятся в доступных участках антитела. При замене этих остатков на цистеин реакционноспособные тиольные группы помещаются, таким образом, в доступные участки антитела и могут быть использованы для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, чтобы получить иммуноконъюгат, раскрытый далее в настоящей заявке. Согласно некоторым вариантам реализации настоящего изобретения один или более из следующих остатков могут быть замещены цистеином: V205 (нумерация по Кабат) легкой цепи; А118 (нумерация ЕС) тяжелой цепи; и S400 (нумерация ЕС) области Fc тяжелой цепи. Антитела, модифицированные путем введения остатка цистеина, могут быть получены, как раскрыто, например, в патенте США №7521541.
е) Производные антител
Согласно некоторым вариантам реализации настоящего изобретения антитело, предложенное в настоящей заявке, может быть дополнительно модифицировано для включения дополнительных небелковых фрагментов, которые известны в данной области техники и общедоступны. Фрагменты, пригодные для получения производных антител, включают, но не ограничиваются ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, но не ограничиваются ими, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимеры этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические сополимеры), а также декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры пролипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоль-пропионовый альдегид может обеспечивать преимущества в процессе производстве благодаря своей стабильности в воде. Полимер может иметь любую молекулярную массу, и может быть разветвленным или неразветвленным. Количество полимерных единиц, прикрепленных к антителу, может варьироваться, и, если прикреплено более одного полимера, то они могут быть одинаковыми или различными молекулами. В целом, количество и/или тип полимеров, применяемых для получения производных антител, можно определить на основании факторов, которые включают, но не ограничиваются перечисленными: конкретные свойства или функции антитела, которые будут улучшены, возможность применения производного антитела в терапии при определенных условиях и т.д.
Согласно другому варианту реализации настоящего изобретения, предложены конъюгаты антитела и небелкового фрагмента, которые могут быть селективно нагреты под действием излучения. Согласно одному из вариантов реализации настоящего изобретения, небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Излучение может иметь любую длину волны и включает, но не ограничивается ими, длины волн, которые не повреждают обычные клетки, но которые нагревают небелковые фрагменты до температуры, при которой происходит гибель клеток, расположенных проксимально относительно конъюгата антитело-небелковый фрагмент.
В. Рекомбинантные способы и композиции
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, раскрытых в патенте США №4816567. Согласно одному из вариантов реализации настоящего изобретения, предложена выделенная нуклеиновая кислота, кодирующая антитело к Jagged, раскрытое в настоящей заявке. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом варианте реализации предложен один или более векторов (например, векторы экспрессии), содержащих такие нуклеиновые кислоты. В другом варианте реализации предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. Согласно другому варианту реализации настоящего изобретения, клетка-хозяин содержит (например, была трансформирована указанным далее вектором): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность VH антитела. Согласно одному из вариантов реализации настоящего изобретения, клетка-хозяин является эукариотической, например, представляет собой клетку яичника китайского хомяка (СНО) или лимфоидную клетку (например, клетку линии Y0, NS0, Sp20). Согласно одному из вариантов реализации настоящего изобретения, предложен способ получения антитела к Jagged, причем указанный способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, предложенное выше, в условиях, подходящих для экспрессии антитела, и возможно выделение антитела из клетки-хозяина (или из среды культивирования клетки-хозяина).
Для получения антитела к Jagged с помощью рекомбинантных способов нуклеиновую кислоту, кодирующую антитело, например, раскрытое выше, выделяют и встраивают в один или более векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием стандартных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Клетки-хозяева, пригодные для клонирования или экспрессии векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, раскрытые в настоящей заявке. Например, антитела могут вырабатываться в бактериальных клетках, в частности, в том случае, если гликозилирование и эффекторные функции области Fc не требуются. Информацию в отношении экспрессии фрагментов антител и полипептидов в бактериальных клетках см., например, в патентах США №№5648237, 5789199 и 5840523 (см. также работу Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Тотова, Нью-Джерси, 2003), стр. 245-254, в которой описана экспрессия фрагментов антител в E.coli). После экспрессирования антитело может быть выделено из бактериальной клеточной массы в виде растворимой фракции и может быть дополнительно очищено.
Помимо прокариотических микроорганизмов, эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются пригодными хозяевами для клонирования или экспрессии векторов, кодирующих антитела, включая грибы и штаммы дрожжей, у которых была осуществлена гуманизация путей гликозилирования, что обеспечило получение антител, характер гликозилирования которых частично или полностью соответствует таковому у человека. См. работы Gerngross, Nat. Biotech. 22:1409-1414 (2004), и Li et al., Nat. Biotech. 24:210-215 (2006).
Клетки-хозяева, пригодные для экспрессии гликозилированного антитела, также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные штаммы бакуловирусов, которые можно применять в комбинации с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры клеток растений также можно применять в качестве хозяев. См., например, патенты США №№5959177, 6040498, 6420548, 7125978 и 6417429 (в которых раскрыта технология PLANTIBODIES™ для получения антител в трансгенных растениях).
Клетки позвоночных также можно применять в качестве хозяев. Например, пригодными клетками-хозяевами могут быть линии клеток млекопитающих, приспособленные к размножению в суспензии. Другие примеры пригодных клеток-хозяев млекопитающих включают линию клеток почки обезьяны CV1, трансформированных вирусом SV40 (COS-7); линию клеток мезонефроса человека (293 или клетки 293, как описано, например, в работе Graham et al., J. Gen Virol. 36:59 (1977)); линию клеток почки новорожденного хомяка (ВНК); клетки Сертоли мыши (клетки линии ТМ4, как описано, например, в работе Mather, Biol. Reprod. 23:243-251 (1980); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK; клетки печени серой крысы (BRL 3А); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки линии TRI, как описано, например, в работе Mather et al., Annals NY. Acad. Sci. 383:44-68 (1982); клетки линии MRC 5; и клетки линии FS4. Другие пригодные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включая линию клеток DHFR- СНО (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Для обзора некоторых линий клеток-хозяев млекопитающих, пригодных для получения антител, см., например, работу Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Тотова, Нью-Джерси), стр. 255-268 (2003).
С. Количественные исследования
Антитела к Jagged, предложенные в настоящей заявке, могут быть идентифицированы, подвергнуты скринингу или исследованы для определения их физических/химических свойств и/или биологической активности с помощью различных способов количественных исследований, известных в данной области техники.
1. Исследования связывания и другие количественные исследования
В одном аспекте антитело согласно настоящему изобретению исследуют для определения активности связывания с антигеном, например, с помощью известных методов, таких как твердофазный иммуноферментный анализ (ИФА), Вестерн-блот и т.д.
Согласно другому аспекту исследования конкурентного связывания можно применять для идентификации антитела, которое конкурирует за связывание с Jagged1 человека или мыши с антителом А, А-1, А-2, С, С-1, D, D-1, D-2, D-3, D-4 и D-5. Согласно другому аспекту исследования конкурентного связывания можно применять для идентификации антитела, которое конкурирует за связывание с Jagged2 человека или мыши с антителом В, В-1, В-2, В-3, С, С-1, D, D-1, D-2, D-3, D-4 и D-5. Согласно некоторым вариантам реализации настоящего изобретения, такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается антитело А, А-1, А-2, В, В-1, В-2, В-3, С, С-1, D, D-1, D-2, D-3, D-4 или D-5.
Подробное описание типичных способов картирования эпитопа, с которым связывается антитело, приведено в работе Morris (1996) «Epitope Mapping Protocols,)) in Methods in Molecular Biology vol. 66 (Humana Press, Тотова, Нью-Джерси).
В соответствии с типичным способом исследования конкурентного связывания иммобилизованный Jagged1 или Jagged2 инкубируют в растворе, содержащем первое меченое антитело, которое связывается с Jagged1 или Jagged2 (например, А, А-1, А-2, В, В-1, В-2, В-3, С, С-1, D, D-1, D-2, D-3, D-4 или D-5), и второе немеченое антитело, способность которого конкурировать с первым антителом за связывание с Jagged1 или Jagged2 исследуют. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный Jagged1 или Jagged2 инкубируют в растворе, содержащем первое меченое антитело, но без второго немеченого антитела. После инкубации в условиях, обеспечивающих связывание первого антитела с Jagged1 или Jagged2, избыток несвязанного антитела удаляют, и измеряют количество метки, связанной с иммобилизованным Jagged1 или Jagged2. Если в исследуемом образце количество метки, связанной с иммобилизованным Jagged1 или Jagged2, существенно снижено по сравнению с контрольным образцом, это указывает на то, что второе антитело конкурирует с первым антителом за связывание с Jagged1 или Jagged2. См. работу Harlow and Lane (1988) Antibodies: A Laboratory Manual ch. 14 (Cold Spring Harbor Laboratory, Колд Спринг Харбор, Нью-Йорк).
2. Количественные исследования активности
Согласно одному из аспектов настоящего изобретения, предложены методы количественных исследований для выявления антител к Jagged, обладающих биологической активностью. Биологическая активность может включать, например, ингибирование Jagged1- или Jagged2-индуцированной передачи сигналов в клетках посредством рецептора Notch, например, ингибирование Jagged1-индуцированной передачи сигналов посредством Notch1. Типичный метод количественного исследования приведен в примерах. В некоторых других вариантах реализации исследовали способность антитела согласно настоящему изобретению ингибировать экспрессию гена-репортера, который чувствителен к Jagged1-индуцированной передаче сигналов посредством рецептора Notch. Типичный метод количественного исследования приведен в примерах. В некоторых вариантах реализации исследуют наличие у антитела согласно настоящему изобретению такого вида биологической активности. В настоящем изобретении также предложены антитела, обладающие таким видом биологической активности в условиях in vivo и/или in vitro.
D. Иммуноконъюгаты
В настоящем изобретении также предложены иммуноконъюгаты, содержащие антитело к Jagged согласно настоящему описанию, которое конъюгировано с одним или более цитотоксических агентов, таких как химиотерапевтические агенты или лекарственные средства, ингибирующие рост агенты, токсины (например, белковые токсины, обладающие ферментативной активностью токсины бактериального, грибкового, растительного или животного происхождения или их фрагменты) или радиоактивные изотопы.
Согласно одному из вариантов реализации настоящего изобретения, иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более лекарственных средств, включая, но не ограничиваясь ими, майтансиноид (см. патенты США 5208020, 5416064 и Европейский патент ЕР 042 235 В1); ауристатин, такой как фрагменты монометилауристатина DE и DF (ММАЕ и MMAF) (см. патенты США 5635483 и 5780588, и 7498298); доластатин; калихеамицин или его производное (см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; Hinman et al., Cancer Res. 53:3336-3342 (1993); и Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклин, такой как дауномицин или доксорубицин (см. Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США №6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел, ортатаксел; трихотецин; и СС1065.
Согласно другому варианту реализации иммуноконъюгат содержит антитело, описанное в настоящей заявке, конъюгированное с обладающим ферментативной активностью токсином или его фрагментом, включая, но не ограничиваясь ими, цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модекцина, альфа-сарцин, белки из Aleurites fordii, диантиновые белки, белки из Phytolaca Americana (PAPI, РАРП и PAP-S), ингибитор из Момордики харантской, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
Согласно другому варианту реализации настоящего изобретения, иммуноконъюгат содержит антитело, описанное в настоящей заявке, конъюгированное с радиоактивным атомом с образованием радиоконъюгата. Различные радиоактивные изотопы доступны для получения радиоконъюгатов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. В случае использования радиоконъюгата для детектирования, он может содержать радиоактивный атом для сцинтиграфических исследований, например Tc99m или I123, или спиновую метку для визуализации методом ядерного магнитного резонанса (ЯМР) (также известным как магнитно-резонансная томография, МРТ), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием ряда бифункциональных агентов, связывающих белки, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо производные (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазобензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и активные бис-соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в работе Vitetta et al., Science 238:1098 (1987). Меченая изотопом углерода-14 1-изотиоцианатбензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с антителом. См. WO 94/11026. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, может быть использован кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Res. 52:127-131 (1992); патент США №5208020).
В настоящей заявке иммуноконъюгаты и ADC явным образом включают, но не ограничиваются ими, конъюгаты, полученные с использованием сшивающих реагентов, включая, но не ограничиваясь ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые коммерчески доступны (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США).
E. Способы и композиции для диагностики и детектирования
Согласно некоторым вариантам реализации настоящего изобретения, любое из антител к Jagged1, предложенных в настоящей заявке, пригодно для детектирования наличия Jagged1 в биологическом образце. В некоторых вариантах реализации любое из антител к Jagged2, предложенных в настоящей заявке, пригодно для детектирования наличия Jagged2 в биологическом образце. В настоящей заявке термин «детектирование» включает количественное или качественное детектирование. В некоторых вариантах реализации термин «биологический образец» включает, например, клетку или ткани, такие как раковые ткани.
Согласно одному из вариантов реализации настоящего изобретения, предложено антитело к Jagged для применения в соответствии со способами диагностики или детектирования. Согласно другому аспекту, предложен способ детектирования наличия Jagged1 в биологическом образце. Согласно другому аспекту предложен способ детектирования наличия Jagged2 в биологическом образце. Согласно некоторым вариантам реализации настоящего изобретения, способ включает приведение биологического образца в контакт с антителом к Jagged1 или антителом к Jagged2, раскрытым в настоящей заявке, в условиях, которые обеспечивают связывание антитела к Jagged1 с Jagged1 или антитела к Jagged2 с Jagged2, соответственно, с последующим детектированием образования комплекса между антителом к Jagged1 и Jagged1, или между антителом к Jagged2 и Jagged2. Такой способ может быть осуществлен в условиях in vitro или in vivo. Согласно одному из вариантов реализации настоящего изобретения, антитело к Jagged1 применяют для отбора субъектов, удовлетворяющих критериям для получения терапии антителом к Jagged1, например, если Jagged1 является биомаркером для отбора пациентов. Согласно одному из вариантов реализации настоящего изобретения, антитело к Jagged2 применяют для отбора субъектов, удовлетворяющих критериям для получения терапии антителом к Jagged2, например, если Jagged2 является биомаркером для отбора пациентов.
Примеры заболеваний, которые могут быть диагностированы с использованием антитела согласно настоящему изобретению, включают рак, например, рак молочной железы, рак легких, рак мозга, рак шейки матки, рак толстой кишки, рак печени, рак желчных протоков, рак поджелудочной железы, рак кожи, В-клеточные злокачественные новообразования и Т-клеточные злокачественные новообразования.
Согласно некоторым вариантам реализации настоящего изобретения, предложены меченые антитела к Jagged. Метки включают, но не ограничиваются ими, метки или фрагменты, которые детектируют непосредственно (например, флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые детектируют косвенно, например, с помощью ферментативной реакции или молекулярного взаимодействия. Типичные метки включают, но не ограничиваются ими, радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаторы редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светлячка и бактериальную люциферазу (патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (ПХ), щелочную фосфатазу, β-галактозидазу, глюкоамилазы, лизоцим, оксидазы сахаридов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, в комбинации с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как ПХ, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки бактериофагов, стабильные свободные радикалы и т.п.
F. Фармацевтические составы
Фармацевтические составы, содержащие антитело к Jagged, раскрытое в настоящей заявке, получают в виде лиофилизированных составов или водных растворов путем смешивания такого антитела, имеющего желаемую степень чистоты, с одним или более возможными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol, А. (1980)). Фармацевтически приемлемые носители в целом являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваются ими: буферы, например, на основе фосфатов, цитратов и других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соль противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Примеры фармацевтически приемлемых носителей согласно настоящему изобретению дополнительно включают интерстициальные агенты для облегчения дисперсии лекарственного средства, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например, растворимые гликопротеины гиалуронидазы РН-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGPs и способы их применения, включая rHuPH20, раскрыты в публикациях патентных заявок США 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP комбинируют с одним или более дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры составов, содержащих лиофилизированное антитело, раскрыты в патенте США №6267958. Водные составы антитела включают те, которые раскрыты в патенте США №6171586 и WO 2006/044908, последние составы включают гистидин-ацетатный буфер.
Состав согласно настоящему изобретению также может содержать более одного действующего вещества, если это требуется для лечения конкретного состояния, предпочтительно те, виды дополнительной активности которых не оказывают взаимного отрицательного влияния. Например, может быть желательным обеспечить дополнительный цитотоксический агент, например, химиотерапевтический агент. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, которые эффективны для реализации предполагаемой цели применения.
Действующие вещества могут быть заключены в микрокапсулы, полученные, например, с помощью методики коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и полиметилметакрилата, соответственно, в коллоидные системы для доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol, А. (1980).
Могут быть получены препараты с пролонгированным высвобождением. Подходящие примеры препаратов с пролонгированным высвобождением включают полупроницаемые носители из твердых гидрофобных полимеров, содержащие антитело, в которых носители находятся в виде формованных изделий, например, пленок или микрокапсул.
Составы, которые будут применять для введения в условиях in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны.
G. Терапевтические способы и композиции
Любое из антител к Jagged, предложенных в настоящей заявке, можно применять в терапевтических способах.
Согласно одному из аспектов настоящего изобретения, предложено антитело к Jagged для применения в качестве лекарственного средства. В других аспектах предложено антитело к Jagged1 для применения в лечении заболевания или расстройства, связанного с нарушением передачи сигналов посредством рецептора Notch, например, рака. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged1 для применения в соответствии со способом лечения. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged1 для применения в соответствии со способом лечения субъекта, страдающего раком, включающим введение субъекту эффективного количества антитела к Jagged1. В одном указанном варианте реализации способ дополнительно включает введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, описанного ниже. Согласно другим аспектам настоящего изобретения, предложено антитело к Jagged2 для применения в лечении рака. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged2 для применения в соответствии со способом лечения. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged2 для применения в соответствии со способом лечения субъекта, страдающего раком, который включает введение субъекту эффективного количества антитела к Jagged2. Согласно одному указанному варианту реализации способ дополнительно включает введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, описанного ниже.
Согласно другим вариантам реализации настоящего изобретения, предложено антитело к Jagged для применения в ингибировании роста клеток рака легких. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged1 для применения в соответствии со способом уменьшения роста рака легких у субъекта, который включает введение субъекту эффективного количества антитела к Jagged1 для уменьшения роста рака легких. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged2 для применения в соответствии со способом уменьшения роста рака легких у субъекта, который включает введение субъекту эффективного количества антитела к Jagged2 для уменьшения роста рака легких. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged1 для применения в соответствии со способом уменьшения роста рака молочной железы у субъекта, который включает введение субъекту эффективного количества антитела к Jagged1 для уменьшения роста рака молочной железы. Согласно некоторым вариантам реализации настоящего изобретения, предложено антитело к Jagged2 для применения в соответствии со способом уменьшения роста рака молочной железы у субъекта, который включает введение субъекту эффективного количества антитела к Jagged2 для уменьшения роста рака молочной железы. «Индивидуум» согласно любому из указанных выше вариантов реализации предпочтительно представляет собой человека.
Согласно другому аспекту настоящего изобретения, предложено применение антитела к Jagged для изготовления или получения лекарственного средства. Согласно одному из вариантов реализации настоящего изобретения, лекарственное средство предназначено для лечения заболевания или расстройства, связанного с нарушением передачи сигналов посредством рецептора Notch. Согласно одному из вариантов реализации настоящего изобретения, лекарственное средство предназначено для лечения рака. В другом варианте реализации настоящего изобретения лекарственное средство предназначено для применения в соответствии со способом лечения рака, включающим введение субъекту, страдающему раком, эффективного количества лекарственного средства. В одном указанном варианте реализации способ дополнительно включает введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, описанного ниже. «Индивидуум» согласно любому из вышеупомянутых вариантов реализации может быть человеком.
Согласно другому аспекту настоящего изобретения, предложен способ лечения заболевания или расстройства, связанного с нарушением передачи сигналов посредством рецептора Notch. Согласно одному из вариантов реализации настоящего изобретения, способ включает введение субъекту, страдающему таким заболеванием или расстройством, эффективного количества антитела к Jagged. Согласно одному из вариантов реализации настоящего изобретения, способ включает введение субъекту, страдающему раком, эффективного количества антитела к Jagged1. Согласно одному указанному варианту реализации способ дополнительно включает введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического агента, описанного ниже. Согласно одному из вариантов реализации настоящего изобретения, способ включает введение субъекту, страдающему раком, эффективного количества антитела к Jagged2. Согласно одному указанному варианту реализации способ дополнительно включает введение субъекту эффективного количества по меньшей мере одного дополнительного терапевтического агента, описанного ниже. «Индивидуум» согласно любому из вышеупомянутых вариантов реализации может быть человеком.
Согласно другому аспекту настоящего изобретения, предложен способ ингибирования роста раковых клеток у субъекта. Согласно одному из вариантов реализации настоящего изобретения, способ включает введение субъекту эффективного количества антитела к Jagged1 или антитела к Jagged2 для ингибирования роста раковых клеток. Согласно одному из вариантов реализации настоящего изобретения, «индивидуум» представляет собой человека.
Согласно другому аспекту настоящего изобретения, предложены фармацевтические составы, содержащие любое из антител к Jagged, предложенных в настоящей заявке, например, для применения в любом из предложенных выше терапевтических способов. Согласно одному из вариантов реализации настоящего изобретения, фармацевтический состав содержит любое из антител к Jagged, предложенных в настоящей заявке, и фармацевтически приемлемый носитель. Согласно другому варианту реализации настоящего изобретения фармацевтический состав содержит любое из антител к Jagged, предложенных в настоящей заявке, и по меньшей мере один дополнительный терапевтический агент, например, описанный ниже.
Антитела согласно настоящему изобретению можно применять в терапии по отдельности или в комбинации с другими агентами. Например, антитело согласно настоящему изобретению можно вводить совместно по меньшей мере с одним дополнительным терапевтическим агентом. Согласно некоторым вариантам реализации настоящего изобретения дополнительный терапевтический агент представляет собой цитотоксический агент. Согласно некоторым вариантам реализации настоящего изобретения дополнительный терапевтический агент представляет собой антитело.
Комбинированные схемы терапии, упомянутые выше, включают комбинированное введение (при котором два или более терапевтических агентов включены в один и тот же или в разные составы), и раздельное введение, в случае которого введение антитела согласно настоящему изобретению может иметь место до, одновременно, и/или после введения дополнительного терапевтического агента или агентов. Согласно одному из вариантов реализации настоящего изобретения введение антитела к Jagged и введение дополнительного терапевтического агента осуществляют с интервалом равным приблизительно один месяц, или одну, две или три недели, или приблизительно один, два, три, четыре, пять или шесть дней. Антитела согласно настоящему изобретению также можно применять в комбинации с лучевой терапией.
Антитело согласно настоящему изобретению (и любой дополнительный терапевтический агент) можно вводить с помощью любых подходящих способов, включая парентеральное, внутрилегочное и интраназальное, и, если желательно для местного лечения, внутриочаговое введение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым подходящим способом, например, путем инъекций, например, внутривенных или подкожных инъекций, отчасти в зависимости от того, является введение кратковременным или длительным. Различные схемы дозирования, включая, но не ограничиваясь ими, однократное или многократное введение в течение различных периодов времени, болюсное введение и импульсную инфузию, включены в область настоящего изобретения.
Антитела согласно настоящему изобретению могут быть приготовлены, дозированы и введены способом, который соответствует требованиям надлежащей медицинской практики. Факторы, которые следует учитывать применительно к этим этапам, включают конкретное заболевание, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние конкретного пациента, причину заболевания, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Состав, содержащий антитело, возможно может быть приготовлен с добавлением одного или более агентов, используемых в настоящее время для предотвращения или лечения рассматриваемого заболевания, либо может быть приготовлен без них. Эффективное количество других агентов зависит от количества антитела, присутствующего в составе, типа заболевания или лечения и других факторов, описанных выше. В целом, такие агенты используют в тех же дозах и вводят с помощью способов, раскрытых в настоящей заявке, или в дозах, составляющих приблизительно от 1 до 99% от величин доз, раскрытых в настоящей заявке, или в любой дозировке и любым способом, который является подходящим, согласно определению эмпирическим путем или в клинической практике.
Соответствующая доза антитела согласно настоящему изобретению для профилактики или лечения заболевания (при использовании по отдельности или в комбинации с одним или более другими дополнительными терапевтическими агентами) будет зависеть от типа заболевания, подлежащего лечению, типа антитела, степени тяжести и течения заболевания, от того, вводят антитело для профилактических или терапевтических целей, предшествующей терапии, истории болезни пациента и его терапевтического ответа на антитело, а также решения лечащего врача. Антитело подходящим образом вводят пациенту однократно или в течение серии введений. В зависимости от типа и степени тяжести заболевания от приблизительно 1 мкг/кг до 15 мг/кг (например, от 0,1 мг/кг до 10 мг/кг) антитела может быть использовано в качестве начальной дозы для введения пациенту, независимо от способа введения, например, в виде отдельных однократных или многократных введений или путем непрерывной инфузии. Одна из типичных суточных дозировок может варьироваться от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. В случае многократных введений в течение нескольких дней или более, в зависимости от состояния, лечение обычно может быть длительным, до достижения желаемой степени подавления симптомов заболевания. Одна из типичных дозировок антитела может варьироваться от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг. Таким образом, пациенту может быть введена одна или более доз равных приблизительно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы могут быть введены с перерывами, например, каждую неделю или каждые три недели (например, так, что пациент получает от приблизительно двух до приблизительно двадцати, или, например, приблизительно шесть доз антитела). Может быть введена более высокая начальная нагрузочная доза с последующим введением одной или нескольких более низких доз. Типичная схема дозирования включает введение начальной нагрузочной дозы 4 мг/кг с последующим еженедельным введением поддерживающей дозы 2 мг/кг антитела. Однако другие схемы дозирования также могут быть пригодными. Прогресс этой терапии легко контролировать с помощью стандартных методик и количественных исследований.
Следует понимать, что любой из предложенных выше составов или терапевтических способов может быть осуществлен с применением иммуноконъюгата согласно настоящему изобретению вместо или в комбинации с антителом к Jagged.
3. Готовые изделия
Согласно другому аспекту настоящего изобретения настоящего изобретения, предложено готовое изделие, содержащее материалы, пригодные для лечения, профилактики и/или диагностики заболеваний, описанных выше. Готовое изделие содержит контейнер и этикетку или вкладыш в упаковку, расположенный на контейнере или относящийся к нему. Пригодные контейнеры включают, например, бутылки, флаконы, шприцы и пакеты для внутривенного введения и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, профилактики и/или диагностики состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере одно действующее вещество в композиции представляет собой антитело согласно настоящему изобретению. На этикетке или вкладыше в упаковку указано, что композицию следует применять для лечения выбранного состояния. Готовое изделие также может включать (а) первый контейнер с содержащейся в нем композицией, в котором композиция содержит антитело согласно настоящему изобретению; и (b) второй контейнер с содержащейся в нем композицией, в котором композиция содержит дополнительный цитотоксический агент или другой терапевтический агент. Готовое изделие в данном варианте реализации настоящего изобретения может дополнительно содержать вкладыш в упаковку, в котором указано, что композиции можно применять для лечения конкретного состояния. Альтернативно или дополнительно, готовое изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Готовое изделие может дополнительно содержать другие материалы, которые являются желательными с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Следует понимать, что любое из указанных выше готовых изделий может включать иммуноконъюгат согласно настоящему изобретению вместо или в комбинации с антителом к Jagged.
III. ПРИМЕРЫ
Ниже приведены примеры способов и композиций согласно настоящему изобретению. Следует понимать, что на практике могут быть применены различные другие варианты реализации с учетом общего описания, приведенного выше.
Пример 1. Получение антител к Jagged.
а) Сортировка и скрининг библиотеки для выявления антител к Jagged1/2 Фаговые библиотеки антител человека, содержащие синтетическое разнообразие в выбранных областях, определяющих комплементарность, имитирующие природное разнообразие репертуара IgG человека, использовали для пэннинга фрагментов Fab, экспрессированных на поверхности частиц бактериофага М13. В качестве антигена для сортировки библиотеки использовали Jag1-DSL-EGF1-4 (SEQ ID NO: 6) человека или Jag2-DSL-EGF1-4 (SEQ ID NO: 8) человека. 96-Луночные планшеты для иммунологических исследований MaxiSorp (Nunc) покрывали в течение ночи при 4°С антигеном-мишенью (10 мкг/мл) и блокировали в течение 1 ч при комнатной температуре с использованием блокирующего буфера для фага ФСБТ (забуференный фосфатом физиологический раствор (ФСБ) с добавлением 1% (масс/об.) бычьего сывороточного альбумина (БСА) и 0,05% (об./об.) Tween-20). VH (см., например, Lee et al., J. Immunol. Meth. 284:119-132 (2004)) и VH/VL (см. Liang et al., JMB. 366: 815-829 (2007)) из фаговых библиотек антител добавляли по отдельности к планшетам, покрытым антигеном-мишенью, и инкубировали в течение ночи при комнатной температуре. На следующий день планшеты, покрытые антигеном-мишенью, промывали десять раз буфером ФСБТ (ФСБ с добавлением 0,05% Tween-20), и связанный фаг элюировали 50 мМ HCl и 500 мМ NaCl в течение 30 мин и нейтрализовали равным объемом 1М Трис-основания (рН=7,5). Выделенные фаговые частицы размножали в штамме Е. coli XL-1 Blue. В течение последующих раундов отбора инкубацию фаговых частиц, экспрессирующих антитело, с планшетами, покрытыми антигеном, уменьшали до 2-3 ч, и постепенно увеличивали жесткость условий промывки планшетов.
После 4 раундов пэннинга наблюдали значительное обогащение. По 96 клонов было получено в ходе сортировки библиотеки VH и VH/VL, чтобы определить их способность специфически связываться с человеческим Jagged1 или Jagged2. Вариабельные области таких клонов секвенировали с помощью ПЦР, чтобы выявить клоны с уникальными последовательностями. Величины аффинности фаговых антител ранжировали с использованием точечного конкурентного ИФА. Значения ИК50 фаговых антител дополнительно определяли с использованием конкурентного ИФА со связыванием фага. Уникальные фаговые антитела, которые специфически связываются с Jagged1 человека (но не с Jagged2), Jagged2 (но не с Jagged1), или с обоими Jagged1 и Jagged2, отбирали и преобразовывали в полноразмерный IgG для оценки в количественных исследованиях в условиях in vitro.
Клоны, представляющие интерес, преобразовывали в IgG путем клонирования областей VL и VH отдельных клонов в вектор экспрессии в клетках млекопитающих pRK (pRK.LPG3.HumanKappa), содержащий константный домен легкой каппа-цепи человека, и вектор экспрессии (pRK.LPG4.HumanHC), кодирующий константный домен полноразмерного IgG1 человека (Shields et al., J Biol Chem 2000; 276: 6591-6604), соответственно. После этого антитела временно экспрессировали в клетках млекопитающих линии СНО, и очищали на колонке с белком А.
b) Конструирование библиотек для улучшения аффинности клонов, полученных из библиотек областей VH или VH/VL
Фагмиду pW0703, полученную из фагмиды pV0350-2b (Lee et al., J. Mol. Biol 340, 1073-1093 (2004), содержащую стоп-кодон (TAA) в любом положении CDR-L3 и экспрессирующую одновалентный фрагмент Fab на поверхности бактериофага М13), использовали в качестве матрицы библиотеки для прививки вариабельных доменов тяжелой цепи (VH) клонов, представляющих интерес, из библиотеки VH для созревания аффинности. Для созревания аффинности использовали две стратегии рандомизации, в строгих и мягких условиях. Для рандомизации в строгих условиях одну библиотеку легких цепей с выбранными положениями трех CDR легкой цепи рандомизировали, используя аминокислоты, предназначенные для имитации природных антител человека, и сконструированное вырождение ДНК соответствовало таковому, описанному в работе Lee et al. (J. Mol. Biol 340, 1073-1093 (2004)). Для достижения мягких условий рандомизации, которые позволяют вводить приблизительно 50% частоту мутаций в выбранных положениях, мутагенную ДНК синтезировали с использованием смесей оснований в соотношении 70-10-10-10, способствующих включению нуклеотидов дикого типа (Gallop et al., Journal of Medicinal Chemistry 37:1233-1251 (1994)). Для рандомизации в мягких условиях мишенями являлись остатки в положениях 91-96 из CDR-L3, 30-33, 35 из CDR-Н1, 50, 52, 53-54 и 56 из CDR-H2, 95-98 из CDR-H3; и для рандомизации отбирали три различные комбинации петель CDR, H1/L3, H2/L3 и H3/L3.
Для клонов, полученных из библиотеки VH/VL, фагмиды, содержащие 4 стоп-кодона (ТАА) в каждой CDR и экспрессирующие одновалентный фрагмент Fab на поверхности бактериофага М13, получали в индивидуальном порядке, и использовали в качестве матриц для мутагенеза по методу Кункеля (Kunkel), чтобы сконструировать библиотеки для созревания аффинности. Для клонов, полученных из библиотеки VH/VL, использовали только стратегию рандомизации в мягких условиях, поскольку разнообразие CDR-L3 было создано в наивной библиотеке. Для достижения мягких условий рандомизации в качестве мишеней использовали остатки в положениях 28-31 из CDR-L1, 50, 53-55 из CDR-L2, 91-96 из CDR-L3, 30-35 из CDR-H1, 50-56 из CDR- Н2, 95-100 из CDR-H3; и для рандомизации отбирали четыре различные комбинации петель CDR, H1/L3*, H2/L3*, и H3/L3* и L1/L2/L3* (где * обозначает положение стоп-кодонов в матрице).
с) Стратегия сортировка фагов для улучшения аффинности
Для отбора фагов с улучшенной аффинностью антигены Jag1 или Jag2 сначала биотинилировали в условиях лимитирующей концентрации реагентов. Фаговые библиотеки подвергали одному раунду сортировки в планшетах и пяти раундам сортировки в растворе с увеличением жесткости условий. Для первого раунда сортировки планшеты Maxisorp сначала покрывали 10 мкг/мл антигена и предварительно блокировали с использованием блокирующего буфера (1% БСА и 0,05% Tween 20 в ФСБ). Фаговые частицы в блокирующем буфере при оптической плотности 3 OD/мл инкубировали в планшетах, покрытых антигеном-мишенью, в течение 3 часов. Лунки промывали десять раз ФСБ-0,05% Tween-20. Связанный фаг элюировали с использованием 150 мкл/лунку 50 мМ HCl, 500 мМ KCl в течение 30 минут, и затем нейтрализовали 50 мкл/лунку 1 М Трис, рН=8, титровали и размножали для следующего раунда. Для последующих раундов пэннинг фаговых библиотек проводили в растворе, в котором фаговую библиотеку инкубировали с 100 нМ биотинилированного белка-мишени (концентрация основана на значении ИК50 исходного клона фага) в 100 мкл буфера, содержащего 1% Superblock (Pierce Biotechnology) и 0,05% Tween-20 в течение 2 ч при комнатной температуре. Смесь затем разбавляли в 10 раз с использованием 1% Superblock, и вносили по 100 мкл в лунки, покрытые нейтравидином (10 мкг/мл), инкубировали в течение 30 минут при комнатной температуре и осторожном встряхивании. Для того чтобы определить неспецифическое связывание содержимое контрольных лунок, содержащих фаг, связывали на планшетах, покрытых нейтравидином. Связанный фаг затем промывали, элюировали и размножали, как описано для первого раунда. Дополнительные пять раундов сортировки в растворе проводили при повышении жесткости условий отбора. Первые несколько раундов предназначены для отбора по скорости прямой реакции за счет уменьшения концентрации биотинилированного белка-мишени с 100 нМ до 0,1 нм, и последние два раунда предназначены для отбора по скорости обратной реакции за счет добавления избыточного количества небиотинилированного белка-мишени (от 300 до 1000 раз выше), чтобы обеспечить конкурирование с более слабыми партнерами по связыванию при комнатной температуре.
d) Высокопроизводительный ИФА для скрининга антител с улучшенной аффинностью (конкурентный одноточечный ИФА)
Колонии отбирали после шестого раунда отбора. Колонии выращивали в 96-луночном планшете (Falcon) в течение ночи при 37°С в 150 мкл/лунку среды 2YT с добавлением 50 мкг/мл карбенициллина и 1×1010/мл M13KO7. Из того же планшета в качестве контроля отбирали колонию клеток XL-1, инфицированных исходным фагом. 96-Луночные планшеты MaxiSorp Nunc покрывали 100 мкл/лунку Jag1 или Jag2 (0,5 мкг/мл) в ФСБ при 4°С в течение ночи. Планшеты блокировали 150 мкл 1% БСА и 0,05% Tween-20 в ФСБ в течение 1 часа.
По 35 мкл фагового супернатанта разводили в 75 мкл буфера для ИФА (твердофазный иммуноферментный анализ) (ФСБ с добавлением 0,5% БСА, 0,05% Tween-20) в присутствии или без 5 нМ Jag1 или Jag2, и инкубировали в течение 1 ч при комнатной температуре в F-планшете (Nunc). По 95 мкл смеси переносили одновременно в планшеты, покрытые антигеном. Планшет осторожно встряхивали в течение 15 мин и промывали десять раз в ФСБ-0,05% Tween-20. Связывание количественно оценивали путем добавления антител к М13, конъюгированных с пероксидазой хрена (ПХ), в буфере для ИФА (1:2500), и инкубировали в течение 30 минут при комнатной температуре. Планшеты промывали десять раз в ФСБ-0,05% Tween-20. Затем по 100 мкл/лунку субстрата пероксидазы вносили в лунки и инкубировали в течение 5 минут при комнатной температуре. Реакцию останавливали добавлением в каждую лунку по 100 мкл 0,1 М фосфорной кислоты (Н3РО4) и инкубировали в течение 5 минут при комнатной температуре. Величину интенсивности желтого окрашивания, OD (оптическая плотность), в каждой лунке определяли с использованием стандартного планшет-ридера для ИФА при длине волны 450 нм. Для анализа последовательности выбирали клоны, величина OD450нм которых снижалась (%) более чем на 50%, по сравнению с уменьшением величины OD450нм (%) в лунках, содержащих исходный фаг (100%). Уникальные клоны отбирали для получения фага, чтобы определить аффинность связывания (ИК50 фага) в отношении Jag1 или Jag2 путем сравнения с соответствующими исходными клонами. После этого большинство клонов с улучшенной аффинностью преобразовывали в IgG1 человека для получения антител и последующего исследования кинетики связывания, используя систему BIAcore, и другие методы количественных исследований в условиях in vivo или in vitro.
Пример 2. Специфичное связывание антител, полученных против Jagged1 или Jagged2.
Антитела D-1 (ФИГ. 10А, левая панель) и С-1 (ФИГ. 10А, правая панель) исследовали для оценки связывания с рекомбинантными очищенными лигандами Notch, Jagged1 человека (hJag-1), Jagged2 человека (hJag-2), Jagged2 мыши (mJag-2), Delta-подобным лигандом 1 человека (hDLL1), Delta-подобным лигандом 1 мыши (mDLL1) и Delta-подобным лигандом 4 человека (hDLL4) с использованием стандартного твердофазного иммуноферментного анализа (ИФА). Планшеты для ИФА покрывали белком-лигандом Notch в концентрации 1 мкг/мл в ФСБ, рН=7,4 (Nunc Maxisorp) при 40°С в течение ночи, включая Jagged1 человека, Jagged2 человека и мыши, Delta-подобный лиганд 1 человека и мыши (DLL-1). Планшеты блокировали казеиновым блокатором в ФСБ (Pierce) в течение одного часа при комнатной температуре. Серийные 3-кратные разведения IgG к Jagged1/2 в буфере ФСБТ (буфер ФБТ (ФСБ + 0,05% (06./06.) Tween-20) с добавлением 0,5% (масс/об.) БСА) добавляли к планшетам и инкубировали в течение одного часа при комнатной температуре. Затем планшеты промывали ФСБТ, и связанные антитела детектировали с использованием IgG козы, конъюгированного с пероксидазой хрена, специфичного в отношении человеческого фрагмента Fab (Sigma). Использовали субстрат ТМВ (3,3',5,5'-тетраметилбензидин), и поглощение при длине волны 650 нм считывали с использованием стандартного планшет-ридера для ИФА. Зависимость величины поглощения от концентрации IgG представляли в графической форме с использованием KaleidaGraph (Synergy Software). На ФИГ. 10А приведены результаты, согласно которым величина OD450 на оси Y представляет степень связывания. Ни одно из антител, полученных в первом раунде скрининга антител, описанном в примере 1, не распознавало селективно только Jagged1 или только Jagged2. D-1 связывается с Jagged1 человека и мыши, а также с Jagged2 человека и мыши (ФИГ. 10A, левая панель, данные не приведены). С-1 связывается с Jagged1 человека и мыши, Jagged2 человека и мыши и Delta-подобным лигандом 1 человека и мыши (рис. 10А, правая панель, данные не приведены). Ни одно из антител не связывалось с Delta-подобным лигандом 4 человека.
Дальнейшие раунды скрининга выявили антитела, специфичные только в отношении одного из членов семейства Jagged, согласно результатам определения методом ИФА. Антитело А связывалось с Jagged1 человека и мыши, но не с Jagged2 (ФИГ. 10В). Напротив, антитело В связывалось с Jagged2 человека и мыши, но не с Jagged1 (ФИГ. 10В). Антитело С-1 использовали в качестве контроля для связывания как с Jagged1, так и с Jagged2.
Пример 3. Определение величины аффинности связывания антител и картирование эпитопов
Величины аффинности связывания фаговых антител к Jagged1/2 измеряли с помощью поверхностного плазмонного резонанса (SRP), используя систему BIAcore™-3000. Фаговые IgG человека к Jagged1/2 захватывали с помощью иммуноглобулина мыши против человеческого IgG, нанесенного на сенсорный чип СМ5, чтобы достичь приблизительно 150 единиц ответа (RU). Для измерений кинетики двукратные серийные разведения Jag1/2 DSL EGF1-4 человека или мыши (от 1,95 нМ до 250 нМ) впрыскивали в буфере ФБТ (ФСБ с добавлением 0,05% Tween-20) при 25°С и скорости потока 30 мл/мин. Скорости прямой реакции (kon) и скорости обратной реакции (koff) рассчитывали с использованием простой модели связывания Ленгмюра в соотношении один к одному (BIAcore Evaluation Software, версия 3.2). Равновесную константу диссоциации (Kd) рассчитывали как отношение koff/kon.
На ФИГ. 11 приведены обобщенные данные по величинам констант связывания для связывания антител А, А-1, А-2, В, В-1, В-2, В-3, В-4, С, С-1, D, D-1 и D-2 с очищенным Jagged1 человека, Jagged2 человека и Jagged2 мыши. Исходное антитело А специфически связывалось с Jagged1 человека и мыши (ФИГ. 11, и данные не приведены). Антитела с созревшей аффинностью А-1 и А-2 связывались с Jagged1 человека и Jagged1 мыши с высокой аффинностью (ФИГ. 11). Антитела А, А-1 и А-2 не связывались с Jagged2 человека или мыши (ФИГ. 11). Напротив, ни одно из антител В, В-1, В-2, В-3 или В-4 не связывалось с Jagged1 человека или мыши. Антитела с созревшей аффинностью В-1, В-2, В-3 или В-4 специфически связывались с Jagged2 человека и мыши (ФИГ. 11, и данные не приведены). Антитела С, С-1, D, D-1, D-2, D-3, D-4 и D-5 связывались с Jagged1 и Jagged2 как человека, так и мыши (ФИГ. 11). В отношении Jagged1 связывание антител С, С-1, D, D-1, D-2, D-3, D-4 и D-5 картировали в фрагменте DSL-EGF1-4 Jagged1 в ходе экспериментов с использованием ИФА с перекрестным блокированием.
Пример 4. Антитела-антагонисты к Jagged ингибируют Jaggedl-индуцированную передачу сигналов в условиях in vitro.
Чтобы определить, могут ли антитела к Jagged действовать в качестве антагонистов Jagged-индуцированной передачи сигналов посредством рецептора Notch, эксперименты с использованием смешанной культуры проводили по существу, как описано в работе Wu et al., Nature 464, 1052-1057 (15 апреля 2010). Клетки NIH-3T3, модифицированные для экспрессии Jagged1, в качестве лиганда Notch, культивировали совместно с клетками NIH-3Т3, которые стабильно экспрессируют Notch1 и которые были временно трансфецированы для экспрессии Notch-чувствительного гена-репортера люциферазы светлячка ТР-1 (12Х CSL) и конститутивно экспрессировали ген-репортер люциферазы Renilla (pRL-CMV, Promega). В смешанной культуре наблюдали сильный сигнал гена-репортера Notch (люцифераза светлячка) (ФИГ. 12, J1-индуцированный положительный контроль). Экспрессия гена-репортера снижалась до фонового уровня при добавлении ингибитора γ-секретазы к смешанной культуре (ФИГ. 12, соединение Е+), что указывало на Notch-зависимую экспрессию репортерной конструкции.
Добавление возрастающих количеств (0,4-50 мкг/мл) анти-Jagged антител С или D привело к дозазависимому ингибированию экспрессии репортера (ФИГ. 12, сравнить С и D с J1-индуцированным положительным контролем). В отличие от этого, изотипическое контрольное антитело, которое не распознает Jagged или Notch, не уменьшало существенно экспрессию гена-репортера (ФИГ. 12, изотипическое контрольное антитело). В совокупности эти результаты показывают, что антитела С и D действуют как антагонисты, то есть ингибируют Jagged1-опосредованную передачу сигналов посредством рецептора Notch, Notch1, в зависимости от дозы.
Аналогичные результаты были получены для антител с созревшей аффинностью, исследованных с использованием описанной выше смешанной культуры, для определения их способности ингибировать Jagged1-опосредованную передачу сигналов посредством Notch. Как и соответствующие исходные антитела С и D, антитела с созревшей аффинностью С-1, D-1, D-2, D-3, D-4 и D-5 ингибировали Jagged1-опосредованную передачу сигналов посредством Notch в зависимости от дозы, тогда как для изотипического контрольного антитела не наблюдали ингибирования (ФИГ. 13А).
Пример 5. Антитела-антагонисты к Jagged ингибируют Jagged1-индуцированную передачу сигналов в условиях in vitro.
Антитела С и D, а также их соответствующие производные с созревшей аффинностью, связываются с Jagged1 человека и мыши и Jagged2 человека и мыши (например, ФИГ. 10А). Чтобы определить, могут ли антитела, которые являются селективными в отношении только Jagged1 или только Jagged2, ингибировать Jagged1 и/или Jagged2-индуцированную передачу сигналов посредством Notch, соответственно, эксперименты с использованием смешанной культуры, описанной в примере 4, повторяли с использованием Jagged1-специфичного антитела А-2 или Jagged2-специфичного антитела В-3. Передачу сигналов индуцировали Jagged1 (ФИГ. 13В, темно-серые столбики) или Jagged2 (ФИГ. 13В, светло-серые столбики), и ингибирование определяли, как описано в примере 4, с использованием антител в концентрациях 0,016-50 мкг/мл. Контрольные эксперименты проводили с культурами, которые не стимулировали лигандом и не обрабатывали антителом (ФИГ. 1В3, необработанные), не стимулировали лигандом (ФИГ. 13В, без стимулирования или 3Т3Р), обрабатывали изотипическим контрольным антителом в дозе 5-10 мкг/мл (ФИГ. 13В, agD или gD), стимулировали лигандом, но не обрабатывали антителом (Стим/без антитела или без антитела), обрабатывали 5 мкМ ингибитора гамма-секретазы, DAPT, или ДМСО, который использовали в качестве контроля носителя DAPT.
Антитело А-2 ингибировало Jagged1-индуцированную передачу сигналов, но не Jagged2-индуцированную передачу сигналов, в зависимости от дозы (ФИГ. 13В, верхняя левая панель). Величины ИК50 для А-2 находились в пределах от 2 до 10 мкг/мл в отношении ингибирования Jagged1, в то время как даже при самой высокой концентрации 50 мкг/мл наблюдали лишь незначительное ингибирование Jagged2 либо оно отсутствовало. Результаты показывают, что антитело А-2 является Jagged1-селективным антагонистом, т.е. антитело А-2 ингибирует Jagged1-опосредованную передачу сигналов, но не Jagged2-опосредованную передачу сигналов. Напротив, антитело В-3 активно ингибировало Jagged2-индуцированную передачу сигналов в самой низкой из исследованных концентраций, но не ингибировало Jagged1-индуцированную передачу сигналов в самой высокой из исследованных концентраций, это свидетельствует о том, что В-3 является Jagged1-селективным антагонистом (нижняя левая панель). Антитело С-1 ингибировало Jagged1- и Jagged2-индуцированную передачу сигналов в зависимости от дозы (правая верхняя панель). В совокупности эти результаты показывают, что А-2 и В-3 действуют как Jagged1- и Jagged2-селективные ингибиторы, соответственно, тогда как С-1 действует в качестве ингибитора как Jagged1, так и Jagged2.
Пример 6. Влияние лечения антителом к Jagged на массу тела.
Как описано выше, ингибиторы гамма-секретазы и другие ингибиторы некоторых рецепторов Notch вызывают потерю массы тела и метаплазию бокаловидных клеток кишечника, что является нежелательным явлением для клинического применения. Чтобы определить, как антитела, описанные в настоящей заявке, влияют на массу тела и состояние кишечника, мышам вводили два раза в неделю антитело к Jagged1/2, антитело С-1 (5-10 мг антитела на кг массы тела мыши (мг/кг)), антитело к Jagged1, А-2 (5-20 мг/кг), антитело к Jagged2, антитело В-3 (5-20 мг/кг), комбинацию антител А-2 и В-3 (каждое по 5 мг/кг) или изотипическое контрольное антитело gD (20 мг/кг). Изотипическое контрольное антитело также использовали, чтобы довести общую концентрацию антител при каждом дозировании до 20 мг/кг. Общую массу тела каждой мыши определяли перед первым введением антител и контролировали до 12-го дня исследования. Средние изменения массы тела показаны на ФИГ. 14 в графической форме в виде зависимости процентного изменения относительно начальной массы тела. Двойное ингибирование Jagged1 и Jagged2 с использованием антитела к Jagged1/2, антитела С-1, или комбинации Jagged1-специфичного антитела А-2 и Jagged2-специфичного антитела В-3 вызывало быструю и значительную потерю массы (ФИГ. 14А). К 4-му дню некоторые мыши, получавшие антитело к Jagged1/2, антитело С-1, потеряли более 5% массы тела, эта потеря прогрессировала почти до 8-10% массы тела к 7-му дню (ФИГ. 14А). Мыши, которые получали комбинацию А-2 и В-3, также быстро теряли массу тела, в некоторых случаях до 17% к 11-му дню (ФИГ. 14А). В отличие от этого, ни одно из Jagged1-специфичных или Jagged2-специфичных антител по отдельности не вызвало потери массы тела за время исследования при введении в дозах 5 мг/кг или 20 мг/кг (ФИГ. 14А). Лечение с использованием комбинации антитела к Jagged1 и антитела к Jagged2 привело к снижению потребления пищи (ФИГ. 14В), которое коррелировало с наблюдаемым снижением массы тела (ФИГ. 14А), этот факт указывает на то, что снижение потребления пищи может частично или полностью объяснить одновременное уменьшение массы тела.
Пример 7. Гистологическое исследование тканей кишечника после лечения антителом к Jagged
Общее ингибирование Notch, например, под действием ингибиторов гамма-секретазы, а также комбинированное ингибирование Notch1 плюс Notch2 или D111 плюс D114 (см. Wu et al., Nature 2010; Pellegrinet et al., Gastroenterology, 2011), вызывает метаплазию бокаловидных клеток у мышей, и была выдвинута гипотеза, что такая метаплазия является причиной наблюдаемого снижения массы тела.
Чтобы определить, связана ли быстрая потеря массы тела после комбинированного ингибирования Jagged1 и Jagged2, наблюдаемого в примере 6, с метаплазией бокаловидных клеток, выделяли и исследовали образцы тканей кишечника мышей, получавших лечение, описанное в примере 6. Образцы тканей кишечника окрашивали гематоксилином и эозином (ФИГ. 15А, Н и Е) или альциановым синим для окрашивания слизистой оболочки, который является маркером секреторных бокаловидных клеток (ФИГ. 15А, альциановый синий). Некоторые образцы исследовали с помощью иммуногистохимических методов для определения экспрессии лизоцима, маркера клеток Панета, или для определения маркера пролиферации Ki-67 (ФИГ. 15В). Не было обнаружено очевидных различий между результатами гистологических исследований или уровнями экспрессии маркера в срезах тканей кишечника мышей, получавших контрольное антитело или антитело к Jagged1/2, антитело С-1. Эти результаты показывают, что потеря массы тела, наблюдаемая после ингибирования обоих лигандов Jagged1 и 2, не может быть отнесена к метаплазии бокаловидных клеток. Кроме того, эти результаты раскрывают новый механизм потери массы тела после обработки ингибиторами Notch, это свидетельствует о том, что метаплазия бокаловидных клеток может являться недостаточным основанием, чтобы объяснить потерю массы тела после обработки универсальными ингибиторами Notch.
Пример 8. Антитела-антагонисты к Jagged1 ингибируют рост клеток рака легких человека в условиях in vivo
Голым бестимусным мышам от Harlan вводили подкожно клетки Calu-6, клетки линии немелкоклеточного рака легких человека. После того как объем опухоли достигал приблизительно 200 мм3 мышам вводили внутрибрюшинно (в/б) два раза в неделю (0,4, 7, 11, 14 и 18 дни) 20 мг/кг изотопического контрольного антитела gD (n=10) или антитела к Jagged1, А-2 (n=10). Объем опухоли у каждой мыши измеряли с использованием циркуля в течение дополнительных 19 дней. Общую массу тела каждой мыши контролировали на протяжении всего исследования.
Объемы опухолей у мышей, получавших антитело к Jagged1, значительно снижались по отношению к объемам опухолей в контрольной группе (ФИГ. 16А). Влияние лечения антителом к Jagged1 можно было детектировать уже на седьмой день после начала лечения (ФИГ. 16А). К 18-му дню средний объем опухолей у мышей, получавших антитело к Jagged1, достигал приблизительно 500 мм3, в то время как средний объем опухолей у контрольных животных на 18 день достигал приблизительно 750 мм3. Не наблюдали существенных изменений массы тела между группой, получавшей лечение, и контрольной группой (ФИГ. 16В).
Пример 9. Антитела к Jagged1 и Jagged2 ингибируют рост клеток рака молочной железы человека в условиях in vivo
Мышам линии СВ-17 SCID.bg вводили в скопление жировой ткани в молочной железе клетки MDA-MD-468, клетки линии рака базального эпителия молочной железы человека. После того как объем опухоли достигал 200 мм3, мышам вводили в/б 30 мг/кг изотипического контрольного антитела gD (изотип IgG1 человека), изотипического контрольного антитела к агглютинину амброзии (изотип IgG2a мыши), антитела к Jagged1, А-2, содержащего каркас IgG1 человека, антитела к Jagged1, А-2, содержащего каркас IgG2a мыши или антитела к Jagged2, антитела В-3, содержащего каркас IgG1 человека на 0, 4, 7, 12, 15, 18, 22, 25, 29, 32, 36, 43, 50, и 57 дни. Объем опухоли (ось Y) измеряли с помощью циркуля в течение 60 дней после первой инъекции. Объемы опухолей в каждой группе (n=9 в каждой группе) представляли в графической форме с использованием линейной модели со смешанными эффектами (ФИГ. 17А). Объемы опухолей для каждой мыши в каждой группе показаны на ФИГ. 17В.
Все три антитела к Jagged существенно ингибировали рост опухоли. Оба антитела к Jagged1 ингибировали рост опухоли в сопоставимой степени, это свидетельствует о том, что наблюдаемые противоопухолевые свойства являются устойчивыми и не зависят от каркаса антител.
Несмотря на то, что вышеизложенное изобретение было подробно описано с помощью иллюстраций и примеров для целей ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем изобретения. Содержание всех патентных заявок и научных публикаций, приведенных в настоящей заявке, явным образом полностью включено в настоящую заявку посредством ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ NRR Notch1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476443C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |
| АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ Notch3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С Notch3 ЗАБОЛЕВАНИЙ | 2007 |
|
RU2493167C2 |
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
| АНТИТЕЛА ПРОТИВ DLL4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2415869C2 |
| АНТИТЕЛА ПРОТИВ BV8 И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2559542C2 |
| АНТИТЕЛА ПРОТИВ НЕЙРОПИЛИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2571226C2 |
| АНТИТЕЛА К PD1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2746409C1 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |








































































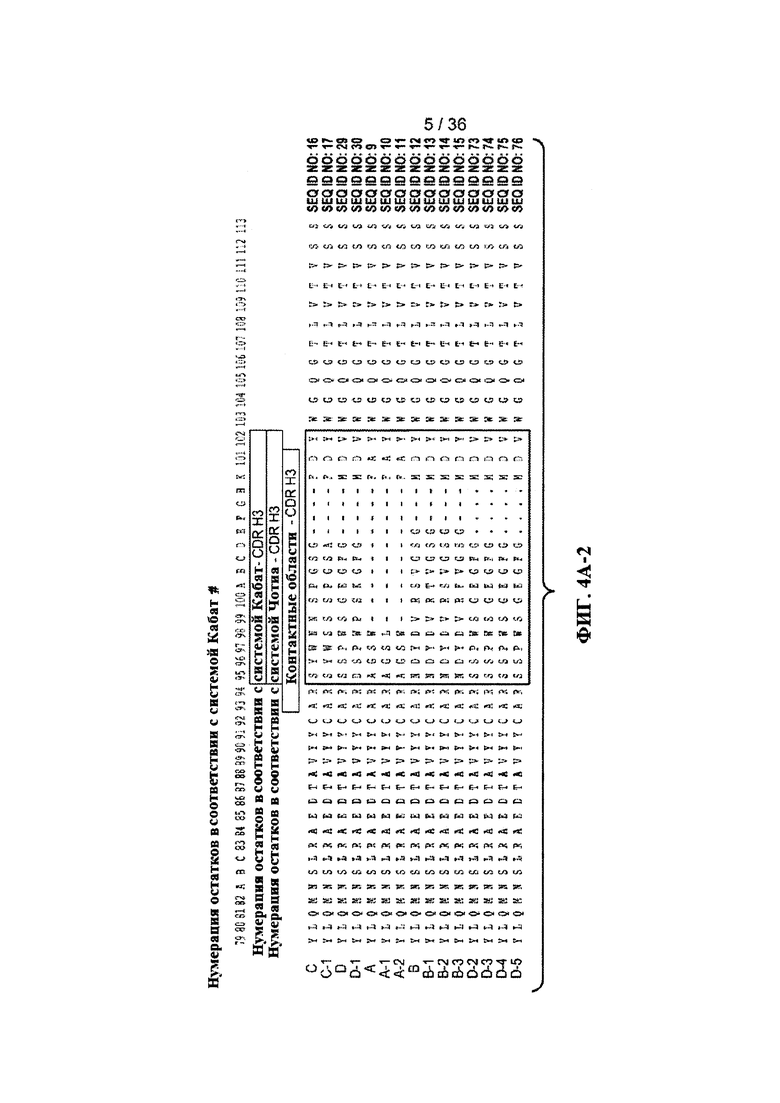
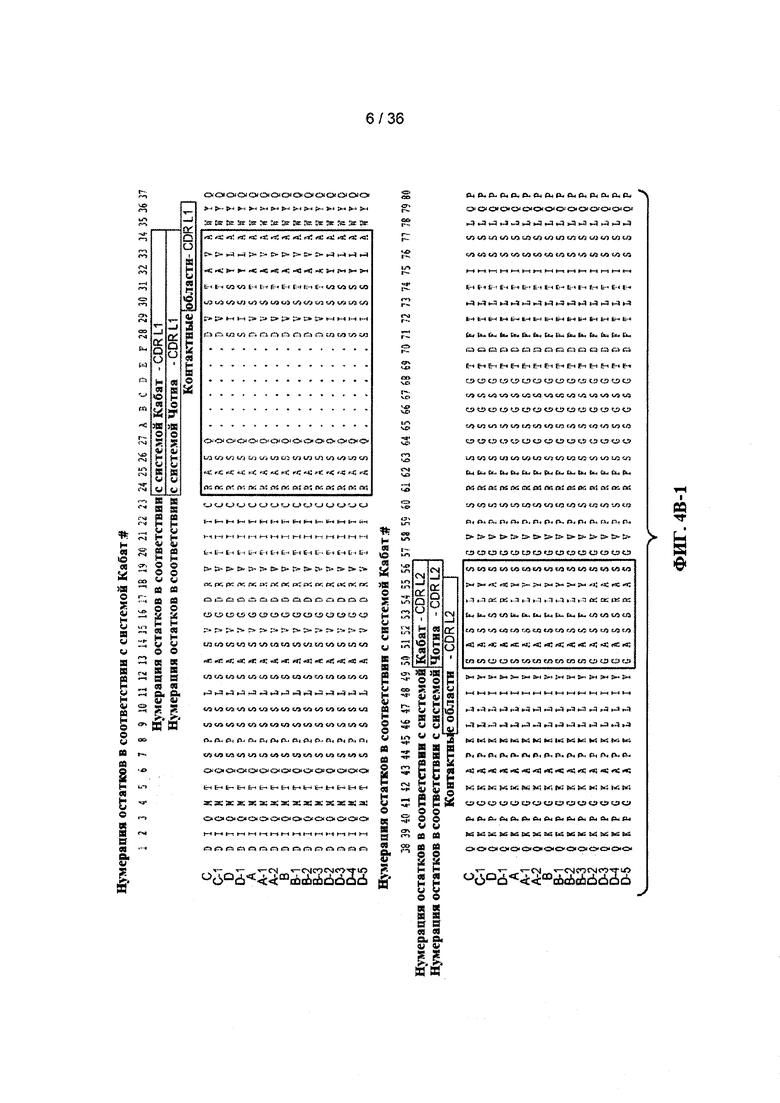

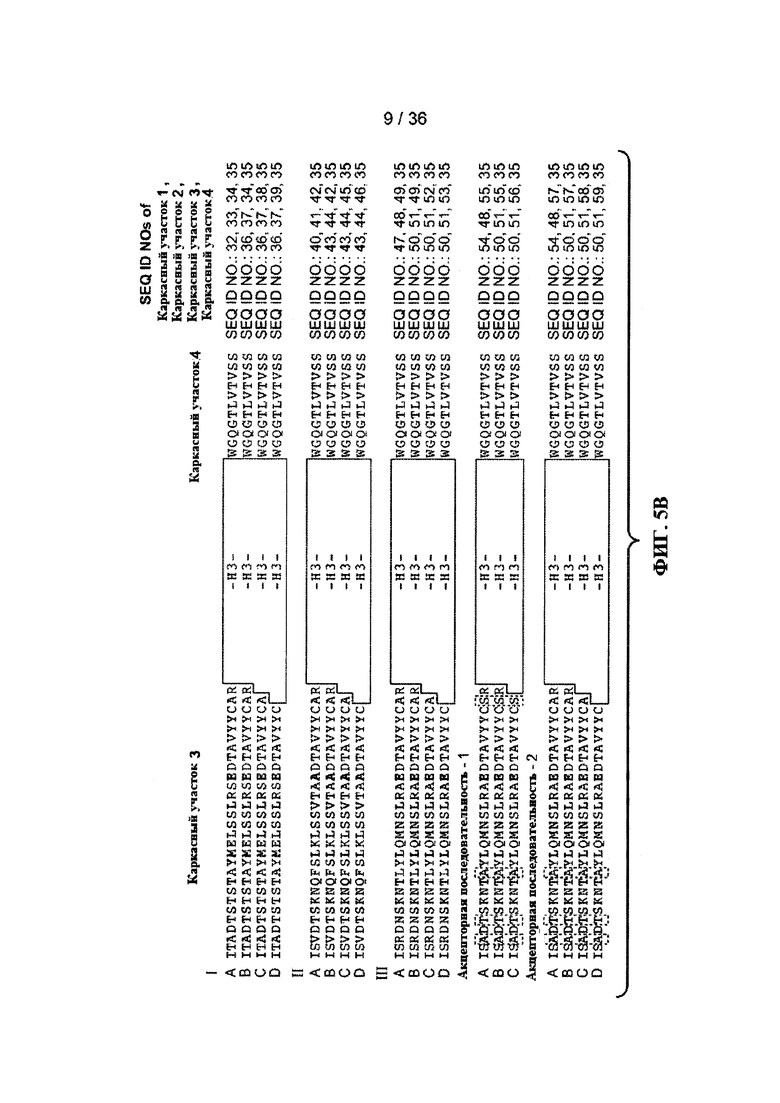
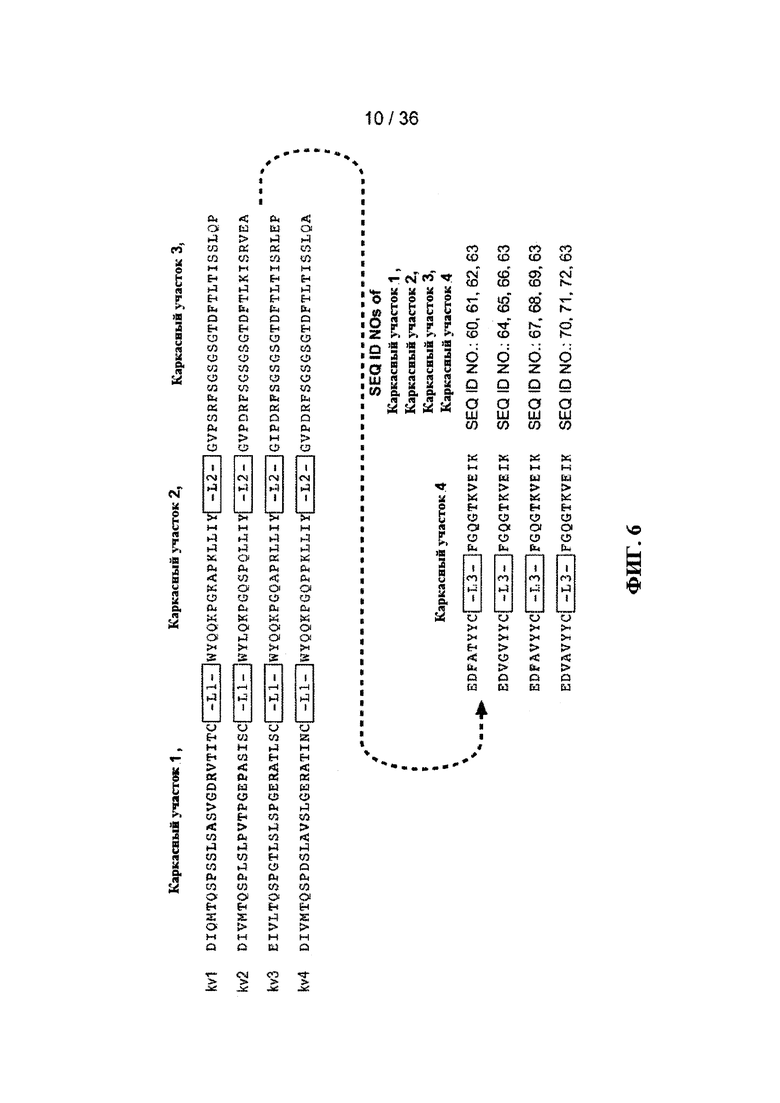
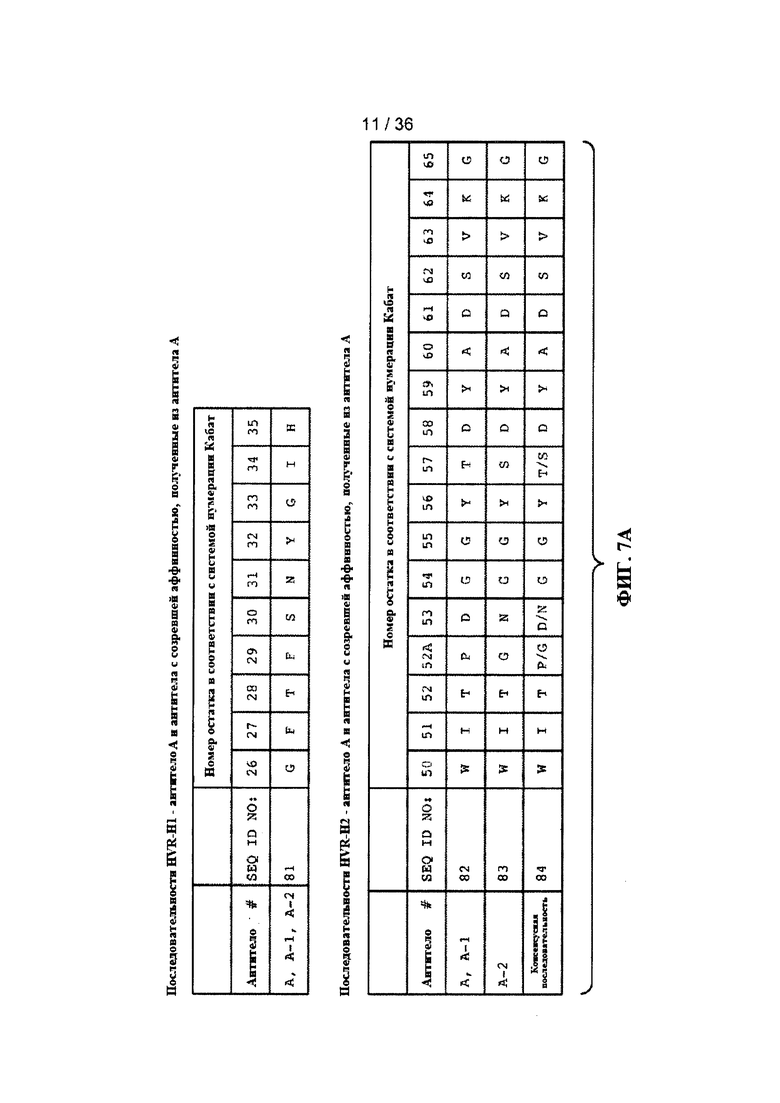
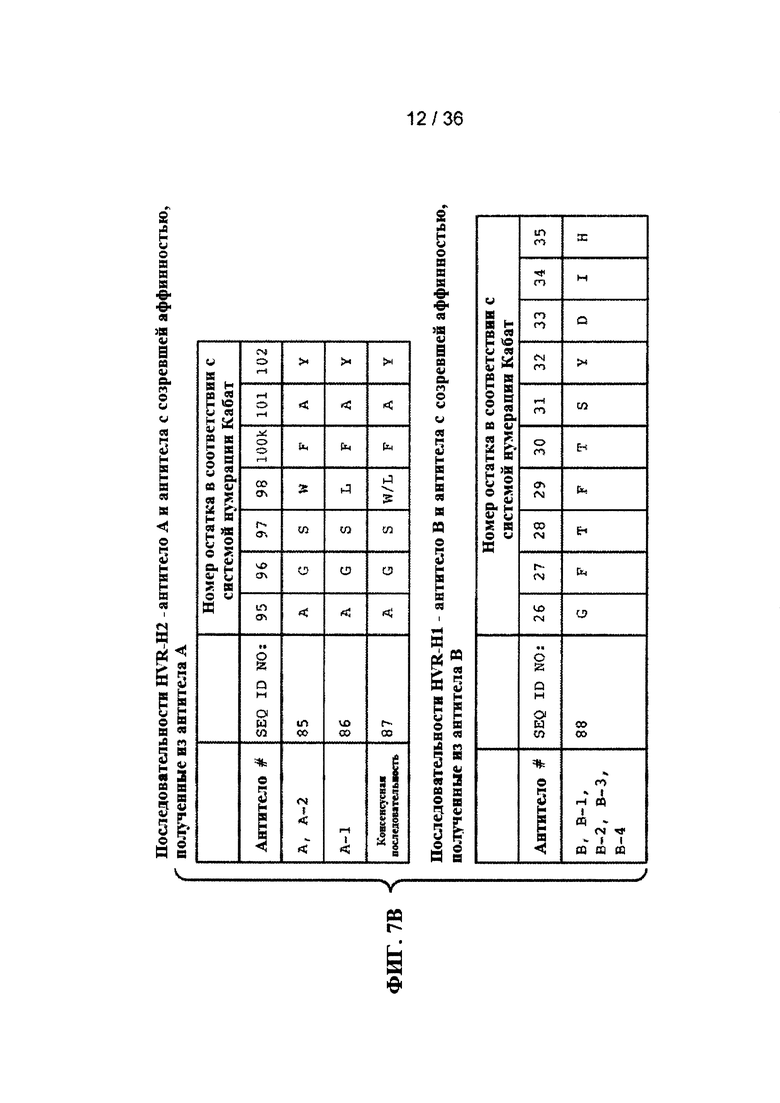
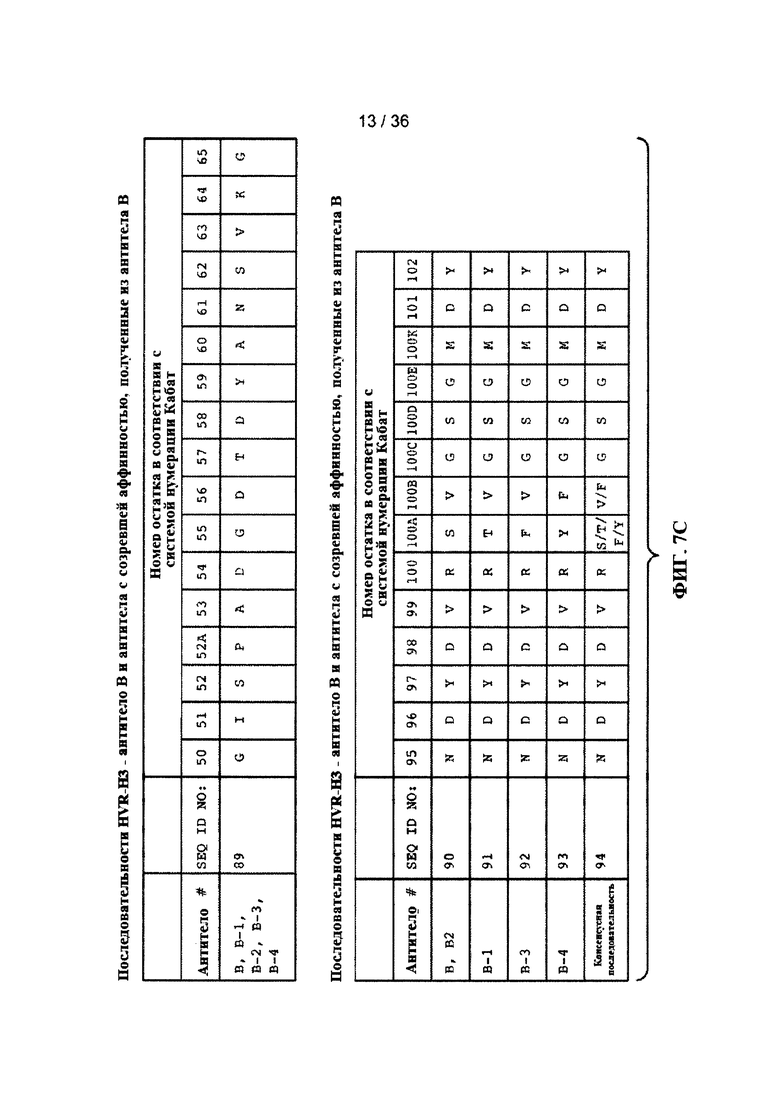
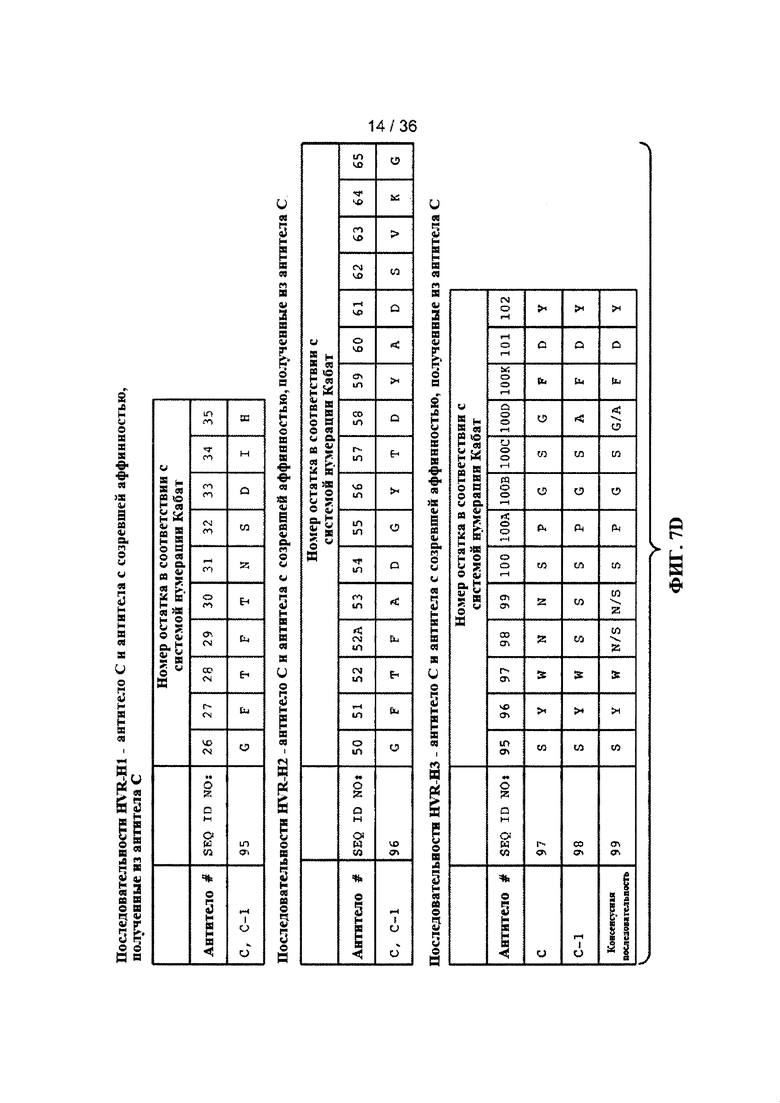
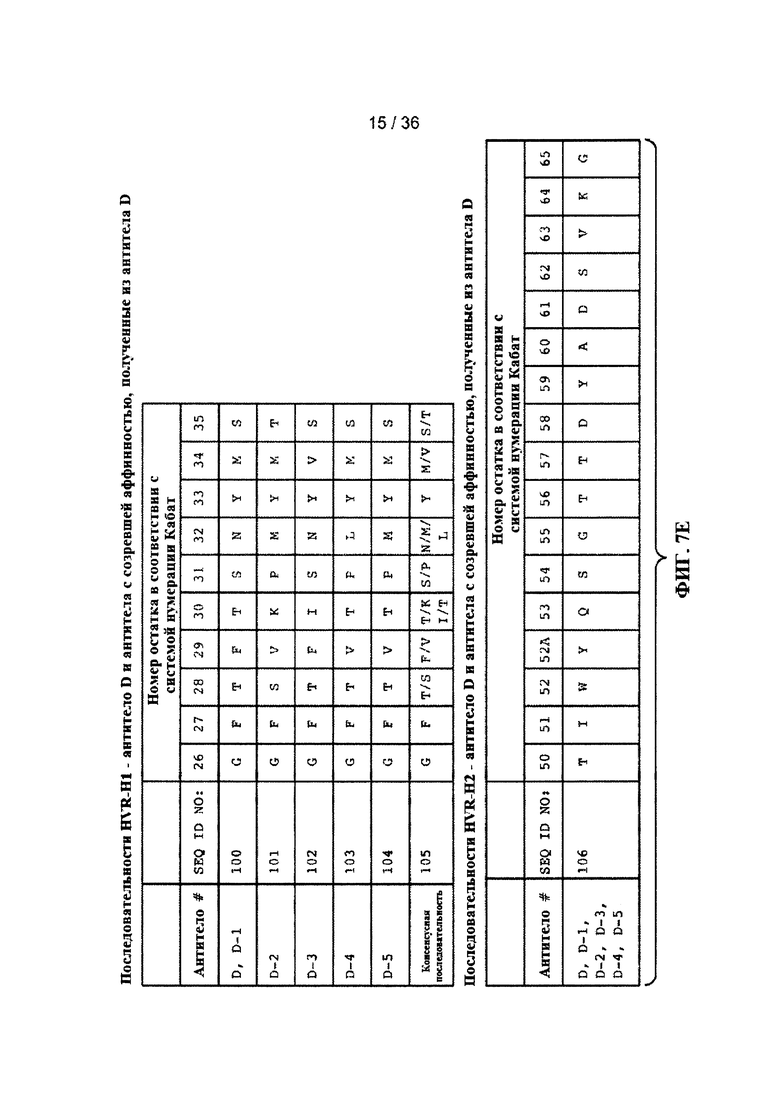
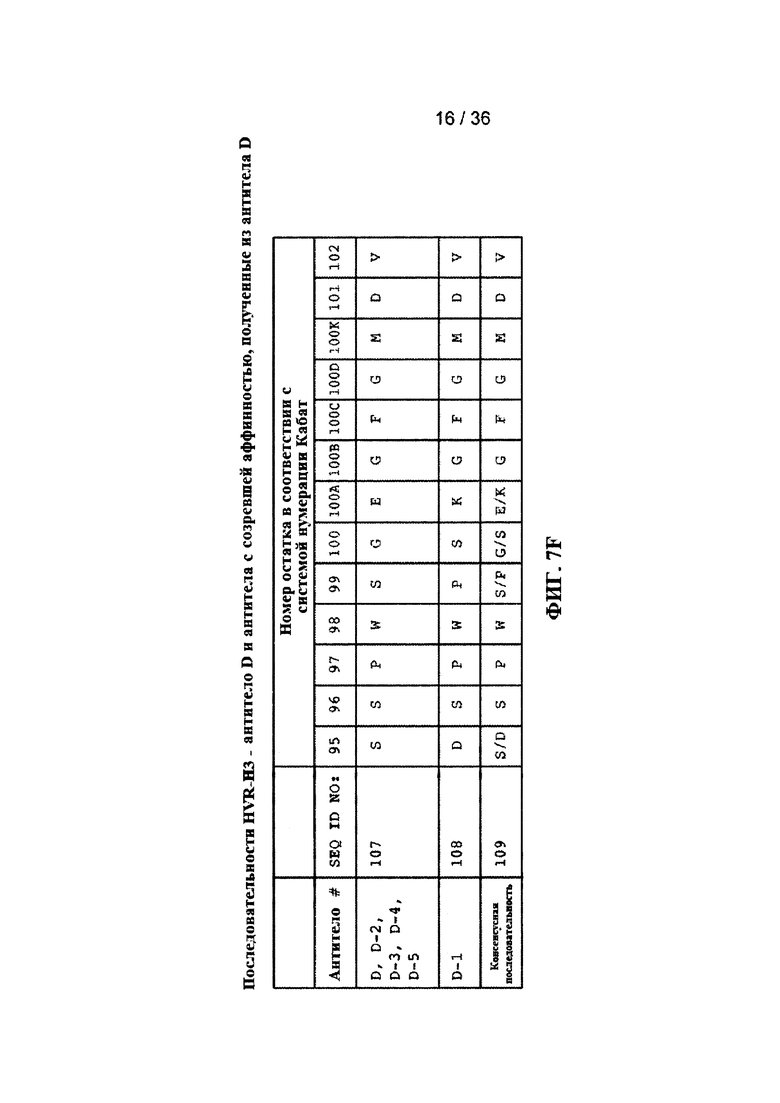
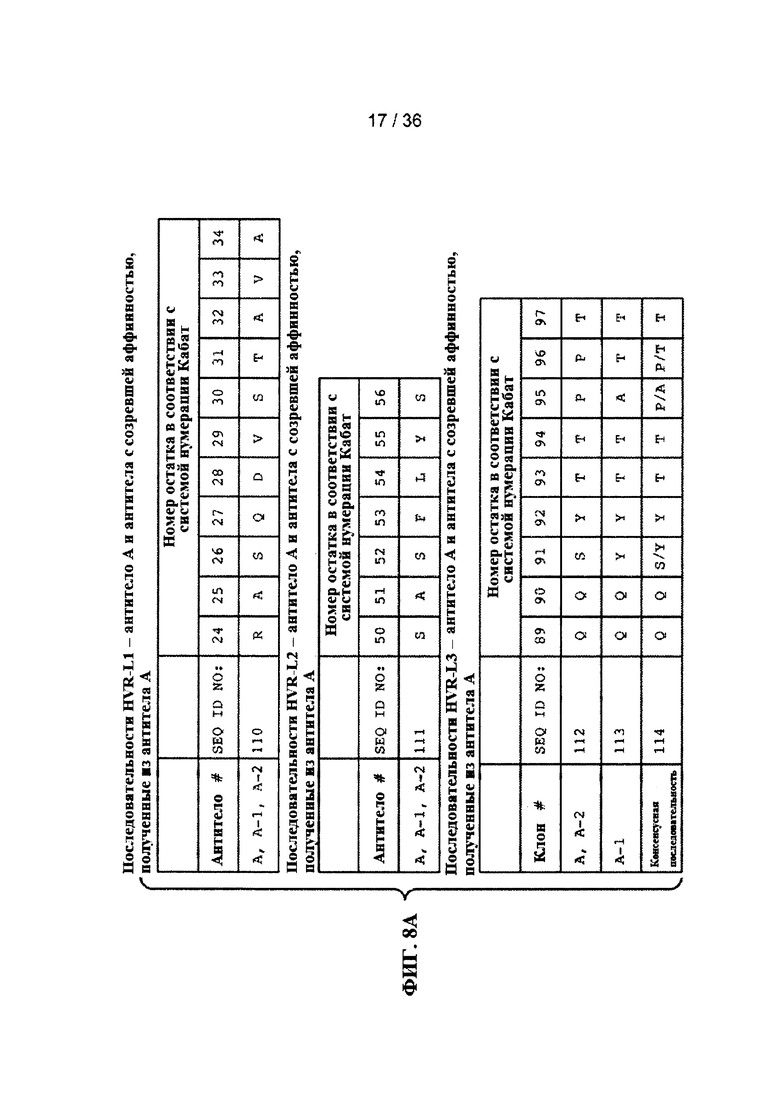
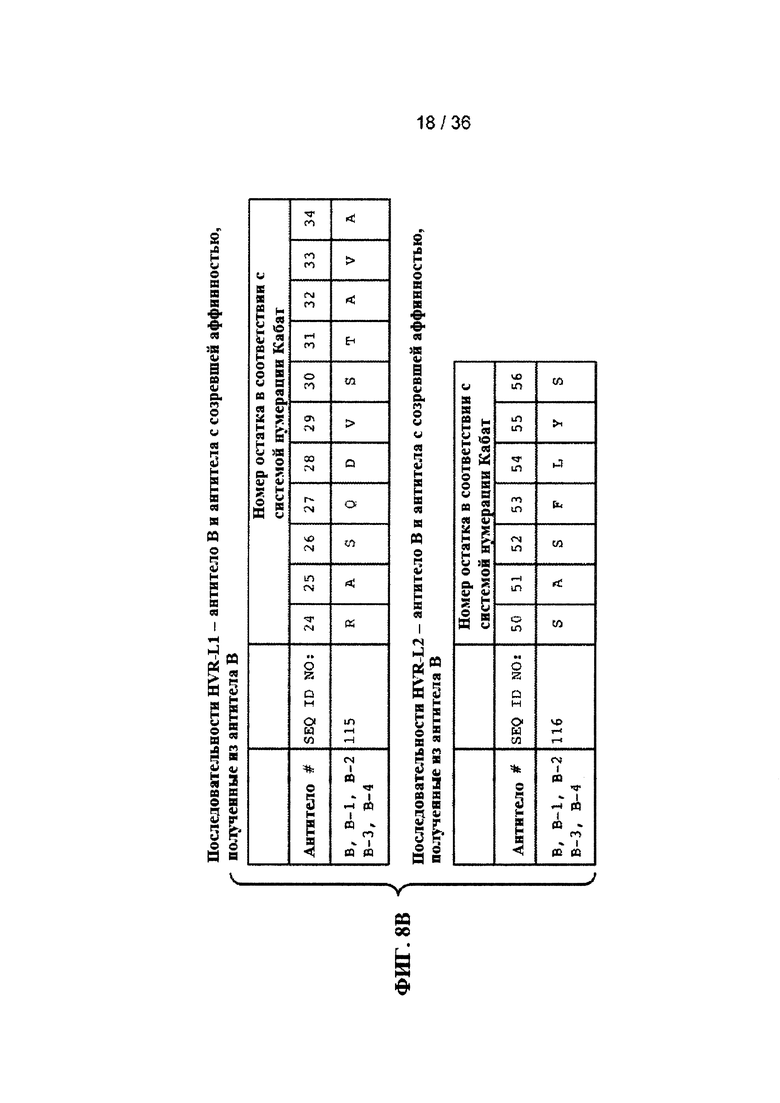
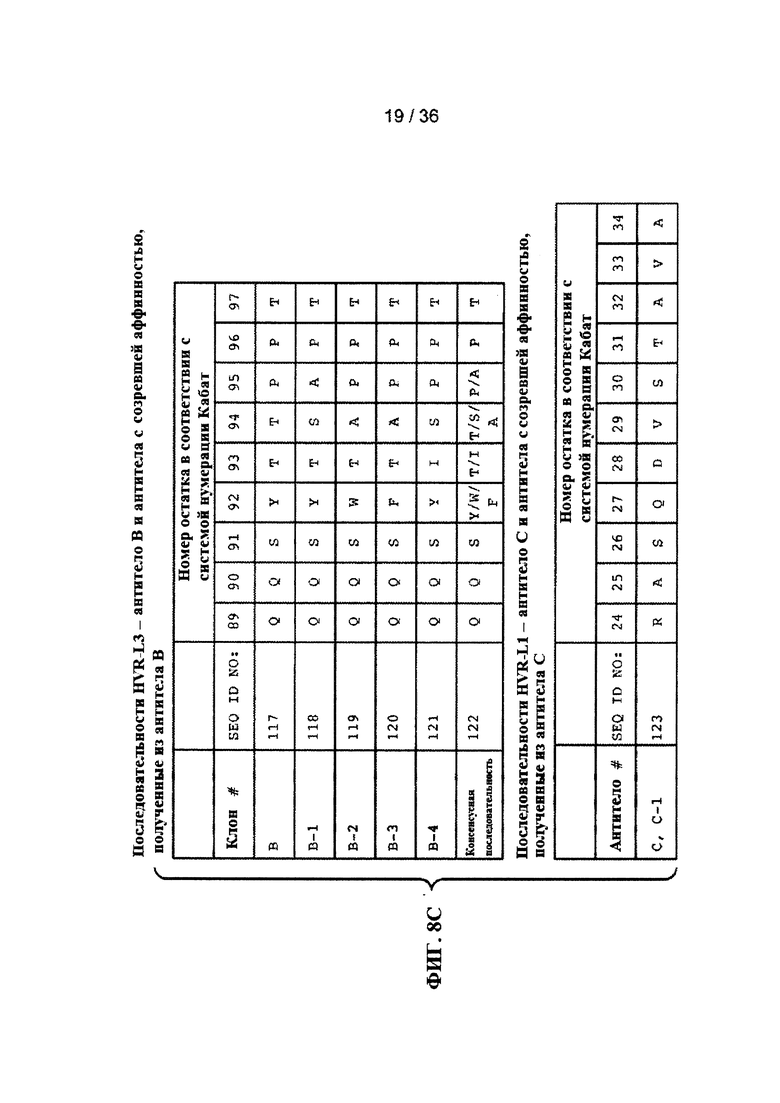
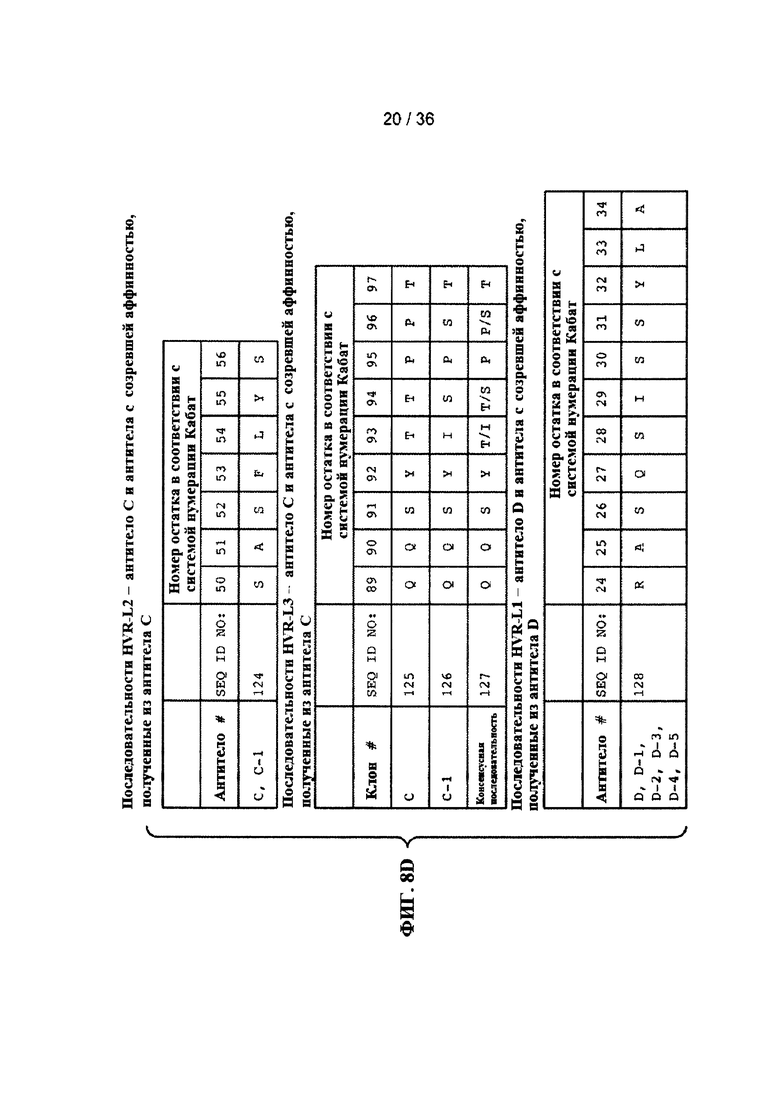
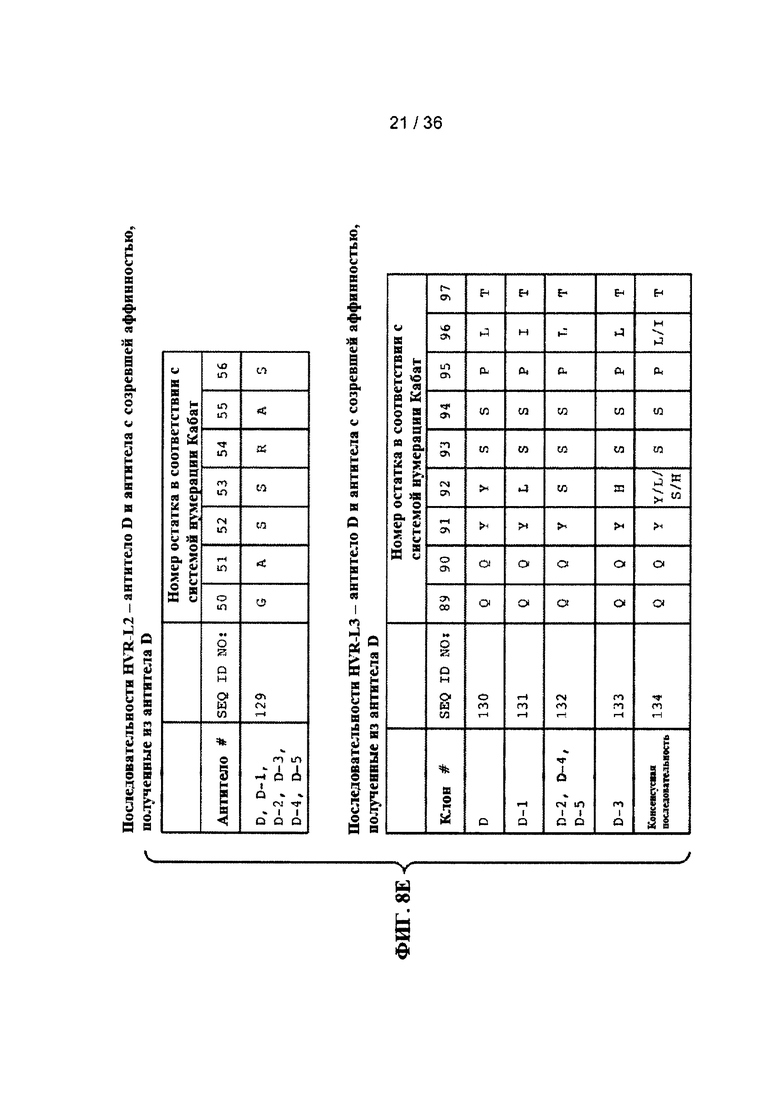

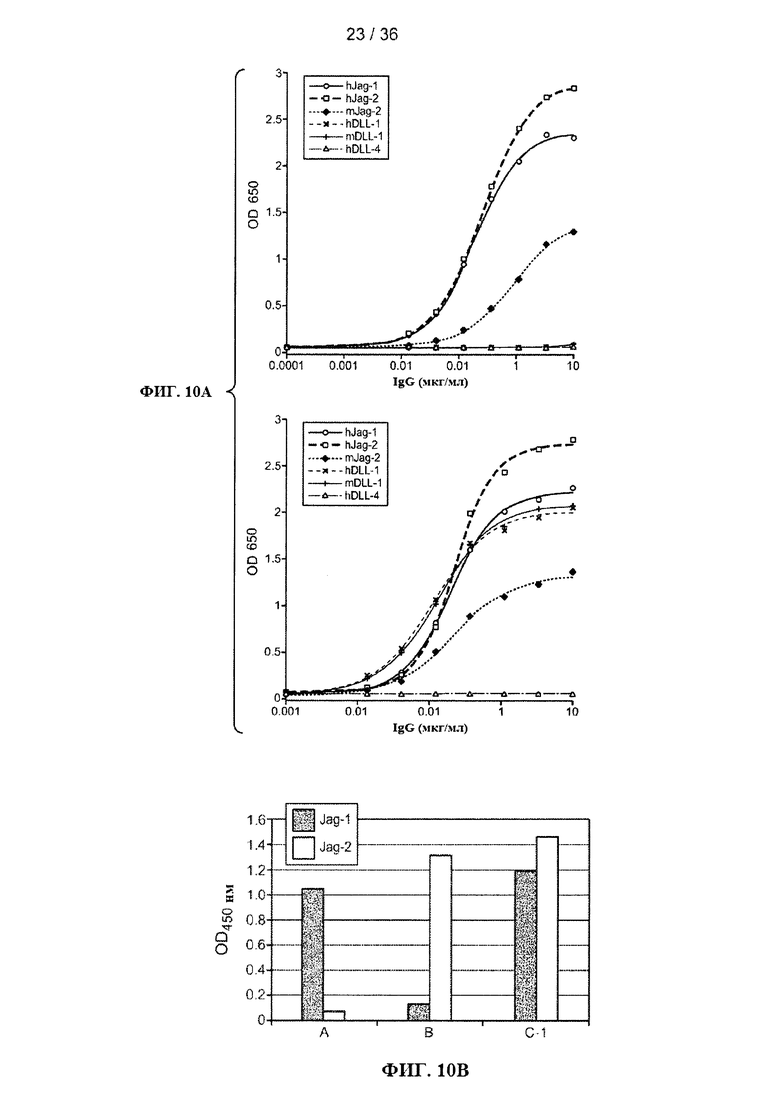
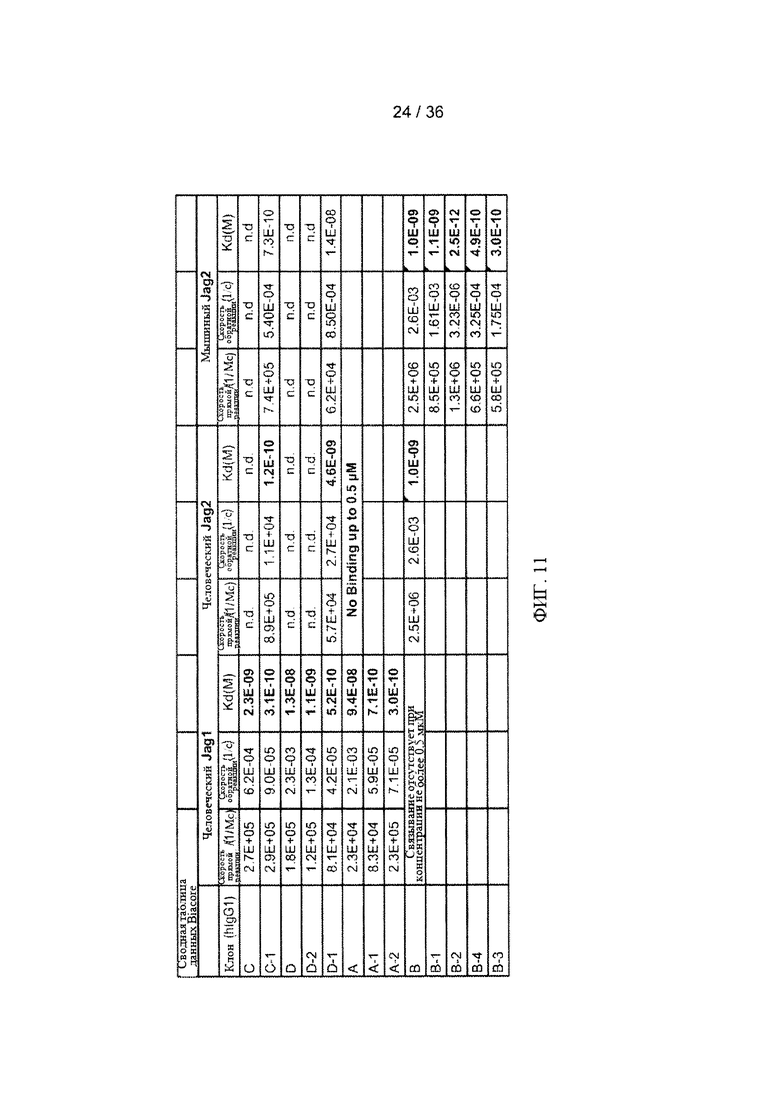
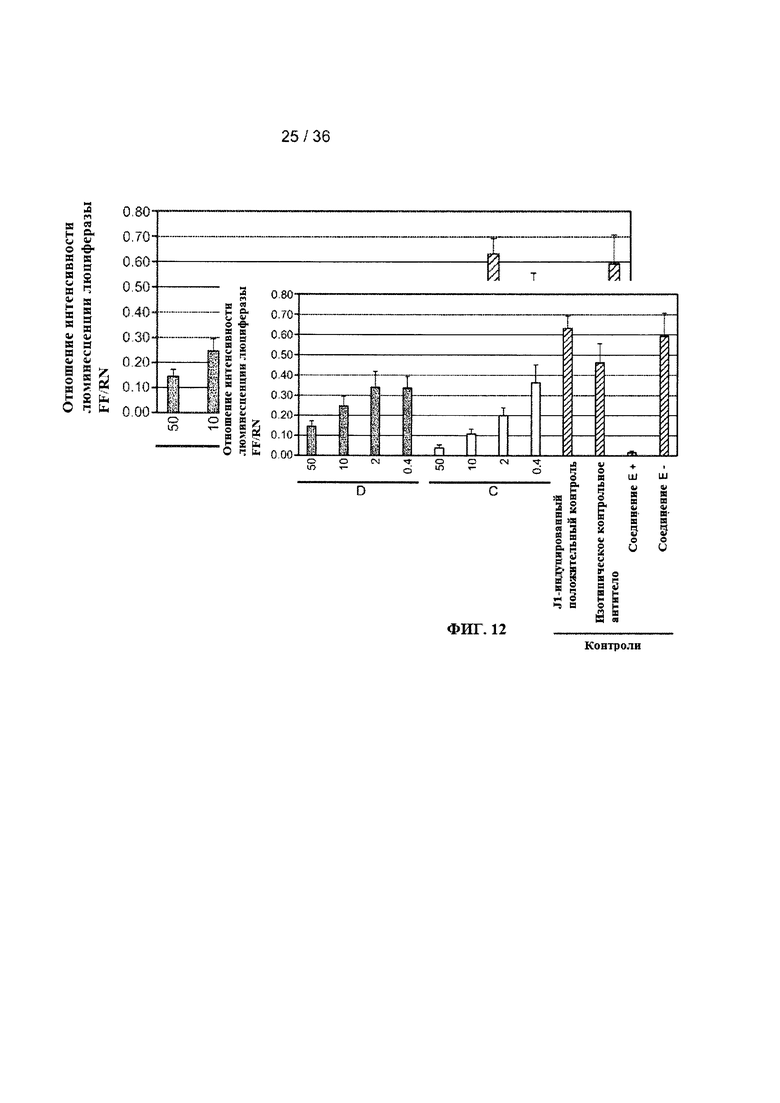
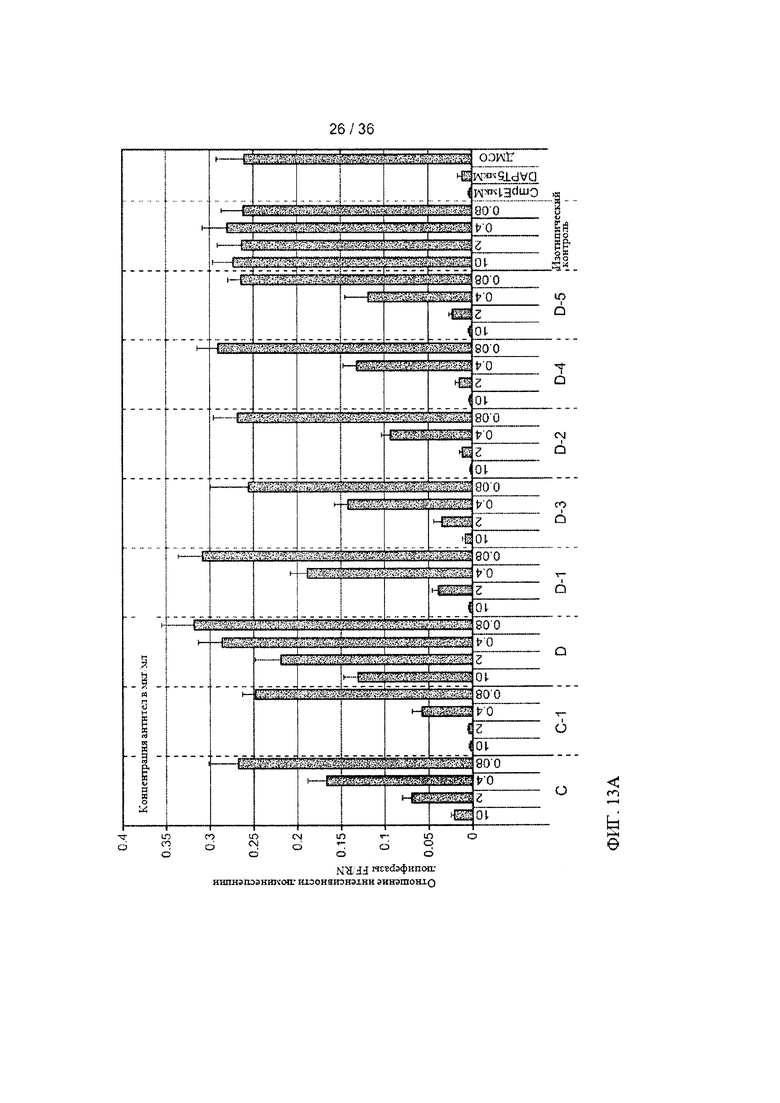
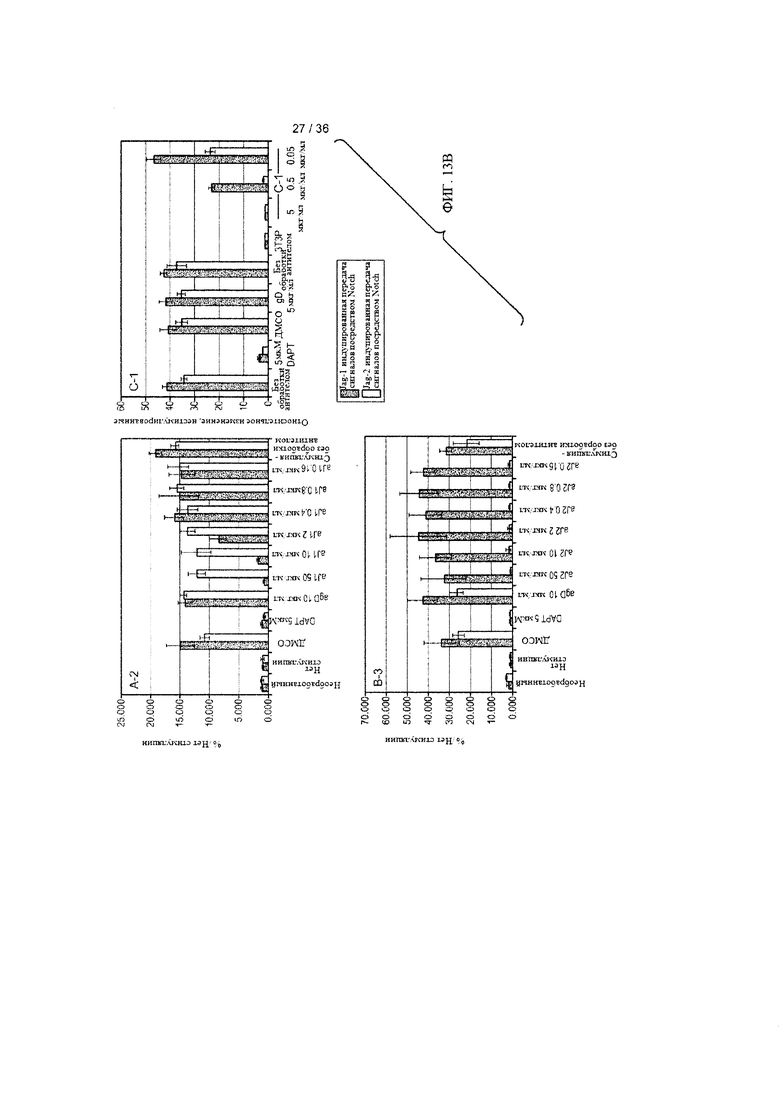
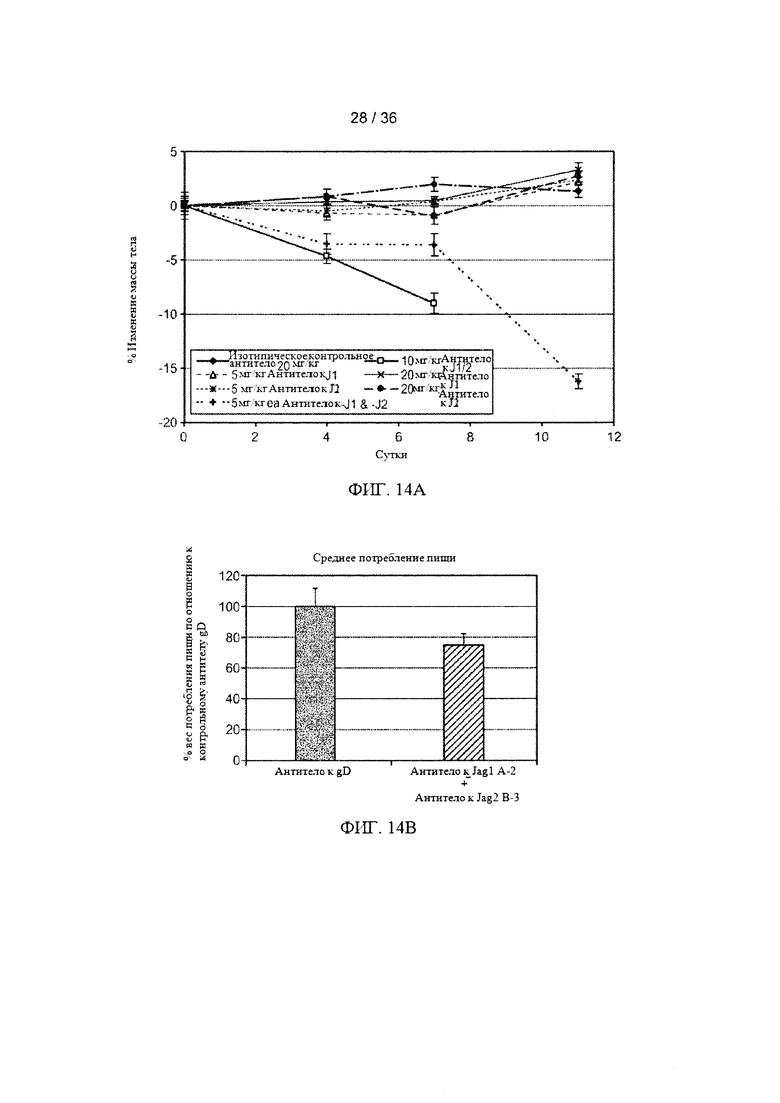


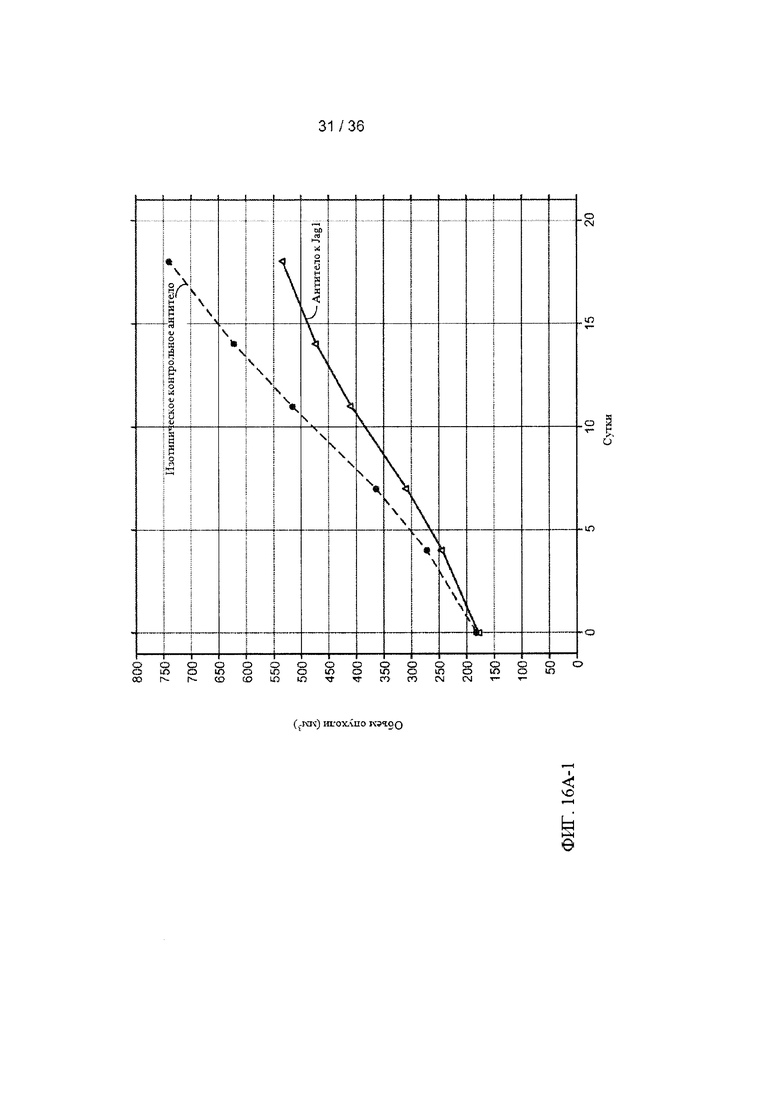
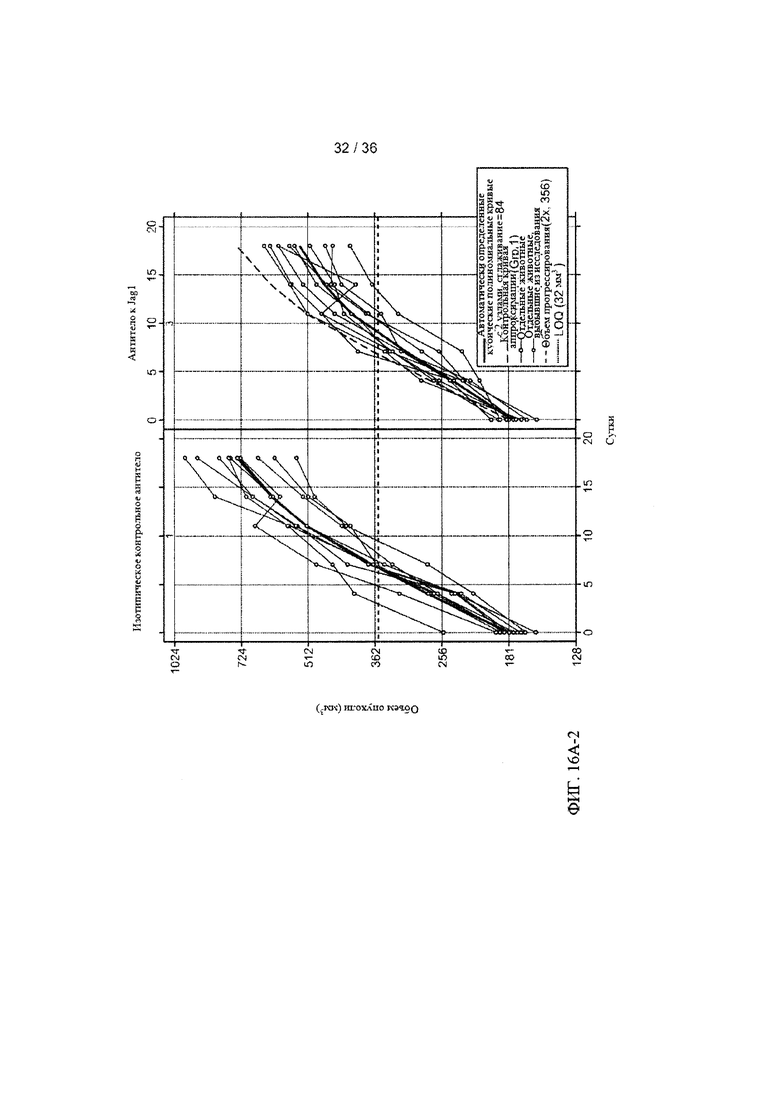
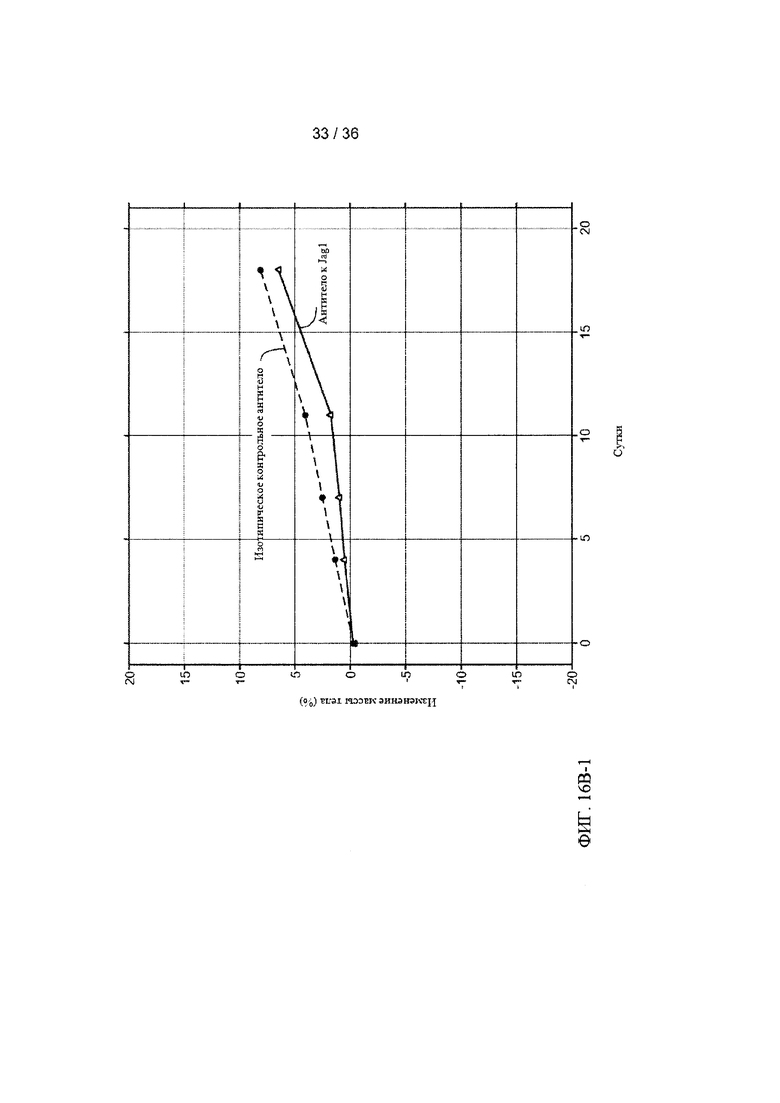
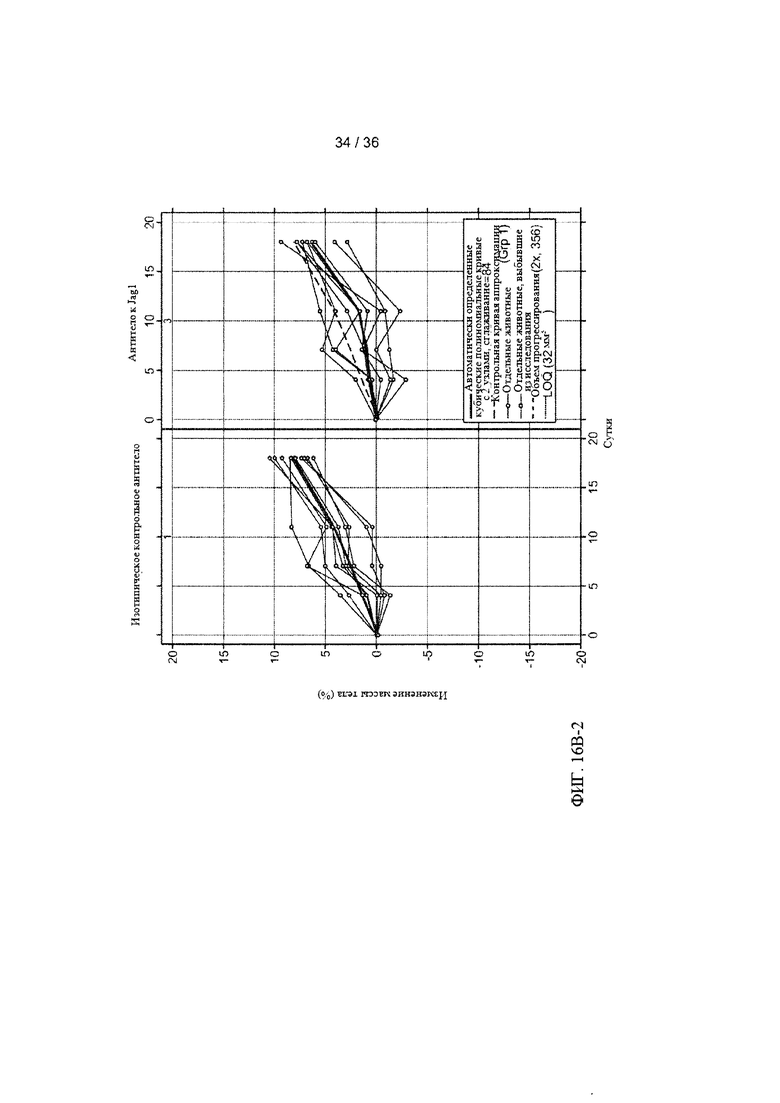
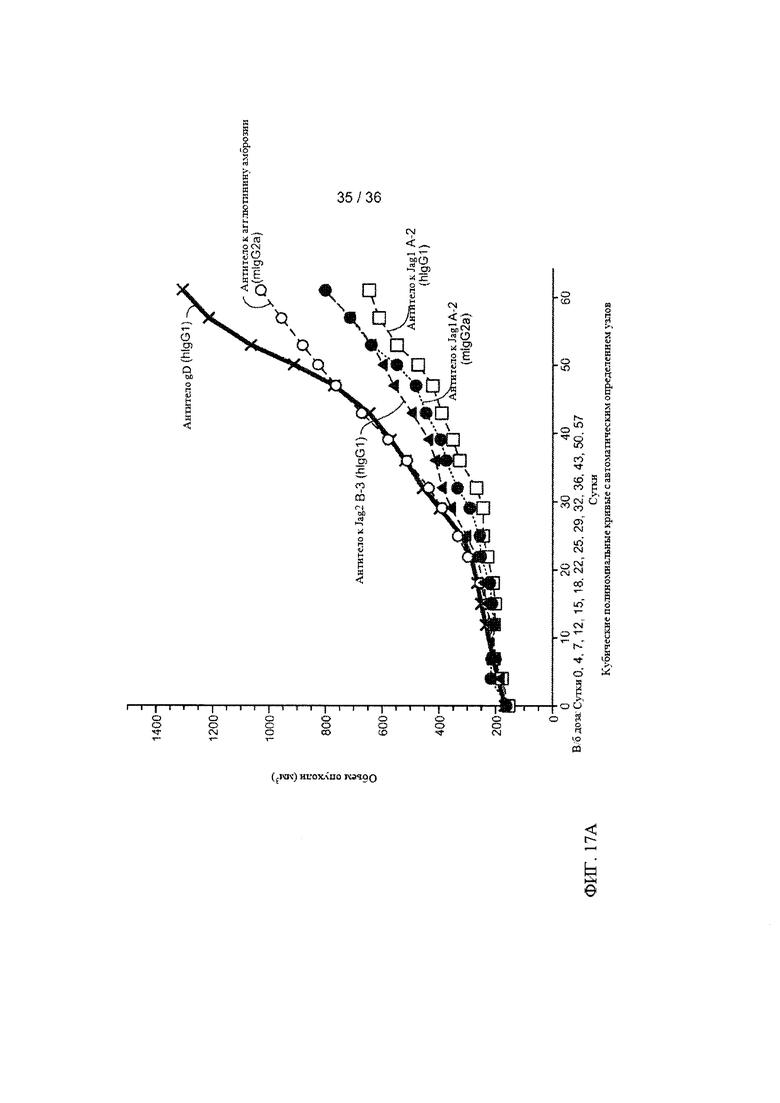
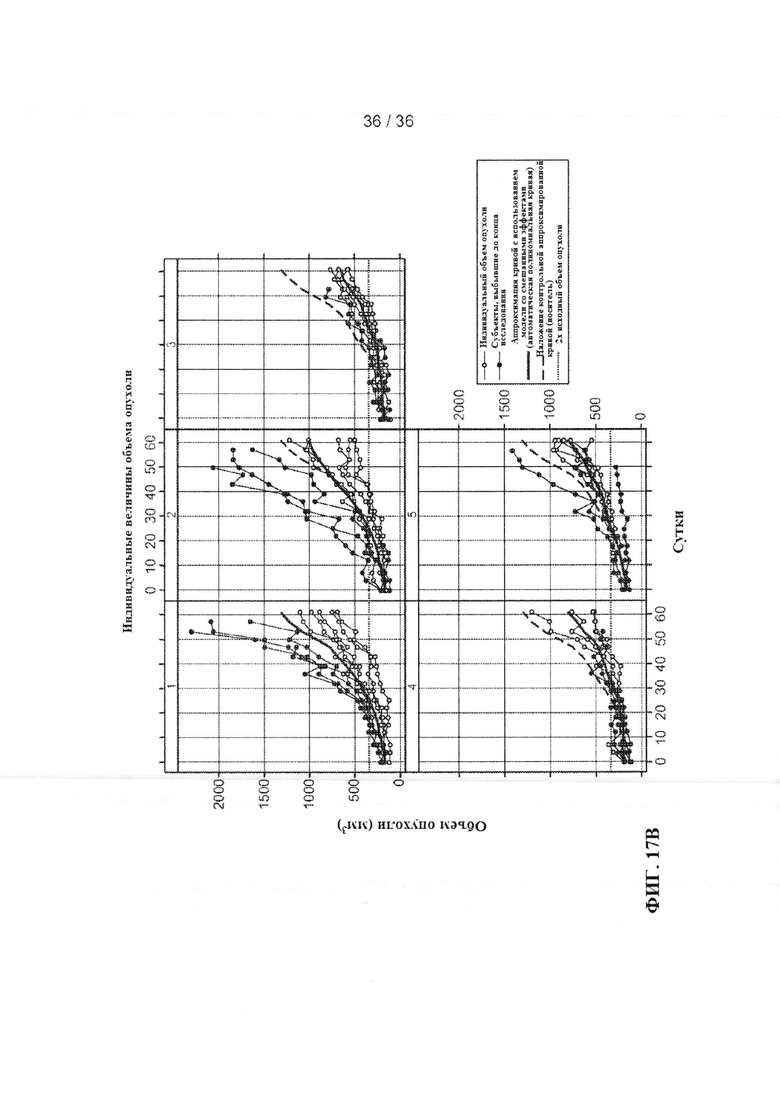
Изобретение относится к области биохимии, в частности к выделенному антителу или его антиген-связывающему фрагменту, которые специфически связываются с Jagged1, и способу его получения. Также раскрыто применение вышеуказанного антитела в составе иммуноконъюгата и фармацевтического состава для лечения рака, в уменьшении роста раковых клеток, а также в получении лекарственного средства для лечения заболевания или расстройства, связанных с нарушением передачи сигналов посредством рецептора Notch. Изобретение также относится к нуклеиновой кислоте, кодирующей вышеуказанное антитело или его фрагмент, а также к клетке-хозяину, содержащей вышеуказанную нуклеиновую кислоту. Изобретение позволяет эффективно осуществлять лечение рака. 12 н. и 18 з.п. ф-лы, 17 ил., 1 табл., 9 пр.
1. Выделенное антитело или его антиген-связывающий фрагмент, которые специфически связываются с Jagged1, содержащие:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 84;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 87;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 114.
2. Антитело или фрагмент по п. 1, содержащие:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112.
3. Антитело или фрагмент по п. 1, содержащие:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 82;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 86;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 113.
4. Антитело или фрагмент по п.1, содержащие:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 81;
(b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 83;
(c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 85;
(d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 110;
(e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 111; и
(f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 112.
5. Антитело по любому из пп. 1-4, которое представляет собой моноклональное антитело.
6. Антитело по любому из пп. 1-4, которое представляет собой человеческое, гуманизированное или химерное антитело.
7. Антитело или фрагмент по любому из пп. 1-4, содержащие каркасный участок вариабельного домена легкой цепи FR1, содержащий аминокислотную последовательность SEQ ID NO: 60; FR2, содержащий аминокислотную последовательность SEQ ID NO: 61; FR3, содержащий аминокислотную последовательность SEQ ID NO: 62; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 135.
8. Антитело по п. 3 или 4, содержащее каркасный участок вариабельного домена тяжелой цепи FR1, содержащий аминокислотную последовательность SEQ ID NO: 50; FR2, содержащий аминокислотную последовательность SEQ ID NO: 136; FR3, содержащий аминокислотную последовательность SEQ ID NO: 57; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 35.
9. Антитело или фрагмент по п. 1, содержащие (a) последовательность VH, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 10; (b) последовательность VL, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 19; или (c) последовательность VH, приведенную в (a), и последовательность VL, приведенную в (b).
10. Антитело или фрагмент по п. 9, содержащие последовательность VH, приведенную в SEQ ID NO: 10.
11. Антитело или фрагмент по п. 9, содержащие последовательность VL, приведенную в SEQ ID NO: 19.
12. Антитело или его антиген-связывающий фрагмент, которые специфически связываются с Jagged1, содержащие последовательность VH, приведенную в SEQ ID NO: 10, и последовательность VL, приведенную в SEQ ID NO: 19.
13. Антитело или фрагмент по п. 1, содержащие (a) последовательность VH, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 11; (b) последовательность VL, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 20; или (c) последовательность VH, приведенную в (a), и последовательность VL, приведенную в (b).
14. Антитело или фрагмент по п. 13, содержащие последовательность VH, приведенную в SEQ ID NO: 11.
15. Антитело или фрагмент по п. 13, содержащие последовательность VL, приведенную в SEQ ID NO: 20.
16. Антитело или его антиген-связывающий фрагмент, которые специфически связываются с Jagged1, содержащие последовательность VH, приведенную в SEQ ID NO: 11, и последовательность VL, приведенную в SEQ ID NO: 20.
17. Антитело или фрагмент по п. 1, которые представляют собой полноразмерное антитело IgG1.
18. Антитело или фрагмент по п. 1, которые являются антагонистом Jagged1-опосредованной передачи сигналов.
19. Выделенная нуклеиновая кислота, кодирующая антитело или фрагмент по п. 1.
20. Клетка-хозяин для получения антитела или фрагмента по п. 1, содержащая нуклеиновую кислоту по п. 19.
21. Способ получения антитела или фрагмента по п. 1, включающий культивирование клетки-хозяина по п. 20 с получением антитела.
22. Иммуноконъюгат для лечения рака, содержащий антитело или фрагмент по любому из пп. 1-4 и цитотоксический агент.
23. Фармацевтический состав для лечения рака, содержащий эффективное количество антитела или фрагмента по любому из пп. 1-4 и фармацевтически приемлемый носитель.
24. Применение антитела или фрагмента по любому из пп. 1-18 в лечении рака.
25. Применение антитела или фрагмента по любому из пп. 1-18 в уменьшении роста раковых клеток.
26. Применение антитела или фрагмента по любому из пп. 1-18 в получении лекарственного средства для лечения заболевания или расстройства, связанных с нарушением передачи сигналов посредством рецептора Notch.
27. Применение по п. 26, где указанное лекарственное средство предназначено для лечения рака.
28. Применение по п. 26, где указанное лекарственное средство предназначено для уменьшения роста раковых клеток.
29. Способ лечения субъекта, страдающего раком, включающий введение указанному субъекту эффективного количества антитела или фрагмента по любому из пп. 1-18.
30. Способ по п. 29, где указанный рак выбран из группы, состоящей из рака молочной железы, рака легких, рака мозга, рака шейки матки, рака толстой кишки, рака печени, рака желчных протоков, рака поджелудочной железы, рака кожи, В-клеточных злокачественных новообразований и Т-клеточных злокачественных новообразований.
| WO 2011063237 A2, 26.05.2011 | |||
| WO 2008091641 A2, 31.07.2008 | |||
| US 2006093599 A1, 04.05.2006 | |||
| US 2007141065 A1, 21.06.2007 | |||
| ВАРТАНЯН А | |||
| А | |||
| и др., Блокирование Notch сигнального пути стабилизирует васкулогенную мимикрию при меланоме, Российский биотерапевтический журнал, 2012, Т | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2018-09-13—Публикация
2013-08-13—Подача