Область техники, к которой относится изобретение
Изобретение относится к (ветеринарной) медицине, а именно к офтальмологии, и предназначено для моделирования внутриглазных инфекционных процессов с целью дальнейшей выработки оптимальной схемы лечения офтальмопатологий бактериального генеза.
Уровень техники
Известен способ моделирования грибкового кератита на кроликах посредством интракорнеального введения 0,1 мл клеточной взвеси грибков (2.5×107 клеток/мл) (Combined Topical Fluconazole and Corticosteroid Treatment for Experimental Candida albicans Keratomycosis Wolfram Schreiber et al Investigative Ophthalmology and Visual Science. 2003; 44:2634-2643). Рассмотренный способ характеризуется следующими недостатками: необходимо проведение сложной интракорнеальной инъекции, а также необходимость в дорогостоящем оборудовании - операционного микроскопа в виварии, невозможность регулирования степени тяжести поражения.
Известен способ моделирования грибкового кератита у кроликов. Производят скарификацию эпителия всей поверхности роговицы. Надевают на глаз предварительно инфицированную дрожжевыми грибами мягкую контактную линзу. Сшивают веки на 3-8 суток (см. патент RU 2346338).
Рассмотренный способ имеет ряд существенных недостатков. Он является травматичным и отсутствует возможность наблюдения за развитием патологического процесса на протяжении 3-8 суток.
Известен способ моделирования герпес-стафилококковой язвы роговой оболочки, заключающийся в заражении роговой оболочки глаза вирусом простого герпеса и введении культуры стафилококка, отличающийся тем, что в переднюю камеру глаза одновременно вводят не менее 1000 ТЦД50/0,1 мл вируса простого герпеса и 2 млн. микробных тел золотистого стафилококка, после чего исследуют роговую оболочку на 3-5 сутки после инфицирования (см. патент RU 97109974).
Рассмотренный способ имеет ряд существенных недостатков. В частности, наличие инфекционных агентов как вирусного, так и бактериального происхождения, а также отсутствие информации о методе введения этих микроорганизмов в переднюю камеру глаза.
Наиболее близким изобретением к описываемому способу по технической сущности является способ моделирования внутриглазного инфекционного процесса, в котором вводят стерильную иглу 26 G в переднюю камеру глаза и отбирают внутриглазную жидкость в объеме 0,1 мл, после этого иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси Staphylococcus aureus в концентрации 1 млрд. микробных тел в 1 мл (см. Моделирование внутриглазного инфекционного процесса / В.Н. Шахова, В.А. Беляев, В.В. Михайленко, Е.В. Сафоновская, А.А. Дорохина // Региональная научно-практическая конференция «Инновационные разработки молодых ученых юга России». - 2012. - С. 177-180).
Рассмотренный способ имеет ряд недостатков, основными из которых является отсутствие информации о времени после инфицирования, когда регистрировались первые клинические признаки офтальмопатологии, о способе получения и вирулентности данного штамма, а также узкий спектр возможности заражения (только Staphylococcus aureus).
Раскрытие изобретения
Задачей изобретения являлась разработка такого способа моделирования внутриглазного инфекционного процесса, который прост в исполнении, позволяет контролировать степень поражения структур глаза.
Техническим результатом изобретения является создание технически простой и высокопризводимой модели внутриглазного инфекционного процесса с одновременной возможностью регулирования желаемой степени тяжести повреждения.
Технический результат достигается с помощью способа моделирования внутриглазного инфекционного процесса, в котором производят введение стерильной иглы в переднюю камеру глаза и отбор внутриглазной жидкости в объеме 0,1 мл, причем после этого иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси штамма, при этом, в качестве инфекционного агента используют Pseudomonas aeruginosa, причем культуру предварительно засевают с помощью бактериальной петли в пробирки с мясо-пептонным агаром, культивируют в термостате при температуре 37±2°C в аэробной среде в течение 24 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,3 млрд по стандарту мутности Тарасевича в стерильной пробирке, клинические признаки инфицирования отмечаются через 1-3 дня после введения штамма.
Сущность способа моделирования внутриглазного инфекционного процесса включающий, введение стерильной иглы в переднюю камеру глаза и отбор внутриглазной жидкости в объеме 0,1 мл, причем после этого иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси штамма, при этом, в качестве инфекционного агента используют Pseudomonas aeruginosa, причем культуру предварительно засевают с помощью бактериальной петли в пробирки с мясо-пептонным агаром, культивируют в термостате при температуре 37±2°C в аэробной среде в течение 24 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,3 млрд по стандарту мутности Тарасевича в стерильной пробирке, клинические признаки инфицирования отмечаются через 1-3 дня после введения штамма.
Краткое описание чертежей и их материалов
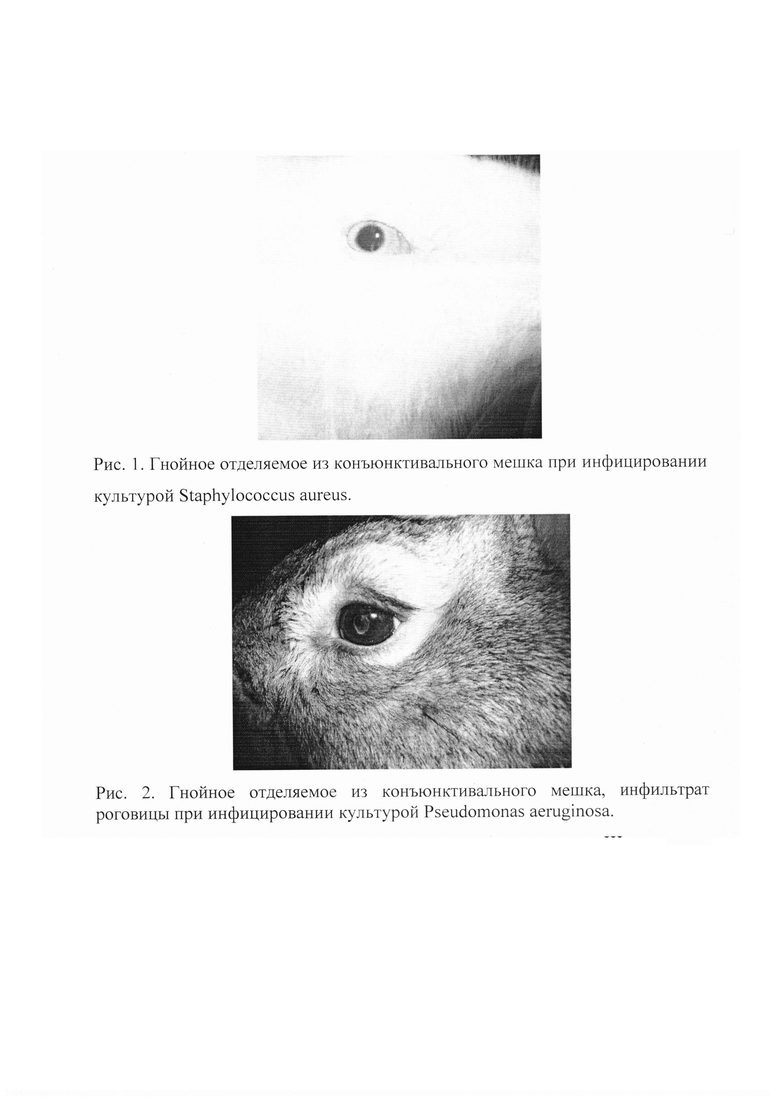
На фиг. 1 дан способ моделирования внутриглазного инфекционного процесса, гнойное отделяемое из конъюнктивального мешка при инфицировании культурой Staphylococcus aureus, рисунок 1.
На фиг. 2 дан способ моделирования внутриглазного инфекционного процесса, гнойное отделяемое из конъюнктивального мешка, инфильтрат роговицы при инфицировании культурой Pseudomonas aeruginosa, рисунок 2.
На фиг. 3 дан способ моделирования внутриглазного инфекционного процесса, инъекция склеры, роговица отечна, инфильтрирована, сосуды радужки расширены, рисунок стушеван, рисунок 3.
На фиг. 4 дан способ моделирования внутриглазного инфекционного процесса, десквамация эпителия роговицы, воспалительная инфильтрация лимфоцитами и макрофагами, рисунок 4.
На фиг. 5 дан способ моделирования внутриглазного инфекционного процесса, воспалительная инфильтрация роговицы, десквамация эпителия радужной оболочки, рисунок 5.
Осуществление изобретения
Примеры конкретного выполнения способа моделирования внутриглазного инфекционного процесса.
Культуру Pseudomonas aeruginosa выделили от телят с подтвержденным диагнозом псевдомоноз. При клиническом осмотре 12 больных телят в возрасте 1,5-2 месяца были обнаружены следующие симптомы болезни: угнетение, шаткая походка повышение температуры тела до 40,1-41,7°C, конъюнктивиты (от серозного до фибринозно-гнойного), у 5 телят кроме конъюнктивита наблюдались признаки кератита с помутнением роговицы, ее поверхность была шероховатая у 4-х на поверхности обнаруживался гнойный экссудат, у одного теленка признаки гнойно-фибринозного панофтальмита.
Культуру Staphylococcus aureus выделили от больного животного с предварительным диагнозом «Стафилококкоз верхних дыхательных путей». У собаки при клиническом осмотре в сочетании с признаками патологии верхних дыхательных путей регистрировался конъюнктивит.
Пример №1.
Культуру предварительно засевают с помощью бактериальной петли в пробирки с мясо-пептонным агаром, культивируют в термостате при температуре 35±2°C в аэробной среде в течение 18 часов. Ресуспендируют культуру Staphylococcus aureus физиологическим раствором. В стерильной зоне пастеровской пипеткой набирают культуру. Доводят концентрацию микробных клеток в 1 мл до 1,0 млрд по стандарту мутности Тарасевича в стерильной пробирке. Производят введение стерильной иглы в переднюю камеру глаза и отбор внутриглазной жидкости в объеме 0,1 мл, после взятия иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси штамма Staphylococcus aureus, клинические признаки инфицирования отмечаются через 5-6 дней после введения штамма.
У животных фиксировали: гнойное отделяемое из конъюнктивального мешка, легкую перикорнеальную инъекцию в месте введения иглы, веки спокойны, роговица прозрачная, радужка спокойная, зрачок реагирует на свет (Рис. 1). Гистологическое исследование структуры глаза у больных животных выявило только отечность и лимфоцитарную инфильтрацию склеры.
Пример №2.
Выполняется аналогично примеру 1, но в качестве инфекционного агента используют Pseudomonas aeruginosa, культивируют в термостате при температуре 36±2°C в аэробной среде в течение 20 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,1 млрд по стандарту мутности Тарасевича в стерильной пробирке, клинические признаки инфицирования отмечаются через 3-4 дней после введения штамма.
При осмотре у животных отмечался: легкий отек и гиперемия век, слезотечение отсутствует или выражено незначительно, конъюнктива ярко-розового цвета, умеренно отечная (Рис. 2). При гистологическом исследовании выявлена отечность стромы конъюнктивы и ее лимфоцитарная инфильтрация, нарушение хода волокон.
Пример №3.
Выполняется аналогично примеру 1, но в качестве инфекционного агента используют Pseudomonas aeruginosa, культивируют в термостате при температуре 37±2°C в аэробной среде в течение 24 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,3 млрд по стандарту мутности Тарасевича в стерильной пробирке, клинические признаки инфицирования отмечаются через 1-2 дня после введения штамма.
У животных наблюдалось угнетение общего состояния, повышение температуры тела до 40,5-41,0°C, частота пульса находилась в пределах 65-80 уд/мин, число дыхательных движений, также было увеличено и составляло 53-55 в минуту. Регистрировались следующие симптомы внутриглазного инфекционного процесса после введения культуры: значительное количество гнойного отделяемого на веках и в конъюнктивальной полости, ярко выраженная смешанная инъекция глазного яблока, роговица отечная, утолщена, инфильтрирована, слезотечение, светобоязнь, цилиарная болезненность, радужная оболочка отечная, гиперемирована, рисунок нечеткий (Рис. 3). В гистологической структуре глаза выявлены у животных такие изменения как (Рис. 4, 5): роговица отечна, явления диффузной полиморфно-клеточной воспалительной инфильтрации стромы, лейкоцитарная инфильтрация радужки с очагами гнойного расплавления, в цилиарном теле скопления воспалительных клеток, признаки увеита в хориоидее, лимфоцитарная инфильтрация слоев сетчатки.
Таким образом, оптимальным является пример 3. Рассмотренный способ способствует развитию внутриглазного инфекционного процесса, который затрагивает переднюю камеру глаза, в том числе, радужную оболочку, роговицу, цилиарное тело, а также сосудистую оболочку и сетчатку.
Предлагаемое изобретение по сравнению с прототипом и другими известными техническими решениями имеет следующие преимущества: создана технически простая и высоко воспроизводимая модель внутриглазного инфекционного процесса с одновременной возможностью регулирования желаемой степени тяжести повреждения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования внутрибрюшного синегнойного инфекционного процесса | 2019 |
|
RU2725136C1 |
| Способ моделирования интраперитонеального стафилококкового инфекционного процесса | 2019 |
|
RU2723745C1 |
| СПОСОБ ОБРАБОТКИ КУЛЬТУРЫ STAPHYLOCOCCUS AUREUS КИСЛОРОДОСОДЕРЖАЩИМ ГАЗОМ ИЗ ПОРТАТИВНОГО ОЗОНАТОРА | 2018 |
|
RU2709720C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2012 |
|
RU2480845C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОЙ СЫВОРОТКИ ПРОТИВ ПСЕВДОМОНОЗА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2008 |
|
RU2376034C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОЙ ДОЗЫ АНТИСЕПТИЧЕСКОГО ПРЕПАРАТА, ЭЛЕКТРОЛИЗНОГО РАСТВОРА ГИПОХЛОРИТА НАТРИЯ, ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1995 |
|
RU2114913C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО РАЗЛИТОГО ПЕРИТОНИТА У КРЫС | 2010 |
|
RU2427925C1 |
| АНТИБАКТЕРИАЛЬНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО В ФОРМЕ КАПЕЛЬ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ БОЛЕЗНЕЙ У ЖИВОТНЫХ | 2015 |
|
RU2580630C1 |
| ВАКЦИНА ПОЛИВАЛЕНТНАЯ ПРОТИВ ПСЕВДОМОНОЗА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2006 |
|
RU2308288C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО АТРОФИЧЕСКОГО РИНИТА И ПАСТЕРЕЛЛЕЗА СВИНЕЙ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2021 |
|
RU2763991C1 |


Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано для моделирования внутриглазного инфекционного процесса. Стерильную иглу вводят в переднюю камеру глаза и отбирают внутриглазную жидкость в объеме 0,1 мл. После этого иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси штамма, причем в качестве инфекционного агента используют Pseudomonas aeruginosa. Культуру предварительно засевают с помощью бактериальной петли в пробирки с мясо-пептонным агаром, культивируют в термостате при температуре 37±2°С в аэробной среде в течение 24 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,3 млрд по стандарту мутности Тарасевича в стерильной пробирке. Клинические признаки инфицирования отмечаются через 1-2 дня после введения штамма. Способ обеспечивает создание технически простой и высоко воспроизводимой модели внутриглазного инфекционного процесса с одновременной возможностью регулирования желаемой степени тяжести повреждения в результате наличия информации о времени после инфицирования, когда регистрировались первые клинические признаки офтальмопатологии, о способе получения и концентрации микробных клеток штамма Pseudomonas aeruginosa, необходимых для заражения. 5 ил., 3 пр.
Способ моделирования внутриглазного инфекционного процесса, включающий введение стерильной иглы в переднюю камеру глаза и отбор внутриглазной жидкости в объеме 0,1 мл, причем после этого иглу оставляют в глазу, шприц заменяют и вводят равный объем взвеси штамма, отличающийся тем, что в качестве инфекционного агента используют Pseudomonas aeruginosa, причем культуру предварительно засевают с помощью бактериальной петли в пробирки с мясо-пептонным агаром, культивируют в термостате при температуре 37±2°С в аэробной среде в течение 24 часов, после чего осторожно смывают ее физиологическим раствором и доводят концентрацию микробных клеток в 1 мл до 1,3 млрд по стандарту мутности Тарасевича в стерильной пробирке, клинические признаки инфицирования отмечаются через 1-2 дня после введения штамма.
| VAN HORN D.L | |||
| et al | |||
| Experimental Pseudomonas keratitis in the rabbit: bacteriologic, clinical, and microscopic observations | |||
| Invest Ophthalmol Vis Sci | |||
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
| Способ моделирования герпес-синегнойной инфекции роговой оболочки глаза | 1989 |
|
SU1691872A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2012 |
|
RU2480845C1 |
| Щипцы для сшивания бумаг | 1929 |
|
SU16186A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГЕРПЕС-СТАФИЛОКОККОВОЙ ЯЗВЫ РОГОВОЙ ОБОЛОЧКИ | 1997 |
|
RU2187843C2 |
| Способ моделирования инфекционного поражения роговицы | 1990 |
|
SU1784227A1 |
Авторы
Даты
2019-09-16—Публикация
2018-09-10—Подача