Изобретение относится к медицине, а именно к офтальмологии, и предназначено для моделирования грибкового кератоувеита с формированием язвы роговицы у кроликов в экспериментальных условиях с целью изучения механизмов происхождения и течения патологического процесса и разработки метода медикаментозной терапии.
В литературе растет число сообщений об увеличении доли грибковых кератитов в структуре инфекционных воспалений роговицы. В то же время этиологическое лечение окуломикозов остается недоступным в большинстве стран, в том числе и в Российской Федерации. [Давлетшина Н.И., Самойлов А.Н. Эпидемиология и методы лечения грибковых кератитов. Вестник офтальмологии. 2020; 136(4): 138-145.]. Если предположить, что все случаи с отрицательным микробиологическим посевом являются грибковыми, ежегодная заболеваемость составит 1.480.916 случаев (1.036.641-1.925.191) [The global incidence and diagnosis of fungal keratitis. Accessed 01.09.21. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30448-5/fulltext].
Разработка эффективных и безопасных лекарственных средств местного этиологического лечения кератомикозов является приоритетной задачей для борьбы с окуломикозами. Создание воспроизводимых экспериментальных моделей кератомикозов на животных несомненно необходимо для изучения механизмов заражения, течения патологического процесса и разработки методик лечения.
Модели in vivo с отработкой способа на экспериментальных животных наиболее точно отражают патологические исходы процесса, в то же время эти протоколы сложны для реализации и требуют строго соблюдения этических норм. Одна из основных проблем экспериментальной медицины - выбор вида животных, на которых будут проводиться исследования. Для изучения закономерностей грибкового процесса на глазах выбраны кролики. Все эксперименты in vivo, описанные в данной работе, одобрены локальным этическим комитетом ФГБОУ ВО «Казанский государственный медицинский университет» МЗ РФ (заседание №1 от 4 февраля 2020 года).
В литературе описано немало аналогов, содержащих разнообразные способы моделирования грибкового кератита у экспериментальных животных.
Известны современные способы создания грибковых кератитов в рамках эксперимента у животных при помощи инстилляции и интрастромальной инъекции суспензии грибковых изолятов с обеспечением условий для инвазии инфекционного агента и формирования воспаления, близкого к клиническому.
Из известных отечественных разработок стоит отметить способ достижения грибкового кератита у кроликов (Патент RU №2346338 С2, МПК G09B 23/28, A61F 9/00 - 10.02.2009, Бюл. №4). Производится скарификация эпителия всей поверхности роговицы, далее надевают на глаз предварительно инфицированную дрожжевыми грибами мягкую контактную линзу и сшивают веки на 3-8 суток. Заявленный метод позволял достичь клинической картины грибкового кератита с контролируемыми стадиями процесса.
Недостатком данного способа является травматичность процедуры, необходимость хирургической блефарорафии. Также нам не удалось достичь выраженной картины грибкового кератита по заявленной методике.
Аналогичным методом с интрастромальным введением инокулята является способ моделирования грибкового кератита у кроликов посредством интракорнеального введения 0,1 мл клеточной взвеси грибков (2,5 × клеток/мл) [Schreiber, W., Olbrisch, A., Vorwerk, С., Koenig, W., Behrens-Baumann, W. Combined topical fluconazole and corticosteroid treatment for experimental Candida albicans keratomycosis. Investigative ophthalmology & visual science, 44(6): 2634-2643].
Недостатком данного способа является слабая контагиозность грибков Candida albicans, также воспроизвести грибковый кератит по заявленной методике при выполнении только лишь инъекции с грибковой суспензией нам не удалось.
Заявленный метод инфицирования кандидозным кератитом, в котором предварительно производят инстиляции гентамицина сульфата 0,5% 2 раза в сутки или глазных капель хлорамфеникола 0,2% без консервантов. Суспензию грибов вводят непосредственно в роговицу через канюлю 27G [Rabbit Model of Candida Keratomycosis. M. Motschmann W. Behrens-Baumann. Handbook of Animal Models of Infection. Experimental Models in Antimicrobial Chemotherapy, 1999, Pages 697-707].
Недостатком данного способа является слабая контагиозность грибков Candida albicans, к тому же для нашей практики большее значение имеет Fusarium spp.
Известен «Способ создания экспериментальной модели грибкового кератита у кроликов» (Патент RU №2746647, МПК G09B 23/28 - 19.04.2021, Бюл. №11). Способ создания экспериментальной модели грибкового кератита у кроликов заключается в том, что под местной анестезией на роговицу накладывают смоченный в 5% спиртовом растворе формалина стерильный диск из гемостатической губки, надевают мягкую контактную линзу на 24 часа, на следующий день снимают мягкую контактную линзу и диск гемостатической губки, на поверхность роговицы в течение 3 дней инстиллируют 0,1% раствор дексаметазона 4 раза в сутки, на 3-й день под местной инфильтрационной анестезией производят скарификацию эпителия роговицы размером 10×10 мм, инстиллируют на роговицу 99% концентрат димексида, далее производится орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия, на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 3-4 подхода производят дополнительное орошение роговицы, отодвинув мягкую контактную линзу, 99% концентратом димексида, свежей клинической суспензией грибковых изолятов Fusarium spp. 106 КОЕ/мл.
Данный патент принят за прототип.
Этот способ неоднократно воспроизведен в рамках экспериментального исследования, однако основным его недостатком является не достаточная глубина расположения инфильтрата, абсолютное самоизлечение у экспериментальных животных и низкий риск потери органа зрения. В клинической практике грибковые кератиты часто приводят к сквозному поражению стромы и перфорации роговицы.
В условиях эксперимента воспроизведение глубокого стромального поражения роговицы по известным методам оказалось трудоемким и безрезультативным. Нами была произведена скарификация эпителия роговицы и применение контактных линз. Необходимым условием для развития грибковой инфекции роговицы явились повреждение эпителия и локальная иммуносупрессия. По этой причине наша методика отличается однократным применением 5% спиртового раствора формалина и инстиляций дексаметазона на этапе подготовки к заражению, а также применением 99% концентрата димексида в момент орошения роговицы кролика клинической суспензией Fusarium spp, и, в отличие от изобретения-прототипа, интрастромальная инъекция 0,1 мл инокулята при каждом сеансе заражения. Таким образом, в 4-5 приемов был достигнут кератоувеит с изъязвлением роговицы у экспериментального животного, что делает результат клинически актуальным. Для приготовления инокулюма также, как и в прототипном способе, использованы чистые, пяти суточные культуры грибов Fusarium solani, выросшие на плотной питательной среде Сабуро. Инокулят предварительно растерт в ступке. В стерильном изотоническом растворе хлорида натрия приготовлена взвесь микроорганизмов с конечной плотностью 1,0×106 клеток/мл, что соответствует 0,5 MF (измерение денситометром согласно данным изготовителя стандартов мутности bioMerieux).
Задачей заявляемого изобретения является разработка достоверно воспроизводимой экспериментальной модели грибкового кератоувеита с изъязвлением роговицы у кроликов, не требующей специального офтальмохирургического оборудования, что позволит расширить возможности для исследования возникновения и течения патологического процесса и разработки местного этиологического лечения.
Техническим результатом заявленного изобретения является достоверно производимый грибковый кератоувеит с изъязвлением роговицы с применением клинической суспензии Fusarium spp.
Технический результат заявленного изобретения достигается за счет того, что под местной анестезией 0,4% оксибупрокаина на роговицу накладывают смоченный в 5% спиртовом растворе формалина стерильный диск из гемостатической губки размером 10×10 мм, надевают мягкую контактную линзу на 24 часа, на следующий день снимают мягкую контактную линзу и диск гемостатической губки, далее на поверхность роговицы в течение 3 дней инстилируют 0,1% раствор дексаметазона 4 раза в сутки, на 3-ий день под местной инфильтрационной анестезией производят скарификацию эпителия роговицы размером 10×10 мм, особенность заключается в том, что инсулиновым шприцем с интегрированной иглой 29G производят интрастромальную инъекцию 0,1 мл 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., инстилируют на роговицу 2-3 капли 99% концентрата димексида, далее производится орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия, на внутреннюю поверхность мягкой контактной линзой наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 5-6 подходов производят дополнительные процедуры заражения роговицы, сняв мягкую контактную линзу, орошая 99% концентратом димескида, свежей клинической суспензией грибковых изолятов Fusarium spp. 106 КОЕ/мл совместно с интрастромальной инъекцией.
Преимуществом приведенного алгоритма является достоверность воспроизведения патологического процесса, сравнимого с клиническим, малоинвазивные методы инъекций при помощи малотравматичных игл, осуществляемые под инстилляционной анестезией, результативности предварительной подготовки инстиляциями медицинских растворов.
Детали, признаки, а также преимущества настоящего изобретения следует из нижеследующего описания реализации заявленного технического решения с использованием фигур, на которых показано:
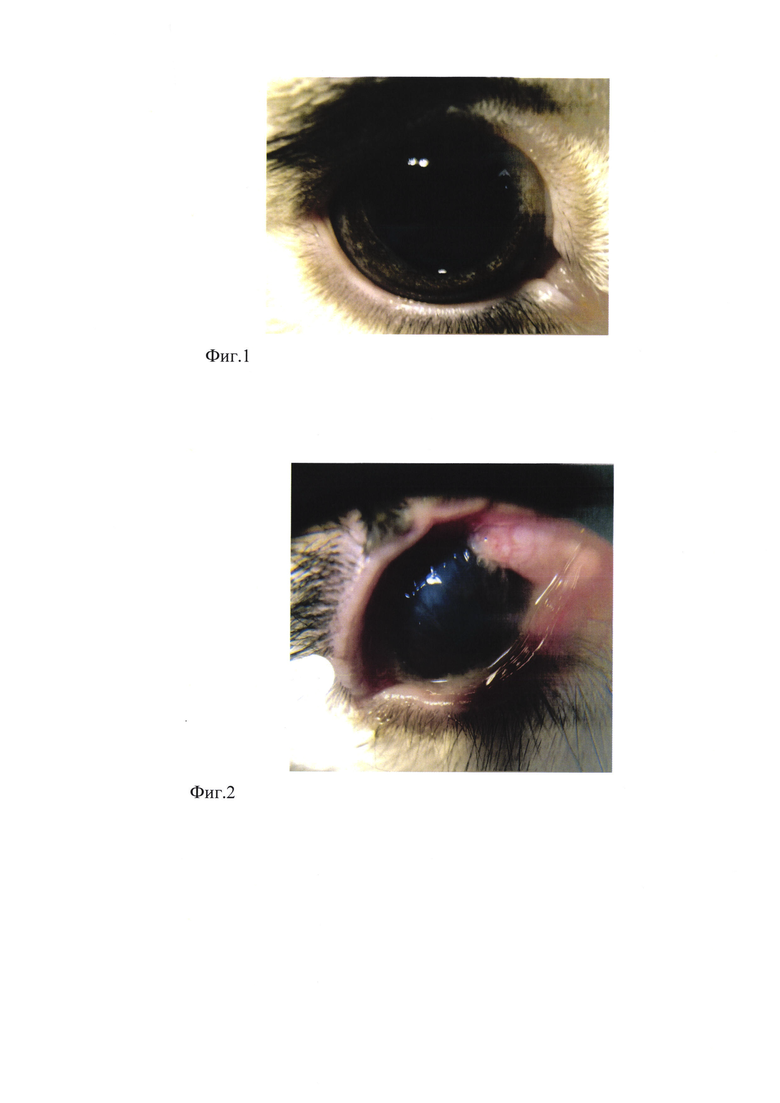
Фиг. 1 - здоровая роговица экспериментального животного (кролик породы «советская шиншилла») перед началом экспериментального заражения;
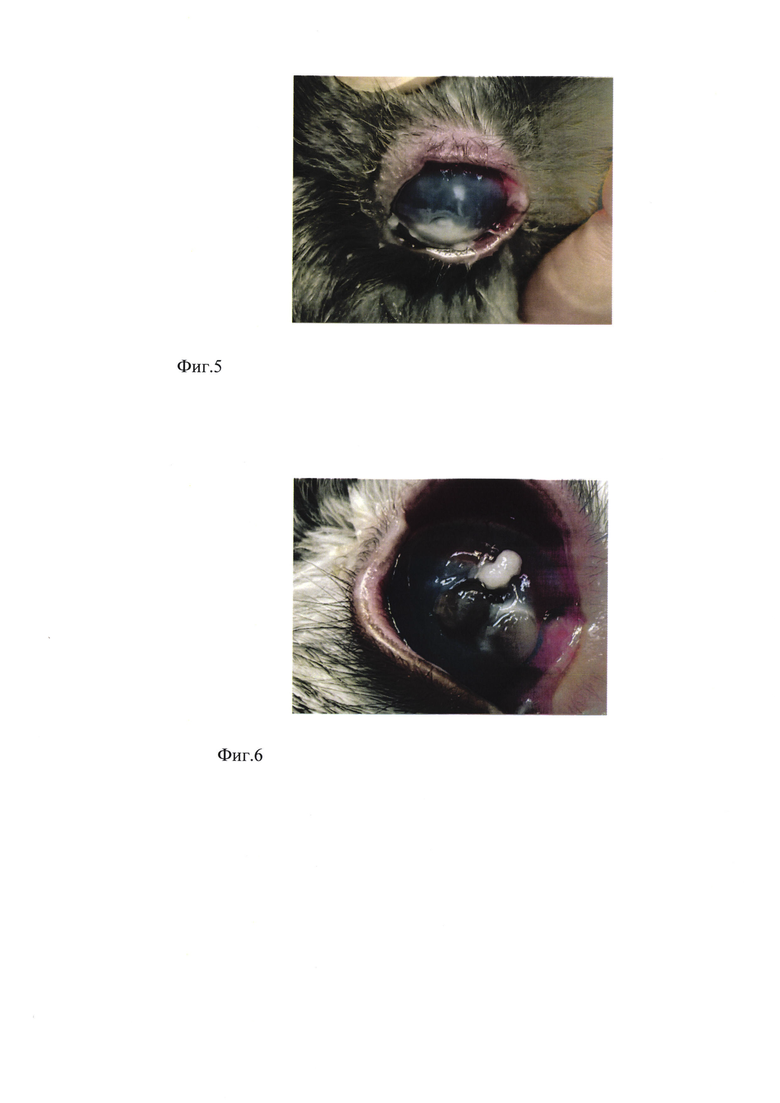
Фиг. 2 - результат аппликации стерильной гемостатической губки в 5% спиртовом растворе формалина под мягкой контактной линзой в течение 1 суток: смешанная инъекция сосудов конъюнктивы, слизистое отделяемое, эпителиопатия, выраженный роговичный синдром;
Фиг. 3 - момент интрастромальной инъекции клинической суспензией грибковых изолятов Fusarium spp.;
Фиг. 4 - вид роговицы под мягкой контактной линзой сразу после интрастромальной инъекции клинической суспензией грибковых изолятов Fusarium spp., орошения поверхности роговицы этой же суспензией;
Фиг. 5 - Кератоувеит с изъязвлением роговицы у кролика в результате экспериментального заражения роговицы кролика клинической суспензией грибковых изолятов Fusarium spp. по описанной методике;
Фиг. 6 - Перфорация язвы роговицы у кролика в результате экспериментального заражения роговицы кролика клинической суспензией грибковых изолятов Fusarium spp. по описанной методике на 14-ый день от первой процедуры заражения.
Способ осуществляется следующим образом.
Производится экспозиция в 5% спиртовом растворе формалина диска размером 10×10 мм стерильной гемостатической губки. Под местной анестезией 0,4% оксибупрокаина губка устанавливается на поверхность роговицы, надевается обычная мягкая контактная линза на 24 часа. На следующий день диск гемостатической губки и мягкая контактная линза удаляются. В течение последующих 3 дней производятся инстиляции 0,1% дексаметазона 4 раза в сутки в исследуемый глаз. На 3-ий день под местной инфильтрационной анестезией 0,4% оксибупрокаина производится скарификация эпителия стерильным микрохирургическим лезвием в оптической зоне 10×10 мм. Инсулиновым шприцем с интегрированной иглой 29G производят интрастромальную инъекцию 0,1 мл 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp. Инстилируется 2-3 капли 99% концентрата димексида. Выжидается 20-30 минут для испарения лишнего объема лекарственных средств. Промывание роговицы и конъюнктивальной полости 0,1% р-ром дексаметазона. Производится орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензии грибковых изолятов Fusarium spp., включающей фрагменты мицелия. На внутреннюю поверхность мягкой контактной линзы наносится 0,2-0,3 мл этой же суспензии. Мягкая контактная линза надевается на роговицу. В последующие дни через 1 день в 5-6 приемов под местной анестезией производится дополнительное орошение поверхности роговицы клинической суспензией Fusarium spp., включающей фрагменты мицелия, с предварительной инстиляцией 1 капли 99% концентрата димексида и 2-3 капель 0,1% дексаметазона. Дополнительно производится интрастромальная инъекция 0,1 мл суспензии Fusarium spp., включающей фрагменты мицелия. В результате мероприятий на 10-12-ый день получают глубокий грибковый гипопион-кератоувеит с изъязвлением роговицы, на 14-ый день без лечения сформирована перфорация роговицы.
Изобретение направлено на устранение вышеописанных недостатков и достоверное воспроизведение грибкового кератоувеита с изъязвлением роговицы с причинением минимальных страданий экспериментальному животному.
Всего проведен эксперимент на 6 кроликах.
Способ поясняется следующим экспериментальным примером.
Пример 1.
Кролик (фиг. 1), у которого при культуральном исследовании мазков конъюнктивы и роговицы здорового глаза выявлен Aspergillus flavus 102 КОЕ/мл, Penicillium expansum 102 КОЕ/мл, S. aureus 101 КОЕ/мл, Enterobacteriaceae 101 КОЕ/мл. Роговица инфицирована по описанной методике.
На 1-й день производится экспозиция в 5% спиртовом растворе формалина диска размером 10×10 мм стерильной гемостатической губки. Под местной анестезией 0,4% оксибупрокаина губка устанавливается на поверхность роговицы, надевается обычная мягкая контактная линза на 24 часа. На следующий день диск гемостатической губки и мягкая контактная линза удаляются.
После обработки роговицы 5% спиртовым раствором формалина развилась клиническая картина химического ожога конъюнктивы и роговицы: смешанная инъекция сосудов конъюнктивы, обильное слизистое отделяемое, эпителиопатия, выраженный роговичный синдром (фиг. 2). Бактериологический и микологический посев мазка отделяемого конъюнктивальной полости, забранного в этот день, роста микрофлоры не обнаружил, таким образом достигнуто асептическое воспаление.
В течение последующих 3 дней производятся инстиляции 0,1% дексаметазона 4 раза в сутки в исследуемый глаз. На 3-й день инстиляций дексаметазона под местной анестезией 0,4% оксибупрокаина проведена скарификация эпителия стерильным микрохирургическим лезвием в оптической зоне 10×10 мм. Инсулиновым шприцем с интегрированной иглой 29G произведена интрастромальная инъекция 0,1 мл 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp (фиг. 3). Инстилируется 2-3 капли 99% концентрата димексида. Выжидается 20-30 минут для испарения лишнего объема лекарственных средств. Промывание роговицы и конъюнктивальной полости 0,1% р-ром дексаметазона. Далее производится орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензии грибковых изолятов Fusarium spp., включающей фрагменты мицелия. На внутреннюю поверхность мягкой контактной линзы наносится 0,2-0,3 мл этой же суспензии. Мягкая контактная линза надевается на роговицу (фиг. 4). Повторно мероприятия проводились через 1 день в 5-6 приемов.
В результате вышеописанного алгоритма получен глубокий грибковый гипопион-кератоувеит с изъязвлением роговицы (фиг. 5), на 14-й день без лечения сформирована перфорация роговицы (фиг. 6), что является сопоставимым прогнозом развития грибкового кератита при отсутствии лечения в клинических случаях.
Применение спиртового раствора формалина позволяет полностью санировать конъюнктивальную полость экспериментальных животных, что подтверждено культуральными данными в начале исследования, получить химический ожог легкой степени и инициировать асептическое воспаление. Инстиляции дексаметазона позволяют достичь местной иммунносупрессии и предотвратить самостоятельную санацию условно-патогенного Fusarium spp. При электронной микроскопии соскобов с роговицы выявлено, что применение димексида способствует повышению адгезии грибковых элементов к эпителию, боуменовой оболочке и строме, что в результате улучшает результативность контаминации. Отсутствие мягкой контактной линзы приводит к самопроизвольной санации даже при выполнении вышеописанных условий. Интрастромальные инъекции позволили достичь картины агрессивного течения кератита, сопоставимого с клиническим.
Таким образом, заявленная методика позволяет воспроизвести глубокий грибковый кератоувеит с изъязвлением роговицы у кроликов с применением микроинвазивной травмы у экспериментальных животных, формалин обеспечивает предварительное обеззараживание конъюнктивальной полости, дополнительное применение дексаметазона подавляет защитные механизмы местного иммунитета, а димексид способствует повышению адгезии мицелии грибов в клинической суспензии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| Способ моделирования грибкового кератита у кроликов | 2023 |
|
RU2823978C1 |
| Способ лечения грибковой язвы роговицы | 2021 |
|
RU2802388C2 |
| Способ лечения грибкового кератита после сквозной кератопластики | 2022 |
|
RU2820070C2 |
| Лекарственное средство для лечения резистентного грибкового кератита и способ его применения | 2022 |
|
RU2790703C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| НОВАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 2010 |
|
RU2481100C2 |
| Лечение резистентного бактериального кератита с помощью мягкой контактной линзы на квантовых точках | 2023 |
|
RU2811935C1 |
| СПОСОБ БИОПОКРЫТИЯ ПОРАЖЕННОЙ РОГОВИЦЫ | 2023 |
|
RU2813951C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2012 |
|
RU2480845C1 |

Изобретение относится к медицине, а именно к офтальмологии. Осуществляют аппликацию смоченным в 5% спиртовом растворе формалина стерильным диском из гемостатической губки размером 10×10 мм под местной анестезией 0,4% оксибупрокаина. Надевают мягкую контактную линзу на 24 часа, на следующий день снимают мягкую контактную линзу и диск гемостатической губки. Далее на поверхность роговицы в течение 3 дней инстиллируют 0,1% раствор дексаметазона 4 раза в сутки, на 3-й день под местной инфильтрационной анестезией производят скарификацию эпителия роговицы размером 10×10 мм. После скарификации инсулиновым шприцем с интегрированной иглой 29G производят интрастромальную инъекцию 0,1 мл 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp. Затем инстиллируют 2-3 капли 99% концентрата димексида, промывают роговицу и конъюнктивальную полость 0,1% раствором дексаметазона. После чего осуществляют орошение конъюнктивальной поверхности и роговицы 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия. Далее на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу. В последующие дни через 1 день за 5-6 подходов проводят дополнительные процедуры заражения роговицы, сняв мягкую контактную линзу, выполняют орошение 99% концентратом димескида, свежей клинической суспензией грибковых изолятов Fusarium spp. 106 КОЕ/мл совместно с интрастромальной инъекцией. Способ позволяет достоверно воспроизвести экспериментальную модель грибкового кератоувеита с изъязвлением роговицы у кроликов, не требует специального офтальмохирургического оборудования, при этом позволяет расширить возможность для исследования возникновения и течения патологического процесса и разработать местное этиологическое лечение. 1 пр., 6 ил.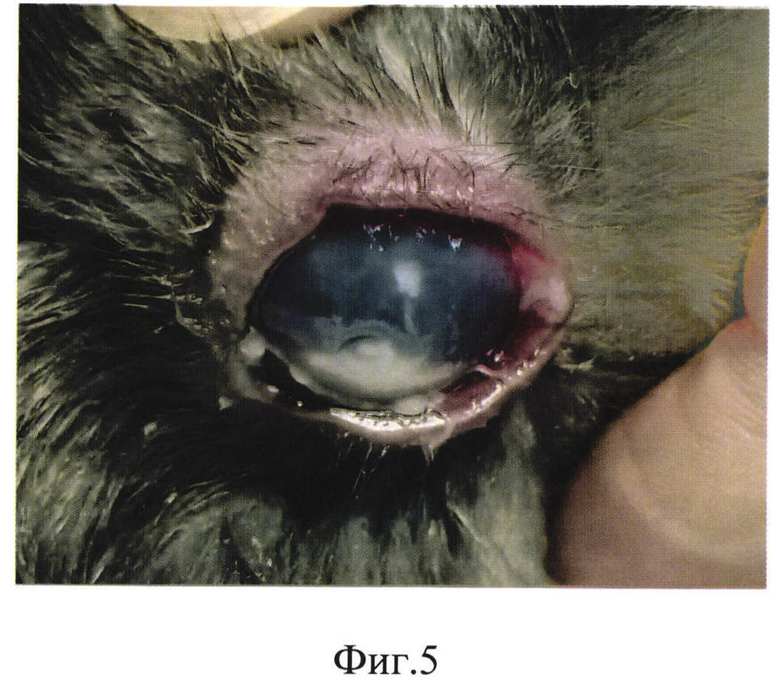
Способ создания экспериментальной модели грибкового кератоувеита у кроликов, включающий последовательное проведение аппликации смоченным в 5% спиртовом растворе формалина стерильным диском из гемостатической губки размером 10×10 мм под местной анестезией 0,4% оксибупрокаина, надевания мягкой контактной линзы на 24 часа, снятия мягкой контактной линзы и диска гемостатической губки, инстилляции на поверхность роговицы 0,1% раствора дексаметазона 4 раза в сутки в течение 3 дней, скарификации эпителия роговицы размером 10×10 мм на 3-й день под местной инстилляционной анестезией, отличающийся тем, что после скарификации инсулиновым шприцем с интегрированной иглой 29G производят интрастромальную инъекцию 0,1 мл 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., затем инстиллируют 2-3 капли 99% концентрата димексида, промывают роговицу и конъюнктивальную полость 0,1% раствором дексаметазона, после чего осуществляют орошение конъюнктивальной поверхности и роговицы 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия, далее на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 5-6 подходов проводят дополнительные процедуры заражения роговицы, сняв мягкую контактную линзу, выполняют орошение 99% концентратом димескида, свежей клинической суспензией грибковых изолятов Fusarium spp. 106 КОЕ/мл совместно с интрастромальной инъекцией.
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ В ЭКСПЕРИМЕНТЕ РЕЦИДИВИРУЮЩЕЙ ЭРОЗИИ РОГОВИЦЫ | 2019 |
|
RU2709834C1 |
| Прибор для определения липкости хлебного мякиша, теста и т.п. материалов | 1941 |
|
SU66829A1 |
| Давлетшина Н.И., Самойлов А.Н | |||
| Эпидемиология и методы лечения грибковых кератитов | |||
| Вестник офтальмологии | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Schreiber W | |||
| et al | |||
| Combined topical fluconazole and corticosteroid treatment for experimental Candida albicans | |||
Авторы
Даты
2022-03-24—Публикация
2021-06-25—Подача