Предлагаемое изобретение относится к офтальмологии и предназначено для моделирования воспалительных заболеваний роговицы грибкового генеза.
Анализ данных о распространенности слепоты в России показывает, что частота обращаемости по поводу воспалительных заболеваний глаз составляет в среднем 2650 на 100 тыс. населения. По данным амбулаторного приема воспалительные заболевания глаз занимают 1, 2 место, уступая лишь аномалиям рефракции. На сегодняшний день по расчетным данным по России среди общего числа больных с воспалительными заболеваниями глаз на кератиты приходится 4,2% больных. Для отработки оптимальных параметров лечения поражений роговицы необходимо создание экспериментальной модели кератита на животных. Одна из основных проблем экспериментальной медицины - выбор вида животных, на которых будут проводиться исследования. Оптимальным животным для изучения инфекционного процесса на глазах являются кролики.
Ближайшим аналогом предлагаемого изобретения является способ того же назначения, включающий моделирование грибкового кератита на кроликах посредством интракорнеального введения 0.1 мл клеточной взвеси грибков (2.5×107 клеток/мл) [Combined Topical Fluconazole and Corticosteroid Treatment for Experimental Candida albicans Keratomycosis Wolfram Schreiber et al Investigative Ophthalmology and Visual Science. 2003; 44:2634-2643].
Описанный способ характеризуется следующими недостатками.
1. Требуется проведение сложной инракорнеальной инъекции, а так же необходимость в дорогостоящем оборудовании - операционного микроскопа в виварии.
2. Невозможность регулирования степени тяжести поражения.
Задачей изобретения являлась разработка такого способа моделирования инфекционных поражений роговицы, который не требует дорогостоящего оборудования, прост в исполнении, позволяет контролировать степень поражения роговицы.
Техническим результатом изобретения является создание технически простой и высокопризводимой модели кератомикоза с одновременной возможностью регулирования желаемой степени тяжести повреждения.
Технический результат достигается за счет стабильного инфицирования с исключением вымывания грибкового агента с поверхности роговицы с помощью создания условий для инкубации грибка посредством использования контактной линзы, предварительно инфицированной дрожжевым грибом, и его внедрения в строму роговицы.
Перед нанесением инфекционного агента производим скарификацию всей поверхности роговицы для устранения барьера инфицирования (эпителий роговицы) и создания возможности для грибковой инвазии. Затем на глаз надеваем инфицированную дрожжевыми грибами мягкую контактную линзу (МКЛ). Применение инфицированной МКЛ создает оптимальные условия инкубации дрожжевой грибковой инфекции за счет постоянного во времени контакта роговицы и инфекционного агента. Веки кролика сшиваются на время 3 суток - для получения кератита легкой тяжести, 5 суток - для получения кератита средней тяжести, 8 суток - для получения тяжелого кератита.
Для создания модели кератомикоза дрожжевые грибы выращивали по известной схеме: смыв суточной культуры со скошенного сусло-агара (30°С) вносили в колбы объемом 500 мл, содержащие 100 мл жидкой среды следующего состава: NH4H2PO4 - 2 г/л, (NH4)2HPO4 - 0,5 г/л, K2SO4 - 0,2 г/л, MgSO4 - 0,2 г/л, 2% дрожжевого автолизата и 1% сахарозы (начальное значение рН 5,7), и выращивали на качалке (230 об/мин) при 32° в течение 4-8 ч. Перед экспериментами выращенные клетки дважды отмывали дистиллированной водой (1500g, 5 мин) и разводили в минеральной среде до концентрации клеток 0,5-1 млн/мл. Подсчет клеток вели в камере Горяева. С целью инфицирования стерильную МКЛ помещали в суспензию, содержащую клетки дрожжевых грибов С. guilliermondii, и выдерживали 4 часа при 32°С до образования белого налета на поверхности МКЛ. Возможно использование и других известных дрожжевых грибов.
Способ осуществляют следующим образом. Перед началом эксперимента животным проводят общепринятую анестезию, например, с помощью препарата Гексенал (производство фирмы «Medro Inc.», Латвия), при этом расчетная доза составляет 0,2 мг на кг веса животного. Стерильным скребцом проводят скарификацию всей поверхности роговицы, после чего надевают на глаз предварительно инфицированную одним из видов дрожжевых грибов мягкую контактную линзу (МКЛ). Веки сшивают на 3 суток - для получения кератита легкой степени тяжести, 5 суток - для получения кератита средней степени тяжести, 8 суток - для получения тяжелого кератита.
Всего провели эксперимент на 30 кроликах. В 1 группе моделировали кератит легкой степени тяжести, во 2 - кератит средней степени тяжести, в 3 - тяжелый кератит.
Моделирование кератита легкой степени в группе 1.
Перед началом эксперимента 10 животным проводили общую анестезию с помощью препарата Гексенал (производство фирмы «Medro Inc.», Латвия), при этом расчетная доза составляла 0,2 мг на кг веса животного. Стерильным скребцом проводили скарификацию эпителия, после чего надевали на глаз инфицированную грибком мягкую контактную линзу (МКЛ). Веки сшивали на 3 суток.
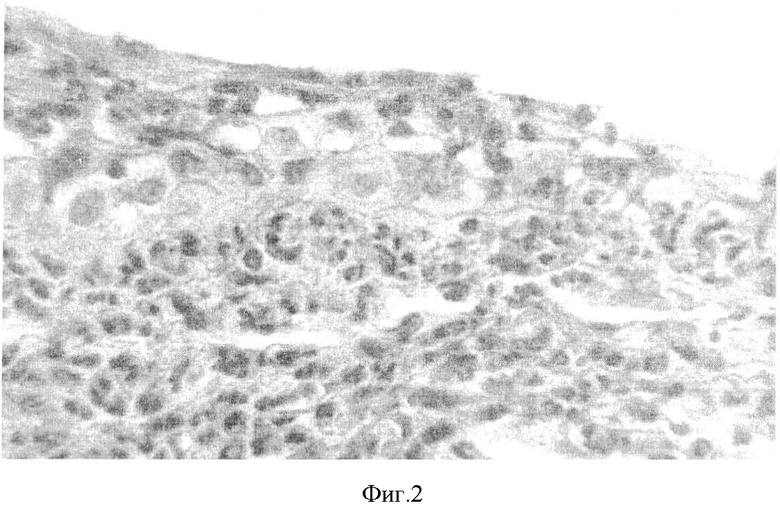
Гнойный кератит легкой степени характеризовался следующими признаками (фиг.1): площадь поражения роговицы до 3 мм в диаметре, затрагиваются только поверхностные слои роговой оболочки. На гистологической (фиг.2) картине видна дегенерация клеток эпителиального пласта. Также обращало на себя внимание истончение стромы. Это было справедливо как в отношении собственного вещества роговицы, так и в отношении переднего ее эпителия. Эпителиальный пласт характеризуется наличием умеренной эксфолиации и дегенерации эпителиоцитов, инфильтрацией лейкоцитами. Собственное вещество роговицы имело признаки отека ткани. Отдельные Коллагеновые волокна стромы были значительно утолщены и разрыхлены. В отдельных препаратах отмечена незначительная васкуляризация стромы собственного вещества роговицы. Цилиарное тело изменено не было. Таким образом, клиническая и гистологическая картина подтверждает наличие кератита легкой степени тяжести.
Моделирование кератита легкой степени в группе 2.
Для создания модели кератомикоза средней степени тяжести проводили все этапы, описанные в примере 1. Веки сшивали на 5 суток.
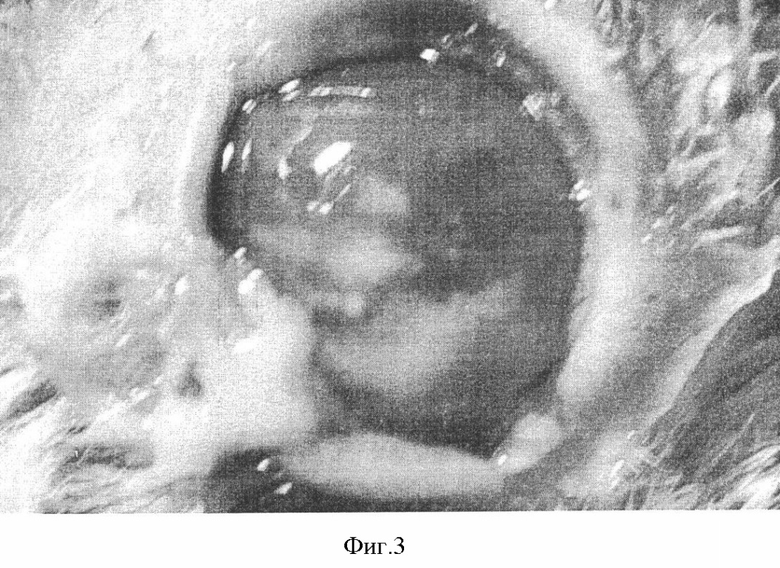
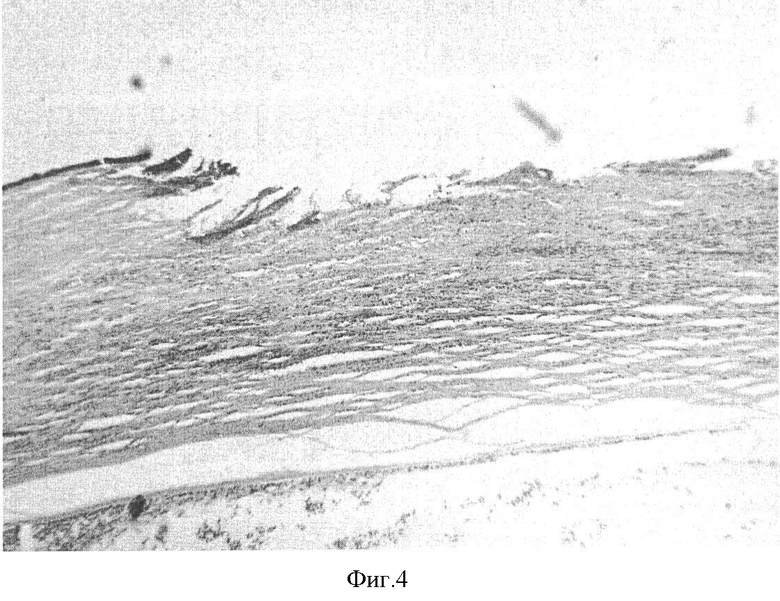
Тяжелая степень характеризовалась: площадь поражения роговицы свыше 6 мм в диаметре (фиг.3), гипопион более 2 мм высотой; и с площадью поражения от 3 до 6 мм в диаметре, но с глубокой гнойной инфильтрацией. На гистологической (фиг.4) картине мы видим образование кератита средней степени тяжести. При осмотре поверхностных слоев роговицы выявили нарушение послойной дифференцировки эпителия. Он имел неравномерную толщину и диспластические изменения. По периферии язвенной поверхности эпителий был отечный, с элементами десквамации и приобретал черты ороговевающего. Отмечалась диффузная инфильтрация лейкоцитами и эозинофилами как эпителиальных, так и стромальных слоев. Имели место выраженные явления межуточного отека ткани собственного вещества роговицы. Коллагеновые волокна стромы были умеренно утолщены, хаотически расположены, разрыхлены, неравномерно прокрашены. В ряде случаев была заметна их фрагментация. В строме просматривались новообразованные сосуды. Сосуды цилиарного тела находились в дилятированном и полнокровном состоянии. В единый конгломерат в области отростков сформировался фибринозный экссудат.
Пример 1.
Перед началом эксперимента кролику проводили общую анестезию с помощью препарата Гексенал (производство фирмы «Medro Inc.», Латвия), при этом расчетная доза составляла 0,2 мг на кг веса животного. Стерильным скребцом скарифицировали эпителий, после чего надели на глаз инфицированную грибком мягкую контактную линзу (МКЛ). Веки сшивали на 8 суток. После снятия швов при проведении офтальмоскопии площадь поражения роговицы превышала 6 мм в диаметре, отмечали сформированный гипопион более 2 мм высотой с гнойной инфильтрацией радужки.
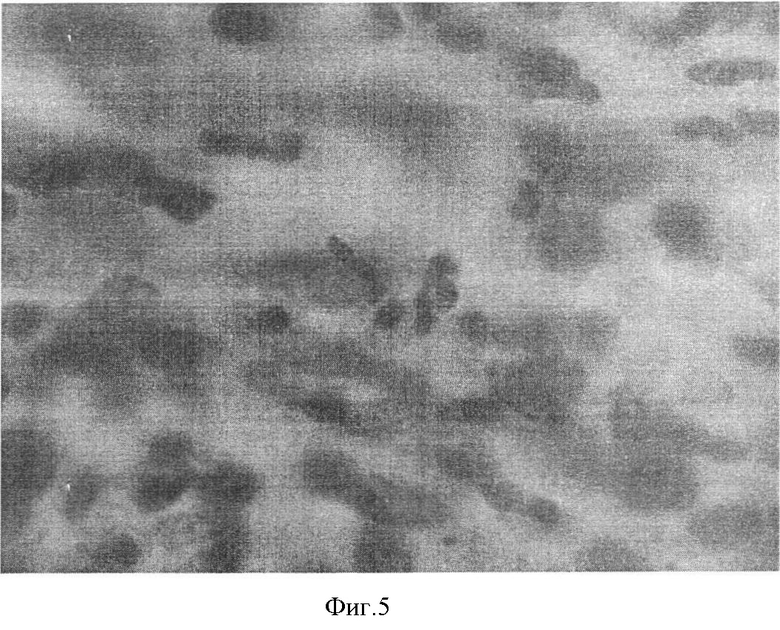
При гистологическом исследовании полутонких срезов в каждом препарате были обнаружены дрожжеподобные почкующиеся грибы рода Candida (фиг.5). Данный факт также подтверждал этиологию гнойной язвы роговицы.
Таким образом, предлагаемый способ моделирования грибкового кератита у кроликов не требует дорогостоящего оборудования, прост в исполнении, позволяет контролировать степень поражения роговицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| Способ моделирования грибкового кератита у кроликов | 2023 |
|
RU2823978C1 |
| Способ создания экспериментальной модели грибкового кератоувеита у кроликов | 2021 |
|
RU2768476C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВНУТРИГЛАЗНОГО ИНФЕКЦИОННОГО ПРОЦЕССА | 2018 |
|
RU2700403C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ КЕРАТИТОВ | 2007 |
|
RU2352367C1 |
| СПОСОБ ФЛУОРЕСЦЕНТНОЙ ДИАГНОСТИКИ ПОРАЖЕНИЙ РОГОВИЦЫ | 2007 |
|
RU2355285C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2012 |
|
RU2480845C1 |
| Лекарственное средство для лечения резистентного грибкового кератита и способ его применения | 2022 |
|
RU2790703C1 |
| Способ лечения грибковой язвы роговицы | 2021 |
|
RU2802388C2 |
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2021 |
|
RU2764121C1 |
Изобретение относится к медицине, а именно к офтальмологии, и предназначено для моделирования воспалительных заболеваний роговицы грибкового генеза. Производят скарификацию эпителия всей поверхности роговицы. Надевают на глаз предварительно инфицированную дрожжевыми грибами мягкую контактную линзу. Сшивают веки на 3-8 суток. Способ позволяет создать технически простую модель кератомикоза различной степени тяжести. 5 ил.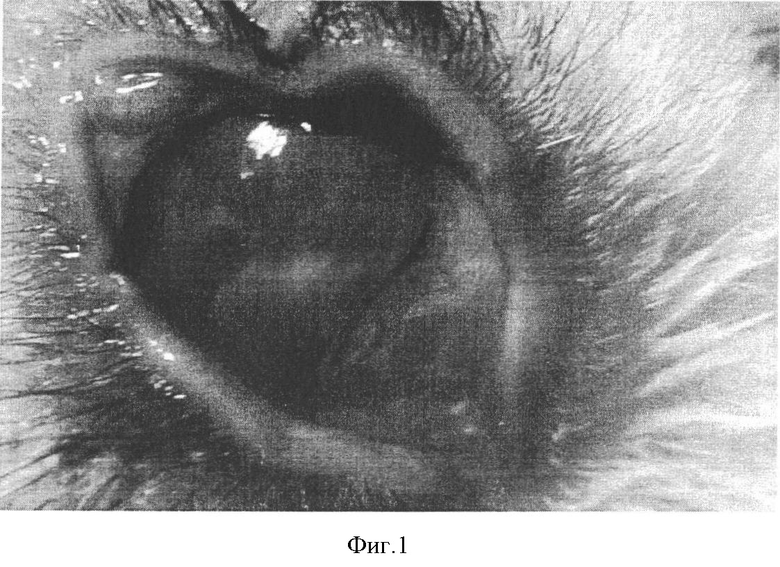
Способ моделирования грибкового кератита у кроликов, отличающийся тем, что производят скарификацию эпителия всей поверхности роговицы, после чего надевают на глаз предварительно инфицированную дрожжевыми грибами мягкую контактную линзу и сшивают веки на 3-8 сут.
| SCHREIBER W., OLBRISCH A., VORWRK CK | |||
| Combined topical fluconazole and corticosteroid treatment for experimental Candida albicans keratomycosis | |||
| Invest Ophthalmol Vis Sci | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Способ моделирования инфекционного язвенного кератита | 1983 |
|
SU1184537A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГЕРПЕС-СТАФИЛОКОККОВОЙ ЯЗВЫ РОГОВОЙ ОБОЛОЧКИ | 1997 |
|
RU2187843C2 |
| Способ моделирования инфекционного поражения роговицы | 1990 |
|
SU1784227A1 |
Авторы
Даты
2009-02-10—Публикация
2007-06-21—Подача