Изобретение относится к области медицины и может быть использовано для оценки качества биотрансплантатов, используемых в трансплантологии, в восстановительной и пластической хирургии, травматологии, комбустиологии, при лечении больных с неотложными состояниями.
Оказание высокотехнологичной медицинской помощи, определенное правительством как одна из основных задач развития здравоохранения, невозможно без широкого внедрения в клиническую практику трансплантации органов, тканей и клеток. В настоящее время клеточная и тканевая трансплантология рассматривается как одно из перспективных направлений в лечении широкого спектра патологий. Развитие клеточных технологий в области регенеративной медицины приводит к созданию новых композиционных материалов, совместимых с клетками, формированию трехмерных тканеподобных структур, предназначенных для трансплантации [О развитии клеточных технологий в Российской Федерации. МЗ CP РФ №325 от 25.07.2003. Применение клеточной терапии в клинической практике. Актуальные вопросы тканевой и клеточной трансплантологии: Сборник тезисов четвертого всероссийского симпозиума с международным участием / Под редакцией: акад. Миронова С.П. - СПб.: Изд-во «Человек и его здоровье», 2010. - 334 с.]. Применяются фибробласты, клетки костного мозга, эндотелиоциты, гепатоциты для улучшения регенерации костной и хрящевой ткани, восстановления кожных покровов, сосудов и печени в хирургии, комбустиологии, травматологии [Грудянов А.И., Ерохин А.И., Миронова Л.Л., Конюшко О.И. Лабораторное исследование активности фибробластов в сочетании с различными видами подсадочных материалов in vitro. Цитология 2001; 43:9: 854. Грудянов А.И., Ерохин А.И. «Способ вестибулопластики», Патент на изобретение РФ №2162663 от 10.02.2001; Шурыгина О.В. Использование культуры клеток аллогенных фибробластов в комплексном лечении альвеолита Автореф. дисс. канд. мед. наук. М., 2006. С.29; А.С.Ермолов, С.В.Смирнов, В.Б.Хватов и соавт. «Способ лечения ожоговой раны», патент на изобретение РФ №2373944 от 27.11.09; Колокольцова Т.Д., Нечаева Е.А., Юрченко Н.Д. и соавт. «ШТАММ ДИПЛОИДНЫХ КЛЕТОК ЧЕЛОВЕКА ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ (ВАРИАНТЫ)», патент на изобретение РФ №2285040 С2 (51) от 10.10.2006]. В дальнейшем началась разработка новых биологически активных материалов на основе тканей человека и животных, создание композиционных биотрансплантатов с различными носителями, включающими живые клетки. Это отражено в сборнике тезисов четвертого Всероссийского симпозиума с международным участием «Актуальные вопросы тканевой и клеточной трансплантологии», СПб., 2010, специалисты предлагают для клинического использования: клеточно-тканевой трансплантат на основе деминерализованованого губчатого вещества кости, содержащий мультипотентные мезенхимальные стромальные клетки из костного мозга (Волова Л.Т. и соавт., с.42); тканеинженерный эквивалент кости (Деев Р.В. и соавт., с.62); комбинированный клеточно-тканевой трансплантат при пластике дефектов суставного гиалинового хряща (Котельников Г.П. и соавт., с.81); применение мультипотентных мезенхимальных стромальных клеток (мм ск) на деминерализованых костно-хрящевых матриксах для восстановления поврежденых суставных поверхностей (Григорян А.С. и соавт., с.161); биодеградируемые полимерные носители для культивирования и трансплантации клеток кожи человека, (Швед Ю.А. и соавт., с.202); мультипотентные мезенхимальные стромальные клетки в составе гидрогелей, микросфер и широкопористых криогелей на основе альгината (Петренко А.Ю. и соавт., с.177); композитные материалы на основе полимерных матриц с интегрироваными стволовыми клетками и нанокомпонентами (Смирнова Н.В. и соавт., с.187).
Таким образом, изготовление биотрансплантатов связано с широким использованием разных типов культивируемых клеток человека. При этом неизбежно возникает проблема объективного контроля взаимодействия клеточных культур в составе предлагаемого биотрансплантата, в первую очередь, с определением количества и качества клеток.
Существует метод оценки численности культуры клеток в суспензии с помощью счетной камеры (Бенюмович М.С. «СЧЕТНАЯ КАМЕРА С СЕТКАМИ ГОРЯЕВА», патент РФ №212630, МПК А61В 10/00, 1999.02). Однако этот метод не может быть использован, так как для его применения требуется отделение клеток от биотрансплантата, что технически невыполнимо при создании монослоя клеток; кроме того, этот метод не позволяет осуществить проведение полноценного качественного анализа клеток. Отметим, что для характеристики любой культуры клеток требуется ее комплексная оценка. Эта интегральная оценка культуры складывается из таких показателей, как соотношение живых и мертвых клеток, динамика роста популяции клеток, скорость формирования монослоя (Герасимов И.Г., Попандопуло А.Г. "Оценка жизнеспособности клеток по их морфометрическим параметрам на примере культивируемых фибробластов" // Цитология. 2007. 49(3) С.204-209).
Прототип: Квитко О.В.; Николаевич Л.Н. Способ анализа популяции фибробластов человека (патент РФ №2017818, 15.08.1994). Фибробласты человека, полученные из кожно-мышечной ткани 7-8-недельных эмбрионов человека, культивируют в среде Игла, содержащей 10% сыворотки крупного рогатого скота. В логарифмической фазе роста проводят трипсинизацию клеток с помощью 0,02% раствора Версена и 0,25% раствора трипсина при 4°С (2 мин) с последующей инкубацией в термостате при 37°С (до 10 мин). На чашки Петри (диаметром 35 мм) высевают клетки в концентрации 100-500 кл/мм2. Клетки инкубируют в условиях насыщающей влажности при 37°С с 5% СО2 в течение 20-24 часов. Для определения концентрации клеток в культуре используют метод подсчета клеток в камере Горяева.
Популяция нормальных фибробластов человека включает две субпопуляции клеток. Одни фибробласты обладают высоким пролиферативным потенциалом и при клонировании образуют многоклеточные колонии (I тип), а другие имеют низкий митотический потенциал и в клональных условиях дают малоклеточные, рыхлые колонии (II тип). Морфологически первые представляют собой веретеновидные клетки, а вторые - парусовидные и плейоморфные клетки. Фибробласты I типа дифференцируются в фибробласты типа II. С возрастом донора и при старении культур фибробластов накапливаются клетки с пониженным пролиферативным потенциалом (парусовидные и плейоморфные). Для цитоморфологического анализа клетки фиксируют и обрабатывают 2% орсеином в 45%-ной уксусной кислоте. Цитоморфологический анализ структуры популяции фибробластов по соотношению веретеновидных, парусовидных и плейоморфных клеток проводят с помощью микроскопа (МБИ-9), используя специальную сетку размером 8×8 мм, с ценой деления стороны квадрата 0,5×0,5 мм, которая устанавливается в окуляр микроскопа. Анализируют 10 полей зрения, выбранных непроизвольно по ходу часовой стрелки. На каждую точку ставят по 5 повторностей (чашек Петри). Показано, что как при стационарном, так и при радиационном старении культуры происходит постепенное, особенно резко выраженное в последний срок (20 сут), уменьшение доли веретеновидных клеток. Таким образом, полученные результаты свидетельствуют о том, что причиной естественного и индуцированного радиацией старения клеточных популяций является накопление малоактивных клеток (II тип).
Недостатками данного метода являются: необходимость трипсинизации клеток для подсчета их в камере Горяева и связанные с этим погрешности; необходимость фиксации клеток для проведения цитоморфологического анализа; непригодность цитоморфологических критериев активности фибробластов для работы с другими культурами клеток; невозможность определения соотношения живых и мертвых клеток в культуре; невозможность динамического наблюдения за культурой клеток в составе биотрансплантатов.
Таким образом, требуется разработать адекватный метод оценки в динамике взаимодействия клеточного компонента с биотрансплантом, используемым или разрабатываемым для пересадки в клинической практике. Обоснованным является применение методов витального окрашивания для оценки взаимодействия клеточных культур с биотрансплантатом. Это позволит проводить исследование на нефиксированных объектах, т.е. живых клетках, непрерывно оценивать динамику их роста и деления, изменение свойств клеток, выращенных на различных субстратах. При этом, морфологическую оценку субстрат-связанных клеток осуществляют непосредственно перед клиническим использованием, без отрыва культуры клеток от биотрансплантата.
Существует ряд витальных красителей, которые под действием возбуждающего света вызывают флуоресценцию цитоплазмы клеток без видимых нарушений их жизнедеятельности [Ромейс Б. Микроскопическая техника. - М.: Издательство иностранной литературы, 1954. - С.171-172]. Из этих красителей нами выбраны трипафлавин и родамин С. Трипафлавин обладает высокой проникающей способностью и в небольших концентрациях не вызывает нарушений генетического аппарата клеток. Родамин С интенсивно окрашивает мембранные структуры клеток и также не взаимодействует с геномом клеток. Кроме того, оба этих красителя обладают способностью в течение длительного времени (до 7 суток) сохранять свою флуоресцентную окраску. Таким образом, имеются веские основания к использованию комплексного флуоресцентного красителя, который бы обладал высокой проникающей способностью, низкой токсичностью и длительным свечением.
Достигаемым техническим результатом является объективная динамическая морфофункциональная оценка клеточного компонента биотрансплантата, разрабатываемого или используемого для пересадки, за счет учета данных, полученных путем исследования витально окрашенных клеток во флуоресцентном микроскопе.
Изготовление красителя. Приготовление красителя, включающего флуорохромы трипафлавин и родамин С, состоит из двух этапов. На первом этапе готовят концентрированные растворы трипафлавина (раствор А) и родамина С (Раствор Б) на 0,15М фосфатном буфере: Раствор А - трипафлавин разводят 0,15М фосфатном буфером в соотношении 1:2000-1:5000. Необходимо добиться полного растворения кристаллов трипафлавина. Раствор Б - родамин С разводят 0.15М фосфатным буфером в соотношении 1:1500-3000. Затем оба красителя смешивают в соотношении 1:1 и разводят в 10 раз 0,9% раствором NaCl. Это рабочий раствор витального красителя. Для окраски 1 см2 биотрансплантата с клетками требуется 2-5 мкл рабочего раствора красителя.
Оценку витально окрашенной культуры клеток в биотрансплантате проводят с помощью флуоресцентного микроскопа (объектив ×4, числовая апертура 1.25) в полуавтоматическом режиме. Для получения флуоресцентного изображения используют зеленый светофильтр (λ возбуждения 510-560 нм, λ эмиссии - от 590 нм). С помощью фотокамеры при экспозиции 1-4 сек получают цифровые изображения клеток и переносят в компьютер. Единицей анализа является 1 поле зрения микроскопа, которое составляет 5 мм2 площади культуры клеток или матрикса. Для морфометрического исследования клеток, оценки яркости свечения 1 поля зрения используют программу Adobe Photoshop. Анализ характера и интенсивности свечения прижизненно окрашенных клеток культуры на биотрансплантате можно наблюдать в течение 3-4 дней. При более длительном наблюдении на 1 мл культуральной среды добавляют по 10 мкл стерильного рабочего раствора трипафлавина и родамина С через каждые 3-4 дня.
В экспериментах установлено, что окрашенные витальным красителем трипафлавином и родамином С клетки культуры сохраняют свои пролиферативные свойства (таблица 1) и жизнеспособность (таблица 2). Индекс пролиферации, время формирования монослоя, количество живых и мертвых клеток в культуре и на биоимплантатх в группе без и после окрашивания витальными флуорохромными красителями были идентичными. Результаты этих исследований обосновывают адекватность проведения предложенной морфофункциональной оценки различных клеточных культур с помощью прижизненного окрашивания трипафлавином и родамином С.
Параметры оценки популяции клеток в составе биоимплантатов
1. Количество прикрепленных клеток на единицу площади биотрансплантата - КПК (тыс/см2)
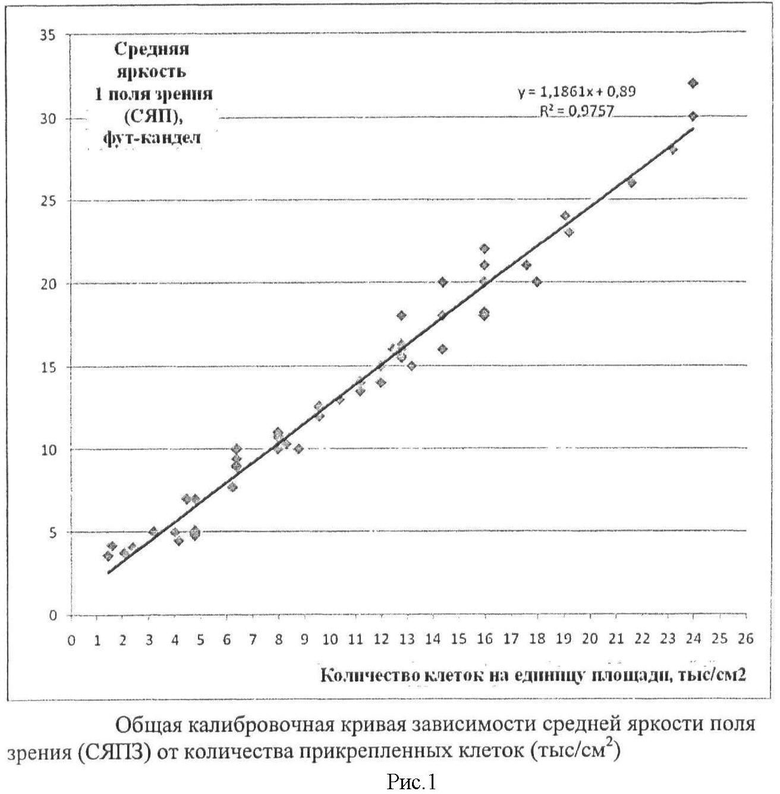
Количество прикрепленных клеток (КПК) на единицу площади оценивают по интенсивности свечения (яркости) в стандартном (5 мм2) поле зрения микроскопа с клетками, витально окрашенными трипафлавином и родамином С. Между интенсивностью свечения стандартного поля зрения (в фут-канделах) и количеством клеток в стандартном поле зрения флуоресцентного микроскопа выявлена тесная корреляционная связь, подтвержденная уравнением у=1,1861х+0,89 (рис.1, где ось ОХ - количество клеток на единицу площади, тыс/см2, ось ОУ - средняя яркость одного поля зрения, фут-кандел). Для расчета КПК на единицу площади строится калибровочная кривая, отражающая зависимость количества клеток на единицу площади дна культурального флакона, чашки Петри или биотрансплантата от интенсивности свечения поля зрения микроскопа (5 мм2).
Построение калибровочной кривой. С помощью счетной камеры Фукс-Розенталя определяют количество клеток в 1 мл анализируемой клеточной суспензии. В несколько чашек Петри (от 4 до 7) диаметром 4 см, содержащих культуральную среду, вносят суспензию с известным числом клеток, например 50, 75, 100, 125, 150 и 200 тысяч. После этого чашки Петри помещают в термостат при 37°С на 24 часа для прикрепления жизнеспособных клеток. Затем чашки Петри вынимают из термостата, удаляют из них культуральную среду, окрашивают культуру клеток с помощью трипафлавина и родамина С, из расчета 5-10 мкл на 1 см2 площади поверхности. На внешней стороне дна чашки Петри с помощью маркера вписывают квадрат, разделенный на 9 одинаковых квадратов, общая площадь которых составляет не менее 70% от площади дна чашки. Чашку помещают на предметный столик флуоресцентного микроскопа. Регистрируют (объектив х4) изображение по 3 полям зрения микроскопа в каждом из 9 квадратов.
Далее изображение переносят в компьютер и с помощью программы Adobe Photoshop оценивают яркость каждого поля зрения (в фут-канделах), рассчитывают среднюю яркость свечения 1 стандартного (5 мм2) поля зрения микроскопа по формуле и выражают в фут-канделах. Средняя яркость поля зрения (СЯПЗ) = суммарная яркость свечения обследованных полей зрения: число обследованных полей зрения
Определяют количество прикрепленных клеток на единицу площади для каждой чашки (в приведенном примере соответственно 4.2, 6.3, 8.4, 10.5, 12.6 и 16.8 тысяч клеток на см2) и на основании этих данных строят калибровочные кривые для различных типов клеток, показывающие связь между КПК и СЯПЗ.
Например. При исследовании культуры клеток фибробластов человека линии М22, культивированных в чашке Петри, при исследовании 27 стандартных полей зрения СЯПЗ составило 10 фут-кандел. Этому значению на калибровочной кривой КПК соответствует 7,7 тыс клеток/см2 или по формуле у=1,1861х+0,89, у=10 фут-кандел, КПК=7681кл/ см2.
Например. При исследовании хондробластов, высаженных на костном матриксе, при исследовании 27 стандартных полей зрения СЯПЗ составило 5 фут-кандел. Этому значению на калибровочной кривой КПК соответствует 3,5 тыс/см2 костного матрикса или по формуле у=1,1861х+0,89, у=5 фут-кандел, КПК=3465 кл/см2
2. Общее количество прикрепленных клеток ОКПК (в тысячах)
ОКПК отражает содержание клеток на исследуемой поверхности биотрансплантата, трехмерных тканеподобных структур, предназначенных для трансплантации.
ОКПК определяется по формуле: ОКПК=КПК × Sпов, где КПК - это количество клеток на на 1 см2 (в тыс/см2), Sпов. - площадь исследуемой поверхности культуральной емкости или биотрансплантате (в см2).
Например. Площадь дна чашки Петри составляет 12 см2, КПК равно 17 000/см2.
ОКПК=17000 клеток/см2 × 12 см2=204000 прикрепленных клеток в чашке Петри. ОКПК=204000 клеток.
Например. Площадь биотрансплантата на основе коллагена, используемого для лечения ожогов, составляет 144 см2, КПК фибробластов равно 6000/ см2. ОКПК=6000 фибробластов/см2 × 144 см2=864000 прикрепленных фибробластов на биотрансплантате.
3. Индекс пролиферации (ИП) клеточной культуры на биотрансплантате
Этот показатель отражает ростовую активность популяции клеток в культуре, т.е. во сколько раз общее число клеток (ОКПК) на данный день пассирования превышает число клеток на 1-й день пассирования. ИП зависит от типа клеток и от сроков их культивирования.
На основании данных ОКПК, полученных в ходе длительного наблюдения культуры клеток (например, в динамике в течение 7 суток), можно рассчитать индекс пролиферации клеточной культуры в чашке Петри или на биотрансплантате.
ИП=ОКПК анализирумый: ОКПК исходный.
Например, на 1 сутки пассирования ОКПК1=50000, на 4 сутки пассирования ОКПК4 - 110000, на 7 сутки ОКПК7 - 140000 клеток. Индекс пролиферации культуры клеток на 4 сутки пассирования равен ОКПК4: ОКПК1=110000:50000=ИП4=2.2. Соответственно, индекс пролифирации на 7-е сутки пассирования равен ОКПК7:ОКПК1=140000:50000=ИП7=2,8.
4. Целостность клеточных мембран - ЦКМ (в баллах) оценивают по интенсивности свечения клетки
Этот параметр отражает качество клеточных мембран, что связано с жизнеспособностью клеток, находящихся в составе биотрансплантата. ЦКМ оценивают по интенсивности свечения культивируемых клеток. Для этого во флуоресцентном микроскопе под объективом ×20 анализируют 100-150 витально окрашенных флуорохромами трипафлавином и родамином С клеток на исследуемой поверхности. Полученное цифровое изображение переносят в компьютер. С помощью программы Adobe Photoshop оценивают интенсивность свечения (яркость) каждой клетки. Определяют среднюю яркость 1 клетки в фут-канделах. ЦКМ оценивают в баллах, где 1 балл соответствует 1 фут-канделу.
Например, при исследовании 120 культивируемых клеток в составе биотрансплантата интенсивность яркости их свечения колебалась от 29 до 38 фут-кандел, составляя в среднем 35 фут-кандел на 1 клетку или 35 баллов. Следовательно, ЦКМ анализирумой популяции клеток равна 35 баллам.
В разных клеточных культурах ЦКМ варьируют от 25 до 50 баллов в зависимости от типа и размера клеток. Мертвые клетки имеют очень низкие значения ЦКМ - 5-15 баллов. Предложена классификация целостности мембран в популяции культуры клеток (таблица 3).
5. Содержание мертвых клеток МК (в %)
Этот параметр оценивают по формуле: МК = количество клеток с ЦКМ менее 15 баллов делят на количество всех обследованных клеток и выражают в процентах.
Например, из 100 обследованных клеток 3 клетки имели МЦК = менее 15 баллов. МК=3:100=3,0%; из 120 обследованных клеток 25 клеток имели МЦК = менее 15 баллов. МК=25:120=20,8%.
Для лучшего понимания предложенного способа приведем следующие примеры.
Пример 1. Исследовали динамику роста культуры фибробластов кожи человека в течение 7 суток в чашке Петри площадью 12 см2. Фибробласты перед посевом в стерильных условиях витально окрашивали из расчета 10 мкл красителя на 1 мл суспензии клеток. Исходное общее число внесенных клеток составило 50000. Клетки прикреплялись на дне чашки Петри через 1 сутки после посева. Анализ культуры фибробластов проводили на 1, 2, 3, 4, 5 и 7 сутки после посева. Оценивали среднюю яркость поля зрения (СЯПЗ), количество прикрепленных клеток на единицу площади (КПК), общее количество прикрепленных клеток (ОКПК), индекс пролиферации (ИП) клеточной культуры, целостность клеточных мембран (ЦКМ), содержание мертвых клеток (МК).
Параметры оценки популяции клеток в культуре были следующими:
на 1-й день - СЯПЗ=4,9 фут-кандел, КПК=3381/см2
на 2-й день - СЯПЗ=6,2 фут-кандел, КПК=4652/см2
на 3-й день- СЯПЗ=12,1 фут-кандел, КПК=9452/см2
на 4-й день - СЯПЗ=15,3 фут-кандел, КПК=12150/см2
на 5-й день - СЯПЗ=15,5 фут-кандел, КПК=12318/см2
на 7-й день - СЯПЗ=15,6 фут-кандел, КПК=12 401/см2
на 1-й день - ОКПК=40572, -
на 2-й день - ОКПК=55824, ИП2=1,37
на 3-й день - ОКПК=113424, ИП3=2,79
на 4-й день - ОКПК=145800, ИП4=3,59
на 5-й день - ОКПК=147816, ИП5=3,64
на 7-й день - ОКПК=148812, ИП7=3,67
на 1-й день - ЦКМ - 31 балл, МК - 0,5%
на 2-й день - ЦКМ - 31 балл, МК - 0,5%
на 3-й день - ЦКМ - 31 балл, МК - 0,5%
на 4-й день - ЦКМ - 31 балл, МК - 0,7%
на 5-й день - ЦКМ - 30 баллов, МК - 2,0%
на 7-й день - ЦКМ - 30 баллов, МК - 3,0%
Заключение: анализируемая клеточная культура фибробластов обладает нормальными ростовыми свойствами и рекомендована для клинического использования.
Пример 2. Для клинического использования были приготовлены различные виды биотрансплантатов - на основе коллагена, полимера гиалуроновой кислоты, дермы человека. На эти биотрансплантаты высевали фибробласты линии М22 (по 0,5 млн клеток) и проводили мониторинг клеточного компонента биотрансплантатов в течение 3 суток (табл.4).
(S=144 см2)
Пример 3. Исследовали действие КВЧ-облучения на культуру фибробластов линии М22, высаженную на биотрансплантат на основе коллагена площадью 144 см2. Оценку культуры в составе биотрансплантат проводили до КВЧ-облучения и через 3 суток после КВЧ-облучения (таблица 5).
Пример 4. Исследовали динамику роста мезенхимальных стволовых клеток (МСК) костного мозга донора органов на биотрансплантате на основе деминерализованной кости человека площадью 12 см2. Оценку культуры в составе биотрансплантата проводили через 1 сутки и через 4 суток после культивирования (таблица 6).
Суммируя вышесказанное, предлагаемый способ осуществляется следующим образом:
для динамического исследования в ламинарном шкафу в культуральные емкости помещают стерильные биотрасплантаты, на которые вносят суспензию клеток в питательной среде, добавляют стерильный витальный флуорохромный краситель на буферном растворе, содержащем трипафлавин и родамин С в соотношении 1:1, причем для окраски 1 см2 клеток биотрансплантата требуется 5-10 мкл рабочего раствора красителя,
- культуральные емкости с клетками инкубируют в условиях 5% СО2 при 37°С,
- посуточно анализируют культуру клеток на биотрансплантате, для чего культуральные емкости перемещают на предметный столик флуоресцентного микроскопа - объектив х4, апертура 0,6, длина волны возбуждения 510-560 нм, длина волны эмиссии - от 590 нм, и измеряют в фут-канделах на биотрансплантате с клетками яркость свечения 27 стандартных полей зрения микроскопа,
- рассчитывают среднюю яркость свечения поля зрения (СЯПЗ) по калибровочной кривой,
- определяют количество прикрепленных клеток (КПК) на 1 единицу площади биотрансплантата, в тыс/см2,
- рассчитывают общее число прикрепленных клеток (ОКПК) на биотрансплантате, в тысячах,
- рассчитывают индекс пролиферации (ИП), для чего определяют во сколько раз ОКПК на данный день пассирования превышает число клеток на 1-й день пассирования,
- под объективом ×20 анализируют изображение 100-150 клеток на биотрансплантате,
- рассчитывают среднюю величину интенсивности свечения 1 клетки на биотрансплантате в фут-канделах и выражают в баллах, причем 1 фут-кандел = 1 баллу, что характеризует целостность клеточных мембран (ЦКМ),
- определяют процент клеток с низкой яркостью свечения, что отражает содержание мертвых клеток (МК), в %,
- оценивают пригодность клеточного компонента биотрансплантата для пересадки, который в норме содержит 14-20 тысяч клеток на см2, из которых не более 5% мертвых, ЦКМ 28-42 балла, ИП на 3-й и 7 день пассирования варьирует от 1,8 до 3,2 в зависимости от типа клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ИНТЕРФЕРОНА ЧЕЛОВЕКА | 2013 |
|
RU2553431C2 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СТАТУСА ТРОМБОЦИТОВ ЧЕЛОВЕКА | 2012 |
|
RU2485502C1 |
| ЭКСПРЕСС-МЕТОД МОРФОФУНКЦИОНАЛЬНОГО АНАЛИЗА ТРОМБОЦИТОВ, ПРИГОДНЫХ ДЛЯ КЛИНИЧЕСКОГО ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2623074C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С ВЫСОКОАДГЕЗИВНЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2813132C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С НИЗКОАДГЕЗИВНЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2813134C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С УПРАВЛЯЕМЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2812733C1 |
| СПОСОБ ОТБОРА ТРОМБОЦИТОВ ЧЕЛОВЕКА, ПРИГОДНЫХ ДЛЯ КРИОКОНСЕРВИРОВАНИЯ | 2015 |
|
RU2623073C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛИЗАТА ТРОМБОЦИТОВ С ВЫСОКИМ СОДЕРЖАНИЕМ ФАКТОРОВ РОСТА | 2020 |
|
RU2739515C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ФИБРОБЛАСТОВ, СПОСОБ СОЗДАНИЯ БИОТРАНСПЛАНТАТА НА ИХ ОСНОВЕ (ВАРИАНТЫ) И СПОСОБ РЕГЕНЕРАЦИИ ТКАНЕЙ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2013 |
|
RU2567004C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА ДЛЯ РОГОВИЦЫ | 2011 |
|
RU2505303C2 |
Изобретение относится к медицине и касается метода оценки качества биотрансплантатов. Способ осуществляется следующим образом. Для динамического исследования в ламинарном шкафу в культуральные емкости помещают стерильные биотрасплантаты, на которые вносят суспензию клеток в питательной среде, добавляют стерильный витальный флуорохромный краситель на буферном растворе, содержащем трипафлавин и родамин С. Культуральные емкости с клетками инкубируют, посуточно анализируют культуру клеток на биотрансплантате. Рассчитывают среднюю яркость свечения поля зрения (СЯПЗ) по калибровочной кривой. Определяют количество прикрепленных клеток (КПК) на 1 единицу площади биотрансплантата, в тыс/см2. Рассчитывают общее число прикрепленных клеток (ОКПК) на биотрансплантате, в тысячах. Рассчитывают индекс пролиферации (ИП). Рассчитывают среднюю величину интенсивности свечения 1 клетки на биотрансплантате в фут-канделах и выражают в баллах, причем 1 фут-кандел = 1 баллу, что характеризует целостность клеточных мембран (ЦКМ). Определяют содержание мертвых клеток (МК), в %. Оценивают пригодность клеточного компонента биотрансплантата для пересадки. Изобретение обеспечивает объективную динамическую морфофункциональную оценку клеточного компонента биотрансплантата, разрабатываемого или используемого для пересадки, за счет учета данных, полученных путем исследования витально окрашенных клеток во флуоресцентном микроскопе. 1 ил., 6 табл., 4 пр.
Метод морфофункциональной оценки клеточного компонента биотрансплантатов, заключающийся в том, что для динамического исследования в ламинарном шкафу в культуральные емкости помещают стерильные биотрансплантаты, на которые вносят суспензию клеток в питательной среде, добавляют стерильный витальный флуорохромный краситель на буферном растворе, содержащем трипафлавин и родамин С в соотношении 1:1, причем для окраски 1 см2 клеток биотрансплантата требуется 5-10 мкл рабочего раствора красителя, затем культуральные емкости с клетками инкубируют в условиях 5% СО2 при 37°С, далее посуточно анализируют культуру клеток на биотрансплантате, для чего культуральные емкости перемещают на предметный столик флуоресцентного микроскопа - объектив ×4, апертура 0,6, длина волны возбуждения 510-560 нм, длина волны эмиссии - от 590 нм, и измеряют в фут-канделах на биотрансплантате с клетками яркость свечения 27 стандартных полей зрения микроскопа, рассчитывают среднюю яркость свечения поля зрения (СЯПЗ) по калибровочной кривой, определяют количество прикрепленных клеток (КПК) на 1 единицу площади биотрансплантата, тыс./см2, далее рассчитывают общее число прикрепленных клеток (ОКПК) на биотрансплантате, тыс., рассчитывают индекс пролиферации (ИП), для чего определяют, во сколько раз ОКПК на данный день пассирования превышает число клеток на 1-й день пассирования, затем под объективом ×20 анализируют изображение 100-150 клеток на биотрансплантате, рассчитывают среднюю величину интенсивности свечения 1 клетки на биотрансплантате в фут-канделах и выражают в баллах, причем 1 фут-кандел = 1 баллу, что характеризует целостность клеточных мембран (ЦКМ), определяют процент клеток с низкой яркостью свечения, что отражает содержание мертвых клеток (МК), %, оценивают пригодность клеточного компонента биотрансплантата для пересадки, который в норме содержит 14-20 тыс. клеток на см2, из которых не более 5% мертвых, ЦКМ 28-42 балла, ИП на 3-й и 7-й день пассирования варьирует от 1,8 до 3,2, в зависимости от типа клеток.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СПОСОБ АНАЛИЗА ПОПУЛЯЦИИ ФИБРОБЛАСТОВ ЧЕЛОВЕКА | 1990 |
|
RU2017818C1 |
| СЧЕТНАЯ КАМЕРА С СЕТКАМИ ГОРЯЕВА | 1997 |
|
RU2126230C1 |
| Thuret G., et al., Is manual counting of corneal endothelial cell density in eye banks still acceptable? The French experience | |||
| Br J Ophthalmol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2013-06-10—Публикация
2012-04-13—Подача