Предлагаемое изобретение относится к медицинской микробиологии, в частности к методам контроля биологических свойств штаммов пробиотических бактерий, используемых при производстве пробиотиков, и может быть использовано для оценки биологической активности лактобацилл и бифидобактерий по отношению к Vibrio cholerae с целью установления возможности применения пробиотиков для профилактики и лечения холеры.
Антибиотикорезистентность возбудителя холеры, отсутствие эффективной вакцинопрофилактики, возможность формирования вибрионосительства и негативные последствия перенесенной инфекции обусловливают необходимость совершенствования подходов к профилактике и лечению этого заболевания, ориентированных на разработку и применение препаратов, альтернативных антибиотикам. В рамках решения данной проблемы находится изучение возможности расширения спектра противохолерных средств за счет дополнительного использования пробиотиков - недорогих, неантибиотических, потенциально терапевтических и профилактических средств на основе пробиотических культур - представителей нормальной микрофлоры человека (лактобацилл и бифидобактерий). При определении возможности использования этих микроорганизмов при холерной инфекции необходимо учитывать биологию возбудителя холеры и особенность патогенеза этой инфекции (кислоточувствительность холерных вибрионов и чувствительность Vibrio cholerae к антагонистическому действию пробиотиков).
Известен способ оценки антагонистической активности пробиотиков на основе лиофилизированной биомассы анаэробных бактерий по отношению к патогенным микобактериям (см. пат. RU №2350648, кл. C12N 1/20, C12Q 1/04, 27.03.2009 г.), заключающийся в том, что антагонистическую активность оценивают по отношению количества колоний индикаторного штамма, выросших на среде с добавлением среды Блоурокка в количестве 10% от объема среды выращивания, к количеству колоний индикаторного штамма, выросших на среде после внесения в нее пробиотика.
Недостатком известного способа является его неэффективность при определении антагонистической активности пробиотиков по отношению к холерным вибрионам из-за особенностей патогенеза этой инфекции и требований к питательным средам.
За прототип выбрана методика тестирования биологических свойств (антагонизма и кислотообразующей активности) пробиотических бактерий, регламентированные методическими указаниями (МУК 4.2.2602-10, п.4.7, п.4.8.1) «Методы контроля. Биологические и микробиологические факторы. Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков», которые устанавливают требования к штаммам, используемым при производстве пробиотиков.
Недостатком прототипа является то, что в методике отсутствуют, как унифицированный способ тестирования антагонизма пробиотических бактерий по отношению к Vibrio cholerae, так и возможность оценки результатов тестирования пробиотиков по антагонистической и кислотообразующей активности. Так, в соответствии с МУК 4.2.2602-10 определение антагонистической активности штамма лактобацилл рекомендуется проводить с помощью метода отсроченного антагонизма, высевая при этом взвесь испытуемой культуры по диаметру чашки Петри с агаризированной средой МРС-5, затем к выросшей культуре подсевают тест-штаммы патогенных и условно патогенных бактерий. Для бифидобактерий рекомендован тест на антагонистическую активность - метод совместного культивирования. Однако на среде МРС-5 холерные вибрионы не растут, а использование двух методик не дает возможности производить единый учет результатов, т.е. определить антагонизм (низкий, средний или высокий).
Кроме того, в соответствии с методикой, кислотообразующую активность лактобацилл и бифидобактерий определяют объемным (титрометрическим) методом нейтрализации кислот в присутствии индикатора, но не предусмотрен ранжированный учет результатов, т.е. для определение низкой, средней или высокой активности кислотообразования.
Технической задачей предполагаемого изобретения является разработка способа оценки биологической активности лактобацилл и бифидобактерий, позволяющего определить их эффективность для профилактики и лечения холеры.
Поставленная задача достигается тем, что проводят тестирование антагонистической и кислотообразующей активности штамма лактобацилл или бифидобактерий по двум показателям: первый показатель - антагонистическая активность методом отсроченного антагонизма по отношению к холерным вибрионам, учет которой осуществляют на основе количественных данных, а именно зона ингибиции роста (в мм) тест-штамма V. cholerae от 6,0 до 15,0 - низкая антагонистическая активность, от 15,1 до 29,0 - средняя, ≥29,1 - высокая, второй показатель - кислотообразующая активность штамма, которая выражается в градусах Тернера (°Т): если кислотообразование ≤99,9 (°Т), то активность кислотообразования оценивается как низкая, если значения этого показателя находятся в пределах (100-149,9)°Т - как средняя, а при значении ≥150,0 (°Т) - как высокая, результат оценки биологической активности лактобацилл и бифидобактерий относительно V. cholerae eltor, classica, O139, non O1/ non O139 считают положительным при 4-х вариантах сочетания результатов тестирования по упомянутым показателям, а именно высокая антагонистическая активность-высокая кислотообразующая активность, соответственно, высокая-средняя, средняя-высокая, средняя-средняя.
Кроме того, антагонистическую активность лактобацилл и бифидобактерий по отношению к холерным вибрионам определяют методом лунок на плотных питательных средах: ХДС-агаре или щелочном агаре.
Способ осуществляется следующим образом
Для проведения способа были использованы 40 штаммов пробиотических бактерий, относящихся к родам Lactobacillus, Bifidobacterium, полученных из Всероссийской коллекции микроорганизмов; 40 музейных и свежевыделенных штаммов холерных вибрионов различных биоваров и серогрупп (по 10 штаммов), из которых к эпидемически опасным относились все 10 штаммов V. cholerae classica и по 5 штаммов V. cholerae eltor, V.cholera O139 и V. cholerae non O1/O139. Остальные штаммы являлись атоксигенными. Для экспериментального моделирования холеры (выявление профилактической и лечебной эффективности) применяли штамм V. cholerae eltor 5879. Штаммы холерных вибрионов были предоставлены музеем живых культур ФКУЗ Рос-товского-на-Дону научно-исследовательского противочумного института Роспотребнадзора.
Все исследования пробиотических штаммов по параметру антагонизма по отношению к холерным вибрионам проводят по предлагаемому способу, а по параметру кислотообразования - в соответствии с МУК 4.2.2602-10 (см. 3).
Оценку результатов тестирования in vitro штаммов пробиотических бактерий по основным параметрам биологической активности проводят по сочетанию качественных показателей, которые определяют на основе количественных данных.
Первоначально осуществляют тестирование на антагонистическую активность пробиотических бактерий относительно холерных вибрионов. Для этого ампулу с лиофильно высушенной пробиотической культурой предварительно вскрывают, а содержимое суспендируют в 2,0 мл 0,85% раствора NaCl (pH 7,2±0,1). Культуру лактобацилл засевают на полужидкую среду МРС (pH 6,4±0,2), а культуру бифидобактерий - на среду Блоурокка (pH 7,3±0,2). Посевы выдерживают в термостате при (37±1)°C в течение (44±4) ч. Затем содержимое пробирок перемешивают встряхиванием и вносят по 0,1 мл в лунки по центру чашки Петри (диаметром 90 мм) с плотной питательной средой (щелочной агар, pH 8,0±0,2 или ХДС-агар, pH 7,7±0,1). При применении ХДС-агара (холерной дрожжевой питательной среды на основе панкреатического перевара пекарских дрожжей), разработанного в ФКУЗ Ростовском-на-Дону научно-исследовательском противочумном институте Роспотребнадзора, упрощается визуальный предварительный учет (см. 1).
После проводят инкубацию при (37±1)°С в течение двух суток. Затем на указанную среду бактериологической петлей диаметром (2,0±0,1) мм штрихом в направлении от лунки с исследуемой культурой (лактобацилл или бифидобактерий), не касаясь краев и под прямым углом, производят подсев 6-ти часовой бульонной (МПБ, pH 7,5±0,1) тест - культуры холерных вибрионов. В качестве тест - штамма используются культура Vibrio cholerae eltor M-878, которая являются тестовой для контроля питательных сред для лабораторной диагностики холеры (см. 2). Для культивирования тест-культуры холерных вибрионов, наряду с применением стандартных питательных сред (основной пептон, 1% пептонная вода, МПБ), рекомендуется использовать холерную дрожжевую питательную среду на основе панкреатического перевара пекарских дрожжей (ХДС-Н, pH 7,5±0,1), разработанную в ФКУЗ Ростовский-на-Дону научно-исследовательском противочумном институте Роспотребнадзора (см. 4) В качестве контроля в лунки вносят полужидкие среды, используемые для выращивания пробиотических бактерий в количестве 0,1 мл, но без посевного материала. Кроме того, контролями роста тест-культур Vibrio cholerae служат их параллельные посевы на чашки с щелочным или ХДС-агаром.
Учет результатов осуществляют через 7 ч (предварительно) и 24 ч инкубации при (37±1)°C (окончательно). Величину зоны задержки роста тест-штаммов холерных вибрионов определяют в мм. Оценку антимикробной активности пробиотических бактерий производят согласно полученным данным: зона ингибиции роста тест-штаммов V. cholerae 6,0-15,0 мм - низкая антагонистическая активность; 15,1-29,0 мм - средняя; 29,1 мм и более - высокая.
Вторым этапом проводят тестирование штаммов пробиотических бактерий на активность кислотообразования. Для этого получают 1 млрд. взвеси изучаемых культур лактобацилл и бифидобактерий путем смыва 0,9% раствором натрия хлорида двухсуточных культур этих микроорганизмов, выращенных на соответствующе плотных питательных средах (МРС-1, «Бифидум среда»). В две пробирки по ГОСТ 13932-79Е (d - 2 см, h - 20 см) стерильно разливают по 25,0 мл среды Блоурокка (для бифидумбактерий) или стерильного обезжиренного молока (для лактобацилл) и вносят по 2,5 мл полученных взвесей соответствующих пробиотических культур. Содержимое тщательно перемешивают и выдерживают в течение (44±4) ч при температуре (37±1)°C. После инкубации проводят определение кислотности в каждой пробирке. Каждую пробу из указанных пробирок (по 10,0 мл) титруют раствором гидрооксида натрия в концентрации 0,1 моль/л (по ГОСТ 4323-77) в присутствии индикатора фенолфталеина (по ГОСТ 5850-72) следующим образом: добавляют по 2-3 капли индикатора до появления стойкого слабо-розового окрашивания, а затем по каплям добавляют гидрооксид натрия. Активность кислотообразования определяют в градусах Тернера (Т°) по ГОСТ 3624-67 и вычисляют по формуле: Т=а·к·10, где «а» - количество миллилитров раствора гидроксида натрия в концентрации 0,1 моль/л, пошедшее на титрование; «к» - 1,03 - поправка к титру раствора гидроксида натрия в концентрации 0,1 моль/л; «Т» - условная величина, выраженная в мл щелочи, пошедшей на титрование 10 мл исследуемой суспензии.
Учет результатов проводят согласно полученным данным: кислотообразование 99,9 (°Т) и менее - активность низкая; 100,0-149,9 (°Т) - средняя; 150,0 (°Т) и более - высокая.
Оценку положительного результата, т.е. установление наличия противохолерной активности штамма лактобацилл или бифидобактерий, проводят по соответствию четырем вариантам сочетания результатов антагонизма к Vibrio cholerae и кислотообразования, приведенным в таблице 1. Все другие сочетания степени выраженности биологических свойств пробиотических бактериальных культур расцениваются как отрицательные результаты.
Пример 1.
Тестирование на антагонистическую активность по отношению к холерным вибрионам. Ампулы с культурами Lactobacillus acidophilus BKM В 2020 Д и L.acidophilus 126 стерильно вскрывали и регидратировали в 2,0 мл 0,85% раствора NaCl (pH 7,2±0,1). Каждую культуру лактобацилл засевали в пробирку с полужидкой средой МРС (pH 6,4±0,2). Посевы выдерживали в термостате при (37±1)°C в течение (44±4) ч. Затем содержимое каждой пробирки перемешивали встряхиванием и вносили по 0,1 мл в лунку по центру чашек Петри (диаметром 90 мм) с плотной питательной средой ХДС-агар (pH 7,7±0,1). Далее на указанную среду бактериологической петлей диаметром (2,0±0,1) мм штрихом в направлении от лунки с исследуемой культурой лактобацилл, не касаясь краев и под прямым углом, производили подсев 6-часовой бульонной (ХДС-Н, pH 7,5±0,1) тест-культуры Vibrio cholerae eltor М-878. Результаты учитывали через 7 ч (предварительно) и 24 ч инкубации при (37±1)°C (окончательно). Учет результатов проводят по соответствию количественного показателя качественному (табл.2). Величины зон задержки роста тест-штамма холерных вибрионов составили: у штамма Lactobacillus acidophilus BKM В 2020 Д - 29,3 мм, а у штамма L.acidophilus 126 - 29,03 мм, что соответствовало высокой степени антагонистической активности (табл. 2).
Тестирование на активность кислотообразования. По 2,5 мл 1 млрд. взвесей каждой из испытуемых культур (L.acidophilus BKM В 2020 Д и L.acidophilus 126) засевали в две пробирки (d - 2 см, h - 20 см) с 25,0 мл стерильного обезжиренного молока. Содержимое пробирок тщательно перемешивали и выдерживали в течение (44±4) ч при температуре (37±1)°C. После инкубации проводили определение кислотности в каждой пробирке (по 2 параллельные пробы). Каждую пробу (10,0 мл) титровали раствором гидроокиси натрия в концентрации 0,1 моль/л в присутствии индикатора фенолфталеина следующим образом: добавляли по 2-3 капли индикатора до появления стойкого слабо-розового окрашивания. Активность кислотообразования определяли в градусах Тернера (Т°) по ГОСТ 3624-67 и вычисляли по формуле: Т=а·к·10, где «а» - количество миллилитров раствора гидроксида натрия в концентрации 0,1 моль/л, пошедшее на титрование; «к» - 1,03 - поправка к титру раствора гидроксида натрия в концентрации 0,1 моль/л; «Т» - условная величина, выраженная в мл щелочи, пошедшей на титрование 10 мл исследуемой суспензии. Учет результатов проводят по соответствию количественного показателя качественному (табл.2).
На титрование 10,0 мл суспензии испытуемой культуры L.acidophilus ВКМ В 2020 Д пошло 21,3 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=21,3·1,03·10=219,4°Т, т.е. исследуемому штамму свойственно кислотообразование высокой интенсивности. На титрование 10,0 мл суспензии культуры L.acidophilus 126 пошло 14,0 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=14,0·1,03·10=144,2 (°Т), т.е. исследуемому штамму свойственно кислотообразование средней интенсивности (табл.2).
Таким образом штамм L.acidophilus ВКМ В 2020 обладал высокой антагонистической активности относительно холерных вибрионов и высокой активностью кислотообразования, а штамм L.acidophilus 126 - высокой антагонистической активностью и средней активностью кислотообразования. Данные результаты соответствовали 1-му (высокая-высокая) и 11-му (высокая-средняя) вариантам сочетания результатов тестирования штаммов по указанным параметрам (табл.1) и свидетельствовали о наличии биологической активности испытуемых штаммов относительно холерных вибрионов.
Пример 2. В исследование были взяты штаммы Lactobacillus acidophilus NK5 и Bifidobacterium bifidum №1. Схема оценки активности в отношении холерных вибрионов, как в примере 1. В тесте на антагонизм использовали щелочной агар (pH 8,0±0,2).
В результате тестирования на антагонистическую активность по отношению к холерным вибрионам было установлено, что величины зон задержки роста тест - штамма холерных вибрионов составили: у штамма L. acidophilus NK5 - 24,6 мм, а у штамма В. bifidum №1 - 20,2 мм, что соответствовало средней степени антагонистической активности по отношению к Vibrio cholerae (табл.2).
В результате тестирования испытуемых штаммов на активность кислотообразования было установлено, что на титрование 10,0 мл суспензии испытуемой культуры L.acidophilus NK5 пошло 14,6 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=14,6·1,03·10=150,4 (°Т), т.е. исследуемому штамму свойственно кислотообразование высокой интенсивности. На титрование 10,0 мл суспензии культуры B.bifidum №1 пошло 9,8 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=9,8·1,03·10=100,9 (°Т), т.е. исследуемому штамму свойственно кислотообразование средней интенсивности (табл.2).
Вывод: штаммы L.acidophilus NK5 и B.bifidum №1 обладали средней антагонистической активностью относительно холерных вибрионов, в то время как у штамма L.acidophilus NK5 была установлена высокая активность кислотообразования, а у штамма B.bifidum №1 - средняя, что соответствовало III-му (средняя-высокая) и IV-му (средняя-средняя) вариантам сочетания результатов тестирования штаммов по указанным параметрам (табл.1) и свидетельствовало о наличии биологической активности испытуемых штаммов относительно холерных вибрионов.
Пример 3. В исследование были взяты штаммы Lactobacillus bulgaricus LB-51, L.lactis ATSS 8000 и Bifidobacterium longum В 379М. Схема оценки активности в отношении холерных вибрионов, как в примере 1. В тесте на антагонизм использовали щелочной агар (pH 8,0±0,2) и ХДС-агар (pH 7,7±0,1). Результаты, полученные на обеих средах, не отличались.
Так, в результате тестирования испытуемых штаммов на антагонистическую активность по отношению к холерным вибрионам было установлено, что величина зоны задержки роста тест - штамма Vibrio cholerae eltor M-878 составили: у штамма L.bulgaricus LB-51 - 15,2 мм, что соответствовало средней степени антагонистической активности по отношению к Vibrio cholerae; у штамма L. lactis ATSS 8000 - 8,6 мм, у штамма В. longum В 379М - 9,2, что соответствовало низкой степени антагонистической активности (табл.2).
В результате тестирования испытуемых штаммов на активность кислотообразования было установлено, что на титрование 10,0 мл суспензии испытуемой культуры L.bulgaricus LB-51 пошло 9,3 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=9,3·1,03·10=95,8 (°Т), т.е. исследуемому штамму свойственно кислотообразование низкой интенсивности. На титрование 10,0 мл суспензии культуры L.lactis ATSS 8000 пошло 9,7 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=9,7·1,03·10=100,0 (°Т), т.е. исследуемому штамму свойственно кислотообразование средней интенсивности. На титрование 10,0 мл суспензии культуры В. longum В 379М пошло 5,8 мл раствора гидроксида натрия в концентрации 0,1 моль/л. Таким образом, Т=5,8·1,03·10=59,7 (°Т), т.е. исследуемому штамму свойственно кислотообразование низкой степени интенсивности (табл.2).
Следовательно, штамм L.bulgaricus LB-51 обладал средней антагонистической активностью относительно холерных вибрионов, L.lactis ATSS 8000 и В. longum В 379М - низкой. У штаммов L.bulgaricus LB-51 и В. longum В 379М была установлена низкая активность кислотообразования, а у штамма L.lactis ATSS 8000 - средняя. Выявленные сочетания результатов тестирования штаммов по 2 параметрам (средняя-низкая, низкая средняя и низкая-низкая) не соответствовало вариантам сочетания результатов тестирования штаммов по наличию противохолерной активности (табл.1), и свидетельствовало об отсутствии биологической активности испытуемых штаммов относительно холерных вибрионов.
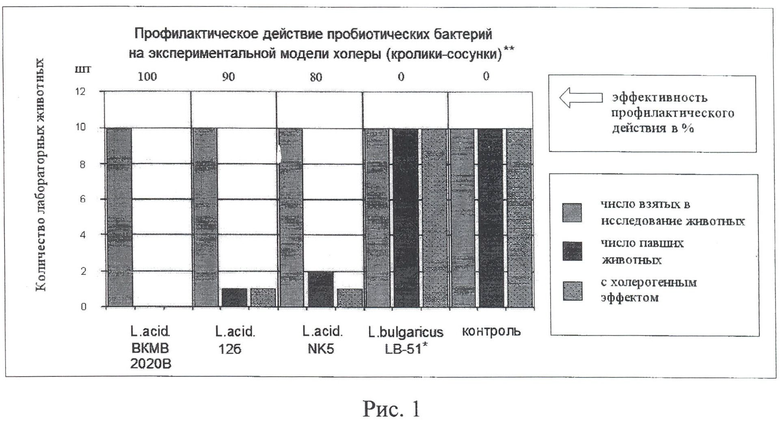
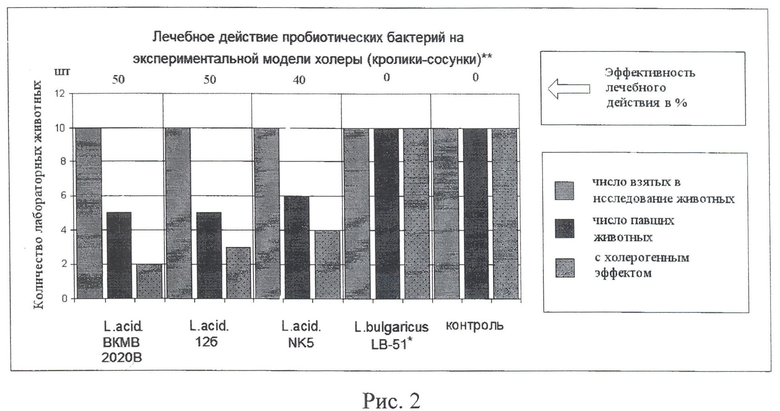
Профилактическую и лечебную эффективность отобранных штаммов изучали по отработанным методикам на модели кроликов-сосунков (см. рис.1, 2).
Применение способа позволяет выявлять наличие или отсутствие у каждого штамма лактобацилл и бифидобактерий биологической активности относительно холерных вибрионов на основе двух параметров - антагонизма и кислотообразования, определенных по количественным данным и связанных по сочетанию результатов тестирования в табличных значениях. Способ прост в осуществлении и может быть использован в качестве дополнительного или основного теста при определении биологической активности пробиотиков относительно холерных вибрионов.
Преимуществом предлагаемого способа является возможность установления наличия у штаммов лактобацилл и бифидобактерий противохолерной активности и последующего осуществления отбора штаммов указанных бактерий, как среди штаммов, являющихся перспективными в качестве производственных, так и среди штаммов, составляющих основу существующих коммерческих препаратов-пробиотиков, что позволит расширить арсенал противохолерных средств за счет дополнительного использования недорогих, неантибиотических препаратов для профилактики и лечения холеры. *
Источники информации
1. Мазрухо А.Б., Каминский Д.И., Ломов Ю.М. и др. Новая питательная среда для диагностики холеры ХДС-агар как перспективный элемент мобилизационного резерва специализированных противоэпидемических бригад //Известия высших учебных заведений Северо-Кавказский регион. Естественные науки. - 2011. - №3. - С.101-105.
2. Методические указания МУК 3.3.2.2124-06 «Контроль диагностических питательных сред по биологическим показателям для возбудителей чумы, холеры, сибирской язвы, туляремии, бруцеллеза, легионеллеза». - М. - 2006. - С.9-11.
3. Методические указания МУК 4.2.2602-10. 4.2. «Методы контроля. Биологические и микробиологические факторы. Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков», М.: Федеральный центр Госсанэпиднадзора Минздрава России. - 2010. - 59 с.
4. Каминский Д.И., Мазрухо А.Б., Ломов Ю.М. и др. Оценка жидкой накопительной среды ХДС-Н для культивирования и выделения холерного вибриона // Биотехнология. - 2003. - №4. - С.70-74.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ LACTOBACILLUS ACIDOPHILUS - АНТИБИОТИКОРЕЗИСТЕНТНЫЙ АНТАГОНИСТ ВОЗБУДИТЕЛЕЙ КИШЕЧНЫХ ИНФЕКЦИЙ | 1994 |
|
RU2063436C1 |
| Способ профилактики холеры с использованием везикул для моделирования противохолерного иммунитета у экспериментальных животных | 2022 |
|
RU2792160C1 |
| СПОСОБ ВНУТРИВИДОВОЙ ДИФФЕРЕНЦИАЦИИ Vibrio cholerae О139 | 2004 |
|
RU2268942C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ЭКСПРЕССИРУЮЩАЯ КЛОНИРОВАННЫЙ ГЕН CEF VIBRIO CHOLERAE (ВАРИАНТЫ), И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ CEF VIBRIO CHOLERAE (ВАРИАНТЫ) | 2005 |
|
RU2313577C2 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ЛПС ХОЛЕРНЫХ ВИБРИОНОВ О139 СЕРОГРУППЫ | 2010 |
|
RU2425875C1 |
| Способ идентификации токсигенных генетических вариантов возбудителя холеры Эль Тор с набором мутаций в генах вирулентости и генах острова пандемичности VSPII методом мультиплексной полимеразной цепной реакции | 2022 |
|
RU2815711C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ЭПИДЕМИЧЕСКИ ЗНАЧИМЫХ ХОЛЕРНЫХ ВИБРИОНОВ VIBRIO ELTOR И VIBRIO CHOLERAE O139 ПО ИХ АДГЕЗИВНОЙ СПОСОБНОСТИ | 2006 |
|
RU2332460C1 |
| СПОСОБ И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ ПРОДУКЦИИ ХОЛЕРНОГО ТОКСИНА И ДИФФЕРЕНЦИАЦИИ ЭПИДЕМИЧЕСКИ ЗНАЧИМЫХ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ КЛАССИЧЕСКОГО И ЭЛЬТОР БИОВАРОВ | 2016 |
|
RU2611359C1 |
| Набор штаммов бактерий для обучения вопросам микробиологии и методам лабораторной диагностики холеры | 2019 |
|
RU2743454C1 |
| КОМПЛЕКСНАЯ ГЕНО- И ИММУНОДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП И ОЦЕНКИ ИХ ВИРУЛЕНТНОСТИ | 2009 |
|
RU2404257C1 |
Изобретение относится к медицинской микробиологии, в частности к методам контроля биологических свойств штаммов пробиотических бактерий, используемых при производстве пробиотиков, и может быть использовано для оценки биологической активности лактобацилл и бифидобактерий по отношению к Vibrio cholerae с целью установления возможности применения пробиотиков для профилактики и лечения холеры. Способ предусматривает тестирование антагонистической и кислотообразующей активности штаммов лактобацилл и бифидобактерий. Антагонистическую активность по отношению к холерным вибрионам определяют методом лунок на плотных питательных средах - ХДС-агаре и щелочном агаре, а учет активности осуществляют на основе количественных данных, а именно зона ингибиции роста (в мм) тест-штамма V.cholerae от 6,0 до 15,0 - низкая антагонистическая активность, от 15,1 до 29,0 - средняя, ≥29,1 - высокая. Кислотообразующую активность штаммов по отношению к холерным вибрионам, выражаемую в градусах Тернера (°Т), определяют на основе количественных данных. Так если кислотообразование ≤99,9 (°Т), то активность кислотообразования оценивается как низкая, если значения этого показателя находятся в пределах (100-149,9) (°Т) - как средняя, а при значении ≥150,0 (°Т) - как высокая. При этом результат оценки биологической активности лактобацилл и бифидобактерий относительно V.cholerae eltor, classica, O139, non O1/ non O139 считают положительным при 4-х вариантах сочетания результатов тестирования по упомянутым показателям, а именно высокая антагонистическая активность - высокая кислотообразующая активность, соответственно, высокая - средняя, средняя - высокая, средняя - средняя. Изобретение позволяет установить наличие или отсутствие противохолерной активности у штаммов. 1 з.п. ф-лы, 2 ил., 2 табл., 3 пр.
1. Способ оценки биологической активности лактобацилл и бифидобактерий относительно холерных вибрионов in vitro, включающий тестирование антогонистической активности методом отсроченного антогонизма и кислотообразования штамма, отличающийся тем, что оценку лактобацилл и бифидобактерий проводят по двум показателям, первый относится к антогонистической активности по отношению к холерным вибрионам, учет которой осуществляют на основе количественных данных, а именно: зона ингибиции роста тест-штамма V.cholerae от 6,0-15,0 мм - низкая антагонистическая активность, от 15,1-29,0 мм - средняя, ≥29,1 - высокая, второй показатель - кислотообразующая активность штамма, которая выражается в градусах Тернера (°Т): если кислотообразование ≤99,9 (°Т) - считают низким кислотообразованием, в пределах (100-149,9) (°Т) - средним, а больше 150,0 (°Т) - высоким, результат оценивают положительным относительно V.cholerae eltor, classica, O139, non O1/ non O139 по четырем вариантам сочетания результатов тестирования по упомянутым показателям, а именно 1 вариант: высокая антагонистическая активность-высокая кислотообразующая активность, 2 вариант: высокая антагонистическая активность-средняя кислотообразующая активность, 3 вариант: сочетание средней-высокой активности и 4 вариант: средней-средней активности.
2. Способ по п.1, отличающийся тем, что выявление антогонистической активности лактобацилл и бифидобактерий по отношению к холерным вибрионам определяют методом лунок на плотных питательных средах: ХДС-агаре или щелочном агаре.
| Методические указания | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Методы контроля | |||
| Биологические и микробиологические факторы | |||
| Система предрегистрационного доклинического изучения безопасности препаратов | |||
| Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков | |||
| - М.: Федеральный центр Госсанэпидемнадзора МЗРФ, 2010, 59 стр | |||
| RU | |||
Авторы
Даты
2013-07-20—Публикация
2012-05-25—Подача