Предлагаемое изобретение относится к области экспериментальной медицины, а именно к профилактике инфекционных болезней, касающейся использования вакцин и препаратов на основе везикул наружных мембраны для профилактики холеры у экспериментальных животных.
Холера остается одной из актуальных проблем здравоохранения в мире. Несмотря на современные методы лечения, улучшение качества питьевой воды и соблюдение санитарных мер, ежегодно от холеры умирают около 100000 человек. Специфическая профилактика холеры на сегодняшний день является наиболее эффективным способом предупреждения и ликвидации эпидемий. На сегодняшнем этапе ВОЗ рекомендует использование холерных вакцин для предотвращения возникновения эпидемий холеры вне эндемичных территорий и их применение для вакцинации контингентов с повышенным риском заражения, а также путешественников и туристов. В 2001 году в России вакцинация против холеры была включена в Календарь профилактических прививок по эпидемическим показаниям.
В настоящее время в мире лицензированы шесть оральных холерных вакцин (Dukoral®, mORC-VAX®, Shanchol®, Euvichol®, Vaxchora®, Oravacs®).
В России зарегистрирована вакцина холерная бивалентная химическая (1), которая представляет собой смесь холерогена-анатоксина и О-антигенов, полученных из инактивированных формалином бульонных культур Vibrio cholerae O1 классического биовара штаммов 569В или КМ76 серовара Инаба и М41 серовара Огава (2). Эта вакцина обеспечивает формирование иммунитета к обоим сероварам холерных вибрионов (3), но не защищает от холеры вызванной вибрионами 0139 серогруппы.
Вакцина, обеспечивающая иммунитет к вибрионам O1 и O139 серогрупп, есть за рубежом. Это вакцина mORC-Vax®, которая производится во Вьетнаме и применяется только в этой стране (4).
Согласно данным литературы в качестве кандидатов в вакцинные препараты могут рассматриваться везикулы наружных мембран возбудителей (5), так как расположенные на их поверхности протективные антигены белковой и липополисахаридной природы обладают не только высокой иммуногенностью, обеспечивая специфический иммунный ответ, но и адъювантными свойствами (6,7,8,9).
Вакцины на основе везикул имеют ряд важных преимуществ: они безопасны, содержат на внешней мембране иммуногенные детерминанты возбудителя, долгое время остаются стабильными даже при комнатной температуре, не требуют холодовой цепи, буферного раствора, что делает их экономически эффективными, особенно для развивающихся стран (10), что делает перспективным их применение для специфической профилактики холеры.
В России подобные исследования никогда не проводились, хотя наличие определенных преимуществ у везикул по сравнению с живыми и сложными химическими вакцинами, возможность использования коктейля из везикул холерных вибрионов разных серогрупп и биоваров для разработки комплексных вакцин, делает целесообразным проведение данных исследований, тем более что в России нет лицензированной вакцины против холеры, вызываемой вибрионами 0139 серогруппы.
Известен способ получения и композиция вакцины против V.cholerae (11), содержащей везикулы наружной мембраны, выделенные из штаммов Е7946 и 0395 холерного вибриона. Полученная вакцина, состоит из пузырьков наружной мембраны V. cholerae для интраназального, внутрибрюшинного, перорального или внутрижелудочного введения. Показано, что данная вакцина не только создает иммунитет у индивидуума, но и может формировать иммунитет у потомства от вакцинированной матери.
Недостатком данного способа является то, что в некоторых вариантах осуществления изобретения используются токсигенные штаммы V. cholerae Е7946 и 0395. Штамм Е7946 является клиническим изолятом 7-й пандемии холеры и относится к серогруппе O1, биотипу ElTor и серотипу Ogawa. 0395 является клиническим изолятом 6-й пандемии и относится к серогруппе O1, классическому биотипу и серотипу Ogawa. Работа с токсигенными штаммами требует соблюдения особых мер безопасности и контроля полученных препаратов везикул на предмет отсутствия в них холерного токсина, основного фактора патогенности холерного вибриона.
Известен способ получения препарата белка OmpТ из атоксигенного штамма холерного вибриона V. choleraeEltor 18950 для моделирования противохолерного иммунитета у экспериментальных животных (12).
Однако иммунизация экспериментальных животных белком внешней мембраны OmpT, выделенным предложенным способом из штамма V. choleraeEltor 18950, предотвращает развитие экспериментальной холеры, вызванной разными биоварами и сероварами возбудителя холеры O1 серогруппы, но не препятствует заражению животных вирулентными штаммами холеры O139 серогруппы, что является недостатком данного способа.
Техническая задача предполагаемого изобретения состояла в разработке нового эффективного способа профилактики холеры для создания иммунитета к V. choleraeO1 и O139 серогруппы с помощью везикул наружных мембран, полученных из атоксигенных штаммов холерного вибриона.
Поставленная цель достигалась тем, что в способе профилактики холеры с использованием везикул для моделирования противохолерного иммунитета у экспериментальных животных, характеризующийся тем, что для профилактики развития холеры в эксперименте до заражения животных смесью 1:1 агаризованной культурой вирулентных штаммов Vibrio cholerae O1 ElTor и Vibrio, cholerae O139 путем введения внутрибрюшинно в дозе 2×108 м.к. в объеме 0,2 мл, мышей весом 16-20 г иммунизируют парентерально двукратно с интервалом в семь дней в объеме 0,2 мл смеси, состоящей из везикул наружных мембран Vibrio cholerae O1 El Tor 18950-5 мкг и Vibrio cholerae O139 серогруппы 17786 -5 мкг, учет результата эффективности созданного везикулами противохолерного иммунитета оценивают положительным, если после заражения животных, отсутствует генерализованная холера у экспериментальных животных.
Способ осуществляется поэтапно по следующей технологии:
1 -этап заключается в получении препарата везикул;
2-этап применение препарата для профилактики холеры, создавая противохолерный иммунитет у экспериментальных животных.
По 1-ому этапу:
Культуру Vibriocholerae O1 ElTor 18950 (ctxA- tcpA-) и V. cholerae O139 серогруппы 17786 (ctxA- tcpA-), полученных из музея живых культур ФКУЗ Ростовского-на-Дону противочумного института Роспотребнадзора, выращивают при 37°С 18 часов на агаре Мартена (рН 7.6). Из суточной агаровой культуры делают 1 млрд. взвесь в 3 мл физиологического раствора (рН 7.8) и 0,5 мл взвеси засевают в 25 мл бульона LB (LangleteP. etal. 2019). Штаммы культивируют с дополнительной аэрацией (шуттелированием) 120-130 качаний в минуту на шуттеле (Incubatorshaker, serious 25, США) 18 часов при 37°С. Из выросшей культуры засевают по 0,5 мл в 4 флакона среды LB по 250 мл и выращивают 18 часов с аэрацией.
После обеззараживания мертиолятом натрия 1:10000 культуру с последующим контролем на специфическую стерильность с помощью бактериологического метода, выращенную в питательной жидкой среде, центрифугируют при 6000 об/мин 25 минут на холоду на центрифуге (BekmanmodelJ2-21, США). Полученные фильтраты фильтруют через мембраны с диаметром пор 0,45 мкм и 0,22 мкм. Затем концентрируют препараты в 10 раз на ультрафильтрационной установке (Amicon, США), с последующим центрифугированием образцов при 45000g в течение 2 часов. Осадок растворяют в 500 мкл физиологического раствора (рН 7.8) для дальнейшего исследования. Белок в полученных препаратах составлял 400-500 мкг/мл. Детекцию белка проводят на приборе (BioRad). Готовые препараты хранят при -20°С.
При исследовании полученных препаратов методом электронной микроскопии обнаружены сферические образования размерами около 40-200 нм, что соответствует данным литературы для препаратов везикул V.cholerae.
По 2-му этапу профилактику холеры в эксперименте проводят:
Создают противохолерный иммунитет у белых мышей, весом 16 - 20 г, в возрасте 6-10 недель, полученных из питомника Ростовского противочумного института Роспотребнадзора. Для этого 10-и группам белых мышей (по 20 шт в группе) иммунизируют парентерально однократно и двукратно с интервалом в семь дней препаратами везикул по 2,5 мкг в объеме 0, 2 мл и 5 мкг в объеме 0,2 мл и смесью полученных препаратов по 5 мкг в 0,2 мл. Группе контрольных животных дают физиологический раствор по той же схеме и в том же объеме.
Для изучения протективных свойств везикул наружных мембран холерного вибриона используют модель генерализованной инфекции холеры на белых мышах. Для этого культуры V. choleraeElTorO1 5879 и V. cholerae 0139 16066 выращивают при температуре 37°С в течение 18 час и готовят 1 млрд взвеси в хлориде натрия по стандарту мутности. Агар Нобля (Difco) растворяют в дистиллированной воде, кипятят в течение 30 мин на водяной бане при постоянном помешивании, охлаждали до 45°С и соединяют с 1 млрд. взвесью культуры в соотношении 1:1 до конечной концентрации агара 0,2%. Полученными взвесями V. cholerae в агаризированном растворе хлорида натрия заражают белых мышей внутрибрюшинно в дозе 2×108 микробных клеток (м.к.) в объеме 0,2 мл.
Развитие генерализованной холеры в течение суток подтверждена 100% -ой гибелью контрольных животных.
Эффективность предложенного способа отражена в следующих примерах:
Пример 1. Оценка эффективности однократного введения препаратов везикул наружных мембран холерного вибриона на модели белых мышей.
Четные группы белых мышей (по 20 шт в группе) иммунизируют парентерально однократно препаратами везикул V.choleraeO1 ElTor 18950 и V. cholerae O139 серогруппы 17786 по 2,5 мкг в объеме 0,2 мл и 5 мкг в объеме 0,2 мл. Группа контрольных животных (20 шт) получает физиологический раствор по той же схеме и в том же объеме (см. таблицу 1). Через две недели после иммунизации проводят оценку защитной эффективности полученных препаратов, заражая животных агаризованной культурой вирулентных штаммов V. cholerae ElTor O1 5879 и O139 16066, соответственно применяемым для иммунизации препаратом.
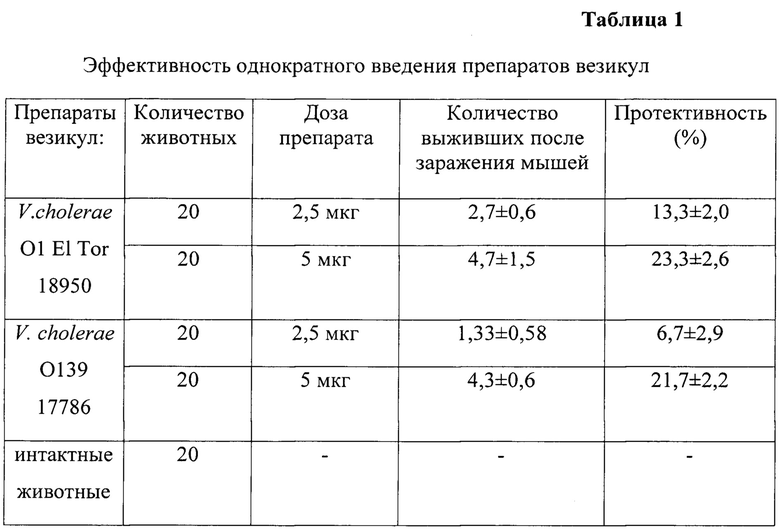
Полученные результаты показывают, что однократное введение везикул холерных вибрионов, выделенных и из штамма O1 серогруппы, и из штамма O139 серогруппы, как при дозе 2,5 мкг, так и при 5 мкг не достаточно эффективно защищают животных от развития генерализованной холеры.
Таким образом, однократное применение препаратов везикул в исследованных дозах не приводят к формированию напряженного иммунитета против возбудителя холеры.
Пример 2. Изучение протективной активности препаратов везикул наружных мембран холерного вибриона при двукратном введении
Белым мышам (4 группы по 20 шт в каждой) парентерально вводят двукратно(с интервалом в семь дней) везикулы V.choleraeO1 ElTor 18950 и V. cholerae O139 серогруппы 17786 по 2,5 мкг в объеме 0,2 мл и 5 мкг в объеме 0,2 мл. Группа контрольных животных (20 шт) получает физиологический раствор по той же схеме и в том же объеме. Через две недели после последней иммунизации оценивают протективную способность полученных препаратов путем заражения животных культурой вирулентных штаммов V. choleraeElTor O1 5879 и O139 16066, в зависимости от типа везикул (см. таблицу 2).
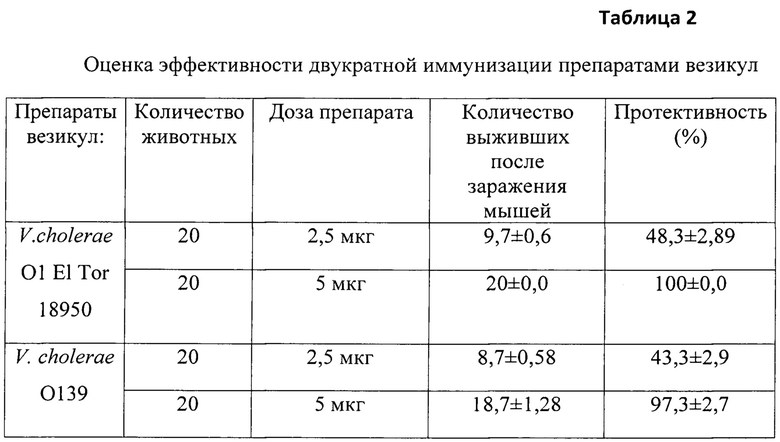
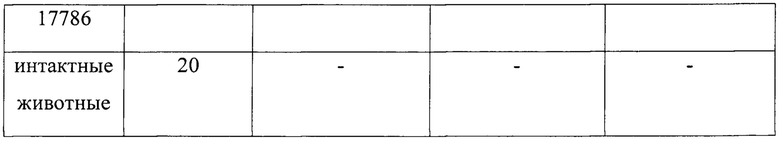
Оценка полученных результатов показала, что двукратное введение привело к формированию противохолерного иммунитета у половины экспериментальных животных, иммунизированных везикулами из штамма возбудителя холеры O1 серогруппы, и у 45% мышей, получавших везикулы из штамма O139 серогруппы. Увеличение иммунизирующей дозы в два раза способствовало формированию иммунитета к возбудителю холеры у всех взятых в эксперимент животных опытных групп.
Таким образом, двукратное, с интервалом в семь дней, применение препарата везикул в дозе 5 мкг приводит к формированию напряженного иммунитета против возбудителя холеры как 01, так и 0139 серогруппы.
Пример 3. Изучение возможности использования микста везикул, выделенных их штаммов O1 и O139 серогрупп, для создания противохолерного иммунитета к возбудителю холеры O1 и O139 серогрупп.
Учитывая, что однократная иммунизация отдельными препаратами была неэффективна, при изучении возможности применения микста везикул белым мышам (20 шт) парентерально вводят двукратно(с интервалом в семь дней) 0,2 мл смеси, состоящей из везикул V.choleraeO1 ElTor 18950 (5 мкг) и V. cholerae O139 серогруппы 17786(5 мкг).Группа контрольных животных (20 шт) получает физиологический раствор по той же схеме и в том же объеме.
Через две недели после последней иммунизации оценивают протективную способность полученных препаратов путем заражения животных смесью (1:1) агаризованных культур вирулентных штаммов V. choleraeO1ElTor 5879 и O139 16066 (см. таблицу 3).
Результаты, приведенные в таблице 3, свидетельствуют о том, что двукратное введение смеси везикул предотвращает развитие экспериментальной холеры у всех взятых в эксперимент опытных животных.
Вывод: данные, отраженные в примерах подтверждают, что препараты везикул наружных мембран, полученные из атоксигенных штаммов холерных вибрионов, как по отдельности, так и в смеси, при двукратном введении в дозе 5 мкг, эффективно защищают экспериментальных животных от генерализованной формы холеры, вызванной вибрионами как O1, так и O139 серогруппы.
Использование предполагаемого изобретения позволяет создать иммунитет к возбудителям холеры O1 и O139 серогрупп, что свидетельствует об эффективности предложенного способа профилактики холеры на экспериментальных животных и целесообразности использования везикул при моделировании противохолерного иммунитета, что потребует дальнейших исследований и клинических испытаний.
Источники информации
1. Вакцина холерная бивалентная химическая;Р N001465/01-220708, 2008, Федеральное казенное учреждение здравоохранения "Российский научно-исследовательский противочумный институт "Микроб" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФКУЗ РосНИПЧИ "Микроб"), 410005, г. Саратов, ул. Университетская, д. 46, Россия.
2. Онищенко Г.Г., Кутырев В.В., Щуковская Т.Н., Смирнова Н.И., Никифоров А.К. и др. Специфическая профилактика холеры в современных условиях//Проблемы особо опасных инфекций. - 2011. - Вып. 107. - С. 5-12.
3. Онищенко Г.Г., Попова А.Ю., Кутырев В.В., Смирнова Н.И., Щербакова С.А. др. Актуальные проблемы эпидемиологического надзора, лабораторной диагностики и профилактики холеры в Российской Федерации // Журн. микробиол., эпидемиол., иммунобиол. - 2016. - №1. - С. 89-101.
4. Lopez A.L., Gonzales M.L., Aldaba J.G., Nair G.B. Killed Oral Cholera Vaccines: History, Development and Implementation Challenges // TherAdv Vaccines. - 2014. - Vol. 2(5). - P. 123-36.
5. Macia L., Nanan R., Hosseini-Beheshti E., Grau G.E. Host- and microbiota-derived extracellular vesicles immune function and disease development // Int. J. Mol. Sci. - 2020. - Vol. 21(1). - P. 107.
6. Schild S., Nelson E.J., Camilli A. Immunization with Vibrio cholerae Outer Membrane Vesicles Induces Protective Immunity in Mice // Infect Immun. - 2008. - Vol. 76(10). - P. 4554-4563.
7. Leitner D.R., Lichtenegger S., Temel P. et al. A combined vaccine approach against Vibrio cholerae and ETEC based on outer membrane vesicles // Front Microbiol. - 2015. - Vol. 6. - P. 823.
8. Pritsch M., Ben-Khaled N., Chaloupka M. et al. Comparison of intranasal outer membrane vesicles with cholera toxin and injected MF59C.1 as adjuvants for malaria transmission blocking antigens AnAPN1 and Pfs48/45 //J. of Immunology Res. -2016: https://doi.org/10.1155/2016/3576028.
9. Reidl J. Biosynthesis of the outer membrane vesicles in Salmonella: are there still gram-negative bacteria? // mbio. - 2016. - Vol. 7(4): e01282-16.
10. van der Pol L., Stork M., van der Ley P. Outer membrane vesicles as platform vaccine technology // Biotechnol. J. - 2015. - Vol. 10(11). - P. 1689-1706.
11. «Способ получения и композиция вакцины против Vibriocholerae, содержащей везикулы наружной мембраны, выделенные из штаммов Е7946 и 0395, выбранных из группы». пат. №2009/049013, опубл. 18.04.2009 г.
12. «Способ получения препарата белка ОмрТ для моделирования противохолерного иммунитета у экспериментальных животных», пат. №2663102, кл. А61К 39/00, опубл. 01.08.2018 г. Бюл. №19.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ОМР Т ДЛЯ МОДЕЛИРОВАНИЯ ПРОТИВОХОЛЕРНОГО ИММУНИТЕТА У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2017 |
|
RU2663102C2 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae KM 263 БИОВАРА ЭЛЬТОР СЕРОВАРА ИНАБА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425867C1 |
| СПОСОБ ОЦЕНКИ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ЛАКТОБАЦИЛЛ И БИФИДОБАКТЕРИЙ ОТНОСИТЕЛЬНО ХОЛЕРНЫХ ВИБРИОНОВ IN VITRO | 2012 |
|
RU2487943C1 |
| СПОСОБ ОЦЕНКИ МЕСТНОГО ГУМОРАЛЬНОГО ПРОТИВОХОЛЕРНОГО ИММУНИТЕТА IN VITRO НА МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2013 |
|
RU2536707C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ЭКСПРЕССИРУЮЩАЯ КЛОНИРОВАННЫЙ ГЕН CEF VIBRIO CHOLERAE (ВАРИАНТЫ), И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ CEF VIBRIO CHOLERAE (ВАРИАНТЫ) | 2005 |
|
RU2313577C2 |
| СПОСОБ ВНУТРИВИДОВОЙ ДИФФЕРЕНЦИАЦИИ Vibrio cholerae О139 | 2004 |
|
RU2268942C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae КМ 262 БИОВАРА ЭЛЬТОР СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425868C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE КМ 169 СЕРОГРУППЫ О139 - ПРОДУЦЕНТ КАПСУЛЬНОГО АНТИГЕНА | 2003 |
|
RU2245363C1 |
| Способ профилактики холеры с помощью бактериофагов | 2021 |
|
RU2783000C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ЛПС ХОЛЕРНЫХ ВИБРИОНОВ О139 СЕРОГРУППЫ | 2010 |
|
RU2425875C1 |
Изобретение относится к области экспериментальной медицины, в частности к способу профилактики холеры с использованием препаратов на основе везикул наружной мембраны вирулентных штаммов Vibrio cholerae O1 El Tor и Vibrio cholerae O139. Мышей весом 16-20 г иммунизируют парентерально двукратно с интервалом в семь дней в объеме 0,2 мл смеси, состоящей из везикул наружных мембран Vibrio cholerae O1 El Tor 18950 - 5 мкг и Vibrio cholerae O139 17786 - 5 мкг, учет результата эффективности созданного везикулами противохолерного иммунитета оценивают положительным, если после заражения животных, отсутствует генерализованная холера у экспериментальных животных. 3 табл., 3 пр.
Способ профилактики холеры с использованием везикул для моделирования противохолерного иммунитета у экспериментальных животных, характеризующийся тем, что для профилактики развития холеры в эксперименте до заражения животных смесью 1:1 агаризованной культурой вирулентных штаммов Vibrio cholerae O1 El Tor и Vibrio cholerae O139 путем введения внутрибрюшинно в дозе 2×108 м.к. в объеме 0,2 мл, мышей весом 16-20 г иммунизируют парентерально двукратно с интервалом в семь дней в объеме 0,2 мл смеси, состоящей из везикул наружных мембран Vibrio cholerae O1 El Tor 18950 - 5 мкг и Vibrio cholerae O139 серогруппы 17786 - 5 мкг, учет результата эффективности созданного везикулами противохолерного иммунитета оценивают положительным, если после заражения животных, отсутствует генерализованная холера у экспериментальных животных.
| WO2009049013 A9, 16.04.2009 | |||
| ГОРЯЕВ А.А | |||
| и др | |||
| Эффективность и безопасность вакцин для профилактики холеры | |||
| БИОпрепараты | |||
| Профилактика, диагностика, лечение 2018 | |||
| Т | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| N | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Стр | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| GABUTTI G | |||
| et al | |||
| Cholera, the Current Status of Cholera Vaccines and Recommendations for Travellers | |||
| Vaccines (Basel) | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Art | |||
| РАСПРЕДЕЛИТЕЛЬНЫЙ МЕХАНИЗМ ДЛЯ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО ГОРЕНИЯ | 1922 |
|
SU606A1 |
| Рекомбинантный белок для иммунизации против холеры | 2019 |
|
RU2723705C1 |
Авторы
Даты
2023-03-17—Публикация
2022-08-16—Подача