Изобретение относится к области химической обработки газовых выбросов, в частности к катализатору для окислительного разложения хлорорганических соединений, содержащему золото и родий, и к способу его получения, а также к применению катализаторов, используемых для очистки бытовых и промышленных газов от паров органических соединений, содержащих хлор, в частности дихлорметан (DCM), и может быть использовано в различных системах и устройствах, используемых для разложения хлорорганических соединений в газах. Такие системы найдут применение при очистке бытовых и промышленных газов, вентвыбросов химчистки и лакокрасочных предприятий, отходящих и промежуточных газов некоторых производств химической промышленности. Подобные системы очистки могут быть использованы для деструкции хлорорганических соединений в газовых выбросах различного происхождения.
Хлорсодержащие легколетучие органические соединения широко используются в промышленности и в быту как растворители, реагенты сухой чистки, обезжиривающие агенты, а также промежуточные вещества при производстве пластмасс, синтетических резин и фармацевтических продуктов. Эти вещества поступают в окружающую среду с вентвыбросами. Кроме того, вещества этого класса образуются при сжигании топлив на электростанциях и выбрасываются в атмосферу с топочными отработанными газами. Сброс хлорорганических соединений в атмосферу привел к их значительному накоплению в окружающей среде и ее загрязнению опасными высокотоксичными веществами. Большинство хлорорганических соединений - токсичные загрязнители, характеризующиеся способностью к биоаккумуляции и относительно высокой устойчивостью к разложению в окружающей среде [A.Peter, T.Held, N.Husers, and F.A.Swartjes, Natural Attenuation. In: F.A.Swartjes (ed.), Dealing with Contaminated Sites, 979-1014, DOI 10.1007/978-90-481-9757-6_22, С_Springer Science + Business Media B.V. 2011]. Известные биологические, адсорбционные, фотохимические, окислительные методы очистки газов и их различные комбинации малоэффективны для разложения таких экотоксикантов. Кроме того, обычное окисление путем сжигания хлорорганических соединений требует высоких температур (выше 1000°C) и приводит к образованию таких ядов, как фосген, хлор, оксид углерода, формилхлорид, фураны, диоксины, оксиды азота, которые зачастую более токсичны, чем исходные хлорорганические вещества.
Для очистки газов от хлорорганических соединений разработаны методы, основанные на окислительной деструкции этих соединений при контакте с частицами катализатора [S.Ojala, S.Pitkäaho, T.Laitinen, N.N.Koivikko, R.Brahmi, J.Gaalova, L.Matejova, A.Kucherov, S.Päivärinta, C.Hirschmann, T.Nevanperä, M.Riihimäki, M.Pirilä, R.L.Keiski. Catalysis in VOC Abatement. Top Catal (2011) 54:1224-1256]. Этот контакт может осуществляться как в специально создаваемых устройствах после предварительной адсорбции хлорорганических веществ из газового потока, так и непосредственно в существующих потоках. Требуемыми продуктами окислительной деструкции являются вода, углекислый газ (CO2) и хлороводород (HCl), который можно легко поглотить водой или щелочью. Если в составе хлорорганического соединения присутствует недостаточное количество водорода, чтобы образовать хлороводород, то окисление проводят влажным воздухом или дополнительно вводят углеводороды. Прием введения углеводородов или воды используют также для повышения селективности катализаторов в деструкции до требуемых продуктов. Из хлорпроизводных углеводородов наиболее трудно разлагаемыми являются дихлорметан (DCM) и тетрахлорэтилен (РСЕ) [A.Koyer-Gołkowska, A.Musialik-Piotrowska, J.D.Rutkowski, Oxidation of chlorinated hydrocarbons over Pt-Pd-based catalyst. Part 1. Chlorinated methanes, Catalysis Today 90 (2004) 133-138]. Для каталитической деструкции этих соединений в литературе предложен ряд катализаторов различного химического состава. Например, промышленный платиновый катализатор, содержащий помимо платины родий в массовом соотношении 3:1 на покрытии из смешанного оксида церия-циркония, нанесенные на алюмооксидный монолит, был применен для окисления РСЕ [Willinger M., Rupp E., Barbaris В., Gao S., Arnold R.G., Betterton E.A., Saez A.E. (2009). Thermocatalytic destruction of gas-phase perchloroethylene using propane as a hydrogen source. J. Hazard. Mater. 167 (2009) 770-776]. Недостатком этого катализатора является необходимость введения дополнительного компонента - пропана - как активатора и источника водорода.
Недавно для удаления галогенорганических соединений из различных выбросов и технологических газов предложен катализатор, состоящий из пористого носителя (оксида алюминия, кремния, титана, циркония, цеолита или их смеси), на поверхности которого присутствует один или несколько благородных металлов из числа Pt, Pd, Rh, Ru, Ir, Hg (0.1-20%, предпочтительно 0.5-3%), V (0.2-20%, предпочтительно 1-5%), и добавки из ряда Cr, Mn, Fe, Co, Ni (0.02-20%, предпочтительно 0.1-2%) [WO 2009013394 A1. 29.01.2009.]. К недостаткам этих катализаторов следует отнести сравнительно низкую каталитическую активность в окислительной деструкции DCM и РСЕ и, как следствие, высокие температуры (>410°C), необходимые для полного превращения малых концентраций этих хлорорганических соединений в газовых потоках при относительно небольших объемных скоростях. Кроме того, наличие в составе катализатора соединений совершенно разных классов требует сложного, многостадийного процесса его приготовления.
В литературе описан катализатор окислительной деструкции DCM в присутствии паров воды, содержащий 0.2-10 мас.% золота, остальное - оксид кобальта Co3O4 [B.Chen, C.Bai, R.Cook, J.Wright, C.Wang. Gold/cobalt oxide catalysts for oxidative destruction of dichloromethane. Catal. Today 30 (1996) 15-20]. Недостатком такого катализатора является низкая механическая прочность и термостабильность оксида кобальта. В качестве оксидного компонента золотосодержащего катализатора окислительной деструкции предложено также использовать оксиды из числа Mg, Al, Si, Ti, V, Mn, Fe, Co, Cu, Zn, Zr, Nb, Mo, In, Sn, W, модифицированные оксидом редкоземельного элемента [Патент JP 2001009284 A. 16.01.2001]. Недостатком такого катализатора является либо низкая механическая прочность и термостабильность, либо невысокая каталитическая активность: высокая конверсия галогенводородов достигается при низких (5000 ч-1) объемных скоростях, что требует использования большого количества катализатора на единицу объема очищаемого газа.
Для каталитической окислительной деструкции летучих галогенорганических соединений часто используются катализаторы, представляющие собой прочный инертный носитель определенной геометрической формы, на который наносится собственно каталитическое покрытие, состоящее из второго носителя и активного компонента либо двух и более активных компонентов.
Известен катализатор разложения газообразных хлорорганических соединений, содержащий в качестве носителя углеродное волокно, а в качестве активного компонента золото (0.05-5 мас.%) и один из оксидов группы Mg, Al, Si, Ti, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, In, Sn, La, Ce (1-25 мас.%) при молярном соотношении активных компонентов 0.005-0.2 [Патент JP 2915393 (B1). 07.05.1999]. Недостатками этого катализатора являются окисление углеродного носителя кислородом воздуха и образующимися галогенами и низкая активность в окислительной деструкции.
В литературе описан катализатор разложения хлорорганических соединений в газах, и принятый нами за прототип, содержащий носитель и нанесенные на него два каталитических компонента: первый каталитический компонент - золото, а второй каталитический компонент, по крайней мере, один оксид из числа Mg, Al, Si, Ti, Mn, Fe, Co, Ni Cu, Zn, Y, Zr, Nb, Mo, In, Sn, La, Ce. Носителем является термоустойчивый материал с удельной поверхностью, по крайней мере, 100 м2/г и диаметром преобладающих пор, по крайней мере, 10 ангстрем [WO 0016898 A1. 30.03.2000]. Этот катализатор готовили либо путем последовательного нанесения прекурсоров каталитических компонентов пропиткой, либо одновременного осаждения при pH=8-10.2 прекурсоров обоих каталитических компонентов из водных растворов, содержащих хлористоводородную кислоту (HAuCl4) и соли металлов, в присутствии носителя, либо использовали оба метода нанесения, с последующей сушкой при 120°C в течение 8 часов, прокаливанием при 250-700°C (предпочтительно 300-450°C) в течение 2 часов и восстановлением при 200-600°C (предпочтительно 250-400°C) в течение 1 часа.
Недостатком известного катализатора является низкая конверсия хлорорганического соединения и образование большого количества оксида углерода CO.
Недостатком известного способа приготовления является то, что в зависимости от природы металла, соли и состава катализатора прекурсоры могут осаждаться преимущественно на разных участках поверхности носителя и образовывать отдельные, не контактирующие между собой фазы каталитических компонентов, что снижает активность и селективность катализатора.
Задачей настоящего изобретения является повышение активности и селективности катализатора, а также разработка способа его получения.
Поставленная задача достигается предлагаемым катализатором для окислительного разложения хлорорганических соединений в газах, включающим золото и оксид титана, согласно изобретению катализатор дополнительно содержит родий при следующем соотношении компонентов, мас.%:
и предложенным способом его получения путем осаждения соединения родия на оксид титана в суспензии при комнатной температуре и интенсивном перемешивании с последующими прогревом суспензии при температуре 70-98°C, пропускании водорода над суспензией при перемешивании сначала при температуре 70-98°C, а затем при комнатной температуре, с последующим прибавлением к полученной суспензии раствора соединения золота при перемешивании и комнатной температуре под водородсодержащей атмосферой.
Предлагаемый способ включает стадии осаждения и закрепления прекурсора родия на поверхности частиц оксида титана, восстановления частиц прекурсора до наночастиц металлического родия и их насыщения водородом в маточном растворе (или воде) под водородсодержащей атмосферой. Золото наносится на частицы родия путем добавления раствора соединения золота к восстановленному образцу родия на оксиде титана, находящемуся в маточном растворе или в воде под водородсодержащей атмосферой.
С целью повышения селективности катализатора по образованию хлороводорода и закрепления частиц прекурсора родия на поверхности оксида титана, маточный раствор с погруженным в него TiO2 после осаждения прекурсора родия нагревают до 70-98°C.
С целью полного осаждения золота и повышения его дисперсности нанесенные наночастицы родия насыщают водородом при комнатной температуре в водной суспензии до введения соединения золота в суспензию и осаждение золота на поверхность частиц родия ведут при комнатной температуре.
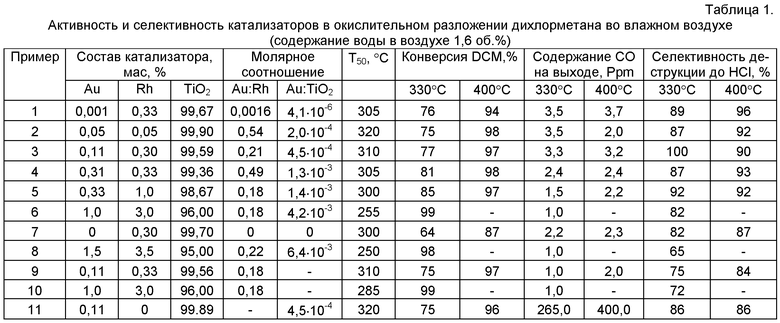
Отличительным признаком предлагаемого катализатора является использование в качестве активного компонента катализатора одновременно родия и золота, а также их количественное содержание, которое составляет 0,05-3 мас.% и 0,001-1 мас.% соответственно, что позволило увеличить активность катализатора и при этом снизить на два порядка количество образующегося оксида углерода. При концентрациях родия менее 0,05% наблюдается образование большого количества высоко токсичного CO вместо углекислого газа. Увеличение концентрации родия более 3%, а золота более 1% нецелесообразно, так как не повышает активность катализатора и, более того, приводит к снижению селективности по HCl при температурах выше 320°C.
Следует отметить, что золото-родиевые катализаторы с предлагаемым молярным соотношением (таблица 1) не предлагались вообще в катализе.
Отличительными признаками способа получения реагента являются (1) прогрев суспензии при температурах 70-98°C, что позволяет закрепить осажденное соединение родия на поверхности носителя; (2) пропускание водорода над суспензией, содержащей соединение родия на оксиде титана, при температурах 70-98°C, что способствует формированию частиц металлического родия на поверхности оксида титана, а при комнатной температуре приводит к насыщению родия водородом для последующего восстановления золота на поверхности родия; (3) осуществление насыщения водородом частиц металлического родия в жидкости при комнатной температуре, что повышает безопасность процесса и (4) использование водородсодержащей атмосферы при осаждении золота на поверхность частиц родия, что позволяет провести полное осаждение золота из растворов.
В качестве исходного соединения родия могут быть использованы соли, обычно применяемые для нанесения наночастиц родия на подложки, например ацетат, хлорид, хлор- и аминокомплексы. В качестве исходного соединения золота могут быть использованы золотохлористоводородная кислота и ее соли, обычно применяемые для нанесения наночастиц золота на подложки, а также другие комплексы, например, ацетат и галогениды золота.
Техническим результатом предлагаемого изобретения является создание катализатора для окислительного разложения хлорорганических соединений в газах с повышенными активностью и селективностью. При этом наносимый каталитический Au-Rh компонент находится преимущественно на внешней поверхности гранул оксида титана, что делает его доступным для процесса деструкции без внутри диффузионных ограничений и снижает вероятность протекания побочных процессов с образованием нежелательных продуктов. Кроме того, предлагаемый способ получения катализатора позволяет наносить Au-Rh компонент на гранулы оксида титана произвольного размера и формы.
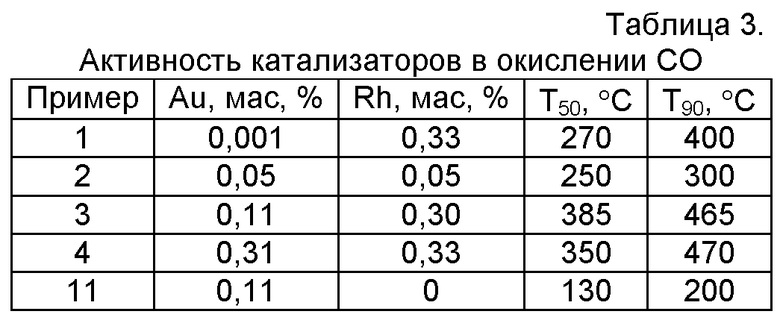
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение. Золото-родиевые катализаторы, по проведенному нами анализу научно-технической литературы, а также рефератов и описаний патентов, не использовались для окислительного разложения или гидролиза галогенорганических соединений. Изобретение также соответствует критерию «изобретательский уровень», так как в отличие от известных катализаторов окислительной деструкции хлорорганических соединений в газовой фазе, содержащих два активных компонента, одним из которых являются частицы золота, нанесенные на частицы оксида титана, предлагаемый катализатор содержит в качестве второго активного компонента наночастицы родия, а наночастицы золота нанесены исключительно только на поверхность частиц родия; активность и селективность такой системы в реакциях окислительного разложения хлорорганических соединений в газовых средах, а также предлагаемый настоящим изобретением путь их синтеза не были описаны ранее. Более того, нами были проведены дополнительные эксперименты по определению каталитической активности синтезированных образцов в реакции окисления CO, которые показали, что температура достижения 50%-ной и 90%-ной конверсии CO (Т50 и Т90) на родиевых катализаторах выше чем на золотых (таблица 3), т.е. родий содержащие катализаторы обладают значительно более низкой активностью в окислении CO, чем золотые катализаторы без родия. Таким образом, улучшение показателей окислительного разложения на родий содержащих катализаторах (таблица 1) обусловлено изменением механизма процесса окислительной деструкции за счет совокупности заявляемых признаков предполагаемого изобретения, а не повышением активности в окислении CO при введении родия.
Оценку активности катализатора проводили в лабораторных условиях. Испытания проводили в окислительном разложении дихлорметана - наиболее распространенного, токсичного и трудно разлагаемого представителя класса хлоралканов С1-С2. Для характеризации каталитических свойств катализаторов обработку воздуха, содержащего 510-580 ppm DCM и 0,25 об.% или 1,6 об.% паров воды, проводили двумя путями: (1) при термопрограммированном нагреве от комнатной температуры до 450°C (режим зажигания); (2) при постоянной температуре в диапазоне 250-420°C в течение 2-4 часов. Объемная скорость подачи газа 40000 ч-1. Сравнение образцов проводили по температуре 50%-ной конверсии DCM в режиме зажигания, а также по основным показателям процесса в стационарном состоянии при 330°C, 400°C: конверсии DCM, селективности разложения до HCl и содержанию CO в отходящих газах. Отходящий газ, после каталитического реактора, анализировали с частотой в 1 минуту и чувствительностью менее 1 ppm на содержание двенадцати возможных продуктов окислительной деструкции, используя FTIR анализатор газов. Образование каких-либо хлорорганических соединений - возможных продуктов деструкции - на катализаторах заявляемого состава не наблюдалось.
Испытания катализаторов в окислении CO проводили в проточной установке с выдержкой при постоянной температуре до постоянных значений конверсии CO. Состав реакционной смеси: CO 1,0 об.%, O2 8,0 об.%, гелий - остальное. Объемная скорость подачи реакционной смеси 6000 ч-1. Активность сравнивали по температуре достижения 50 и 90% конверсии CO.
Изобретение далее иллюстрируется примерами, не ограничивающими его объем.
Пример 1. Образец готовят по заявляемому методу. Соль родия RhCl3·3H2O (0,084 г) растворяют в 70 мл дистиллированной воды (pH=6,9) на ледяной бане при температуре 4°C. При интенсивном перемешивании добавляют по каплям 1 М раствор NaOH до pH=6,7. Концентрация родия в полученном растворе 0,045 моль л-1 (0,47 мг/мл). В полученный раствор одной порцией добавляют 10,00 г оксида титана. Выдерживают суспензию в течение 0,5 часа на ледяной бане, затем 0,5 часа при 20°C, поддерживая pH добавлением 1 М раствора NaOH. Нагревают суспензию до 80°C и выдерживают еще 1 час. После этого колбу с суспензией продувают водородом при перемешивании при температуре 80°C в течение 2 часов, затем охлаждают до комнатной температуры и продолжают перемешивать еще 1 час для насыщения родия водородом. При включенном перемешивании, без разгерметизации системы, добавляют в колбу 0,00095 М раствор HAuCl4 (0,55 мл) и продолжают перемешивание в течение 1 часа. Суспензию фильтруют, образец промывают на фильтре водой и высушивают в сушильном шкафу при 60°C. Состав катализатора и результаты испытаний активности приведены в таблицах 1-3.
Пример 2. Образец готовят по заявляемому методу. Соль родия RhCl3·3H2O (0,0069 г) растворяют в 200 мл дистиллированной воды при комнатной температуре. В полученный раствор одной порцией добавляют 4,92 г оксида титана. При интенсивном перемешивании добавляют по каплям 1 М раствор Na2CO3 до pH=6,7. Концентрация родия в полученном растворе 0,13 ммоль л-1 (0,013 мг/мл). Выдерживают суспензию в течение 12 часов при 20°C поддерживая pH добавлением 1 М раствора Na2CO3. Нагревают суспензию до 95°C и выдерживают еще 1 час. После этого колбу с суспензией продувают водородом при перемешивании в течение 2 часов при 95°C, затем охлаждают до комнатной температуры и продолжают перемешивать еще 1 час для насыщения родия водородом. При включенном перемешивании, без разгерметизации системы, добавляют в колбу 0,0095 М раствор HAuCl4 (1,30 мл) и продолжают перемешивание в течение 1 часа. Фильтруют полученную суспензию, осадок промывают на фильтре водой и высушивают в сушильном шкафу при 60°C. Состав катализатора и результаты испытаний активности приведены в таблицах 1, 3.
Пример 3. Образец готовят по заявляемому способу аналогично Примеру 1, но навеска RhCl3·3H2O 0,042 г, навеска оксида титана 5,05 г, а объем добавляемого 0,0095 М раствора HAuCl4 2,84 мл, прогрев суспензии ведут при 70°C. Состав катализатора и результаты испытаний активности приведены в таблицах 1-3.
Пример 4. Аналогичен примеру 2, но навеска соли родия 0,0488 г, навеска оксида титана 5,80 г, добавляют 0,24 М раствор HAuCl4 (0,38 мл), а pH поддерживают 1 М раствором NaOH. Состав катализатора и результаты испытаний активности приведены в таблицах 1-3.
Пример 5. Аналогичен примеру 2, но навеска соли родия 0,138 г, навеска оксида титана 5,40 г, добавляют 0,24 М раствор HAuCl4 (0,38 мл), а pH поддерживают 1 М раствором NaOH. Состав катализатора и результаты испытаний активности приведены в таблицах 1, 2.
Пример 6. Аналогичен примеру 1, но берется 0.20 г RhCl3·3Н2О, 2,62 г оксида титана, 18 мл декарбонизированной воды, 1,27 мл 0,104 М раствора HAuCl4. Состав катализатора и результаты испытаний активности приведены в таблицах 1, 2.
Следующие примеры 7-11 даны для сравнения и описывают приготовление и испытания образцов с запредельными значениями содержания родия и золота (Примеры 7, 8), а также образцов, полученных известными методами (Примеры 9, 10), и прототипа состава катализатора (Пример 11). Состав катализаторов и результаты испытаний активности в окислительной деструкции приведены в таблице 1.
Пример 7. Аналогичен примеру 3, но раствор HAuCl4 не добавляли.
Пример 8. Аналогичен примеру 2, но навеска соли родия 0,44 г, добавляют 0,24 М раствор HAuCl4 (1,57 мл), а pH поддерживают 1 М раствором NaOH.
Пример 9. Катализатор готовят пропиткой оксида титана по влагоемкости раствором, содержащим соединения обоих металлов, с последующей сушкой и прокаливанием. Пропиточный раствор содержал золотохлористоводородную кислоту и хлорид родия в количестве, требуемом для приготовления катализатора с содержанием металлов 0,11 мас.% и 0,33 мас.% соответственно. Образец после пропитки сушили при 80°C в течение 12 часов. Перед определением каталитической активности образец восстанавливают в токе водорода при 400°C. Состав катализатора и результаты испытаний активности в дехлорировании приведены в таблице 1.
Пример 10. Образец готовят методом соосаждения золота и родия в виде смешанного прекурсора с последующим восстановлением до металла. Все операции с золотосодержащими растворами проводят в посуде из темного стекла. В качестве исходного соединения золота используют [Au(NH3)4]Cl3, раствор которого готовят предварительно перед синтезом катализаторов. Для этого раствор HAuCl4 (8,3·10-4 моль/л) медленно титруют 1 М раствором аммиака до NH3:Au=4:1, не допуская превышения рН=6.0. Катализатор готовят следующим образом. В требуемое количество раствора [Au(NH3)4]Cl3 (153 мл) присыпают соответствующее количество (2,50 г) оксида титана одной порцией и перемешивают в течение 1 часа. После этого суспензию нагревают до 65°C и к ней одной порцией приливают 0,026 М раствор хлорида родия, полученный растворением 0,19 г RhCl3·3Н2О в 26,5 мл воды. Быстро доводят pH до 6,0 добавлением по каплям 1 М раствора NaOH. Осадок промывают на фильтре декарбонизированной дистиллированной водой. Для восстановления образец с фильтра переносят в круглодонную колбу на 50 мл, добавляют 29 мл воды и перемешивают до однородной массы. Продувают колбу водородом и перемешивают суспензию 2 часа. Образец фильтруют, промывают и высушивают при 80°C. Состав катализатора и результаты испытаний активности в дехлорировании приведены в таблице 1.
Пример 11. Навеску оксида титана 10,00 г суспендировали в 50 мл дистиллированной воды. К полученной суспензии при интенсивном перемешивании добавляли 0,019 г HAuCl4·4H2O. Затем pH суспензии доводили до значения 8,0 добавлением 5%-ного раствора щелочи (NaOH) и перемешивали в течение часа. Суспензию фильтровали, полученный осадок промывали дистиллированной водой. Далее последовательно проводили сушку образца при 120°C 8 часов, прокаливание - при 450°C в течение 2 часов, восстановление в водороде - при 350°C в течение 1 часа. Состав катализатора и результаты испытаний активности приведены в таблице 1.
Приведенные примеры показывают, что катализаторы предлагаемого состава, приготовленные по предлагаемому способу (Примеры 1-6), обладают высокой активностью и селективностью окисления до HCl (Таблица 1), причем на катализаторах предлагаемого состава образуется менее 4 ppm CO при окислении влажным воздухом (1,6 об.%), что на два порядка ниже чем на золотом катализаторе (сравнительный пример 11). Следует отметить, что при окислении DCM техническим воздухом (содержание влаги 0,26 об.%) конверсия DCM и селективность по HCl так же высоки, а содержание CO низкое (Таблица 2). При одновременном содержании золота и родия (Примеры 1, 3, 4) катализаторы обладают более высокой активностью в деструкции дихлорметана, чем чисто родиевый (Пример 7). На катализаторах предлагаемого состава при высоком содержании золота и родия практически полная конверсия дихлорметана наблюдается при низких температурах 330°C (Пример 6), а на катализаторах с минимальным содержанием металлов (Примеры 1-4) наблюдается более высокая селективность окисления до хлороводорода при практически полной конверсии дихлорметана вплоть до 400°C. Катализаторы заявляемого состава, приготовленные по известным способам, также обладают высокой активностью (сравнительные примеры 9, 10), однако приготовление катализатора по предлагаемому способу приводит к значительному повышению селективности до хлороводорода (Примеры 1-5).
Таким образом, техническим результатом настоящего изобретения является повышение активности катализатора и его селективности окисления до HCl, причем на катализаторах предлагаемого состава образуется менее 5 ppm CO при окислении как влажным воздухом (1,6 об.%), так и техническим воздухом (содержание воды в воздухе 0,26 об.%). Кроме того, предлагаемый способ получения катализатора позволяет наносить Au-Rh компонент на гранулы оксида титана произвольного размера и формы.
Предлагаемое изобретение может быть применимо в различных системах и устройствах, используемых для дехлорирования хлорорганических соединений в газовых выбросах и производственных помещениях на предприятиях, производящих и использующих растворители для химчистки, пятновыводители, растворители красок и т.п. Предлагаемый способ получения катализатора позволяет исключить из известного производства катализатора стадии (1) отделения носителя с нанесенным прекурсором родия от пропиточного раствора; (2) длительной сушки пропитанного носителя при 80-150°C; (3) прогрева пропитанного соединениями родия носителя при температурах 100-500°C в газовом потоке, содержащем смесь водорода и инертного газа; (4) консервации насыщенного водородом образца в водородсодержащей атмосфере. Предлагаемый способ получения катализатора является более технологичным, экономичным и безопасным. В результате существенно снижаются капитальные затраты на строительство и эксплуатацию, энергозатраты на производство и повышается безопасность производства катализатора. Предлагаемый способ является также более экологически безопасным, так как исключается образование и выброс в атмосферу экотоксикантов - продуктов термического разложения и восстановления солей родия, таких как оксиды азота, хлор, хлороводород. Исключается необходимость дополнительного строительства систем очистки отходящих газов от хлороводорода, оксидов азота. Предлагаемый способ получения катализатора является технологичным, не требует специфической аппаратуры, а исходные материалы, используемые для его получения, - оксид титана, карбонат и гидроксид натрия, золотохлористоводородная кислота, соли родия - производятся в промышленном масштабе, что в совокупности позволит организовать широкомасштабное производство катализатора на базе существующих производств химической промышленности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛЕНА | 2013 |
|
RU2528830C1 |
| КАТАЛИЗАТОР ДЛЯ ИЗБИРАТЕЛЬНОГО ОКИСЛЕНИЯ МОНООКСИДА УГЛЕРОДА В СМЕСИ С АММИАКОМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2515514C1 |
| КАТАЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2399993C2 |
| КАТАЛИЗАТОР ДЛЯ ИЗБИРАТЕЛЬНОГО ОКИСЛЕНИЯ МОНООКСИДА УГЛЕРОДА В СМЕСИ С АММИАКОМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2013 |
|
RU2515529C1 |
| КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2635092C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ N-(ФОСФОНОМЕТИЛ)-ГЛИЦИНА | 2018 |
|
RU2663905C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛМЕТАКРИЛАТА | 2014 |
|
RU2665708C2 |
| ЗОЛОТОЙ КАТАЛИЗАТОР НА НОСИТЕЛЕ | 2006 |
|
RU2378048C2 |
| СЛОИСТЫЙ КОМПОЗИТ И СПОСОБЫ ПРИГОТОВЛЕНИЯ И ИСПОЛЬЗОВАНИЯ ЭТОГО КОМПОЗИТА | 2006 |
|
RU2371249C2 |
| СЛОИСТАЯ КОМПОЗИЦИЯ И СПОСОБЫ ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ КОМПОЗИЦИИ | 2006 |
|
RU2386477C2 |
Изобретение относится к области химической обработки газовых выбросов, в частности к катализатору для окислительного разложения хлорорганических соединений и к способу его получения. Описаны катализатор для окислительного разложения хлорорганических соединений в газах, содержащий золото, родий и оксид титана при следующем соотношении компонентов, мас.%: Au - 0,001-1; Rh - 0,05-3; оксид титана (TiO2) - остальное, и способ его получения путем осаждения соединения родия на оксид титана в суспензии при комнатной температуре и интенсивном перемешивании с последующими прогревом суспензии при температуре 70-98°C, пропускании водорода над суспензией при перемешивании сначала при температуре 70-98°C, а затем при комнатной температуре с последующим прибавлением к полученной суспензии раствора соединения золота при перемешивании и комнатной температуре под водородсодержащей атмосферой. Техническим результатом настоящего изобретения является повышение активности катализатора и его селективности окисления до HCl, причем на катализаторах предлагаемого состава образуется менее 5 ppm CO при окислении как влажным воздухом (1,6 об.%), так и техническим воздухом (содержание воды в воздухе 0,26 об.%). 2 н.п. ф-лы, 3 табл., 11 пр.
1. Катализатор для окислительного разложения хлорорганических соединений в газах, включающий золото и оксид титана, отличающийся тем, что он дополнительно содержит родий при следующем соотношении компонентов, мас.%:
2. Способ получения катализатора для окислительного разложения хлорорганических соединений в газах по п.1 осуществляют путем осаждения соединения родия на оксид титана в суспензии при комнатной температуре и интенсивном перемешивании с последующими прогревом суспензии при температуре 70-98°C, пропускании водорода над суспензией при перемешивании сначала при температуре 70-98°C, а затем при комнатной температуре с последующим прибавлением к полученной суспензии раствора соединения золота при перемешивании и комнатной температуре под водородсодержащей атмосферой.
| WO 2000016898 A1, 30.03.2000 | |||
| СПОСОБ ОБЕЗВРЕЖИВАНИЯ ХЛОРСОДЕРЖАЩИХ УГЛЕВОДОРОДОВ | 1995 |
|
RU2093228C1 |
| СПОСОБ АДСОРБЦИОННО-КАТАЛИТИЧЕСКОЙ ОЧИСТКИ ВОДЫ ОТ ХЛОРАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, КАТАЛИЗАТОР-АДСОРБЕНТ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2400434C1 |
| US 7476374 B2, 13.01.2009 | |||
| JP 50092857 A, 24.07.1975 | |||
| СПОСОБ ВЫДЕЛЕНИЯ ТРИМЕТИЛХЛОРСИЛАНА ИЗ СМЕСИ С ЧЕТЫРЕХХЛОРИСТЫМ КРЕМНИЕМ | 1997 |
|
RU2119491C1 |
| US 20100228061 A1, 09.09.2010. | |||
Авторы
Даты
2013-07-27—Публикация
2012-07-18—Подача