Изобретение относится к области биотехнологии и вирусологии и касается получения новой клеточной линии почки теленка (Bos taurus), предназначенной для репродукции вирусов животных в целях их детектирования, выделения, проведения вирусологических исследований, а также для изготовления диагностических и профилактических ветеринарных биопрепаратов.
Постоянные линии клеток почек крупного рогатого скота (КРС) широко используются в научных исследованиях и биотехнологии [1, 2]. Их получают из эмбрионов, новорожденных и взрослых животных [3]. Известны следующие линии клеток почек и других органов КРС:
- почки теленка - MDBK - Madin-Darby Bovine Kidney cells;
- почки теленка - Taurus - 1;
- почки крупного рогатого скота - ПТ-80;
- почки эмбриона бычка - AUBEK;
- трахеи эмбриона бычка - FBT.
Эти и другие линии клеток почек теленка и других органов КРС используются для культивирования вирусов диареи, ринотрахеита [4], гриппа, парагриппа-III, коронавирусов, аденовирусов и др. (А.с. СССР №1347448, 1985; А.с. СССР №1212043, 15.10.1985 [5]). Линии клеток различаются по индексу пролиферации, адгезивности, чувствительности к вирусам, способности размножаться в той или иной питательной среде, антигенности, цитогенетическим характеристикам, морфологии. Постоянные клеточные линии, полученные из почек и других органов КРС, делятся по степени хромосомной трансформации на 2 группы: первая группа с околодиплоидным набором хромосом (58-62 хромосомы) и без значительных хромосомных перестроек, к которой относятся линии клеток Taurus-1, ПТ-80, AUBEK [5, 6, 7]; вторая группа с гипоплоидным модальным классом (50-52 хромосомы) и наличием от 8 до 11 маркерных, трансформированных хромосом, к которой относятся линии клеток MDBK, FBT [8, 9].
В ходе продолжительного пассирования выше представленные постоянные клеточные линии, как правило, неоднородные по цитогенетическим, морфологическим и физиологическим характеристикам, имеют ограниченное применение в вирусологической работе, что обуславливает необходимость расширения арсенала клеток животных посредством получения новых клеточных линий со стабильными культуральными свойствами и широким диапазоном использования в производстве вакцин.
Наиболее близкой линией клеток по цитоморфологическим, кариологическим и культуральным признакам является MDBK, которая была получена в 1958 году [8] и имеет несколько трофовариантов [9]. По биотехнологическим параметрам она уступает вновь полученной линии: средняя продуктивность MDBK с клинского матраса равна 100÷130 млн. клеток, с роллера объемом 3 л 120÷150 млн. клеток. Также эта клеточная линия быстро элиминируется после снижения количества сыворотки менее 5%.
Задачей, на решение которой направлено данное изобретение, явилось получение новой линии клеток из почки теленка с улучшенными биотехнологическими характеристиками, пригодной для детектирования и выделения широкого спектра вирусов, а также для изготовления диагностикумов и специфической профилактики вирусных заболеваний животных.
Поставленная задача решена получением линии клеток почки теленка (Bos Taurus) RBT - Rene Bos Taurus.
Сущность предлагаемого изобретения пояснена следующими графическими материалами:
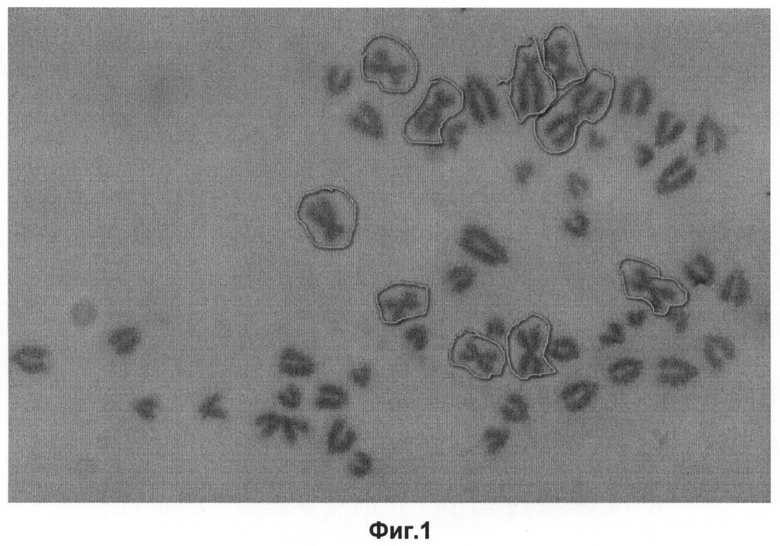
Фиг.1 - Метафазная пластинка клеточной линии RBT - 51 хромосома;
Фиг.2 - Идиограмма кариотипа RBT;
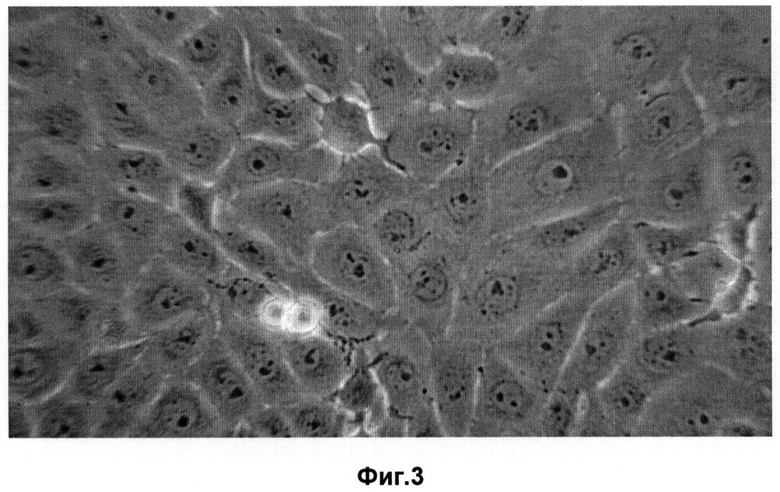
Фиг.3 - Монослой клеточной линии RBT в логарифмической фазе роста;
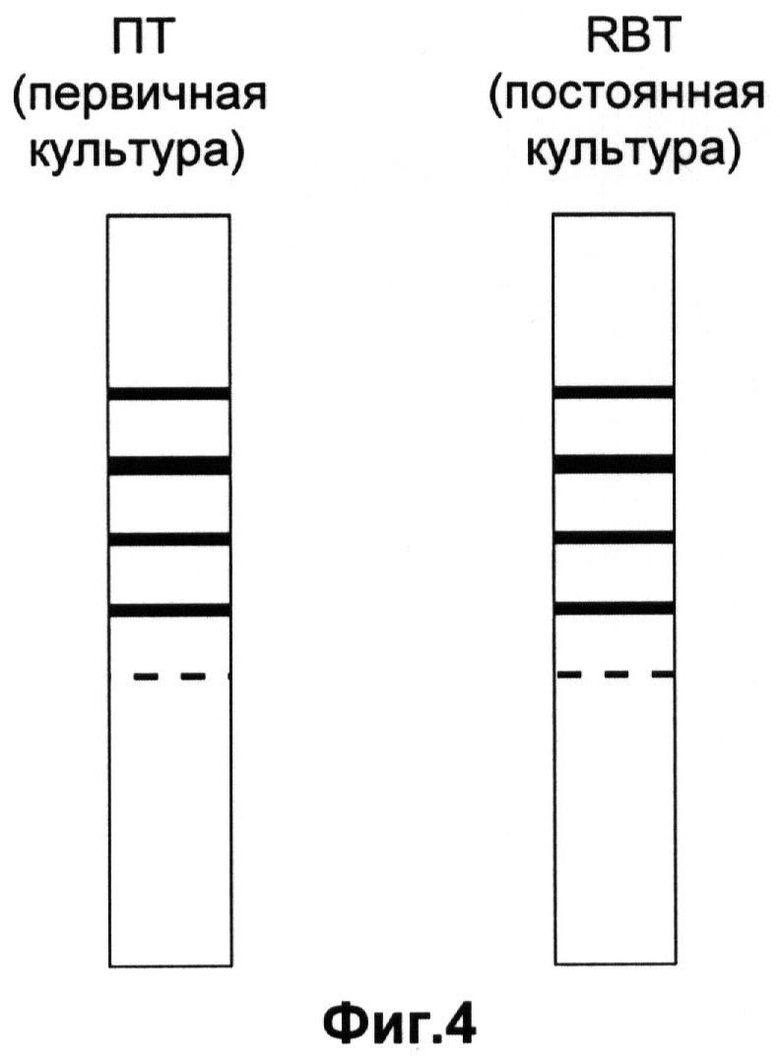
Фиг.4 - Схема спектра изоферментов ЛДГ первичной культуры (ПТ) и постоянной культуры (RBT).
Получение линии клеток почки теленка (Bos Taurus)
RBT - Rene Bos Taurus
Нами получена новая линия клеток RBT из первично трипсинизированных клеток почки 2-месячного теленка. Монослой клеток первичной культуры из почки теленка был сформирован на пятые сутки после посева первично трипсинизированных клеток в концентрации 300 000 клеток в 1 мл (со сменой среды после 2-х суток культивирования). Для выращивания первичной культуры применялась питательная среда на основе солевого раствора Эрла с 0,4% гидролизата лактальбумина (Peptone from lactalbumin ensimatic, readilly soluble «Serva»), 0,3 г/л глютамина и витаминами, с добавлением 10% фетальной сыворотки КРС. После первого пересева сохранялась значительная потенция к пролиферации: так на первом пассаже монослой сформировался на 3-4 сутки при посевной концентрации 150000 клеток в миллилитре. Начальные пассажи субкультуру вели только на среде 0,4% ГЛА на Эрла с добавлением 10% фетальной сыворотки. На синтетических и полусинтетических средах (среда Игла MEM и ПСП) происходило резкое снижение митотической активности клеток. До 30-го пассажа культивирование проводили на среде 0,4% ГЛА на Эрла. До 11-го пассажа субкультура почки теленка отличалась полиморфизмом: присутствовали фибробластоподобные, эпителиоиды, веретенообразные и полигональные клетки. Продуктивность была незначительная - 15÷20 млн. клеток с клинского матраса. Рассев проводили один раз в неделю в пропорции 1:2, 1:1.
К 30-му пассажу появились тенденции к изоморфизму и к увеличению ростовой активности субкультуры: фибробластоподобные клетки стали укрупняться и элиминироваться. Появились группы эпителиоподобных клеток небольшого размера (до 15 мкм в адгезированном состоянии), которые активно разрастались в большие колонии и вытесняли фибробластоподобные крупные клетки. В 10÷15% популяции клеток стали появляться 1-2 метацентрические хромосомы (кроме Х-хромосомы). К этому же периоду стала увеличиваться продуктивность субкультуры (до 20÷25 млн. клеток с клинского матраса). После каждого пересева эпителиоподобных клеток становилось больше, а фибробластоподобные клетки укрупнялись и разрушались под воздействием трипсина. С этого периода культивируемые клетки стали адаптировать на среды Игла MEM и ПСП. Одно условие оставалось неизменным - использование фетальной сыворотки КРС, свободной от микоплазм и латентных вирусов.
Следующее подробное тестирование субкультуры провели на 50-52 пассажах. К этому периоду культура была полностью адаптирована к средам Игла, ПСП, MEM; продуктивность клеток с клинского матраса повысилась до 50 млн. Клеточная популяция преимущественно состояла из эпителиоподобных (полигональных) клеток, фибробластоподобные клетки почти полностью элиминировались, но появились гигантские клетки (до 10% от общей площади монослоя), которые сохранялись в пассажах. Произошли значительные изменения в кариотипе: появилось 6-7 мета- и субметацентрических аутосом; модальный класс сформировался в пределах 53-54 хромосом, полиплоиды и гигантские клетки составили 6÷8%.
Дальнейшее исследование культуры проводилось на 65-м пассаже, когда продуктивность клеток с клинского матраса увеличилась до 100 млн. и более, а рассев клеток можно было проводить в пропорциях 1:4÷1:8. Также была выявлена способность клеточной линии к росту во вращающихся 3-литровых сосудах.
Сформировавшаяся популяция клеток, на данном этапе своего существования, по вышеперечисленным признакам, обозначилась как постоянная (перевиваемая) линия клеток. Кариологическое изучение клеток на 65 и 81 пассажах показало, что модальный класс стабилизировался на уровне 51 хромосомы, появилось 10 мета- и субметацентрических хромосом, которые являются маркерами новой клеточной культуры (Фиг.1, 2).
Клетки сформированного монослоя отличаются изоморфизмом эпителиоподобных и веретенообразных клеток, количество полиплоидов (гигантские клетки) значительно уменьшилось и составило менее 1%. Ядра клеток в основном округлые, содержат 1-2 крупных ядрышка (Фиг.3). В стационарной фазе роста мембраны клеток слабо контрастируются (формируется псевдосинцитий). В то же время клеточная культура хорошо трипсинизируется до единичных клеток.
Проведенный анализ изоферментов ЛДГ подтвердил видовое происхождение данной клеточной культуры от крупного рогатого скота Bos taurus (Фиг.4). Спектр линий изоферментов ЛДГ, представленный на схеме для первичной культуры клеток ПТ (почка теленка), полностью идентичен таковым для новой перевиваемой культуры клеток из почки теленка - RBT.
Высевы на баксреды на всех этапах формирования клеточной культуры показали отсутствие контаминации ее бактериями, дрожжами, грибами и микоплазмами.
Клетки претерпели в общей сложности 65 пассажей до превращения из субкультуры в высокопродуктивную постоянную клеточную линию с указанными выше свойствами. Их образцы, отобранные на 67-94 пассажах, были заложены на хранение в криобанк ФГБУ «ВНИИЗЖ» под авторским названием «Линия клеток почки теленка (Bos Taurus) RBT Rene Bos Taurus».
Образец постоянной линии клеток почки теленка (Bos Taurus) RBT - Rene Bos Taurus, отобранный на 78 пассаже, депонирован в 2010 г. в коллекции соматических клеток сельскохозяйственных и промысловых животных Всероссийского научно-исследовательского института экспериментальной ветеринарии РККК(П) (СХЖ РАСХН) под №74.
Биотехнологические характеристики
Клетки RBT выращивают при рН 6,9÷7,2 и температуре 36÷38°С в монослое, в пластиковых или стеклянных сосудах емкостью от 50 до 1500 мл и во вращающихся сосудах 2000-3000 мл при соотношении среды и объема сосуда в пределах 1:6÷1:10. При этом используют среду MEM с 0,25% гидролизата лактальбумина или ПСП на солевом растворе Эрла с добавлением 10% сыворотки КРС. В таблице 1 представлены данные о продуктивности клеточной культуры RBT при культивировании в разных культуральных емкостях.
При кратности рассева 1:4÷1:8 монослой образуется спустя 2-4 суток культивирования без смены среды. Субкультивирование проводится общепринятым методом, вызывая диспергирование монослоя смесью, содержащей 0,02% версена (этилендиаминтетраацетат) и 0,25% трипсина в соотношении 1:1. Долю жизнеспособных клеток определяют методом суправитального окрашивания снятой суспензии - трипановым синим, а также по результатам наблюдения за динамикой роста посеянной культуры. Исследование кинетических характеристик линии RBT на 94 пассаже показало, что максимальный урожай на уровне 150÷200 миллионов клеток в матрасе 1500 мл обеспечивается через 4 дня при посевной плотности 100 тыс. клеток в мл (таблица 1). Продуктивность в роллерных сосудах достигает 400 млн./кл. В пересчете на площадь, продуктивность с 1 см2 достигает 660 тыс. клеток.
В стандартных условиях культивирования клеточная линия имеет высокий уровень гликолиза. При закислении среды, дегенерация клеточной культуры начинается на 5÷7 сутки. Полное разрушение монослоя при 37°С наступает на 10÷12 сутки роста.
Кроме стандартных параметров культивирования, клеточная линия RBT стабильно растет в течение 10 и более пассажей с применением 2% сыворотки КРС вместо 10%. Снижение пролиферации клеток наступает после 5 последовательных пассажей с применением 0,6% сыворотки.
Ампулы с клетками RBT, сконцентрированными до плотности 5,0÷10,0×106 кл/мл в свежей ростовой среде с 10% диметилсульфоксида, хранят в жидком азоте. Клетки размораживают, оттаивая ампулы в водяной бане при температуре 37÷38°С. Оптимальный уровень пролиферативной активности клеточной культуры, отмеченный перед замораживанием, достигается уже на 2 пассаже после оттаивания.
Монослой, формируемый клетками RBT, характеризуется упорядоченной ориентацией вытянутых полигональных эпителиоподобных клеток. Ядра клеток, как правило, округлой или овальной формы, различной величины (в зависимости от стадии клеточного цикла), с 1-2 крупными и несколькими мелкими ядрышками.
В процессе получения постоянно клеточной линии RBT видовая принадлежность была проверена методами и кариологического анализа 11, 30, 50, 65, 81 пассажей. Во всех случаях по спектру изоферментов ЛДГ обнаруживали признаки вида Bos Taurus. В кариотипе клеточной линии произошла стабилизация: сформировался модальный класс популяции клеток с 51 хромосомами (32%); клетки с 50-52 хромосомами составляют 77%; полиморфизм от 40 до 65 хромосом. В кариотипе присутствуют 9 метацентрических и одна субметацентрическая хромосомы, У-хромосома элиминирована, полиплоидов менее 1%.
При обследовании клеток цитохимическими методами (окрашивание акридиновым оранжевым или оливомицином), а также при высевах на баксреды (МПБ, МПА, ТГС и 0,3% PPLO-агар), при исследовании методом электронной микроскопии и ПЦР, наличия бактерий, грибов и микоплазм не выявлено.
Клетки RBT предназначены для выделения и накопления вирусов животных, для определения их инфекционной активности, изучения генетических и фенотипических свойств, а также для изготовления диагностических и вакцинных препаратов, включающих вирусы или их компоненты. Данные клетки чувствительны к заражению вирусами различных семейств инфекционного ринотрахеита (сем. герпесвирусы), чумы (сем. парамиксовирусы) и коронавируса (сем. коронавирусы) КРС, вирусной диареи - болезни слизистых КРС (сем. флавивирусы).
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1.
Репродукция коронавируса КРС в клеточных культурах
Суспензию клеток концентрацией 50÷150 тыс. кл/мл рассевали в стационарные или вращающиеся сосуды. Культивирование клеток проводили в среде Игла с 0,25% ГЛА или ПСП с 10% сыворотки КРС при температуре 36÷37°С при pH 6,9÷7,1 без смены среды до формирования полного плотного монослоя. Для размножения вируса использовали клеточный монослой, не имеющий признаков контаминации и дегенерации.
Заражение культуры проводили посредством контакта концентрированной суспензии вируса с монослоем в клинских матрасах, предварительно удалив использованную ростовую среду и дважды сполоснув клетки подогретым раствором Хенкса. Контакт вируса с клетками осуществляли в течение 1 часа с 5÷8 мл вирусной суспензии при 37°C, добавленным в количестве, обеспечивающем множественность заражения 1,0-5,0 ТЦД50/мл на одну клетку. Этой порцией вируса равномерно орошали монослой, слегка покачивая культуральный сосуд. Для обеспечения указанной множественности заражения концентрат посевного вируса и поддерживающую среду смешивали, как правило, в соотношении 1:30÷1:50. Затем в культуральные сосуды добавляли среду ПСП без сыворотки и инкубировали при pH 7,2÷7,3 в течение 45÷96 часов при температуре 37°C до наступления полного лизиса инфицированной культуры.
Полученный таким образом вирусный материал замораживали при температуре минус 40°C для извлечения максимального вирусного урожая. Затем его титровали в клеточной культуре RBT и Taurus-2 в пенициллиновых флаконах. Титр вируса, полученный на культуре RBT, был в пределах 8,0÷9,0 lg ТЦД50/мл (таблица 2).
В последующих опытах было установлено, что при заражении клеток RBT на любом уровне после 65 пассажа штаммами коронавируса КРС его урожай стабильно воспроизводился с титрами инфекционной активности, находившимися в тех же пределах.
Пример 2.
Репродукция вируса инфекционного ринотрахеита КРС
С клетками и вирусом обращались так же, как описано в примере 1. Титрование проводили на клеточных культурах RBT, MDBK, ЯДК-04. Репродукция вируса в культуре клеток RBT происходила за 24÷48 часов, быстрее, чем на других культурах. Титр достигал 7,0÷8,0 lg ТЦД50/мл (таблица 3).
Пример 3.
Репродукция вирусной диареи - болезни слизистых КРС
С клетками и вирусом обращались так же, как описано в примере 1. Отличие заключалось в том, что при контакте вируса с монослоем клеток в среду с вирусной суспензией добавляли трипсин в концентрации 0,01%. Титрование проводили на клеточных культурах RBT и Taurus-2. Титр инфекционной активности в культуре клеток RBT достигал 6,0÷7,0 lg ТЦД50/мл и 1:100 в ИФА (таблица 4). Пролиферативная активность клеточной культуры RBT в 2-3 раза выше, чем у Taurus-2, поэтому производство вакцин на ее основе более рентабельно.
Пример 4.
Репродукция вируса чумы КРС
Репродукция вируса чумы КРС происходит в течение 96÷120 часов. Для культивирования вируса использовали среду ПСП с 2,5% сыворотки КРС. Титрование проводили на постоянных клеточных линиях RBT, Taurus-2 и субкультуре ПТ. Титр инфекционной активности при культивировании вируса в культуре клеток RBT достигал 7,0 lg ТЦД50/мл (таблица 5).
Проведенные исследования по культивированию коронавируса и вируса ринотрахеита КРС в клеточной линии RBT свидетельствуют о высокой чувствительности этой культуры к выше указанным вирусам - 8,0÷9,0 lg ТЦД50/мл. В случае с вирусом ринотрахеита КРС клетки RBT оказались удобной системой для титрования данного вируса.
Сравнительное изучение репродукции коронавируса, вирусов ринотрахеита, диареи и чумы КРС на различных культурах позволяют сделать вывод, что предложенная новая постоянная линия клеток RBT (полученная из почки теленка) обладает высокой чувствительностью к вышеуказанным вирусам и, в сочетании с высокой пролиферативной активностью и способностью к росту во вращающихся сосудах, делает ее пригодной для производства профилактических противовирусных препаратов.
Источники информации
1. Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В., Фомина Н.В. - Вирусные болезни животных. М.: ВНИИТ и БП, 1998.
2. Спиер Р.Е., Гриффитс Дж.Б. - Биотехнология клеток животных. М.: Агропромиздат, 1989. - 185 с.
3. Дьяконов Л.П., Ситьков В.И. - Животная клетка в культуре. Методы и их применение в биотехнологии. М.: Спутник+, 2009, 656 с.
4. Козыренко Т.И., Дьяконов Л.П., Поздняков А.А. Изучение чувствительности перевиваемых клеток к вирусу инфекционного ринотрахеита КРС // Научные основы технологии промышленного производства ветеринарных препаратов: тез. докл. второй всесоюз. конф. М. 1981. - С.20-21.
5. КАТАЛОГ. Специализированная коллекция перевиваемых соматических клеточных культур сельскохозяйственных и промысловых животных РККК(П), (СХЖ РАСХН), Москва, 2006, 115 с.
6. Миронова Л.Л., Преображенская Н.К., Шитикова Г.С. и др. Отечественные линии перевиваемых клеток почек теленка - субстрат для биотехнологии - Биотехнология, 1998, №5, с.25-31.
7. Миронова Л.Л., Попова В.Д., Конюшко О.И., Хапчаев В.Д., Зыбин Д.В., Акопян А.С. Опыт создания банка авторских линий перевиваемых линий клеток и применение их в вирусологической практике - Биотехнология, 2000, №6, С.41-47.
8. Madin S.H., Darby N.B. Established Kidney Cell lines of Adult Bovine and Ovine Origin // Proc. Soc. Exp. Biol. Med. - 1958. - Vol.98. - P.574-576.
9. КАТАЛОГ. Российская коллекция клеточных культур, под ред. Г.П.Пинаева, Санкт-Петербург, 2004, 315 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм клеток почки крупного рогатого скота (Bos Taurus renibus) для репродукции вирусов | 2024 |
|
RU2832870C1 |
| TCh (Testis Capra hircus) - перевиваемая монослойная сублиния клеток тестикул месячного козлёнка, предназначенная для репродукции вирусов оспы, чумы мелких жвачных животных и заразного узелкового дерматита крупного рогатого скота, а также для изготовления диагностических и профилактических ветеринарных биопрепаратов | 2021 |
|
RU2768962C1 |
| ЛИНИЯ КЛЕТОК ЯИЧНИКОВ КОЗЫ ДОМАШНЕЙ Capra hircus L. ЯДК-04 ДЛЯ РЕПРОДУКЦИИ ВИРУСОВ ЖИВОТНЫХ | 2006 |
|
RU2335537C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ВИРУСНОЙ ДИАРЕИ, РОТАВИРУСНОЙ И КОРОНАВИРУСНОЙ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2012 |
|
RU2515058C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПАРАГРИППА-3, ИНФЕКЦИОННОГО РИНОТРАХЕИТА И ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2012 |
|
RU2504400C1 |
| ШТАММ "NADL-ВНИИЗЖ" ВИРУСА ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА DIARRHEA VIRUS BOVINUM ДЛЯ ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ, СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНОЙ ДИАРЕИ КРУПНОГО РОГАТОГО СКОТА | 2010 |
|
RU2449013C2 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ПОЧКИ ORYCTOLAGUS CUNICULUS L ДЛЯ КУЛЬТИВИРОВАНИЯ ВИРУСОВ ЖИВОТНЫХ | 1994 |
|
RU2065496C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПЕРИММУННОЙ СЫВОРОТКИ К АДЕНОВИРУСУ BOVINE-10 КРУПНОГО РОГАТОГО СКОТА | 2020 |
|
RU2772751C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ПОЧКИ SUIS DOMESTICA L. ДЛЯ КУЛЬТИВИРОВАНИЯ ВИРУСОВ ЖИВОТНЫХ | 1998 |
|
RU2140451C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ГОНАД CAPRA HIRCUS L-ПРОДУЦЕНТ ВИРУСОВ ЖИВОТНЫХ | 1994 |
|
RU2061753C1 |

Изобретение относится к области вирусологии и биотехнологии. Постоянная линия клеток почки теленка Bos taurus RBT депонирована в 2010 году в РККК(П) (СХЖ РАСХН) под №74. Линия RBT получена из первично трипсинизированных клеток почки 2-месячного теленка в процессе 65 последовательных пассажей в монослое на среде 0,4 ГЛА на Эрла с 10% фетальной сывороткой КРС. Образует однородную по морфологии популяцию эпителиальных клеток со значительным полиморфизмом в кариотипе. При этом популяция клеток с 51 хромосомами составляет 32%, в отличие от нормального кариотипа Bos taurus (60 хромосом), у RBT присутствуют 9 метацентрических и 1 субметацентрическая хромосомы, количество полиплоидов не более 2%. Линия RBT обладает высокой чувствительностью к коронавирусу, вирусу инфекционного ринотрахеита, вирусу чумы и вирусной диарее, а также высокой пролиферативной активностью и способностью к росту во вращающихся сосудах. 4 ил., 5 табл., 4 пр.
Постоянная линия клеток почки теленка Bos taurus RBT, депонированная 2010 году в РККК(П) (СХЖ РАСХН) под №74, для репродукции вирусов животных, характеризующаяся тем, что она:
- получена из первично трипсинизированных клеток почки 2-месячного теленка в процессе 65 последовательных пассажей в монослое на среде 0,4 ГЛА на Эрла с 10% фетальной сыворотки КРС;
- образует однородную по морфологии популяцию эпителиальных клеток со значительным полиморфизмом в кариотипе, при этом популяция клеток с 51 хромосомами составляет 32%, в отличие от нормального кариотипа Bos taurus (60 хромосом), у RBT присутствуют 9 метацентрических и 1 субметацентрическая хромосомы, количество полиплоидов не более 2%;
- при культивировании в монослое циклическим способом обеспечивает репродукцию коронавируса КРС с титром 8,0-8,5 lg ТЦД50/мл, вируса ринотрахеита КРС с титром 7,0-8,0 lg ТЦД50/мл, вируса чумы КРС с титром 6,0-7,0 lg ТЦД50/мл, титр инфекционной активности вирусной диареи телят в ИФА достигает 1:100.
| MADIN S.H | |||
| et al, Established Kidney Cell Lines of Adult Bovine and Ovine Origin, Proc | |||
| Soc | |||
| Exp | |||
| Biol | |||
| Med., 1958, vol.98, p.574-576 | |||
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ГОНАД CAPRA HIRCUS L-ПРОДУЦЕНТ ВИРУСОВ ЖИВОТНЫХ | 1994 |
|
RU2061753C1 |
| ДУМОВА В.В | |||
| и др | |||
| Особенности репродукции коронавируса крупного рогатого скота штамм «ВНИИЗЖ» в перевиваемой культуре клеток RBT | |||
| Вопр | |||
| вирусологии, 2011, т.56, №2, реферат. | |||
Авторы
Даты
2013-07-27—Публикация
2012-06-26—Подача