Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, к способу получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота.
Аденовирусная инфекция крупного рогатого скота - остро протекающая, контагиозная вирусная болезнь, главным образом телят, характеризующаяся поражением органов респираторно - кишечного тракта. Болезнь регистрируется во всех странах мира, в том числе и в России. Вирус вызывает заболевания крупного рогатого скота, обуславливая в 20-30% случаев вспышки респираторно - кишечных болезней. Как правило, данный возбудитель вызывают заболевания в ассоциации, с такими вирусами как инфекционный ринотрахеит, парагрипп-3, вирусная диарея в 80-8% случаях, при этом смертность телят достигает 27-30% [1]. Экономический ущерб выражается в падеже телят, снижении мясной и молочной продуктивности, выбраковке животных. В противоэпизоотических мероприятиях ведущее место отводится своевременной лабораторной диагностике. К наиболее информативным методам лабораторной диагностики инфекционных болезней относятся методы серодиагностики, такие как иммуноферментный анализ (ИФА), реакция непрямой гемагглютинации (РНГА), реакция диффузной преципитации (РДП), реакция торможения гемагглютинации (РТГА) и др.
Известно, что для серодиагностики аденовирусной инфекции крупного рогатого скота актуальным и жизненно важным является применение в лабораторной практике реакции нейтрализации (РН) (золотой стандарт диагностики) [6].
Данный метод универсален и позволяет выявлять уровень вируснейтрализующих антител для постановки диагноза, оценки животных в отношении вирусоносительства и благополучия. Метод РН уникален и является единственно верным в оценке эффективности применения вакцин, поскольку лишь при ее использовании выявляется уровень вируснейтрализующих (протективных) антител, защищающих животных от прямого заражения. Методы ИФА, РИГА, РДП, РТГА дают лишь косвенный ответ в отношении напряженности иммунитета. Диагностического набора для аденовирусной инфекции крупного рогатого скота методом РН в нашей стране не существует. Известно, что одним из этапов создания диагностического набора для постановки РН является получение высокоактивных, специфичных гипериммунных сывороток. Для этого используют, как правило, антигены, полученные из вирусов с известными биологическими характеристиками, а также используют оригинальные схемы иммунизации. Процесс получения гипериммунных сывороток не должен быть дорогостоящим, и чаще всего исследователи используют лабораторных животных (к примеру, кроликов породы шиншилла) [3].
При выборе штамма аденовируса мы учитывали, что в составе гексона аденовируса Bovine-10 обнаружены видоспецифическая (уникальная), межродоспецифическая (общая для аденовирусов I и II подгрупп КРС), родоспецифическая (общая для аденовирусов КРС - WBR -1, обезьян Ад 16 и человека Ад I), межродовая (общая для аденовирусов млекопитающих, в частности КРС - WBR -1 и птиц - Ад I) или общая для всего семейства Adenoviridae антигенные детерминанты. Эта информация имеет практический интерес, поскольку наличие в составе гексона аденовирусов первой антигенной подгруппы перекрестнореагирующих антигенных детерминант являлось основанием для создания универсального биопрепарата для диагностики аденовирусной инфекции [2].
Известен способ получения гипериммунных сывороток для создания диагностического набора и являющийся наиболее близким к предлагаемому изобретению по технической сущности (Патент РФ №2482875 от 27.05.2013 года - прототип 1) [4]. К недостаткам данного способа получения гипериммунной сыворотки можно отнести сложность технологии получения гипериммунной сыворотки, использование для иммунизации инактивированных, не очищенных антигенов, что препятствует процессу получения высоко специфических сывороток. Схема предусматривает полный цикл иммунизации в течение всего 68 дней, что не обеспечивает длительную сохранность титров антител высокой активности в течение продолжительного срока.
Известен также способ получения туляремийной диагностической сыворотки (патент РФ №2010577 от 15.04.1994 г. - прототип №2) [5]. Недостатком данного прототипа является то, что в качестве антигена используют инактивированный формалином туляремийный микроб. Формалин является канцерогеном и токсичен для животных. Для иммунизации используют лошадей, которых трудно контролировать на отсутствие эндогенных вирусов, что препятствует получению высоко специфических гипериммунных сывороток.
В доступной нам литературе не известны технологические решения, содержащие режимы способа получения гипериммунной сыворотки аналогичные заявляемому, то есть, предлагаемый способ соответствует критерию новизны.
В задачу наших исследований входило упрощение технологии получения гипериммунной сыворотки, сокращение затрат на ее получение и получение высокоактивной гипериммунной сыворотки крови на лабораторных животных, которых иммунизируют по оригинальной схеме очищенным антигеном аденовируса Bovine-10 путем гидрофобной и одностадийной анионообменной хроматографии, полученным при культивировании аденовируса на отечественных линиях перевиваемых клеток почки теленка Taurus-1 (Т-1), Taurus-2 (Т-2), Taurus - 4 (Т-4).
Цель достигают благодаря тому, что перевиваемые клетки почки теленка Т-1, Т-2, Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, Т-2, Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов, с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1, или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 6,0-7,0 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0,1-0,3 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С в течение 2-3-х дней, после чего наступает ЦПД 90%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса должен составлять не ниже 6,0-7,0 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5-3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - 80 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,2 -0,5 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестых-седьмых введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа при комнатной температуре, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения более 12 месяцев. Титр специфических антител в РН должен составлять не ниже 1:512, в РНГА не ниже 1:1024.
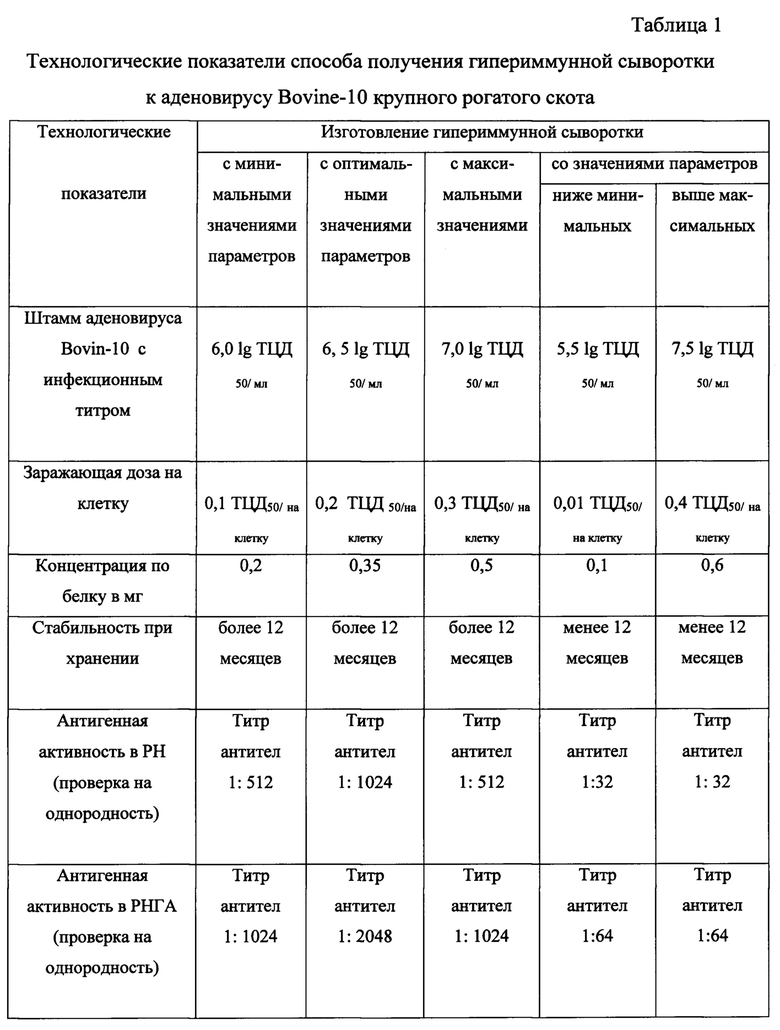
Технологические показатели способа получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота приведены в таблице 1.
Пример 1. Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота с минимальными значениями параметров.
Приготовление аденовируса (АД).
Перевиваемые клетки почки теленка Т-1, Т-2, Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, или Т-2, или Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов, с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1, или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 6,0 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0,1 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С, в течение 2-3-х дней, после чего наступает ЦПД 50%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса должен составлять не ниже 6,0 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5-3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - 80 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,2 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестых-седьмых введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения более 12 месяцев. Титр специфических антител в РН должен составлять не ниже 1:512, в РНГА не ниже 1:1024.
Пример 2. Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота с оптимальными значениями параметров.
Приготовление аденовируса (АД).
Перевиваемые клетки почки теленка Т-1, или Т-2, или Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, Т-2, Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов или в смеси из 50% среды Игла MEM с двойным набором аминокислот и витаминов, с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1 или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 6,5 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0, 2 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С, в течение 2-3-х дней, после чего наступает ЦПД 50%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса должен составлять не ниже 6,0-7,0 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5-3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - на 80 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,35 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестых-седьмых введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения более 12 месяцев. Титр специфических антител в РН должен составлять не ниже 1:1024, в РНГА не ниже 1:2048.
Пример 3. Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота с максимальными значениями параметров.
Приготовление аденовируса (АД).
Перевиваемые клетки почки теленка Т-1, или Т-2, Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, или Т-2, или Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1 или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 7,0 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0,3 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С, в течение 2-3-х дней, после чего наступает ЦПД 50%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса должен составлять не ниже 6,0-7,0 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5 - 3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - 80 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,5 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестых-седьмых введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения более 12 месяцев. Титр специфических антител в РН должен составлять не ниже 1:512, в РНГА не ниже 1:1024.
Пример 4. Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота ниже минимальных значений параметров.
Приготовление аденовируса (АД).
Перевиваемые клетки почки теленка Т-1, или Т-2, или Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, Т-2, Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1 или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 5,5 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0, 01 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С, в течение 2-3-х дней, после чего наступает ЦПД 50%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса составляет 5,5 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5-3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - 80 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,1 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестых-седьмых введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения менее 12 месяцев. Титр специфических антител в РН 1:32, в РНГА 1:64.
Пример 5. Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота выше максимальных значений параметров.
Приготовление аденовируса (АД).
Перевиваемые клетки почки теленка Т-1, или Т-2, или Т-4 поддерживают периодическими пассажами. Для этого монослой клеток Т-1, или Т-2, или Т-4 диспергируют подогретым до 37°С 0,02% раствором версена с добавлением химопсина 0,02 мг на 1,00 мл версена, затем ресуспендируют в ростовой питательной среде Игла MEM с двойным набором аминокислот и витаминов с 10% сыворотки крови крупного рогатого скота, суспензию доводят до концентрации 300000-350000 клеток в 1 мл и полученную суспензию переносят в плоские культуральные флаконы. Затем флаконы инкубируют в термостате при температуре 37°С в стационарных условиях, в атмосфере углекислого газа при 5% и 100%-ной влажности. Через 48-72 часа образуется 95-100% монослой. На монослой перевиваемых культур клеток почек теленка Т-1, или Т-2, или Т-4, выращенных в матрасах, вносят вирус с инфекционным титром 7,5 lg ТЦД50/мл (Тканевых Цитопатических Доз), из расчета 0,4 ТЦД50/клетку. Матрасы инкубируют при температуре 37°С, в течение 2-3-х дней, после чего наступает ЦПД 50%. Цитопатическое действие характеризуется округлением клеток в виде гроздьев винограда и отделением их от стекла, с последующей полной дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса составляет 7,5 lg ТЦД50/мл. Освобождение вируса из клеток осуществляет путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования. Титрование проводят по общепринятой методике. Полученную вируссодержащую жидкость очищают путем гидрофобной и одностадийной анионообменной хроматографии.
Гипериммунные сыворотки получают на кроликах породы шиншилла весом 2,5-3 кг по схеме:
1-ое введение - первые сутки;
2-ое введение - на 21 день;
3- е введение - на 35 день;
4-ое введение - на 50 день;
5-ое введение - 85 день;
6-ое введение - на 110 день;
7-ое введение - на 130 день.
Очищенный аденовирус первого типа Bovine-10 в концентрациях 0,6 мг/мл по белку вводят внутрикожно (первое, второе введение) в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда. Третье – пятое введения проводят в те же точки, с неполным адъювантом Фрейнда в тех же дозах. При шестом-седьмом введениях иммуногены вводят без адъюванта в яремную вену по 2,0 мл. Для контроля иммунизации проводят отбор крови из яремной вены, начиная с третьего введения. Полученную кровь собирают в пробирки, выдерживают в течение часа, обводят для отделения сгустка от стенок цилиндра, а затем выдерживают 12-14 часов при 4°С. Полученную сыворотку центрифугируют при скорости вращения ротора 2000-3000 об/мин. Сыворотки собирают во флаконы. Гипериммунную сыворотку подвергают контролю на однородность, стабильность, специфичность и активность в РН, РНГА. Хранят сыворотку в течение одного года, замораживая при температуре -70°С. Стабильность хранения менее 12 месяцев. Титр специфических антител в РН 1:32, в РНГА 1:64.
Источники информации:
1. Красота А.Ю., Вахрушев С.В., Алексеева Н.Ю. и др. Комплексный мониторинг эпизоотической ситуации по респираторно-кишечной патологии крупного рогатого скота в хозяйствах Московской области. // The 3rd International LRAN and RASSIA Conference. Agriculture fhd Natural Resoures. Abstracts. /М., MTAA. - 2002. - C. 137-13 8.
2. Кругляк B.A., Белоусова P.B., Народицкий B.C., Тихоненко Т.И. и др. Структурный анализ ДНК аденовирусов крупного рогатого скота. // Вестник сельскохозяйственной науки. - М., 1989. - №12. - С. 148.
3. Лабораторный регламент получения иммуноглобулинов диагностических риккетсиозных полигрупповых люминесцирующих кроличьих сухих, №170 / Р.Б. Гольдин [и др.] // Утвержден Председателем КВС при Минздраве СССР 10.02.1981. - 1980. - Л.: [Б.и.], - 48 с.
4. Патент РФ №2482875. Способ получения гипериммунных риккетсиозных сывороток / Попов С.В., Нуралова И.В., Стапанов А.В., Зуева Н.В. - Опубл. 27.05.2013; Бюл. №15.
5. Патент РФ №2010577. Способ получения диагностической сыворотки / Тюменцев С.Н., Андреевская Н.М., Тюменцева И.С., Калиновский А.И., Репина Л.П., Загоскина Т.Ю. - Опубл. 15.04.1994.
6. Сюрин В.Н. Вирусные болезни животных / Самуйленко А.Я., Соловьев Б.В., Фомина Н В.// М., ВНИТИБП. - 1998. - С. 928.
Изобретение относится к области химии и ветеринарии, а именно к способу получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота, включающему использование культурального аденовируса Bovine-10, его очищение, получение антигена и введение его кролику, в котором используют перевиваемую культуру клеток Taurus-1 (Т-1), или Taurus-2 (Т-2), или Taurus-4 (Т-4), заражающую дозу 0,1-0,3 ТЦД50/клетку, получают вирус с инфекционным титром 6,0-7,0 lg ТЦД50/мл, очищают его путем гидрофобной и одностадийной анионообменной хроматографии, получают суспензию вируса с концентрацией по белку 0,2-0,5 мг/мл, вводят внутрикожно по схеме на 1-й, 21-й дни в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда, на 35-й, 50-й, 80-й дни – в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с неполным адъювантом Фрейнда, на 110-й, 130-й дни – без адъюванта в яремную вену по 2,0 мл, получают гипериммунную сыворотку с титрами антител в реакции нейтрализации (РН) не ниже 1:512 и в реакции непрямой гемагглютинации (РНГА) не ниже 1:1024. Технический результат заключается в получении высокоактивной и высокоспецифичной гипериммунной сыворотки крови на лабораторных животных, которых иммунизируют по схеме очищенным антигеном аденовируса Bovine-10. 1 табл., 5 пр.
Способ получения гипериммунной сыворотки к аденовирусу Bovine-10 крупного рогатого скота, включающий использование культурального аденовируса Bovine-10, его очищение, получение антигена и введение его кролику, в котором используют перевиваемую культуру клеток Taurus-1 (Т-1), или Taurus-2 (Т-2), или Taurus-4 (Т-4), заражающую дозу 0,1-0,3 ТЦД50/клетку, получают вирус с инфекционным титром 6,0-7,0 lg ТЦД50/мл, очищают его путем гидрофобной и одностадийной анионообменной хроматографии, получают суспензию вируса с концентрацией по белку 0,2-0,5 мг/мл, вводят внутрикожно по схеме на 1-й, 21-й дни в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с полным адъювантом Фрейнда, на 35-й, 50-й, 80-й дни – в 20 точек вдоль позвоночного столба по 0,2 мл суспензии вируса с неполным адъювантом Фрейнда, на 110-й, 130-й дни – без адъюванта в яремную вену по 2,0 мл, получают гипериммунную сыворотку с титрами антител в реакции нейтрализации (РН) не ниже 1:512 и в реакции непрямой гемагглютинации (РНГА) не ниже 1:1024.
| ЛОБОВА Т | |||
| П | |||
| Усовершенствование лабораторной диагностики аденовирусной инфекции крупного рогатого скота: автореф | |||
| дисс | |||
| канд | |||
| биол | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| гос | |||
| акад | |||
| ветеринар | |||
| медицины и биотехнологии им | |||
| К.И | |||
| Скрябина | |||
| - Москва, 2006 | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПЕРИММУННЫХ РИККЕТСИОЗНЫХ СЫВОРОТОК | 2011 |
|
RU2482875C1 |
| Способ получения антигена аденовирусов крупного рогатого скота | 1989 |
|
SU1632973A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ БИВАЛЕНТНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСНОЙ ДИАРЕИ И АДЕНОВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2362585C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПЕРИММУННОЙ АНТИРАБИЧЕСКОЙ СЫВОРОТКИ | 2001 |
|
RU2196607C2 |
Авторы
Даты
2022-05-25—Публикация
2020-12-08—Подача