Изобретение относится к области:
- медицины, а именно к диагностике нарушений функции гематоэнцефалического барьера (ГЭБ) и мониторингу эффективности проводимой терапии;
- иммуно-диагностики, а именно к определению уровня содержания натуральных антител в сыворотке крови;
- пептидной химии, а именно к конструированию и модификации синтетических пептидных фрагментов для использования в качестве антигена для определения натуральных антител к природным белкам человеческого организма, в частности для определения натуральных антител к белку S100β человека.
Травматическое повреждение мозга при ЧМТ включает в себя два основных механизма: первичное повреждение мозга, как результат непосредственного воздействия механической энергии, и вторичное его повреждение, возникающие вследствие сложных и многообразных механизмов, запускаемых с момента получения травмы.
Говоря о первичном повреждении головного мозга, подразумевают непосредственное повреждение сосудов, аксонов, нейронов и глии, которое происходит при воздействии механической энергии и приводит к многочисленным формам поражения мозга (диффузные аксональные повреждения; ушибы и размозжения мозга; некоторые виды первичных внутричерепных кровоизлияний; множественные распространенные внутримозговые геморрагии; контузии и разрывы ствола мозга). Большинство авторов считают, что раннее выявление и устранение внутричерепных и внечерепных факторов является основополагающим моментом в лечении больных с черепно-мозговой травмой [Гайтур Э.И., и соавт., 1996; Потапов А.А., и соавт., 1996; Chesnut R.M., e.a., 1993; Pietropaoli JA, e.a., 1992].
Церебральная ишемия является наиболее важным фактором, сопровождающим вторичные повреждения мозга, и часто способствует неблагоприятным исходам ЧМТ. Некоторые авторы считают, что в основе посттравматической болезни мозга могут лежать иммунологические механизмы, которые в одних случаях облегчают течение травмы мозга, а в других - вызывают дополнительное повреждение ткани мозга, способствуя развитию отека мозга [Archelos J.J., Hartung H-P., 2000; Ганнушкина И.В., 1974]. Наиболее важное значение в посттравматических повреждениях мозга, по мнению автора, имеет потеря способности организма вовремя восстанавливать целостность ГЭБ. Сходная ситуация наблюдается при развитии опухолей мозга. Если на ранних стадиях роста опухоли функция ГЭБ остается близкой к норме, то, по мере роста опухоли, проницаемость его растет, что приводит к инфильтрации нервной ткани иммунными клетками, с одной стороны, и проникновению мозговых антигенов в кровь, с другой стороны [Fenstermaker RA and Ciesielski MJ, 2004].
В связи с этим поиск биохимических маркеров повреждения мозга и оценки состояния целостности ГЭБ являются важными задачами современной нейробиологии.
Эффективным маркером в оценке повреждения мозга является белок S-100β [Kruijk et al, 2001; Ingebrigtsen, Romner, 2003]. S-100 является специфическим белком, способным связывать кальций. Свое название белок получил благодаря свойству оставаться в растворенном состоянии в насыщенном растворе сульфата аммония. Семейство белков S-100 состоит из более, чем 18 тканеспецифических мономеров, два из которых - α и β с молекулярным весом 10,4 КД и 10,5 КД, образуют гомо- и гетеродимеры, присутствующие в высокой концентрации в клетках нервной системы. S-100(ββ) находится в высоких концентрациях в астроцитах и шванновских клетках, гетеродимер S-100(αβ) присутствует в астроцитах. S-100 (β) и S-100 (α) представлены как гомо и гетеродимеры в некоторых тканях злокачественных опухолей (меланома, глиома и некоторые опухоли мягких тканей). Белок S-100 метаболизируется в почках, а его период полураспада составляет два часа. Белок S-100β является биохимическим маркером повреждения клеток мозга. Повышение содержания этого белка в сыворотке крови и цереброспинальной жидкости отмечено при многих заболеваниях, сопровождающихся повышением проницаемости мембран и/или гибелью глиальных клеток вследствие некроза и апоптоза, а так же нарушения целостности структуры гематоэнцефалического барьера. Увеличение в биологических жидкостях концентрации белка S-100β, обозначаемого в некоторых работах как белок S-100, было найдено при остром ишемическом инсульте [Wunderekhen et al., 1999; Herrman, Vos, Wunderlich, 2000], перинатальных гипоксическо-ишемических повреждениях ЦНС у новорожденных детей, злокачественной меланоме [Henze et al., 1999; Hauschild A. et al., 1997] и ряде других заболеваний [Голосная и соавт., 2004].
Белок S-100 участвует в дифференциации цитоскелетных структур и Са+2-зависимых клеточных информационных процессах. Некроз астроцита, при повреждении мозга в результате травмы или при злокачественных опухолях, вызывающий выход белка S-100β из цитозоля в экстраклеточное пространство, а также интегральное нарушение мембран в теневой зоне ишемических очагов, приводящее к цитотоксическому и вазогенному отеку, могут являться причиной значительного увеличения содержания белка S-100β в сыворотке крови.
Определение самого белка S-100β в сыворотке крови в настоящее время достаточно широко используется в неврологии и отчасти в онкологии. На рынке представлены диагностические наборы, например: CanAg S100 EIA (CanAg Diagnostics Швеция), Human S100B ELISA Kit (Bio Vendor Laboratory Medicine, Чехия), Human S100B ELISA Kit (Abnova Corporation, Тайвань), S-100 Beta EIA Kit (Alpco Diagnostics,CUIA), Human S100 beta ELISA Kit (Cosmo Bio Co., Ltd. Япония). Несмотря на существующее разнообразие диагностических наборов, их высокая цена значительно ограничивает их применение на российском рынке. Кроме того, определение белка S-100β в крови является достаточно грубым показателем, который хоть и дает возможность диагностировать острое повреждение мозга, но не позволяет делать прогноз относительно эффективности лечении и возможного исхода заболевания.
Известны способы определения уровня антител, в том числе к белку S100β, например, описанный в патенте РФ №2107913 «Способ скринингового обследования женщин детородного возраста с помощью тест-системы ELI-P для прогноза развития эмбриона/плода и рождения здорового либо аномального ребенка» (Полетаев А.Б.; Вабищевич Н.К.; Морозов С.Г.). Наиболее близким к заявляемому решению можно считать изобретение, защищенное патентом РФ №2259567 «Способ скриннингового выявления лиц группы риска развития патологии нервной системы и мониторинга за состоянием больных, страдающих нервно-психическими заболеваниями» (Полетаев А.Б., Амбросимова А.А., Соколов М.А.).
Рассмотренные способы обладают рядом существенных отличий и недостатков:
- в качестве компонента тест-систем используется белок S100, выделенный из мозга животных, и/или цельные или фрагментированные идиотипические антитела к этому белку. Использование подверженных денатурации белка и антител затрудняет стандартизацию выполняемого анализа, т.к.
- денатурация белка снижает сроки хранения и точность тест-системы.
- подход никогда не был исследован в качестве диагностического инструмента для оценки нарушений проницаемости ГЭБ и мониторинга эффективности терапии ЧМТ,
- описываемый биомаркер никогда не был использован для диагностики онкозаболеваний, таких как злокачественная меланома, анапластическая астроцитома и мультиформная глиобластома.
Задачей настоящего технического решения является повышение эффективности тестирования неврологических и онкологических заболеваний нервной системы, а также диагностики прогноза исхода и эффективности лечения черепно-мозговой травмы, методом определения специфических антител к белку. Эффективность выражается в увеличении специфичности, снижению вариабельности теста, уменьшения количества сорбированного антигена, снижению стоимости тестирования по сравнению с использованием белка S100β, за счет создания модифицированного пептида.
Для осуществления этой задачи был разработан химически модифицированный пептид - фрагмент человеческого белка S100β, который используется следующим образом: пептид S100β (18-32) применяется в качестве антигена для иммунологического метода диагностики, для чего иммобилизуется на стандартных видах иммунологических сорбентов (полистрироловом луночном планшете, нитроцеллюлозе, нейлоне и магнитных или нано-частицах), отбирается образец крови пациента, из которого выделяется сыворотка, и в ней определяется уровень нАТ к S100β.
Использование предложенного модифицированного синтетического пептида, позволяет осуществлять анализ и/или мониторинг нАТ к белку S100β в образцах сыворотки крови человека и животных и оптимизировать тестирование неврологических и онкологических заболеваний нервной системы, за счет увеличении специфичности теста, снижения вариабельности результатов теста в 2-3 раза, уменьшения количества сорбированного антигена с 12 до 50 раз.
Сущность данного технического решения состоит в том, что предложен модифицированный пептид, состоящий из последовательности 15 аминокислот (18-32), принадлежащих человеческому белку S100β, ковалентно соединенный с ним спейсер (Ahx), состоящий из 2-аминогептановой кислоты или аналогичного с ней соединения, и ковалентно соединенная со спейсером молекулы биотина (Bio) по формуле (Таблица 1): A-Tyr1-Ser2-Gly3-Arg4-Glu5-Gly6-Asp7-Lys8-His9-Lys10-Leu11-Lys12-Lys13-Ser14-Glu15-Б, где А представляет собой Bio-Ahx, Bio-Acp, Bio или О, а Б представляет собой О или -NH2 (SEQ ID NO 1-5) (Bio обозначает биотин, Ahx обозначает остаток 2-аминогептановой кислоты, Acp - обозначает остаток, 6-аминокапроиновой кислоты, О обозначает отсутствие аминокислоты).
Последовательность человеческого белка S100β известна: Met-Ser-Glu-Leu-Glu-Lys-Ala-Met-Val-Ala-Leu-Ile-Asp-Val-Phe-His-Gln-Tyr-Ser-Gly-Arg-Glu-Gly-Asp-Lys-His-Lys-Leu-Lys-Lys-Ser-Glu-Leu-Lys-Glu-Leu-Ile-Asn-Asn-Glu-Leu-Ser-His-Phe-Leu-Glu-Glu-Ile-Lys-Glu-Gln-Glu-Val-Val-Asp-Lys-Val-Met-Glu-Thr-Leu-Asp-Asn-Asp-Gly-Asp-Gly-Glu-Cys-Asp-Phe-Gln-Glu-Phe-Met-Ala-Phe-Val-Ala-Met-Val-Thr-Thr-Ala-Cys-His-Glu-Phe-Phe-Glu-His-Glu.
Расчет для последовательности пептидного фрагмента с наиболее выраженными иммунологическими свойствами проводили методом компьютерного анализа по программам BSITE1 (Antigenic Sites Analysis Program, при использовании параметров consensus scale) и Peptide Companion (расчет с использованием данных Hopp and Woods hydrophilicity scale). Анализ полученных данных с учетом заданного размера фрагмента (10-15 аминокислотных остатков), стабильности препаратов и особенностей твердофазного пептидного синтеза позволил выбрать в качестве антигенной детерминанты последовательность 18-32:
Tyr-Ser-Gly-Arg-Glu-Gly-Asp-Lys-His-Lys-Leu-Lys-Lys-Ser-Glu.
Соответствующий пептид синтезировали в форме:
Bio-Ahx-Tyr-Ser-Gly-Arg-Glu-Gly-Asp-Lys-His-Lys-Leu-Lys-Lys-Ser-Glu-NH2
Рассчитанная структура была модифицирована добавлением «спейсера» в виде 2-аминогептановой кислоты. Добавление «спейсера» оптимизирует стерическое положение пептида после сорбции на поверхности иммунологическим планшетом. К «спейсеру» была ковалентно присоединена молекула биотина для обеспечения оптимального аффинного связывания с поверхностью иммунологических планшетов или других пригодных для использования в иммунологическом анализе сорбентов, покрытых стрептавидином. Подобная формула позволяет увеличить специфичность анализа при использовании в 10-15 раз меньшего количества антигена, чем при использовании белкового антигена S100β. Этот подход не только оптимизирует анализ, но и приводит к его значительному удешевлению.
Пример 1. Преимущества использования модифицированного пептида при определении антител к S100β.
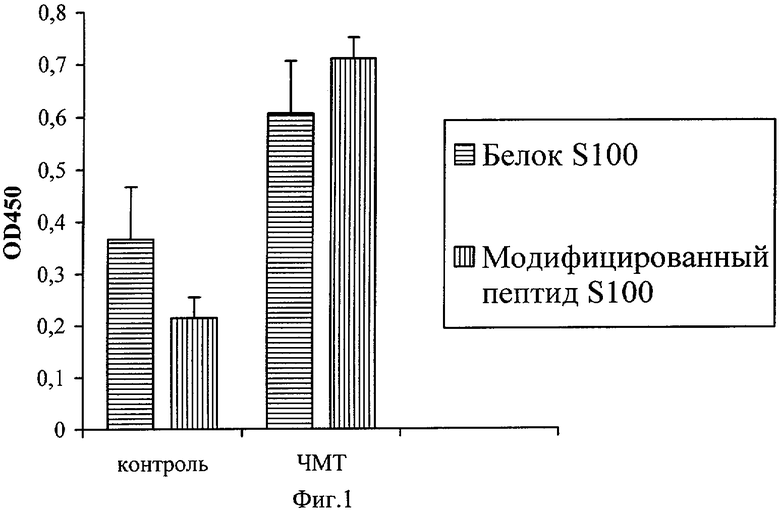
Проведено изучение эффективности использования модифицированного пептида S100β (18-32) в качестве антигена в системе твердофазного иммуноферментного анализа (ИФА) в сравнении с природным белком S100β. В эксперименте было использованы сыворотки крови крыс с экспериментальной черепно-мозговой травмой (n=9) в сравнении с группой контрольных животных (n=10). Исследование показало, что использование модифицированного пептида S100β (18-32) приводило к снижению вариабельности при определении нАТ к S100β: 19% - для белкового антигена и 6% - для пептидного. При этом одинаковая величина сигнала (оптической плотности) достигалась при использовании в 12 раз меньшего количества пептидного антигена: 0.5 мкг на ячейку иммунологического планшета для белкового антигена 0,04 мкг на ячейку для пептида. Таким образом, использование модифицированного пептида S100β (18-32) оптимизировало проведение анализа. На Фиг.1 приведены результаты иммуноферментного анализа сывороток крови крыс с экспериментальной черепно-мозговой травмой (ЧМТ) с использованием белка S100β (0,5 мкг/яч) и модифицированного пептида S100β (18-32) (0,04 мкг/яч) в качестве антигена. По оси ординат - оптическая плотность раствора после проведения анализа при длине волны 450 нм.
Исследования также показали, что модифицированный пептид S100β обладает большей эффективностью связывания с иммуносорбентами в 100-1000 раз в различных вариантах иммунодиагностики по сравнению с белком S100β. Эффективность связывания достигается за счет высокоаффинного взаимодействия биотина, входящего в структуру модифицированного пептида. и покрывающего иммуносорбент белка авидина. Таким образом, высокая константа связывания позволяет добиться практически полного связывания антигена с сорбентом, что приводит 100-1000 кратной экономии антигена при использовании модифицированного пептида. При использовании белка S100β большая часть антигена остается в растворе.
Пример 2. Взаимосвязь между эффективностью терапии в период восстановления после черепно-мозговой травмы у крыс и уровнем нАТ к модифицированному пептиду S100β (18-32).
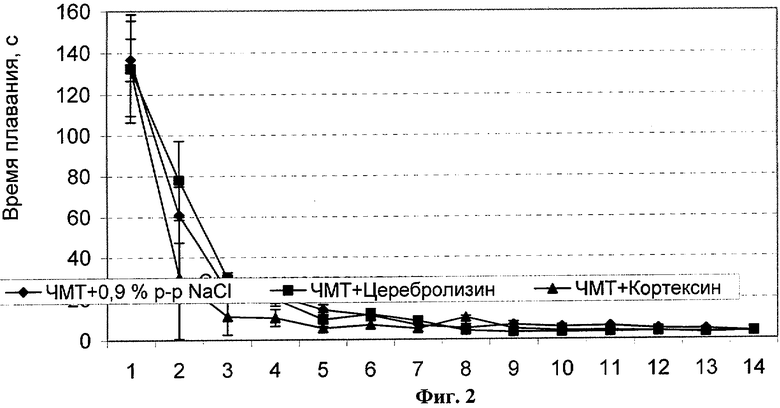
Были проведены исследования взаимосвязи между уровнем нАТ к модифицированному пептиду S100β (18-32) и эффективностью экспериментальной терапии. Исследование проведено на самцах крыс-альбиносов (n=9) массой 160-220 г. У животных был предварительно выработан условный рефлекс активного избегания плаванием. Моделирование ЧМТ проводилось с помощью weight-drop метода. Экспериментальную терапию начинали через 0,5 часа после механического воздействия. Использовали известный пептидный нейропротектор кортексин (0,15 мг/кг) (Герофарм, Россия) и препарат церебролизин (0,2 мл/кг) (EbwePharma, Австрия). Препараты вводили интраперитонеально один раз в сутки. Контрольная группа получала физиологический раствор в объеме введения препарата. Курс лечения продолжался в течение всего периода наблюдения - 7-10 суток. Оценка восстановления предварительно сформированных условных рефлексов проводилась, начиная с первых суток после нанесения ЧМТ, и продолжалась ежедневно на протяжении всего периода наблюдения (14 суток). На 14-день эксперимента у животных отбирались образцы крови. Уровень нАТ к S100β в сыворотке определяли с использованием модифицированного пептида S100β (18-32) в качестве антигена в системе твердофазного иммуноферментного анализа (ИФА). Результаты исследования продемонстрировали наличие различия по этому показателю между контрольной группой (животные без ЧМТ) и группами животных с ЧМТ с лечением (кортексин, церебролизин) и без лечения. Уровень нАТ к S100β у животных с травмой превышал контрольный в 1,5-2,5 раза в зависимости от типа лечения. Динамика восстановления условного рефлекса активного избегания плаванием при экспериментальной терапии последствий черепно-мозговой травмы у крыс отражена на Фиг.2.
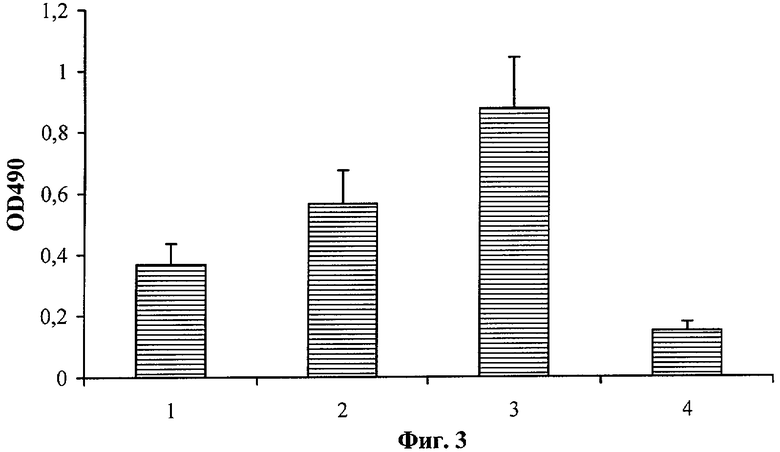
На Фиг.3 показан уровень нАТ к S100β в крови крыс на 14 день экспериментальной терапии последствий черепно-мозговой травмы у крыс. Группы: 1 - ЧМТ + Кортексин, 2 - ЧМТ + церебролизин, 3 - ЧМТ контроль (без лечения), 4 - контроль (без травмы) (n=9; P≤0,05).
Выявлено наличие выраженной корреляционной связи между скоростью восстановления условного рефлекса у животных (R=-0,78; р=0,02) и стойкостью неврологических нарушений (R=0,68; р=0,05) и уровнем нАТ к S100β. Эксперимент показал, что экспериментальная ЧМТ приводит к значительному повышению уровня нАТ к S100β к 14 дню после травмы. Кроме того, исследование продемонстрировало существование зависимости между скоростью восстановления функций ЦНС после ЧМТ и уровнем нАТ к S100β. При этом успех экспериментальной терапии и быстрое восстановление функций ЦНС были ассоциированы с более низким уровнем нАТ к S100β.
Пример 3. Мониторинг уровня нАТ к S100β у детей в процессе восстановления после ЧМТ на фоне стандартной терапии.
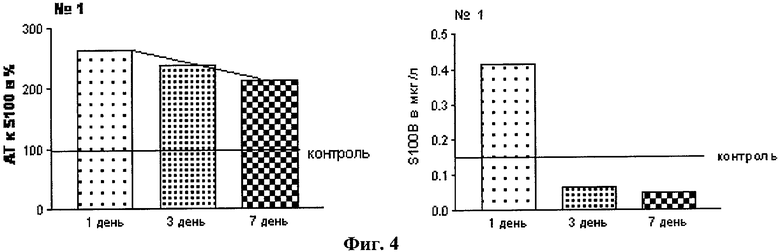
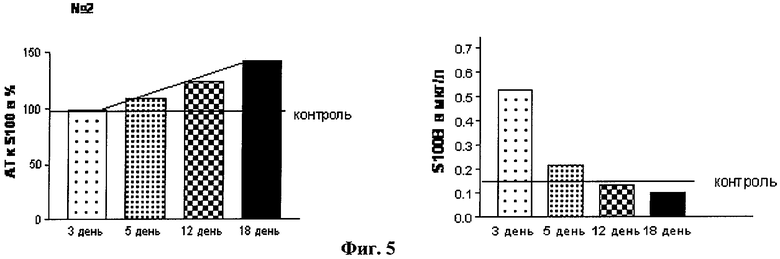
Исследована сыворотка крови 114 детей в динамике в первые дни после ЧМТ. Параллельно оценивалось содержание белка S100β (с использованием теста CanAg S100 EIA) (CanAg Diagnostics Швеция) и нАТ к модифицированному пептиду S100β (18-32) с использованием модифицированного пептида S100β (18-32) в качестве антигена в системе твердофазного иммуноферментного анализа (ИФА). На Фиг.4 отражены показатели при тяжелой ЧМТ с последующим хорошим восстановлением. Диагноз: Сочетанная тяжелая ЧМТ, ушиб головного мозга. На Фиг.5 - данные при инвалидности в результате тяжелой ЧМТ. Диагноз: Открытая ЧМТ, перелом основания черепа.
Полученные результаты позволяют сделать следующие выводы:
1. У большинства пациентов увеличение содержания нАТ к S100β (18-32) отмечается одновременно с увеличением концентрации белка S100β в крови (см. Фиг.4).
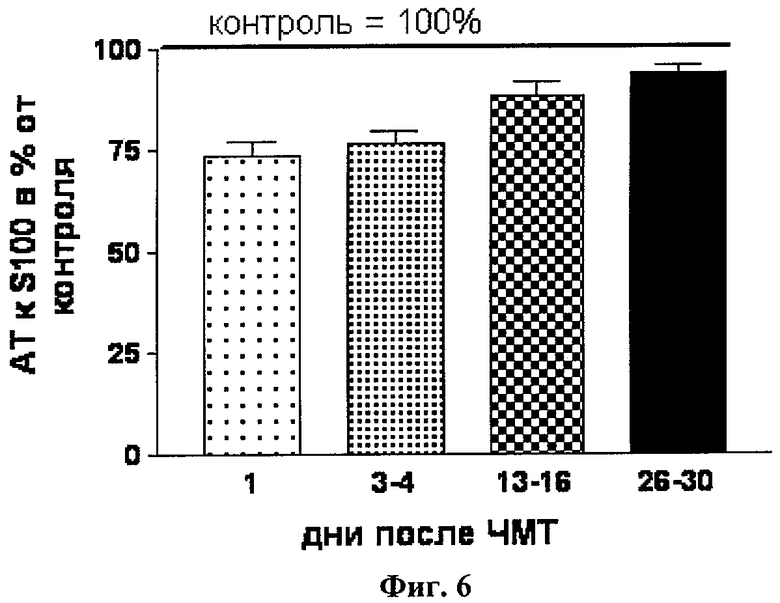
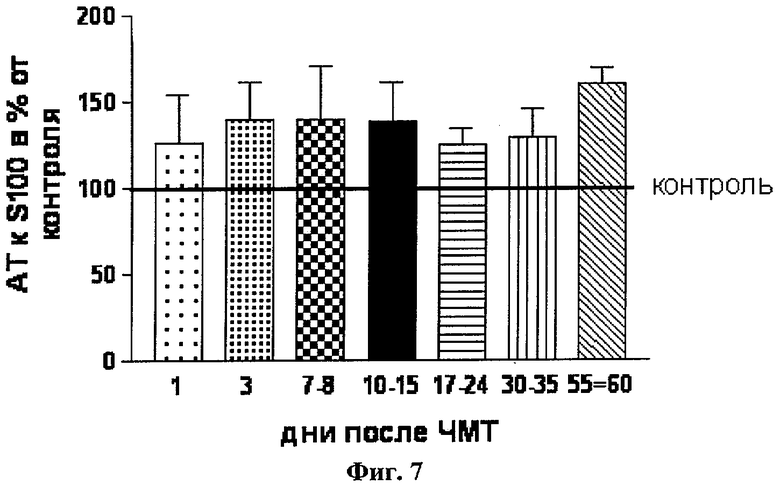
2. У детей с хорошим восстановлением церебральных функций после ЧМТ и хорошим откликом на проводимую терапию уровень нАТ к S100β (18-32) в крови (n=54) (Фиг.6) был достоверно ниже, чем у пациентов с тяжелыми последствиями и мало эффективным лечением (n=45) (Фиг.7). Динамика уровня S100β (18-32) нАТ характеризовалась снижением уровня (Фиг.4).
3. Выявлено, что у части детей с тяжелой ЧМТ отмечается увеличение содержания нАТ к S100β (18-32). Динамика уровня нАТ к S100β характеризовалась повышением уровня (Фиг.7).
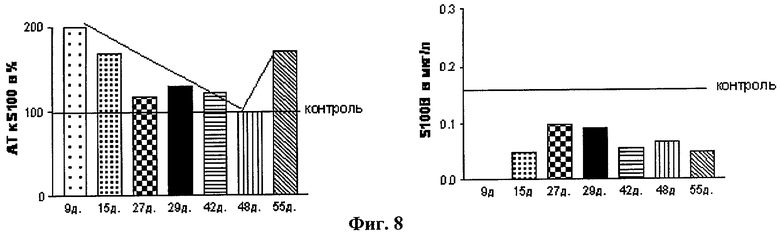
4. На Фиг.8 показано, что у пациента, находящегося в крайне тяжелом вегетативном состоянии при постоянных реанимационных мероприятиях (полная инвалидность в результате утопления - тяжелой гипоксии), наблюдалось повышенное содержание нАТ к S100β (18-32) на протяжении длительного времени, причем, при ухудшении клинического состояния отмечен вторичный подъем нАТ к S100β (18-32). AT к S100B увеличены без повышения самого белка S100B. В этом случае именно увеличение AT к S100B служит показателем повреждения барьерных механизмов, что позволяет высказать предположение, что раннее повреждение ГЭБ является неблагоприятным признаком.
Отсюда можно сделать вывод, что в этих случаях нАТ к S100β (18-32) являются чувствительным биомаркером повреждений мозга и ГЭБ в отсроченный период после ЧМТ. Принципиальными и основными отличиями использования уровня нАТ к S100β (18-32) от уровня белка S100β в крови является следующее:
1. Несмотря на то, что повышение выше нормы обоих показателей происходит одновременно после ЧМТ, дальнейшая их динамика значительно отличается. Так, уровень белка S100β снижается к норме к 3-4 дню после ЧМТ вне зависимости от тяжести, особенностей течения и исхода заболевания, в то время как динамика нАТ к S100β (18-32) зависит от этих показателей (Фиг.4, 5 и 8).
2. При благоприятном исходе тяжелой ЧМТ и ЧМТ средней степени тяжести наблюдается незначительный подъем нАТ к S100β (18-32) с последующим снижением к 7-10-му дню (Фиг.4). В случае неблагоприятного исхода ЧМТ с последующей инвалидизацией пациента отмечается прогрессирующее увеличение нАТ к S100β (18-32) и достижение им более высоких абсолютных значений (Фиг.5 и 7).
3. При легких ЧМТ с благоприятным исходом динамика уровней белка S-100β и нАТ к S100β (18-32) совпадают: незначительное быстрое повышение показателя с последующей нормализацией в течение 7-10 дней (Фиг.4 и 6).
4. При вегетативных состояниях (кома), наступивших в результате тяжелой ЧМТ, наблюдается сложная динамика уровня нАТ к S100β (18-32) с периодическими падениями и подъемами на фоне нормального уровня белка S-100β (Фиг.8).
5. Крайним случаем является летальный исход, В этом случае динамики обоих показателей идентичны: значительный подъем, достигающий своего пика 10-15 дню после ЧМТ, сменяется проградиентным снижением, приближающимся к норме к моменту смерти.
Таким образом, на основании проведенных исследований следует вывод о том, что определение уровня содержания натуральных антител (нАТ) к модифицированному пептиду является достоверным способом диагностики прогноза исхода и эффективности лечения черепно-мозговой травмы. При уровне нАТ в крови больных от 110 и до 500% по отношению к контрольному стандартному образцу диагностируют возможность осложнений в течении заболевания. При проведении серии последовательных исследований дальнейшее повышение уровня нАТ в крови больных от 110 и до 500% по отношению к контрольному стандартному образцу является показателем развития осложнений в течении заболевания и неблагоприятного прогноза, а при снижение уровня нАТ от 110% до 50% по отношению к контрольному стандартному образцу является критерием благоприятного течения заболевания и прогноза.
Уровень нАТ к модифицированному пептиду S100β (18-32) является уникальным, гораздо более специфичным и информативным показателем, чем применявшийся ранее уровень белка S100β. Он позволяет не только констатировать факт травмы и повреждения ГЭБ, но и оценивать динамику течения заболевания, эффективность терапии и делать прогнозы исхода заболевания.
Пример 4. Уровень нАТ к S100β у больных со злокачественной меланомой
Злокачественная меланома является одним из наиболее опасных видов рака кожи. Тем не менее, ранняя диагностика заболевания является важным условием эффективности терапии и снижения смертности. Наиболее важной задачей становится раннее обнаружение метастазов. Для выявления диагностического потенциала уровня нАТ к S100β (18-32) был проведен анализ сывороток крови больных, находящихся на разных стадиях заболевания (Таблица 1). Результаты анализа демонстрируют достоверное повышение уровня нАТ к S100β (18-32), начиная с III стадии заболевания. Наиболее резкое повышение уровня отмечено на стадии метастазирования. Данные свидетельствуют о перспективности использования нАТ к S100β (18-32) в качестве диагностического и, возможно, прогностического критерия при злокачественной меланоме.
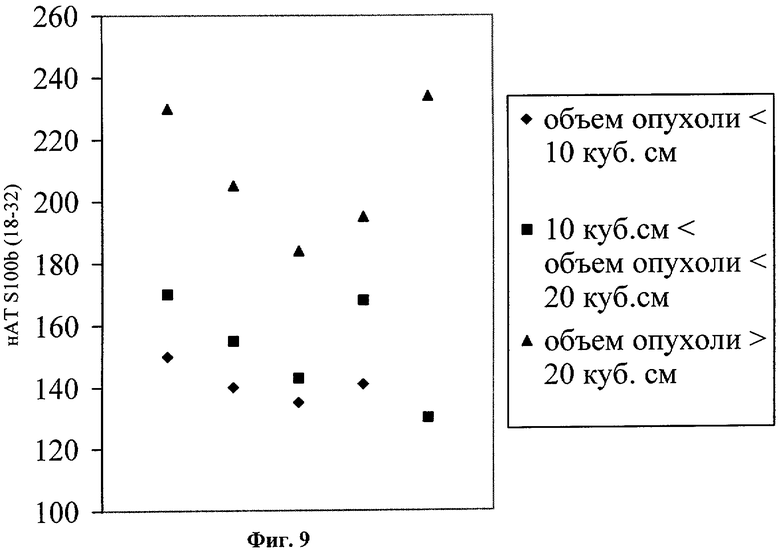
Пример 5. Взаимосвязь уровень нАТ к S100β (18-32) с объемом опухоли у больных с глиомами
У 14 больных с диагнозом анапластической астроцитома (8) и мультиформная глиобластома (6) был проведен анализ уровня нАТ к S100β (18-32) в крови. На Фиг.9 приведены данные индивидуально для каждого пациента.
Всем пациентам в период подготовки к операции был проведена МРТ (магниторезонансная томография) для определения объема и локализации опухоли. Объем опухоли рассчитывался с использованием соответствующего программного обеспечения. Анализ нАТ к S100β (18-32) проводили за 3-е суток до операции. Объем опухоли был сопоставлен с уровнем нАТ к S100β (18-32). Выявлена прямая пропорциональность между объемом опухоли и уровнем нАТ к S100β (Фиг.9).
Таким образом, настоящее изобретение обладает рядом принципиальных отличий:
- оно включает в себя специально рассчитанный стабильный синтетический пептидный фрагмент белка S100β человека S100β (18-32);
- данный пептидный фрагмент специальным образом через спейсер ковалентно связан с молекулой биотина, что позволяет значительно улучшить сорбцию антигена за счет высокоаффинного связывания с покрытыми стрепт-авидином иммуно-сорбентом;
- настоящее изобретение с высокой эффективностью применимо для экспресс-диагностики поражений ГЭБ и мониторинга эффективности терапии ЧМТ, а также как независимый прогностический критерий течения заболевания.
- настоящее изобретение применимо для диагностики ряда онкологических заболеваний таких, как меланома и глиома, и для мониторинга эффективности проводимой терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ МОДУЛИРОВАНИЯ CART-КЛЕТОК | 2017 |
|
RU2774232C2 |
| ШАТТЛ ДЛЯ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2019 |
|
RU2754794C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ РАЗЛИЧНОЙ СТЕПЕНИ ТЯЖЕСТИ (ЕГО ВАРИАНТЫ) | 2023 |
|
RU2799834C1 |
| АНТИТЕЛО, КОТОРОЕ РАСПОЗНАЕТ ПЕПТИД Т14 АСНЕ | 2016 |
|
RU2729491C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С CD20 | 2018 |
|
RU2724469C2 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ЯИЧНИКА | 2020 |
|
RU2832172C2 |
| СВЯЗЫВАЮЩИЙ RGMA БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2705304C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ СОТРЯСЕНИЯ ГОЛОВНОГО МОЗГА И УШИБА ГОЛОВНОГО МОЗГА ЛЕГКОЙ СТЕПЕНИ У ДЕТЕЙ НА РАННЕЙ СТАДИИ | 2003 |
|
RU2241225C1 |
| СОЕДИНЕНИЕ, СВЯЗЫВАЮЩЕЕ АДРЕНОМЕДУЛЛИН (ADM), ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ТЕРАПИИ ИЛИ ПРОФИЛАКТИКИ СИМПТОМОВ ЗАБОЛЕВАНИЯ | 2018 |
|
RU2790561C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 2010 |
|
RU2426992C1 |
В изобретении описан химически модифицированный пептид - фрагмент человеческого белка S100β, состоящий из последовательности 15 аминокислот, соответствующих аминокислотам в положении 18-32 аминокислотной последовательности белка S100β. Пептид ковалентно соединен со спейсером (Ahx), состоящим из 2-аминогептановой кислоты или аналогичного с ней соединения, и ковалентно соединенной со спейсером молекулой биотина (Bio). Пептид имеет общую формулу: A-Tyr1-Ser2-Gly3-Arg4-Glu5-Gly6-Asp7-Lys8-His9-Lysl0-Leull-Lysl2-Lysl3-Serl4-Glul5-Б, где А представляет собой Bio-Ahx, Bio-Acp, Bio или 0, а Б представляет собой 0 или -NH2. Bio обозначает биотин, Ahx обозначает остаток 2-аминогептановой кислоты, Acp - обозначает остаток 6-аминокапроиновой кислоты, 0 обозначает отсутствие аминокислоты. Способ диагностирования и прогнозирования меланомы предусматривает определение уровня содержания натуральных антител (нАТ) в крови к пептиду по изобретению и по концентрации антител в сравнении с контролем диагностируют стадии меланомы. Прогнозирование исхода и эффективности лечения черепно-мознговой травмы осуществляют путем определения уровня содержания нАТ к пептиду по изобретению. При снижении уровня нАТ в крови больных по отношению к контрольному стандартному образцу диагностируют благоприятный исход заболевания и эффективность лечения. Изобретение может с высокой эффективностью использоваться как экспресс-диагностика поражений ГЭБ и мониторинга эффективности терапии ЧМТ и ряда онкологических заболеваний. 3 н.п. ф-лы, 9 ил., 1 табл., 5 пр.
1. Модифицированный пептид для диагностики и прогнозирования исхода и эффективности лечения заболеваний и повреждений головного мозга, содержащий последовательность из 15 аминокислот, соответствующих аминокислотам в положении 18-32 аминокислотной последовательности человеческого белка S100β, и имеющий формулу:
A-Tyrl-Ser2-Gly3-Arg4-Glu5-Gly6-Asp7-Lys8-His9-Lysl0-Leull-Lys12-Lysl3-Serl4-Glu15-Б, где А представляет собой Bio-Ahx, Bio-Acp, Bio или 0, а Б представляет собой 0 или -NH2, представленную в SEQ ID NO 1-5, где Bio обозначает биотин, Ahx обозначает остаток 2-аминогептановой кислоты, Acp - обозначает остаток 6-аминокапроиновой кислоты, 0 обозначает отсутствие аминокислоты.
2. Способ диагностирования и прогнозирования меланомы путем определения уровня содержания натуральных антител (нАТ) в крови к пептиду по п.1, и при увеличении уровня нАТ в крови к контрольному образцу до 99% диагностируют I стадию меланомы по классификации AJCC, при увеличении уровня нАТ до 112% - II стадию, при увеличении уровня нАТ до 120% - III стадию и при увеличении уровня нАТ до 180% - IV стадию меланомы.
3. Способ прогнозирования исхода и эффективности лечения черепно-мозговой травмы, отличающийся тем, что определяют уровень содержания натуральных антител (нАТ) к пептиду по п.1 путем определения уровня нАТ по отношению к контрольному стандартному образцу и при уровне нАТ в крови больных в пределах от 50 и до 110% по отношению к контрольному стандартному образцу диагностируют благоприятный исход заболевания и эффективность лечения, при уровне нАТ в крови больных от 110 и до 500% по отношению к контрольному стандартному образцу диагностируют возможность осложнений в течении заболевания, при проведении серии последовательных исследований дальнейшее повышение уровня нАТ в крови больных от 110 и до 500% по отношению к контрольному стандартному образцу является показателем развития осложнений в течении заболевания и неблагоприятного прогноза, а при снижение уровня нАТ от 110% до 50% по отношению к контрольному стандартному образцу является критерием благоприятного течения заболевания и прогноза.
| СПОСОБ СКРИННИНГОВОГО ВЫЯВЛЕНИЯ ЛИЦ ГРУППЫ РИСКА РАЗВИТИЯ ПАТОЛОГИИ НЕРВНОЙ СИСТЕМЫ И МОНИТОРИНГА ЗА СОСТОЯНИЕМ БОЛЬНЫХ, СТРАДАЮЩИХ НЕРВНО-ПСИХИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ | 2003 |
|
RU2259567C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2258934C9 |
| СПОСОБ ВЫЯВЛЕНИЯ ГРУПП РИСКА РАЗВИТИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2218569C1 |
| EP 1521083 A2, 06.04.2005 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА РАЗВИТИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2147128C1 |
| Способ приготовления хинальдииа | 1930 |
|
SU26668A1 |
| KR 100846354 B1, 15.07.2008. | |||
Авторы
Даты
2013-08-27—Публикация
2009-02-16—Подача