Изобретение относится к ветеринарии, а именно к диагностике инфекционных заболеваний и может быть использовано для диагностики лептоспироза у сельскохозяйственных животных.
Известен способ диагностики лептоспироза, основанный на использовании реакции микроагглютинации - РМА (ГОСТ 25380-91. Животные сельскохозяйственные. Методы лабораторной диагностики лептоспироза. - Взамен ГОСТ 325386-82; введ. 1993-01-01. - М.: Изд-во стандартов, 1992. - 30 с.), который осуществляется путем добавления лептоспирозной культуры к исследуемой сыворотке крови животного с последующим определением титров лептоспирозных антител. В качестве антигенов для обнаружения специфических антител в сыворотке крови животных в РМА используют живые культуры лептоспир. При этом обязательным является использование при плановом исследовании на лептоспироз каждой сыворотки крови минимум семи антигенов (живых лептоспир серогрупп L.hebdomadis, L.pomona, L.tarassovi, L.grippotyphosa, L.canicola, L.sejroe, L.icterohaemorrhagiae). Диагностические штаммы лептоспир лаборатории поддерживают периодическими пересевами через каждые 10-15 дней. В реакции используют культуры лептоспир в возрасте 5-10 дней без признаков агглютинации и лизиса с накоплением микробных клеток 50-100 млн/см3.
Однако известный способ имеет существенные недостатки: большая трудоемкость, субъективная оценка результатов диагностики, невозможность стандартизации проведения диагностики, необходимость учета реакции только под микроскопом. Кроме того, способ требует постоянного поддерживания в стабильном состоянии полного диагностического набора живых лептоспир, что может представлять угрозу здоровью персонала ветеринарных лабораторий.
За прототип принят способ обнаружения лептоспирозных антител в сыворотке крови свиней с помощью иммуноферментного анализа (ИФА), где для изготовления антигена используют лептоспиры 7-ми серогрупп: L.hebdomadis, L.pomona, L.tarassovi, L.grippotyphosa, L.canicola, L.sejroe, L.icterohaemorrhagiae (см. Патент РФ №2053513, МПК A61K 39/00 от 27.01.96.). Однако данный способ трудоемок, т.к. для получения антигена необходимо использовать лептоспиры 7-ми серогрупп и при этом данный способ не предназначен для выявления лептоспирозных антител у других видов сельскохозяйственных животных.
Задачей изобретения является расширение арсенала способов диагностики лептоспироза, обеспечивающего в короткие сроки с максимальной точностью и объективностью получение результатов, свидетельствующих о наличии в исследуемых сыворотках крови сельскохозяйственных животных антител к патогенным лептоспирам, а также безопасные условия труда для персонала диагностических лабораторий.
Поставленная задача решается тем, что в способе диагностики лептоспироза сельскохозяйственных животных, включающем метод непрямого твердофазного ИФА для выявления антител к антигенам семи серогрупп L.hebdomadis, L.pomona, L.tarassovi, L.grippotyphosa, L.canicola, L.sejroe и L.icterohaemorrhagiae в сыворотке крови, согласно изобретения, в качестве антигена применяют смешанные в равных количествах антигенные белки из лептоспир трех серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis. Данный способ позволяет выявлять лептоспирозные антитела у разных видов сельскохозяйственных животных.
Способ осуществляется следующим образом.
Полученным антигеном сенсибилизируют полистироловые планшеты для ИФА в течение 16-18 ч при 20-22°C, с последующим наслаиванием 1% раствора БСА с экспозицией в 1 ч при 37°C и последующей трехкратной промывкой.
В две лунки планшета вносят по 100 мкл положительного контрольного образца (К+), в две другие лунки планшета - по 100 мкл отрицательного контрольного образца (К-). В остальные лунки планшета вносят по 50 мкл разводящего буферного раствор для сывороток (РБР-С) и по 50 мкл исследуемых сывороток. Раствор перемешивают 5 раз пипетированием, не касаясь дна лунки.
После внесения проб сывороток планшет помещают в пластиковый пакет или накрывают крышкой и инкубируют 60 минут при 37°C. После инкубации лунки освобождают от содержимого и пятикратно промывают рабочим фосфатно-солевым буферным раствором с твином (ФСБ-Т).
После промывки в лунки планшета вносят по 100 мкл раствора конъюгата, конъюгированного с пероксидазой хрена (РКг-G); планшет помещают в пластиковый пакет или накрывают крышкой и выдерживают 30 минут при 37°C.
После повторной инкубации лунки освобождают от содержимого и проводят пятикратное промывание рабочим раствором ФСБ-Т. После промывки в лунки планшета вносят по 100 мкл раствора хромоген - тетраметилбензидин субстрата (ТМБ-субстрат) и выдерживают 30 минут при 37°C в темноте. По истечению указанного времени реакцию останавливают добавлением в каждую используемую лунку по 50 мкл стоп-раствора.
Оценка результатов реакции:
Результаты ИФА регистрируют на спектрофотометре. Оптическую плотность (ОП) измеряют при длине волны 450 нм. Нулевой уровень («бланк») задают по воздуху. Рассчитывают ОПкрит. по формуле:
ОПкрит.=ОПК-(ср.)+0,2,
где ОПК-(ср.) - среднее значение ОП (ОПК-) по двум лункам.
Если значение оптической плотности исследуемого образца не превышает ОПкрит., то образцы рассматриваются как отрицательные на наличие лептоспирозных антител к серогруппам L.pomona, L.tarassovi, L.hebdomadis, L.icterohaemorrhagiae, L.grippotyphosa, L.sejroe и L.canicola.
Если значение оптической плотности исследуемого образца превышает ОПкрит., то образцы рассматриваются как положительные на наличие лептоспирозных антител к серогруппам L.pomona, L.tarassovi, L.hebdomadis, L.icterohaemorrhagiae, L.grippotyphosa, L.sejroe и L.canicola в любом сочетании.
Пример 1. Определяли оптимальное сочетание антигенных белков разных серогрупп лептоспир при получении антигена.
Для этого использовали отдельно антигенные белки каждой из 5-ти серогрупп лептоспир (антигенные белки серогрупп L.canicola и L.sejroe отдельно не брали для исследования, т.к. они имеют антигенную структуру идентичную с L.icterohaemorrhagiae и L.hebdomadis соответственно), а также смешанные в равных количествах антигенные белки семи серогрупп.
- №1 антигенные белки L.hebdomadis,
- №2 антигенные белки L.pomona,
- №3 антигенные белки L.tarassovi,
- №4 антигенные белки L.icterohaemorrhagiae,
- №5 антигенные белки L.grippotyphosa,
- №6 антигенные белки L.hebdomadis+L.pomona+L.tarassovi+L.grippotyphosa+L.canicola+L.sejroe+L.icterohaemorrhagiae - поливалентный антиген.
Для исследования в ИФА с изготовленными антигенами использовали сыворотки крови кроликов, сенсибилизированных культурами лептоспир различных серогрупп. Предварительно сыворотки крови исследовали в РМА. В качестве контроля специфичности использовали сыворотку крови интактных кроликов с отрицательной РМА на лептоспироз (табл.1).
Результаты исследований, приведенные в таблице №1, показывают, что при исследовании сывороток крови интактных кроликов с разными антигенами в ИФА во всех случаях получили отрицательные результаты, которые совпали с РМА.
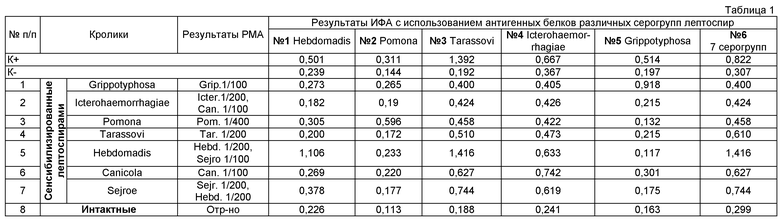
При испытании поливалентного антигена (из L.hebdomadis+L.pomona+L.tarassovi+L.grippotyphosa+L.canicola+L.sejroe+L.icterohaemorrhagiae) положительные показания в ИФА получены у кроликов, сенсибилизированных только L.hebdomadis, L.tarassovi, L.canicola и L.sejroe, т.е. не у всех кроликов.
Максимальное число положительных результатов ИФА при исследовании сыворотки крови кроликов, сенсибилизированных каждым из антигенов семи серогрупп, получено при использовании антигенных белков из L.tarassovi (у кроликов, сенсибилизированных L.pomona, L.tarassovi, L.canicola, L.icterohaemorrhagiae и L.sejroe). Исключение составили сыворотки крови кроликов, сенсибилизированных лептоспирами Grippotyphosa и Hebdomadis, которые дали в ИФА отрицательный результат. Поэтому было решено использовать для изготовления антигена сочетание антигенных белков лептоспир трех серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis.
Пример 2. Испытания антигена, полученного из антигенных белков L.tarassovi, L.grippotyphosa и L.hebdomadis, провели с помощью ИФА на сыворотках крови кроликов, интактных и искусственно сенсибилизированных лептоспирами (табл.2).
Из таблицы 2 видно, что антиген, полученный с использованием антигенных белков лептоспир 3-х серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis, выявил в иммуноферментном анализе антитела у всех кроликов, сенсибилизированных лептоспирами как каждой из семи серогрупп, так и смесью лептоспир семи серогрупп.
Интактные кролики в ИФА дали отрицательный результат.
Пример 3. Разработанным антигеном в ИФА провели тестирование 25 проб сывороток крови крупного рогатого скота, часть которых были положительными на наличие лептоспирозных антител по результатам реакции микроагглютинации - РМА (табл.3).
В результате установлено, что все сыворотки крови, положительные по результатам РМА, дали положительный результат в ИФА с использованием антигенных белков лептоспир 3-х серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis (100% животных). Отрицательно реагирующий в РМА крупный рогатый скот в ИФА дал отрицательный результат (100% животных).
Пример 4. Разработанным антигеном в ИФА провели тестирование 14 проб сывороток крови свиней, часть которых были положительными на наличие лептоспирозных антител по результатам реакции микроагглютинации - РМА (табл.4).
Из таблицы 4 видно, что все сыворотки крови свиней, положительные по результатам РМА, дали положительный результат в ИФА с использованием антигенных белков лептоспир 3-х серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis (100% животных). Отрицательно реагирующие в РМА свиньи в ИФА дали отрицательный результат (100% животных).
Таким образом, предлагаемый способ диагностики лептоспироза у сельскохозяйственных животных с помощью метода непрямого твердофазного иммуноферментного анализа с использованием антигенных белков лептоспир 3-х серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis значительно упрощает диагностику лептоспироза, благодаря применению в качестве антигенов убитых штаммов лептоспир, вследствие чего устраняются большие трудности, связанные с необходимостью поддержания и использования в лабораториях полного диагностического набора живых лептоспир. Кроме того, упрощается учет полученных результатов реакции, который проводится на спектрофотометре, а не в темном поле зрения микроскопа, как при РМА, исключается возможность неправильной интерпретации результатов.
Данный способ обладает быстротой постановки и учета, безопасностью и стандартностью, обеспечивает быстрое выявление антител к любому антигену из семи распространенных серогрупп возбудителя, что позволяет оперативно и систематически осуществлять контроль за эпизоотическим состоянием животных по лептоспирозу.
Предлагаемый способ диагностики лептоспироза позволяет ставить диагноз на данное заболевание в минимально короткие сроки, обладает высокой специфичностью и чувствительностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ изготовления аллергена ВВИ для диагностики лептоспироза свиней | 1990 |
|
SU1796190A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛЕПТОСПИРОЗНОГО ДИАГНОСТИКУМА ДЛЯ ПОСТАНОВКИ РЕАКЦИИ ЛАТЕКС-АГГЛЮТИНАЦИИ | 2000 |
|
RU2177617C1 |
| Тест-штамм Leptospira interrogans серогруппы Canicola серовара canicola для детекции антител к L. canicola | 2018 |
|
RU2707539C2 |
| Тест-штамм Leptospira interrogans серогруппы Grippotyphosa серовара grippotyphosa для детекции антител к L. grippotyphosa | 2020 |
|
RU2752978C1 |
| Тест-штамм Leptospira interrogans серогруппы Icterohaemorrhagiae серовара copenhageni для детекции антител к L. icterohaemorrhagiae | 2016 |
|
RU2607006C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395299C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395297C1 |
| Способ изготовления вакцины поливалентной против лептоспироза лошадей | 2023 |
|
RU2815538C1 |
| Тест-штамм Leptospira interrogans серогруппы Icterohaemorrhagiae для детекции антител к L. icterohaemorrhagiae | 2023 |
|
RU2799846C1 |
| ШТАММ БАКТЕРИЙ LEPTOSPIRA INTERROGANS, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПОЛУЧЕНИЯ ЛЕПТОСПИРОЗНЫХ ВАКЦИН | 1992 |
|
RU2049815C1 |
Изобретение относится к ветеринарии. Способ диагностики лептоспироза сельскохозяйственных животных, включающий определение наличия антител к антигенам семи серогрупп L.hebdomadis, L.pomona, L.tarassovi, L.grippotyphosa, L.canicola, L.sejroe и L.icterohaemorrhagiae в сыворотке крови методом иммуноферментного анализа, отличающийся тем, что в качестве антигена применяют смешанные в равных количествах антигенные белки из лептоспир трех серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis. Изобретение значительно упрощает и максимально сокращает диагностику лептоспироза, позволяет осуществлять оперативный контроль за эпизоотическим состоянием животных по лептоспирозу. Способ обладает высокой специфичностью, чувствительностью и стандартностью, а также обеспечивает создание безопасных условий труда для персонала диагностических лабораторий. 4 табл., 4 пр.
Способ диагностики лептоспироза сельскохозяйственных животных, включающий определение наличия антител к антигенам семи серогрупп L.hebdomadis, L.pomona, L.tarassovi, L.grippotyphosa, L.canicola, L.sejroe и L.icterohaemorrhagiae в сыворотке крови методом иммуноферментного анализа, отличающийся тем, что в качестве антигена применяют смешанные в равных количествах антигенные белки из лептоспир трех серогрупп - L.tarassovi, L.grippotyphosa и L.hebdomadis.
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛЕПТОСПИРОЗНОГО ДИАГНОСТИКУМА ДЛЯ ПОСТАНОВКИ РЕАКЦИИ ЛАТЕКС-АГГЛЮТИНАЦИИ | 2000 |
|
RU2177617C1 |
| RU 0002053513 C1, 27.01.1996 | |||
| Артикулятор | 1928 |
|
SU19735A1 |
| US 20110052629 A1, 03.03.2011 | |||
| Способ укладки трубопровода по дну моря свободным погружением | 1984 |
|
SU1254233A1 |
| US 20060204522 A1, 14.09.2006. | |||
Авторы
Даты
2013-09-20—Публикация
2012-08-21—Подача