Изобретение относится к области неорганической химии, а именно к способу получения твердых растворов оксисульфидов редкоземельных элементов (РЗЭ) состава (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3 в порошкообразном состоянии. Порошки твердых растворов могут найти применение для изготовления керамических изделий, как люминофоров, так и лазерных материалов.
В литературе найдено десять основных способов получения оксисульфидов Ln2O2S. Сведения по получению твердых растворов в системах LnI 2O2S-LnII 2O2S (LnI, LnII=La-Lu, Y) более ограниченные. В основном используют те же способы получения, что и при получении соединений Ln2O2S.
В ряде способов получения соединений Ln2O2S, усложнение состава шихты вызывает проявление в системе новых фазовых взаимодействий. Требуется существенное изменение условий синтеза для получения порошка твердого раствора в фазовом однородном состоянии.
Критически проанализированы способы получения соединений Ln2O2S и возможность их использования для получения порошков твердых растворов состава (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3.
Известен способ воздействия полисульфида натрия на полуторный оксид редкоземельного элемента[1-3].
1) 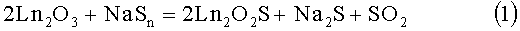
Недостатками способа является: необходимость отделения оксисульфида РЗЭ от сульфида натрия; полисульфид натрия термически неустойчив, поэтому температурный интервал проведения реакции ограничен; сера, образующаяся при термическом разложении NaSn, оказывает слабое сульфидирующее действие на оксид; необходимость получения полисульфида натрия как прекурсора; способ для получения твердых растворов не применялся. Следует предположить, что каждый из оксидов лантаноидов будет образовывать оксисульфид и только в итоге термической обработки будет происходить образование твердых растворов оксисульфида. В методе будет образовываться значительное количество побочных продуктов.
Известен способ обработки полуторного оксида редкоземельного элемента в потоке сероводорода [1, 2, 12, 13].
2) 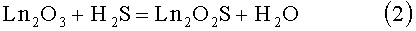
Недостатками способа является: использование токсичного газообразного реагента - сероводорода; длительность образования фаз Ln2O2S до 10 и более часов при температурах синтеза от 800°С дл 1100°С; в случае получения твердых растворов Ln'1-xLn''1-xO2S (Ln', Ln''=La, Pr, Nd, Sm; x=0-1) трудоемкость приготовления шихты с равномерным распределением в нем катионов лантаноидов.
Известен способ восстановления полуторных оксидов РЗЭ сероуглеродом [1,2, 12, 13].
3) 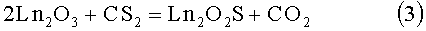
Способ имеет ряд недостатков. Используется CS2, который является токсичным веществом. Прекурсор CS2 является более сильным сульфидирующим веществом, чем H2S, что может привести к образованию оксисульфидных фаз различных химических составов. Обработка оксисульфидов РЗЭ сульфидирующим газом CS2 является основным способом получения соединений Ln2S2 [12]. В процессе гетерогенной реакции газообразного CS2 с частичками Ln2O3 происходит стадийное сульфидирование оксида. В центре частиц сохраняется оксидная фаза, часто она не фиксируется методом рентгенофазового анализа и может проявиться только при микроструктурном анализе сплавленного порошка. По поверхности частиц, где наиболее высокая концентрация CS2 могут образоваться оксисульфидные фазы различных составов, например Ln2OS2, Ln10S14O, а также полуторные сульфиды Ln2S3. Синтез твердых растворов (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3 из шихты, полученные смешением исходных оксидов, неизбежно приведет к длительной стадии взаимодействия оксисульфидов, которые локализованы в исходной шихте в различных частицах; использование CS2 приводит к загрязнению шихты частицами углерода.
Известен способ восстановления оксисульфатов РЗЭ оксидом углерода II [1, 4].
4) 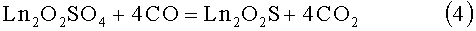
Недостатки способа: предварительное получение оксида углерода II, который является высокотоксичным веществом; недостаточно изучены температурные режимы обработки шихты, не установлен нижний и верхний предел температурного интервала образования гомогенного Ln2O2S; соединения Ln2O2SO4 не являются товарными прекурсорами; реакция не использовалась для получения твердых растворов Ln'1-xLn''1-xO2S (Ln', Ln''=La, Pr, Nd, Sm; x=0-1).
Известен способ спекания полуторного оксида РЗЭ и полуторного сульфида РЗЭ [1, 2].
5) 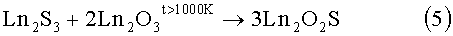
Недостатки способа: необходимость предварительного получения достаточно дорогостоящих веществ, полуторных сульфидов РЗЭ, получаемых в потоке CS2 при температурах 1100-1300°С; твердофазные гетерогенные реакции спекания между двумя тугоплавкими веществами протекают очень медленно, достижение равновесия в подобных реакциях - является труднодостигаемой целью; повышение температуры спекания до 1300-1500°С сократит время синтеза, но повышает вероятность загрязнение образца, при взаимодействии веществ образуется твердый спек, который необходимо дополнительно размельчать; метод является малопригодным для получения твердых растворов (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3.
Известен способ воздействия на полуторный сульфид парами воды [1, 12].
6) 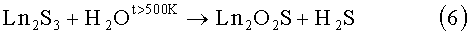
Недостатки способа: необходимость предварительного получения достаточно дорогостоящих веществ, полуторных сульфидов редкоземельных элементов, получаемых в потоке CS2 при температурах 1100-1300°С; в литературе указаны ориентировочные температуры проведения реакции; в виду невысоких температур проведения процесса для образования твердых растворов Ln'1-xLn''1-xO2S (Ln', Ln''=La, Pr, Nd, Sm; x=0-1) необходима длительная стадия гомогенизации продукта.
Известен способ окисления полуторных сульфидов редкоземельных элементов кислородом до соединений Ln2O2S [1].
7) 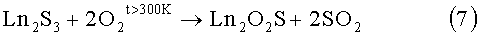
Недостатки способа: необходимость предварительного получения достаточно дорогостоящих веществ, полуторных сульфидов РЗЭ, получаемых в потоке CS2 при температурах 1100-1300°С; неоднородность фазового состава продуктов окисления частиц Ln2S3 происходит от поверхности к центру, оксисульфидная фаза в поверхностных слоях шихты может окислиться до оксида, в тоже время, как в центре частиц будет сохраняться сульфидная фаза. Сложно получить оксисульфид без примесей сульфидов и оксидов лантаноидов; метод является малопригодным для получения твердых растворов (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3; в продуктах реакции присутствуют нескольких твердых веществ, которые необходимо разделять; сложность полного удаления примесей без частичного окисления целевого продукта Ln2O2S.
Известен способ спекания оксидов с серой в восстановительной атмосфере с присутствием карбоната щелочного металла и минерализатора [1, 6, 7].
8) 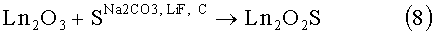
Недостатки способа: длительный и трудоемкий процесс; возникновение брака после прокаливания шихты; порошок люминофора имеет много пыли несформированных частиц, распространение частиц по диаметру распределены в широком диапазоне.
Известен способ получения катодолюминофора на основе оксисульфида иттрия и европия, состава (Y1-x-yEuxTby)2O2S, где 0,001≅X≅10, 0≅y≅10-4 из шихты, содержащей соединения, составляющие редкоземельные элементы, сульфидирующий агент - серу и минерализаторы, путем прокаливания при 1180°С в течение 2 ч с последующей промывкой продукта прокалки и минеральной кислотой, и поверхностным модифицированием [7].
Недостатки способа: длительный и трудоемкий процесс; возникновение брака после прокаливания шихты; порошок люминофора имеет много пыли несформированных частиц и широкое распространение частиц по размерам.
Метод может использоваться для получения твердых растворов, но потребуются более длительные отжиги для гомогенизации шихты.
Известен способ обработки сульфата РЗЭ в потоке водорода [1, 5, 8, 9, 13].
9) 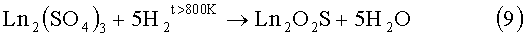
При обработке сульфатов РЗЭ в потоке водорода является наиболее близким аналогом к заявляемому методу в патенте. Способ малоизучен, в литературе приведена только схема реакции, сообщается, что в процессе реакции образуется также Ln2O2SO4.
Недостатки способа: не установлен температурный интервал, в котором реакция протекает количественно; не установлены примеси, образующиеся при температурах ниже или выше температур получения гомогенных продуктов; не определена последовательность фазовых превращений при протекании реакции; не построены кинетические зависимости выхода продуктов реакции от времени, определяющие технологические параметры процесса, не изучались влияние размеры и формы частиц на кинетические характеристики процесса; метод не применялся для получения твердых растворов (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S (где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3).
Наиболее близким к заявляемому способу является метод [13], в котором при получении двойных сульфидов редкоземельных металлов состава xAS(1-х)Ln2S3 А=Са, Sr, Ba; Ln=La, Се, Pr, Nd; 0≤x≤0.5 имеется стадия раздельного растворения в хлороводородной кислоте оксидов AIIO (AII=Са, Sr, Ba) и оксидов Ln2O3 (Ln=La, Се, Pr, Nd), смешивание растворов, соосаждение сульфата щелочноземельного элемента (Са, Sr, Ba) и сульфата редкоземельного элемента (La, Се, Pr, Nd), прекурсором сульфатом аммония, отделения осадка сульфатов и его предварительной обработки в потоке водорода при 750-950°С.
В изложенной работы [13] формулировке метода, применения данного метода для получения твердых растворов состава (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3 не приведет к необходимым результатам.
Оксиды редкоземельных элементов Ln2O3 достаточно плохо растворяются в хлороводородной кислоте различных концентраций. Необходим нагрев системы, иногда длительный, использование избытка HCl.
Использование прекурсора HCl приводит к довнесению в раствор как минимум эквивалентного количества анионов хлора, которые сорбируются осадком. Отделение ионов Cl- промыванием неизбежно приведет к частичному растворению сульфатов лантаноидов и селективной (различной) потере сульфатов редкоземельных элементов, в виду различных значений их произведений растворимости.
Произведение растворимости безводного сульфата лантана равна 3·10-5 [11]. Основные сульфаты лантаноидов малорастворимы. Значения произведений растворимости при 25°С составляют: CeOHSO4 8,23·10-15, LaOHSO4 2,62·10-15, La4(ОН)(SO4)3 1,22·10-18, La2(OH)4SO4 1,52·10-24 [11],
Выделение из суспензии осадка соосажденных сульфатов редкоземельных элементов также не приемлемо для применения предложенного метода. В виду различной растворимости сульфатов РЗЭ La, Pr, Nd, Sm содержание ионов лантаноидов в осадке и растворе будет различным и будет отличаться от содержания РЗЭ в исходной шихте.
Температурный интервал обработки сульфатов в потоке водорода, указанный в [13] составляет 750-950°С.
Обработка, содержащихся в шихте сульфата самария, сульфата неодима в потоке водорода при 900°С и в особенности при 950°С неизбежно приведет к протеканию реакции
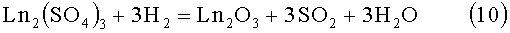
В образцах будут содержаться примесные фазы Ln2O3.
Обработка сульфата лантана, сульфата неодима в потоке водорода при 950°С также уже приводит к образованию продуктов взаимодействия - оксидных соединений Ln2O3 и Nd2O3.
Редкоземельный элемент Се, перечисленный в формуле изобретения работы [13] не представлен в формуле разрабатываемого метода,
Обработка сульфата церия в потоке водорода, начиная с 500°С приводит практически к параллельному протеканию реакции образования фаз Ce2O2S и CeO2. При температурах обработки выше 650-750°С образование СеОз становится преобладающим.
Цель заявляемого изобретения - разработать эффективный технологичный способ получения оксисульфидов (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3 с высокой фазовой однородностью, в котором будут сокращены продолжительности высокотемпературных обработок.
Цель достигается тем, что в результате последовательных операций подготовки шихты соосаждении, сокристализации сульфатов лантаноидов, термической обработки шихты на воздухе при температурах 70-90°С до достижения сухого состояния образца, при 600°С в течении до 1,5 часов для удаления сохранившихся примесей форм кислот, образуется слабо спеченный образец, в котором достигается статистически равномерное распределение частиц сульфатов каждого из лантаноидов в пределах образовавшихся агломератов частиц. Шихта образована сульфатами редкоземельных элементов. В шихте редкоземельные элементы находятся в том соотношении, которое задано соотношением масс исходных навесок.
Предварительно проведенными систематическими исследованиями установлено, что обработка в потоке водорода только перечисленных сульфатов лантаноидов а именно: La2(SO4)3, Pr2(SO4)3, Nd2(SO4)3, Sm2(SO4)3 приводит к получению гомогенных оксисульфидов состава Ln2O2S.
Термическая обработка в потоке водорода может проводиться только в определенных температурных интервалах 600-800°С. Установлены продолжительности обработки, которые приводят к получению гомогенных твердых растворов состава (La(1-x)Pr(1-y)Nd(1-z)Sm(1-k))2O2S, где значения x=0-1, y=0-1, z=0-1, k=0-1, но так чтобы x+y+z+k=3.
При обработке шихты сульфатов в потоке водорода в интервале температур 500-550°С скорость образования твердого раствора оксисульфидов невелика в связи, с чем требуются термические обработки в несколько десятков часов. Образующиеся продукты имеют несовершенную кристаллическую структуру, рефлексы на рентгенограммах размыты. Идентифицирование рентгенограмм затруднительно, что не позволяет однозначно определить фазовую однородность продукта. Продолжительность обработки в потоке водорода 12 часов при 600°С обеспечивает получение фазового однородного твердого раствора оксисульфидов редкоземельных элементов. Необходимая продолжительность обработки приготовляемой шихты сульфатов в потоке водорода при 700°С составляет 7 часов, при 800°С - 2 часа. Химическое взаимодействие отражает следующее балансное уравнение:
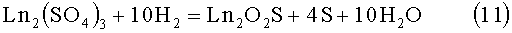
Обработка шихты соосажденных, сокристаллизованных сульфатов лантаноидов La2(SO4)3, Pr2(SO4)3, Nd2(SO4)3, Sm2(SO4)3 при температурах 950°С, а для соединений РЗЭ Nd2(SO4)3, Sm2(SO4)3 при 900°С неизбежно приведет к образованию в шихте примесей полуторных оксидов редкоземельных элементов Ln2O3. по реакции, которую отражает следующее балансное уравнение:
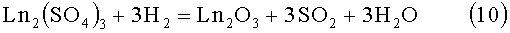
Шихту состоящую из сульфатов редкоземельных элементов готовят следующим образом: берут навески весовых форм оксидов редкоземельных элементов в соотношении обеспечивающим заданный состав шихты. Навеску помещают в термостойкий стакан, доливают 20 мл дистиллированной воды, приливают азотную кислоту марки хч, концентрацией 57% небольшими порциями. Визуально контролируют состояние суспензии. Последние порции азотной кислоты приливают по каплям, для того, чтобы избыток прилитой азотной кислоты не превышал 1-2%. В такой же последовательности к раствору приливают концентрированную серную кислоту (хч, 98%). Из образовавшейся суспензии, путем выпаривания удаляют воду. Используют нагреватель, в котором тепло проводится к боковым стенкам стакана. Термическую обработку проводят при 70-90°С до образования сухого остатка. Образовавшийся твердый образец размалывают, помещают в термостойкий, химический инертный тигель (материалы тигля Al2O3, SiO2) и термически обрабатывают при 600°С в течении до 1,5 часа, что обеспечивает полное удаление из образца избыточных примесей кислот.
После охлаждения шихту растирают, просеивают через сито с размерами ячейки 100 мк, полученную фракцию обрабатывают в потоке водорода при повышенных температурах. Соотношение объема проходящего водорода и массы навески должно быть таким, чтобы за один час сквозь вещество навески проходил объем водорода, не менее 8 эквивалентным объемам уравнения реакции (11).
Для обработки веществ используется вертикальный реактор [15], применение которого обеспечивает прохождение газообразного потока через вещество, а не над веществом, как при использовании горизонтального реактора. Предварительно через реактор пропускается необходимый объем водорода для вытеснения имеющегося в нем воздуха. Реактор помещают в вертикальную печь с заданной температурой. Температура продолжительности термической обработки составляют 600°С - 12 часов, 700°С - 7 часов, 800°С - 2 часа.
Пример 1: Приготовление 12 г порошка твердого раствора состава (La0,7Pr0,1Nd0,1Sm0,1)2O2S.
Исходными прекурсорами являются оксиды редкоземельных элементов Ln2O3 марок В, Г, Д, Е, которые для удаления сорбированных из воздуха газов (CO2, Н2О) отжигают при 600°С один час. Из весовых форм оксидов РЗЭ берутся навески прекурсоров, которые составляют m(La2O3)=7,9173 г, m(Pr2O3)=1,1449 г, m(Nd2O3)=1,1683 г, m(Sm2O3)=1,2109 г.
Навески прекурсоров количественно переносятся в термостойкий стакан, объемом 0,5 литра, приливается 20 мл. дистиллированной воды, а затем небольшими порциями (от 5-6 мл до 1 мл и по каплям) приливают азотную кислоту марки хч, 57%. Эквивалентные объемы кислот, которые должен быть прилиты, предварительно рассчитывают. Стакан с содержимым может быть умеренно нагрет до 30-50°С. Контролируют визуально переход оксидов в раствор. Последние порции азотной кислоты приливают каплями. Желательно, чтобы избыток прилитой азотной кислоты не превышал 1-2%. К образовавшемуся раствору приливают концентрированную серную кислоту, марки хч, 98% порциями по 3-0.5 мл. Последние части эквивалентного объема приливают по каплям, визуально контролируя образование осадков. Избыточное количество прилитой серной кислоты должно составлять 1-2%. Суспензию нагревают до 70°С. Желательно использовать нагреватели, подводящие тепло ко дну и стенкам стакана. По мере испарения воды, температуру поднимают до 90°С, но так, чтобы избежать расплескивания суспензии. Термообработку проводят до образования сухого, плотного образца, который после охлаждения подвергают помолу, до образования сыпучего порошка. Порошок помещается в тигель из химически инертного материала (Al2O3, SiO2) и термически обрабатывается при 600°С в течение до 1,5 часа, что обеспечивает полное удаление из образца оставшихся избыточных форм кислот. Выделение газов контролируют визуально. По охлаждению шихту размалывают до фракции, проходящей через сито 100 микрон. Порошок помещают в стакан из SiO2, в котором находится трубка подачи газов, что обеспечивает прохождение газов сквозь слой обрабатываемого вещества. Конструкцию помещают в вертикальный реактор. Согласно уравнению (11) эквивалентный объем водорода на один моль сульфата редкоземельного элемента составляет 10 молей. Из количества молей взятого вещества рассчитывают необходимую скорость подачи водорода в реактор, так чтобы за один час проходило не менее 8 эквивалентных объемов водорода. Реактор продувают потоком водорода в течение 15-20 минут, помещают в трубчатую вертикальную муфельную печь с температурой 800°С. Обработку проводят в течение 2 часов. Образуется порошок твердого раствора оксисульфида состава (La0,7Pr0,1Nd0,1Sm0,1)2O2S. Выход продукта количественный. Фазовый состав по данным рентгенофазового анализа: фазово-однородный.
Пример 2: Приготовление порошка твердого раствора (La0,99Nd0,01)2O2S.
Навески весовых форм оксидов редкоземельных элементов количественно переносятся в термостойкий стакан. Приливается 20 мл дистиллированной воды. Небольшими порциями (от 5-6 мл до 1 мл и по каплям) приливают азотную кислоту марки хч, 57% с избытком до 1-2%. К образовавшемуся раствору приливают концентрированную серную кислоту, марки хч, 98% порциями по 3-0.5 мл с избытком до 1-2%. Суспензию нагревают до 70°С и по мере выпаривания воды поднимают температуру до 90°С. Термообработку проводят до образования сухого, плотного образца, который после охлаждения подвергают помолу, до образования сыпучего порошка. Порошок помещается в тигель из химически инертного материала (Al2O3, SiO2) и термически обрабатывается при 600°С в течение до 1,5 часа. По охлаждению шихту размалывают до фракции менее 100 микрон. Порошок помещают в стакан из SiO2, в котором находится трубка подачи газов. Стакан с веществом и трубкой помещают в вертикальный реактор. Реактор продувают потоком водорода в течение 15-20 минут, помещают в трубчатую вертикальную муфельную печь с температурой 600°С. Обработку проводят в течение 12 часов. Образуется порошок твердого раствора оксисульфида состава (La0,99Nd0,01)2O2S. Выход продукта количественный. Фазовый состав по данным рентгенофазового анализа: фазово-однородный.
Источники информации
1. Супоницкий Ю.Л., Кузьмичева Г.М., А.А. Елисеев А.А. Оксосульфиды редкоземельных элементов // Успехи химии. 1988. Т L VII. Вып.3. C.367-383.
2. Супоницкий Ю.Л. Термическая химия оксосоединений РЗЭ и элементов VI группы: Дисс.… д-ра хим. наук: 02.00.04. Москва. 2002. 248 с.
3. Супоницкий Ю.Л. Химия редкоземельных элементов: учебное пособие. М.: РХТУ им. Д.И.Менделеева, 2007. 108 с.
4. Сургутский В.П., Серебренников В.В. Изучение кинетики и механизма восстановления сульфатов редкоземельных элементов окисью углерода // Журн. неорг. химии. 1966. Т. XI. Вып.1. С.1-9.
5. Лаптев В.И. Синтез и термохимическое исследование оксисульфидов некоторых редкоземельных элементов: Автореф. дис… канд. хим. наук: 02.00.01. М. 1980. 20 с.
6. Сощин Н.П., Амирян A.M. Способ получения катод олюминафора на основе оксисульфида иттрия. Описание изобретения к авторскому свидетельству №283463. 06.Х.1970. Бюллетень №31.
7. Михитарьян Б. В. Люминесцентно-спектральные свойства твердых растворов Gd2O2S-Tb2O2S и Y2O2S-TbiO2S: Дисс…. канд. физ. - мат.наук: Ставрополь, 2007. 171 с.
8. Сальникова Е.И., Калиев Д.И., Андреев И.О. Кинетика образований фаз при обработке La2(SO4)3, La2O2SO4 в потоке водорода // Журнал физической химии. 2011. т.85. №12. С.2121-2125.
9. Сальникова Е.И., Андреев О.В., Гельмель Н.Л. Получение гомогенных оксисульфидов Ln2O2S (Ln=La, Nd) // Тез. докл. Всеросс. науч. конф. «Актуальные проблемы химии. Теория и практика», Уфа, 2010. С.92.
10. Хритохин Н.А., Андреев О.В., Паршуков Н.Н. Восстановление сульфатов переходных металлов водородом // Журн. неорг. химии. 1995. Т.40. №12. С.1958-1960.
11. Комиссарова Л.Н. Соединения редкоземельных элементов. Сульфаты, селенаты, теллураты, хроматы // Л.Н. Комиссарова Пушкина, В.М. Шацкий и др. М.: Наука, 1986. 366 с.
12.. Sokolov V.V. Optical materials containing rare earth ЬпзЗз sulfides. /. Sokolo V.V., Karamzin A.A., Trushnikova L.N., Savelyeva M.V. // Journal of alloys and compounds. - 1995, V.225. - p.567-570.
13. Андреев О.В., Кертман А.В., Вахитова Р.Х. Способ получения двойных сульфидов редкоземельных металлов. Патент на изобретение №1456365. SU 1456365 A1, C01F 7/00, С01В 17/20, опубликовано 07.02.1989.
14. Гризик А.А., Елисеев А.А., Толстова В.А., Шмидт Е.В. Закономерности фазового состава продуктов сульфидизации окислов гадолиния, тербия, диспрозия. / Халькогениды. // Киев: Наукова думка. - 1975. С.12-17.
15. Бамбуров В.Г. Простые и сложные сульфиды щелочноземельных и редкоземельных элементов / Бамбуров В.Г., Андреев О.В. // Журнал неорганической химии. - 2002. Т.47. - №4. - С.676-683.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВ СОЕДИНЕНИЙ ДИОКСОСУЛЬФИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ LnOS И ТВЕРДЫХ РАСТВОРОВ НА ИХ ОСНОВЕ Ln'OS-Ln''OS ( Ln, Ln', Ln''=Gd-Lu, Y) | 2013 |
|
RU2554202C2 |
| Неорганическое люминесцентное соединение, маркировка с использованием неорганического люминесцентного соединения и носитель информации с использованием неорганического люминесцентного соединения | 2019 |
|
RU2730491C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВ ФТОРСУЛЬФИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ LnSF | 2012 |
|
RU2500502C1 |
| БЫСТРОКИНЕТИРУЮЩИЙ ИНФРАКРАСНЫЙ ЛЮМИНОФОР НА ОСНОВЕ ОКСИСУЛЬФИДОВ ИТТРИЯ И ЛАНТАНА | 2012 |
|
RU2516129C2 |
| Состав для контроля подлинности носителя информации (варианты) | 2020 |
|
RU2766111C1 |
| Способ получения поликристаллов четверных соединений ALnAgS(A = Sr, Eu; Ln = Dy, Ho) | 2018 |
|
RU2679244C1 |
| ИНФРАКРАСНЫЙ ЛЮМИНОФОР КОМПЛЕКСНОГО ПРИНЦИПА ДЕЙСТВИЯ НА ОСНОВЕ ОКСИСУЛЬФИДОВ ИТТРИЯ, ЛАНТАНА И ГАДОЛИНИЯ, АКТИВИРОВАННЫЙ ИОНАМИ Nd | 2015 |
|
RU2615695C2 |
| ИНФРАКРАСНЫЙ ЛЮМИНОФОР КОМПЛЕКСНОГО ПРИНЦИПА ДЕЙСТВИЯ НА ОСНОВЕ ОКСИСУЛЬФИДОВ ИТТРИЯ, ЛАНТАНА, ГАДОЛИНИЯ, АКТИВИРОВАННЫЙ ИОНАМИ Er | 2015 |
|
RU2614690C2 |
| ЛЮМИНЕСЦИРУЮЩИЙ МАТЕРИАЛ ДЛЯ ТВЕРДОТЕЛЬНЫХ ИСТОЧНИКОВ БЕЛОГО СВЕТА (ВАРИАНТЫ) | 2010 |
|
RU2456327C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВ ТРИСУЛЬФИДОВ ЕВРОПИЯ, ЛАНТАНОИДОВ И МЕДИ | 2010 |
|
RU2434809C1 |
Изобретение относится к области неорганической химии, а именно к способу получения порошков твердых растворов оксисульфидов редкоземельных элементов, для изготовления керамических изделий, люминофоров и лазерных материалов. Способ получения порошков твердых растворов оксисульфидов лантана, неодима, праозеодима и самария включает приготовление шихты из заданных масс весовых форм оксидов редкоземельных элементов, растворенных в азотной кислоте, осаждение концентрированной серной кислотой из полученного раствора сульфатов редкоземельных элементов, выпаривание образовавшейся суспензии на воздухе при 70-90°С до сухого состояния, ее растирание и прокаливание при температуре 600°С в течение 1,5 часа, далее растирание до мелкодисперсного состояния и обработку в потоке водорода при скорости подачи газа 6 экв/час по отношению к массе навески сульфатов редкоземельных элементов при следующих температурах и продолжительностях термических обработок 600°С - 10 часов, 700°С - 5 часов и 850°С - 1 час. Изобретение обеспечивает эффективное получение порошков твердых растворов оксисульфидов редкоземельных элементов высокой фазовой однородности и сокращение продолжительности высокотемпературной обработки. 2 пр.
Способ получения порошков твердых растворов оксисульфидов лантана, неодима, праозеодима и самария составов Ln'1-xLn''1-xO2S (Ln', Ln''=La, Pr, Nd, Sm; x=0-1), заключающийся в приготовлении шихты и ее последующей обработке в потоке водорода, отличающийся тем, что для получения порошков твердых растворов в фазовом однородном состоянии исходную шихту получают из заданных масс весовых форм оксидов редкоземельных элементов, которые растворяют в азотной кислоте, из полученного раствора сульфаты редкоземельных элементов осаждают концентрированной серной кислотой, образовавшуюся суспензию выпаривают на воздухе при 70-90°С до сухого состояния, растирают, прокаливают при температуре 600°С в течение 1,5 ч, растирают до мелкодисперсного состояния и обрабатывают в потоке водорода при скорости подачи газа 6 экв/ч по отношению к массе навески сульфатов редкоземельных элементов при следующих температурах и продолжительностях термических обработок 600°С - 10 ч, 700°С - 5 ч и 850°С - 1 ч.
| СПОСОБ ПОЛУЧЕНИЯ КАТОДОЛЮМИНОФОРА НА ОСНОВЕ ОКСИСУЛЬФИДА ИТТРИЯ | 0 |
|
SU283463A1 |
| RU 2401860 C2, 20.10.2010 | |||
| SU 1450358 A1, 10.11.1998 | |||
| Способ получения двойных сульфидов редкоземельных металлов | 1987 |
|
SU1456365A1 |
| Ложемент для горизонтального складирования рулонов листового проката | 1985 |
|
SU1344451A1 |
Авторы
Даты
2013-10-27—Публикация
2011-10-17—Подача