Настоящее изобретение относится к способу получения покрытых серебром катализаторов. Изобретение кроме того адресовано непосредственно к серебряным катализаторам и выгоде их использования в синтезе формальдегида.
Формальдегид (ФА) является одним из наиболее важных химикатов неспецифического действия; производство в ЕС в 2002 году составило более 3 миллионов тонн; в два раза больше, скорее всего, было произведено во всем мире (5,3 миллионов тонн (1989)) [К. Weissermel, H.-J. Arpe, Industrielle Organische Chemie, VCH, 1994]. ФА требуется в особенности для производства различных смол (фенол, меламин и т.д.) и полимеров. Синтез проистекает в сущности непосредственно из метанола [К. Weissermel, H.-J. Arpe, Industrielle Organische Chemie, VCH, 1994; M. Qian, M.A. Liauw, G. Emig, Appl. Catal. A: General, 238 (2003) 211], хотя прямой синтез из метана был также изучен [Н. Berndt, A. Martin, A. Brückner, E. Schreier, D. Müller, H. Kosslick, G.-U. Wolf, B. Lücke, J. Catal., 191 (2000) 384]. Синтез из метанола производится или посредством дегидрогенизации или посредством частичного окисления. В то время как дегидрогенизация (Ур.1) проистекает эндотермическим образом (+84 кДж/моль), частичное окисление (Eq.2) является высоко экзотермическим (-159 кДж/моль).
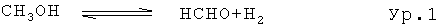
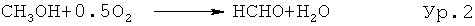
Частичное окисление выполнено в два различных способа с различными катализаторами. Главные отличительные признаки представляют собой во-первых различные катализаторы, а во-вторых соблюдение пределов взрывоопасности МеОН в воздухе.
При способе с недостатком воздуха или контакта с серебром (BASF, Border), Bayer, Degussa, ICI, Celanese, DuPont, Mitsubishi, Mitsui, plant sizes: 80-135 kt/a of FA), используются содержания МеОН>37.5 об.%. В способе с избытком воздуха, молибденом или FORMOX (Lummus, Montecatini, Hiag/Lurgi, Perstorp/Reichsdorf, plant sizes: 20-30 kt/a of FA), способ проводится при содержании МеОН<7 об.%. Около 80% всех заводов работают посредством способа с недостатком воздуха или контакта с серебром; приблизительно 55% производства ФА в Западной Европе основаны на способе контакта с серебром [М.Qian, М.А.Liauw, G.Emig, Appl. Catal. A: General, 238 (2003) 211; Catalysis from A to Z, VCH Wiley, 2000, p.224].
Частичное окисление посредством способа с недостатком воздуха выполняется главным образом в два варианта: (i) способ с МеОН балластом (к примеру. Degussa, ICI) и (ii) способ с водяным балластом (BASF). Принимая во внимание, что неполная конверсия достигается в первом способе, в котором используются только МеОН и воздух, фактически полная конверсия может быть достигнута во втором способе с дополнительным измерением пара. Нормально работать со смесью МеОН/H2O 60/40.
Доступные в настоящее время процессы, вместе с тем, все связаны с тем фактом, что серебряный катализатор становится спекшимся относительно быстро при реакционных температурах, и для газов становится все более трудным быть введенными, чтобы протекать через слой катализатора. Когда расходы в этом случае становятся слишком большими, формальдегидный завод должен быть остановлен, а катализатор заменен, что приводит к дорогой стоимости остановок производства. Огнеупорная способность воды позволяет достичь однородного распределения высокой температуры в способе с водяным балластом и защищает катализатор от чрезмерно быстрого "спекания". Кроме того, пар помогает предотвратить или минимизировать коксовое формирование. По этим причинам продолжительность службы серебряного катализатора в способе с водяным балластом значительно выше, чем в способе с метаноловым балластом, хотя было бы желательно дополнительное увеличение срока службы (WO 0130492)
Известны в принципе для производства наночастицы серебряно-платиновые сплавы, у которых есть покрытие из пористого силикатного геля (Ultra-thin porous silica coated silver-platinum alloy nano-particle as a new catalyst precursor, Kai Man K.Yu, David Thompsett, Shik Chi Tsang, Chem. Commun., 2003, (13), 1522-1523). Однако, такие наночастицы являются неподходящими для синтеза формальдегида, так как они имеют слишком высокую объемную плотность, и для газов таким образом было бы очень трудно быть преобразованным, чтобы протекать через них при использовании в слое катализатора.
Таким образом задачей настоящего изобретения является определить способ для получения кристаллов серебра и определить непосредственно кристаллы серебра, которые улучшили бы срок службы по сравнению с кристаллами существующего уровня техники в синтезе формальдегида посредством способа с водяным балластом. В то же самое время не должно быть оказано негативное воздействие на другие параметры, такие как выход продукта за один проход в единицу времени, скорость каталитического обмена и активности.
Задача достигнута в соответствии с формулой изобретения.
В соответствии с процедурой, в способе получения кристаллов серебра с тонким пористым покрытием оксидного материала элементы выбраны из группы, которая состоит из алюминия, кремния, циркония, титана и их смесей, таким образом, что
a) кристаллы серебра контактируют с золь-гелевым раствором элементов, о которых идет речь, и
b) получающиеся в результате кристаллы серебра собирают,
c) освобождают от органического растворителя и
d) затем подвергают термической обработке при температуре между 50°С и точкой плавления серебра, раствор согласно поставленной задаче достигают способом, который является простым, и не менее выгодным для этого. Несмотря на покрытие, получающиеся в результате серебряные катализаторы являются одинаково активными, так же как и избирательные и приводят к выходам продукта за один проход в единицу времени столь же хорошим как и оригинальные используемые кристаллы серебра без соответствующего покрытия. В то же самое время покрытие, тем не менее, помогает противодействовать спеканию кристаллов серебра, что приводит к значительно увеличенному сроку службы катализаторов и, следовательно, к резкому снижению затрат в виду отсутствия замены катализатора. Кроме того, абсолютно удивительным является то, что заменой самого катализатора можно управлять более легко, так как материал, который будет меняться, не является затвердевшим, а может быть с легкостью удален из реактора по сравнению с обычно используемым материалом.
В настоящем способе, на этапе а) кристаллы серебра контактируют с золь-гелевым раствором элементов, о которых идет речь. Это предпочтительно сделано посредством простого смачивания кристалла соответствующим раствором. Предпочтительно, этап а) выполняется в растворителе, который содержит органический растворитель. Кристаллы могут предпочтительно также быть введены в сосуд/реактор, который содержит золь-гелевый раствор, необязательно при перемешивании. Добавление может также быть полностью обратным. Предпочтительно, золь-гелевый раствор является таким, в котором алкоксиды элементов, о которых идет речь являются растворенными в органической матрице. Алкоксиды могут, в результате гидролиза, уже быть частично сшитыми и могут таким образом присутствовать в коллоидальной растворенной форме. Для того, чтобы стабилизировать раствор, могут быть добавлены определенные добавки.
Как обозначено, золь-гелевый раствор предпочтительно используется в форме органической среды. Квалифицированный специалист в данной области знает, какие растворы являются предпочтительными здесь. Тем не менее, особое предпочтение отдается воплощению, в котором используемыми растворителями являются спирты. В большей особенности преимущественные растворители могут быть выбранными из группы, которая состоит из метанола, этанола, n-пропанола, изопропилового спирта, n-бутанола, изобутанола, вторичного бутанола, трет-бутанола, n-пентанола и их связующих изомеров и их смесей. Можно добавить, кроме того, органические растворители к золь-гелевому раствору, к примеру эфиры.
В большей степени предпочтительным воплощением является то, в котором выбранным золь-гелевым раствором является алкоксид элемента, о котором здесь идет речь, в соответствующем спирте как органический растворитель. В связи с этим, в большей степени особенно предпочтительны алкоксидные соединения элемента, о котором здесь идет речь, является выбранным из группы метоксидов, этоксидов, пропоксидов, изопропоксидов, n-бутоксидов, вторичных бутоксидов, изобутоксидов, трет-бутоксидов, n-пропоксидов или их связывающих изомеров и их смесей.
Затем, кристаллы серебра собраны и таким образом освобождены от лишнего золь-гелевого раствора. Сбор может быть выполнен посредством простого фильтрования, декантирования или подобными методами. В дальнейшем, лишний растворитель, который все еще остается налипшим на кристаллах серебра, удаляют. Это может быть сделано в простой способ посредством удаления растворителя из получающихся в результате кристаллов серебра путем испарения его при условиях окружающей среды. Дополнительные методы являются известными для квалифицированного специалиста в данной области. В частности, растворитель может также быть удален ускоренным путем посредством дополнительных мер, к примеру применение вакуума, подвергания газовому потоку (воздух, азот) и т.п.
В необязательном заключительном этапе получающиеся в результате кристаллы серебра подвергают термической обработке при температуре между 50°С и точкой плавления серебра.
Это предпочтительно делают при температуре между 300°С и 700°С, наиболее предпочтительно при от 400°С до 600°С. Термическая обработка может быть выполнена с применением вакуума или в присутствии окисной атмосферы, предпочтительно воздуха.
Кристаллы серебра, полученные таким образом, могут использоваться для формальдегидного производства в этой форме или необязательно после дополнительных технологических мер как определено выше.
В дополнительной конфигурации настоящего изобретения изобретение таким образом относится к кристаллам серебра с тонким пористым покрытием оксидного материала элементов, выбранных из группы, которая состоит из алюминия, кремния, циркония, олова, титана и их смесей, получаемых посредством способа согласно изобретению.
Кристаллы серебра для синтеза формальдегида должны иметь особую форму, чтобы было возможно успешно использовать в качестве катализаторов. Они не могут быть слишком маленькими, так как слишком малые впадины в ином случае остаются между отдельными кристаллами для того, чтобы преобразовать газы для непрерывного протекания. Закупорка слоя катализатора была бы следствием. С другой стороны, размеры частиц кристаллов не должны быть слишком большими, так как в противном случае в результате будет получено неблагоприятное соотношение между дорогим материалом катализатора и площадью поверхности. Это, как было обнаружено, было выгодно, когда значение распределения размера частиц составляло от 0.15 до 2.5 мм, более предпочтительно от 0.5 до 2.0 мм и наиболее предпочтительно от 0.5 до 1.0 мм.
Покрытие кристаллов серебра служит - как уже обозначено - для того, чтобы препятствовать тому, чтобы кристаллы серебра спекались вместе в слое катализатора в синтезе формальдегида. У покрытия должна быть соответствующая толщина для того, чтобы быть в состоянии достаточно гарантировать этот эффект. У покрытия поэтому должна быть толщина на сколько это возможно не меньше чем 0.3 мкм. С другой стороны можно предположить, что слишком большая толщина покрытия может быть не выгодна с точки зрения слипания и износа. Толщина покрытия должна таким образом быть между 0.3 мкм - 10 мкм. Предпочтительно, толщина составляет 1.0-5.0 мкм, более предпочтительно 2.0-4.0 мкм и наиболее предпочтительно около 3.0 мкм.
Покрытие состоит из оксидного материала предполагаемых элементов. Согласно изобретению, такой материал интерпретируется как являющийся неорганическим соединением, которое содержит рассматриваемые элементы, присутствующие соединенными друг к другу через кислородные атомы в пределах всего материала или, по крайней мере, в преобладающих частях. Оксидный материал таким образом предпочтительно содержит различные типы SiO2, алюминиевые оксиды (к примеру, α-, β-, γ-Al2O3, бемит, и т.д.), TiO2, ZrO2, смесь оксидов или смешанных оксидов этих соединений, к примеру различные виды цеолитов, SAPO, перовскитов, шпинелей и т.п.. Покрытие может также присутствовать в форме керамики.
Катализатор изобретения должен предпочтительно иметь особую объемную плотность. Она должно быть между >1700 и <3800 г/л, предпочтительно >1700 и <2400 г/л и наиболее предпочтительно между >1700 и <2000 г/л.
Данное изобретение также, кроме того, относится к использованию кристаллов серебра, покрытых в соответствии с изобретением в качестве катализаторов для получения формальдегида.
Для этого применения, к примеру, синтеза формальдегида, кристаллы серебра должны обладать чистотой >99.9%, предпочтительно >99.99%. Элементы, которые могут присутствовать в ультрамалых количествах в кристаллах серебра, как было обнаружено, были такими, которые выбраны из группы, которая состоит из золота, висмута, меди, железа, свинца, палладия и платины. Количество этих элементов составляет меньше чем 100 ppm, предпочтительно <50 ppm и очень предпочтительно <30 ppm.
Покрытие кристаллов серебра, по крайней мере, кардинально задерживает совместное спекание кристаллов во время синтеза формальдегида. Кристаллы могут также - когда запланирована замена катализатора - быть удалены из реактора значительно с большей легкостью, так как спекание кристаллов менее выражено. Покрытие эффективно придает наружную твердую оболочку кристаллам серебра, которая значительно продлевает срок службы слоя катализатора в синтезе формальдегида и, таким образом, препятствует частой замене катализатора. Начиная с замены катализатора и остановки производства, что вызывает большинство проблем, которые становятся причинами удорожания затрат на производство формальдегида, данное изобретение помогает обеспечить выполнение синтеза формальдегида со значительно меньшими затратами.
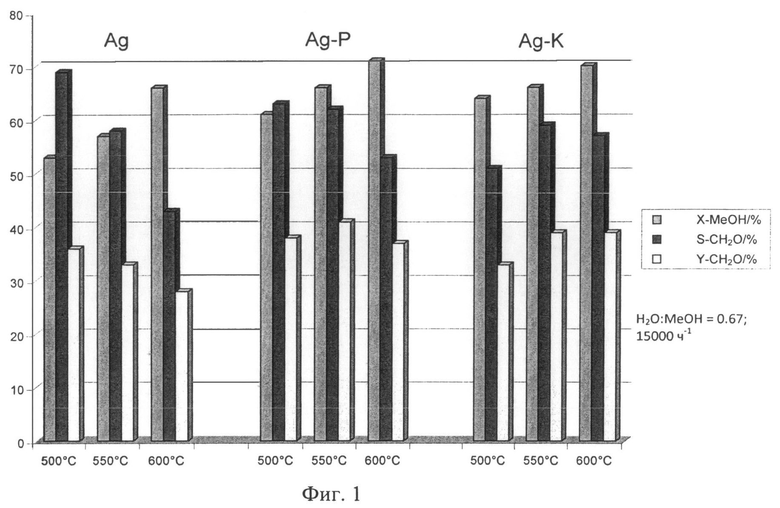
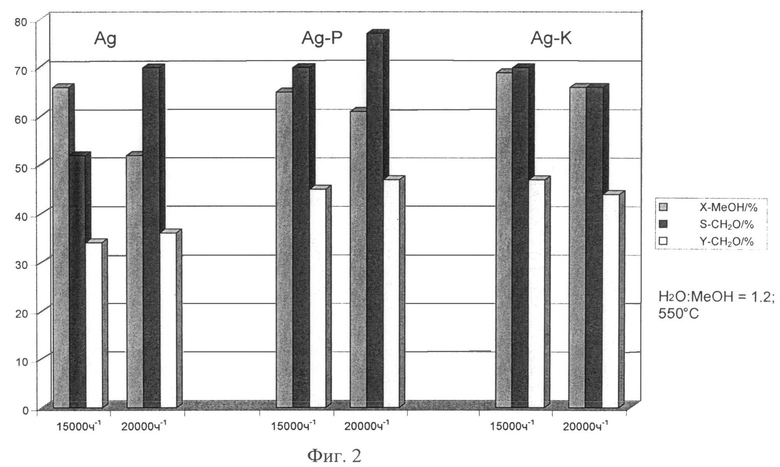
Тесты продемонстрировали, что выход с новыми катализаторами к удивлению не значительно более низкий, чем с изначально используемыми серебряными катализаторами (Фиг.1, Фиг.2).
Примеры:
Производство катализаторов
Кристаллы Ag были покрыты керамическим слоем γ-Al2O3 посредством коллоидного бемитового (А100Н) золя или полимерного Al2O3 золя.
Характерной особенностью коллоидных золей является диспергированные ультрамалые частицы в области 1 нм, которые статически отталкивают друг друга вследствие поверхностных зарядов. Для получения коллоидного бемитового раствора три-втор-бутоксид алюминия (ATSB) был разбавлен 2-бутанолом и добавлен по капле в воду, подкисленную азотной кислотой. Гидролиз, который имеет место, протекал с избытком воды. 2-Бутанол, который формируется, впоследствии отгоняли. Преобразование в бемит с одновременной стабилизацией бемитового коллоидного раствора имело место в результате кипения с обратным холодильником при 120°С. Был получен чистый бемитовый коллоидный раствор, который переливается бледно-голубоватым цветом.
Для полимерных коллоидных растворов алкоксиды металлов подобным образом служат материалом прекурсора. Полимерный бемитовый коллоидный раствор оксида алюминия был аналогичным образом приготовлен из растворенного изопропиловым спиртом три-втор-бутоксида алюминия (ATSB). В отличие от получения коллоидных растворов, здесь подается только небольшое количество воды, что приводит к частичному гидролизу и предотвращает осаждение гидроксидов. Частично гидролизируемые алкоксиды конденсируют с отведением воды для формирования полимеров. Полный гидролиз предотвращают посредством добавления комплексообразующих веществ, таких как ацетил ацетон. Перемешивание с предотвращением воздуха и добавление азотной кислоты стабилизирует коллоидные растворы. Сформирован чистый коллоидный раствор.
Полученные коллоидные растворы используются для покрытия кристаллов Ад посредством окунания или орошения. Это сопровождается последующим высушиванием кристаллов на решетчатом субстрате при содержаниях влаги>50% и температурах между 25 и 100°С. Это преобразовывает коллоидный раствор в гель; наночастицы сшиваются трехмерно в пространстве. Посредством спекания покрытых кристаллов в керамических стеклоплавильных сосудах при 500°С с временем выдержки 3 часа, керамическое покрытие было сформировано из гелевого слоя на кристаллах Ag.
Литература:
С.Jeffrey Brinker, George W.Scherer
Sol-Gel Science, The Physics and Chemistry of Sol-Gel-Processing
ACADEMIC PRESS, INC.
Тесты на определение активности
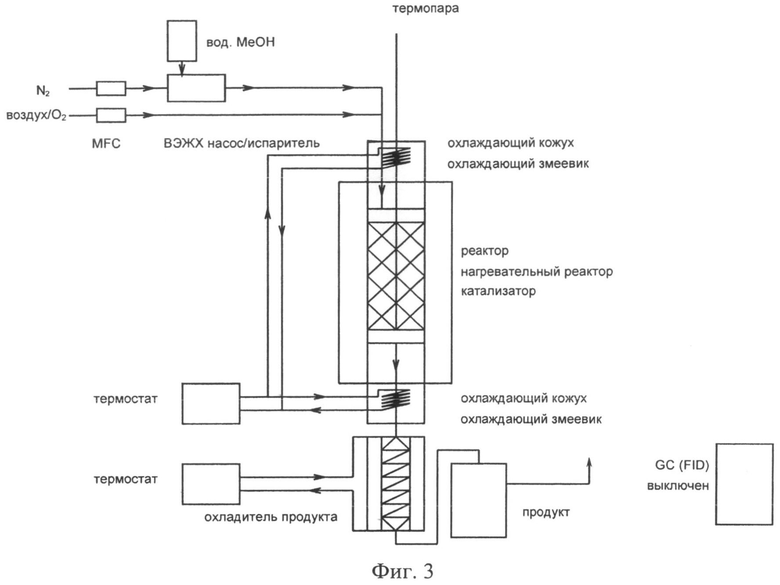
Аппарат, как показано на фигуре 3, был использован для выполнения тестов на определение активности.
N2 и воздух/O2 были измерены с Применением МРП (мультирегуляторы потока), которые был заранее откалиброваны посредством расходомера с мыльной пленкой. Для проверки, газовые потоки были также измерены позже после прохождения через ненагретый реактор. Жидкость была измерена посредством ВЭЖХ насоса с направленным вверх дегазатором. Смеси H2O/MeOH были установлены при посредстве первоначальных масс. Для вычисления объема жидкой фазы, который будет измерен (мл/мин), аддитивное состояние плотности компонентов было первоначально принято для плотности смесей. После того, как тестирование было закончено, количество введенной жидкости было проверено по отношению к изменению в весе жидкого резервуара. Соответственно, коррекция количества измеренного МеОН была произведена для вычисления преобразования МеОН (Х-МеОН), а также и объемных процентов всех поданных компонентов и ЧОСГ (часовая объемная скорость газа)
Используемый реактор представляет собой ALSINT 99.7 керамическую трубку; внешний диаметр 15 мм, внутренний диаметр 10 мм, длина 500 мм (из Haldenwanger Berlin (ВТК - Buntenkötter Technische Keramik, Neuss)). Реакторное входное отверстие и выходное отверстие были выдержаны при приблизительно 120°С посредством охлаждения воды (охлаждающая катушка). Коробка термостата (120°С) гарантирует, что формальдегид не полимеризируется прежде, чем поток продукта вводится в конденсатор и в сборный сосуд для образцов продукта. Жидкий реагент был испарен при 120°С в испарителе, который соединен с реактором вверх по направлению. Температура реактора была отрегулирована до температуры, которая является желательной на слое катализатора, которая была измерена в середине слоя катализатора. Она должна была быть скорректирована в случае изменений в уровне подачи жидкости и составе. После того как покинул реактор и термобокс, получаемый газ был охлажден до приблизительно 5°С в змеевиковом конденсаторе и передан в типовой пункт забора жидкости, который был аналогичным образом охлажден.
Слой катализатора состоял в каждом случае из 0.1 г Ag катализатора с фракцией частицы 0.5-1 мм, смешан с 3 г 1-1.4 мм белого высококачественного корунда (по аналогии к [М.Qian, M.A.Liauw, G.Emig, Appl. Catal. A: General, 238 (2003) 211.]). Объем слоя составлял 2.3 мл (на основе ЧОСГ вычисления). Для предварительно нагрева исходной реакционной смеси на входной стороне, дополнительный слой высококачественного корунда была наслоен над слоем катализатора.
Были протестированы три образца катализатора: Кат.1: "Чистое серебро" (Ag), Кат.2: Ag модифицированный с оксидом алюминия на полимерной основе (алюминиевый гидроксидный прекурсор - изобретательский) (Ag-Р), Кат.3: Ag модифицированное с оксидом алюминия на коллоидной основе (алюминиевый зольный прекурсор - изобретательский) (Ag-К).
Исследования газовой хроматографии были произведены с Shimadzu GC 17A с Применением AT-Q 30 м × 0.32 мм капиллярной колонки и FID с расположенным вверх по направлению метанизатор. Главным образом, использовались следующие условия:
Вводимый объем 0.9 µл, расслоение 40, линейная скорость 30.9 см/с, температурная программа 6 минут изотермическая 120°С, 10 К/мин до 200°С, время удержания 1 мин, 5 инъекций на каждый образец. Капиллярная GC колонка эксплуатируется при начальнйо температуре 120°С, для того чтобы предотвратить полимеризацию формальдегида или образования диметоксиметана с МеОН.
Тесты были проведены при 500-600°С и пространственных скоростях 6000-20000 ч-1; отношение МеОН: вода было 0.67 или 1.2. Преобразования МеОН достигают приблизительно 70% при 600°С; выходы ФА составляют 35-40%. При низких наполнениях или высоких периодах удержания, наблюдался высокий уровень разложения ФА; СО был главным продуктом.
Детали тестов могут быть взяты из следующих таблиц:
При выполнении всех реакционных условий, к удивлению, в незначительной степени низшие выходы и преобразования метанола были получены с Ag катализаторами, поверхность которых была модифицирована с алюминий оксидными нанесениями (Ag-Р и Ag-К).
Фигуры 1 и 2 демонстрируют МеОН преобразования и ФА выходы в виде функции реакционной температуры и пространственной скорости.
Фиг.1: МеОН преобразование и ФА селективность или выход в соответствии с реакционной температурой
Фиг.2: МеОН преобразование и ФА селективность или выход в соответствии с заполнением
Х-МеОН: МеОН преобразование [%]
S-ФА: Селективность формальдегида [%]
Y-ФА: Выход формальдегида [%].
| название | год | авторы | номер документа |
|---|---|---|---|
| Обертка для курительного изделия, курительное изделие и способ изменения горючих характеристик бумажной обертки для курительных изделий | 1990 |
|
SU1804312A3 |
| ГАЗОЧУВСТВИТЕЛЬНЫЙ СЛОЙ ДЛЯ ОПРЕДЕЛЕНИЯ ФОРМАЛЬДЕГИДА В ВОЗДУХЕ, СЕНСОР С ГАЗОЧУВСТВИТЕЛЬНЫМ СЛОЕМ И ДЕТЕКТОР ДЛЯ ОПРЕДЕЛЕНИЯ ФОРМАЛЬДЕГИДА | 2019 |
|
RU2723161C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ КАРБОНИЛИРОВАНИЯ | 2007 |
|
RU2453528C2 |
| БЫТОВОЙ ЭЛЕКТРОПРИБОР, СОДЕРЖАЩИЙ АНТИМИКРОБНЫЙ АГЕНТ | 2010 |
|
RU2549066C2 |
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ СУСПЕНЗИЙ МЕТАЛЛИЧЕСКИХ НАНОЧАСТИЦ И СТАБИЛЬНЫЕ КОЛЛОИДНЫЕ СУСПЕНЗИИ, ПОЛУЧЕННЫЕ ТАКИМ СПОСОБОМ | 2010 |
|
RU2536144C2 |
| КАТАЛИЗАТОР НА ОСНОВЕ Fe ДЛЯ СИНТЕЗА ФИШЕРА-ТРОПША, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2468863C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАРБОНОВЫХ КИСЛОТ С ЭТИЛЕНОВОЙ НЕНАСЫЩЕННОСТЬЮ ИЛИ ИХ ЭФИРОВ И ИХ КАТАЛИЗАТОР | 2011 |
|
RU2582603C2 |
| ОБОИ С ВОЗДУХООЧИЩАЮЩЕЙ ФУНКЦИЕЙ И СПОСОБ ИЗГОТОВЛЕНИЯ ТАКИХ ОБОЕВ | 2010 |
|
RU2432263C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНКАРБОНАТА И/ИЛИ АЛКИЛЕНГЛИКОЛЯ | 2009 |
|
RU2506124C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ СЕРЕБРА | 2008 |
|
RU2385293C2 |
Изобретение относится к области катализа. Описан способ получения кристаллов серебра с распределением среднего размера частиц от 0.15 мм до 2.5 мм и пористым покрытием оксидных материалов, в котором а) кристаллы серебра контактируют с золь-гелевым раствором материалов, о которых идет речь, в растворителе, который содержит органический растворитель и b) получающиеся в результате кристаллы серебра собирают, с) освобождают от органического растворителя и d) затем подвергают термической обработке при температуре между 50°С и точкой плавления серебра. Описано применение полученных кристаллов в качестве катализатора для получения формальдегида. Технический результат - увеличение активности катализатора получения формальдегида. 3 н. и 7 з.п. ф-лы, 3 ил., 4 табл., 1 пр.
1. Способ получения кристаллов серебра с распределением среднего размера частиц от 0,15 мм до 2,5 мм и пористым покрытием оксидных материалов элементов, выбранных из группы, которая состоит из алюминия, кремния, циркония, титана и их смесей, отличающийся тем, что
a) кристаллы серебра контактируют с золь-гелевым раствором элементов, о которых идет речь, в растворителе, который содержит органический растворитель, и
b) получающиеся в результате кристаллы серебра собирают,
c) освобождают от органического растворителя и
d) затем подвергают термической обработке при температуре между 50°С и точкой плавления серебра.
2. Способ по п.1, отличающийся тем, что выбранный золь-гелевый раствор представляет собой алкоксид элемента, о котором идет речь, в соответствующем спирте в качестве органического растворителя.
3. Способ по п.2, отличающийся тем, что выбранное алкоксидное соединение элемента, о котором идет речь, является одним выбранным из группы метоксидов, этоксидов, пропоксидов, изопропоксидов, n-бутоксидов, втор-бутоксидов, изобутоксидов, трет-бутоксидов, n-пропоксидов или их структурных изомеров.
4. Способ по п.1, отличающийся тем, что получающиеся в результате кристаллы серебра освобождают от растворителя посредством подвергания растворителя выпариванию при условиях окружающей среды.
5. Способ по п.1, отличающийся тем, что термическая обработка производится при температуре между 400°С и 600°С.
6. Кристаллы серебра с распределением среднего размера частиц от 0,15 мм до 2,5 мм и пористым покрытием оксидного материала элементов, выбранных из группы, которая состоит из алюминия, кремния, циркония, титана и их смесей, которые получают посредством одного из способов по пп.1-5.
7. Кристаллы серебра по п.6, отличающиеся тем, что покрытие имеет толщину 0,3-10 мкм.
8. Кристаллы серебра по п.6, отличающиеся тем, что оксидный материал выбран из группы SiO2, различных видов оксидов алюминия, TiO2, ZrO2, смеси оксидов или смешанных оксидов этих соединений, необязательно в форме керамики.
9. Кристаллы серебра по п.6 с объемной плотностью между >1700 г/л и <3800 г/л.
10. Применение кристаллов серебра по одному или более пп.6-9 в качестве катализатора для получения формальдегида.
| Устройство для сварки термопластов | 1983 |
|
SU1110647A1 |
| Автомат для контроля и сортировки уплотнительных колец | 1989 |
|
SU1696006A1 |
| US 2006192183 A1, 31.08.2006 | |||
| US 20080103219 A1, 01.05.2008 | |||
| US 20080193746 A1, 14.08.2008 | |||
| US 20060167147 A1, 27.07.2006 | |||
| Капельница | 1978 |
|
SU818561A1 |
| US 6338830 B1, 15.01.2002 | |||
| Способ профилактики желудочно-кишечных болезней телят "Глюкогемовитом | 1989 |
|
SU1676625A1 |
| Клавиатурный передатчик телеграфных сигналов Морзе | 1927 |
|
SU7783A1 |
Авторы
Даты
2014-01-10—Публикация
2009-08-26—Подача