Предшествующий уровень техники
Рак предстательной железы является ведущей причиной заболеваемости и смертности у мужчин в современном мире. По оценкам Американского общества по борьбе с раковыми заболеваниями (The American Cancer Society) только в течение одного 2007 года в США будет поставлен диагноз около 218890 новых случаев рака предстательной железы. Рак предстательной железы является второй после рака легких основной причиной гибели от рака среди американских мужчин. Однако в то время как примерно у 1 мужчины из 6 будет поставлен диагноз рака предстательной железы во время его жизни, только 1 мужчина из 35 действительно погибнет от него. По оценкам Американского общества по борьбе с раковыми заболеваниями 27050 мужчин в США погибнут от рака предстательной железы в 2007 году. Рак предстательной железы составляет около 9% связанных с раком летальных исходов у мужчин.
В то время как коэффициент заболеваемости раком предстательной железы чрезвычайно вырос в конце 1980х годов, полагают, что значительная часть такого возрастания отражает усовершенствование в обнаружении и диагностике благодаря широкому использованию тестирования на простатоспецифичный антиген (PSA). В действительности, коэффициент заболеваемости раком предстательной железы сокращается с начала 1990х годов, и коэффициент смертности от рака предстательной железы также снижается с начала 1990х годов (см. Программу выживаемости, распространенности и исходов злокачественных новообразований (SEER) и Национальный центр статистики здоровья (the National Center for Health Statistics) (http://seer.cancer.gov/)). Более 9 из 10 случаев рака предстательной железы обнаруживают на локальных и региональных стадиях (локальная означает, что рак все еще ограничен предстательной железой; региональная означает, что он распространился с предстательной железы на близлежащие области, но не на отдаленные области, такие как кости). При сравнении мужчин одного возраста и расы, у которых нет рака (относительное выживание), индекс 5-летнего относительного выживания для этих мужчин составляет приблизительно 100%, однако индекс 5-летнего относительного выживания для мужчин, у которых рак предстательной железы уже распространился на отдаленные части тела на момент постановки диагноза, составляет всего лишь приблизительно 32%. Оценивают, что только в США приблизительно $8 миллиардов тратится каждый год на лечение рака предстательной железы (Cancer Trends Progress Report (http://progressreport.cancer.gov)).
Преобладание рака предстательной железы зависит от тестостерона для роста, и существующее в настоящее время медикаментозное лечение распространенного рака предстательной железы заключается в андрогенной депривации, которая может быть достигнута путем двусторонней орхиэктомии или путем введения агонистов рецептора гонадотропин-высвобождающего гормона (GnRH). Удаление яичков (кастрация) являлось в течение многих лет стандартным способом предупреждения секреции мужских гормонов половыми железами в качестве средства для снижения роста злокачественных опухолей предстательной железы. Совсем недавно секрецию мужских гормонов нарушали химическими средствами путем вмешательства в продуцирование лютеинизирующего гормона (LH), который регулирует синтез андрогенов. Свидетельства из рандомизированных исследований строго подтверждают, что ранняя эндокринная терапия при данном заболевании с неметастатическим локальным распространением, с метастазами лимфатических узлов или без них, ассоциирована с успехом выживания (см. Grantors et al. (1998) J.Urol. 159:2030-34; Messing et al. (1999) N.Eng. J.Med. 341:1781-88; и (1997) Br. J.Urol. 79:235-46).
Гонадотропин-высвобождающий гормон (GnRH) представляет собой естественный гормон, продуцируемый гипоталамусом, который взаимодействует с рецептором в гипофизе для стимуляции продуцирования LH. Для снижения продуцирования LH были разработаны агонисты GnRH-рецептора (GnRH-R), такие как лейпролид и гозерелин. Такие GnRH-агонисты обычно являются аналогами GnRH, представляющего собой декапептид pyroGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2. Например, GnRH-агонисты, имеющие D-изомер вместо Gly по положению 6, обладают большей аффинностью/силой связывания с рецептором и большей биологической эффективностью по сравнению с нативным гормоном; один из примеров представляет собой [D-Ala6]-GnRH (описанный в патенте США No. 4072668), имеющий следующую формулу: pGlu-His-Trp-Ser-Tyr-D-Ala-Leu-Arg-Pro-Gly-NH2.
Такие GnRH-R-агонисты изначально действуют таким образом, чтобы стимулировать высвобождение LH, и только после продолжительной обработки действуют таким образом, чтобы уменьшить чувствительность GnRH-R, так что LH больше не продуцируется. Изначальная стимуляция продуцирования LH агонистом приводит к первичному резкому повышению в продукции мужских половых гормонов, так что первоначальным ответом на терапию агонистом является ухудшение состояния здоровья пациента, а не улучшение (например, рост опухоли может увеличиться). Это явление, известное как "выброс тестостерона" или "реакция вспышки," может продолжаться в течение двух-четырех недель. Дополнительно, каждое последующее введение агониста может вызывать дополнительный небольшой выброс LH (известный как явление "наслоение острого состояния на фоновое хроническое" ("acute-on chronic")), которое может дополнительно ухудшить состояние. Выброс тестостерона стимулирует рак предстательной железы и может привести к ухудшению имеющихся симптомов или появлению новых симптомов, таких как сдавление спинного мозга, костная боль и обструкция мочеиспускательного канала (Thompson et al. (1990) J.Urol. 140:1479-80; Boccon-Gibod et al. (1986) Eur. Urol. 12: 400-402). Один из подходов, который был предпринят, чтобы избежать эту проблему, представлял собой комбинированное введение GnRH-R-агониста с антиандрогеном, таким как флутамид, известное как терапия с тотальной андрогенной абляцией (total androgen ablation therapy (AAT)). Гормональную терапию GnRH-R-агонистом в комбинации с антиандрогеном использовали в качестве предварительного лечения перед радикальной простатэктомией, известного как адъювантная терапия. Однако, применение антиандрогенов ассоциировано с тяжелыми побочными эффектами со стороны печени и желудочно-кишечного тракта.
Антагонисты рецептора гонадотропин-высвобождающего гормона (GnRH-R) были разработаны для преодоления "выброса тестостерона" или "реакции вспышки", ассоциированных с GnRH-агонистами. Однако, GnRH-антагонистические пептиды часто ассоциированы с возникновением гистамин-высвобождающей активности. Такая гистамин-высвобождающая активность является серьезным препятствием для клинического применения таких антагонистов, так как высвобождение гистамина приводит в результате к неблагоприятным побочным эффектам, таким как отек и зуд.
Поиск улучшенных GnRH-антагонистов привел в результате к созданию антида (Antide), то есть [Ac-D-2Nal1, D-4CIPhe2, D-3Pal3, Lys(Nic)5, D-Lys(Nic)6, ILys8, D-Ala10]-GnRH; и цетрореликса (Cetrorelix), то есть [Ac-D-2Nal1, D-4CIPhe2, D-3Pal3, D-Cit6, D-Ala10]-GnRH. В патенте США No. 5516887 описаны GnRH-антагонисты, про которые сказано, что они являются более эффективными, чем антид в снижении тестостерона в плазме крови, например [Ac-D-2Nal1, D-4CIPhe2, D-3Pal3, D-Nε-карбамоил-Lys6, Ilys8, D-Ala10]-GnRH, который назван антареликс (Antarelix). Кроме того, в патенте США No. 5296468 раскрыты разработка и синтез ряда GnRH-антагонистов, где боковые цепи выбранных остатков подвергают взаимодействию с образованием цианогуанидиновых группировок, некоторые из которых затем самопроизвольно превращаются в желаемый гетероцикл, например 3-амино-1,2,4-триазол(а1 г). Такие цианогуанидиновые группировки наращивают на омега-аминогруппу в аминокислотной боковой цепи, такой как лизин, орнитин, 4-амино-фенилаланин (4Aph) или их варианты с удлиненной цепью, такие как 4-амино-гомофенилаланин (4Ahp). GnRH-антагонисты, имеющие такие существенно модифицированные или неприродные аминокислоты в положениях 5 и 6, проявляют хорошую биологическую эффективность, и те, которые имеют наращенный Aph, обычно считаются особенно эффективными. Один из тех, которые особенно полезны, представляет собой азалин В (Azaline В), то есть [Ac-D-2Nal1, D-4CIPhe2, D-3Pal3, 4Aph(atz)5, D-4Aph(atz)6, ILys8, D-Ala10]-GnRH. В патенте США No. 5506207 раскрыты биоэффективные GnRH-антагонисты с ацилированными, амино-замещенными фенилаланиновыми боковыми цепями остатков в положениях 5 и 6; один такой декапептид представляет собой ацилин (Acyline), то есть [Ac-D-2Nal1, D-4CIPhe2, D-3Pal3, 4Aph(Ac)5, D-4Aph(Ac)6, ILys8, D-Ala10]-GnRH. Несмотря на привлекательные свойства этой группы GnRH-антагонистов, продолжается поиск еще более улучшенных GnRH-антагонистов, в частности тех, которые проявляют длительный период биологического действия. Часто может быть важным то, что пептидный аналог должен проявлять длительный период действия в отношении секреции LH, свойство, которое может быть усилено благодаря устойчивости пептида к разложению протеолитическими ферментами в организме в случае показаний как к краткосрочному, так и длительному лечению. В дополнение, для облегчения введения этих соединений млекопитающим, в частности людям, без значительного гелеобразования, считается чрезвычайно благоприятным для таких GnRH-антагонистических декапептидов иметь высокую растворимость в воде при нормальных физиологических значениях рН, то есть при рН от приблизительно 5 до приблизительно 7,4.
В то время как применение и агонистов, и антагонистов GnRH при андрогенной депривационной терапии для лечения рака предстательной железы дало обнадеживающие результаты, имеются опасения, связанные с относительной безопасностью этих доступных лекарственных средств. Например, было обнаружено, что GnRH абареликс несет риск возникновения тяжелых аллергических реакций, в том числе анафилактической реакции с гипотензией и потерей сознания, и кроме того, как было обнаружено, с потерей эффективности во время курса лечения в некоторых случаях. В действительности, Abarelix™ (Plenaxis™ в США) был в конечном итоге одобрен, но только для пациентов с распространенным раком предстательной железы, и был в конце концов изъят с рынка в 2005 году по коммерческим соображениям, по-видимому связанным с этими проблемами. Кроме того, в то время как смертность от рака предстательной железы возрастает, вряд ли он оказывает полное влияние на коэффициент смертности в этой группе, предполагая возможность повышенного риска гибели от причин, не связанных с раком предстательной железы. В частности, предполагается, что некоторые андрогенные депривационные терапии могут неблагоприятным образом влиять на здоровье сердечно-сосудистой системы (см. Yannucci et al. (2006) J.Urology 176:520-525; и Etzioni et al. (1999) J.Natl. Cane. Inst. 91:1033).
Соответственно, необходимы новые терапевтические подходы для лечения рака предстательной железы, которые не имеют неблагоприятных последствий выброса тестостерона, связанного с GnRH-агонистом, а также нежелательных побочных эффектов доступных терапий GnRH-антагонистами.
Краткое изложение сущности изобретения
Заявители обнаружили, что относительно низкая доза GnRH-антагониста дегареликса (degarelix), доставляемая приблизительно один раз в каждые 28 суток (например, ежемесячно), может безопасно и быстро подавлять уровни тестостерона до терапевтических уровней у пациентов, страдающих раком предстательной железы, не вызывая выброса тестостерона и со значительно сниженным риском возникновения нежелательного побочного эффекта (отличного от побочного эффекта, связанного с местом введения, например местом инъекции), ассоциированного с андрогенной депривационной терапией, такого как расстройство сердечной деятельности, артралгия и/или инфекция мочевыводящих путей. Преимущества применения дегареликса для лечения рака предстательной железы могут включать пониженную вероятность возникновения и/или пониженную тяжесть симптомов неблагоприятных реакций, неблагоприятных явлений или побочных действий в отношении органов или тканей.
Согласно настоящему изобретению в его первом аспекте предложена композиция, содержащая дегареликс, для лечения у субъекта рака предстательной железы, обеспечивающего пониженную частоту и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции. Композиция может быть предназначена для лечения у субъекта рака предстательной железы с пониженной частотой и/или вероятностью возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом введения. Согласно изобретению в его дополнительном аспекте предложено применение дегареликса в изготовлении лекарственного средства для лечения у субъекта рака предстательной железы, обеспечивающего пониженную частоту и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции.
Лечение может сопровождаться или быть ассоциированным с пониженной частотой или вероятностью возникновения одного или более чем одного из следующего: сердечно-сосудистые и/или сосудистые побочные эффекты (например, с пониженной частотой и/или вероятностью возникновения одного или более чем одного из следующего: инфаркт миокарда, боль в груди, нарастание боли в груди, шум в сердце, нарастание шума в сердце, ишемия миокарда, атриовентрикулярная блокада, тромбоз глубоких вен (DVT), сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности), скелетно-мышечное расстройство (например артралгия и/или скелетно-мышечная скованность), заболевание соединительной ткани, расстройство мочевыводящей или почечной системы.
Композиция (или лекарственное средство) могут быть предназначены для введения дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток. Композиция (или лекарственное средство) могут быть предназначены для лечения, где частота и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции/или введения, снижена по сравнению с частотой и/или вероятностью возникновения такого побочного эффекта, ассоциированного с лечением GnRH-агонистом лейпролидом.
Композиция (или лекарственное средство) могут быть предназначены для лечения, где субъект имеет по меньшей мере 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл к 28 суткам лечения, например, где субъект имеет по меньшей мере 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл на 28-365 сутки лечения. Композиция (или лекарственное средство) могут быть предназначены для лечения, где субъект имеет по меньшей мере 30%-ное снижение (например по меньшей мере 50%-ное снижение) уровня простатоспецифичного антигена (PSA), к 14 суткам лечения. Композиция (или лекарственное средство) могут быть предназначены для лечения, где субъект имеет по меньшей мере 60%-ное снижение (например по меньшей мере 75%-ное снижение) уровня простатоспецифичного антигена (PSA), к 28 суткам лечения. Композиция (или лекарственное средство) могут быть предназначены для лечения с по меньшей мере 80%-ной вероятностью поддержания уровня простатоспецифичного антигена (PSA) при менее чем 5 нг/мл во время лечения.
Композиция (или лекарственное средство) могут быть предназначены, например, для лечения с пониженной частотой и/или вероятностью возникновения сердечно-сосудистого и/или сосудистого побочного(ых) эффекта(ов) у субъекта, подвергаемого лечению. Например, они могут быть предназначены для лечения с пониженной частотой и/или вероятностью возникновения одного или более чем одного из следующего: инфаркт миокарда, боль в груди, нарастание боли в груди, шум в сердце, нарастание шума в сердце, ишемия миокарда, атриовентрикулярная блокада, тромбоз глубоких вен (DVT), сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности.
Композиция (или лекарственное средство) могут быть предназначены, например, для лечения с пониженной частотой и/или вероятностью возникновения одного или более чем одного из следующего: скелетно-мышечное расстройство и/или заболевание соединительной ткани у субъекта, подвергаемого лечению. Например, они могут быть предназначены для лечения с пониженной частотой или вероятностью возникновения артралгии и/или скелетно-мышечной скованности (например, у субъекта с локально распространенным раком предстательной железы и/или у субъекта возрастом менее 65 лет).
Композиция (или лекарственное средство) могут быть предназначены, например, для лечения с пониженной частотой и/или вероятностью возникновения расстройства мочевыводящей или почечной системы. Например, они могут быть предназначены для лечения с пониженной частотой и/или вероятностью повышения мочевой ретракции и/или инфекции мочевыводящих путей (например, неинфекционного цистита). Композиция (или лекарственное средство) могут быть предназначены для лечения субъекта с локально распространенным раком предстательной железы.
Композиция (или лекарственное средство) могут быть предназначены для лечения субъекта с индексом массы тела (ВМ1) менее чем 30 кг/м2, например, для лечения субъекта с индексом массы тела (ВМ1) от 20 до 30 кг/м2, например от 20 до 25 кг/м2. Композиция (или лекарственное средство) могут быть предназначены для лечения субъекта с уровнем холестерина большим или равным 4 ммоль/л.
Согласно настоящему изобретению в его дополнительном аспекте предложена композиция, содержащая дегареликс, для лечения рака предстательной железы у субъекта, имеющего индекс массы тела от 20 до 30 кг/м2, например, у субъекта, имеющего индекс массы тела от 20 до 25 кг/м2. Согласно настоящему изобретению в его дополнительном аспекте предложена композиция, содержащая дегареликс, для лечения рака предстательной железы у субъекта, имеющего уровень холестерина больший или равный 4 ммоль/л.
В одном аспекте изобретения предложен способ лечения у субъекта рака предстательной железы с пониженной вероятностью выброса тестостерона или другого побочного эффекта терапии агонистом гонадотропин-высвобождающего гормона (GnRH). Способ включает введение субъекту дегареликса в начальной дозе приблизительно 240 мг с последующим введением этому субъекту дегареликса в поддерживающей дозе приблизительно 80 мг один раз в каждые приблизительно 28 суток и таким образом лечение у этого субъекта рака предстательной железы с пониженной вероятностью выброса тестостерона или другого побочного эффекта, связанного с GnRH-агонистом.
В дополнительном аспекте изобретения предложен способ лечения у субъекта рака предстательной железы с пониженной вероятностью выброса тестостерона или другого побочного эффекта терапии агонистом гонадотропин-высвобождающего гормона (GnRH). Способ включает введение субъекту дегареликса в начальной дозе 160-320 мг с последующим введением этому субъекту дегареликса в поддерживающей дозе 60-160 мг один раз в каждые 20-36 суток и таким образом лечение у этого субъекта рака предстательной железы с пониженной вероятностью выброса тестостерона или другого побочного эффекта, связанного с GnRH-агонистом.
В некоторых воплощениях этих способов по изобретению поддерживающую дозу вводят ежемесячно. В дополнительных воплощениях субъект, которого лечат, имеет пониженную вероятность развития или проявления нежелательного побочного эффекта во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом. В конкретных воплощениях субъект, которого лечат, имеет пониженную вероятность развития или проявления сердечнососудистого побочного эффекта, такого как инфаркт миокарда, боль в груди, шум в сердце, или сосудистого побочного эффекта (например, тромбоза глубоких вен (DVT)) во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом. В дополнительных воплощениях данных способов субъект, которого лечат, имеет пониженную вероятность развития побочного эффекта, выбранного из группы, состоящей из сердечной аритмии, заболевания коронарных артерий и расстройства сердечной деятельности. В особенно полезных воплощениях субъект, которого лечат, имеет индекс массы тела (BMI) менее чем 30 кг/м2, в частности BMI менее чем 25 кг/м2. В дополнительных полезных воплощениях субъект, которого лечат, имеет уровень холестерина больший или равный 4 ммоль/л (155 мг/дл).
В дополнительных воплощениях способы по изобретению используют для лечения субъекта, который имеет риск развития сердечно-сосудистого заболевания. В особенно полезных воплощениях способы по изобретению дополнительно включают стадию идентификации рака предстательной железы у субъекта, который также имеет риск развития сердечно-сосудистого заболевания, для лечения этим способом.
В еще дополнительных воплощениях субъект, которого лечат, имеет пониженную вероятность развития или проявления усиления артралгии и/или скелетно-мышечной скованности во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом. В особенно полезных воплощениях изобретения субъект, которого лечат, имеет локально распространенный рак предстательной железы и/или возраст менее чем 65 лет.
В дополнительных воплощениях субъект, которого лечат, имеет пониженную вероятность развития скелетно-мышечного расстройства и/или заболевания соединительной ткани во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом. В конкретных воплощениях скелетно-мышечное расстройство и/или заболевание соединительной ткани представляет собой артралгию. В других воплощениях скелетно-мышечное расстройство и/или заболевание соединительной ткани представляет собой скелетно-мышечную скованность.
В еще дополнительных воплощениях этих способов по изобретению субъект, которого лечат, имеет пониженную вероятность развития неинфекционного цистита во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом.
В другом воплощении субъект, которого лечат, имеет пониженную вероятность развития расстройства мочевыводящей или почечной системы по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом. В некоторых воплощениях расстройство мочевыводящей или почечной системы представляет собой инфекцию мочевыводящих путей. В особенно полезных воплощениях изобретения субъект, которого лечат, имеет локально распространенный рак предстательной железы. В другом воплощении расстройство мочевыводящей или почечной системы представляет собой увеличение задержки мочевыделения. В еще одном воплощении расстройство мочевыводящей или почечной системы представляет собой неинфекционный цистит.
В еще дополнительных воплощениях субъект, которого лечат, имеет пониженную вероятность развития эректильной дисфункции во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом: В других воплощениях субъект, которого лечат, имеет пониженную вероятность снижения либидо во время лечения по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом.
В конкретных воплощениях указанных выше способов по изобретению субъект, которого лечат, имеет по меньшей мере приблизительно 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл к 28 суткам лечения. В некоторых воплощениях субъект, которого лечат, имеет по меньшей мере приблизительно 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл на 28-364 сутки лечения. В еще дополнительных воплощениях субъект, которого лечат, имеет по меньшей мере приблизительно 30%-ное снижение уровня простатоспецифичного антигена (PSA) к 14 суткам лечения. В конкретных воплощениях субъект, которого лечат, имеет по меньшей мере приблизительно 50%-ное снижение уровня простатоспецифичного антигена (PSA) к 14 суткам лечения. В дополнительных воплощениях субъект, которого лечат, имеет по меньшей мере приблизительно 60%-ное снижение уровня простатоспецифичного антигена (PSA) к 28 суткам лечения. В еще дополнительных воплощениях субъект, которого лечат, имеет по меньшей мере приблизительно 75%-ное снижение уровня простатоспецифичного антигена (PSA) к 28 суткам лечения.
В дополнительных воплощениях способа по изобретению субъект, которого лечат, имеет по меньшей мере приблизительно 80%-ную (например 95%-ную) вероятность поддержания уровня простатоспецифичного антигена (PSA) при менее чем 5 нг/мл во время лечения.
В дополнительных воплощениях способа по изобретению субъект, которого лечат, имеет локально распространенный рак предстательной железы и имеет по меньшей мере приблизительно 40%-ное снижение уровня PSA к 14 суткам лечения.
В еще дополнительных воплощениях субъект, которого лечат, имеет метастатический рак предстательной железы и имеет по меньшей мере приблизительно 60%-ное снижение уровня PSA к 14 суткам лечения.
В конкретных воплощениях описанных выше способов по изобретению субъект, которого лечат, имеет индекс массы тела менее чем 30 кг/м2 (особенно менее чем 25 кг/м2). Согласно настоящему изобретению в дополнительном аспекте предложена композиция, содержащая дегареликс, для лечения рака предстательной железы у субъекта, имеющего повышенную вероятность развития сердечно-сосудистого заболевания или расстройства. Согласно настоящему изобретению в дополнительном аспекте предложено применение дегареликса в изготовлении лекарственного средства для лечения рака предстательной железы у субъекта, имеющего повышенную вероятность развития сердечно-сосудистого заболевания или расстройства. Композиция (или лекарственное средство) могут быть предназначены для введения дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток. Композиция (или лекарственное средство) могут быть предназначены для введения дегареликса в начальной дозе приблизительно 240 мг и в поддерживающей дозе приблизительно 80 мг дегареликса один раз в каждые приблизительно 28 суток лечения. Композиция или лекарственное средство могут быть предназначены для лечения, которое включает стадию идентификации подходящего субъекта, имеющего рак предстательной железы и имеющего риск развития сердечнососудистого заболевания или расстройства. Сердечно-сосудистое заболевание или расстройство может представлять собой, например, шум в сердце, атриовентрикулярную блокаду или ишемию миокарда.
Композиция или лекарственное средство могут быть предназначены для лечения субъекта, имеющего индикатор повышенного и/или высокого риска развития сердечно-сосудистого заболевания. Индикатор повышенного риска развития сердечно-сосудистого заболевания представляет собой одно или более чем одно из следующего; высокое кровяное давление, высокий уровень холестерина в липопротеинах низкой плотности, низкий уровень холестерина в липопротеинах высокой плотности, высокий уровень сывороточной глюкозы и привычка курения. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с кровяным давлением большим или равным 130 на 85 мм рт. ст. (ртутного столба). Композиция или лекарственное средство могут быть предназначены для лечения субъекта, ежедневно курящего сигареты. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем холестерина в липопротеинах низкой плотности большим или равным приблизительно 160 мг/дл. Композиция или лекарственное средство могут быть предназначены для лечения субъекта, имеющего уровень холестерина в липопротеинах высокой плотности менее чем 35 мг/дл. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем глюкозы натощак более чем приблизительно 120 мг/дл. Индикатором высокого риска развития сердечно-сосудистого заболевания является одно или более чем одно из следующего: высокий уровень сывороточного С-реактивного белка (CRP), высокий уровень сывороточного гомоцистеина, высокий уровень сывороточного фибриногена и высокий уровень сывороточного липопротеина (a) (Lp(a)). Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем С-реактивного белка более чем 3 мг/дл. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем сывороточного гомоцистеина более чем 30 мкмоль/л. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем сывороточного фибриногена более чем 7,0 г/л. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем сывороточного Lp(a) более чем 30 мг/дл.
Композиция или лекарственное средство могут быть предназначены для лечения субъекта с индексом массы тела менее чем 30 кг/м2, например менее чем 25 кг/м2. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с индексом массы тела от 20 до 30 кг/м2, например от 20 до 25 кг/м2. Композиция или лекарственное средство могут быть предназначены для лечения субъекта с уровнем холестерина большим или равным 4 ммоль/л.
В другом аспекте изобретения предложены способы лечения рака предстательной железы у субъекта, имеющего риск развития сердечнососудистого заболевания или расстройства, путем введения терапевтически эффективной дозы дегареликса данному субъекту, страдающему раком предстательной железы, у которого имеется риск развития сердечнососудистого заболевания или расстройства. В конкретных воплощениях терапевтически эффективная доза включает начальную стартовую дозу от 160 до 320 мг дегареликса и ежемесячную поддерживающую дозу от 60 до 160 мг дегареликса. В дополнительных воплощениях терапевтически эффективная доза дегареликса включает поддерживающую дозу приблизительно 80 мг дегареликса один раз в каждые приблизительно 28 суток лечения. В некоторых воплощениях изобретения терапевтически эффективная доза дегареликса дополнительно включает однократную начальную дозу приблизительно 240 мг дегареликса в начале лечения.
В конкретных воплощениях субъект, которого лечат, идентифицирован как имеющий риск развития конкретного сердечно-сосудистого заболевания или расстройства, такого как шум в сердце, атриовентрикулярная блокада и/или ишемия миокарда.
В дополнительных воплощениях субъект, которого лечат, имеет индикатор повышенного риска развития сердечно-сосудистого заболевания, например, высокое кровяное давление, высокий уровень холестерина в липопротеинах низкой плотности, низкий уровень холестерина в липопротеинах высокой плотности, высокий уровень сывороточной глюкозы и/или привычка курения. В конкретных воплощениях субъект, которого лечат, имеет высокое кровяное давление, которое больше или равно 130 на 85 мм рт.ст. В дополнительных воплощениях субъект, которого лечат, ежедневно курит сигареты. В еще дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень холестерина в липопротеинах низкой плотности, который больше или равен приблизительно 160 мг/дл. В дополнительных воплощениях субъект, которого лечат, имеет низкий уровень холестерина в липопротеинах высокой плотности, который меньше чем 35 мг/дл. В других воплощениях субъект, которого лечат, имеет повышенный уровень глюкозы натощак, который больше чем приблизительно 120 мг/дл.
В еще других особенно полезных воплощениях субъект, которого лечат, имеет индикатор повышенного риска развития сердечно-сосудистого заболевания, такой как высокий уровень сывороточного С-реактивного белка (CRP), высокий уровень сывороточного гомоцистеина, высокий уровень сывороточного фибриногена и/или высокий уровень сывороточного липопротеина (a) (Lp(a)). В конкретных воплощениях субъект, которого лечат, имеет повышенный уровень С-реактивного белка, составляющий более чем 3 мг/дл. В других воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного гомоцистеина, составляющий более чем 30 мкмоль/л. В дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного фибриногена, составляющий более чем 7,0 г/л. В еще дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного Lp(a), составляющий более чем 30 мг/дл.
В некоторых воплощениях субъект, которого лечат, имеет индекс массы тела менее чем 30 кг/м2 (в частности менее чем 25 кг/м2).
В дополнительных воплощениях субъект, которого лечат, имеет пониженную вероятность, по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом, развития сердечнососудистого побочного эффекта, такого как сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности. В конкретных воплощениях изобретения субъект, которого лечат, имеет индекс массы тела (ВМ1) менее чем 30 кг/м2 (особенно менее чем 25 кг/м2). В других воплощениях субъект, которого лечат, имеет уровень холестерина больший или равный 4 ммоль/л (155 мг/дл).
В еще одном аспекте изобретения предложен способ лечения рака предстательной железы у субъекта, имеющего риск развития сердечнососудистого заболевания или расстройства, путем сначала идентификации подходящего субъекта, страдающего раком предстательной железы, который также имеет риск развития сердечно-сосудистого заболевания или расстройства. Этому подходящему субъекту, имеющему риск развития сердечно-сосудистого заболевания, затем вводят начальную дозу приблизительно 240 мг дегареликса с последующим введением поддерживающей дозы приблизительно 80 мг дегареликса один раз в каждые приблизительно 28 суток, тем самым лечат рак предстательной железы у субъекта, имеющего риск развития сердечно-сосудистого заболевания или расстройства. В некоторых воплощениях поддерживающую дозу дегареликса вводят ежемесячно.
В дополнительном аспекте изобретения предложен способ лечения рака предстательной железы у субъекта, имеющего риск развития сердечнососудистого заболевания или расстройства, путем сначала идентификации подходящего субъекта, страдающего раком предстательной железы и имеющего риск развития сердечно-сосудистого заболевания или расстройства. Этому подходящему субъекту, имеющему риск развития сердечно-сосудистого заболевания, затем вводят начальную дозу 160-320 мг дегареликса с последующим введением поддерживающей дозы 60-160 мг дегареликса, доставляемой один раз в каждые приблизительно 28 суток, тем самым лечат рак предстательной железы у субъекта, имеющего риск развития сердечнососудистого заболевания или расстройства, с пониженной вероятностью выброса тестостерона или другого побочного эффекта, связанного с GnRH-агонистом. В некоторых воплощениях поддерживающую дозу дегареликса вводят ежемесячно. В конкретных воплощениях данного аспекта субъект, которого лечат, имеет индекс массы тела менее чем 30 кг/м2 (в частности, BMI менее чем 25 кг/м2). В дополнительных воплощениях субъект, которого лечат, имеет риск развития сердечно-сосудистого заболевания или расстройства, такого как шум в сердце, атриовентрикулярная блокада и/или ишемия миокарда. В еще других воплощениях субъект, которого лечат, имеет индикатор повышенного риска развития сердечно-сосудистого заболевания. В дополнительных воплощениях субъект, которого лечат, имеет индикатор повышенного риска развития сердечно-сосудистого заболевания, например, высокое кровяное давление, высокий уровень холестерина в липопротеинах низкой плотности, низкий уровень холестерина в липопротеинах высокой плотности, высокий уровень сывороточной глюкозы и/или привычку курения. В конкретных воплощениях субъект, которого лечат, имеет высокое кровяное давление, которое больше или равно 130 на 85 мм рт.ст. В дополнительных воплощениях субъект, которого лечат, ежедневно курит сигареты. В еще дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень холестерина в липопротеинах низкой плотности, который больше или равен приблизительно 160 мг/дл. В дополнительных воплощениях субъект, которого лечат, имеет низкий уровень холестерина в липопротеинах высокой плотности, составляющий менее чем 35 мг/дл. В других воплощениях субъект, которого лечат, имеет повышенный уровень глюкозы натощак, составляющий более чем приблизительно 120 мг/дл.
В еще других воплощениях субъект, которого лечат, имеет индикатор повышенного риска развития сердечно-сосудистого заболевания, такой как высокий уровень сывороточного С-реактивного белка (CRP), высокий уровень сывороточного гомоцистеина, высокий уровень сывороточного фибриногена и/или высокий уровень сывороточного липопротеина (a) (Lp(a)). В конкретных воплощениях субъект, которого лечат, имеет повышенный уровень С-реактивного белка, составляющий более чем 3 мг/дл. В других воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного гомоцистеина, составляющий более чем 30 мкмоль/л. В дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного фибриногена, составляющий более чем 7,0 г/л. В еще дополнительных воплощениях субъект, которого лечат, имеет повышенный уровень сывороточного Lp(a), составляющий более чем 30 мг/дл. В других воплощениях субъект, которого лечат, имеет пониженную вероятность, по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом, развития сердечно-сосудистого побочного эффекта, такого как сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности. В некоторых воплощениях изобретения субъект, которого лечат, имеет индекс массы тела менее чем 30 кг/м2 (особенно менее чем 25 кг/м2).
В еще одном аспекте данного изобретения предложен способ лечения рака предстательной железы у предпочтительного субъекта путем идентификации субъекта, страдающего раком предстательной железы, имеющего индекс массы тела менее чем приблизительно 25 кг/м2. Этому предпочтительному субъекту, идентифицированному таким образом, вводят однократную начальную дозу 160-320 мг дегареликса и затем с последующими ежемесячными дозами 60-160 мг дегареликса, вводимыми один раз в каждые 20-36 суток. В некоторых воплощениях субъект, которого лечат, имеет пониженную вероятность, по сравнению с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом, развития сердечно-сосудистого побочного эффекта, такого как сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности. В конкретных воплощениях начальная доза дегареликса составляет приблизительно 240 мг, и поддерживающая доза дегареликса составляет приблизительно 80 мг, вводимые ежемесячно. В дополнительных конкретных воплощениях предпочтительный субъект имеет уровень холестерина больший или равный 4 ммоль/л (155 мг/дл).
Краткое описание графических материалов
На Фиг.1 представлено изображение химической структуры дегареликса.
На Фиг.2 представлен график, иллюстрирующий влияние введения доз дегареликса 240 мг/80 мг на уровень тестостерона в плазме от 0 до 364 суток лечения.
На Фиг.3 представлен график, иллюстрирующий сравнение влияния введения доз дегареликса 240 мг/80 мг с введением доз Lupron 7,5 мг на процентное изменение уровня тестостерона в плазме от 0 до 28 суток лечения.
На Фиг.4 представлен график, иллюстрирующий сравнение влияния введения доз дегареликса 240 мг/160 мг и дегареликса 240 мг/80 мг с влиянием введения доз Lupron 7,5 мг на средние уровни лютеинизирующего гормона (LH) в течение периода времени от 0 до 364 суток лечения.
На Фиг.5 представлен график, иллюстрирующий сравнение влияния введения доз дегареликса 240 мг/160 мг и дегареликса 240 мг/80 мг с влиянием введения доз Lupron 7,5 мг на средние уровни фолликулостимулирующего гормона (FSH) в течение периода времени от 0 до 364 суток лечения.
На Фиг.6 представлен график, иллюстрирующий сравнение влияния введения доз дегареликса 240 мг/80 мг с влиянием введения доз Lupron 7,5 мг на уровни простатоспецифичного антигена (PSA) от 0 до 56 суток лечения.
Подробное описание изобретения
Конкретные аспекты изобретения описаны более подробно ниже. Патенты и научная литература, на которую здесь ссылаются, включены в данное описание путем ссылки.
Общие положения
В целом в данном изобретении предложено применение GnRH-антагониста дегареликса для лечения рака предстательной железы (и способы лечения) с использованием схем введения доз, которые приводят в результате к оптимальной эффективности и сниженным серьезным побочным эффектам, таким как сердечно-сосудистое заболевание, артралгия (например, побочные эффекты, отличные от побочных эффектов, связанных с местом введения), в частности в некоторых подгруппах пациентов, по сравнению с другими андрогенными депривационными терапиями, в частности терапиями GnRH-агонистом, таким как лейпролид.
Относительная эффективность- и безопасность (включая неблагоприятные побочные эффекты) терапии GnRH-агонистом лейпролидом (также лейпрорелином или LUPRON DEPOT) известна в данной области техники (см., например, Persad (2002) Int. J.Clin. Pract. 56:389-96; Wilson et al. (2007) Expert Opin. Invest. Drugs 16:1851-63; и Berges et al. (2006) Curr. Med. Res. Opin. 22:649-55). В дополнение, сообщалось также об относительной эффективности и безопасности терапии GnRH-антагонистом абареликсом (PLENAXIS) (см., например, Mongiat-Artus et al. (2004) Expert Opin. Pharmacother. 5:2171-9; и Debruyne et al. (2006) Future Oncol. 2:677-96). Обзор по основным способам проведения и анализа описанного здесь вида контролируемых клинических исследований, включая анализы безопасности, эффективности и избирательных преимуществ для некоторых субпопуляций пациентов, доступен (см. Spilker (1991) Guide to Clinical Trials Raven Press, New York; и Spilker (1996) Quality of Life and Pharmacoeconomics in Clinical Trials Lippincott - Raven Publishers New York).
Определения
Формы единственного числа включают ссылку на множественное число, если из контекста ясно не следует иное.
Термин "ADR" ("adverse drug reaction"), как он использован здесь, относится к неблагоприятной реакции на лекарственное средство, и термин "АЕ" ("adverse event") относится к "неблагоприятному явлению".
Термины "примерно" и "приблизительно" означают почти такое же число или значение, на которое ссылаются. Термины "примерно" и "приблизительно", как они использованы здесь, следует понимать как охватывающие ±10% конкретного количества, частоты или значения.
Термин "агонист", как он использован здесь, относится к агенту, который имитирует или активирует (например потенцирует или добавляет) биологическую активность белка. Агонист может представлять собой белок дикого типа или его производное, имеющее по меньшей мере одну биологическую активность белка дикого типа.
"Антагонист", как он использован здесь, относится к агенту, который дезактививрует (например подавляет или ингибирует) по меньшей мере одну биологическую активность белка.
Термин "артралгия", как он использован здесь, относится к боли в одном или более чем одном суставе, которая может возникать как симптом повреждения, инфекции, заболевания, в частности артрита, или аллергической реакции на лекарственное лечение. В отличительном значении термина "артралгия" от термина "артрит" следует отметить, что "артралгия" специфически относится к невоспалительным состояниям, а термин "артрит" следует использовать, когда данное состояние является воспалительным состоянием.
Термин "индекс массы тела" (BMI, body mass index) относится к статистической мере измерения массы субъекта, пересчитанной в отношении к росту, которая является приблизительной мерой относительных процентных соотношений жировой и мышечной массы в организме человека. BMI определяют как массу тела индивидуума, деленную на квадрат его роста, и эти формулы, использованные в медицине, дают единицу измерения, выраженную в кг/м2.
Термин "Cl" ("confidence interval") относится к статистическому доверительному интервалу.
Термин "сердечно-сосудистый", как он использован здесь, относится к состояниям, в которые вовлечены сосуды сердца и/или кровеносные сосуды.
Термин "сердечная аритмия", как он использован здесь, представляет собой любую группу состояний, в которых электрическая активность сердца разрегулирована, либо она быстрее или медленнее чем нормальная.
Термины "заболевание коронарных артерий" или "болезнь коронарных артерий", как они использованы здесь, относятся к состоянию (такому как склероз или тромбоз), которое замедляет кровоток через коронарные артерии к сердечной мышце.
Термин "расстройство сердечной деятельности", как он использован здесь, относится к любому из ряда аномальных органических состояний, влияющих на сердце, включая коронарную болезнь сердца, сердечный приступ, сердечно-сосудистое заболевание, легочно-сердечная недостаточность и высокое кровяное давление.
Термин "тромбоз глубоких вен" (также известный как глубокий венозный тромбоз или DVT) означает образование кровяного сгустка ("тромба") в глубокой вене. Тромбоз глубоких вен наиболее часто поражает вены нижних конечностей, такие как бедренная вена или подколенная вена, либо глубокие вены тазовой области. Иногда поражаются вены руки (известно как болезнь Педжета-Шреттера). Тромбофлебит представляет собой более общий класс патологий этого типа. Имеется значительный риск возникновения тромба, эмболизирующего и двигающегося к легким, вызывая тромбоэмболию легочной артерии.
Термин "ЭКГ" относится к электрокардиограмме.
Термин "MedDRA" ("Medical dictionary for regulatory activities") относится к Медицинскому словарю регулирующей деятельности.
Термин "инфаркт миокарда" относится к инфаркту миокарда, который возникает в результате окклюзии коронарной артерии, что может выражаться внезапной болью в груди, затруднением дыхания, тошнотой и потерей сознания и иногда летальным исходом. "Инфаркт" относится к процессу формирования инфаркта, который представляет собой область некроза в ткани или органе, приводя в результате к обструкции локального кровообращения тромбом или эмболом.
"Мужская сексуальная дисфункция" включает импотенцию, потерю либидо и эректильную дисфункцию. "Эректильная дисфункция" представляет собой расстройство, включающее неспособность самца мужского пола достигнуть эрекции, эякуляции или и того, и другого.
Термин "рак предстательной железы" относится к любому раку предстательной железы, при котором клетки предстательной железы мутируют и начинают бесконтрольно размножаться. Термин "рак предстательной железы" включает раннюю стадию - локализованный рак предстательной железы; позднюю стадию - локально распространенный рак предстательной железы; и терминальную стадию - метастатический рак предстательной железы (при котором раковые клетки распространяются (метастазируют) из предстательной железы на другие части тела, особенно кости и лимфатические узлы).
Термин "простатоспецифичный антиген" или "PSA" ("prostate-specific antigen") относится к белку, продуцируемому клетками предстательной железы, который присутствует в малых количествах в сыворотке нормальных мужчин, но часто повышен при наличии рака предстательной железы и других расстройств предстательной железы. Анализ крови на определение PSA является наиболее эффективным тестом, доступным в настоящее время для раннего обнаружения рака предстательной железы. Более высокие по сравнению с нормальными уровни PSA ассоциированы как с локализованным, так и с метастатическим раком предстательной железы (СаР).
Термин "PD" ("pharmacodynamic") относится к фармакодинамическим параметрам, и термин "РК" ("pharmacokinetic") относится к фармакокинетическим параметрам.
Термин "РТ" ("preferred term") относится к предпочтительному термину.
Термин "SAE" ("serious adverse event") относится к тяжелому неблагоприятному явлению.
Термин "SD" ("standard deviation") относится к стандартному отклонению.
Термин "SOC" ("system organ class") относится к системно-органным классам.
Термин "SUSAR" ("suspected, unexpected serious adverse reaction") относится к сомнительной неожиданной тяжелой неблагоприятной реакции.
"Субъект" или "пациент" представляет собой млекопитающего мужского пола, более предпочтительно человека мужского пола. Млекопитающие мужского пола, отличные от человека, включают сельскохозяйственных животных, спортивных животных и питомцев.
"Инфекция мочевыводящих путей" (urinary tract infection, UTI) представляет собой бактериальную инфекцию, которая поражает любую часть мочевыводящих путей, представляющих собой пути, по которым отводится моча, и включающие почечные канальцы и почечную лоханку почек, мочеточник, мочевой пузырь и мочеиспускательный канал. Наиболее распространенным типом UTI является инфекция мочевого пузыря, которую часто также называют циститом. Другим типом UTI является почечная инфекция, известная как пиелонефрит, которая представляет собой более тяжелое состояние.
Дегареликс и родственные фармацевтические препараты
Дегареликс является сильнодействующим GnRH-антагонистом, который представляет собой аналог декапептида GnRH (pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2), включающий в положениях 5 и 6 лара-уреидо-фенилаланины (Jiang et al. (2001) J.Med. Chem. 44:453-67). Он показан для лечения пациентов, страдающих раком предстательной железы, у которых подтверждена андрогенная депривация (включая пациентов с повышенными уровнями PSA после уже проведенной простатэктомии или лучевой терапии).
Дегареликс представляет собой селективный антагонист (блокатор) GnRH-рецептора, который конкурентно и обратимо связывается с гипофизарными GnRH-рецепторами, тем самым быстро снижая высвобождение гонадотропинов и затем тестостерона (Т). Рак предстательной железы чувствителен к тестостероновой депривации, что является основополагающим принципом в лечении гормон-зависимого рака предстательной железы. В отличие от GnRH-агонистов, блокаторы GnRH-рецептора не индуцируют выброс лютеинизирующего гормона (LH) с последующими выбросом тестостерона/стимуляцией опухоли и потенциальным симптоматическим обострением после начала лечения.
Активный ингредиент дегареликс представляет собой синтетический линейный амид декапептида, содержащий семь неприродных аминокислот, пять из которых являются D-аминокислотами. Данное лекарственное вещество представлено в виде ацетатной соли, однако активной группировкой этого вещества является дегареликс в виде свободного основания. Ацетатная соль дегареликса представляет собой белый или беловатый аморфный порошок низкой плотности, как получено после лиофилизации. Химическое название представляет собой D-аланинамид N-ацетил-3-(2-нафталинил)-D-аланил-4-хлор-D-фенилаланил-3-(3-пиридинил)-D-аланил-L-серил-4-[[[(4S)-гексагидро-2,6-диоксо-4-пиримидинил]карбонил]амино]-L-фенилаланил-4-[(аминокарбонил)амино]-D-фенилаланил-L-лейцил-N6-(1-метилэтил)-L-лизил-L-пролил. Он имеет эмпирическую формулу C82H103N18O16Cl и молекулярную массу 1632,3 Да.
Химическая структура дегареликса была показана ранее (ЕР 1003774, US 5925730, US 6214798) и представлена на Фиг.1. Его можно также легко представить формулой:
Ac-D-Nal-D-Cpa-D-Pal-Ser-Aph(Hor)-D-Aph(Cbm)-Leu-Lys(iPr)-Pro-D-Ala-NH2
Введение и дозирование
Дегареликс может быть изготовлен в виде препарата для введения подкожно, в противоположность внутривенному введению, как правило, в абдоминальную область, как описано более подробно ниже. Как и в случае с другими лекарственными средствами, вводимыми путем подкожной инъекции, место инъекции можно периодически варьировать, чтобы адаптироваться к дискомфорту в месте инъекции при данном лечении. В целом инъекции следует делать в области, где пациент не будет подвергаться сдавливанию, например, не рядом с поясом или ремнем и не рядом с ребрами.
Введение дегареликса путем подкожной или внутримышечной инъекции на практике оправдано, однако ежедневные инъекции как правило не приемлемы, поэтому депо-препарат дегареликса может быть использован, как описано более подробно в WO 03/006049 и публикациях заявок США Nos. 20050245455 и 20040038903. Кратко, подкожное введение дегареликса может быть осуществлено с использованием технологии депо-препаратов, в которой пептид высвобождается из биоразлагаемой полимерной матрицы в течение периода времени (типично) 1-3 месяцев. Дегареликс и родственные GnRH-антагонистические пептиды, как описано в WO 03/006049 и публикациях заявок США Nos. 2005/0245455 и 2004/0038903, имеют высокую аффинность в отношении GnRH-рецептора и намного более высокую растворимость в воде, чем другие GnRH-аналоги. Дегареликс и эти родственные GnRH-антагонисты способны к образованию геля после подкожной инъекции, и этот гель может действовать как депо-препарат, из которого пептид высвобождается в течение периода времени, составляющего недели или даже месяцы.
Определяющей переменной в отношении образования эффективного депо-препарата дегареликса является концентрация раствора в комбинации с количеством вещества, вводимым как таковым. Концентрация должна находиться в пределах функционального диапазона. Если препарат является слишком разбавленным, то никакой депо-препарат не образуется, и длительная продолжительность действия теряется, независимо от количества данного лекарственного вещества. Если препарат является слишком концентрированным, то образование геля будет иметь место до того, как лекарственное средство могло быть введено. Эффективные депо-образующие препараты дегареликса обычно имеют концентрацию не менее чем 5 мг/мл дегареликса, например от 5 до 40 мг/мл дегареликса.
Таким образом, дегареликс может быть предложен в виде порошка для разведения (растворителем) в виде раствора для инъекции (например подкожной инъекции, например с образованием депо-препарата, как описано выше). Порошок может быть предложен в виде лиофилизата, содержащего дегареликс (например, в виде ацетата) и маннит. Подходящим растворителем является вода (например вода для инъекций, или WFI). Например, дегареликс может быть предложен во флаконе, содержащем 120 м г дегареликса (ацетата) для разведения в 3 мл WFI, так чтобы каждый мл раствора содержал приблизительно 40 мг дегареликса. В другом примере дегареликс может быть предложен во флаконе, содержащем 80 мг дегареликса (ацетата). После разведения в приблизительно 4 мл WFI, например 4,2 мл WFI, каждый мл раствора содержит приблизительно 20 мг дегареликса.
Композиция может быть предназначена для введения дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток. Например, композиция может быть предназначена для введения в начальной дозе приблизительно 240 мг и затем в поддерживающей дозе приблизительно 80 мг один раз в каждые приблизительно 28 суток.
Предпочтительная схема введения доз для лечения взрослых особей мужского пола, страдающих раком предстательной железы, представляет собой однократную стартовую дозу 240 мг дегареликса, вводимую в виде двух подкожных инъекций по 120 мг с последующими ежемесячными поддерживающими дозами по 80 мг дегареликса, вводимых в виде однократной подкожной инъекции, начиная приблизительно с одного месяца после введения начальной стартовой дозы.
Например, схема введения доз дегареликса может представлять собой введение в виде начальной стартовой дозы 240 мг, вводимой в виде двух инъекций по 3 мл препарата с содержанием дегареликса приблизительно 40 мг/мл, с последующим введением ежемесячных поддерживающих доз по 80 мг, вводимых в виде однократной инъекции 4 мл препарата с содержанием дегареликса приблизительно 20 мг/мл. В другом примере ежемесячные поддерживающие дозы 160 мг могут быть использованы, например, путем введения 4 мл препарата с содержанием дегареликса приблизительно 40 мг/мл каждый месяц.
Разведенный раствор должен представлять собой прозрачную жидкость, свободную от нерастворенных веществ. Однократная доза 240 мг дегареликса с последующей ежемесячной поддерживающей дозой 80 мг быстро вызывает снижение концентраций лютеинизирующего гормона (LH), фолликулостимулирующего гормона (FSH) и затем тестостерона. Концентрация дигидротестостерона (DHT) в плазме снижается аналогичным для тестостерона образом.
Дегареликс эффективен в достижении и поддержании подавления тестостерона значительно ниже уровня медикаментозной кастрации, составляющего 0,5 нг/мл. Как более подробно описано ниже, поддержание ежемесячного введения доз по 80 мг приводило в результате к непрерывному подавлению тестостерона у 97% пациентов в течение по меньшей мере одного года. В частности, средние уровни тестостерона после одного года лечения составляли 0,087 нг/мл.
Важные фармакокинетические параметры для дегареликса, оцененные у пациентов, страдающих раком предстательной железы, приведены в Таблице 1 ниже. Средние остаточные концентрации препарата дегареликса в поддерживающей фазе при использовании 80 мг в концентрации 20 мг/мл составляли 10,9 нг/мл.
Фармакокинетические параметры дегареликса после подкожного введения 240 мг в концентрации 40 мг/мл
После подкожного введения 240 мг дегареликса (6 мл в концентрации 40 мг/мл) пациентам, страдающим раком предстательной железы, дегареликс выводится двухфазным образом со средним значением конечного полувыведения приблизительно 43 суток. Длительный период полувыведения после подкожного введения является следствием очень медленного высвобождения дегареликса из депо, образованного в месте(ах) инъекции. На фармакокинетическое поведение данного лекарственного средства сильно влияет его концентрация в суспензии для инъекции.
Полученное в результате распределение по объему у здоровых пожилых мужчин составляет приблизительно 1 л/кг. Оцененное связывание с белками плазмы составляет приблизительно 90%.
Дегареликс подвергается обычному пептидному разложению во время прохождения гепатобилиарной системы и большей частью выводится в виде пептидных фрагментов с фекалиями. Никаких существенных метаболитов не было обнаружено в образцах плазмы после подкожного введения. В исследованиях in vitro было показано, что дегареликс не является субстратом для человеческой CYP450 (цитохромы Р-450) системы. Таким образом, клинически значимые фармакокинетические взаимодействия с другими лекарственными веществами маловероятны.
У здоровых мужчин приблизительно 20% даваемой дозы дегареликса выводилось почками, подтверждая, что приблизительно 80% выводится посредством гепатобилиарной системы у людей. Клиренс у здоровых пожилых мужчин составляет 35-50 мл/час/кг.
Неблагоприятные явления (побочные эффекты)
Было обнаружено, что дегареликс в целом хорошо переносится в клинических исследованиях. Наиболее распространенные наблюдаемые неблагоприятные реакции во время терапии FIRMAGON происходили как результат ожидаемых физиологических эффектов подавления тестостерона, главным образом приливы и повышение массы тела, а также связанные с местом инъекции неблагоприятные явления (побочные эффекты, связанные с местом инъекции), главным образом боль в месте инъекции и эритема в месте инъекции.
В подтверждающем активно-контролируемом клиническом исследовании, включающем дегареликс подкожно (п.к.) с лейпролидом внутримышечно (в.м.) в течение 12 месяцев лечения пациентов, страдающих раком предстательной железы, наиболее часто регистрируемые побочные эффекты представляли собой неблагоприятные явления, возникающие в месте инъекции (побочные эффекты, связанные с местом инъекции), включая боль (28%), эритему (17%), набухание (6%), уплотнение (4%) и узелковое уплотнение (3%). Эти неблагоприятные явления были большей частью временными, от слабой до умеренной интенсивности, возникали в основном при введении стартовой дозы и приводили к очень малому числу случаев прекращения лечения (<1%). Большинство неблагоприятных явлений, связанных с местом инъекции, не требовало никакого лечения. Из зарегистрированных случаев 20% были улучшены пациентами с помощью лекарств для безрецептурного отпуска (ОТС, over the counter), таких как анальгетики, или холодных компрессов. В дополнение, имел место ряд других частых неблагоприятных явлений, включая увеличение массы тела, усталость, озноб, приливы, гипертензию, боль в спине, артралгию и инфекцию мочевыводящих путей, как резюмировано в Таблице 2 ниже.
Сравнение наиболее частых неблагоприятных явлений при лечении дегареликсом по сравнению с лечением лейпролидом
Не было выявлено свидетельств каких-либо клинически значимых изменений в функции печени. Наблюдались небольшие повышения активности ферментов печени, и эти изменения были в целом слабыми и преходящими.
Суммировали данные по безопасности из всех клинических исследований с дегареликсом в лечении рака предстательной железы, включая пациентов, получающих другие схемы введения доз. Следующие неблагоприятные реакции, еще не перечисленные, были зарегистрированы исследователем как реакции, связанные с лекарственным средством, для ≥1% пациентов: эректильная дисфункция, гинекомастия, гипергидроз, атрофия яичек и диарея.
В медицинской литературе сообщалось о пониженной костной плотности у мужчин, которые были подвергнуты орхиэктомии или которых лечили GnRH-агонистом. Можно ожидать, что длительные периоды медикаментозной кастрации у мужчин будут воздействовать на костную плотность.
Преимущества схемы введения терапевтических доз дегареликса для лечения рака предстательной железы включают пониженную вероятность возникновения и/или пониженную тяжесть. симптомов неблагоприятных реакций, неблагоприятных явлений или побочных эффектов в отношении других органов или тканей. Был описан расширенный перечень потенциальных неблагоприятных явлений, связанных с лекарственными терапиями.
Терминология неблагоприятных реакций позволяет исследователям идентифицировать одинаковые неблагоприятные реакции одним и тем же термином и идентифицировать отличающиеся неблагоприятные реакции разными терминами. Может быть использована стандартная терминология, однако были разработаны специализированные фармацевтические справочники для определения терминов неблагоприятных реакций и их синонимов (см. Gillum (1989) "The Merck regulatory dictionary: A pragmatically developed drug effects vocabulary" Drug Info. J. 23:217-220). Терминология неблагоприятных реакций Всемирной Организации Здравоохранения (ВОЗ) также доступна для разграничения значений индуцированных лекарствами побочных эффектов (см., например, Saltzman (1985) "Adverse reaction terminology standardization" Drug Info. J. 19:35-41). Система символов кодирования для неблагоприятных реакций (The Coding Symbols for a Thesaurus of Adverse Reaction Terms (COSTART)) также известна в данной области техники (см., например, NcNeil et al. (1982) N.Engl. J.Med. 306:1259-62; и Teal and Dimmig (1985) "Adverse drug experience management" Drug Info. J. 19:17-25). Эти перечни часто разделяют по системам организма, а некоторые термины аннотированы альтернативными классификациями.
COSTART дает основу для лексического контроля сведений о неблагоприятных реакциях, поступающих из разных источников. COSTART изначально организована согласно анатомии. Она имеет иерархическую классификацию терминов, начиная с наиболее широкого (категории систем организма) до наиболее узкого (конкретные предпочтительные термины или даже специальные поисковые категории). Систему COSTART используют и поддерживают в Центре лекарственных средств и биопрепаратов при Управлении по контролю над пищевыми продуктами и медикаментами (Center for Drugs and Biologies at the Food and Drug Administration (FDA)) для надзора за продаваемыми лекарствами, и многие старшие менеджеры вписывают ее в различные разделы рецензирования. Существует четыре индекса COSTART: индекс А, содержащий три перечня, включающие категории поиска по системам организма и специальные поисковые категории (например, неоплазия).
Система терминологии неблагоприятных реакций согласно ВОЗ относительно краткая. Каждому из этих терминов присвоен кодовый номер. Это дает преимущество в том, что один и тот же код сохраняется, когда термин переводят на разные языки. В системе ВОЗ использована иерархия "предпочтительных терминов" для описания неблагоприятных реакций. Другие часто используемые термины названы "включенными терминами", которые перечислены с их предпочтительными терминами.
FDA и многие фармацевтические компании прошли через эволюцию систем оценки в отношении получения, сбора, обработки и определения неблагоприятных реакций. Медицинский справочник, который использован в FDA ("The Center for Drugs and Biologies Ingredient Dictionary"), известен в данной области техники, и его использование при категоризации неблагоприятных явлений урегулировано (см., например, Forbes et al. (1986) Drug Info. J. 20:135-45; and Turner et al. (1986) Drug Info. J. 20:147-50).
Обзор по некоторым преимуществам и недостаткам терминологии неблагоприятных реакций COSTART, SNOMED и ВОЗ приведен в Stephens ("The Detection of New Adverse Drug Reactions" pp.18-124, Stockton Press, New York).
Медицинский словарь регулирующей деятельности (MedDRA) представляет собой особенно полезный источник для определений неблагоприятных явлений, относящихся к исследованиям лекарственных средств. MedDRA использует практическую, принятую в медицине терминологию с акцентом на простоту использования для ввода данных, поиска, анализа и отображения, а также подходящий баланс между чувствительностью и специфичностью в пределах регуляторного окружения. Она была разработана Международной конференцией по гармонизации технических требований в фармацевтике (the International Conference on Harmonisation (ICH)) и принадлежит Международной Федерации Производителей Фармацевтики и Фармацевтических Ассоциаций (the International Federation of Pharmaceutical Manufacturers and Associations (IFPMA)), действующей в качестве доверенного лица Руководящего комитета ICH (the ICH steering committee), и легко доступна в продаже (см., например, интернет-сайт MedDRA www.meddramsso.com). Организация поддержки ведения услуг (Maintenance and Support Services Organization (MSSO)) MedDRA имеет контракт с Международной Федерацией Производителей Фармацевтики и Фармацевтических Ассоциаций (IFPMA) на сохранение и поддержу внедрения терминологии. Терминология MedDRA применима ко всем фазам разработки лекарственных средств, за исключением токсикологии на животных, и использована в примерах, следующих ниже.
Как описано более подробно ниже, ряд других неблагоприятных реакций, включая сердечно-сосудистые аномалии (например, сердечные аритмии, заболевания коронарных артерий и расстройства сердечной деятельности), артралгию и инфекцию мочевыводящих путей, неожиданно возникают с более низкой частотой по сравнению с андроген-угнетающими терапиями предшествующего уровня техники, такими как GnRH-антагонист лейпролид.
Сердечно-сосудистое заболевание
Изобретение включает способы лечения индивидуумов, страдающих раком предстательной железы, у которых имеется риск развития сердечнососудистого заболевания, а также способы лечения обычных в иных отношениях пациентов, страдающих раком предстательной железы, с пониженной вероятностью развития сердечно-сосудистого побочного эффекта. Этот аспект изобретения особенно важен, в свете последних открытий, свидетельствующих о возможности повышенного риска летального исхода от причин, не связанных с раком предстательной железы, в частности, относящихся к неблагоприятным эффектам в отношении здоровья сердечно-сосудистой системы у пациентов, которых подвергали лечению андрогенными депривационными терапиями предшествующего уровня техники (см. Yannucci et al. (2006) J.Urol. 176:520-5).
Признаки наличия риска развития сердечно-сосудистого заболевания были всесторонне исследованы и известны в данной области техники (см., например, Wilson et al. (1998) Circulation 97:1837-47; Hackam (2003) JAMA 290:932-940). Эти факторы сердечно-сосудистого риска включают: высокое кровяное давление (в частности, ≥130 на 85 мм рт.ст.); высокие уровни холестерина в липопротеинах низкой плотности (в частности, ≥160 мг/дл); низкие уровни холестерина в липопротеинах высокой плотности (в частности, менее чем 35 мг/дл); высокие уровни сывороточной глюкозы (в частности, уровни глюкозы натощак более чем приблизительно 120 мг/дл); высокие уровни сывороточного С-реактивного белка (CRP) (в частности, уровни более чем 3 мг/дл); высокие уровни сывороточного гомоцистеина (в частности, уровни более чем 30 мкмоль/л); высокие уровни сывороточного фибриногена (в частности, уровни более чем 7,0 г/л); и высокие уровни сывороточного липопротеина (а) (Lp(a)) (в частности, уровни более чем 30 мг/дл). В дополнение, было показано, что привычка курения ассоциирована с повышенным риском развития сердечно-сосудистого заболевания.
Кроме того, сообщалось о связи общей массы тела, индекса массы тела (BMI) и наличия индикаторов "метаболического синдрома" с риском развития сердечно-сосудистого заболевания (см., например, Behn and Ur (2006) Curr. Opin. Cardiol. 21:353-60; и Romero-Corral etal. (2006) The Lancet 368:666-78).
Данное изобретение проиллюстрировано далее следующими примерами, которые не следует интерпретировать как ограничивающие.
Примеры
Клиническое исследование дегареликса для лечения рака предстательной железы
В этом примере было проведено открытое многоцентровое рандомизированное исследование в параллельных группах для изучения эффективности и безопасности схем введения доз дегареликса раз в месяц. Пациенты в двух группах лечения дегареликсом получали стартовую дозу дегареликса 240 мг в концентрации приблизительно 40 мг/мл с последующей одной из двух разных схем введения доз раз-в-месяц: 160 мг (приблизительно 40 мг/мл) и 80 мг (приблизительно 20 мг/мл). Эти схемы введения доз дегареликса сравнивали с введением LUPRON DEPOT™ 7,5 мг пациентам, страдающим раком предстательной железы, нуждающихся в андрогенной абляционной терапии.
В исследовании также изучали, безопасен и эффективен ли дегареликс в отношении достижения и поддержания подавления тестостерона до уровней кастрации, что оценивали как долю пациентов с подавлением тестостерона до уровня ≤0,5 нг/мл в течение 12 месяцев лечения, и сравнивали уровни сывороточного тестостерона и простатоспецифичного антигена (PSA) при использовании схемы введения доз дегареликса против лейпролида 7,5 мг в течение первых 28 суток лечения. В исследовании дополнительно сравнивали безопасность и переносимость использования схем введения доз дегареликса по сравнению с лечением лейпролидом 7,5 мг и, кроме того, сравнивали ответы в виде тестостерона, лютеинизирующего гормона (LH), фолликулостимулирующего гормона (FSH) и PSA при использовании схемы введения доз дегареликса в сравнении с лейпролидом 7,5 мг. В исследовании дополнительно сравнивали результаты, записанные пациентами (факторы качества жизни и приливы), при использовании схемы введения доз дегареликса в сравнении с лейпролидом 7,5 мг во время лечения. Наконец, в исследовании оценивали фармакокинетические параметры исследуемых схем введения доз дегареликса.
План исследования
Всего 620 пациентов рандомизировали 1:1:1 в одну из трех групп лечения. Из них 610 пациентам вводили исследуемый медицинский продукт (Investigational Medicinal Product (IMP)). 10 рандомизированных пациентов отказались от исследования до начала введения доз.
Пациенты в двух группах лечения получали стартовую дозу дегареликса 240 мг в концентрации 40 мг/мл (240@40) на 0 сутки, вводимую в виде двух эквивалентных подкожных (п.к.) инъекций по 120 мг каждая. Затем пациенты получали 12 дополнительных однократных п.к. доз дегареликса, либо 80 мг в концентрации 20 мг/мл (группа 80@20: дегареликс 240/80 мг), либо 160 мг в концентрации 40 мг/мл (группа 160@40: дегареликс 240/160 мг), вводимых п.к. каждые 28 суток. В третьей группе лечения пациенты получали активное лечение лейпролидом 7,5 мг на 0 сутки и каждые 28 суток, вводимые в виде однократной внутримышечной (в.м.) инъекции. Для пациентов, получающих лечение лейпролидом 7,5 мг, бикалутамид можно давать как защиту от клинического внезапного обострения на усмотрение исследователя.
Пациентов стратифицировали согласно географическому региону (Центральная и Восточная Европа, Западная Европа и Америка) и массе тела (<90 кг и ≥90 кг).
Группа лечения дегареликсом 240/160 мг
Эта группа получала начальную дозу 240 мг в концентрации 40 мг/мл (240@40) на 0 сутки. Эту стартовую дозу вводили в виде двух эквивалентных подкожных (п.к.) инъекций по 120 мг каждая. Затем группа получала 12 поддерживающих доз по 160 мг в концентрации 40 мг/мл (160@40) в виде однократных п.к. доз дегареликса каждые 28 суток.
Группа лечения дегареликсом 240/80 мг
Эта группа получала начальную дозу 240 мг в концентрации 40 мг/мл (240@40) на 0 сутки. Эту стартовую дозу вводили в виде двух эквивалентных подкожных (п.к.) инъекций по 120 мг каждая. Затем группа получала 12 поддерживающих доз по 80 мг в концентрации 20 мг/мл (80@20) в виде однократных п.к. доз дегареликса каждые 28 суток.
Группа лечения лейпролидом 7.5 мг
Эта группа получала сравнительную терапию лейпролидом 7,5 мг. Этот препарат для лечения вводили в виде однократной внутримышечной (в.м.) инъекции, один раз в каждые 28 суток, начиная с 0 суток.
Методология лечения
Пациентов наблюдали на постоянной основе, и они посещали клинику с интервалами в один месяц вплоть до одного года. Пациентов наблюдали клинически в течение по меньшей мере 1 часа после каждого введения исследуемого лекарственного средства. Пациентам, которые закончили данное исследование и удовлетворяли соответствующим критериям, предложили возможность получать долговременное лечение и поддержку в расширенном исследовании.
Всего 807 пациентов было отобрано, и 620 пациентов рандомизировано 1:1:1 в три группы лечения: дегареликс 240/160 мг, дегареликс 240/80 мг и лейпролид 7,5 мг. Из 620 рандомизированных пациентов 610 пациентов действительно получили исследуемое лекарственное средство, включая 202, 207 и 201 пациентов в группах лечения дегареликсом 240/160 мг, дегареликсом 240/80 мг и лейпролидом 7,5 мг, соответственно. Всего 504 пациента закончили данное исследование.
Диагноз и критерии включения в исследование
Мужчины возрастом 18 лет и старше с гистологически подтвержденной по шкале Глисона (Gleason graded) аденокарциномой предстательной железы (все стадии), которым было показано андрогенное абляционное лечение (за исключением неоадъювантной гормональной терапии), были подходящими для участия в исследовании. Подписанное информированное согласие получали перед осуществлением любого действия, связанного с исследованием. Пациенты должны были иметь исходный уровень тестостерона >1,5 нг/мл и уровень PSA ≥2 нг/мл на момент отбора. Пациентов с повышенным PSA после осуществления простатэктомии или лучевой терапии в лечебных целях могли включить в данное исследование. Необходимо было, чтобы пациенты имели балл по шкале ECOG ≤2. и среднюю продолжительность жизни по меньшей мере 12 месяцев. Предшествующее или настоящее гормональное лечение рака предстательной железы (хирургическая кастрация или другая гормональная манипуляция, например GnRH-агонисты, GnRH-антагонисты, антиандрогены или эстрогены) приводили в результате к исключению из данного исследования. Однако, пациенты, которые подвергались простатэктомии или лучевой терапии в лечебных целях, принимали неоадъювантное гормональное лечение в течение максимальной продолжительности 6 месяцев, при условии, что это лечение было закончено за по меньшей мере 6 месяцев до отборочного визита. Сопутствующее лечение ингибитором 5-α-редуктазы также приводило в результате к исключению из исследования. Пациенты, которые являлись кандидатами для лечебной терапии (т.е. радикальной простатэктомии или лучевой терапии), были исключены. Пациенты с историей в анамнезе тяжелых реакций гиперчувствительности или клинически значимых расстройств (отличных от рака предстательной железы), которые могли бы повлиять на заключение данного исследования, как оценено исследователем, не были подходящими для включения в данное исследование. Пациенты с выраженным исходным удлинением QT/QTcF интервала (>450 мсек), которые использовали сопутствующие препараты, которые могут удлинять QT/QTcF интервал или которые имели историю в анамнезе дополнительных факторов риска развития желудочковых аритмий по типу трепетание-мерцание, были исключены. Пациенты, которые имели уровни сывороточной аланинтрансферазы (АЛТ) или общего билирубина выше верхнего уровня нормального интервала на момент отборочного визита или которые имели установленную или подозреваемую симптоматическую болезнь печени и желчных путей были также исключены. Пациентов также исключали, если они имели установленную гиперчувствительность к любому компоненту исследуемых продуктов. В дополнение, пациенты с любой формой рака за последние пять лет, за исключением рака предстательной железы и удаленного хирургическим путем базально-клеточного или плоскоклеточного рака кожи, были исключены из исследования. Пациенты, которые имели недееспособность по причине психического заболевания или языковые барьеры, препятствующие адекватному пониманию или содействию, также являлись неподходящими для участия в данном исследовании. Никаких других исследуемых лекарственных средств не должны были вводить в пределах 28 суток перед отборочным визитом.
Продолжительность лечения
Пациенты в группах лечения дегареликсом получали стартовую дозу 240@40 на 0 сутки и 12 поддерживающих доз по 160@40 (группа лечения дегареликсом 240/160 мг) или по 80(5)20 (группа лечения дегареликсом 240/80 мг) каждые 28 суток. Введение исследуемых медицинских продуктов имело место на 0 сутки, 28 сутки (±2 суток) и затем каждые 28 суток (±7 суток) до конца исследования; 364 сутки (±7 суток). Пациентам, которые закончили данное исследование и удовлетворяли соответствующим критериям, предложили возможность получать долговременное лечение и поддержку в расширенном исследовании.
Пациенты в группе сравнительной терапии получали лечение лейпролидом 7,5 мг на 0 сутки и затем каждые 28 суток в виде 12 поддерживающих доз. Пациенты, которые закончили данное исследование, получили в итоге тринадцать доз. Пациентам, которые закончили данное исследование и удовлетворяли соответствующим критериям, предложили переключиться на лечение дегареликсом в продолжающемся исследовании. Этих пациентов рандомизировали в группы лечения дегареликсом 240/80 мг или 240/160 мг. На 0 сутки данного исследования пациенты, которых ранее лечили лейпролидом 7,5 мг в исследовании CS21, получили стартовую дозу дегареликса 240 мг (40 мг/мл) с последующими ежемесячными поддерживающими дозами либо 80 мг (20 мг/мл), либо 160 мг (40 мг/мл).
Пациентов в этой сравнительной группе лечили лейпролидом 7,5 мг путем внутримышечной (в.м.) инъекции из предварительно заполненного двухкамерного шприца. Пациенты получали лейпролид 7,5 мг на 0 сутки и затем каждые 28 суток, вводимый в виде однократной в.м. инъекции. По усмотрению исследователя бикалутамид могли давать для защиты от клинического внезапного обострения заболевания.
Критерии для оценки эффективности
Критерием первичной эффективности являлась вероятность поддержания уровней тестостерона при ≤0,5 нг/мл, начиная с 28 суток до 364 суток.
Критерии вторичной эффективности были следующими: доля пациентов с выбросом тестостерона во время первых 2 недель лечения; доля пациентов с уровнем тестостерона ≤0,5 нг/мл на 3 сутки; процентное изменение PSA от исходного уровня до 28 суток; возможность поддержания уровня тестостерона при ≤0,5 нг/мл, начиная с 56 суток до 364 суток; уровни сывороточных тестостерона, LH, FSH и PSA на протяжении всего периода времени исследования; время до проявления недостаточного PSA-ответа, определяемого как два последовательных повышения на 50% и по меньшей мере 5 нг/мл в сравнении с самым низким уровнем; концентрация дегареликса в течение первого месяца и минимальные уровни в крови на 308 и 336 сутки; частота и масштабы повышений уровней тестостерона на 255 и/или 259 сутки в сравнении с уровнем тестостерона на 252 сутки; качество жизни на 0, 28, 84, 168 сутки и при последнем визите в конце исследования; частота и интенсивность испытываемых приливов (отмечаемых ежедневно от начала исследования вплоть до последнего визита в конце исследования). Кроме того, было добавлено два дополнительных критерия вторичной эффективности: вероятность поддержания достаточного тестостеронового ответа, начиная с 28 суток до 364 суток (пациента считали имеющим недостаточный тестостероновый ответ, если он имел одно значение для тестостерона >1,0 нг/мл или два последовательных значения для тестостерона >0,5 нг/мл, начиная с 28 суток и далее); и процентное изменение PSA от исходного уровня до 14 суток.
Критерии для оценки безопасности
Показатели безопасности для данного исследования оценивали на основе следующего: частота и тяжесть неблагоприятных явлений (АЕ); наличие клинически значимых изменений в лабораторных параметрах (клиническая химия, гематология и анализ мочи); изменения на электрокардиограммах (ЭКГ) и в основных показателях жизнедеятельности; изменения, обнаруживаемые при физикальном обследовании; и масса тела.
Неблагоприятное явление (АЕ) было определено как возникновение любой нежелательной реакции на медицинское лечение у пациента или субъекта, подвергнутого исследованию, которому вводили исследуемый медицинский продукт (IMP), и которая не обязательно имеет причинно-следственную связь с этим исследуемым лечением. Таким образом, АЕ представляло собой любой неблагоприятный или непреднамеренный признак (включая аномальные лабораторные данные), симптом или заболевание, временно ассоциированное с использованием продукта, независимого от того относится ли он к IMP или нет.
Это определение также включало неожиданные поражения и основания для изменений в лечении (лекарственное средство и/или доза), какой-либо медицинской консультации или консультации по уходу или фармации, или направления в клинику или на хирургические вмешательства. Оно также включало АЕ, наблюдаемые обычно, и АЕ, прогнозируемые на основе фармакологического действия данного IMP. Любая клинически значимая реакция в месте инъекции с тяжестью, требующей активного вмешательства (то есть, изменение дозы, прекращение исследования лекарственного средства, более частое наблюдение или обработка места инъекции), также признавалась АЕ и подлежала регистрации в журнале (АЕ log). Это определение представляло собой минимальное требование для регистрации АЕ, относящихся к реакциям в месте инъекции. Могли иметь место ситуации, в которых не было активного наблюдения, но реакцию все же следовало считать как АЕ.
Неблагоприятная реакция на лекарственное средство (ADR) была определена как АЕ, оцениваемое исследователем как возможно или вероятно связанное с лечением данным IMP.
Неожиданное АЕ было определено как АЕ, не идентифицированное по природе, тяжести или частоте возникновения в разделе "нежелательные эффекты" в текущем исследовательском отчете для организаторов исследования или во вкладыше упаковки с лейпролидом 7,5 мг.
Об АЕ пациенты могли сообщать самостоятельно или ответив при общем опросе исследователя о состоянии их здоровья, или АЕ могли представлять собой результат изменений системной или местной переносимости, лабораторных параметров или физикальных наблюдений. Все АЕ были зарегистрированы. Были описаны характер каждого явления, время и дата возникновения, продолжительность, интенсивность, критерии тяжести, оценка его причины и взаимосвязи с исследуемым лекарственным средством, необходимость специфической терапии и его последствия. Действие, предпринятое из-за АЕ, классифицировали в соответствии с медицинским продуктом (без изменений, прекращение, другое изменение [конкретизировали]). Все лекарственные препараты, используемые для лечения АЕ, записывали в сопровождающий журнал лекарственных препаратов.
Все пациенты, испытавшие АЕ, независимо от того считали ли их ассоциированными с использованием данного исследуемого лекарственного средства или нет, подвергались наблюдению до устранения или стабилизации АЕ либо до окончания участия пациента в исследовании (то есть, до последнего визита в конце исследования, законченного для этого пациента).
Любое АЕ, оцененное исследователем как серьезное, тяжелое и/или возможно или вероятно связанное с исследуемым продуктом, подвергали наблюдению до тех пор, пока оно не было устранено, или до тех пор, пока медицинское состояние пациента не стабилизировалось, и всю релевантную информацию о последующем наблюдении сообщали в Ferring Pharmaceuticals A/S. Кроме того, любое АЕ, связанное с тестированием функции печени (LFT), подвергали наблюдению исследователем. Результат по АЕ классифицировали следующим образом: пациент восстановился, восстановился с остаточными явлениями, еще не восстановился или умер.
Однако, все второстепенные АЕ регистрировали, независимо от того считал ли исследователь их явлениями, связанными с IMP, или нет. Если АЕ ухудшилось по интенсивности, и пациент не восстановился между наблюдениями, регистрировали одну АЕ с наиболее высокой интенсивностью. Период регистрации АЕ составлял период от времени, когда пациент подписал информированное согласие, до последнего визита в конце исследования. АЕ, требующие терапии, лечили с Использованием принятых стандартов медицинского ухода для защиты здоровья и хорошего самочувствия пациента. Соответствующее реанимационное оборудование и лекарственные препараты были доступны для обеспечения наилучшего возможного лечения в неотложной ситуации.
АЕ оценивали в баллах в соответствии с Общими Критериями Терминологии для обозначения неблагоприятных явлений (Common Terminology Criteria for Adverse Events (CTCAE)) Национального института рака (the National Cancer Institute (NCI)). Согласно критериям CTCAE, АЕ оценивали по пятибалльной шкале, соответствующей слабым, умеренным, тяжелым, угрожающим жизни или инвалидизирующим АЕ и повлекшим летальный исход. Для тех АЕ, которые не описаны в CTCAE, использовали отдельную пятибалльную шкалу для оценки интенсивности АЕ, как описано ниже:
1 балл АЕ: слабые - незначительные; никакого специального медицинского вмешательства; только бессимптомные лабораторные данные, только радиографические данные; минимальная клиническая значимость;
2 балла АЕ: умеренные - от минимального вмешательства до локального вмешательства, либо неинвазивное вмешательство;
3 балла: тяжелые - значительные симптомы, требующие госпитализации или инвазивного вмешательства; переливания крови; избирательной инвазивной радиологической процедуры; терапевтической эндоскопии или операции;
4 балла: угрожающие жизни или инвалидизирующие - осложненные острыми, угрожающими жизни метаболическими или сердечно-сосудистыми осложнениями, такими как недостаточность кровообращения, геморрагия, сепсис; угрожающие жизни физиологические последствия; необходимость интенсивной терапии или срочной инвазивной процедуры; неотложной инвазивной радиологической процедуры, терапевтической эндоскопии или операции;
5 баллов: летальный исход.
Кроме того, четырехбалльную шкалу использовали для оценки причинно-следственной связи АЕ с исследуемым продуктом, как указано ниже:
вероятно - четко выраженная временная взаимосвязь с улучшением при отмене тестируемого лекарственного средства или снижении дозы;
возникновение симптоматики вновь при повторном введении; подчиняется известной картине ответа на тестируемое лекарственное средство;
возможно - прослеживается умеренное временное последствие в результате введения; может быть вызвано клиническим состоянием пациента или факторами окружающей среды либо другими вводимыми лекарствами;
маловероятно - не прослеживается умеренное временное последствие в результате введения; может быть вызвано клиническим состоянием пациента или факторами окружающей среды либо другими вводимыми лекарствами;
нет взаимосвязи - явно и несомненно вызвано посторонними причинами, и не удовлетворяет критериям, перечисленным выше, то есть "маловероятно", "возможно" или "вероятно".
Тяжелые неблагоприятные явления (SAE) были определены как любое нежелательное медицинское проявление, которое в любой дозе приводило в результате к летальному исходу, являлось угрожающим жизни, требовало госпитализации пациента или продления существующей госпитализации, приводило в результате к устойчивому или значительному ограничению дееспособности/нетрудоспособности, являлось важным медицинским проявлением или приводило в результате к врожденной аномалии/пороку развития.
Летальный исход пациента, участвовавшего в данном исследовании, не считали результатом как таковым, а считали скорее исходом болезни. Любой случай, приводящий в результате к летальному исходу, регистрировали и подробно описывали, в том числе летальный исход, наступивший в пределах четырех недель после окончания лечения, и независимо от причинно-следственной связи с IMP.
Термин "угрожающее жизни" в определении SAE относился к явлению, при котором пациент имел непосредственный риск летального исхода на момент данного явления. Он не относился к событию, которое могло вызвать летальный исход, если бы оно было более тяжелым.
Лабораторные параметры (Таблица 4) регистрировали при отборе и во время исследования. Подробные методологии и используемое оборудование, а также нормальные диапазоны для различных параметров известны в данной области техники.
Лабораторные параметры
В дополнение, образцы крови, взятые до начала введения доз на 0 сутки, 168 сутки и при последнем визите в конце исследования, оценивали на наличие антител против дегареликса.
Клинически значимые лабораторные отклонения от нормы, подтверждающие заболевание или органную токсичность, и тяжесть, требующую активного вмешательства (то есть изменение дозы, прекращение введения лекарственного средства, более частое наблюдение или диагностическое исследование), были зарегистрированы как АЕ.
Давление крови и пульс измеряли при отборе, перед введением дозы при каждом визите для введения доз и при последнем визите в конце исследования. Диастолическое и систолическое давление крови измеряли после отдыха в течение пяти минут в положении сидя. Пациентов наблюдали клинически в течение по меньшей мере 1 часа после каждого введения исследуемого медицинского продукта (IMP) для наблюдения за любой внезапно возникающей реакцией гиперчувствительности. Во время периода наблюдения диастолическое и систолическое кровяное давление измеряли через 5, 10, 30 и 60 минут после введения дозы.
Электрокардиограмму (ЭКГ) с 12 отведениями снимал местный персонал при отборе, на 0 сутки, 3 сутки, каждые 12 недель (84 суток) после 0 суток и при последнем визите в конце исследования. ЭКГ снимали перед введением доз, когда был запланирован визит для введения дозы. ЭКГ получали в цифровой форме, и измерения осуществляли как известно в данной области техники. Измерения ЭКГ включали сердечные сокращения, PR, QRS интервалы, QT и QTc, Т и U волны.
Каждого пациента также подвергали физикальному исследованию при отборе, на 0 сутки, затем каждые 12 недель и при последнем визите в конце исследования. Регистрировали любые клинически значимые аномальные данные, наблюдаемые при скрининге. Любые клинически значимые аномальные данные, наблюдаемые после этого, записывали как АЕ.
Массу тела измеряли при отборе и при последнем визите в конце исследования. При отборе измеряли рост (без обуви). Индекс массы тела (BMI) определен как масса тела индивидуума, деленная на квадрат его роста. Эта формула, универсально используемая в медицине, дает единицу измерения, выражаемую в кг/м2. Индекс массы тела может быть точно рассчитан с использованием любых формул, приведенных ниже.
Статистические способы
Были проведены все статистические анализы, суммарные статистические данные подсчитывали с использованием программного обеспечения по статистическому анализу SAS™, версия 9 или выше. Популяции для анализа были следующие:
группа анализа «начавшие получать лечение» (intention-to-treat, ITT) включала всех рандомизированных пациентов, которые получили по меньшей мере одну дозу исследуемого медицинского продукта (IMP);
группа анализа «в соответствии с протоколом» (per protocol, PP) включала всю группу анализа ITT без существенных нарушений протокола;
группа анализа безопасности была идентична группе анализа ITT, и таким образом все анализы безопасности были осуществлены для группы анализа ITT.
Основной критерий эффективности анализировали для обоих групп анализа ITT и PP, причем группу анализа ITT считали главной. Основной критерий эффективности анализировали с использованием метода Каплана-Майера. Для каждой из трех групп лечения степени тестостероновых ответов с 95%-ным доверительным интервалом (С1) рассчитывали путем преобразования повторным логарифмированием функции выживаемости. Различия между группами лечения дегареликсом и лейпролидом 7,5 мг оценивали с использованием 97,5%-ного Cl, рассчитанного методом аппроксимации нормальным распределением с использованием суммарной стандартной ошибки.
Для оценки эффективности дегареликса проверяли две гипотезы:
(1) критерий FDA был взят для определения того, составляет ли нижний предел 95%-ного доверительного интервала (Cl) для кумулятивной вероятности достижения уровня тестостерона ≤0,5 нг/мл от 28 суток до 364 суток не ниже чем 90%;
(2) критерий Европейского агентства по оценке лекарственных средств (The European Agency for the Evaluation of Medicinal Products (EMEA)) был взят для определения того, что дегареликс не меньше по эффективности чем лейпролид 7,5 мг в отношении кумулятивной вероятности достижения уровня тестостерона ≤0,5 нг/мл от 28 суток до 364 суток. Граница «не меньшей эффективности» для различий между лечениями (дегареликс против лейпролида 7,5 мг) составляла - 10 процентных точек.
Все дополнительные критерии эффективности анализировали для обоих групп анализа ITT и PP, если не оговорено иное. Долю пациентов с выбросом тестостерона во время первых 2 недель лечения анализировали с использованием точного критерия Фишера. Точный критерий Фишера также использовали для анализа доли пациентов с уровнем тестостерона ≤0,5 нг/мл на 3 сутки. Процентное изменение уровня PSA от исходного уровня к точке 28 суток анализировали с использованием критерия Уилкоксона. Для обоих критериев Фишера и Уилкоксона были сделаны отдельные представления данных по группе лечения, географическому региону, типу массы (<90 кг, ≥90 кг) и для подгруппы лечения лейпролидом 7,5 мг.
Дополнительные конечные точки: вероятность достижения уровня тестостерона ≤0,5 нг/мл от 56 суток до 364 суток, период времени до проявления недостаточного PSA-ответа и вероятность достижения достаточного тестостеронового ответа от 28 суток до 364 суток анализировали с использованием метода Каплана-Майера.
Результаты эффективности
Основная задача данного исследования заключалась в том, чтобы продемонстрировать эффективность дегареликса в достижении и поддержании подавления тестостерона до уровней кастрации, что оценивали в виде доли пациентов с подавлением тестостерона до уровня ≤0,5 нг/мл в течение 12 месяцев лечения.
Результаты показывают, что дегареликс, доставляемый при схеме введения доз 240/80 мг, вызывал быстрое и эффективное подавление уровней тестостерона, которые оставались низкими на протяжении всего 364-суточного периода лечения (Фиг.2).
Оценки вероятностей достижения уровней тестостерона ≤0,5 нг/мл от 28 суток до 364 суток по методу Каплана-Майера составляли 98,3%, 97,2% и 96,4% для групп лечения дегареликсом 240/160 мг, дегареликсом 240/80 мг и лейпролидом 7,5 мг, соответственно. Для всех трех групп лечения нижний предел 95%-ного Cl был выше предварительно определенного 90%-ного порога. Было продемонстрировано, что лечение дегареликсом не хуже по эффективности, чем терапия лейпролидом 7,5 мг в отношении вероятности достижения уровней тестостерона ≤0,5 нг/мл от 28 суток до 364 суток. Для обоих групп лечения дегареликсом целый 97,5%-ный Cl для различия в вероятности по сравнению с группой лечения лейпролидом 7,5 мг был больше, чем граница «не меньшей эффективности» - 10 процентных точек. Таким образом, данное исследование полностью удовлетворяло критериям эффективности FDA и ЕМЕА.
Надежность результатов по основному критерию эффективности была подтверждена наблюдаемыми фактическими данными анализа, которые давали подобные оценки общей доли пациентов с уровнем тестостерона ≤0,5 нг/мл от 28 суток до 364 суток для групп лечения дегареликсом 240/160 мг, дегареликсом 240/80 мг и лейпролидом 7,5 мг, соответственно, 98,2%, 97,0% и 96,0%. Обнаружения в первичных анализах далее подтверждали вторичными анализами эффективности в отношении вероятности достижения уровней тестостерона ≤0,5 нг/мл от 56 суток до 364 суток.
Как и ожидали, значительно более высокая доля пациентов в группе лечения лейпролидом 7,5 мг (80,1%) имела выброс тестостерона (повышение ≥15% от исходного уровня) во время первых двух недель лечения по сравнению с суммарными группами дегареликса (0,2%: один пациент) (р<0,0001, точный критерий Фишера). Этого пациента, которого лечили дегареликсом, можно считать артефактом, так как этот пациент имел низкий исходный уровень тестостерона (0,0065 нг/мл), так что выброс с такого низкого исходного уровня был незначительным. Напротив, у 96% пациентов, получающих дегареликс, проявлялось подавление тестостерона на 3 сутки по сравнению с ни одним пациентом в группе лечения лейпролидом 7,5 мг (р<0,0001, точный критерий Фишера). Как показано на Фиг.3, схема введения доз дегареликса 240/80 мг быстро и эффективно подавляла уровни тестостерона, в то время как Lupron 7,5 мг действовал намного более постепенно и только после изначального выброса тестостерона.
Профили сывороточных уровней LH с течением времени были аналогичны профилям, наблюдаемым для тестостерона. После введения дегареликса средние уровни LH для группы анализа ITT быстро снижались и составляли <0,7 МЕ/л на 1 сутки, представляя снижение на приблизительно 88% от исходного уровня. Для обоих групп лечения дегареликсом средние уровни LH оставались сниженными до конца исследования на 364 сутки. В противоположность этому, резкий подъем средних уровней LH наблюдался для пациентов в группе лечения лейпролидом 7,5 мг, который достиг пикового значения при 31,0 МЕ/л на 1 сутки (>400%-ное повышение от исходного уровня) перед экспоненциальным снижением до 0,035 МЕ/л к 56 суткам и поддержанием на этом уровне до 364 суток (см. Фиг.4).
Быстрое снижение уровней FSH также наблюдалось у пациентов, которых лечили дегареликсом. Введение дегареликса приводило в результате к снижению средних уровней FSH до ≤1,5 МЕ/л к 7 суткам, представляя >80%-ное снижение от исходного уровня. Для обоих групп лечения дегареликсом средние уровни FSH сохранялись сниженными до конца исследования на 364 сутки. Для пациентов в группе лечения лейпролидом 7,5 мг имел место изначальный резкий подъем уровней FSH, подобно тому что наблюдали для уровней LH, который достиг пикового значения при 22,5 МЕ/л на 1 сутки (146%-ное повышение от исходного уровня) перед экспоненциальным снижением до 2,0 МЕ/л к 14 суткам. Средние уровни FSH затем повысились примерно к 56 суткам до достижения плато при приблизительно 4,40 МЕ/л и оставались на этом уровне до 364 суток (см. Фиг.5).
Как показано на Фиг.6, схема введения доз дегареликса 240/80 мг также давала более быстрое и эффективное снижение уровней PSA, чем это делало лечение Lupron 7,5 мг. Быстрое снижение уровней PSA наблюдали для пациентов, которых лечили дегареликсом. В противоположность этому уровни PSA в группе лечения лейпролидом 7,5 мг достигли плато во время первой недели лечения перед экспоненциальным снижением до уровней подавления. Имело место значительно более сильное снижение средних уровней PSA от исходного уровня, которое наблюдали на 14 сутки и 28 сутки для пациентов, которых лечили дегареликсом, по сравнению с пациентами, которых лечили лейпролидом 7,5 мг (р<0,0001, критерий Уилкоксона). Вероятность наблюдения PSA по суммарным группам лечения дегареликсом, являющаяся меньшей чем вероятность по группе лечения лейпролидом 7,5 мг, была слегка выше на 14 сутки (0,82), чем на 28 сутки (0,70). Вероятность завершения данного исследования без проявления недостаточного PSA-ответа была наивысшей в группе лечения дегареликсом 240/80 мг (91,2%) и слегка ниже (~85,8%) для обоих групп лечения дегареликсом 240/160 мг и лейпролидом 7,5 мг, хотя это различие не было статистически значимым.
Антиандрогенную терапию, как соответствует протоколу, давали 22 пациентам в группе лечения лейпролидом 7,5 мг в начале лечения для защиты от внезапного обострения болезни. Данные по PSA для этих пациентов показали более высокий средний процент изменений от исходного уровня на 14 сутки (61,7% снижение) и 28 сутки (89,1%) по сравнению с теми пациентами в группе лечения лейпролидом 7,5 мг, которые не получали антиандрогенную терапию, где процентное снижение составило 15,3% и 61,7% на 14 и 28 сутки, соответственно. Следует отметить, что средний процент изменений уровней PSA у пациентов, принимавших лейпролид плюс антиандроген, был аналогичен тем пациентам, которых лечили дегареликсом, тем самым подтверждая, что дегареликс является более эффективным, чем традиционная терапия GnRH-агонистом, в подавлении PSA в начале лечения. Дегареликс не требует дополнительного сопровождающего лечения в качестве профилактики внезапного обострения болезни; даже стартовая доза 240 мг имеет такой же эффект в отношении уровней PSA, как и комбинация GnRH-агониста с антиандрогеном.
Фармакодинамический профиль дегареликса был характерным для GnRH-антагониста с быстро снижаемыми уровнями сывороточного тестостерона, LH и FSH; В противоположность этому, для пациентов в группе лечения лейпролидом 7,5 мг, уровни сывороточного тестостерона, LH и FSH быстро возрастали в первую неделю лечения перед падением до уровней подавления.
Результаты безопасности
Безопасность и переносимость оценивали по наблюдаемым и регистрируемым возникшим при лечении АЕ, включая реакции в месте инъекции, гематологические, клинико-химические и уринологические лабораторные параметры, показатели жизненно-важных функций/клинические наблюдения, измерения массы тела и физикальное обследование, ЭКГ и сопутствующее лечение.
Параметры безопасности оценивали для всех пациентов, включенных в группу анализа ITT, содержащую всех 610 рандомизированных пациентов, которые получили по меньшей мере одну дозу исследуемого лекарственного средства. Все таблицы по безопасности включают четыре колонки: три отдельно описанные группы лечения и суммарная группа лечения дегареликсом.
Краткий обзор по неблагоприятным явлениям
Неблагоприятные явления признавали как «возникшие при лечении», если они появлялись в интервал времени от введения начальной дозы до конца исследования. Неблагоприятные явления признавали как «возникшие до лечения», если они существовали в период между отбором и начальными инъекциями IMP. Как описано выше, все АЕ классифицировали согласно MedDRA (версия 10.0) в системно-органные классы (SOC), расположенные в алфавитном порядке, и по предпочтительному термину (РТ), в порядке уменьшения частоты возникновения. Возникшие при лечении АЕ выражали в баллах интенсивности (используя NCl СТСАЕ) и в зависимости от исследуемого лекарственного средства. Общий обзор по АЕ, возникшим при лечении, представлен в Таблице 5.
Общий обзор по неблагоприятным явлениям, возникшим при лечении
Суммарные проценты пациентов, испытавших возникшие при лечении АЕ, были сравнимы во всех трех группах лечения. Зарегистрировано 167 (83%) пациентов в группе лечения дегареликсом 240/160 мг с возникшими при лечении АЕ, по сравнению с 163 (79%) пациентами в группе лечения дегареликсом 240/80 мг и 156 (78%) пациентами в группе лечения лейпролидом 7,5 мг. В целом ADR были зарегистрированы у 238 (58%) пациентов суммарной группы лечения дегареликсом, из них, 120 (59%) пациентов в группе лечения дегареликсом 240/160 мг и 118 (57%) пациентов в группе лечения дегареликсом 240/80 мг. Для группы лечения лейпролидом 7,5 мг у 42% пациентов зарегистрированы ADR. Это различие было ожидаемым, и его можно объяснить полностью АЕ, связанными с инъекцией (связанные с местом инъекции побочные эффекты), которые проявлялись в более высокой степени в суммарной группе лечения дегареликсом. За исключением ADR, связанных с местом инъекции, частота возникновения остальных ADR была аналогичной в трех группах лечения:
у 88 (44%) пациентов зарегистрированы ADR, за исключением реакций в месте инъекции, в группе лечения дегареликсом 240/160 мг;
у 90 (43%) пациентов зарегистрированы ADR, за исключением реакций в месте инъекции, в группе лечения дегареликсом 240/80 мг;
у 84 (42%) пациентов зарегистрированы ADR, за исключением реакций в месте инъекции, в группе лечения лейпролидом 7,5 мг.
Такие результаты подтверждают, что оба варианта поддерживающих доз дегареликса (80@20 мг/мл или 160@40 мг/мл) приводили в результате к аналогичной частоте возникновения ADR.
Всего у 45 (11%) пациентов суммарной группы лечения дегареликсом зарегистрировано 67 серьезных АЕ, включая десять летальных исходов. Всего у 24 (12%) пациентов в группе лечения дегареликсом 240/160 мг зарегистрированы серьезные АЕ, в сравнении с 21 (10%) пациентом в группе лечения дегареликсом 240/80 мг и 28 (14%) пациентами, включая 9 летальных исходов, в группе лечения лейпролидом 7,5 мг. Все летальные исходы были оценены как не связанные или маловероятно связанные с исследуемым лечением. Такие результаты следует также интерпретировать в том смысле, что это популяция пожилых людей (средний возраст 72 года), у которых имеется и рак предстательной железы, и другие основные заболевания.
О тридцати четырех пациентах (8%) суммарной группы лечения дегареликсом сообщили как о прекративших лечение из-за АЕ (включая как фатальные, так и нефатальные АЕ); 19 (9%) пациентов в группе лечения дегареликсом 240/160 мг и 15 (7%) пациентов в группе лечения дегареликсом 240/80 мг, кроме того, было 12 (6%) пациентов, прекративших лечение, в группе лечения лейпролидом 7,5 мг. Из пациентов суммарной группы лечения дегареликсом зарегистрировано 17 пациентов с SAE, которые привели к прекращению лечения.
Подробный анализ неблагоприятных явлений
В то время как общая частота возникновения неблагоприятных явлений была аналогичной в двух группах лечения дегареликсом и контрольной группе лечения лейпролидом, подавляющее большинство таких явлений для групп лечения дегареликсом представляли реакции в месте инъекции, связанные с подкожной/депо-системой доставки, используемой для дегареликса. В сравнении с этим, внутримышечная инъекция лейпролида не была ассоциирована с такой высокой степенью реакций в месте инъекции, несмотря на то что общая частота возникновения неблагоприятных явлений была аналогичной. Соответственно, подробный анализ точного типа неблагоприятных явлений, имеющих место в каждой исследуемой группе, был предпринят для того, чтобы охарактеризовать типы неблагоприятных явлений, отличных от реакций в месте инъекции (побочных эффектов, связанных с местом инъекции), которые должно быть имеют место в группе лечения лейпролидом, чтобы дать объяснение в целом аналогичной частоте возникновения неблагоприятных явлений.
В Таблице 6 собраны данные по количеству пациентов с возникшими при лечении АЕ, представленными согласно SOC. Все возникшие при лечении АЕ представлены по системно-органным классам и предпочтительному термину Med-DRA.
Возникшие при лечении неблагоприятные явления согласно системно-органным классам
Возникшие при лечении АЕ зарегистрированы для сравнимого процента пациентов во всех трех группах лечения: 83%, 79% и 78% пациентов в группах лечения дегареликсом 240/160 мг, дегареликсом 240/80 мг и лейпролидом 7,5 мг, соответственно. Как показано в Таблице 6 выше, не было значительных различий между выявленными SOC для двух групп лечения дегареликсом. Доминирующим системно-органным классом, выявленным для пациентов, лечившихся дегареликсом в обоих группах лечения, был «Общие расстройства и состояния, связанные с местом введения», зарегистрированные для 47% пациентов суммарной группы лечения дегареликсом и 18% пациентов группы лечения лейпролидом 7,5 мг. Большинство этих АЕ представляли собой боль в месте инъекции, которая имела место у 29% пациентов суммарной группы лечения дегареликсом. Кроме того, «сосудистые расстройства» были зарегистрированы для 33% пациентов групп лечения дегареликса и 30% пациентов группы лечения лейпролидом 7,5 мг, главным образом приливы. Другие выявленные SOC у ≥15% пациентов представляли собой:
«исследования» у 27% пациентов групп лечения дегареликсом и 31% пациентов группы лечения лейпролидом 7,5 мг, «инфекции и заражения» у 20% и 24% пациентов, соответственно, «скелетно-мышечные расстройства и заболевания соединительной ткани» у 17% и 26% пациентов, соответственно, и «желудочно-кишечные расстройства» у 17% и 19% пациентов, соответственно. Наиболее частые скелетно-мышечные расстройства и заболевания соединительной ткани представляли собой боль в спине, зарегистрированная у 6% пациентов групп лечения дегареликсом и 8% пациентов группы лечения лейпролидом 7,5 мг, а также артралгия, зарегистрированная для 4% пациентов групп лечения дегареликсом и 9% пациентов группы лечения лейпролидом 7,5 мг.
При изучении SOC среди АЕ, ассоциированных с лечением дегареликсом по сравнению с лейпролидом, выявили несколько областей повышенного риска для лейпролида по сравнению с дегареликсом. Например, «скелетно-мышечные расстройства и заболевания соединительной ткани» имели место у 26% пациентов группы лечения лейпролидом по сравнению всего лишь с 17% пациентов групп лечения дегареликсом в целом (и даже ниже, 15% в группе лечения дегареликсом 240/80 мг). Кроме того, «расстройства почечной и мочевыводящей системы» имели место у 19% пациентов группы лечения лейпролидом, но только лишь у 13% пациентов группы лечения дегареликсом, в то время как «расстройства репродуктивной системы и заболевания молочных желез» имели место у 10% пациентов группы лечения лейпролидом, но всего лишь у 5% пациентов группы лечения дегареликсом. Кроме того, «расстройства сердечной деятельности» имели место при слегка увеличенной в целом частоте возникновения для группы лечения лейпролидом (13%) по сравнению с дегареликсом (9% в целом между двумя группами лечения). Это может представлять особый интерес, поскольку, как рассмотрено выше, существуют некоторые опасения в данной области в том, что некоторые андрогенные депривационные терапии оказывают неблагоприятные влияния на здоровье сердечно-сосудистой системы (см. Yannucci et al. (2006) J.Urology 176:520-525; и Etzioni et al. (1999) J.Natl. Cane. Inst. 91:1033). Соответственно, андрогенные депривационные терапии, которые минимизируют риск развития сердечно-сосудистых побочных эффектов, особенно желательны.
Повышенный риск развития расстройств сердечной деятельности, скелетно-мышечных расстройств и заболеваний соединительной ткани, почечных и мочевыводящих расстройств и расстройств репродуктивной системы, характерный для лейпролида в сравнении с дегареликсом, вероятно служит объяснением общего сходства по частоте возникновения неблагоприятных явлений между лейпролидом и дегареликсом, несмотря на тот факт, что большинство неблагоприятных явлений, наблюдаемых для дегареликса, представляло собой реакции в месте инъекции, связанные со способом подкожной доставки, и не относилось к неблагоприятным системным эффектамвотношении других органных систем.
Как показано в Таблице 7, наиболее часто регистрируемые АЕ, возникшие при лечении, для пациентов, которых лечили дегареликсом, представляли собой реакции в месте инъекции (в частности, боль и эритема в месте инъекции). Наиболее часто регистрируемые АЕ как для пациентов группы лечения дегареликсом, так и для пациентов группы лечения лейпролидом во время данного исследования, представляли собой явления приливов: всего зарегистрировано приливов у 52 (26%) пациентов в группе лечения дегареликсом 240/160 мг по сравнению с 53 (26%) пациентами в группе лечения дегареликсом 240/80 мг и 43 (21%) пациентами в группе лечения лейпролидом 7,5 мг.
Неблагоприятные явления согласно системно-органным классам и предпочтительному термину, имеющие место в ≥5% случаев в любой группе лечения
Ожидали, что длительное лечение дегареликсом и лейпролидом 7,5 мг приведет в результате к неблагоприятным реакциям, ассоциированным с подавлением тестостерона, таким как приливы, потеря либидо, импотенция и бесплодие, а также повышенная потливость. Таким образом, следовало ожидать, что приступы приливов будут относительно распространены и главным образом считаться возможно или вероятно связанными с лечением. Однако, было зарегистрировано очень мало АЕ, связанных с сексуальной дисфункцией или потливостью. В целом, сообщили о 22 (5%) пациентов суммарной группы лечения дегареликсом и 21 (10%) пациентов группы лечения лейпролидом с расстройствами репродуктивной системы/молочных желез и приблизительно 1% пациентов, которых лечили дегареликсом, с расстройствами потоотделения (SOC: кожа и подкожные ткани): зарегистрировано шесть (1%) пациентов с эректильной дисфункцией, шесть (1%) пациентов с ночной потливостью, четыре (<1%) пациента с испытываемой болью в яичках, три (<1%) пациента с болью в тазовой области, три (<1%) пациента с гипергидрозом, два (2%) пациента каждый испытывали гинекомастию, простатит или атрофию яичка, а все другие расстройства репродуктивной системы/молочных желез зарегистрированы для одного (<1%) пациента, и никаких других расстройств потоотделения зарегистрировано не было.
Анализ этих данных по SOC/предпочтительному термину дополнительно подтверждает обнаружение, обсужденное выше, в отношении сокращенного числа скелетно-мышечных расстройств, а также расстройств почечной и мочевыделительной системы для дегареликса по сравнению с лечением лейпролидом. Например, 9% пациентов группы лечения лейпролидом испытывали инфекции мочевыводящих путей во время курса лечения по сравнению с только лишь 3% всех пациентов, которых лечили дегареликсом. Подобным образом, 9% пациентов группы лечения лейпролидом испытывали артралгию (боль в суставе) во время курса лечения, в то время как только лишь 4% всех пациентов, которых лечили дегареликсом, испытывали артралгию.
Резюмируя, частота случаев возникших при лечении АЕ была аналогична для пациентов, которых лечили дегареликсом и лейпролидом 7,5 мг. Возникшие при лечении АЕ были зарегистрированы для 330 (81%) пациентов в суммарной группе лечения дегареликсом и для 156 (78%) пациентов в группе лечения лейпролидом 7,5 мг. Большинство АЕ были слабой или умеренной интенсивности.
Для 58% пациентов, которых лечили дегареликсом, были зарегистрированы АЕ, которые, как было принято исследователем, возможно/вероятно связаны с IMP (ADR), а те пациенты, которых лечили лейпролидом 7,5 мг, имели 42% ADR. Однако, большинство возникших при лечении ADR представляло собой общие расстройства и состояния, связанные с местом введения, включая реакции в месте инъекции, которые имели место у 173 (42%) пациентов в суммарной группе лечения дегареликсом. Для пациентов, которых лечили дегареликсом, общая частота возникших при лечении реакций в месте инъекции составила 4,4 на 100 инъекций. Большинство реакций в месте инъекции возникло после введения первой дозы дегареликса, в случаях когда вводили две инъекции, и со временем реакции в месте инъекции уменьшались. Среди предпочтительных терминов MedDRA с наиболее высокой частотой возникновения появлялись боль в месте инъекции (2,9 на 100 инъекций) и эритема в месте инъекции (1,9 на 100 инъекций) для суммарной группы лечения дегареликсом. Все другие предпочтительные термины имели частоту возникновения 0,5 на 100 инъекций или менее. Ни одна из ADR, связанных с инъекцией, не была признана тяжелой, и не было никаких реакций гиперчувствительности немедленного типа. У пяти (1,2%) пациентов были зарегистрированы реакции в месте инъекции, связанные с дегареликсом, которые привели к прекращению лечения. Другие распространенные регистрируемые ADR представляли собой приливы, которые были ожидаемой неблагоприятной реакцией, ассоциированной с подавлением тестостерона. В целом, приливы были зарегистрированы для 104 (25%) пациентов, которых лечили дегареликсом, и 42 (21%) пациентов, которых лечили лейпролидом 7,5 мг. У одного пациента, которого лечили дегареликсом, были зарегистрированы ADR в виде приливов, которые привели к прекращению лечения. Примечательно то, что хотя ожидалось, что АЕ, связанные с сексуальной дисфункцией, будут приводить к подавлению тестостерона, фактически их было зарегистрировано очень мало.
Было зарегистрировано 121 серьезных неблагоприятных явлений SAE у 73 (12%) пациентов с относительно равной частотой возникновения среди групп лечения. Наиболее распространенные SAE представляли собой расстройства сердечной деятельности, которые возникли у десяти (2%) пациентов в суммарной группе лечения дегареликсом и десяти (5%) пациентов в группе лечения лейпролидом 7,5 мг; а также расстройства почечной и мочевыделительной системы, которые возникли у 10 (2%) пациентов в суммарной группе лечения дегареликсом и шести (3%) пациентов в группе лечения лейпролидом 7,5 мг.
Увеличение массы является известным эффектом андрогенной депривации, и явно аномальные увеличения массы ≥7% от исходного уровня наблюдали у 10% пациентов, которых лечили дегареликсом, и 13% пациентов, которых лечили лейпролидом 7,5 мг. Частота возникновения других явно аномальных изменений в показателях жизнедеятельности согласовалась с группой пожилых пациентов, многие из которых имели в анамнезе болезни сердца и гипертензию.
Таким образом, в то время как лечение дегареликсом приводило в результате к значительному количеству субъектов, испытывающих несущественные реакции в месте инъекции, эти неблагоприятные эффекты были заметно менее серьезными, чем многие из тех, которые связывали с GnRH-агонистом лейпролидом. Примечательно, что эти несущественные реакции в месте инъекции были также намного менее серьезными, чем потенциально угрожающие жизни эффекты, ассоциированные с другим GnRH-антагонистом абареликсом (Abarelix) (Plenaxis в США) (см. www.fda.gov/cder/drug/infopage/plenaxis). В действительности Abarelix/Plenaxis был ассоциирован с тяжелыми аллергическими реакциями (например, отек языка/гортани, астма, хрипы и серьезные проблемы с дыханием), и поэтому он доступен только через специальную «программу безопасности пользователя» ("user safety program") для обеспечения того, чтобы он безопасно использовался врачами с подходящей квалификацией для введения и мониторинга этого лекарственного средства.
Дополнительные статистические анализы подгрупп популяций
Дополнительные статистические анализы результатов клинического исследования CS21 были предприняты с целью определения того, проявлялись ли преимущества в превосходной эффективности и/или сниженных побочных эффектах дегареликса над лечением лейпролидом в частности в определенных подгруппах пациентов. Особое внимание уделили тому, отвечали ли конкретные подгруппы пациентов за любые из сниженных сердечных, артралгических побочных эффектов и/или инфекции мочевыводящих путей, наблюдаемых при лечении дегареликсом по сравнению с лечением лейпролидом.
Используя результаты из обобщения по данным клинической эффективности (SCE) и обобщения по данным клинической безопасности (SCS), были проанализированы разные группы пациентов. Различающиеся подгруппы включали подгруппы по расам (европеоидная, негроидная и другие), возрасту (<65 лет, от ≥65 лет до <70 лет и ≥75 лет), массе (<70 кг, ≥70-<90 кг и ≥90 кг), индексу массы тела (ВМ1) (<20, от >20 до 30 и >30 кг/м2)), региону (Северная Америка, Западная Европа, Центральная и Восточная Европа и Другие) и стадии рака предстательной железы (например, локализованный, локально распространенный и метастатический).
SCS обобщали в виде как приближенной частоты (n/N), так и частоты возникновения неблагоприятных явлений (количество пациентов с по меньшей мере одним неблагоприятным явлением исследуемым на 1000 человеко-лет), включая точный 95%-ный Cl на основе модели Пуассона, и представляли по предпочтительному термину MedDRA (и группировали по SOC) для всех исследуемых групп, включая исследование CS21 (исследование, представляющее фазу 3 контролируемого группового исследования) и для всех подгрупп. Кратко, модель Пуассона дает точные 1-а нижние (LL) и верхние (UL) границы доверительного интервала:
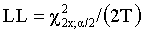
соответственно, где Т представляет собой количество 1000 человеко-лет, и х представляет собой количество субъектов, у которых по меньшей мере один раз было зарегистрировано неблагоприятное явление при исследовании (см. Gerlinger et a/. (2003) Eur. J. Contracept. Reprod. Health Care 8:87-92).
Для фазы 3 контролируемого исследования (CS21), приближенные частоты в группах лечения дегареликсом сравнивали с таковыми для группы лечения лейпролидом 7,5 мг, используя двусторонний точный критерий Фишера и соответствующие Р-значения, отмеченные звездочками. Эти Р-значения представляли в виде *(0,01<Р≤0,05), **(0,001<Р≤0,01) и ***(Р≤0,001). Подобным образом, частоты возникновения сравнивали, используя Р-значения, ассоциированные с критерием UMPU (равномерно наиболее мощный несмещенный критерий) на основе модели Пуассона. Кратко, допуская xi ~ (λiTi) Пуассона, где xi = количеству субъектов с возникшим явлением, Ti = общему количеству на 1000 человеко-лет в группе исследования i, и λi = частоте возникновения в группе исследования i (i=1,2), когда Р-значение=2 мин (P(S≥1), P(S≤xi), 0,5), где S ~ двучлен (x1+x2, T1/(T1+T2)) (см., например, Lehmann (1986) Testing Statistical Hypotheses. 2ая редакция, Springer-Verlag, New York).
Основываясь на этих результатах, идентифицировали все неблагоприятные явления (по SOC или РТ уровню), которые демонстрировали статистически значимую (Р<=.05) или погранично значимую (.05<Р<0,2) более низкую частоту в группе лечения дегареликсом по сравнению с группой лечения лейпролидом 7,5 мг.
В SCS сердечно-сосудистые явления были исследованы более конкретно по более укрупненным уровням MedDRA, то есть частота возникновения у субъекта АЕ и коэффициенты возникновения были сгруппированы по следующим Групповым терминам высокого уровня (High Level Group Terms, HLGT) по группам исследования и лечения:
HLGT = сосудистые расстройства центральной нервной системы
HLGT = сердечные аритмии
HLGT = заболевания коронарных артерий
HLGT = сердечная недостаточность
Чтобы дополнительно обосновать наблюдаемые, но потенциально изолированные данные по уровням конкретного предпочтительного термина относительно того, что дегареликс показывает более низкую частоту возникновения, чем лейпролид, в отношении специфических расстройств сердечной деятельности, частоту возникновения в отношении упомянутых выше HLGT, а также SOC=расстройства сердечной деятельности, к которым эти HLGT относятся, были тестированы по подгруппам на основе возможного фактора риска (холестерин, BMI, масса тела, систолическое/диастолическое кровяное давление, расстройство сердечной деятельности в анамнезе, возраст, пульс). Эти подгруппы анализа не были заранее запланированы как часть SCS. Путем тестирования статистической значимости фактора риска при лечении (дегареликс/лейпролид 7,5 мг) в зависимости от времени, для анализов явления (модель пропорциональных рисков Кокса) эти ковариаты подвергали скринингу в отношении потенциальных эффектов по подгруппам. Индекс массы тела и в меньшей степени уровень холестерина были идентифицированы соответственно. Далее, ВМ1 подгруппы (<25, от 25 до <30 и ≥30 кг/м2) и подгруппы с низким/нормальным уровнем холестерина (≤4 ммоль/л и >4 ммоль/л, соответственно) использовали для тестирования и количественного определения различий по частоте возникновения между дегареликсом и лейпролидом, вместе с использованием модели Пуассона, упомянутой выше. Статистически значимая более низкая частота возникновения по сравнению с лейпролидом была отмечена для пациентов с BMI <25 кг/м2 в отношении SOC = расстройства сердечной деятельности (Р=0,0045), HLCT = заболевания коронарных артерий (Р=0,005) и HLGT = сердечные аритмии (пограничное состояние, Р=0,056), с относительными рисками, соответственно, 0,242 (95%-ный Cl: 0,08-0,67), 0,0 (95%-ный Cl: 0,0-0,47) и 0,312 (95%-ный Cl: 0,09-1,03]). Статистически значимая более низкая частота возникновения по сравнению с лейпролидом была отмечена для пациентов с уровнем холестерина большим или равным 4 ммоль/л в отношении HLGT = сердечные аритмии (Р=0,035), с относительными рисками, соответственно, 0,41 (95%-ный Cl: 0,18-0,94).
См. Таблицы 8-10 в отношении данных эффективности по подгруппам по SCE, Таблицы 11-19 в отношении данных по подгруппам по SCS и Таблицы 20-23 в отношении диагностически обоснованных данных по подгруппам по сердечно-сосудистому риску. Вкратце, данные Таблицы включают:
Время достижения подавления тестостерона во время суток 28, 56,…, 364 в подгруппе <65-летнего возраста значительно лучше лечения LUPRON DEPOT ® 7,5 мг для обоих схем введения доз дегареликса (см. Таблицу 8 ниже).
Результаты годичной эффективности в отношении конечных результатов по тестостерону для контролируемого исследования CS21 в подгруппе <65-летнего возраста
Время до проявления недостаточного PSA-ответа значительно (Р=0,03) лучше в группе лечения дегареликсом 240/80 мг по сравнению с лечением LUPRON DEPOT ® 7,5 мг в группе>75-летнего возраста и также (Р=0,06) значительно лучше в группе<65-летнего возраста (см. Таблицу 9 ниже).
Результаты годичной эффективности в отношении конечных результатов по PSA для контролируемого исследования CS21 в возрастных подгруппах
Процент изменений PSA от исходного уровня более выражен у пациентов с метастатической стадией рака предстательной железы (см. Таблицу 10 ниже). Все подгруппы лучше по статистической значимости, чем при лечении LUPRON DEPOT ® 7,5 мг.
Влияние стартовой дозы на PSA во время первого месяца лечения для контролируемого исследования CS21 - по подгруппам стадий рака предстательной железы
Примечательные статистически значимые данные в общей популяции исследования представляют собой (см. Таблицу 11):
Инфаркт миокарда (РТ); 0,5% (2/409, объединенные данные по дегареликсу) против 2,5% (5/201, LUPRON DEPOT ® 7,5 мг),
Периферический отек (РТ): 2% (8/409, объединенные данные по дегареликсу) против 5% (10/201, LUPRON DEPOT® 7,5 мг),
Боль в груди: 0,5% (2/409, объединенные данные по дегареликсу) против 3% (6/201, LUPRON DEPOT® 7,5 мг),
Инфекция мочевыводящих путей: (РТ) 3% (13/409, объединенные данные по дегареликсу) против 9% (18/201, LUPRON DEPOT® 7,5 мг),
Шум в сердце (РТ): 0% (0/409, объединенные данные по дегареликсу) против 1,5% (3/201, LUPRON DEPOT® 7,5 мг),
Скелетно-мышечные расстройства и заболевания соединительной ткани (SOC): 17% (68/409, объединенные данные по дегареликсу) против 26% (53/201, LUPRON DEPOT® 7,5 мг),
Артралгия (РТ в пределах скелетно-мышечных и CTD SOC): 4,2% (17/409, объединенные данные по дегареликсу) против 9% (18/201, LUPRON DEPOT® 7,5 мг),
Скелетно-мышечная скованность (РТ в пределах скелетно-мышечных и CTD SOC): 0% (0/409, объединенные данные по дегареликсу) против 1% (3/201, LUPRON DEPOT® 7,5 мг),
Снижение либидо: 0% (0/409, объединенные данные по дегареликсу) против 1,5% (3/201, LUPRON DEPOT® 7,5 мг),
Задержка мочевыделения: 1,2% (5/409, объединенные данные по дегареликсу) против 4,5% (9/201, LUPRON DEPOT® 7,5 мг),
Неинфекционный цистит: 0% (0/409, объединенные данные по дегареликсу) против 2% (4/201, LUPRON DEPOT® 7,5 мг),
Эректильная дисфункция: 1,5% (6/409, объединенные данные по дегареликсу) против 4,5% (9/201, LUPRON DEPOT® 7,5 мг),
Тромбоз глубоких вен (DVT): 0% (0/409, объединенные данные по дегареликсу) против 1,5% (3/201, LUPRON DEPOT® 7,5 мг).
Указаны примечательные статистически значимые данные в подгруппах и между подгруппами.
Приближенная частота возникших при лечении неблагоприятных явлений согласно системно-органным классам и предпочтительному термину MedDRA
Преобладание скелетно-мышечных расстройств и заболеваний соединительной ткани (SOC) и артралгии не ограничено лишь метастатической стадией, но есть во всех подгруппах стадий заболевания (см. Таблицу 12). Артралгия является статистически значимой у пациентов с локально распространенной стадией.
Приближенная частота возникших при лечении неблагоприятных явлений. согласно системно-органным классам и предпочтительному термину MedDRA - по стадии рака предстательной железы
Почечные расстройства и расстройства мочевыделительной системы, а также скелетно-мышечные расстройства и заболевания соединительной ткани в группе <65-летнего возраста (см. Таблицу 13).
Приближенная частота возникших при лечении неблагоприятных явлений согласно системно-органным классам и предпочтительному термину MedDRA - в группе <65-летнего возраста
Приближенная частота возникших при лечении неблагоприятных явлений согласно системно-органным классам и предпочтительному термину MedDRA - по категориям массы тела
Приближенная частота возникших при лечении неблагоприятных явлений согласно системно-органным классам и предпочтительному термину Med-DRA - по расам
Эти результаты, показанные в Таблицах 16 и 17 ниже, демонстрируют, что субъекты, подвергнутые лечению, имели значительно сниженный риск развития заболевания коронарных артерий, сердечной недостаточности, инфаркта миокарда, сердечной аритмии, болезни коронарных артерий или сердечной недостаточности при получении андроген-угнетающей терапии дегареликсом по сравнению с Lupron.
Частота возникновения (в 1000 PY (человеко-лет) сердечнососудистых явлений по сравнению с фоновой заболеваемостью
Частота возникновения сердечно-сосудистых явлений, определяемых согласно групповым терминам высокого уровня
Смертность в подгруппах со статистически (предварительно запланировано как часть ISS) значимыми данными:
Смертность по группе лечения
Смертность по группе лечения
Соотношение частот возникновения сердечных аритмий по BMI в CS21 - Дегареликс против Лейпролида
Эти результаты показывают, что субъекты, которых лечили, с BMI менее чем 30 кг/м2 (например менее чем 25 кг/м2, например 20-25 кг/м2) имели значительно сниженный риск развития сердечной аритмии при получении андроген-угнетающей терапии дегареликсом по сравнению с Lupron.
Соотношение частот возникновения заболеваний коронарных артерий по BMI в CS21 - Дегареликс против Лейпролида
Эти результаты показывают, что субъекты, которых лечили, с BMI менее чем 25 кг/м2, например 20-25 кг/м2, имели значительно сниженный риск развития заболевания коронарных артерий при получении андрогенугнетающей терапии дегареликсом по сравнению с Lupron.
Соотношение частот возникновения расстройств сердечной деятельности (SOC) по BMI в CS21 - Дегареликс против Лейпролида
Эти результаты показывают, что субъекты, которых лечили, с BMI менее чем 30 кг/м2 (например менее чем 25 кг/м2, например 20-25 кг/м2) имели значительно сниженный риск развития расстройств сердечной деятельности при получении андроген-угнетающей терапии дегареликсом по сравнению с Lupron.
Соотношение частот возникновения сердечных аритмий по уровню холестерина в CS21 - Дегареликс против Лейпролида
Эти результаты показывают, что субъекты, которых лечили, с уровнем холестерина большим или равным 4 ммоль/л имели значительно сниженный риск развития сердечных аритмий при получении андроген-угнетающей терапии дегареликсом по сравнению с терапией GnRH-антагонистом Lupron.
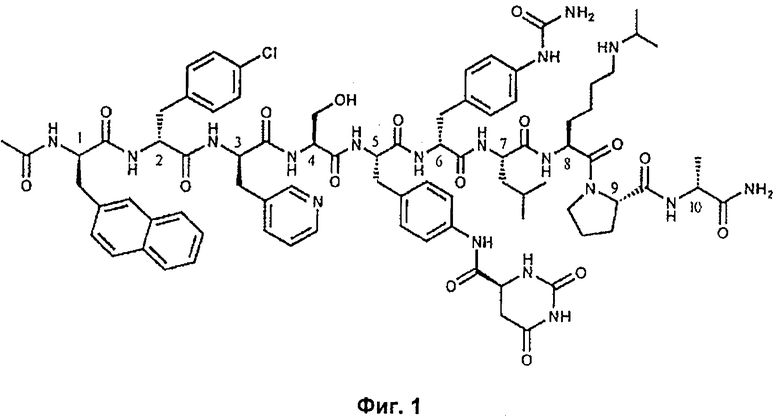

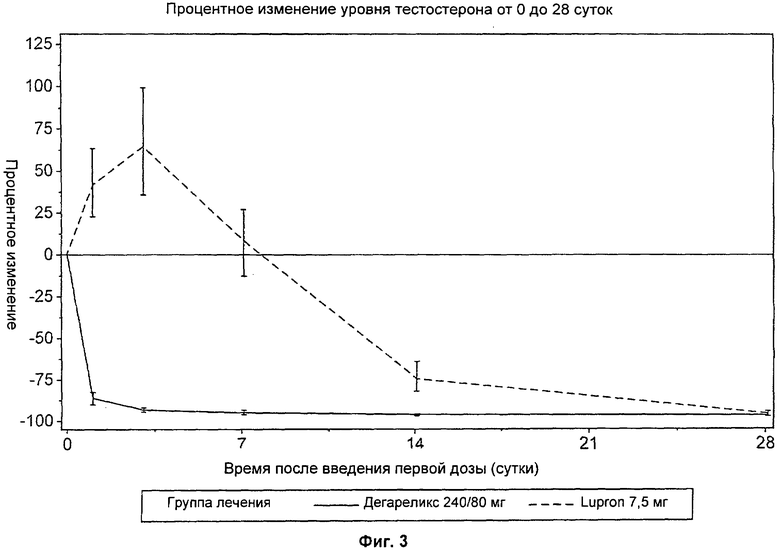
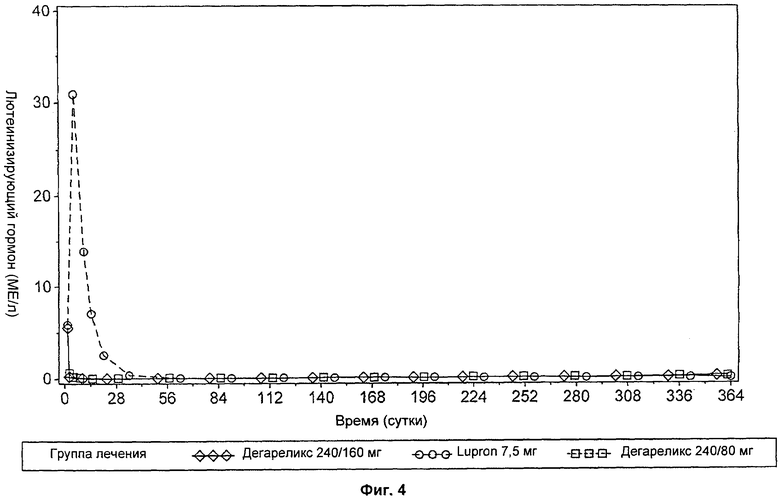
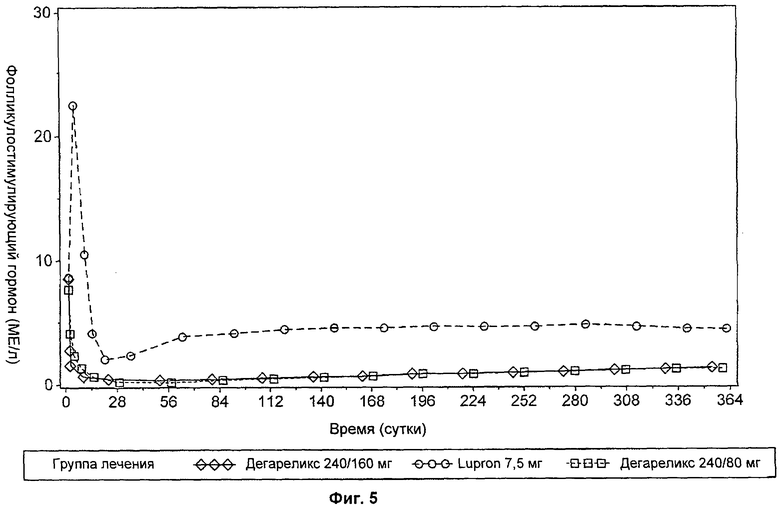
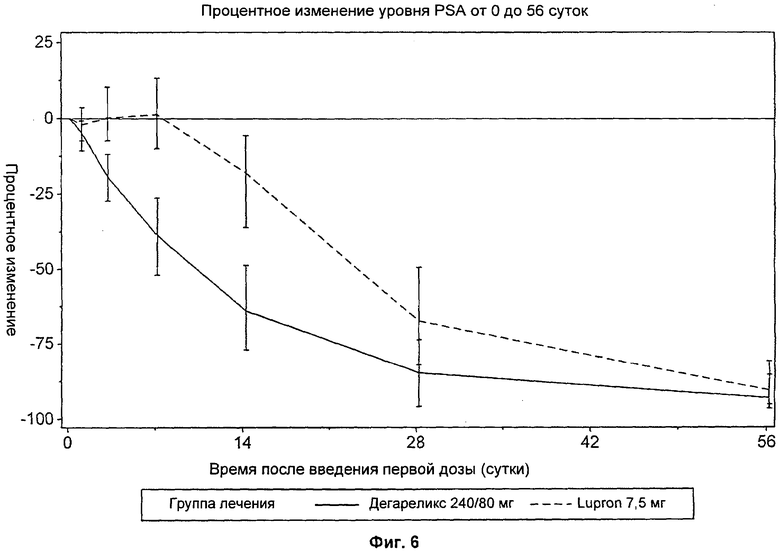
Группа изобретений относится к медицине, в частности к онкологии. Для лечения у субъекта рака предстательной железы осуществляют введение указанному субъекту дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток. Данное лечение обеспечивает пониженную частоту и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции, причем указанный побочный эффект выбран из сердечно-сосудистого и/или сосудистого побочного эффекта, скелетно-мышечного расстройства и/или заболевания соединительной ткани и расстройства мочевыводящей или почечной системы. 2 н. и 13 з.п. ф-лы, 23 табл., 6 ил., 1 прим.
1. Способ лечения у субъекта рака предстательной железы, включающий введение указанному субъекту дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток, где указанное лечение обеспечивает пониженную частоту и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции, и где указанный побочный эффект выбран из сердечно-сосудистого и/или сосудистого побочного эффекта, скелетно-мышечного расстройства и/или заболевания соединительной ткани и расстройства мочевыводящей или почечной системы.
2. Способ по п.1, где субъект имеет по меньшей мере 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл к 28 суткам лечения; и/или где субъект имеет по меньшей мере 95%-ную вероятность поддержания терапевтически низкого уровня сывороточного тестостерона меньшим или равным 0,5 нг/мл на 28-365 сутки лечения; и/или где субъект имеет по меньшей мере 30%-ное снижение или по меньшей мере 50%-ное снижение уровня простатоспецифичного антигена (PSA) к 14 суткам лечения; и/или где субъект имеет по меньшей мере 60%-ное снижение или по меньшей мере 75%-ное снижение уровня простатоспецифичного антигена (PSA) к 28 суткам лечения; и/или для лечения с по меньшей мере 80%-ной вероятностью поддержания уровня простатоспецифичного антигена (PSA) при менее чем 5 нг/мл во время лечения.
3. Способ по п.1, где указанный сердечно-сосудистый и/или сосудистый побочный эффект представляет собой одно или более одно из следующего: инфаркт миокарда, боль в груди, нарастание боли в груди, шум в сердце, нарастание шума в сердце, ишемия миокарда, атриовентрикулярная блокада, тромбоз глубоких вен (DVT), сердечная аритмия, заболевание коронарных артерий и/или расстройство сердечной деятельности.
4. Способ по п.1, где указанное скелетно-мышечное расстройство и/или заболевание соединительной ткани представляет собой артралгию и/или скелетно-мышечную скованность.
5. Способ по п.4 для лечения субъекта с локально распространенным раком предстательной железы или для лечения субъекта возрастом менее 65 лет.
6. Способ по п.1, где указанное расстройство мочевыводящей или почечной системы представляет собой повышение мочевой ретракции и/или инфекцию мочевыводящих путей, например неинфекционный цистит.
7. Способ по п.6 для лечения субъекта с локально распространенным раком предстательной железы.
8. Способ по п.1 для лечения субъекта с индексом массы тела (BMI) менее чем 30 кг/м2, например для лечения субъекта с индексом массы тела (BMI) от 20 до 30 кг/м2, например от 20 до 25 кг/м2; и/или для лечения субъекта с уровнем холестерина большим или равным 4 ммоль/л.
9. Способ по п.1, где частота и/или вероятность возникновения побочного эффекта, отличного от побочного эффекта, связанного с местом инъекции и/или введения, снижена по сравнению с частотой и/или вероятностью возникновения такого побочного эффекта, ассоциированного с лечением агонистом гонадотропин-высвобождающего гормона (GnRH) лейпролидом.
10. Способ лечения рака предстательной железы у субъекта, имеющего повышенную вероятность развития сердечно-сосудистого заболевания или расстройства, включающий введение указанному субъекту дегареликса в начальной дозе от 160 до 320 мг и затем в поддерживающей дозе от 60 до 160 мг один раз в каждые 20-36 суток.
11. Способ по п.10, включающий введение дегареликса в начальной дозе приблизительно 240 мг и в поддерживающей дозе приблизительно 80 мг дегареликса один раз в каждые приблизительно 28 суток лечения и возможно дополнительно включающий, перед указанным введением дегареликса, стадию идентификации подходящего субъекта, имеющего рак предстательной железы и имеющего риск развития сердечно-сосудистого заболевания или расстройства.
12. Способ по п.10 или 11, где сердечно-сосудистое заболевание или расстройство представляет собой шум в сердце, атриовентрикулярную блокаду или ишемию миокарда; и/или для лечения субъекта, имеющего индикатор повышенного и/или высокого риска развития сердечно-сосудистого заболевания.
13. Способ по п.12, где индикатор повышенного риска развития сердечно-сосудистого заболевания представляет собой одно или более чем одно из следующего: высокое кровяное давление, высокий уровень холестерина в липопротеинах низкой плотности, низкий уровень холестерина в липопротеинах высокой плотности, высокий уровень сывороточной глюкозы и привычка курения.
14. Способ по п.13 для лечения субъекта с кровяным давлением большим или равным 130 на 85 мм рт.ст.; и/или для лечения субъекта, ежедневно курящего сигареты; и/или для лечения субъекта с уровнем холестерина в липопротеинах низкой плотности большим или равным приблизительно 160 мг/дл; и/или где субъект имеет уровень холестерина в липопротеинах высокой плотности менее чем 35 мг/дл; и/или для лечения субъекта с уровнем глюкозы натощак более чем приблизительно 120 мг/дл; и/или где индикатором высокого риска для сердечно-сосудистого заболевания является одно или более чем одно из следующего: высокий уровень сывороточного C-реактивного белка (CRP), высокий уровень сывороточного гомоцистеина, высокий уровень сывороточного фибриногена и высокий уровень сывороточного липопротеина (a) (Lp(a)); и/или для лечения субъекта с уровнем C-реактивного белка более чем 3 мг/дл; и/или для лечения субъекта с уровнем сывороточного гомоцистеина более чем 30 мкмоль/л; и/или для лечения субъекта с уровнем сывороточного фибриногена более чем 7,0 г/л; и/или для лечения субъекта с уровнем сывороточного Lp(a) более чем 30 мг/дл.
15. Способ по п.10 для лечения субъекта с индексом массы тела менее чем 30 кг/м2; и/или для лечения субъекта с индексом массы тела менее чем 25 кг/м2; и/или для лечения субъекта с индексом массы тела от 20 до 30 кг/м2, предпочтительно от 20 до 25 кг/м2; и/или для лечения субъекта с уровнем холестерина большим или равным 4 ммоль/л.
| PRINCIVALLE M | |||
| et al | |||
| Rapid suppression of plasma testosterone levels and tumor growth in the dunning rat model treated with degarelix, a new gonadotropin-releasing hormone antagonist | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| PMID: 17170469 | |||
| МИКРОЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ СОЛИ ПЕПТИДОВ С ПОЛИЭФИРАМИ, ИМЕЮЩИМИ КОНЦЕВЫЕ КАРБОКСИГРУППЫ, И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ | 1993 |
|
RU2152225C1 |
| Камерная плита для фильтрпресса | 1988 |
|
SU1551395A1 |
| US 20060234918 A1, 19.10.2006. | |||
Авторы
Даты
2014-01-20—Публикация
2009-02-10—Подача