Изобретение касается нового способа получения хлорида натрия.
Хлорид натрия изготавливают в промышленном масштабе из водных растворов, полученных растворением природного источника хлорида натрия в воде и кристаллизацией из образовавшегося водного раствора хлорида натрия путем выпаривания воды, которое обычно осуществляют, используя выпарные аппараты, многокорпусные или с термокомпрессией вторичного пара. Многокорпусные системы обычно содержат три или более последовательно соединенных испарительных камеры с принудительной циркуляцией. В многокорпусной системе пар, генерируемый в каждом выпарном аппарате, подается в последующий выпарной аппарат для повышения энергетической отдачи. Выпарные аппараты с термокомпрессией вторичного пара и принудительной циркуляцией состоят из кристаллизатора, компрессора и парового скруббера. Водный раствор хлорида натрия (солевой раствор) поступает в камеру кристаллизатора, где соль кристаллизуется. Пар отводят, очищают и сжимают для повторного использования в нагревателе.
Как рекомпрессионные выпарные аппараты, так и многокорпусные выпарные аппараты являются энергоемкими, поскольку включена стадия выпаривания воды. Кроме того, солевой раствор, полученный растворением природного источника хлорида натрия в воде, обычно содержит большое количество основных загрязнений. Указанные загрязнения в солевом растворе, полученном из природного источника, включают, среди прочего, ионы калия, бромидные, магния, кальция, стронция и сульфатные. Во многих областях применения, таких как в индустрии химических превращений (например, хлорной и хлоратной промышленности), где используемое оборудование является чрезвычайно чувствительным, такие загрязнения должны быть в значительной степени удалены.
Самый распространенный технологический прием, позволяющий решить вышеуказанные проблемы, состоит в очистке сырьевого солевого раствора перед подачей в выпарную установку. Однако, обычно, очистка солевого раствора не удаляет или не понижает K- и Br-загрязнение.
Кроме того, вследствие очистки солевого раствора, в очищенном солевом растворе будут присутствовать диоксид углерода, бикарбонат и карбонат. В ходе испарительной кристаллизации в общепринятых выпарных аппаратах (многокорпусные установки или установки с термокомпрессией вторичного пара, обычно эксплуатируемые при повышенной температуре) может образовываться накипь из CaSO4∙xH2O, SrCO3 и CaCO3, в особенности, на поверхности теплообменников. Вследствие такой накипи производственная мощность завода по производству поваренной соли со временем понижается, равно как и энергетическая отдача процесса. После эксплуатационного периода, характерного для наличия большого количества загрязнений в водном растворе и схемы стандартной технологии, выпарная установка нуждается в очистке, а значит, коэффициент использования завода по производству поваренной соли также снижается.
Поскольку существующая технология требует значительных энергетических затрат и цены на электроэнергию существенно возрастают с течением времени, необходим способ производства хлорида натрия с меньшим электропотреблением.
Avram и др. в "Technologies for eutectic freeze crystallization", Rev. Chim., том 55 (10), 2004, стр. 769-772 описывают эвтектическую кристаллизацию вымораживанием как способ разделения водного раствора на лед и отвержденный раствор. Упоминается, что эвтектическая кристаллизация вымораживанием, в основном, применима для обработки сточной воды, содержащей неорганические соли.
Habib и Farid в "Heat transfer and operating conditions for freeze concentration in a liquid-solid fluidized bed heat exchanger", Chemical Engineering and Processing, том 45, 2006, стр. 698-710 описывают способ концентрирования вымораживанием, согласно которому жидкости концентрируют вымораживанием воды. Конкретнее, описана стадия охлаждения, которой подвергают водный раствор, содержащий 8% масс. NaCl или менее, внутри отдельного трубчатого теплообменника с псевдоожиженным слоем с образованием льда. Данным способом получают концентрат, обогащенный растворенными веществами.
Документ США 3779030 касается способа изготовления концентрата хлорида натрия из морской воды. В разделе 1, строки 59-67, поясняется принцип эвтектического вымораживания. Однако по данному способу образуются кристаллы льда, обеспечивающие источник пресной воды, и морская вода лишь только концентрируется.
Солевые растворы, упомянутые в данных документах, предназначены для получения льда, который, например, может быть полезен для районов с нехваткой питьевой воды. Однако, указанные растворы не пригодны для крупномасштабного производства хлорида натрия.
Stepakoff и др. в Desalination, том 14, 1974, стр. 25-38 описывают способ, включающий непрерывное замораживание солевого раствора в морозильном танке с перемешиванием путем прямого контакта с несмешивающимся холодильным агентом до достижения температуры эвтектики. Конкретнее, солевой раствор охлаждают прямым охлаждением с помощью фреона R-114, так что при -6°F сосуществует пять фаз: а именно, лед, солевой раствор, дигидрат, жидкий фреон и фреон в виде пара. Упоминается, что такой способ эвтектического вымораживания вносит существенный вклад в проблему утилизации отходов, будь то промышленные сточные воды или солоноватые воды. Однако, сырьевые потоки, используемые Stepakoff'ом и др., равно как описанный способ эвтектического вымораживания не пригодны для применения в крупномасштабном производстве хлорида натрия.
Документ GB 1009736 описывает способ получения очищенной безводной соли - хлорида натрия - из запасов относительно чистой безводной соли. Согласно данному способу, обеспечивают циркуляцию или прохождение насыщенного солевого раствора через подводимую соль, получая, таким образом, суспензию. Температуру смеси соли и солевого раствора поддерживают от 32,2°F и до -6,02°F включительно, чтобы растворить загрузочную соль и получить дигидрат указанной соли. Затем полученную таким образом суспензию солевой раствор-дигидрат подвергают операции нагревания с целью плавления дигидрата с образованием избытка очищенной безводной соли, осаждающейся из соответствующего солевого раствора. Избыточную безводную соль отделяют от выпускаемого продукта, тогда как соответствующий солевой раствор возвращают к подводимой загрузочной соли для повторения процесса.
Способ по GB 1009736 может быть использован только для твердой безводной сырьевой соли. Указанный способ не приемлем для производства безводной соли - хлорида натрия - при добыче растворением. Другой недостаток данного способа состоит в том, что циркулирующий солевой раствор становится избыточно загрязненным примесями, извлеченными из подводимой загрузочной соли, так что солевой раствор должен быть либо выброшен и заменен, либо обработан химически для поддержания в пригодной для эксплуатации форме.
Задача данного изобретения состоит в разработке способа получения хлорида натрия, который мог бы быть осуществлен в промышленном масштабе, являться менее энергоемким, чем общепринятые способы получения соли выпариванием, и быть пригодным для производства соли, где источником соли является подземное месторождение соли, разрабатываемое путем добычи растворением. Другая задача данного изобретения состоит в получении хлорида натрия заданной чистоты, не требующем стадии очистки солевого раствора. Заданная чистота хлорида натрия выше либо равна чистоте соли того же самого солевого раствора после общепринятой очистки и общепринятых стадий испарительной кристаллизации. Как правило, чистота выше, в том смысле, что концентрация K и Br в полученной соли является более низкой. Еще одна задача данного изобретения состоит в разработке способа получения хлорида натрия, по которому очистка от шлама может быть сведена к минимуму.
Неожиданно было обнаружено, что указанные задачи удается реализовать способом, по которому условия эксплуатации включают специальную стадию понижения температуры. Более конкретно, способ получения хлорида натрия по данному изобретению включает стадии:
(i) получение солевого раствора с концентрацией хлорида натрия выше, чем концентрация хлорида натрия в точке эвтектики, но ниже, чем концентрация хлорида натрия в насыщенном солевом растворе, путем растворения источника хлорида натрия в воде;
(ii) охлаждение полученного солевого раствора путем охлаждения с промежуточным холодоносителем в самоочищающемся теплообменнике с псевдоожиженным слоем/кристаллизаторе до температуры ниже 0°C, но выше температуры эвтектики полученного солевого раствора, и, тем самым, получение суспензии, включающей дигидрат хлорида натрия и маточный раствор;
(iii) подача дигидрата хлорида натрия в установку для рекристаллизации с образованием хлорида натрия и маточного раствора, и
(iv) рециркуляция, по меньшей мере, части маточного раствора, полученного на стадии (ii) и/или стадии (iii), на стадию (i).
Способ по данному изобретению менее энергоемкий, чем общепринятые способы выпаривания. Основное снижение затрат энергии возникает за счет разницы между теплотой кристаллизации и теплотой испарения, даже когда применяется многократное использование пара. Кроме того, в случае рассматриваемого способа больше нет необходимости в очистке сырьевого солевого раствора перед стадией кристаллизации. Более конкретно, в общепринятых способах получения, где хлорид натрия получают из солевого раствора выпариванием воды, плохо растворимые твердые отходы типа Mg(OH)2, CaSO4∙xH2O, SrCO3 и CaCO3 кристаллизуются из сырьевого солевого раствора первыми и затем отбрасываются. Если такую обработку по очистке солевого раствора не выполнять, хлорид натрия, полученный на стадии кристаллизации выпариванием воды, будет сильно загрязнен Mg, Ca и Sr в той или иной форме. Для такой обработки по очистке солевого раствора требуется значительное количество химикатов для очистки солевого раствора.
Такая обработка по очистке является излишней в способе по данному изобретению. После того как неочищенный сырьевой солевой раствор подвергают стадии кристаллизации с получением дигидрата хлорида натрия и последующей стадии рекристаллизации, получают хлорид натрия с такой же или даже большей чистотой, чем чистота соли, хлорида натрия, полученной из такого же солевого раствора, но с использованием общепринятого способа выпаривания, включающего стадию очистки указанного солевого раствора.
Кроме того, концентрация K и Br в солевом растворе не изменяется при вышеуказанной обработке по очистке солевого раствора, а снижается лишь путем кристаллизации. Представленный способ включает две стадии кристаллизации по сравнению с одной стадией кристаллизации в общепринятых способах.
Преимущества нового способа состоят, таким образом, в том, что полученный хлорид натрия содержит более низкие уровни K и Br и что можно избежать очистки от шлама из Mg(OH)2, CaSO4∙xH2O, SrCO3 и CaCO3. Кроме того, ни капитальные вложения, ни профилактический ремонт, ни затраты на очищающие химические реагенты, ни трудовые ресурсы для очистки солевого раствора не требуются.
Другое главное преимущество способа по данному изобретению состоит в том, что все примеси, присутствующие в сырьевом солевом растворе, могут быть возвращены в каверны, из которых первоначально добывают солевой раствор, что также делает указанный способ более экологически благоприятным, чем общепринятые способы получения соли.
Еще одно преимущество данного способа состоит в том, что поскольку способ представляет собой низкотемпературный процесс, ожидается более низкая коррозия и возможность применения более дешевых конструкционных материалов.
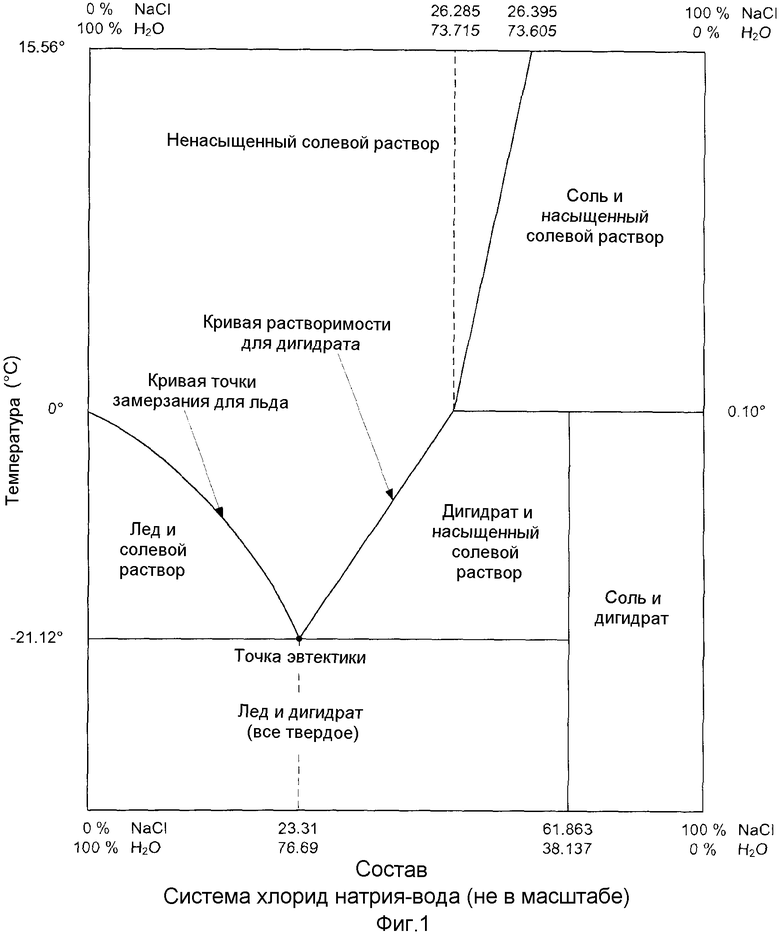
В контексте данной заявки следует отметить, что "эвтектическая температура" означает температуру, при которой происходит кристаллизация эвтектической смеси. Кроме того, термин "эвтектическая смесь" имеет нормальный дополнительный оттенок значения, то есть означает смесь некоторых компонентов в таких соотношениях, что точка плавления имеет наиболее низкий возможный уровень и что, кроме того, такие компоненты кристаллизуются из раствора при указанной температуре одновременно. Температура, при которой происходит кристаллизация эвтектической смеси, носит название "эвтектическая температура", и состав и температура, при которых происходит кристаллизация эвтектической смеси, носят название "эвтектическая точка" (см., например, фиг.1). Чистый водный раствор хлорида натрия имеет эвтектическую точку при -21,12°C и 23,31% масс. хлорида натрия (Dale W. Kaufmann, Sodium Chloride, The Production and Properties of Salt and Brine, Hafner Publishing Company, New York, 1968, p. 547). В этом отношении также может быть сделана ссылка на фиг.1. Следует отметить, что примеси в солевом растворе будут влиять на температуру и/или состав, при которых происходит кристаллизация эвтектической смеси (также иногда именуемых точкой эвтектики).
Исходя из чистого водного раствора хлорида натрия при 20°C, можно выделить три композиционных области:
1. 0-23,31% масс. хлорида натрия
2. 23,31-26,29% масс. хлорида натрия
3. ≥26,29% масс. хлорида натрия - насыщенный раствор хлорида натрия, где все массы приведены в расчете на суммарный солевой раствор.
Охлаждение 0-23,31% масс. ненасыщенного солевого раствора дает лед при температуре приблизительно от 0°C до -21,12°C. Поскольку чистая вода в форме льда удаляется из системы, оставшийся солевой раствор становится более концентрированным. Дальнейшее охлаждение дает дополнительное количество льда и солевой раствор, который является еще более концентрированным. Наконец, при -21,12°C достигается точка эвтектики; помимо льда образуется дигидрат хлорида натрия, и, в конечном счете, весь солевой раствор становится твердым при достаточном отведении тепла.
Охлаждение 23,31-26,29% масс. ненасыщенного солевого раствора приводит к образованию дигидрата при температуре приблизительно от 0,10°C до -21,12°C. Поскольку в системе образуется чистый дигидрат (который содержит больше (~62% масс.) NaCl, чем солевой раствор), оставшийся солевой раствор становится менее концентрированным. Дальнейшее охлаждение приводит к образованию дополнительного количества дигидрата, и, в результате, солевой раствор становится еще менее концентрированным. Наконец, при -21,12°C достигается точка эвтектики, где в дополнение к дигидрату хлорида натрия также образуется лед, и, в конечном счете, весь солевой раствор становится твердым при достаточном отведении тепла.
Охлаждение солевого раствора, содержащего более 26,29% масс. хлорида натрия, сначала приводит к образованию некоторого количества безводного NaCl (нормальная соль), и вплоть до 0,10°C достигается слегка менее концентрированный солевой раствор. При указанной температуре кристаллизованный чистый ангидрат (NaCl) превращается в дигидрат. Затем происходит тот же процесс, что описан для охлаждения 23,31-26,29% масс. водного раствора хлорида натрия.
Подчеркнуто еще раз, что вышеупомянутые температуры и композиционные области относятся к чистому солевому раствору NaCl. Если в солевом растворе присутствуют примеси, указанные температуры и области могут слегка отличаться.
Согласно данному изобретению, на стадии понижения температуры (ii) солевой раствор предпочтительно охлаждать до температуры, немного выше температуры эвтектики указанного раствора. Термин "немного выше температуры эвтектики указанного раствора" означает температуру, более высокую, чем температура эвтектики. На практике, термин "немного выше температуры эвтектики указанного раствора" означает температуру на "0,01°C или немного выше температуры эвтектики указанного раствора". Охлаждение до температуры, немного выше эвтектической, позволяет избежать нежелательного образования льда. В зависимости от ограничений способа может быть целесообразно охлаждать до температуры, не столь близкой к точке эвтектики, а прекращать охлаждение при любой температуре в диапазоне между началом образования ангидрата и/или дигидрата и температурой эвтектики. Более конкретно, солевой раствор на стадии понижения температуры (ii) более предпочтительно охлаждать до температуры на 0,1°C, еще предпочтительней 0,5°C и, наиболее предпочтительно, 1°C выше температуры эвтектики.
На стадии охлаждения (ii) солевой раствор целесообразно охлаждать до температуры ниже начала кристаллизации ангидрата и/или дигидрата. Практически, сказанное означает, что солевой раствор охлаждают до температуры ниже, чем 0,1°C (абсолютная величина). Предпочтительно охлаждать до температуры на 14°C выше температуры эвтектики или более низкой. Более предпочтительно, для увеличения выхода, охлаждать солевой раствор до температуры на 11°C выше температуры эвтектики или более низкой. Наиболее предпочтительно охлаждать до температуры на 7°C выше температуры эвтектики или более низкой.
При этом отмечено, что потребляемая энергия на стадии охлаждения (ii) по данному изобретению используется только на охлаждение потока солевого раствор и образование кристаллов дигидрата, таким образом, потребляемая энергия сравнительно низкая.
Кроме того, установлено, что энергия, затраченная на рециркуляцию маточного раствора в подземное месторождение соли, может быть ограниченной или существенной, в зависимости от расстояния до месторождения соли. Сказанное означает, что, в целом, существует значительный временной интервал, за который, согласно данному способу (включая рециркуляцию солевого раствора), затрата энергии много меньше, чем в общепринятых способах производства соли выпариванием (включая подачу солевого раствора), на тонну вырабатываемой соли.
Кроме того, установлено, что никакой стадии разделения, которая существует в случае способа эвтектической кристаллизации вымораживанием, не требуется для отделения льда от дигидрата хлорида натрия.
Кроме того, согласно данному изобретению все образование и, таким образом, возможное появление отложений льда на внутренних стенках камеры, используемой в способе получения соли, предупреждается привлекательным образом, что позволяет выполнять процесс в непрерывном режиме без необходимости в предотвращении образования ледяных отложений. Установлено, что разница температур между температурой (в массе) солевого раствора, подвергаемого стадии кристаллизации, и температурой холодоносителя, присутствующего с другой стороны стенок реактора, может быть значительно больше, чем в случае эвтектического вымораживания. В случае эвтектического вымораживания максимальное различие температур является обычно столь низким, как 1,0-1,5°C, для сведения к минимуму риска обмерзания реактора. По данному способу максимальное различие температур обычно в 2-3 раза больше, что делает способ более эффективным.
Далее способ будет описан более подробно. На первой стадии (i) солевой раствор получают растворением источника хлорида натрия в воде. Следует отметить, что термин "источник хлорида натрия", использованный в данном документе, как подразумевается, означает все источники соли, в которых содержится более 50% масс. NaCl. Предпочтительно, такая соль содержит более 75% масс. NaCl. Более предпочтительно, содержания соли составляют свыше 85% масс. NaCl, тогда как содержание соли свыше 90% масс. NaCl является наиболее предпочтительным. Соль может представлять собой садочную морскую соль (соль, полученную выпариванием воды из морской воды с использованием солнечного тепла), каменную соль или подземное месторождение соли. Предпочтительно, источником соли является подземное месторождение соли, разрабатываемое добычей растворением (здесь также именуемое технологическая каверна солевого раствора).
Что касается воды в рассматриваемом способе, можно использовать любое водоснабжение, обычно применяемое в общепринятых способах кристаллизации соли, например, воду из поверхностных водоисточников, подземную воду или питьевую воду.
Солевой раствор, полученный на первой стадии способа по данному изобретению, имеет концентрацию хлорида натрия, которая выше, чем концентрация хлорида натрия в точке эвтектики. Однако солевой раствор на стадии (i) имеет концентрацию хлорида натрия, которая ниже, чем концентрация хлорида натрия в насыщенном растворе хлорида натрия (здесь далее также именуемый почти насыщенный раствор хлорида натрия).
Как правило, концентрация хлорида натрия солевого раствора, полученного на первой стадии данного способа, отвечает концентрации хлорида натрия, которая, по меньшей мере, на 0,01% масс. хлорида натрия (из расчета на общую массу указанного солевого раствора) выше эвтектической концентрации (т.е. концентрации хлорида натрия в указанном солевом растворе в точке эвтектики). Предпочтительно, указанный солевой раствор имеет концентрацию, которая, по меньшей мере, на 0,1% масс., более предпочтительно, по меньшей мере, на 1% масс. или, еще предпочтительней, по меньшей мере, на 2% масс. более концентрированная по содержанию хлорида натрия, чем эвтектическая концентрация.
В предпочтительном варианте осуществления данного изобретения солевой раствор, полученный на первой стадии способа по данному изобретению, является почти насыщенным раствором хлорида натрия. Подразумевается, что почти насыщенный раствор хлорида натрия означает раствор хлорида натрия с концентрацией хлорида натрия, достаточно низкой для того, чтобы избежать нежелательных образований отложений хлорида натрия на оборудовании, с которым указанный раствор контактирует, но близкой к насыщению. Как понятно специалисту в данной области, невозможно определить "почти насыщенный раствор хлорида натрия", указав одну конкретную концентрацию хлорида натрия, поскольку количество хлорида натрия, которое будет растворимо в насыщенном растворе хлорида натрия, зависит от количества примесей, присутствующих в указанном солевом растворе. Как правило, однако, почти насыщенным раствором хлорида натрия является раствор, который может быть получен из соответствующего насыщенного раствора хлорида натрия добавлением ровно такого количества воды, которое необходимо, чтобы избежать нежелательных образований отложений хлорида натрия на оборудовании во время технологической обработки, которое обычно составляет, по меньшей мере, 0,5% масс. воды и, предпочтительно, отвечает диапазону от 0,5 до 1,5% масс. воды из расчета на общую массу насыщенного раствора хлорида натрия. Другими словами, солевой раствор, полученный на первой стадии способа по данному изобретению, является солевым раствором, который содержит не более 99,5% масс., более предпочтительно, не более 99,0% масс. и, наиболее предпочтительно, не более 98,5% масс. хлорида натрия, растворенного в указанном солевом растворе, когда раствор является насыщенным по хлориду натрия. Солевой раствор, подвергаемый стадии охлаждения (ii), является не суспензией, а прозрачным солевым раствором, т.е. солевым раствором, не включающим никаких количеств твердого хлорида натрия, видимых невооруженным глазом.
Охлаждение солевого раствора на стадии (ii) согласно способу по данному изобретению осуществляют путем охлаждения с промежуточным холодоносителем. Под "охлаждением с промежуточным холодоносителем" подразумевается, что условия эксплуатации включают способы охлаждения, где холодоноситель не находится в прямом контакте с солевым раствором. Более конкретно, холодоноситель содержится в замкнутой системе, и солевой раствор, предназначенный для охлаждения, физически полностью отделен от холодоносителя непроницаемой стенкой (например, трубы). Охлаждение с промежуточным холодоносителем используют, поскольку в таком случае полностью предупреждается загрязнение выпускаемого хлорида натрия следами холодоносителя, и можно привлекательным образом избежать дополнительных стадий очистки. Холодоносителем могут являться один или несколько хладагентов, таких как аммиак, бутан, диоксид углерода или фреон, либо жидкость или смесь жидкостей, не характеризующаяся фазовым превращением при теплообмене, такая как смесь этиленгликоль/вода, смесь хлорид кальция/вода, смесь формиат калия/вода, алкилзамещенные ароматические соединения (например, Dowtherm J от Dow Chemical Company) или полидиметилсилоксан. Охлаждение солевого раствора с промежуточным холодоносителем предпочтительно обеспечивается либо выпариванием с падающей пленкой, либо посредством замкнутой системы с холодоносителем (т.е. с помощью жидкости без фазового превращения при теплообмене). Если охлаждение с промежуточным холодоносителем достигается с помощью жидкости без фазового превращения при теплообмене, указанный холодоноситель охлаждают, используя хладагент, и впоследствии холодоноситель отдает холод солевому раствору через непроницаемую стенку и подвергается рециркуляции для повторного охлаждения с использованием указанного хладагента.
Согласно данному изобретению, охлаждение с промежуточным холодоносителем предпочтительно обеспечивается с замкнутой системы, в которой солевой раствор физически полностью отделен от холодоносителя, выбираемого из группы, состоящей из: аммиака, бутана, диоксида углерода, фреона, смеси этиленгликоль/вода, смеси хлорид кальция/вода, смеси формиат калия/вода, алкилзамещенных ароматических соединений и полидиметилсилоксана, посредством непроницаемой стенки. В другом предпочтительном варианте осуществления данного изобретения охлаждение с промежуточным холодоносителем достигается путем выпаривания с падающей пленкой холодоносителя, выбранного из группы, состоящей из: аммиака, бутана, диоксида углерода и фреона.
Охлаждение с промежуточным холодоносителем на стадии (ii) способа по данному изобретению проводят в самоочищающемся теплообменнике с псевдоожиженным слоем/кристаллизаторе для поддержания стенок, по существу, свободными от отложений. Под термином "самоочищающийся теплообменник с псевдоожиженным слоем/кристаллизатор" понимают вертикальный кожухотрубный теплообменник, снабженный дополнительным устройством для поддержания стенок свободными от отложений. Например, в трубах теплообменника поддерживают псевдоожиженный слой частиц стали (в технологическом потоке). Такой теплообменник был, например, описан в документе США 7141219. Явное преимущество теплообменника с псевдоожиженным слоем/кристаллизатора состоит в том, что указанное оборудование включает значительно меньше механических частей, чем скребковый кристаллизатор с охлаждаемой стенкой, что делает указанный теплообменник менее дорогостоящим, чем скребковый кристаллизатор с охлаждаемой стенкой. В особенности для крупномасштабного производства указанный теплообменник обеспечивает значительную экономию затрат. Кроме того, теплообменник с псевдоожиженным слоем/кристаллизатор характеризуется повышенной эксплутационной надежностью по сравнению со скребковым кристаллизатором с охлаждаемой стенкой. К тому же, значительно большие скорости теплопередачи, обычно получаемые в теплообменнике с псевдоожиженным слоем, по сравнению с обычным теплообменным оборудованием приводят к существенному сокращению размера теплообменного оборудования при заданном режиме работы. Кроме того, запуск и контроль сравнительно легки.
Стадию охлаждения преимущественно осуществляют при давлении, по меньшей мере, 0,3 бар, предпочтительно, по меньшей мере, 0,5 бар и, наиболее предпочтительно, по меньшей мере, 0,7 бар. Желательно, чтобы давление было не выше 7 бар и, более предпочтительно, не выше 5 бар. Наиболее предпочтительно, способ осуществляют при атмосферном давлении, повышенном лишь за счет статистического давления и динамического давления, создаваемого циркуляционным насосом.
В одном из вариантов осуществления данного изобретения, первую стадию охлаждения сырьевого солевого раствора приблизительно до 0°C осуществляют общепринятым способом, перед стадией охлаждения (ii). Более конкретно, такое охлаждение приблизительно до 0°C удобно выполнять в теплообменнике с псевдоожиженным слоем/кристаллизаторе, но более предпочтительно осуществлять указанную стадию в обычном теплообменнике, таком как кожухотрубный теплообменник или пластинчатый теплообменник. Затем охлажденный сырьевой солевой раствор может быть смешан с рециркулированной суспензией кристаллов или прозрачным маточным раствором для регулирования плотности суспензию и/или степени концентрирования маточного раствора. Охлажденный солевой раствор с необязательными кристаллами ангидрата и/или дигидрата хлорида натрия затем дополнительно охлаждают в теплообменнике с псевдоожиженным слоем/кристаллизаторе до температуры, приближающейся к эвтектической, но не достигающей температуры эвтектики, как описано выше, при кристаллизации дигидрата хлорида натрия. Такое охлаждение достигается путем охлаждения с промежуточным холодоносителем. Условия теплообмена предпочтительно выбирать такие, чтобы плотность суспензии, образуемой дигидратом хлорида натрия, не мешала правильному функционированию теплообменника с псевдоожиженным слоем/кристаллизатора. Затем полученную суспензию, включающую дигидрат хлорида натрия и маточный раствор, подвергают стадии разделения, на которой образовавшийся дигидрат хлорида натрия отделяют от маточного раствора.
Отделение маточного раствора от дигидрата хлорида натрия предпочтительно производят с применением одного или нескольких циклонов, или одного или нескольких декантаторов, необязательно комбинированных с одним или несколькими центрифугами или фильтрами.
Дигидрат хлорида натрия, отделенный от маточного раствора, может быть очищен перед использованием на стадии рекристаллизации. Указанный дигидрат хлорида натрия может быть очищен любым общепринятым способом, но, предпочтительно, с применением промывной колонны, в которой, предпочтительно, маточный раствор, полученный на стадии рекристаллизации, используют противоточно в качестве промывной жидкости.
На следующей стадии необязательно очищенный дигидрат хлорида натрия подают в установку для рекристаллизации для получения хлорида натрия и маточного раствора.
Предпочтительно, условия рекристаллизации выбирают так, чтобы получить стандартное распределение по размерам частиц стандартной непросеянной вакуумной соли (т.е. кристаллы имеют такое распределение частиц по размерам, что частицы задерживаются ситом около 100 мкм, но проходят через сито 1000 мкм). Ограниченное перемешивание и небольшие различия в температуре относительно температуры перехода дигидрата хлорида натрия в ангидрат хлорида натрия (около 0,1°C) приводят к требуемому распределению частиц по размерам. Предпочтительно, рекристаллизацию выполняют в пробковом режиме потока для гарантии полного завершения рекристаллизации на выходе из секции рекристаллизации. Пробковый режим потока может быть также имитирован некоторым количеством последовательно соединенных установок для рекристаллизации, например, установками для непрерывной рекристаллизации из смешанной суспензии с удалением смешанного продукта (CMSMPR). Соль, образующуюся в результате рекристаллизации, отделяют от маточного раствора с помощью любых общепринятых устройств, предпочтительно гидроциклонов и центрифуг, и, необязательно, подвергают дальнейшей обработке. Как упомянуто, маточный раствор может быть впоследствии частично рециркулирован в качестве промывной жидкости в промывную колонну.
По меньшей мере, часть маточного раствора, полученного на стадии охлаждения (ii), рециркулируют на первую стадию, т.е. на стадию, где сырьевой солевой раствор получают растворением источника соли в воде. Поэтому целесообразно первую стадию выполнять в технологической каверне солевого раствора. Альтернативно, по меньшей мере, часть маточного раствора, полученного на стадии рекристаллизации (iii) дигидрата хлорида натрия, рециркулируют на первую стадию. Возможна также рециркуляция обоих маточных растворов (частично или полностью) на первую стадию. Полная рециркуляция как маточного раствора со стадии охлаждения (ii), так и маточного раствора со стадии рекристаллизации (iii) возвращает все примеси на место происхождения (т.е. в технологическую каверну солевого раствора) без вреда для окружающей среды. Следовательно, указанный вариант осуществления данного изобретения наиболее привлекателен в отношении экологической перспективы. Конечно, как следствие, качество сырьевого солевого раствора будет значительно хуже, чем в отсутствие такой рециркуляции. Неожиданно, однако, было обнаружено, что качество указанного сырьевого солевого раствора остается достаточным для производства высококачественной соли, поскольку кристаллизация и рекристаллизация дигидрата хлорида натрия дает соль с большей чистотой, чем в случае соли, полученной из такого же солевого раствора с применением общепринятых стадий очистки и испарительной кристаллизации.
Возможность рециркуляции маточного раствора в технологическую каверну в способе по изобретению составляет разительный контраст по сравнению с общепринятыми способами выпаривания, где, из соображений качества, рециркуляции маточных растворов в каверны выхода сырьевого солевого раствора избегают, по мере возможности, чтобы поддерживать концентрации примесей в сырьевом солевом растворе как можно ниже.
Загрязнения в сырьевых водных растворах хлорида натрия, полученных из природного источника, почти всегда включают сульфат-ионы. Наличие сульфат-ионов может оказывать отрицательное влияние на стадию рекристаллизации (т.е. стадию (iii) данного способа). Таким образом, предпочтительно, если свыше 0,08% масс. сульфат-ионов присутствует в солевом растворе, полученном растворением источника хлорида натрия в воде (т.е. стадия (i) данного способа), производят измерения, чтобы избежать выходящего хлорида натрия со слишком высокой концентрацией сульфатов. Более конкретно, при охлаждении солевого раствора, включающего сульфат-ионы, в конечном счете, образуется Na2SO4∙10H2O, здесь также именуемый глауберова соль. Растворимость глауберовой соли быстро понижается с понижением температуры. В результате, при охлаждении полученного солевого раствора путем охлаждения с промежуточным холодоносителем в самоочищающемся теплообменнике с псевдоожиженным слоем/кристаллизаторе до температуры ниже 0°C, но выше температуры эвтектики полученного солевого раствора, глауберова соль будет выкристаллизовываться из раствора вместе с дигидратом хлорида натрия. И поэтому, если свыше 0,08% масс. сульфат-ионов присутствует в солевом раствора, полученном растворением раствора хлорида натрия в воде, в предпочтительном варианте осуществления данного изобретения суспензию, полученную на стадии (ii), включающую, помимо дигидрата хлорида натрия и маточного раствора, также глауберову соль, подвергают стадии, на которой дигидрат хлорида натрия и глауберову соль физически отделяют друг от друга. Предпочтительно, указанное разделение выполняют, используя гидроциклон. Более подробно, суспензию, включающую дигидрат хлорида натрия, глауберову соль и маточный раствор, полученную на стадии (ii), подают в гидроциклон, получая обогащенный дигидратом хлорида натрия поток и обогащенный глауберовой солью поток. Обогащенный дигидратом хлорида натрия поток затем подвергают стадии рекристаллизации (т.е. стадии (iii) по данному способу). Обогащенный глауберовой солью поток, предпочтительно, по крайней мере, частично, рециркулируют на стадию (i). Под термином "обогащенный дигидратом хлорида натрия поток" понимают поток, содержащий свыше 50% масс. всего дигидрата хлорида натрия, присутствующего в суспензии, полученной на стадии (ii), перед тем, как суспензию подвергают указанной стадии разделения. Обогащенный глауберовой солью поток содержит свыше 50% масс. всей глауберовой соли, присутствующей в суспензии перед разделением.
Для указанной стадии может быть использован любой гидроциклон, обычно применяемый в способах производства соли.
Описанная выше дополнительная стадия способа еще более предпочтительна, если свыше 0,82% масс. сульфат-ионов присутствует в солевом растворе, полученном на стадии (i), и, наиболее предпочтительна, если свыше 1,2% масс. сульфат-ионов присутствует в солевом растворе, полученном на стадии (i) данного способа.
Способ по данному изобретению дополнительно иллюстрируется следующими неограничивающими примерами.
Пример 1
Порцию в 1,200 г 26% масс. раствора NaCl (полученного растворением соли фармакологической степени чистоты в деминерализованной воде при температуре окружающей среды) помещают в стеклянный сосуд с рубашкой и охлаждают, используя для охлаждения Syltherm 800. Ниже 0°C дигидрат хлорида натрия начинает кристаллизоваться. Охлаждение прекращают при -19°C. Образуется лишь одна твердая фаза. Когда перемешивание прекращают, кристаллы оседают на дне сосуда. Полученные кристаллы отделяют фильтрованием от маточного раствора. Маточный раствор анализируют на содержание NaCl (массовое), установлено, что указанный раствор содержит 23,6% масс. NaCl.
Кристаллы дигидрата хлорида натрия помещают в чашу и температуру поднимают до 10°C. Кристаллы начинают рекристаллизоваться в безводный хлорид натрия. Часть продукта хлорида натрия растворяется в выделенной кристаллической воде, таким образом, образуется некоторое количество насыщенного солевого раствора. Кристаллы, отделенные от солевого раствора фильтрованием через стеклянный фильтр, обладают высокой чистотой.
Пример 2
В емкости для испытаний 2,232 г сырьевого солевого раствора, полученного из коммерчески используемой технологической каверны солевого раствора (Хенгело, Нидерланды; солевой раствор, содержащий 25,9% масс. NaCl и, наряду с другими примесями, 1250 мг/кг Ca2+), охлаждают до -18°C в морозильной камере. Образуется твердая фаза, локализованная на дне емкости для испытаний. Указанная фаза содержит дигидрат хлорида натрия (NaCl∙2вод.). Образовавшиеся кристаллы удаляют фильтрованием при -18°C. Маточный раствор, анализируемый на содержание NaCl, содержит 23,7% масс. NaCl, что свидетельствует о том, что концентрация NaCl в маточном растворе, как ожидалось, все еще превышает эвтектическую концентрацию. Часть кристаллов промывают ледяной водой и повторно растворяют в 1,5-кратной массе чистой воды. Полученная концентрация кальция в кристаллах дигидрата хлорида натрия, определенная методом индуктивно связанной плазмы (ICP), равна 40 мг/кг.
Пример 3
Часть кристаллов дигидрата хлорида натрия, полученных по примеру 2, промывают ледяной водой для удаления адгезированного маточного раствора. Затем повторно нагревают до +10°C, чтобы вызвать рекристаллизацию. Точнее, кристаллы дигидрата хлорида натрия рекристаллизуются в указанных условиях в безводный NaCl ("нормальную" соль), суспендированный в насыщенном солевом растворе. Полученный твердый NaCl содержит 1,3 мг/кг Ca (установлено методом индуктивно связанной плазмы (ICP)).
Кальций является одной из основных примесей, которую необходимо удалять в операциях по химической очистке солевого раствора при общепринятом производстве вакуумной соли. Обычная вакуумная соль высокой чистоты содержит 1-10 мг/кг Ca в конечном продукте, часто свыше 3 мг/кг. Такой уровень Ca является результатом химической очистки солевого раствора и стадии кристаллизации.
Как показано выше, хлорид натрия, полученный способом по данному изобретению, имеет концентрацию Ca 1,3 мг/кг. Кроме того, качество соли, полученной способом по данному изобретению, по меньшей мере, эквивалентно качеству обычного продукта, а во многих случаях полученная соль даже чище обычного продукта. Указанная чистота получена без какой-либо химической очистки солевого раствора, путем использования двух указанных стадий кристаллизации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДА НАТРИЯ | 2009 |
|
RU2494044C2 |
| СПОСОБ И РЕАКТОР ДЛЯ ИЗВЛЕЧЕНИЯ ХЛОРИДА НАТРИЯ И ХЛОРИДА КАЛИЯ ИЗ ПОЛИМИНЕРАЛЬНЫХ ИСТОЧНИКОВ | 2018 |
|
RU2669622C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАТА КАЛИЯ, СУЛЬФАТА НАТРИЯ И ХЛОРИДА НАТРИЯ | 1995 |
|
RU2157791C2 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ СУЛЬФАТА КАЛИЯ ИЗ СУЛЬФАТА НАТРИЯ | 1994 |
|
RU2107028C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАТА КАЛИЯ И СУЛЬФАТА НАТРИЯ (ВАРИАНТЫ) | 1995 |
|
RU2176218C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАТА КАЛИЯ | 1994 |
|
RU2105717C1 |
| СПОСОБ ОБРАБОТКИ ОТХОДОВ В ВИДЕ СУЛЬФАТА НАТРИЯ | 1994 |
|
RU2108972C1 |
| Способ непрерывного синтеза 4-нитрозофенола | 2021 |
|
RU2762969C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАТА КАЛИЯ ИЗ ПОТАША И СУЛЬФАТА НАТРИЯ | 1999 |
|
RU2235065C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ СУЛЬФАТА И ХЛОРИДА НАТРИЯ ИЗ МИНЕРАЛИЗОВАННЫХ ВОД | 2004 |
|
RU2281258C2 |
Изобретение может быть использовано в химической промышленности. Способ получения хлорида натрия включает следующие стадии: (i) получения солевого раствора с концентрацией хлорида натрия выше, чем концентрация хлорида натрия в точке эвтектики, но ниже, чем концентрация хлорида натрия в насыщенном солевом растворе, путем растворения источника хлорида натрия в воде; (ii) охлаждения полученного солевого раствора путем охлаждения с промежуточным холодоносителем в самоочищающемся теплообменнике с псевдоожиженным слоем/кристаллизаторе до температуры ниже 0°C, но выше температуры эвтектики полученного солевого раствора, с получением суспензии, включающей дигидрат хлорида натрия и маточный раствор; (iii) подачи дигидрата хлорида натрия в установку для рекристаллизации с образованием хлорида натрия и маточного раствора, и (iv) рециркуляции по меньшей мере части маточного раствора, полученного на стадии (ii) и/или стадии (iii), на стадию (i). Изобретение позволяет снизить энергоемкость промышленного получения хлорида натрия из подземных месторождений, повысить чистоту получаемого хлорида натрия без проведения стадий очистки и испарительной кристаллизации. 8 з.п. ф-лы, 1 ил., 3 пр.
1. Способ получения хлорида натрия, включающий стадии:
(i) получения в технологической каверне солевого раствора с концентрацией хлорида натрия выше, чем концентрация хлорида натрия в точке эвтектики, но ниже, чем концентрация хлорида натрия в насыщенном солевом растворе, путем растворения источника хлорида натрия в воде;
(ii) охлаждения полученного солевого раствора путем охлаждения с промежуточным холодоносителем в самоочищающемся теплообменнике с псевдоожиженным слоем/кристаллизаторе до температуры ниже 0°C, но выше температуры эвтектики полученного солевого раствора, с получением суспензии, содержащей дигидрат хлорида натрия и маточный раствор;
(iii) подачи дигидрата хлорида натрия в установку для рекристаллизации с образованием хлорида натрия и маточного раствора; и
(iv) рециркуляции, по меньшей мере, части маточного раствора, полученного на стадии (ii) и/или стадии (iii), на стадию (i).
2. Способ по п.1, в котором солевой раствор, полученный на стадии (i), имеет концентрацию хлорида натрия, которая, по меньшей мере, на 0,01 мас.% предпочтительно, по меньшей мере, на 1 мас.% является более концентрированной по хлориду натрия, чем концентрация эвтектики.
3. Способ по п.1 или 2, в котором солевой раствор, полученный на стадии (i), имеет концентрацию хлорида натрия, отвечающую концентрации хлорида натрия, полученной разбавлением указанного солевого раствора, который является насыщенным в отношении хлорида натрия, по меньшей мере, 0,5 мас.% воды из расчета на общую массу солевого раствора.
4. Способ по п.1, в котором на стадии (ii) солевой раствор охлаждают до температуры в диапазоне от температуры на 0,1°C выше температуры эвтектики указанного солевого раствора до температуры на 14°C выше температуры эвтектики указанного солевого раствора.
5. Способ по п.1, в котором на стадии (ii) солевой раствор охлаждают до температуры в диапазоне от температуры на 1°C выше температуры эвтектики указанного солевого раствора до температуры на 7°C выше температуры эвтектики указанного солевого раствора.
6. Способ по п.1, в котором охлаждение с промежуточным холодоносителем достигается с помощью замкнутой системы, в которой солевой раствор физически полностью отделен от холодоносителя, выбранного из группы, состоящей из: аммиака, бутана, диоксида углерода, фреона, смеси этиленгликоль/вода, смеси хлорид кальция/вода, смеси формиат калия/вода, алкилзамещенных ароматических соединений и полидиметилсилоксана, непроницаемой стенкой.
7. Способ по п.1, в котором охлаждение с промежуточным холодоносителем достигается путем выпаривания с падающей пленкой холодоносителя, выбранного из группы, состоящей из: аммиака, бутана, диоксида углерода и фреона.
8. Способ по п.1, в котором суспензия, полученная на стадии (ii), также включает глауберову соль и указанную суспензию подают в гидроциклон, получая обогащенный дигидратом хлорида натрия поток и обогащенный глауберовой солью поток, при этом обогащенный дигидратом хлорида натрия поток подвергают стадии (iii).
9. Способ по п.8, где обогащенный глауберовой солью поток, по крайней мере, частично рециркулируют на стадию (i).
| Способ струйно-абразивной обработки поверхностей деталей | 1981 |
|
SU1009736A1 |
| RU 2056355 C1, 20.03.1996 | |||
| Способ очистки хлористого натрия | 1985 |
|
SU1353732A1 |
| Способ определения прочности адгезионной связи на срез | 1981 |
|
SU979963A1 |
| FR 2866870 A1, 02.09.2005 | |||
| HABIB В., FARID M., Heat transfer and operating conditions for freeze concentration in a liquid-solid fluidized bed heat exchanger, Chemical Engineering and Processing, 2006, vol.45, p.698-710. | |||
Авторы
Даты
2014-01-20—Публикация
2009-10-29—Подача