Изобретение относится к области ветеринарии и медицины и может быть использовано для профилактики и лечения бактериальных инфекций.
Азитромицин (2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-13-[(2,6-диокси-3-C-метил-3-O-метил-а-L-рибогексопиранозил)окси]-2-этил-3,4,10-тригидрокси-3,5,6,8,10,12,14-гептаметил-11-[[3,4,6-тридеокси-3-(диметиламино)-b-D-ксило-гексапиранозил]окси]-1-окс-6-азацтклопентадекан-15-он) является полусинтетическим антибиотиком, производным эритромицина. Азитромицин активен в отношении грамположительных микроорганизмов: Streptococcus spp. (групп C, F и G, кроме устойчивых к эритромицину), Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus viridans, Staphylococcus epidermidis, Staphylococcus aureus; грамотрицательных бактерий: Haemophilus influenzae, Moraxella catarrhalis, Bordetella pertussis, Bordetella parapertussis, Legionella pneumophila, Haemophilus ducreyi, Campylobacter jejuni, Neisseria gonorrhoeae и Gardnerella vaginalis; некоторых анаэробных микроорганизмов: Bacteroides bivius, Clostridium perfringens, Peptostreptococcus spp; а также Chlamydia trachomatis, Chlamydia pneumoniae, Mycoplasma pneumoniae, Mycobacterium avium complex, Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdorferi.
Известна жидкая фармацевтическая композиция азитромицина для офтальмогического использования с содержанием активнодействующего вещества до 10% (патент США №6,277,829 B1 от 21.08.2001 Antonio Asero, Grazia Mazzone, process for preparation of aqueous formulation for ophthalmic use). Также известна жидкая композиция азитромицина для местного применения (патент США №7,064,104 B1 от 20.06.2006 Jacques Luyckx, Frederic Pilotaz, Pharmaceutical composition based on macrolides for topical application in ophthalmology).
Известна быстрорастворимая форма азитромицина перорального использования (патент США №7,572,773 B2 от 11.08.2009 Aleksandar Danilovsky, Knezevie Zdravka, single dose fast dissolving azithromycin).
Выделены соли азитромицина с малоновой кислотой. Данные соединения могут быть использованы для приготовления быстрорастворимых форм азитромицина для перорального применения (патент США №2009/0318375 A1 B2 от 24.12.2009 Во Sung Kwon, Eun Sook Kim, Нее Cheol Kim, Sangmin Yun, Myoung-sill Ко, Тае Hun Song, Han Kyong Kim, Kwee Hyun Suh, Gwansum Lee, crystalline azithromycin L-malate monohydrate and pharmaceutical composition containing same).
Известны различные твердые фармацевтические композиции азитромицина для перорального использования (патент США №2007/0185194 A1 от 9.08.2007 Kamal Mehta, Rajeev Shankar Mathur, Sujata Paul, Sanjeev Kumar Sethi, Rajiv Malik, stable oral compositions of azithromycin monohydrate; патент США №2007/0185194 A1 от 9.08.2007 Kamal Mehta, Rajeev Shankar Mathur, Sujata Paul, Sanjeev Kumar Sethi, Rajiv Malik, stable oral compositions of azithromycin monohydrate; патент США №2005/0106239 А1 от 19.05.2005 Ruth Tenengauzer, Joseph Schwarz, Julia Hrakovsky, Tania Lessen, Lev Khondo, Mathi Mathivanan, Claude Singer, Michal Pesachovich, stabilized azithromycin compositions; патент США №2008/0096831 А1 от 24.04.2008 Mohsen Sadatrezaei, Pablo Davila, Gary Barbera, stabilized azithromycin composition).
Все вышеперечисленные составы предназначены для орального или наружного применения.
Известна твердая лекарственная форма, содержащая лиофилизированный азитромицин (патент США №0116336 от 1.07.2006 Byung Ho Woo, К. Keith Knwok, Kang Yong Yang, lyophilized azithromycin formulation). Существует лиофилизированная форма азитромицина с коммерческим названием "Sumamed" производства Плива.
Данная лекарственная форма представляет собой стерильный порошок для приготовления инъекционного раствора непосредственно перед применением, так как антибиотик в данном растворе быстро разлагается.
Наиболее близким к предлагаемому решению является жидкая форма азитромицина, содержащая этиловый спирт, сорастворители: полиэтандиол, пропиленгликоль; регулятор pH (см. патент CN 1613453 «Azithromycin injection and its preparation»).
Однако данная лекарственная форма содержит этиловый спирт, следовательно, его нельзя вводить внутримышечно или подкожно, т.к. это приведет к развитию некроза ткани. Он используется только внутривенно и в разбавленном водном растворе. Таким образом, это не готовый к применению инъекционный раствор, а концентрат, который добавляют в раствор для внутривенных инфузий.
Задачей настоящего изобретения является конструирование препарата на основе азитромицина в виде раствора, обладающего широким спектром антимикробного действия, в виде готового к применению инъекционного раствора не только для внутривенного, но и для внутримышечного, подкожного, внутриматочного и интрацистернального введения.
Техническим результатом является высокая физико-химической стабильность (не менее 18 месяцев) жидкой лекарственной формы, при обеспечении безопасности для лечения и профилактики заболеваний, вызванных патогенными микроорганизмами.
Указанный в заявке технический результат достигается за счет экспериментально установленных неизвестных комбинаций антиоксидантов, органических растворителей и регуляторов pH с макролидным антибиотиком - азитромицином.
Поставленная задача решается тем, что антибактериальная инъекционная фармацевтическая композиция, включающая азитромицин, растворители и/или сорастворители, консервант, содержит регулятор рН, антиоксидант, в качестве которого используют аскорбиновую кислоту, или аскорбат натрия, или аскорбат кальция, или пальмитил аскорбат, или 4-метил-2,6-дитретбутилфенол, или третбутилгидрохинон, 2,4,5-тригидроксибутирофенон, или метабисульфит натрия, или альфа-токоферол, или тиоглицерин, или их комбинации, а в качестве консерванта выбран бензиловый спирт, парабены, хлорэтон или их комбинации, в качестве растворителей или сорастворителей используют органические растворители - диметилацетамид, или диметилсульфоксид, или N-метил-2-пирролидон, или 2-пирролидон, или их комбинации; или комбинации органических растворителей с водой, при следующих соотношениях компонентов, в масс.%: азитромицин 5-50; антиоксидант 0,1-0,2, консервант 1-2, регулятор pH до 5, растворители - остальное.
В композиции действующее вещество растворено в смеси органического растворителя и воды с добавлением веществ, стабилизирующих кислотность раствора. Соотношения органического растворителя, воды и регуляторов pH (кислотности) подобраны таким образом, чтобы физико-химическая стабильность раствора была максимально возможной при минимальной степени деградации растворенного азитромицина. Органический растворитель и регулятор рН отобраны по критерию наименьшей токсичности при внутримышечном и подкожном введении.
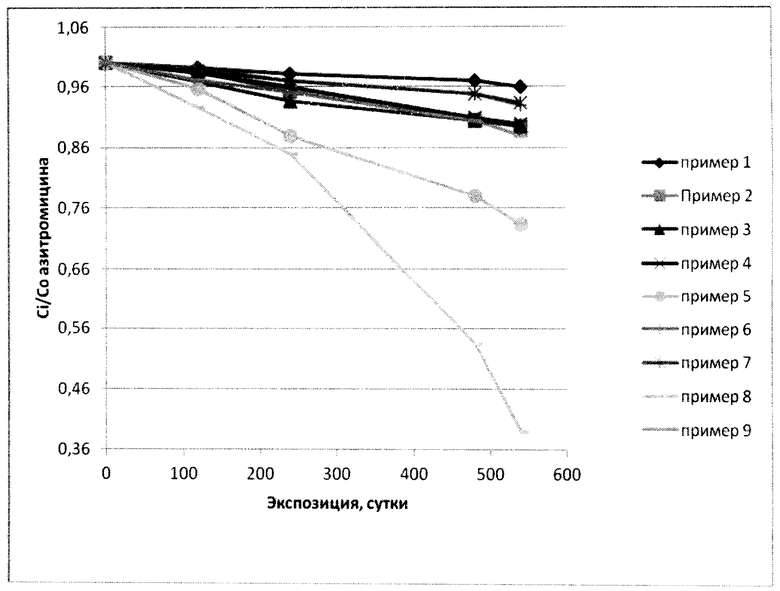
Изобретение поясняется графиком, на котором приведены данные по деградации растворов азитромицина, изготовленных по примерам приведенных рецептур и построенным на основе данных таблицы 7.
Разработка заявленной лекарственной формы осуществлялось на основании следующих критериев:
1. Выявление состава лекарственной формы, обеспечивающего максимально возможную концентрацию азитромицина в растворе;
2. Выявление веществ (разрешенных для использования в инъекционных препаратах), обеспечивающих:
- максимальную стабильность полученного раствора (например: отсутствие осадка, расслоение раствора и т.д.);
- максимальную химическую стабильность действующего вещества (азитромициин и другие макролиды) в предложенной лекарственной форме;
3. Выбор лекарственной формы с минимальной токсичностью при сохранении высокой антибактериальной активности, присущей азитромицину и другим макролидам.
Разработанный препарат представляет собой стабильный раствор действующего компонента - азитромицина. В качестве регуляторов pH используются лимонная кислота, или яблочная кислота, или бензойная кислота, или янтарная кислота, или их комбинации. В качестве консервантов используются бензиловый спирт, парабены, монохлорэтон или их комбинации. В качестве антиоксидантов используются аскорбиновая кислота, или аскорбат натрия, или аскорбат кальция, или пальмитил аскорбат, или 4-метил-2,6-дитретбутилфенол, или третбутилгидрохинон, 2,4,5-тригидроксибутирофенон, или метабисульфит натрия, или токоферол ацетат, или тиоглицерин, или их комбинации.
Лекарственная форма может включать в себя солюбилизатор. В качестве солюбилизатора используют Cremophor EL, или Cremophor ELP (полиоксиэтилен-глицерол-тририцинолеат), или Cremophor RH40 (полиоксиэтилен-глицерол-тригидроксистеарат), или Tween 80 (полиоксиэтиленсорбитан моноолеат), или Solutol HS15 (полиэтиленгликоль-660-12-гидрокси-стеарат), или полоксамер F68, или полоксамер F127 (полиоксиэтилен-полиоксипропилен блок сополимер), или их комбинации. Также лекарственная форма может включать в себя анестетик. В качестве анестетика используют лидокаин гидрохлорид до 0,5%.
Методы оценки физико-химической стабильности растворов азитромицина Содержание азитромицина в растворе измеряли методом ВЭЖХ, основываясь на методе, предусмотренном Государственной Фармакопеей РФ XII, ФС «Азитромицин».
Для обоснования выбора наиболее оптимального растворителя определяли растворимость азитромицина в различных органических растворителях (Таблица 1).
Наиболее оптимальными растворителями являются N-метил-2-пирролидон и диметилацетамид.
Однако из работы Jouyban A, Fakhree MA, Shayanfar A. [1] известно, что N-метил-2-пирролидон и диметилацетамид обладают высокой токсичностью при использовании их в чистом виде. Указанные растворители обладают водоотнимающей способностью, приводящей к обезвоживанию и некрозу тканей в месте введения. Известно, что добавление воды в лекарственную форму на основе органических растворителей резко снижает эти токсические эффекты [1].
Эксперименты с водно-органическими растворами азитромицина не дали положительного результата по критерию «физико-химическая стабильность». Все варианты лекарственной формы были неустойчивыми, через непродолжительное время наблюдалось выпадение осадка.
Для решения этой проблемы были проведены эксперименты по подбору противоионов (регуляторов pH) к азитромицину, обеспечивающих физико-химическую стабильность лекарственной формы азитромицина в водно-органическом растворе. В качестве регуляторов pH (кислотности) были выбраны следующие кислоты, разрешенные к применению в инъекционных растворах: лимонная кислота, бензойная кислота, молочная кислота, фосфорная кислота.
Основные результаты экспериментов представлены в таблице 2.
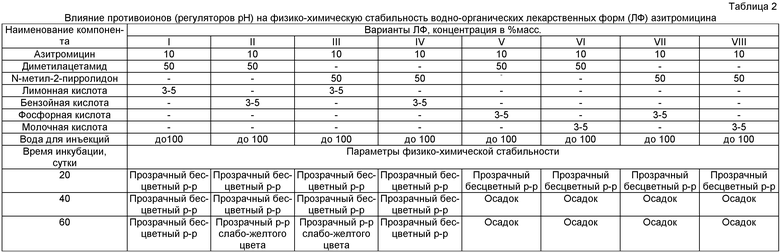
По полученным данным были отобраны варианты лекарственных форм №I и №IV, как наиболее физико-химически стабильные и не вызывающие токсических эффектов при инъекциях в экспериментах на лабораторных животных. Дальнейшее изучение этих лекарственных форм проводили при большем времени инкубации с определением концентрации действующего вещества (азитромицина) (таблица 3).
ЛФ
Концентрацию азитромицина определяли методом ВЭЖХ, опубликованном в Государственной Фармакопее XII [2] и Европейской фармакопее [3] с модификациями. Из таблицы 3 видно, что химическая стабильность в выбранных лекарственных формах недостаточна.
На следующем этапе исследования расширили перечень регуляторов pH и провели эксперименты с аскорбиновой кислотой, взяв за основу те же лекарственные формы. Наиболее значимые результаты представлены в таблице 4.
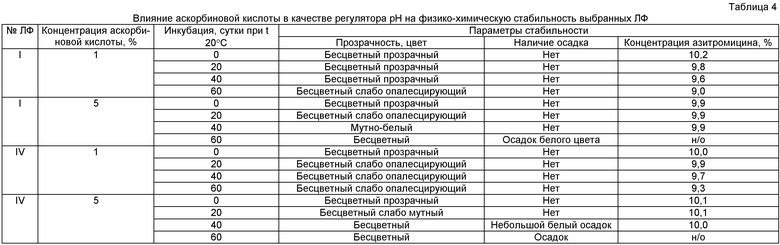
В данных экспериментах показано, что аскорбиновая кислота в высоких концентрациях эффективна в качестве ингибитора деструкции азитромицина, но не обеспечивает стабильность раствора лекарственной формы.
Проанализировав всю совокупность полученных данных, было решено оставить в качестве регуляторов pH лимонную и бензойную кислоты с внесением небольшого количества аскорбиновой кислоты в качестве дополнительного противоиона. Основные результаты этого эксперимента представлены в таблице 5. Для иллюстрации взята лекарственная форма №I (диметилацетамид + лимонная кислота).
кислоты, %
при t 20°C
Таким образом, было определено соотношение регулятора pH с аскорбиновой кислотой как дополнительным противоионом, обеспечивающее стабильную и безопасную лекарственную форму азитромицина для инъекций.
Известно, что аскорбиновая кислота используется в фармацевтической и пищевой промышленности в качестве антиоксиданта. В связи с этим были проведены эксперименты с другими веществами-антиоксидантами с целью выявления эффекта, аналогичного действию аскорбиновой кислоты в выбранных лекарственных формах. Полученные данные представлены в таблице 6.
Из таблицы 6 видно, что исследованные антиоксиданты также могут выступать в качестве дополнительного противоиона-комплексообразователя, одновременно обеспечивая защиту от окисления.
Причиной стабилизации азитромицина и других макролидных антибиотиков, в данном случае, является образование комплексного соединения антибиотика с аскорбиновой кислотой или другими подобными веществами. Константа устойчивости комплекса антибиотик/антиоксидант достаточно большая, поэтому в водно-органической среде такой комплекс существует малое время и не успевает выйти из сферы реакции (выпасть в осадок). С другой стороны, органические кислоты ионизируют свободную молекулу азитромицина, и она вновь реагирует с дополнительным противоионом, в результате устанавливается равновесие, присущее данному раствору лекарственной формы. Дальнейшая разработка заключалась в определении диапазона массовых соотношений органический растворитель/регулятор pH/дополнительный противоион-комплексообразователь (антиоксидант)/ действующее вещество и оптимизации возможных составов лекарственных форм.
Способ приготовления
Азитромицин суспендируют в соответствующем растворителе или смеси растворителей, затем добавляют регулятор pH, солюбилизатор, анестетик, консервант, антиоксидант.
Ниже приведены составы лекарственных форм, которые иллюстрируют оптимальные соотношения компонентов:
Пример №1
Приведен состав, содержащий анестетик.
Пример №2
Приведена рецептура с солюбилизатором (полиоксиэтилен-глицерол- тририцинолеат) и соответствующим количеством других компонентов.
Пример №3
Приведена рецептура с максимальным количеством солюбилизатора и соответствующим количеством других компонентов.
Увеличение количества солюбилизатора выше 30% приводит к нестабильности раствора (расслоение и выпадение осадка).
Пример №4
Приведена рецептура с максимальным количеством органического растворителя и соответствующим количеством других компонентов.
Увеличение количества органического растворителя выше 80% ведет за собой увеличение токсических свойств лекарственной формы.
Пример №5
Приведена рецептура с максимальным количеством органического растворителя и соответствующим количеством других компонентов, без регулятора pH.
Исключение из состава лекарственной формы регулятора отрицательно сказывается на стабильности раствора (быстрое потемнение, падение концентрации действующего вещества), кроме того, увеличение количества органического растворителя выше 70% ведет за собой увеличение токсических свойств лекарственной формы.
Пример №6
Приведена рецептура с применением в качестве солюбилизатора полоксамера F127 без добавления органического сорастворителя и соответствующим количеством других компонентов.
Уменьшение количества солюбилизатора ниже 5,0% ведет за собой уменьшение стабильности лекарственной формы (выпадение осадка), к тому же уменьшение количества действующего вещества ведет за собой уменьшение терапевтической эффективности лекарственной формы.
Пример №7
Приведена рецептура с применением в качестве солюбилизатора полоксамера F127 без добавления органического сорастворителя и отличающаяся от примера №6 большим содержанием азитромицина.
Увеличение содержание азитромицина выше 10,0%, при использовании в качестве солюбилизатора полоксамера F127, ведет за собой увеличение вязкости раствора при температурах ниже +15°C.
Пример №8
Приведена рецептура с максимальным количеством регулятора pH и соответствующим количеством других компонентов.
Увеличение количества регулятора рН выше 5% ведет за собой увеличение кислотности раствора, при этом усиливается местнораздражающее действие лекарственной формы, и увеличивается скорость деградации основного компонента.
Пример №9
Приведена рецептура с максимальным количеством действующего вещества и соответствующим количеством других компонентов.
При концентрации более 50% азитромицина раствор становится недостаточно стабильным, при этом растворы с концентрацией действующего вещества в интервале 30%-50% достаточно вязкие, что ухудшает эксплуатационные свойства.
Пример №10
Приведена рецептура, где в качестве органического растворителя используется диметилсульфоксид.
Формы, где в качестве основного растворителя используется диметилсульфоксид, характеризуются меньшей устойчивостью (выпадение осадка).
Пример №11
Приведена рецептура, где в качестве органического растворителя используется 2-пирролидон.
Формы, где в качестве сорастворителя используется бензиловый спирт (или другие спирты), характеризуются меньшей устойчивостью (изменение цвета раствора и деградация действующего вещества).
Исследование стабильности производилось для образцов, хранящихся при температуре окружающей среды (17-26°C). Результаты приведены в таблице 7.
Из приведенных данных следует, что лекарственные формы, сделанные по рецептурам, описанным выше, удовлетворяют требованиям физико-химической стабильности, при этом самыми оптимальными являются рецептуры 1-4. Внесение же в состав анестетика никак не изменяет физико-химические свойства лекарственной формы.
Из графика следует, что внесение недостаточного количества регулятора pH ведет к нестабильности раствора (падение концентрации действующего вещества, пример 5), равно как и применение его избыточного количества (пример 8). Не включение в состав инъекционного раствора органического растворителя, с одновременным применением соответствующего солюбилизатора (полоксамер F 127), слабо влияет на стабильность раствора (примеры 6, 7), но заметно повышает вязкость раствора. Включение в состав раствора солюбилизатора, с одновременным применением органического растворителя, никак не влияет на стабильность (примеры 1-4), однако присутствие ПАВ может улучшить фармакологические свойства получаемых лекарственных форм. Увеличение содержания азитромицина до 50% (пример 9) обуславливает применение только органического растворителя с регулятором pH, при этом применение ПАВов исключено, вследствие высокой вязкости форм, в составе которых присутствует солюбилизатор.
Новый технический результат - стабильность фармацевтической композиции, в данной заявке на изобретение достигается посредством выявления и оптимизации новых неизвестных комбинаций антиоксидантов, органических растворителей и регуляторов pH с макролидными антибиотиками (азитромицином и т.д.). Найденные комбинации обеспечивают получение инъекционного раствора антибиотика, отвечающего основным требованиям, предъявляемым фармакопеями, а именно:
- физико-химическая стабильность лекарственной формы (ЛФ) и действующего вещества;
- низкая токсичность (безопасность);
- сохранение заявленной (надлежащей) антибактериальной активности антибиотика.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ СТАБИЛЬНОСТИ ИНЪЕКЦИОННОЙ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ | 2017 |
|
RU2666607C1 |
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ У ЖИВОТНЫХ | 2012 |
|
RU2504347C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ У ЖИВОТНЫХ | 2009 |
|
RU2397753C1 |
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ КРОВЕПАРАЗИТАРНЫХ И ИНВАЗИОННЫХ ЗАБОЛЕВАНИЙ | 2005 |
|
RU2296568C1 |
| Инъекционная лекарственная форма для лечения и профилактики заболеваний печени у животных | 2021 |
|
RU2800150C2 |
| Гепатопротекторная инъекционная фармацевтическая композиция на основе силимарина и наночастиц селена | 2017 |
|
RU2645092C1 |
| Фармацевтический состав для ингибиторов гистондеацетилазы | 2011 |
|
RU2625758C2 |
| МИКРОКОЛЛОИДНЫЙ РАСТВОР ПРОПОФОЛА ДЛЯ АНЕСТЕЗИИ | 2013 |
|
RU2535001C1 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ФТОРХИНОЛОНЫ | 2007 |
|
RU2527327C2 |
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА МЕТРОНИДАЗОЛА | 2000 |
|
RU2173993C1 |
Изобретение относится к области ветеринарии и медицины и может быть использовано для профилактики и лечения бактериальных инфекций. Антибактериальная инъекционная фармацевтическая композиция включает азитромицин, растворители и/или сорастворители, консервант, антиоксидант. В качестве антиоксиданта используют аскорбиновую кислоту, или аскорбат натрия, или аскорбат кальция, или пальмитил аскорбат, или 4-метил-2,6-дитретбутилфенол, или третбутилгидрохинон, 2,4,5-тригидроксибутирофенон, или метабисульфит натрия, или альфа-токоферол, или тиоглицерин, или их комбинации, а в качестве консерванта выбран бензиловый спирт, парабены, хлорэтон или их комбинации, в качестве растворителей или сорастворителей используют органические растворители - диметилацетамид, или диметилсульфоксид, или N-метил-2-пирролидон, или 2-пирролидон, или их комбинации, или комбинации органических растворителей с водой, при следующих соотношениях компонентов, масс.%:
азитромицин 5-50,
антиоксидант 0,1-0,2,
консервант 1-2,
регулятор pH до 5,
растворители - остальное.
Антибактериальная инъекционная фармацевтическая композиция на основе азитромицина обладает широким спектром антимикробного действия и пригодна для внутривенного, внутримышечного, подкожного, внутриматочного и интрацистернального введения. 2 з.п. ф-лы, 1 ил., 7 табл., 11 пр.
1. Антибактериальная инъекционная фармацевтическая композиция, включающая азитромицин, растворители и/или сорастворители, консервант, характеризующаяся тем, что содержит регулятор рH, антиоксидант, в качестве которого используют аскорбиновую кислоту, или аскорбат натрия, или аскорбат кальция, или пальмитил аскорбат, или 4-метил-2,6-дитретбутилфенол, или третбутилгидрохинон, 2,4,5-тригидроксибутирофенон, или метабисульфит натрия, или альфа-токоферол, или тиоглицерин, или их комбинации, а в качестве консерванта выбран бензиловый спирт, парабены, хлорэтон или их комбинации, в качестве растворителей или сорастворителей используют органические растворители - диметилацетамид, или диметилсульфоксид, или N-метил-2-пирролидон, или 2-пирролидон, или их комбинации, или комбинации органических растворителей с водой, при следующих соотношениях компонентов, масс.%:
2. Композиция по п.1 отличающаяся тем, что включает дополнительно солюблизатор, полоксамеры или полиоксиэтилен-глицерол-тририцинолеат, или их комбинации в количестве 1-30%.
3. Композиция по п.1, отличающаяся тем, что она дополнительно содержит анестетик до 2,0%, в качестве которого используют новокаин, или совкаин, или бупивакаин, или ропивакаин, или лидокаин, или их смеси.
| Способ получения полотна материала из пластиката поливинилхлорида | 1988 |
|
SU1613453A1 |
| ФАРМАЦЕВТИЧЕСКИЕ И ВЕТЕРИНАРНЫЕ ПАСТООБРАЗНЫЕ КОМПОЗИЦИИ | 2001 |
|
RU2304962C2 |
| СОСТАВ ДЛЯ ТЕРАПИИ И ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ ЖИВОТНЫХ | 2006 |
|
RU2327453C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ СУСПЕНЗИЯ АЗИТРОМИЦИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2003 |
|
RU2255730C1 |
| WO2003032922A2,24.04.2003 | |||
| US20070199856A1,30.08.2007 | |||
Авторы
Даты
2014-04-10—Публикация
2012-06-08—Подача